同时诊断柯萨奇A6型、A10型的方法及试剂盒与流程
本发明属于诊断领域,更具体地,本发明涉及同时诊断柯萨奇病毒a6型、a10型的方法及试剂。
背景技术:
近年来全球食源性疾病和恶性食品污染事件频频的发生,使食品安全已成为一个巨大并不断扩大的世界卫生问题,并日益成为全球关注的热点。世界卫生组织将食品安全看作是一个世界性的挑战。全球每年发生40~60亿例食源性腹泻,而许多食源性疾病的大规模暴发都是由病毒引起的。其中以受污染的水、贝类和果蔬为载体而导致的病毒性疾病如诺瓦克病毒、轮状病毒、科萨奇和甲肝病毒为主要病因较为常见。提高食源性致病微生物快速监测的准确性和控制的时效性是解决食源性病毒疾病暴发问题的关键。
柯萨奇病毒(coxsackievirus,cv)根据对小白鼠的致病性不同分为a和b组,a组包括23个血清型,b组包括6个血清型。柯萨奇病毒能够引起人类多种感染性疾病,包括无菌性脑膜炎、病毒性心肌炎、疱疹性咽峡炎和手足口病(hand,footandmouthdisease,hfmd)等。手足口病是中国法定丙类传染病。柯萨奇病毒a组16型(cval6)被认为是手足口病的主要病原体,近年来柯萨奇病毒a组6和10型引起的手足口病病例也呈明显上升趋势。b组可引起呼吸道感染、腹泻、脑膜炎、心肌炎等,是儿童病毒性心肌炎最常见的原因。该病可通过粪口途径以及呼吸道飞沫传播,或经接触患者皮肤、黏膜的疱疹液而感染。手足口病具有传染性很强、传播快的特点,极易造成暴发流行,危害婴幼儿的生命健康。
但是,柯萨奇病毒的病毒血清型特别多,不同血清型近似度高,不易于进行准确的血清型分辨,常常因为多种血清型的干扰而导致检测结果假阳性或假阴性,严重影响到检测结果的判断。因此,合适的检测试剂的开发以及检测方法的优化是尤为重要的。
技术实现要素:
本发明的目的在于提供一种同时诊断柯萨奇病毒a6型、a10型的方法及试剂。
在本发明的第一方面,提供一种同时测定柯萨奇病毒a6型、a10型的方法,所述方法包括:以待测样品的dna为模板,以seqidno:1、seqidno:2、seqidno:4和seqidno:5所示核苷酸序列的引物进行pcr扩增,并以seqidno:3和seqidno:6所示核苷酸序列的探针进行识别;若存在seqidno:1、seqidno:2的扩增产物,则柯萨奇病毒a6型阳性;若存在seqidno:4、seqidno:5的扩增产物,则柯萨奇病毒a10型阳性。
在一个优选例中,所述的seqidno:6所示核苷酸序列的探针进行锁核酸修饰。
在另一优选例中,对seqidno:6所示核苷酸序列的探针的第3、4、14和15位碱基进行锁核酸修饰。
在另一优选例中,所述的seqidno:3和seqidno:6所示核苷酸序列的探针携带荧光标记,且两者的荧光标记不同。
在另一优选例中,在进行pcr扩增时,采用的退火温度为56~59℃。
在另一优选例中,在进行pcr扩增时,采用的退火温度为56.2℃和58.7℃。
在另一优选例中,所述的待测样品包括:食品、饮料、保健品。
在另一优选例中,所述方法的检测下限为1拷贝。
在另一优选例中,所述的方法是不以疾病诊断为目的的方法。
在本发明的另一方面,提供一种用于同时鉴定柯萨奇病毒a6型、a10型的试剂盒,其中包括:seqidno:1、seqidno:2、seqidno:4和seqidno:5所示核苷酸序列的引物;seqidno:3和seqidno:6所示核苷酸序列的探针。
在一个优选例中,所述的seqidno:3和seqidno:6所示核苷酸序列的探针携带荧光标记,且两者的荧光标记不同。
在另一优选例中,所述试剂盒中还包括选自以下的试剂:dna提取试剂,taq酶,pcr缓冲液,dna聚合酶,和/或说明同时测定柯萨奇病毒a6型、a10型的方法的使用说明书。
在本发明的另一方面,提供所述的试剂盒的用途,用于同时测定柯萨奇病毒a6型、a10型。
在一个优选例中,所述的用途是不以疾病诊断为目的的用途。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
图1a、柯萨奇病毒a6型特异性反应图。1:柯萨奇病毒a6;2:甲型肝炎病毒;3:诺如病毒;4:轮状病毒;5:星状病毒;6:脊髓灰质炎病毒;7:札如病毒。
图1b、柯萨奇病毒a6与其余血清型鉴别特异反应图。1:柯萨奇病毒a6,2:柯萨奇病毒a10,3:柯萨奇病毒b2,4:柯萨奇病毒b4,5:阴性对照。
图2a、柯萨奇病毒a10型特异性反应图。1:柯萨奇病毒a10;2:甲型肝炎病毒;3:诺如病毒;4:轮状病毒;5:星状病毒;6:脊髓灰质炎病毒;7:札如病毒。
图2b、柯萨奇病毒a10与其余血清型鉴别特异反应图。1:柯萨奇病毒a10,2:柯萨奇病毒a6,3:柯萨奇病毒b2,4:柯萨奇病毒,b45:阴性对照。
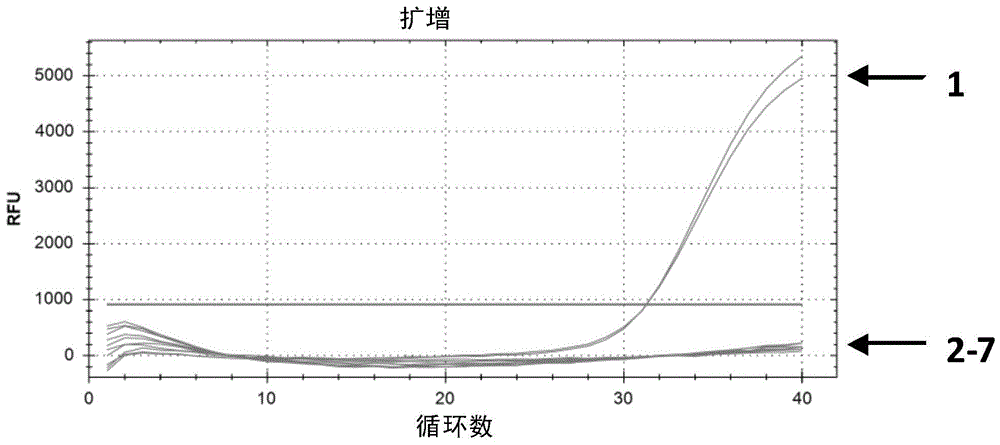
图3、柯萨奇病毒a6pcr扩增图。
图4、柯萨奇病毒a10pcr扩增图。
图5、柯萨奇病毒pcr检测体系不同退火温度优化结果。
具体实施方式
本发明人经过广泛而深入的研究,揭示一组可特异性鉴定柯萨奇a6型、a10型成分的试剂,所述的试剂包括引物和探针。为了优化检测敏感度,本发明人还优化了pcr检测的方案,以及优化了探针设计。本发明的试剂以及方法具有良好的再现性、灵敏度。
现阶段应用最广的实时荧光定量pcr(qpcr),但稳定性、准确性相对而言不能满足精细检测的需要,特别是针对一些血清型较多的病毒样品。柯萨奇病毒血清型较多,a组包括23个血清型,b组包括6个血清型,尽管它们之间高度相近但却致病能力有很大的区别。因此,临床上进行准确的检测、鉴定是非常关键的。但是,鉴于柯萨奇病毒的血清型和变异株非常多,且不同株型之间基因组序列的同源性也非常高,如何准确地、便捷地(最好实时地)判断出高危型的柯萨奇病毒一直是本领域关注的课题,目前临床所用方法实际上存在较高比例的假阳性和假阴性现象,不同血清型之间的误判可能性较大。本发明人经过长期的研究后,制备了可特异区分柯萨奇a6型、a10型的检测试剂/试剂盒。所述检测试剂是在经过本发明人广泛筛选和临床论证后获得的,特异性良好,不会与其它血清型以及它类病毒发生交叉反应。
试剂及试剂盒
本发明人通过柯萨奇a6型、a10型及其它血清型以及其它物种在基因层面的比较和筛选,经大量的比对分析和反复试验,获得了特异性地扩增柯萨奇a6型、a10型的引物、探针,从而建立了用于检测柯萨奇a6型、a10型成分的pcr方法,达到鉴定柯萨奇a6型、a10型成分的目的。本发明的试剂盒,可以实现对于柯萨奇a6型、a10型两种血清型的同时检测,并不会因体系复杂而导致假阳性以及假阴性,特异性和灵敏度均非常理想。
因此,本发明提供一组引物,所述的引物具有seqidno:1、seqidno:2、seqidno:4和seqidno:5所示的核苷酸序列。
本发明的这些引物还可以用放射性同位素、生物素、酶、荧光素或其他化学发光物质进行标记。
本发明还提供一组探针,所述的探针具有seqidno:3和seqidno:6所示的核苷酸序列;较佳地,所述的探针携带有荧光标记物,从而便于进行荧光的识别或检测。
本发明还涉及一种用于同时鉴定柯萨奇a6型、a10型成分的试剂盒,所述试剂盒中含有seqidno:1、seqidno:2、seqidno:4和seqidno:5所示的核苷酸序列的引物;更佳地,所述的试剂盒中还含有seqidno:3和seqidno:6所示的核苷酸序列的探针。
对于a10的引物探针,本发明人在前期研究中发现,难以找到特异性以及敏感性良好的引物探针,主要原因可能是:探针尽管能在理论上识别扩增产物,但其却设计难以有效检测体系,深层原因可能是at含量不合适以及反应体系不匹配。为此,本发明人根据所积累的研究经验,改变引物扩增区段、改变探针靶向区段、进行探针长度调整、探针中碱基修饰等多方面的试验。最终,本发明人发现,以seqidno:6所示核苷酸序列的探针并配合在相应位置的锁核酸设计,可以极大地提高检测的特异性以及敏感性,并且当a10与a6共同检测时,也可以良好地适应这一反应体系。
本发明人也发现,锁核酸的位置选择是较为关键的,若是在seqidno:6的其它碱基上进行锁核酸,则也导致检测特异性以及敏感性的不同程度的下调。因此,在进一步的优选方式中,对seqidno:6所示核苷酸序列的探针的第3、4、14、15位碱基进行锁核酸修饰。
此外,所述的试剂盒还可含有其它鉴定柯萨奇a6型、a10型成分的试剂,如(但不限于):
(a)各种pcr反应用试剂,例如但不限于:taq酶,pcr缓冲液,dntp,dna聚合酶等;或
(b)各种提取dna(即制备pcr反应模板)所需的试剂,例如但不限于:酚、氯仿、异戊醇、nacl等;或
(c)提取dna的试剂盒。
此外,所述的试剂盒中还可含有鉴定柯萨奇a6型、a10型成分的使用说明书和/或标准操作程序。
本发明所述的试剂盒可实现快速检测、批量检测柯萨奇a6型、a10型成分的目的。
pcr方法
基于本发明所提供的适用于鉴定柯萨奇a6型、a10型成分的特异性引物及探针,本发明还提供了一种鉴定柯萨奇a6型、a10型成分的方法,所述方法包括:以待测样品的dna为模板,以seqidno:1、seqidno:2、seqidno:4和seqidno:5所示核苷酸序列的引物进行pcr扩增,并以seqidno:3和seqidno:6所示核苷酸序列的探针进行识别;若存在seqidno:1、seqidno:2的扩增产物,则柯萨奇病毒a6型阳性;若存在seqidno:4、seqidno:5的扩增产物,则柯萨奇病毒a10型阳性。
聚合酶链反应(pcr)技术是本领域技术人员熟知的技术,其基本原理是体外酶促合成特异dna片段的方法。本发明的方法可采用常规的pcr技术进行。
作为本发明的优选方式,pcr步骤为:反应前,将含有cdna模板的pcr溶液稀释后分布到大量的独立反应室,单分子间通过稀释分离,利用上述引物独自进行pcr扩增,最后分别分析内外源基因的拷贝数。
更为优选地,本发明人还比较了pcr过程中所涉及的多种条件,包括反应体系、反应组分的添加量、退火时间、退火温度等等,并且发现退火温度的高低与反应的扩增效率显著性相关。在此基础上,本发明人优化了退火温度,将该温度控制在56~59℃;较佳地为56.2℃和58.7℃。
利用本发明的引物及探针,只需进行pcr反应和/或琼脂糖凝胶电泳,优选地采用dpcr,并通过判断相应的pcr产物的有无,就可以准确、快速地判断待测样品是否含有柯萨奇a6型、a10型成分,而且所需的样品量很少,对于微量的柯萨奇a6型、a10型成分也能检出,灵敏度非常高。
经全面测试,本发明建立的检测方法是特异于柯萨奇a6型、a10型成分的检测,该检测方法绝对检测下限为1拷贝;且具有良好的可重复性,因此建立的该检测方法效果特别优异。
因此,本发明建立的柯萨奇a6型、a10型成分pcr检测特异性高、灵敏度高、可重复性好,可适用于柯萨奇a6型、a10型成分的检测,且满足口岸和相关实验室日常检测要求。
本发明的主要优点在于:
(1)揭示一种可在同一反应体系中特异性鉴定柯萨奇a6型、a10型成分的引物,所述的引物特异性良好,对于多种柯萨奇a6型、a10型成分能够实现特异性扩增,而对于柯萨奇a6型、a10型以外的其它物质则不能特异性扩增。并且,所述引物具有良好的再现性、结果稳定可靠。
(2)利用所述的引物或含有所述引物的检测试剂盒,可快速、大批量地检测柯萨奇a6型、a10型成分,从待测样品中快速准确地区分柯萨奇a6型、a10型成分,不受其它血清型的干扰,并且所需样品量少,操作简单。
(3)较佳地,本发明应用pcr技术,可快速实现待测样品如食品中柯萨奇a6型、a10型源性成分的准确鉴定。
(4)本发明的方法的推广应用对保障产品的质量,保护消费者知情权和选择权,维护正常的经济秩序等提供了技术支持。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
实施例1、检测靶点的鉴定及pcr引物探针的设计
本发明人根据柯萨奇病毒a6型以及a10型的基因组特点并综合分析此类病毒的其它血清型以及与柯萨奇病毒亲缘关系较近的其它物种的基因组特点,经过大量的分析比较,确定一套对于检测柯萨奇病毒a6型以及a10型特异性以及敏感性特别好的检测试剂,包括检测引物和探针,它们的序列如表1。
表1、柯萨奇病毒a6、a10特异性引物探针序列表
表1中,a10的探针中存在“(+t)”、“(+c)”以及“(+a)”,表示相应位置存在1个碱基且该碱基发生了锁核酸修饰。对于a10的引物探针,本发明人在前期研究中发现,难以找到特异性以及敏感性良好的引物探针,主要原因可能是:探针尽管能在理论上识别扩增产物,但其却设计难以有效检测体系,深层原因可能是at含量不合适、退火温度不匹配、反应体系不匹配等。为此,本发明人根据所积累的研究经验进行了多种方面的调整以改变这一现象,包括:改变引物扩增区段、改变探针靶向区段、进行探针长度调整、探针中碱基修饰等多方面的试验。
本发明人发现,以seqidno:6的探针并配合在相应位置的锁核酸设计,可以极大地提高检测的特异性以及敏感性,并且当a10与a6共同检测时,也可以良好地适应这一反应体系。同时,本发明人也发现,锁核酸的位置选择是较为关键的,若是在seqidno:6中第3、4、14和15位碱基以外的其它碱基上进行锁核酸,则也使得检测特异性以及敏感性的不同程度地下调。
实施例2、进行基于pcr的特异性鉴定
样品如下:
柯萨奇病毒a6:复旦大学附属儿科医院腹1泻粪便中分离,经测序鉴定。
柯萨奇病毒a10:复旦大学附属儿科医院腹泻粪便中分离,经测序鉴定。
柯萨奇病毒b2:复旦大学附属儿科医院腹泻粪便中分离,经测序鉴定。
柯萨奇病毒b4:复旦大学附属儿科医院腹泻粪便中分离,经测序鉴定。
甲型肝炎病毒:获自上海国际旅行者与保健中心。
札如病毒(sav-i):复旦大学附属儿科医院腹泻粪便中分离,经测序鉴定。
诺如病毒(nvgi、nvgii):复旦大学附属儿科医院腹泻粪便中分离,经测序鉴定。
轮状病毒(a群,g3p亚型):复旦大学附属儿科医院腹泻粪便中分离,经测序鉴定。
星状病毒(sav-1型):复旦大学附属儿科医院腹泻粪便中分离,经测序鉴定。
脊髓灰质炎病毒(pv-i、ii型):复旦大学附属儿科医院腹泻粪便中分离,经测序鉴定。
pcr模板的制备:上述腹泻样本用1×pbs缓冲液(0.14mol/lnacl,0.003mol/lkcl,0.00175mol/lkh2po4,0.01mol/lna2hpo4,ph7.5,上海生工生物工程有限公司)稀释10倍至10%悬液,分别取140μl悬液采用磁珠法核酸提取试剂盒(上海辉睿生物科技有限公司)并按照说明书进行病毒核酸提取,提取的核酸保存于-80℃冰箱备用。
实时荧光pcr扩增体系及反应条件为:2×onesteprt-pcrbufferⅲ12.5μl,takaraextaqhs(5u/μl)0.5μl,primescriptrtenzymemixⅱ0.5μl,上下游引物(10μmol/l)各0.5μl,探针(10μmol/l)1μl,rna模板2μl,rnasefreedh2o7.5μl,总体积25μl。
反应条件:第一阶段,反转录,42℃5min,95℃10s;第二阶段,95℃5s,60℃30s,共40个循环。
pcr(数字pcr)扩增体系及反应条件为:
一步法rt-pcr反应混液10μl,10μmol/l上下游引物各1.5μl,10μmol/l探针0.5μl,rna模板2μl,补水至反应终体积为20μl。
根据仪器要求,将配制好的pcr反应混合液,加入微反应体系生成装置的加样孔中,按仪器操作说明生成微反应体系。将微反应体系放置于pcr扩增仪中,按以下参数进行扩增:60℃30min(1℃/s),1个循环;95℃,5min(1℃/s),1个循环;94℃,30s,55℃,1min(1℃/s),40个循环;98℃10min(1℃/s),1个循环;4℃保存反应产物。对微反应体系进行荧光检测。
柯萨奇病毒a6型特异性反应的测定结果如图1a~b,可见,可以良好地实现柯萨奇病毒a6型与其它病毒的区分以及与柯萨奇病毒其它血清型的区分。
柯萨奇病毒a10型特异性反应的测定结果如图2a~b,可见,可以良好地实现柯萨奇病毒a10型与其它病毒的区分以及与柯萨奇病毒其它血清型的区分。
柯萨奇病毒a6pcr扩增的测定结果如图3。
柯萨奇病毒a10pcr扩增的测定结果如图4。
结果表明,用实时荧光pcr检测仅能扩增出柯萨奇病毒,对其他病毒诸如甲型肝炎病毒、札如病毒、诺如病毒、轮状病毒、星状病毒和脊髓灰质炎病毒等均无扩增。其它柯萨奇病毒血清型如b2、b4与a6以及a10非常接近,但是本发明的方法也能够实现良好地区分。因此表明,这组引物探针能有效扩增和识别出靶基因,并且特异性非常好。
实施例3、柯萨奇病毒pcr检测体系的优化
本发明人比较了pcr过程中所涉及的多种条件,包括反应体系、反应组分的添加量、退火时间、退火温度等等。经过反复比较发现,退火温度的高低与反应的扩增效率显著性相关。
取柯萨奇病毒a6、a10的rna作为模板,分别在多种退火温度下进行扩增反应,比较不同条件下pcr的检测结果。
双重pcr(数字pcr)扩增体系为:
一步法rt-pcr反应预混液8μl,10μmol/la6、a10上下游引物各1.5μl,10μmol/la6、a10探针各0.5μl,a6、a10rna模板各2μl,补水至反应终体积为20μl。
双重pcr扩增条件:
根据仪器要求,将配制好的pcr反应混合液,加入微反应体系生成装置的加样孔中,按仪器操作说明生成微反应体系。将微反应体系放置于pcr扩增仪中,按以下参数进行扩增:60℃30min(1℃/s),1个循环;95℃,5min(1℃/s),1个循环;94℃,30s,退火温度梯度分别为52.8℃、56.2℃、58.7℃、60.8℃和63.0℃,1min(1℃/s),40个循环;98℃10min(1℃/s),1个循环;4℃保存反应产物。对微反应体系进行荧光检测。
由图5可见,在52.8℃、56.2℃和58.7℃条件下,a6目的基因片段扩增效率显著性高于60.8℃和63.0℃。而在56.2℃和58.7℃条件下柯萨奇病毒a10目的基因片段的扩增效率显著性高于其他温度。
因此,在进行a6、a10双重pcr反应时,选择56.2℃和58.7℃的温度作为最优反应温度。
实施例4、柯萨奇病毒pcr方法的可重复性实验
柯萨奇病毒由复旦大学附属儿科医院腹泻粪便中分离,经测序鉴定。
病毒原液处理:上述腹泻样本用1×pbs缓冲液(0.14mol/lnacl,0.003mol/lkcl,0.00175mol/lkh2po4,0.01mol/lna2hpo4,ph7.5,上海生工生物工程有限公司)稀释10倍至10%悬液,分别取140μl悬液采用磁珠法核酸提取试剂盒(上海辉睿生物科技有限公司)并按照说明书进行病毒核酸提取,提取的核酸保存于-80℃冰箱备用。
为测试建立的pcr方法的可重复性,取柯萨奇病毒的rna模板,用0.1×te(tris-hcl,edta·na,ph8.0)缓冲液稀释:a6、a10在原液基础上稀释至10-1的浓度,每个浓度设置四次平行重复,然后分别计算标准偏差(standarddeviation,sd)和相对标准偏差(relativestandarddeviation,rsd)来判断检测的可重复性。
双重pcr扩增体系为:
一步法rt-pcr反应预混液8μl,10μmol/la6、a10上下游引物各1.5μl,10μmol/la6、a10探针各0.5μl,a6、a10rna模板各2μl,补水至反应终体积为20μl。
双重pcr扩增条件为:
根据仪器要求,将配制好的pcr反应混合液,加入微反应体系生成装置的加样孔中,按仪器操作说明生成微反应体系。将微反应体系放置于pcr扩增仪中,按以下参数进行扩增:60℃30min(1℃/s),1个循环;95℃,5min(1℃/s),1个循环;94℃,30s,退火温度为56.2℃,1min(1℃/s),40个循环;98℃10min(1℃/s),1个循环;4℃保存反应产物。对微反应体系进行荧光检测。
结果如表2所示,a6四次重复扩增拷贝数的sd值介于3.83~23.55之间,rsd值介于7.01%~9.38%之间,a10的四次重复扩增拷贝数的sd值介于3.78-21.51之间,rsd值介于5.11%~8.94%之间,均小于25%。
表2、建立的柯萨奇病毒pcr定量检测方法可重复性测试
因此,本发明建立的柯萨奇病毒a6、a10双重pcr定量检测方法可重复性非常好。
实施例5、柯萨奇病毒pcr方法的灵敏度测定
以含有a6和a10扩增片段的质粒进行稀释,拷贝数分别是1.0、10、100、1000、10000和50000拷贝/μldna进行灵敏度验证。含有a16和b2扩增片段的质粒进行稀释,拷贝数分别是1.4、14、140、1400、14000和70000拷贝/μldna进行灵敏度验证。每组dna样品进行四个平行的pcr实验。
双重pcr扩增体系为:扩增体系,同时以a6、a10两种为模板。
2×ddpcrsupermix10μl,a6、a10上下游引物(10μmol/l)各1.5μl,a6、a10探针(10μmol/l)各0.5μl,a6、a10dna模板各1.0μl,补水至20μl。
双重pcr扩增条件为:
95℃10min(1℃/s)一个循环;94℃30s,56.2℃1min(1℃/s),40个循环;98℃10min(1℃/s),一个循环,4℃保温。
实验结果如表3所示,当采用浓度为10、100、1000、10000和50000拷贝的dna样品进行定量检测a6时,测定的sd值在1.07-2894.84之间,rsd值在3.86%~12.02%之间。当采用浓度为10、100、1000、10000和50000拷贝的dna样品进行定量检测a10时,测定的sd值在1.34-2277.43之间,rsd值在2.26%~13.08%之间。当采用最低的1.0拷贝样品进行扩增时,百分比含量仍然具有参考意义。
表3、建立的柯萨奇pcr定量检测方法灵敏度测试
因此,建立的柯萨奇a6和a10的pcr方法精确度高,模板浓度低至10拷贝时也可进行准确定量。
实施例6、柯萨奇病毒pcr方法的lod和loq测试
以1.0和10拷贝/μl柯萨奇病毒a6、a10cdna的低含量样品为对象,在同样的实验环境下开展两组平行试验,每组平行试验重复4次,利用pcr方法对其精确定量。
实际检测1.0和10拷贝/μl柯萨奇病毒a6cdna样品。结果表明,检测下限(lod)为1.0拷贝,定量下限(loq)为10拷贝。
实际检测1.0和10拷贝/μl柯萨奇病毒a10cdna样品。结果表明,检测下限(lod)为1.0拷贝,定量下限(loq)为10拷贝。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>上海出入境检验检疫局动植物与食品检验检疫技术中心
<120>同时诊断柯萨奇a6型、a10型的方法及试剂盒
<130>190973
<160>6
<170>siposequencelisting1.0
<210>1
<211>19
<212>dna
<213>引物(primer)
<400>1
agctagcacccactccctg19
<210>2
<211>19
<212>dna
<213>引物(primer)
<400>2
agtgctccacactcgcctc19
<210>3
<211>16
<212>dna
<213>探针(probe)
<400>3
ccgtttcgattcatca16
<210>4
<211>19
<212>dna
<213>引物(primer)
<400>4
ctcgtccgtacatgctgca19
<210>5
<211>20
<212>dna
<213>引物(primer)
<400>5
tgcaggagggtcagtgagtt20
<210>6
<211>20
<212>dna
<213>引物(primer)
<400>6
tttcaatggcaaacagcaac20
- 还没有人留言评论。精彩留言会获得点赞!