鲤浮肿病毒和锦鲤疱疹病毒双重实时荧光定量检测方法与流程
本发明涉及一种鲤浮肿病毒和锦鲤疱疹病毒双重实时荧光定量pcr检测方法,属于鱼类病毒检测技术领域。
背景技术:
鲤和锦鲤是我国具有重要市场价值的品种,随着养殖规模的不断扩大,鱼类疫病也频繁出现。其中,鲤浮肿病毒(carpedemavirus,cev)和锦鲤疱疹病毒(kioherpesvirus,khv)都可以感染鲤和锦鲤,对水产养殖产业造成严重危害。cev是一种线性双链dna,属于痘病毒,大小约为200nm×400nm。khv也为双链dna,属疱疹病毒,是直径167~200nm的二十面体,有囊膜。以上两种病毒均只感染鲤和锦鲤,且引起的临床症状极其相似,包括烂鳃、眼球凹陷、食欲不振、体表出血等,死亡率高达80%~100%。因此,在养殖生产中,当鲤或锦鲤出现凹眼、烂鳃等症状,并有高死亡率时,现场依靠发病症状和流行特点很难区分这两种病毒病,需进一步进行实验室检测。
分子生物学方法是实验室最常用的检测cev和khv的方法。现有技术中通常采用由英国cefas建立、matras等公布的单重荧光定量pcr法检测cev,采用sc/t7212.1-2011行业标准检测khv,由于cevd和khvd临床症状极其相似,往往需要针对同一样品分别检测cev和khv这两种病原,耗时较长。实时荧光定量pcr具有灵敏度高、特异性强和重复性好等优点,已逐渐成为动物病原检测的重要方法。目前,尚未见应用双重实时荧光定量pcr技术同时检测cev和khv的相关报道。
cev和khv已经成为危害国内外鲤和锦鲤养殖产业的重要病原。鲤和锦鲤养殖具有重要的经济价值和市场价值,目前,对cevd和khvd并没有有效的治疗措施,尽快确诊病原,尽早切断传播途径对降低经济损失有重要作用。
目前,诊断cev主要依靠分子生物学检测方法,还没有筛选到能够稳定易感cev的敏感细胞系。oyamatsu等和英国cefas建立的套式pcr都存在漏检现象。英国cefas建立的实时荧光定量pcr是目前最适用于检测cev的方法,更适用于cev的常规监测。针对khv的敏感细胞系已有大量报道,例如锦鲤鳍细胞(koifincells,kfc)、鲤鱼脑细胞(commoncarpbraincells,ccb)、锦鲤鳃细胞系(thegillofkoi,kog)等,但通常需要传代3~5次,分离培养时间较长,且首次分离成功的很少,故普通pcr检测方法依然是诊断khv首选,但相对于实时荧光定量pcr法来说,耗时较长,检测操作步骤较多。单重实时荧光定量pcr方法对cev和khv的检测已得到较广泛的应用。
技术实现要素:
本发明为了解决上述问题,提供一种新型的鲤浮肿病毒和锦鲤疱疹病毒双重实时荧光定量pcr检测方法,该方法能够同时检测cev和khv,提高了检测效率,在样品量非常大时具有很大优势。
本发明所述的鲤浮肿病毒和锦鲤疱疹病毒双重实时荧光定量pcr检测方法包括以下步骤:
第一、合成引物与taqman探针:
根据cevp4a基因序列,对引物序列进行优化,上游引物第1个碱基改为简并碱基w,下游引物第1个碱基改为简并碱基r;根据khvorf7基因保守序列,设计1对特异性引物和1条taqman探针;分别使用fam和vic作为探针报告基团,bhq1作为探针淬灭基团;
第二、确定反应体系及条件:
采用20μl反应体系,2×probepcrmastermix10μl,上、下游引物和探针引物终浓度在0.2μmol/l~0.8μmol/l之间,qnrox参考染料0.1μl,模板2.5μl,depc水补足20μl;反应程序为:95℃预变性2min,1个循环;95℃5s,50~60℃退火31s,40个循环。
优选地,反应体系确定为:2×probepcrmastermix10μl,cev上、下游引物终浓度0.6μmol/l,探针终浓度0.3μmol/l,khv上、下游引物终浓度0.4μmol/l,探针终浓度0.2μmol/l,qnrox参考染料0.1μl;模板2.5μl,depc水补足20μl;反应程序为:95℃预变性2min,1个循环;95℃5s,56℃退火31s,40个循环。
在一个实施例中,根据cevp4a基因序列对引物序列进行优化后的cev-r序列为rattcctcaaggagttdcagtaaa。
在一个实施例中,根据cevp4a基因序列对引物序列进行优化后的cev-f序列为wgttttgtakattgtagcatttcc。
在一个实施例中,探针cev-probe序列为fam-agagtttgtttcttgccatacaaact-bhq1。
在一个实施例中,根据khvorf7基因保守序列设计的引物khv-r序列为cacggatcttctatgctaca。
在一个实施例中,根据khvorf7基因保守序列设计的引物khv-f序列为ttgttgtgcgttgatgttc。
在一个实施例中,根据khvorf7基因保守序列设计的探针khv-probe序列vic-cttgacggcactcgtcgagccgtagccc-bhq1。
本发明所述的鲤浮肿病毒和锦鲤疱疹病毒双重实时荧光定量pcr检测方法对cev和khv的灵敏度为15copies/μl。
本发明所述的鲤浮肿病毒和锦鲤疱疹病毒双重实时荧光定量pcr检测方法与单重实时荧光定量pcr扩增所获得的ct值的变异系数小于3%。
与现有技术相比,本发明所述的鲤浮肿病毒和锦鲤疱疹病毒双重实时荧光定量pcr检测方法的有益效果在于:灵敏度高、特异性好,与其他病毒无交叉反应;临床试验结果表明,该方法的结果与实验室常规检测结果一致,针对混合感染样品可特异的检出感染病原,适用于实验室对cev和khv的常规检测,可为cevd和khvd两种常见鱼类疫病的快速诊断提供必要的技术支撑。
附图说明
图1a是cev的敏感性曲线。
图1b是cev的标准曲线。
图2a是khv的敏感性曲线。
图2b是khv的标准曲线。
图3是特异性试验曲线。
图4是real-timepcr组内重复性试验获得的目标扩增曲线。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
本发明所述的鲤浮肿病毒和锦鲤疱疹病毒双重实时荧光定量pcr检测方法包括以下步骤:
第一、合成引物与taqman探针:根据matras等公布的cevp4a基因序列,对引物序列进行优化,上游引物第1个碱基改为简并碱基w,下游引物第1个碱基改为简并碱基r;根据genbank中khvorf7基因保守序列,应用primer6.0软件设计1对特异性引物和1条taqman探针;分别使用fam和vic作为探针报告基团,bhq1作为探针淬灭基团(见表1)。引物序列由北京六合华大基因科技有限公司合成。
表一引物和taqman探针序列
第二、确定反应体系及条件:
采用20μl反应体系,2×probepcrmastermix10μl,上、下游引物和探针引物终浓度在0.2μmol/l~0.8μmol/l之间,qnrox参考染料0.1μl,模板2.5μl,depc水补足20μl;反应程序为:95℃预变性2min,1个循环;95℃5s,50~60℃退火31s,40个循环。
为了确定最佳引物浓度配比和反应程序,本申请采用多种毒株,进行了大量的特异性试验、重复性试验、干扰性试验,并采用本申请建立的双重实时荧光定量pcr方法,检测本实验室鉴定保存的13份cev阳性样品、7份khv阳性样品,评价该方法的可靠性。
本申请采用的毒株包括鲤浮肿病毒(carpedemavirus,cev)、锦鲤疱疹病毒(kioherpesvirus,khv)、金鱼造血器官坏死病毒(goldfishhaematopoieticnecrosisvirus,gfhnv)、流行性造血器官坏死病毒(epizootichaematopoieticnecrosis,ehnv)、蛙虹彩病毒(bohleiridovirus,biv)、斑点叉尾鮰病毒(channelcatfishvirus,ccv),由北京市水产技术推广站鉴定保存,白斑综合征病毒(whitespotsyndromevirus,wssv)、虾肝肠胞虫(enterocytozoonhepatopenaei,ehp)标准品购自中国水产科学研究院黄海水产研究所。
本申请采用的dna抽提试剂盒、荧光quantinovatmprobepcrkit试剂盒均购自qiagen公司;dna扩增试剂盒购自北京百泰克生物技术有限公司;ab7500荧光定量pcr仪购自lifetechnologies公司。
制备标准品:
参照dna抽提试剂盒说明书,提取鲤浮肿病毒和锦鲤疱疹病毒的dna,送至北京天成新脉生物技术有限公司,合成cevp4a基因序列(528bp)和khvorf7基因序列(484bp),分别克隆到peasy-t1载体和puc57-kan载体上,构建cev-p4a和khv-orf7标准质粒,根据质粒浓度计算拷贝数。
双重实时荧光定量pcr反应条件及引物浓度优化:
浓度为1.5×107copies/μl的质粒cev-p4a和khv-orf7混合液作为标准品,采用20μl反应体系,2×probepcrmastermix10μl,应用矩阵法对引物浓度进行最佳配比和筛选,将上、下游引物和探针引物终浓度在0.2μmol/l~0.8μmol/l之间调整,qnrox参考染料0.1μl,模板2.5μl,depc水补足20μl。反应程序为:95℃预变性2min,1个循环;95℃5s,50~60℃退火31s,40个循环。根据荧光pcr结果曲线和ct值确定最佳引物浓度配比和反应程序。
敏感性试验与标准曲线的建立:
对质粒cev-p4a和khv-orf7进行10倍系列稀释,将相同稀释倍数的质粒充分混合作为模板,按照已优化好的双重实时荧光定量pcr反应条件进行扩增,建立标准曲线。
特异性试验:
分别以3.0×105copies/μl的质粒cev-p4a或khv-orf7作为模板,同时加入cev和khv的引物和探针,按照优化好的反应条件进行二重单检的实时荧光pcr扩增,每个样品孔同时收集fam和vic两种荧光信号,确定该方法的引物与探针在cev和khv之间的特异性。采用本申请建立的方法,对gfhnv、ehnv、ccv等dna病毒进行特异性验证。
重复性试验:
将浓度为3.0×105copies/μl的cev-p4a和khv-orf7质粒等体积混合,获得1.5×105copies/μl的质粒混合液作为模板,分为5个标本同时检测。在第4天、第7天重复检测保存于-20℃的模板,通过计算ct值的标准差(s)和变异系数(cv)验证本申请的方法的批内重复性和批间重复性。
干扰性试验:
将质粒cev-p4a和khv-orf7按不同浓度进行组合(3.0×107和3.0×101;3.0×101和3.0×107),分别进行单重和双重荧光定量pcr检测,确定当模板浓度相差较大时cev和khv之间的检测是否存在干扰现象。
临床样品检测应用:
采用本申请建立的双重实时荧光定量pcr方法,检测本实验室鉴定保存的13份cev阳性样品、7份khv阳性样品,评价该方法的可靠性。
反应体系及条件的优化:
通过对引物及探针浓度的筛选及退火温度的优化,最佳反应体系确定为:2×probepcrmastermix10μl,cev上、下游引物终浓度0.6μmol/l,探针终浓度0.3μmol/l,khv上、下游引物终浓度0.4μmol/l,探针终浓度0.2μmol/l,qnrox参考染料0.1μl.模板2.5μl,depc水补足20μl。反应程序为:95℃预变性2min,1个循环;95℃5s,56℃退火31s,40个循环。
敏感性试验结果及标准曲线的建立:
以10倍系列稀释的cev-p4a或khv-orf7质粒混合液(1.5×107~1.5×101copies/μl)作为模板,进行双重实时荧光定量pcr扩增,结果见图1a、图1b、图2a和图2b。图1a和图2a中附图标记1-7表示1.5×107拷贝/μl~1.5×101拷贝/μl,附图标记8表示空白对照。
图1至图4中,阈值:荧光扩增曲线上仪器自动设定或人为设定的一个值,一般是pcr扩增的3-15个循环的荧光信号的标准偏差的10倍,在pcr扩增的指数期。
ct值:每个反应管内的荧光信号到达设定的阈值时所经历的循环数。
rn:是荧光报告基团的荧光发射强度与参比染料的荧光发射强度的比值;
△rn:是rn扣除基线后得到的相对荧光值(△rn=rn-基线);
基线:在pcr扩增反应的最初数个循环里,荧光信号变化不大,接近一条直线,这样的直线就是基线。
本申请的方法最低能检测到的cev浓度为1.5×101copies/μl,以质粒拷贝数的lg值为横坐标,ct为纵坐标建立标准曲线,回归方程为:y=-3.4551x+38.76;该方法最低能检测到的khv浓度为1.5×101copies/μl,以质粒拷贝数的lg值为横坐标,ct为纵坐标建立标准曲线,回归方程为:y=-3.5287x+39.099。结果表明本申请建立的方法对cev和khv的灵敏度为15copies/μl。
特异性实验结果:
当反应体系中只加入cev或khv基因组dna作为模板,采用本申请建立的方法进行pcr扩增时,结果只得到相应模板的特异性荧光曲线,表明引物及探针在这两种病毒间具有特异性。对gfhnv、ehnv、ccv等阳性核酸的扩增结果显示,这几种dna病毒、阴性对照以及空白对照均不能产生扩增曲线,呈现阴性结果,见图3,表明本申请建立的双重实时荧光定量pcr法具有良好的特异性。图3中,1为鲤浮肿病毒;2为锦鲤疱疹病毒;3为金鱼造血器官坏死病毒;4为流行性造血器官坏死病毒;5为蛙虹彩病毒;6为斑点叉尾鮰病毒;7为白斑综合征病毒;8为虾肝肠胞虫;9为空白对照。
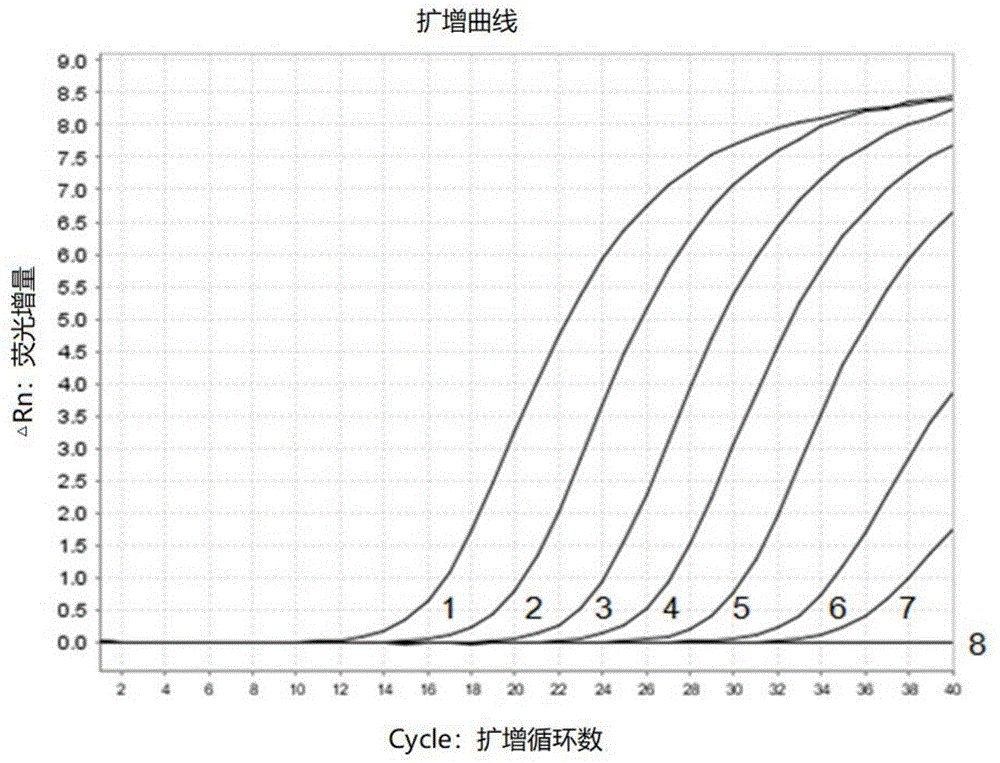
重复性试验结果:
以1.5×105copies/μl的质粒混合液作为模板,进行批内重复性试验,结果5个平行样品均获得目标扩增曲线,见图4。图4中1~5为1.5×105拷贝/μlcev;6~10为1.5×105拷贝/μlkhv;11为空白对照。cev的sd为0.10,cv为0.49﹪;khv的sd为0.13,cv为0.66﹪,见表2。第4、7天后进行批间重复性试验,cev的sd为0.10,cv为0.52%;khv的sd为0.13,cv为0.67%,见表3。结果表明,本申请建立的双重实时荧光定量pcr法具有良好的重复性。
表2组内重复性试验
表3组间重复性试验
干扰性试验结果:
将质粒cev-p4a和khv-orf7按不同浓度进行组合进行荧光定量pcr检测,发现当两种模板浓度相差很大时,本申请的方法依然能够检出低浓度模板,且与单重实时荧光定量pcr扩增所获得的ct值的变异系数小于3%,见表4。
表4干扰性试验结果
临床样品应用检测结果:
采用本申请建立的cev和khv双重实时荧光定量pcr法,对经单重pcr检测阳性的13份cev样品和采用sc/t7212.1-2011行业标准检测阳性的7份khv样品进行扩增,结果13份cev阳性样品在fam荧光通道均有特异的荧光曲线和ct值,在vic荧光通道无扩增曲线和ct值,且病毒浓度为1.05×102—7.09×104copies/μl。7份khv阳性样品在vic荧光通道均有特异性的荧光曲线和ct值,病毒浓度为3.91×102—3.02×105copies/μl,在fam荧光通道6份样品无扩增曲线和ct值;1份样品有特异的荧光曲线和ct值,且病毒浓度为5.6×104copies/μl。
本申请根据matras等公布的cevp4a基因序列,对引物序列进行优化,合成1对特异性引物和1条taqman探针;根据khvorf7基因保守序列,设计筛选1对特异性引物和1条taqman探针。引物序列间无相互干扰,通过矩阵法筛选出了cev和khv的最佳引物和探针浓度组合,优化反应条件,成功建立双重实时荧光定量pcr方法,大大缩短了检测时间,全程约需1.5h,与用单重荧光定量pcr分别检测两种病毒相比,减少1.5h,与普通pcr相比则减少约4h;本申请的方法具有较高的敏感性,可检测到15copies/μl的cev或khv;具有良好的特异性,不与其它病毒发生交叉反应;由于扩增产物不需电泳,则有效避免普通pcr方法可能产生的气溶胶污染风险。
临床样品检测结果表明,有1份khv阳性样品也为cev阳性。经查,该样品为2015年由本实验室采集,由于实验室是2016年后开始开展大量cev相关研究,并未对2016年之前的样品进行cev复检,因此针对该样品只进行了khv鉴定。采用单重实时荧光定量pcr对该样品进行扩增,有明显扩增曲线和ct值,为cev阳性,表明本申请建立的双重实时荧光定量pcr方法检测结果与实验室常规方法结果一致。通过对临床样品的检测证明cev和khv在临床上确实有混合感染的情况发生。在同一样品中两种病原的含量可能相差较大,本申请通过干扰性试验,探讨当模板浓度相差较大时,高浓度模板对低浓度模板是否存在干扰现象。结果表明,当两种模板浓度相差很大时,本申请的方法依然能够检出低浓度模板,且与单重实时荧光定量pcr扩增所获得的ct值的变异系数小于3%。
综上,本申请建立的双重实时荧光定量pcr检测方法灵敏度高、特异性好,与其他病毒无交叉反应;临床试验结果表明,该方法的结果与实验室常规检测结果一致,针对混合感染样品可特异的检出感染病原,适用于实验室对cev和khv的常规检测,可为cevd和khvd两种常见鱼类疫病的快速诊断提供必要的技术支撑。
虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!