用于定量监测山核桃干腐病侵染和传播的qLAMP方法及所用引物与流程
本发明属于生物技术与植物病害流行学领域,涉及定量环介导等温扩增(qlamp)技术用于监测雨水、树体和土壤等处山核桃干腐病病菌孢子数量的定量环介导等温扩增引物组及其使用方法,属于植物病害流行学、动态监测及预警的技术领域。
背景技术:
茶藨子葡萄座腔菌(botryosphaeriadothidea)是寄主依赖型弱寄生性植物病原真菌,寄主范围很广,是一种世界范围内危害木本植物健康的真菌病原,其中侵染山核桃树干引起山核桃干腐病。山核桃干腐病在浙西等山核桃主产区普遍发生,受害面积逐步扩大,是山核桃产业发展的瓶颈。病原菌以菌丝体在山核桃树体内越冬,翌年春季潜伏在树体内的病菌开始活动,突破树皮形成溃疡斑,其表面形成子实体并释放孢子,引起新的侵染。孢子借风雨传播,侵入树皮细胞或树体伤口后表现明显的“潜伏侵染”特性,从3月下旬开始到11月都有不同程度的病害发生。4月中旬至6月中旬气温在25℃—30℃是孢子释放侵染的高峰期的高峰,7~8月气温30℃以上的高温天气不利于病菌的发展,秋季气温下降至30℃以下又会产生病菌的发展。目前急需一种快速,准确监测雨水、树体等处山核桃干腐病病菌孢子数量的技术,以达到对干腐病的传播与发生做出科学合理的预测预报的目的。
随着核酸相关的鉴定方法不断发展,基于普通pcr的方法已经成功用于检测山核桃干腐病菌,但pcr法特异性等检测耗时偏长,需要6~8h,且检测灵敏度偏低,检测过程较繁杂,关键的是还容易受到各种pcr抑制物的影响。环介导等温扩增技术(loop-mediatedisothermalamplification,lamp)是日本荣研株式会社发明的一种新的核酸扩增技术,因为其扩操作简便、快速、特异性高、成本低等优点,成为可以替代pcr的新的核酸扩增技术。它是针对靶基因的6个区域设计4对特异性引物,在bst大片段聚合酶的作用下引起自循环链置换反应,60-65℃范围60min内,能大量合成目标dna。由于lamp扩增过程依赖识别靶序列6个独立区域,所以反应特异性很强,并且核酸扩增过程是在恒温条件下进行,普通水浴锅或者等温保温瓶就能满足反应要求,检测成本降低,所需时间短。
技术实现要素:
本发明要解决的技术问题是提供一种用于监测雨水、树体等处山核桃干腐病菌孢子数量的定量环介导等温扩增(q-lamp)方法、引物组合物和试剂盒。
为了解决上述技术问题,本发明提供用于监测山核桃干腐病病菌孢子数量动态的定量环介导等温扩增引物,q-lamp引物组合物由以下4条引物组成(即,由上下游外引物,上下游内引物这四条引物组成):
上游外引物(f3):5’—tgtccataggttcacctcca—3’;
下游外引物(b3):5’—agatggtctgcctgtggt—3’;
上游内引物(fip):5’—caaagtcagcgcgatgcagcgaccggccaatgcgtaag—3’;
下游内引物(fib):5’—agggtaaccaaatcggtgctgcgtcgattcgcgttagcgg—3’。
本发明还同时提供了用于监测山核桃干腐病病菌孢子数量动态的定量环介导等温扩增试剂盒,包含上述q-lamp引物组合物。
作为本发明的试剂盒的改进:正/反内向引物fip/bip的浓度为1.6μm,正/反向外引物f3/b3的浓度为0.125μm。
作为本发明的试剂盒的进一步改进:试剂盒还包含定量环介导等温扩增反应预混液:10×thermopolbuffer、dntps(1mm)、mgcl2(6.25mm)、甜菜碱(0.6m)、10×sybrgreeni、bstdna聚合酶(0.4u·μl-1)、ddh2o。
本发明还同时提供了利用上述试剂盒进行的山核桃干腐病病菌孢子数量动态的定量环介导等温扩增方法:
1)、q-lamp反应
q-lamp反应体系(20μl):
10×thermopolbuffer2.0μl、10mm的dntps2.0μl、25mm的mgcl25.0μl、5m的甜菜碱2.4μl、10×sybrgreeni1.2μl、8u/μl的bstdna聚合酶1μl,20μm的fip引物1.6μl、20μm的bip引物1.6μl、10μm的f3引物0.25μl、10μm的b3引物0.25μl、dna模板1μl,ddh2o补足至20μl;
扩增条件为恒温65.9℃,1min(此时间点获取荧光数据,这一过程为一个循环),进行80个循环;80℃反应10min,终止反应;
注:可获得ct值;
即,20μl检测反应体系由上述19μl检测溶液和1μl待测dna模板(浓度在0.001ng/μl~100ng/μl)组成。
2)、获得孢子数量、dna浓度。
作为本发明的定量环介导等温扩增方法的改进:
孢子数量(个)计算公式为
dna浓度计算公式为
y为ct值。
在本发明中,
稀释样品ct值(y)与每毫升样品孢子数量的log值(x)之间的标准曲线1:y=-6.863x+49.937,孢子数量(个)计算公式为
计算公式:构建标准曲线,用每毫升样品孢子数量的log值为x轴、对应的ct值为y轴作图,显示递减线性等式[y=mx+b,或y=m(log每毫升样品孢子数量)+b],从递减的线性等式可以推导出如下等式,以确定未知样本的量:
标准曲线2:定义lg(dna浓度值/0.0001)为x,对应的ct值为y轴作图,即:y=-3.5823x+37.233,dna浓度计算公式为
在本发明中,扩增结果的分析和判定方法包括:
在扩增前加入sybrgreeni作为反应指示剂,以荧光信号做为结果判定依据,反应结束后仪器自动根据标准曲线显示定量结果ct值。根据q-lamp扩增反应时间与梯度稀释山核桃干腐病菌孢子制成标准曲线,再根据待测样品的反应时间,可准确算出该样品的孢子起始浓度。
本发明的方法能定量监测雨水、树体和土壤等处的山核桃干腐病菌孢子数量,克服以往实时荧光定量pcr检测方法的不足,具有高灵敏度、高特异性、低污染、反应稳定等优点,该方法不易受pcr抑制物及其它污染物的影响。
本发明的发明过程包括:
(1)根据从山核桃干腐病菌扩增得到的β-tubulin序列与其菌他菌种间的β-tubulin序列差异位点设计特异性引物;
(2)引物的筛选;
(3)引物的特异性检测;
(4)q-lamp反应温度优化;
(5)q-lamp的检测灵敏度。
具体如下:
1、引物的设计:
首先基于赤霉β-tubulin序列比对出2个同源性较高的序列,设计了1对葡萄座腔菌引物a1(干aβ-f1816和干aβ-r),从genbank中下载拟盘多毛孢菌(pestalotiopsismicrospora,登录号为ku377338.1)、木霉菌(trichodermaviride,登录号为z15055.1)、层生镰刀菌(fusariumproliferatum,登录号为kj544178.1)、黑孢菌(nigrosporachinensis,登录号为ky019579.1)、轮层炭菌(daldiniasp.,登录号为ku684130.1)、链格孢菌(alternariaoregonensis,登录号为jq671993.1)的β-tubulin序列,根据山核桃干腐病菌扩增得到的β-tubulin序列与其菌他菌种间的β-tubulin序列差异位点,设计出四套特异性葡萄座腔菌lamp检测的引物(例如,可使用在线引物设计软件primerexplorev5)。
所述引物信息见表1。
表1引物序列信息
2、引物的筛选
lamp采用25μl反应体系,具体如下:
lamp反应参数设为65.9℃,60min。
注:引物的筛选采用lamp检测技术,使用abi2720pcr仪器,根据hnb指示剂的颜色变化及电泳图进而筛选得到适合的引物。
lamp反应结束后,通过颜色变化和电泳图谱判定是否为阳性扩增。如果山核桃干腐病菌样品lamp扩增产物显示天蓝色,电泳图谱应为梯状条带,待测样品为阳性。山核桃干腐病菌样品lamp扩增产物显示紫色,电泳图谱无条带扩增,判定待测样品为阴性。经过筛选表明,表1中的引物组1适合用于山核桃干腐病菌的lamp检测。
3、引物的特异性检测
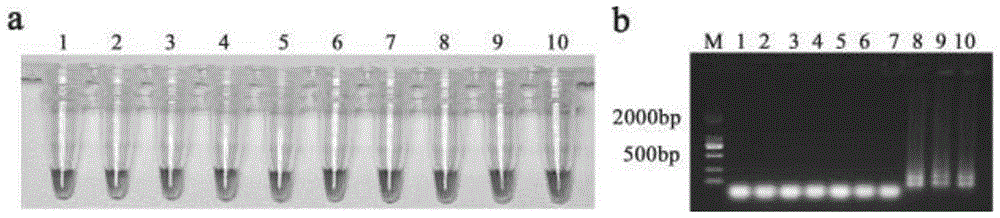
为检测引物的特异性,利用表1中的引物组1对各菌株进行lamp验证,山核桃干腐病菌菌株(干腐病bddh-1菌株、干腐病bddh-2菌株、干腐病bddh-3菌株)能扩增出产物,颜色显示为天蓝色,琼脂糖凝胶电泳图谱呈梯状条带;参照菌株不能扩增出产物,颜色显示为紫色,琼脂糖凝胶电泳图谱无梯状条带。反应结果显示如图1,引物组1具有对山核桃干腐病菌的特异性。
参照菌株,包括木霉菌(trichodermaviride)、层生镰刀菌(fusariumproliferatum)、拟盘多毛孢菌(pestalotiopsismicrospora)、黑孢菌(nigrosporachinensis)、链格孢菌(alternariaoregonensis)、轮层炭菌(daldiniasp.)。
4、反应程序的优化
以建立能定量监测山核桃干腐病菌的q-lamp最佳反应温度为目的,利用上述引物组合1,同反应预混液构成检测液,加入山核桃干腐病菌dna模板1μl(浓度为0.1ng/μl),将反应温度分别设置67.0℃、66.6℃、65.9℃、64.5℃、62.8℃、61.4℃、60.5℃和60.0℃,各80个循环,每个循环60s,80℃10分钟。反应结果显示如图2,在反应温度为65.9℃时,荧光最强,扩增产物最多,而且反应时间最短,在38min时扩增达到峰值。65.9℃为扩增的最佳温度,后续干腐病病q-lamp反应在65.9℃进行。
5、检测体系的灵敏度验证结果
用优化后的干腐病菌q-lamp检测体系对梯度稀释的干腐病菌纯菌丝的dna溶液检测结果表明,在dna浓度为100ng/μl、10ng/μl、1ng/μl、0.1ng/μl、0.01ng/μl和0.001ng/μl时,均能有效扩增,同一样品重复性可靠。各浓度对应的扩增时间分别为16.32min、18.68min、22.43min、26.63min、30.84min和33.26min。结果表明,所建立的q-lamp检测体系理论上干腐病菌dna的检测线为1pgdna。
6、q-lamp扩增和标准曲线的建立
取一定数量成熟的干腐病菌分生孢子器于2.0ml离心管中,加入1.5ml无菌水进行破壁处理,接着用3层滤纸过滤洗脱孢子,将干腐病菌的孢子稀释成1.0×105个/ml、1.0×104个/ml、1.0×103个/ml、1.0×102个/ml、1×101个/ml、1个/ml等6个系列浓度梯度。用优化后的干腐病菌q-lamp检测体系对梯度稀释的孢子dna检测,在孢子浓度为1.0×105个/ml、1.0×104个/ml、1.0×103个/ml、1.0×102个/ml和1.0×101个/ml时,均能有效扩增。各浓度对应的扩增时间分别为16.67min、21.51min、28.69min、36.26min和43.61min,均在60min以内。结果表明,所建立的q-lamp检测体系理论上能检测到浓度为1.0×101个/ml的孢子。
6个梯度稀释的干腐病菌孢子dna模板的扩增结果建立了稀释样品ct值(y)与每毫升样品孢子数量的log值(x)之间的标准曲线,y=-6.863x+49.937,相关系数r2=0.9922,即二者呈现良好的线性关系。
此方法可用于雨水、空气、树体等处干腐病菌孢子的定量测定。
本发明基于已定量的标准样品做出的标准曲线方程,标准品浓度的对数值与反应时间之间的相关系数r2>0.95,为定量未知样品的dna提供了理论依据。
本发明建立了山核桃干腐病菌的快速、特异性、灵敏度高的定量监测技术体系,该方法的建立对干腐病的预测预报和防控具有十分重要的意义。
本发明与现有技术相比,具有以下技术优势:
(1)特异性强,鉴定快速:检测方法结果显示,常见的真菌均为检测的阴性结果,只有山核桃干腐病菌才出现阳性结果。整个检测过程无需开盖,且只需1小时以内,克服了传统的显病原菌孢子显微观察和计数过程中需要大量的专业知识做出判断、结果难以判定的缺点。
(2)准确定量,灵敏度高:通过山核桃干腐病菌孢子基因组dna进行灵敏度检测,q-lamp技术可检测到最低山核桃干腐病菌孢子浓度为1.0×101个/ml,且在1.0×101~1.0×105个/ml浓度范围内都有很好的线性关系。不但克服了传统pcr受抑制物影响大等问题,也解决了普通lamp只能确定病菌的有无的局限性;
实用性好、应用范围广:可以定量监测土壤、空气和雨水及树体中山核桃干腐病菌,适用于山核桃干腐病菌孢子数量的动态监测,为其预测预报提供依据。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
图1为引物特异性测定;
1:木霉菌(trichodermaviride);2:层生镰刀菌(fusariumproliferatum);3:拟盘多毛孢菌(pestalotiopsismicrospora);4:黑孢菌(nigrosporachinensis);5:链格孢菌(alternariaoregonensis);6:轮层炭菌(daldiniasp.)7:ck;8:干腐病bddh-1菌株;9:干腐病bddh-2菌株;10:干腐病bddh-3菌株;
图2是温度对干腐病菌q-lamp检测体系的影响图;
图3是干腐病菌q-lamp检测体系的特异性图;
图4是q-lamp检测葡萄座腔菌dna的灵敏度图;
从左至右的曲线对应的浓度依次为100ng/μl、10ng/μl、1ng/μl、0.1ng/μl、0.01ng/μl和0.001ng/μl。
具体实施方式
下面通过实例并结合附图对本发明进行进一步描述,以下描述对本发明的保护范围不构成任何意义上的限定,仅仅做示例说明。
以下实施例中使用的主要试剂及仪器为:bstdna聚合酶(newenglandbiolabs、mgcl2(sigma),dntps(南京诺唯赞生物科技有限公司),甜菜碱、ddh2o水、分子质量标准dnamaker(takara生物工程公司基因组)、真菌基因组dna快速抽提试剂盒(生工生物工程股份有限公司)、bio-radcfx96实时荧光定量pcr仪。
实施例1、检测体系的特异性分析
以山核桃干腐病菌(botryosphaeriadothidea)作为阳性对照,以木霉菌(trichodermaviride)、层生镰刀菌(fusariumproliferatum)、拟盘多毛孢菌(pestalotiopsismicrospora)、黑孢菌(nigrosporachinensis)、链格孢菌(alternariaoregonensis)、轮层炭菌(daldiniasp.)六种真菌作为阴性对照,并以双蒸水作为空白对照进行测试。
检测溶液共19μl,加入待测dna模板(浓度在0.001ng/μl~100ng/μl,阳性对照、阴性对照时,浓度均为0.1ng/μl)1μl,构成20μl检测反应体系。20μl体系中含有8u/μl的bstdna聚合酶1μl、10×thermopolbuffer2.0μl、20μm的fip引物1.6μl、20μm的bip引物1.6μl、10μm的f3引物0.25μl、10μm的b3引物0.25μl、25mm的mgcl25.0μl、10mm的dntps2.0μl、5m的甜菜碱2.4μl、10×sybrgreeni1.2μl、dna模板1μl,双蒸水补足至20μl。q-lamp扩增反应程序为:65.9℃,80个循环,每循环60s;80℃,10min。
反应结果如图3所示,以干腐病菌dna为模板的样品检测出现荧光信号(对应的扩增时间为23.94),检测结果为阳性,以其它6种真菌dna为模板及ddh2o对照的样品未检测到荧光信号,检测结果均为阴性。检测结果表明,筛选得到的lamp引物组1能特异性地检测干腐病菌。
实施例2、引物的灵敏度检测
用优化后的干腐病菌q-lamp检测体系(如实施例1所述)对梯度稀释的干腐病菌纯菌丝的dna溶液检测结果如图4所示,在dna模板浓度为100ng/μl、10ng/μl、1ng/μl、0.1ng/μl、0.01ng/μl和0.001ng/μl时,均能有效扩增,同一样品重复性可靠。各浓度对应的扩增时间分别为16.32min、18.68min、22.43min、26.63min、30.84min和33.26min。结果表明,所建立的q-lamp检测体系理论上干腐病菌dna的检测线为1pgdna。
实施例3、标准曲线的获得:
标准曲线1、在孢子浓度为1.0×105个/ml、1.0×104个/ml、1.0×103个/ml、1.0×102个/ml和1.0×101个/ml时,各浓度对应的扩增时间分别为16.67min、21.51min、28.69min、36.26min和43.61min,根据稀释样品ct值(y)与每毫升样品孢子数量的log值(x)之间的标准曲线:y=-6.863x+49.937,相关系数r2=0.9922,孢子数量(个)计算公式为
计算公式:构建标准曲线,用每毫升样品孢子数量的log值为x轴、对应的ct值为y轴作图,显示递减线性等式[y=mx+b,或y=m(log每毫升样品孢子数量)+b],从递减的线性等式可以推导出如下等式,以确定未知样本的量:
标准曲线2、在菌丝dna浓度为100ng/μl、10ng/μl、1ng/μl、0.1ng/μl、0.01ng/μl和0.001ng/μl时,均能有效扩增,各浓度对应的扩增时间分别为16.32min、18.68min、22.43min、26.63min、30.84min和33.26min。构建标准曲线,定义lg(dna浓度值/0.0001)为x,对应的ct值为y轴作图,即:y=-3.5823x+37.233,相关系数r2=0.9904,dna浓度计算公式为
实施例4、q-lamp检测林间水样中的孢子
在被干腐病侵染的山核桃林间,随机选择5处放置敞开的金属容器(30×20×10cm),放置点应距发病植株约50cm处。放置时间选择为预测的降雨期之前,第二天将每个容器里的雨水收集。量取100ml收集的水样,提取水样中分生孢子的基因组dna。
提取方式为:将100ml样品以6800rcf离心5min,排出90%的水,经过两次浓缩至1ml,并通过涡旋震荡将孢子重新悬浮在剩余的1ml水样中,接着取1ml孢子悬浮液以6800rpm离心5min,排出800μl的水,并通过涡旋震荡将孢子重新悬浮在剩余的200μl水样中,加入200μl10%chelex-100溶液、200μl10%sds溶液和0.4g酸洗珠,置于fsat-prep仪器中,以6m/s的速度震荡40s后,于100℃水浴锅中加热5min,震荡加热步骤重复三次后于冰上放置2min。接着以10000rpm离心5分钟,取上层液体400μl,加入500μl缓冲液gp2(tiangen试剂盒),充分混匀;将混匀的液体转入吸附柱cb3中,12000rpm离心30s,弃掉废液;向吸附柱cb3中加入500μl缓冲液gd,12000rpm离心30s,弃掉废液,将吸附柱cb3放入收集管中;向吸附柱cb3中加入600μl缓冲液pw,12000rpm离心30s,弃掉废液,将吸附柱cb3放入收集管中,接着重复此步骤一次;将吸附柱cb3放回收集管中,12000rpm离心2min,弃掉废液。将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液;将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200μl洗脱缓冲液te,室温放置2-5分钟,12000rpm离心2min,将溶液收集到离心管中;100ml水样最终获得50μl的裂解液。
取1μl裂解液直接作为dna模板,按照优化后的反应体系和扩增条件(如实施例1所述)在bio-radcfx96实时荧光定量pcr仪上进行q-lamp检测,记录扩增时间。按照孢子数量与扩增时间的对应关系,换算出孢子数量(y=-6.863x+49.937,孢子数量(个)计算公式为
举例说明如下:30.93=-6.863x+49.937,因此x=2.7695;102.7695=588.17。
实施例5、对人为添加孢子的样品定量检测
分别往3个聚脂胶片(2cm×2cm)上人为添加干腐病菌的孢子,各胶片的孢子数量分别为1.0×103个、1.0×102个、1×101个。对收集的吸附有孢子的胶片进行裁切成边长小于1mm的小碎片后放入2ml离心管,然后提取胶片上孢子的基因组dna。
提取过程为:在离心管加入200μl10%chelex-100溶液、200μl10%sds溶液和0.4g酸洗珠,置于fsat-prep仪器中,以6m/s的速度震荡40s后,于100℃水浴锅中加热5min,震荡加热步骤重复三次后于冰上放置2min。接着以10000rpm离心5分钟,取上层液体400μl,加入500μl缓冲液gp2(tiangen试剂盒),充分混匀;将混匀的液体转入吸附柱cb3中,12000rpm离心30s,弃掉废液;向吸附柱cb3中加入500μl缓冲液gd,12000rpm离心30s,弃掉废液,将吸附柱cb3放入收集管中;向吸附柱cb3中加入600μl缓冲液pw,12000rpm离心30s,弃掉废液,将吸附柱cb3放入收集管中,接着重复此步骤一次;将吸附柱cb3放回收集管中,12000rpm离心2min,弃掉废液。将吸附柱cb3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液;将吸附柱cb3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200μl洗脱缓冲液te,室温放置2-5分钟,12000rpm离心2min,将溶液收集到离心管中;最终获得50μl的裂解液。
取1μl裂解液直接作为dna模板,按照优化后的反应体系和扩增条件(如实施例1所述)在bio-radcfx96实时荧光定量pcr仪上进行q-lamp检测,记录扩增时间。按照孢子数量与扩增时间间的对应关系(y=-6.863x+49.937,孢子数量(个)计算公式为
实施例6、在临安龙岗镇、清凉峰镇、昌化镇、湍口镇、太阳镇等地的山核桃林间,分别从发病的树干底部至2m以下的位置,每隔50cm采集发病的韧皮部组织,标记为0、50、100、150、200cm等5处取样点;另从发病的树干病斑部位,每隔一定距离采集树干的韧皮部组织,标记为0、5、10、20cm等4处取样点。
取采集样品韧皮部3g,分别放入fw100型高速万能粉碎机中,粉碎2min后,取400mg组织加液氮用研杵碾压样品,待剩余少量液氮时快速用力研磨,重复研磨3-4次,接着使用植物基因组dna提取试剂盒(tiangen)提取dna,从而获得每个采集样品的dna模板。
标准样品为干腐病菌纯菌丝的dna溶液;经10倍梯度稀释处理,从而获得标准样品的dna模板,浓度为100ng/μl到0.001ng/μl。
将采集样品与标准样品同时在荧光定量pcr上进行反应,记录将采集样品与标准样品扩增循环阈值(ct),通过稀释样品得到的标准曲线2(y=-3.5823x+37.233,dna浓度计算公式为
上述每个取样点在荧光定量pcr上所得的扩增循环阈值(ct)以及换算所得的孢子量如下表2所述。
表2
对比例1-1、
以以下引物组合进行试验:
上游外引物(f3-1):5’—tgtccataggttcacctcct—3’;
下游外引物(b3-1):5’—agatggtctgcctgtggg—3’;
上游内引物(fip-1):5’—caaagtcagcgcgatgcagcgaccggccaatgcgtaag—3’;
下游内引物(fib-1):5’—agggtaaccaaatcggtgctgcgtcgattcgcgttagcgg—3’;
注:两条外引物的3’端最后一个碱基a和t分别替换为t和g,以验证引物的特异性。
以上述引物替代实施例1的引物(浓度、用量均保持不变),20μl反应体系的其余成分和q-lamp扩增反应程序等同于实施例1;对实施例1中的阳性对照、6个阴性对照、1个空白对照进行检测。
试验结果都显示为阴性,未检出荧光信号。表示该引物组合构成的环介导等温扩增体系不能有效检测出干腐病菌,即使将dna模板的浓度增加至200ng/μl,仍然无法有效区分。
对比例1-2、
以以下引物组合进行试验:
上游外引物(f3-2):5’—tgtccataggttcacctcca—3’;
下游外引物(b3-2):5’—agatggtctgcctgtggt—3’;
上游内引物(fip-2):5’—caaagtcagcgcgatgcagcgaccggccaatgcgtaat—3’;
下游内引物(fib-2):5’—agggtaaccaaatcggtgctgcgtcgattcgcgttagcgc—3’;
注:两条内引物的的3’端最后一个碱基g和g分别替换为t和t,以验证引物的特异性。
以上述引物替代实施例1的引物(浓度、用量均保持不变),20μl反应体系的其余成分和q-lamp扩增反应程序等同于实施例1;对实施例1中的阳性对照、6个阴性对照、1个空白对照进行检测。
试验结果都显示为阴性,未检出荧光信号。表示该引物组合构成的环介导等温扩增体系不能有效检测出山核桃干腐病菌,即使将dna模板的浓度增加至200ng/μl,仍然无法有效区分。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
序列表
<110>浙江农林大学
<120>用于定量监测山核桃干腐病侵染和传播的qlamp方法及所用引物
<160>4
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
tgtccataggttcacctcca20
<210>2
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>2
agatggtctgcctgtggt18
<210>3
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>3
caaagtcagcgcgatgcagcgaccggccaatgcgtaag38
<210>4
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>4
agggtaaccaaatcggtgctgcgtcgattcgcgttagcgg40
- 还没有人留言评论。精彩留言会获得点赞!