一种丙酮氰醇与卤代烷反应制备腈的方法与流程
本发明属于有机合成技术领域,涉及一种丙酮氰醇与卤代烷反应制备腈的方法。
背景技术:
腈是一类含氰基的有机物,它是重要的化工原料,在医药、新材料等领域有重要应用,其中代表性的化合物如己二腈是制备尼龙66的原料、苯乙腈是生产多种医药、农药的中间体;丙烯腈可与其他单体共聚合,生产合成橡胶和工程塑料等等。
现有的制备腈的方法较多,但最常用的方法是脂肪卤代烃与金属氰化物进行亲核取代反应制备腈。该方法的局限性主要有(1)金属氰化物为剧毒的氰化钠、氰化钾,由此带来的严重的环境污染和人身安全等问题;(2)氰化钠/氰化钾属于无机盐,在有机溶剂中几乎不溶,需要加入相转移催化剂,如四丁基溴化铵、十六烷基三甲基铵、18冠6醚等,增加生产成本;(3)当反应物为叔卤代烷时,反应以消除产物为主,导致取代产物的产率较低;(4)当反应物是氯代烷或溴代烷等反应活性较弱的卤代烷时,需要加入碘化钾或碘化钠做助催化剂。为了克服此反应存在的上述缺陷,目前实验室多以三甲基硅氰作为氰化试剂,但是该物质价格昂贵,原子利用率低,反应需在严格无水无氧条件下进行,因此不能满足工业化生产要求。
使用丙酮氰醇这种相对安全,替代氢氰酸(人类致死量为0.57mg/kg)、氰化钠、氰化钾(丙酮氰醇的ld50是52mg/kg,而氰化钠的ld50是6mg/kg)等剧毒的氰化试剂,避免由此带来的环境污染和人身安全等问题;丙酮氰醇是生产丙烯腈的副产物,其价格低廉,用丙酮氰醇替代价格昂贵的氰化试剂,将大大降低生产成本,更具实用价值。现有的用丙酮氰醇作为氰源通过卤代烷的亲核取代反应制备氰化物的方法较少,已有的报道中用到的催化剂为不常见的有机强碱四甲基胍或者怕水、易燃的氢化锂等。
技术实现要素:
本发明是要解决现有的用卤代烷制备腈的方法时使用剧毒的氰化钠、氰化钾催化剂或原子经济性差、价格昂贵的三甲基硅氰作氰源以及反应时间较长,产率较低,反应条件严格等问题。提供一种利用卤代烷与丙酮氰醇的亲核取代反应制备腈的新方法。
本发明利用丙酮氰醇与卤代烷的亲核取代反应制备腈的方法,具体步骤如下:
将丙酮氰醇溶解在由非质子性高沸点偶极溶剂与非质子性低沸点溶剂组成的混合溶剂中,加入催化剂氢氧化锂,25-50℃搅拌一小时后加入卤代烷,tlc监控原料消失后,加水洗涤,乙酸乙酯萃取,乙酸乙酯层再分别用水和饱和食盐水洗涤,用无水na2so4干燥后过滤浓缩得到腈。
进一步的所述氰化试剂为丙酮氰醇。
进一步的所述丙酮氰醇与卤代烷的摩尔比为1.1-1.5:1。
进一步的所述催化剂为单水合氢氧化锂,单水合氢氧化锂与卤代烷的摩尔比为1.1-1.5:1。
进一步的所述卤代烷为伯卤代烷及仲卤代烷。
进一步的所述卤代烷为氯代烷、溴代烷及碘代烷,其中卤代烷可以是但不局限于下列化合物:氯化苄、氯代正丁烷、氯代仲丁烷、1,4-二氯丁烷、1-氯辛烷、3-氯丙酸乙酯、1-氯-2-苯乙烷、3-氯丙腈、1,2-二氯乙烷、氯代十二烷;溴代正丁烷、溴代仲丁烷、1,4-二溴丁烷、1-溴-3-苯基丙烷、3-溴丙腈、溴化苄、3-溴-丙酸甲酯、1-溴乙基苯、4-溴丁酸甲酯、溴代正辛烷、溴代十八烷、二苯溴甲烷、2-溴戊烷、7-溴庚酸乙酯、1,2-二溴乙烷;碘代正丁烷、碘代正辛烷、碘代十四烷。
进一步的所述反应温度为25-50℃,优选为50℃。
进一步的所述反应溶剂为非质子性高沸点偶极溶剂与非质子性低沸点溶剂组成的混合溶剂,其中非质子性高沸点偶极溶剂是1,3-二甲基咪唑啉酮、n-甲基吡咯烷酮、六甲基磷酰三胺;低沸点溶剂为二氯甲烷、三氯甲烷、丙酮、乙腈、四氢呋喃、乙醚。
进一步的所述混合溶剂的比例为非质子性高沸点偶极溶剂与非质子性低沸点溶剂的体积比为1:2-1:7,优选为1:3。
本发明的反应原理为:丙酮氰醇在单水合氢氧化锂催化下,可以与卤代烷发生亲核取代反应制备腈。
本发明的有益效果:
本发明使用丙酮氰醇作为氰源,替代了剧毒品氰化钠、氰化钾;替代了价格昂贵的三甲基氰硅烷等氰化试剂。
本发明的反应条件温和,反应时间短,反应收率达到95%以上。
本发明使用价格低廉的单水合氢氧化锂做催化剂,工艺简单,生产成本较低。
附图说明
图1为实施例一中苯乙腈的核磁共振氢谱;
图2为实施例一中苯乙腈的核磁共振碳谱;
图3为实施例一中苯乙腈的红外光谱。
图4为实施例十中丁二腈的核磁共振氢谱;
图5为实施例十中丁二腈的核磁共振碳谱;
图6为实施例十中丁二腈的红外光谱。
具体实施方式
本发明技术方案不局限于以下所列举具体实施方式,还包括各具体实施方式间的任意组合。
具体实施方式一:本实施方式利用丙酮氰醇与卤代烷反应制备腈的方法,具体步骤如下:
将丙酮氰醇溶解在由非质子性高沸点偶极溶剂与非质子性低沸点溶剂组成的混合溶剂中,加入催化剂氢氧化锂,25-50℃搅拌一小时后加入卤代烷,tlc监控原料消失后,加水洗涤,乙酸乙酯萃取,乙酸乙酯层再分别用水和饱和食盐水洗涤,用无水na2so4干燥后过滤浓缩得到腈。
具体实施方式二:本实施方式与具体实施方式一不同的是:反应溶剂为1,3-二甲基咪唑啉酮与四氢呋喃组成的混合溶剂。其它与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一不同的是:反应溶剂为1,3-二甲基咪唑啉酮与二氯甲烷组成的混合溶剂。其它与具体实施方式一相同。
具体实施方式四:本实施方式与具体实施方式一不同的是:反应溶剂为n-甲基吡咯烷酮与丙酮组成的混合溶剂:其它与具体实施方式一相同。
具体实施方式五:本实施方式与具体实施方式一不同的是:1,3-二甲基咪唑啉酮与四氢呋喃组成的混合溶剂的体积比为1:2。其它与具体实施方式一相同。
具体实施方式六:本实施方式与具体实施方式一不同的是:1,3-二甲基咪唑啉酮与四氢呋喃组成的混合溶剂的体积比为1:5。其它与具体实施方式一相同。
具体实施方式七:本实施方式与具体实施方式一不同的是:1,3-二甲基咪唑啉酮与四氢呋喃组成的混合溶剂的体积比为1:7。其它与具体实施方式一相同。
具体实施方式八:本实施方式与具体实施方式一不同的是:催化剂单水合氢氧化锂与卤代烷的摩尔比为1.3:1。其它与具体实施方式一相同。
具体实施方式九:本实施方式与具体实施方式一不同的是:催化剂单水合氢氧化锂与卤代烷的摩尔比为1.5:1。其它与具体实施方式一相同。
具体实施方式十:本实施方式与具体实施方式一不同的是:丙酮氰醇与卤代烷的摩尔比为1.2:1。其它与具体实施方式一相同。
具体实施方式十一:本实施方式与具体实施方式一不同的是:丙酮氰醇与卤代烷的摩尔比为1.5:1。其它与具体实施方式一相同。
具体实施方式十二:本实施方式与具体实施方式一不同的是:反应温度为50℃。其它与具体实施方式一相同。
具体实施方式十三:本实施方式与具体实施方式一至十二之一不同的是:卤代烷为氯化苄、氯代正丁烷、氯代仲丁烷、1,4-二氯丁烷、1-氯辛烷、3-氯丙酸乙酯、1-氯-2-苯乙烷、3-氯丙腈、1,2-二氯乙烷、氯代十二烷;溴代正丁烷、溴代仲丁烷、1,4-二溴丁烷、1-溴-3-苯基丙烷、3-溴丙腈、溴化苄、3-溴-丙酸甲酯、1-溴乙基苯、4-溴丁酸甲酯、溴代正辛烷、溴代十八烷、二苯溴甲烷、2-溴戊烷、7-溴庚酸乙酯、1,2-二溴乙烷;碘代正丁烷、碘代正辛烷、碘代十四烷。其它与具体实施方式一至十二之一相同。
下面对本发明的实施例做详细说明,以下实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方案和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1:
用丙酮氰醇与卤代烷反应制备腈的方法,其特征在于该方法具体步骤如下:
将1.5mol丙酮氰醇溶解在1,3-二甲基咪唑啉酮与四氢呋喃组成的混合溶剂中,(体积比为1:3),加入1.5mol催化剂单水合氢氧化锂,50℃搅拌一小时后加入1mol溴化苄,tlc监控原料消失后,加水洗涤后,乙酸乙酯萃取,乙酸乙酯层再分别用水和饱和食盐水洗涤,用无水na2so4干燥后过滤浓缩得到苯乙腈产品。反应时间2.5h,收率97%。
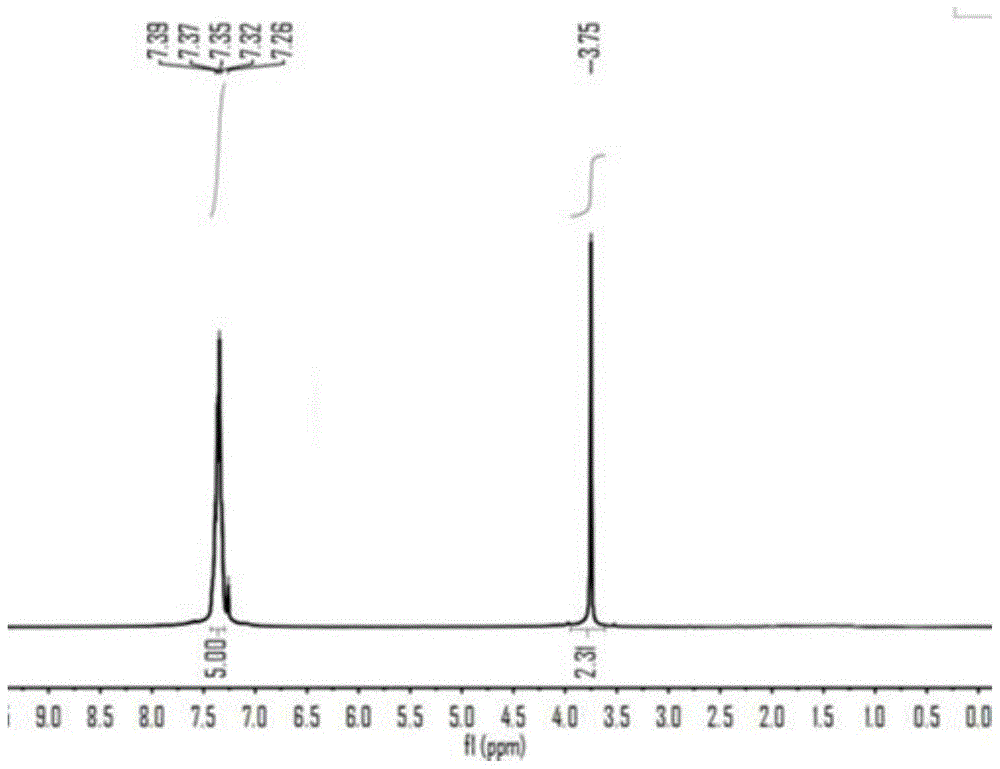
苯乙腈的核磁共振氢谱(300mhz,cdcl3,单位ppm)如图1所示:7.39-7.32(m,5h),3.75(s,2h)。
苯乙腈的核磁共振碳谱(75mhz,cdcl3,单位ppm)如图2所示:129.9,128.9,127.8,127.7,117.8,23.3
苯乙腈的红外光谱(kbr涂膜法,单位:cm-1)如图3所示:3068,3034,2251,1603,1497,1454,1417,1078,1030,740
结合化合物的氢谱、碳谱和红外光谱可以看出,所合成的化合物结构是正确的。
实施例2:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为氯化苄,反应时间4.5h,产率为95.6%。
实施例3:本实施例所有实验条件和处理方法与实施例1相同,只是将由1,3-二甲基咪唑啉酮与四氢呋喃组成的混合溶剂改为1,3-二甲基咪唑啉酮与二氯甲烷组成的混合溶剂,反应时间5.5h,产率为95.7%。
实施例4:本实施例所有实验条件和处理方法与实施例1相同,只是将1,3-二甲基咪唑啉酮与四氢呋喃组成的混合溶剂改为n-甲基吡咯烷酮与丙酮组成的混合溶剂,反应时间为3.5h,产率为96.3%。
实施例5:本实施例所有实验条件和处理方法与实施例1相同,只是将1,3-二甲基咪唑啉酮与四氢呋喃组成的混合溶剂改为六甲基磷酰三胺与乙醚组成的混合溶剂,反应时间为5h,产率为95.2%。
实施例6:本实施例所有实验条件和处理方法与实施例1相同,只是将1,3-二甲基咪唑啉酮与四氢呋喃组成的混合溶剂的体积比为1:3改为1:5,反应时间为3.5h,产率为96.7%。
实施例7:本实施例所有实验条件和处理方法与实施例1相同,只是将催化剂单水合氢氧化锂与溴化苄的摩尔比1.5:1改为1.3:1,反应时间为4.5h,产率为96.2%。
实施例8:本实施例所有实验条件和处理方法与实施例1相同,只是将丙酮氰醇与溴化苄的摩尔比为1.5:1改为1.2:1,反应时间为4h,产率为95.9%。
实施例9:本实施例所有实验条件和处理方法与实施例1相同,只是将温度由50℃改为25℃,反应时间为5h,产率为95.3%。
实施例10:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为3-氯丙腈,反应时间为3.5h,产率为98%。产品丁二腈的核磁共振氢谱(300mhz,cdcl3,单位ppm)如图4所示:2.76(s,4h);丁二腈的核磁共振碳谱(75mhz,cdcl3,单位ppm)如图5所示:116.2,14.7;丁二腈的红外光谱(kbr涂膜法,单位:cm-1)如图6所示:3465,2989,2955,2254,1427,1003,964,822,762,605。
实施例11:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为1-氯-2-苯乙烷,反应时间为2.5h,产率为97.9%。产品苯丙腈的核磁共振氢谱数据(300mhz,cdcl3,单位ppm):7.36-7.24(m,5h),2.97(t,j=7.36hz,2h),2.63(t,j=7.40hz,2h);苯丙腈的核磁共振碳谱数据(75mhz,cdcl3,单位ppm):138.1,128.9,128.2,127.2,119.1,31.5,19.3;苯丙腈的红外光谱数据(kbr涂膜法,单位:cm-1):3087,3069,3030,2868,2246,1604,1496,1454,1425,1079,1340,749。
实施例12:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为3-氯丙酸乙酯,反应时间为3.5h,产率为95.9%。产品3-氰基丙酸乙酯的核磁共振氢谱数据(300mhz,cdcl3,单位ppm):4.19(q,j=7.09hz,2h),2.65(s,4h),1.27(t,j=7.13hz,3h);3-氰基丙酸乙酯的核磁共振碳谱数据(75mhz,cdcl3,单位ppm):170.0,118.5,61.5,30.0,14.1,12.6;3-氰基丙酸乙酯的红外光谱数据(kbr涂膜法,单位:cm-1):2927,2854,2251,1736,1691,1422,1377,1199,1114,1018,854,617。
实施例13:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为氯代十八烷,反应时间为4.5h,产率为95.1%。产品n-十九烷基腈的核磁共振氢谱数据(300mhz,cdcl3,单位ppm):2.33(t,j=7.03,2h),1.68-1.63(m2h),1.49-1.44(m,2h),1.26(s,28h),0.88(t,j=5.54hz,3h);n-十九烷基腈的核磁共振碳谱数据(75mhz,cdcl3,单位ppm):119.9,32.0,29.7,29.6,29.4,28.8,28.7,25.4,22.7,17.2,14.2;n-十九烷基腈的红外光谱数据(kbr涂膜法,单位:cm-1):3064,3032,2987,2938,2877,2242,1958,1896,1669,1385,752,570。
实施例14:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为二苯溴甲烷,反应时间4.5h,产率为95.2%。产品二苯乙腈的核磁共振氢谱数据(300mhz,cdcl3,单位ppm):7.35(m,10h),5.14(s,1h);二苯乙腈的核磁共振碳谱数据(75mhz,cdcl3,单位ppm):135.9,129.2,128.3,127.8,42.8;二苯乙腈的红外光谱数据(kbr压片法,单位:cm-1)3027,2933,2852,2243,1658,1597,1492,1118,1079,744,697,540。
实施例15:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为1-溴-3-苯基丙烷,反应时间为3h,产率为96%。产品4-苯基丁腈的核磁共振氢谱数据(300mhz,cdcl3,单位ppm):7.36-7.17(m,5h),2.80-2.75(t,j=7.40hz,2h),2.34-2.29(t,j=7.09hz,2h),2.00-1.95(m,2h),;4-苯基丁腈核磁共振碳谱数据(75mhz,cdcl3,单位ppm):139.7,128.6,128.4,126.5,119.5,34.3,26.9,16.3;4-苯基丁腈红外光谱数据(kbr涂膜法,单位:cm-1):3085,3069,3029,2928,2867,2246,1603,1497,1455,1425,1082,1030,748,701。
实施例16:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为7-溴庚酸乙酯,反应时间为4h,产率为96.8%。产品7-氰基庚酸乙酯的:核磁共振氢谱数据(300mhz,cdcl3,单位ppm):4.15-4.11(q,j=7.02hz,2h),2.34-2.27(t,j=11.72hz,4h),1.66-1.61(m,4h),1.47-1.40(t,j=5.39hz2h),1.38-1.35(m,2h),1.27-1.22(t,j=7.04hz,3h);7-氰基庚酸乙酯的核磁共振碳谱数据(75mhz,cdcl3,单位ppm):173.4,119.6,132.4,60.1,34.0,28.2,28.1,25.0,24.4,16.9,14.1;7-氰基庚酸乙酯的红外光谱数据(kbr涂膜法,单位:cm-1):2936,2863,2245,1732,1464,1373,1252,1187,1096,1033。
实施例17:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为1,4-二溴丁烷,反应时间为3h,产率为97.9%。产品己二腈的核磁共振氢谱(300mhz,cdcl3,单位ppm):2.44-2.41(m,4h);1.83-1.81(m,4h);己二腈的核磁共振碳谱(75mhz,cdcl3,单位ppm):118.72,24.21,16.59;己二腈的红外光谱(kbr涂膜法,单位:cm-1):2949,2881,2249,1697,1462,1427,1335,898,766。
实施例18:本实施例所有实验条件和处理方法与实施例13相同,只是将1,4-二溴丁烷改为1,4-二氯丁烷,反应时间为4.5h,产率为95.3%。
实施例19:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为3-溴丙酸甲酯,反应时间为3.5h,产率为98.2%。产品3-氰基丙酸甲酯的核磁共振氢谱(300mhz,cdcl3,单位ppm):3.73(s,3h),2.70-2.61(m,4h);3-氰基丙酸甲酯的核磁共振碳谱(75mhz,cdcl3,单位ppm):170.4,118.4,52.3,29.8,13.0;3-氰基丙酸甲酯的红外光谱(kbr涂膜法,单位:cm-1):3328,2959,2251,1667,1576,1506,1387,1279,1181,950,883,682。
实施例20:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为了碘代正丁烷,反应时间3.5h,产率为95.5%。产品戊腈的核磁共振氢谱数据(300mhz,cdcl3,单位ppm):2.34(t,j=7.02hz,2h),1.67-1.59(m,2h),1.52-1.44(m,2h),0.92(t,j=7.20hz,3h);戊腈的核磁共振碳谱数据(75mhz,cdcl3,单位ppm):119.8,27.4,21.8,16.8,13.2;戊腈的红外光谱数据(kbr涂膜法,单位:cm-1):2992,2941,2243,1460,1382,1190,1141,976,876,696,596,475。
实施例21:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为了碘代正辛烷,反应时间3.5h,产率为97.2%。产品壬腈的核磁共振氢谱数据(300mhz,cdcl3,单位ppm):2.35-2.30(t,j=7.06hz,2h),1.69-1.60(m,2h),1.43-1.41(m,2h),1.30-1.27(m,8h),0.87-0.85(t,j=6.62hz,3h);产品壬腈的核磁共振碳谱数据(75mhz,cdcl3,单位ppm):119.9,31.7,29.0,28.7,22.6,17.1,14.1;产品壬腈的红外光谱数据(kbr涂膜法,单位:cm-1):2927,2856,2246,1466,1427,1377,723。
实施例22:本实施例所有实验条件和处理方法与实施例1相同,只是将溴化苄改为了碘代十四烷,反应时间3h,产率为96.6%。产品十五烷腈的核磁共振氢谱数据(300mhz,cdcl3,单位ppm)::2.33(t,j=7.09hz,2h),1.68-1.63(m,2h),1.44-1.41(m,2h),1.25(s,20h),0.88(t,j=6.17hz,3h);十五烷腈的核磁共振碳谱数据(75mhz,cdcl3,单位ppm):119.8,31.9,29.7,29.6,29.5,29.4,29.3,28.7,25.4,22.7,17.1,14.1;十五烷腈的红外光谱数据(kbr涂膜法,单位:cm-1):2926,2854,2247,1686,1466,1427,1378,1297,722。
由实施例10-22的产物结构数据表明,所合成的化合物结构是正确的。
- 还没有人留言评论。精彩留言会获得点赞!