一种新型血管紧张素转化酶抑制剂筛选模型的构建和应用的制作方法
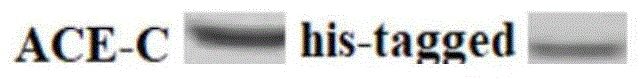
本发明属于生物技术与食品开发技术领域,具体涉及一种新型血管紧张素转化酶抑制剂筛选模型的构建和应用。
背景技术:
高血压是导致心脑血管疾病的重要原因之一,而血管紧张素转化酶(angiotensini-convertingenzyme,ace)在人体血压调节过程中发挥着非常关键的作用,抑制ace的活性已成为治疗高血压的重要手段。
目前在研究食源性ace抑制肽与ace的构效关系的过程中,已经构建了多种构效关系模型,主要包括ace的c结构域模型、ace的n结构域模型等,但此类模型筛选得到的ace抑制肽大多存在较大的体内和体外活性差异。究其原因,可能是这些模型都是基于体外游离状态的ace反应体系,忽略了ace作为膜蛋白的特殊性。实际上,在人体血压调节过程中真正起着关键作用的是存在于细胞膜上的组织ace,细胞膜环境对ace活性有着极大的影响。研究表明,组织ace与细胞膜表面更接近的c结构域是ace调控血压和心血管功能的主导性位点。如果通过表达c结构域及疏水跨膜区蛋白与脂质体重构得到膜结合ace抑制剂筛选模型,用以探究食源性ace抑制肽的膜亲和力与膜结合ace抑制活力之间具有相关性,这将对提高食源性ace抑制肽的体外筛选效率,减小体内外活性差异具有重要意义。
技术实现要素:
本发明的目的在于提供一种可以模拟膜结合ace的新型血管紧张素转化酶抑制剂筛选模型的构建和应用。
本发明提供的ace抑制剂筛选模型的构建包括以下步骤:
1、ace的c结构域目的片段的获取
利用ncbi人源ace全基因信息中与c结构域有关的2500bp的序列作为ace的c结构域序列。通过primerpremier5.0引物设计软件进行引物设计,以人源ace全基因组为模板进行pcr,得到全长为2135bp的目的片段。
2、ace的c结构域重组质粒的构建
将扩增得到的目的基因片段与pcdna3.1(+)载体同时双酶切后进行连接,转化到大肠杆菌感受态中进行质粒提取,对得到的重组质粒进行酶切及测序鉴定。
3、ace的c结构域蛋白的表达纯化
将构建得到的重组质粒转染到中国仓鼠卵巢细胞cho-k1中,对诱导表达后的细胞进行目的蛋白的提取并用westernblotting对蛋白表达的正确性进行验证,验证成功后利用蛋白纯化系统对提取得到的目的蛋白进行纯化。
4、新型血管紧张素转化酶抑制剂筛选模型的构建
利用脂质制备脂质体模拟膜结构,将得到的模拟膜与纯化后的ace的c结构域蛋白进行重构反应。通过fitc对ace的c结构域蛋白进行荧光标记,在荧光显微镜下可以检测到新型血管紧张素转化酶抑制剂筛选模型的建立,并命名为膜结合血管紧张素转化酶抑制剂筛选模型。
5、新型血管紧张素转化酶抑制剂筛选模型的应用
运用膜结合血管紧张素转化酶抑制剂筛选模型与ace的c结构域蛋白两种体系对食源性血管紧张素转化酶抑制剂进行筛选,利用高效液相色谱法对筛选体系进行活力测定,验证膜结合血管紧张素转化酶抑制剂筛选模型筛选结果是否有区别于普通ace的c结构域蛋白。
发明效果:
1、本发明是一种模拟膜结合血管紧张素转化酶抑制剂筛选的模型。较目前常用的ace更为贴近血管紧张素转化酶抑制剂在人体内的作用机制。所以,通过此类模型筛选的血管紧张素转化酶抑制剂更具有实用性。
2、本发明选择的表达细胞株系为中国仓鼠卵巢细胞cho-k1,因其属于成纤维细胞,自身分泌蛋白较少,利于外源基目的稳定整合,易于大规模培养,是用于真核生物基因表达较为成功的宿主细胞。
3、本发明通过akta纯化系统对目的蛋白进行两次纯化,提高了目的蛋白的纯度,并结合对模拟膜的制备条件优化,使得到的新型血管紧张素转化酶抑制剂筛选模型的筛选准确性更高。
4、本发明可应用于多种的食源性血管紧张素转化酶抑制剂的筛选,其应用范围广,筛选效率高。
附图说明
图1为本发明所述ace的c结构域蛋白表达的westernblotting分析。
图2为本发明所述ace的c结构域蛋白纯化优化结果的westernblotting分析。
图3为本发明所述新型血管紧张素转化酶抑制剂筛选模型构建的验证结果。
图4为本发明所述新型血管紧张素转化酶抑制剂筛选模型的应用情况示意图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步说明。
实施例一:ace的c结构域重组质粒的构建
步骤一、根据ncbi数据库中ace全基因信息(序列号:1636)以含有完整人源aceorf的hg11598-nh质粒为模板,利用primerpremier5.0进行引物设计,得到上游引物为:5’aagcttatgccgttgcctgacaactaccc3’(含hindⅲ酶切位点),下游引物为5’gaattctcacaccatcaccatcaccatggagtgtctcagctccacctc3’(含ecori酶切位点以及组氨酸标签序列)。用taqdna聚合酶通过pcr扩增仪进行扩增,待反应结束后,利用琼脂糖凝胶电泳对pcr所得产物进行检验,将检测结果正确的产物进行回收,回收得到的即为目的基因即人源血管紧张素转化酶c结构域蛋白cdna。
步骤二、将人源ace的c结构域蛋白的基因片段与真核表达载体pcdna3.1(+)载体均由ecori和hindⅲ进行双酶切,随后用t4dna连接酶将二者连接。将连接后的产物转化到dh5α感受态细菌中,涂板过夜培养后,挑取单菌落,于摇床中培养后提取质粒,进行琼脂糖凝胶电泳及酶切等技术初步鉴定。对初步鉴定结果正确的连接产物进行测序;最终将序列鉴定正确的质粒进行扩增培养,得到含有目的基因的pcdna3.1(+)真核表达载体,命名为pcdna3.1(+)-acec。
步骤三、重组质粒dna经ecori和hindⅲ双酶切后,出现了5.4kb和2.1kb的两条特异性条带,与预想结果一致。测序结果显示,该序列正确率为100%。
实施例二:ace的c结构域蛋白的表达纯化
步骤一、在含有10%胎牛血清的f12-k(gibco)培养基,37℃,5%co2条件下培养cho-k1细胞。在6孔板中以每孔2×105个细胞进行铺板,过夜培养后,用转染试剂turbofect转染1~5h;其中质粒pcdna3.1(+)-acec的转染量为每孔500~900ng,转染试剂turbofect的量为1~5μl。
步骤二、对转染后的细胞进行培养,分别回收培养48h,72h,96h的细胞,利用细胞膜蛋白与细胞浆蛋白提取试剂盒将ace的c结构域蛋白从细胞膜上分离出来,得到的粗品膜蛋白浓度为23μg/μl,对分离得到的膜蛋白利用westernblot鉴定其蛋白结构是否正确以及his-tag标签的表达情况,结果证实了ace-c结构域蛋白以及his-tag标签均正确表达(图1-2)。
步骤三、对验证后的蛋白进行纯化,首先在aktaprimeplus蛋白纯化系统中接入histraptmhp纯化柱,经过两次结合缓冲液与一次洗脱缓冲液分离后回收得到含有大量盐离子但仅含目的蛋白的溶液;再将hiprep16/60sephacryls-200hr蛋白纯化柱接入aktaprimeplus蛋白纯化系统,去除目的蛋白溶液中的盐离子,最终得到分子量为77.7kda、浓度为3.75μg/μl的ace的c结构域蛋白。
实施例三:新型血管紧张素转化酶抑制剂筛选模型的构建
步骤一、将磷脂/胆固醇按照6:1~9:1的配比溶解在混合比为1:1~4:1的氯仿与甲醇混合溶液中,50~70℃的条件下旋转蒸发去除氯仿和甲醇,加入重构缓冲液(10~40mmhepes,100~150mmnacl,2~6%w/w甘油,ph7.5)溶解脂质体,液氮反复冻融后,利用lf-1脂质体挤出器挤出,最终得到在室温环境下可稳定4h的模拟膜。
步骤二、在此基础上,将提纯得到的ace的c结构域蛋白与步骤一制备得到的模拟膜按照1:10~1:30的比例进行重构,控制反应温度为20~37℃,反应时间为10~40min,在此过程中轻微震荡混合体系,带反应结束后得到新型血管紧张素转化酶抑制剂筛选模型即膜结合血管紧张素转化酶抑制剂筛选模型。
步骤三、利用fitc对ace的c结构域蛋白进行标记。配置2mg/ml的蛋白质溶液与1mg/mlfitc溶液,将二者按照200:1的体积比进行混合后,4℃避光孵育8h;随后加入nh4cl,使nh4cl终浓度为50mm,在4℃孵育2h;以0.01mol/lph7.2pbs作为洗脱液,结合凝胶柱-葡聚糖sephadexg-25柱纯化出去多余的fitc;在荧光显微镜下检测(图3)。
实施例四:新型血管紧张素转化酶抑制剂筛选模型活力的测定
步骤一、将20~40μl马尿酸-组氨酸-亮氨酸(hhl)与50~70μlace的c结构域蛋白溶液混匀,37℃反应1h,加入60~80μl1m的盐酸溶液终止反应。将终溶液过0.22μm滤膜后置于高效液相色谱仪中测定其中马尿酸(ha)的含量。具体液相条件如下:柱温为25℃,流速为0.5ml/min,进样量20μl,流动相a为纯乙腈,流动相b为含0.5%三氟乙酸的去离子水,二者比例为25:75,检测波长为228nm。最终的得到血管紧张素转化酶c结构域蛋白的酶活为0.53u/μg,其中血管紧张素转化酶一个单位(u)活性被定义为在37℃下,每分钟hhl被分解成ha所需的酶量。
步骤二、将20~40μlhhl与50~70μl与步骤一中具有相同蛋白含量的膜结合血管紧张素转化酶抑制剂筛选模型溶液混匀,37℃反应1h,加入60~80μl1m的盐酸溶液终止反应。将终溶液过0.22μm滤膜后置于高效液相色谱仪中测定其中ha的含量。具体液相条件如下:柱温为25℃,流速为0.5ml/min,进样量20μl,流动相a为纯乙腈,流动相b为含0.5%三氟乙酸的去离子水,二者比例为25:75,检测波长为228nm。最终的得到膜结合血管紧张素转化酶抑制剂筛选模型的酶活为0.85u/μg。
实施例五:新型血管紧张素转化酶抑制剂筛选模型的应用
步骤一、在获得膜结合血管紧张素转化酶抑制剂筛选模型后,即可用于有食源性生物活性肽的筛选。我们利用该模型,筛选了以食源性生物活性肽rvpsl为模板进行改造的15条疏水肽,筛选流程如下:将20~40μlhhl与50~70μl不同体系且酶活相同的酶溶液混匀,37℃预热5min,加入10μl食源性血管紧张素转化酶抑制剂于37℃反应1h,加入60~80μl1m的盐酸溶液终止反应。将终溶液过0.22μm滤膜后置于高效液相色谱仪中测定其中ha的含量。具体液相条件如下:柱温为25℃,流速为0.5ml/min,进样量20μl,流动相a为纯乙腈,流动相b为含0.5%三氟乙酸的去离子水,二者比例为25:75,检测波长为228nm。
步骤二、在筛选的15条疏水肽中可以看出不同肽在两种体系中的抑制活力是存在区别的(图4),这些筛选结果表明,游离体系中筛选得到的活性较高的血管紧张素转化酶抑制剂在膜结合血管紧张素转化酶体系中的活性可能并不理想,因此该模型可以方便快捷地对血管紧张素转化酶抑制剂的非游离体系的抑制活性进行初筛。
- 还没有人留言评论。精彩留言会获得点赞!