一株具有良好定殖能力的硒氧化型根瘤菌T3F4及其应用的制作方法
本发明属于农业微生物技术领域,涉及一株具有良好定殖能力的硒氧化型根瘤菌t3f4及其应用,所述的根瘤菌分类为rhizobiumsp.,该菌株在土壤和植物体内具备优秀定殖能力、增加土壤有效硒含量,并促进植物富硒。
背景技术:
硒(se)位于元素周期表第ⅵ主族,硒在自然界中以se(-ⅱ)、se(0)、se(iv)及se(vi)四种价态的形式存在。se(-ⅱ)主要是有机硒,常见于生物体内,如生物体内重要的硒代半胱氨酸(secys)、硒代蛋氨酸(semet)、一甲基硒(ch3-se)、二甲基硒(ch3-se-ch3)和甲基硒代半胱氨酸(semecys)等。se(iv)及se(vi)主要是无机硒,多存在于非生物体,通常以含氧阴离子存在,如亚硒酸盐(seo32-)和硒酸盐(seo42-),是植物吸收利用硒的主要来源。化学单质硒se(0)在自然界中较少见,多数存在于富硒矿中。其中亚硒酸盐在这四种价态的化合物中毒性最强,而单质硒基本无毒。
硒是人体所必需的微量元素,对人体健康至关重要。人体有25种硒蛋白,硒是其活性中心,在机体能量代谢和基因表达中起重要作用,如抗氧化、免疫调节和拮抗作用。硒在人体内的安全阈值很窄,每天硒摄取量低于40μg就会缺硒;大于400μg就可能出现中毒。缺硒会导致心肌病、免疫力下降、认知能力下降和大骨节病等40多种疾病;但硒摄入过量也会导致脱发、指甲脱落、增加糖尿病风险等。
中国土壤缺硒(低于0.6mg/kg)面积达到72%,从而造成2/3的人口硒摄入不足。人体硒营养主要来源于食用植物,通过日常饮食提升硒摄入水平被认为是目前最安全的补硒方式,因而提高作物硒含量的研究备受关注。
目前强化植物富硒的方法有多种,应用最为广泛的是通过土壤施硒、叶面喷硒及拌种等方式。土壤中含有单质硒、亚硒酸盐、硒酸盐和有机硒等,植物主要吸收亚硒酸盐和硒酸盐,但亚硒酸盐容易被土壤吸附截留,从而难以被植物吸收利用。因此,在土壤中添加微生物,使其溶解硒或氧化硒,进而增加植物对硒的吸收,是一种安全可靠、成本低廉的方式。
技术实现要素:
本发明的目的在于提供一株具有良好定殖能力的硒氧化型根瘤菌t3f4,该菌株由申请人从湖北恩施富硒土壤中分离而来,所述菌株命名为rhizobiunsp.t3f4,保藏编号为cctccno:m2019057。
本发明的另一个目的在于提供了根瘤菌t3f4在硒氧化中的应用。
本发明的最后一个目的在于提供了根瘤菌t3f4在制备植物富硒剂中的应用,土壤中添加菌剂t3f4可以促进小白菜吸收硒,成熟时小白菜中的硒含量显著上升,其中叶片中硒含量上升达43.1%,根部硒含量上升达60.2%。此外,根瘤菌t3f4还可以促进土壤硒形态的转化,小白菜成熟时盆栽土壤有效硒含量上升达9.9%。
为了达到上述目的,本发明采取以下技术措施:
申请人从中国湖北省恩施州富硒土壤中分离、筛选到一株具有氧化单质硒能力和在土壤中促进小白菜富硒的根瘤菌t3f4,申请人将该菌命名为根瘤菌(rhizobiumsp.)t3f4,该菌株已于2019年1月18日送至中国典型培养物保藏中心(cctcc)保藏,其保藏编号为cctccno:m2019057,分类命名:rhizobiumsp.t3f4。
该菌株的具体特征如下:
a.形态学特征
根瘤菌t3f4的细胞形态为杆状,长1-1.25μm,宽0.2-0.25μm。
b.培养特征
根瘤菌t3f4在1/5lb琼脂平板培养基上28℃培养48h,形成圆状的淡黄色小菌落,边缘光滑,隆起。
根瘤菌t3f4在硒氧化中的应用,包括利用该菌株将难利用态的单质硒氧化成水溶态的亚硒酸盐。
根瘤菌t3f4在制备植物富硒剂中的应用,将该富硒剂撒入土壤中,不但可以促进植物富硒,将不溶态的单质硒氧化成植物可吸收利用的亚硒酸盐,还可以转化土壤中的硒形态,让植物更有效地利用硒元素。
与现有技术相比,本发明具有以下优点:
(1)本发明获得的一株根瘤菌t3f4,具有将不溶态的单质硒氧化成植物可吸收利用的亚硒酸盐的能力,从而促进植物富硒;是对极其有限的硒氧化菌株资源的补充。
(2)本发明的根瘤菌t3f4可在土壤中稳定定殖,具有解硒的能力,将难溶态的硒转化为可利用态的硒,促进植物吸收硒。
(3)本发明的根瘤菌t3f4是一种植物内生菌,可以在植物根内、叶片中长期定殖,可持续性强,长期发挥氧化硒和解硒的作用。
(4)本发明提供了一种利用有益微生物促进植物富硒的新方式,安全、环保。
附图说明
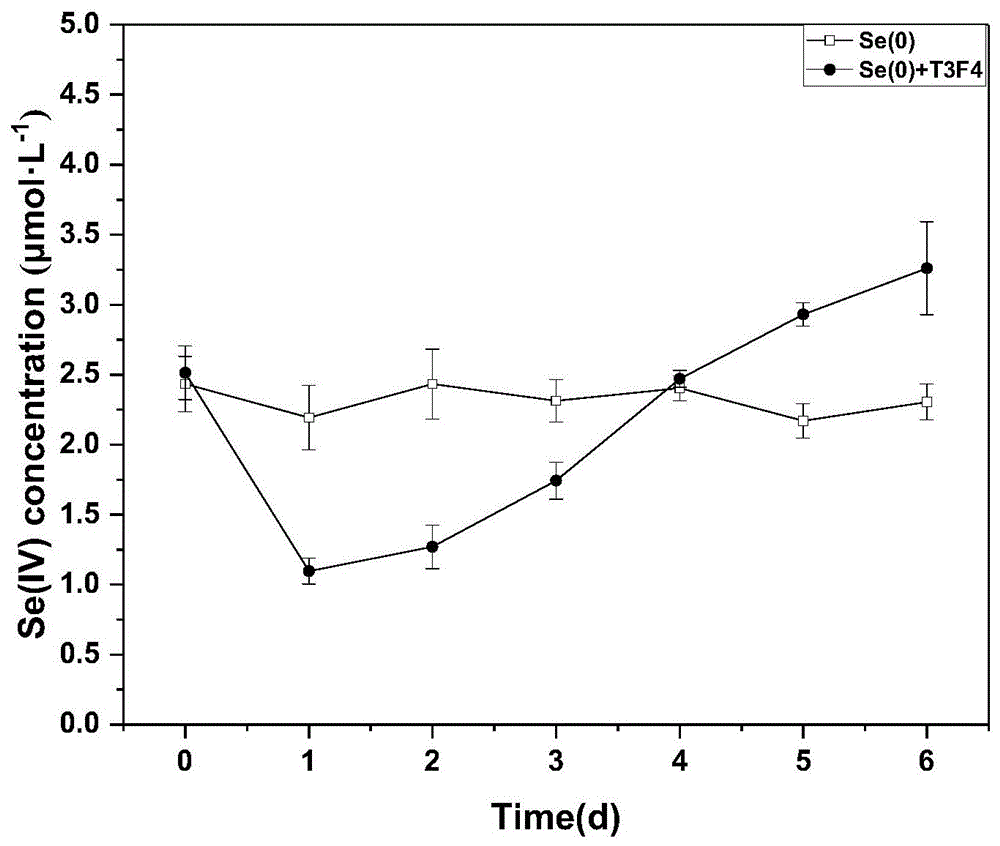
图1为根瘤菌t3f4将单质硒氧化成亚硒酸盐的示意图;
图1中se(0)表示只加单质硒不加根瘤菌t3f4的处理对照,se(0)+t3f4表示既加根瘤菌t3f4又加单质硒的实验处理。
图2为加根瘤菌t3f4处理后小白菜吸收硒的效果图;
图2中上图是盆栽小白菜根部硒含量,图2下图是盆栽小白菜叶片硒含量;control表示不加硒处理;+t3f4表示加根瘤菌t3f4处理;-t3f4表示不加菌的空白对照;se(0)表示加单质硒处理;se(iv)表示加亚硒酸钠处理。
图3为根瘤菌t3f4对小白菜盆栽土壤硒形态的影响;
control表示不加硒处理;+t3f4表示加根瘤菌t3f4处理;-t3f4表示不加菌的空白对照;se(0)表示加单质硒处理;se(iv)表示加亚硒酸钠处理;0d表示未种小白菜的原始土壤;21d表示种植小白菜21天后的土壤。
图4为根瘤菌t3f4在根际土壤、非根际土壤、植物叶片中的定殖数量;
图4中t3f4根际土表示加根瘤菌t3f4的根际土壤;t3f4+se(iv)根际土表示加根瘤菌t3f4加亚硒酸钠的根际土壤;t3f4+se(0)根际土表示加根瘤菌t3f4加单质硒的根际土壤;t3f4非根际土表示加根瘤菌t3f4的非根际土壤;t3f4+se(iv)非根际土表示加根瘤菌t3f4加亚硒酸钠的非根际土壤;t3f4+se(0)非根际土表示加根瘤菌t3f4加单质硒的非根际土壤;t3f4叶片表示加根瘤菌t3f4的小白菜叶片;t3f4+se(iv)叶片表示加根瘤菌t3f4加亚硒酸钠的小白菜叶片;t3f4+se(0)叶片表示加根瘤菌t3f4加单质硒的小白菜叶片。
具体实施方式
下面结合具体实施例对本发明做进一步详细说明。实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。下述实施例中所用方法如无特别说明均为常规方法。
实施例1:根瘤菌(rhizobiumsp.)t3f4的分离、鉴定
(1)样品采取:申请人于2012年7月从湖北省恩施土家族苗族自治州富硒地区表层土壤中采集到本发明所用的富硒土样。
(2)菌体分离纯化:称取土样10g于装有90ml无菌生理盐水的三角瓶中,置28℃摇床中振荡半小时,再依次取1ml加入到9ml无菌生理盐水中逐步稀释至10-2,10-3,10-4,10-5,分别取0.1ml涂布于1/5lb固体培养基中,每个梯度涂3个平板。置28℃恒温培养一周,挑取单菌落划线纯化。纯化后按50%甘油:菌液(体积比1:1)保存于螺口管中,-80℃保藏。
(3)硒氧化菌的筛选:称取0.1g单质硒粉(cp)于含有100ml1/5lb液体培养基的250ml的三角瓶中,115℃灭菌20min。冷却后,接入菌液150μl,28℃,160rpm摇床培养6d,中间定点取样(上清)。将所得上清液于8000rpm离心10min,使用原子荧光形态分析仪检测四价硒的含量。若四价硒含量明显增加,说明该菌对单质硒具有氧化性。
(4)硒氧化菌的分类鉴定:对获得的菌株进行16srrna基因测序并构建其系统进化树,结合其生理生化特征,申请人鉴定该菌属于根瘤菌属。该菌株已于2019年01月18日送往中国典型培养物保藏中心(cctcc)保藏,分类命名:rhizobiunsp.t3f4,保藏号为cctccno:m2019057,地址:中国武汉武汉大学。
该菌株的具体特征如下:
a.形态学特征
根瘤菌t3f4的细胞形态为杆状,长1-1.25μm,宽0.2-0.25μm。
b.培养特征
根瘤菌t3f4在1/5lb琼脂平板培养基上28℃培养48h,形成圆状的淡黄色小菌落,边缘光滑,隆起。
实施例2:根瘤菌t3f4氧化单质硒曲线
具体步骤如下所述:
(1)准备3瓶已灭菌的1/5lb液体培养基,每瓶100ml。取三瓶各加入0.5g/l已灭菌的单质硒。接种对数期(od600值约0.8)t3f4菌液,接种量1%。混匀后立刻取样2ml,该样作为首次取样,置于干净的离心管中。将各三角瓶置于28℃,160rpm恒温摇床中培养。取样时间分别为0d、1d、2d、4d、5d、6d,该实验设置三重复。取样结束后样品作以下处理。
(2)每次取的样品2ml,12000rpm离心10min,上清液过0.22μm的滤膜于-20℃冰箱保存。
(3)用北京吉天仪器有限公司原子荧光形态分析仪(型号sa-20)检测样品中se(iv)的含量。
(4)以测得se(iv)浓度(μmol/l)为纵坐标,时间为横坐标构建单质硒氧化曲线图(图1)。
(5)如图1所示,样品上清液中se(iv)含量呈先下降后不断增加的趋势。第0天到第1天,上清液中的se(iv)含量迅速下降,从2.5μmol/l下降到1.1μmol/l。从第1天到第6天,se(iv)含量不断增加,到第6天为止,上清中se(iv)含量为3.26μmol/l。
实施例3:
根瘤菌t3f4促进小白菜富硒及土壤硒形态转化
具体步骤如下所述:
表1实验分组
“+”表示添加,“-”表示不添加
小白菜:四季青小白菜,购自江西省丰城市航城种业有限公司
(1)土壤预处理:将风干土称重2kg/盆,然后施入亚硒酸钠或单质硒(5mg/kg,化合物浓度),拌匀,按15%含水率加入水,平衡3天;
(2)平衡完成后,把用生理盐水保存的根瘤菌t3f4母液用水稀释,均匀地将根瘤菌t3f4菌液喷洒在土表面,保证土壤中的菌含量>107cfu/g,土壤拌匀,每个处理12个重复;
(3)土壤拌匀后立即移栽长势一致的四季青小白菜(株高约6cm),每盆1株小白菜幼苗;
(4)移栽后按白菜生长需求保持充足的水分;
(5)移栽21天后小白菜成熟,取样(植物全株)及土壤;
(6)样品杀青按照常用的制茶工艺、烘干(至含水率5%以下)、粉碎后,按中华人民共和国国家标准gb500993-2017“食品中硒的测定的方法”消解植株样品;土壤硒形态的测定根据吴少尉等报道的“土壤硒形态提取方法”浸提土壤样品(吴少尉等,2004)。
(7)用北京吉天仪器有限公司生产的原子荧光形态分析仪(型号为hg-afs)测定植株和土壤中的硒。
(8)将所测试的结果数据用spssstatistics22.0统计软件处理,以植物或土壤单位重量的硒含量(mg/kg)为纵坐标,各个处理为横坐标,origin8软件做图,结果如图2所示。
(9)如图2所示,土壤添加单质硒或是亚硒酸钠都能显著提高小白菜各部位硒含量,添加t3f4的处理组和相应的对照组相比,小白菜各部位硒含量都有不同程度的上升。t3f4处理组和对照组(control)相比,根部硒含量上升37.3%,分别为0.75mg/kg和1.03mg/kg;叶片硒含量上升47.2%,分别为0.570mg/kg和0.839mg/kg。se(0)+t3f4处理组和se(0)对照组相比,根部硒含量上升了26.3%,分别达到3.38mg/kg和4.27mg/kg;叶片硒含量上升了31.1%,分别达到1.739mg/kg和2.279mg/kg。se(iv)+t3f4处理组和se(iv)对照组相比,根部硒含量上升60.2%,分别达到2.45mg/kg和3.92mg/kg;叶片硒含量上升43.1%,分别达到1.499mg/kg和2.145mg/kg。
(10)如图3所示,添加菌剂t3f4可以显著提高土壤中有效硒的占比,种植小白菜后的土壤和原始土壤相比有效硒(水溶态和可交换态)占比有不同程度的上升。小白菜成熟时,t3f4处理组与对照组相比,有效硒含量从36.3%上升到46.2%;t3f4+se(iv)处理组和se(iv)对照组相比,有效硒含量从29.0%上升到38.9%;t3f4+se(0)处理组和se(0)对照组相比,有效硒含量从15.7%上升到20.4%。
实施例4:
t3f4在根际土、非根际土及叶片中的定殖动态
(1)荧光标记根瘤菌t3f4:采用双亲本杂交方法将质粒phc60(含有gfp)转化到根瘤菌t3f4中,在荧光显微镜下验证绿色荧光的表达,成功转入gfp的根瘤菌t3f4命名为t3f4-gfp。
(2)土壤预处理:将风干土称重2kg/盆,然后施入亚硒酸钠或单质硒(5mg/kg,化合物浓度),拌匀,按15%含水率加入水,平衡3天。
(3)平衡完成后,把用生理盐水保存的根瘤菌t3f4母液用水稀释,按菌量>107cfu/g均匀地将根瘤菌t3f4菌液喷洒在土表面,土壤拌匀,每个处理12个重复。
(4)土壤拌匀后立即移栽长势一致的四季青小白菜(株高约6cm),每盆1株小白菜。
(5)移栽后按小白菜生长需求保持充足的水分。
(6)分别在灌菌后3天、7天、15天和21天时取样,每次每组取一株完整的小白菜,测定t3f4-gfp在根际土和非根际土中的定殖动态。
(7)土样活菌计数。每次取样将小白菜整株连根拔起,抖落并收集附着在根上的土壤作为根际土,收集根部周围5cm以外土壤作为非根际土。取两份土壤鲜重2g,一份土壤65℃烘干至恒重,另一份土壤加入无菌水18ml,振荡30min,充分混匀后按10倍稀释法稀释,分别取10-3、10-4和10-5浓度的悬浮液100μl涂平板,每个浓度3次重复,涂布于含50μg/ml四环素(tetracycline)的1/5lb抗性平板,28℃恒温培养48h后,在倒置荧光显微镜下统计抗性平板上的菌落数,计算每克土壤(干重)的含菌量(cfu/g)。
(8)叶片活菌计数。每次取样后剪去小白菜根和茎,用自来水洗净后,自然晾干表面水分,称取叶片1.0g,加入0.85%的nacl9ml,充分研磨,按10倍稀释法稀释后,分别取10-2、10-3和10-4浓度的悬浮液100μl涂板,每个浓度3次重复,涂布于含50μg/ml四环素(tetracycline)的1/5lb抗性平板,28℃恒温培养48h后,在倒置荧光显微镜下统计抗性平板上的菌落数,计数并计算每克叶片(鲜重)的含菌量(cfu/g)。
(9)将所计算出的结果数据用spssstatistics22.0统计软件处理,以菌落数量[log(cfu/g)]为纵坐标,取样时间为横坐标,origin8软件做图,结果如图4所示。
(10)如图4所示,土壤中添加单质硒或亚硒酸钠对t3f4在土壤及小白菜中的定殖没有影响。接菌第3d时,根际土中的t3f4-gfp的数量达到3×108cfu/g,此后,t3f4的数量有所下降,在第7d时达到了2.0×107cfu/g,第14d达到1.2×107cfu/g,在小白菜成熟时(第21d),t3f4浓度仍可以达到6.6×106cfu/g,表明t3f4可以在小白菜根际长期定殖。在非根际土和小白菜叶片中也可以观察到相似的现象,在第3d时,t3f4-gfp在非根际土和小白菜叶片的数量均为2.1×106cfu/g,而在小白菜成熟时,t3f4-gfp在非根际土和小白菜叶片的数量分别为3.2×105cfu/g和2.0×105cfu/g。
- 还没有人留言评论。精彩留言会获得点赞!