基于粒径选择法的胞外囊泡表面蛋白特异适配体筛选技术的制作方法
本发明涉及分子生物学领域,具体涉及基于粒径选择法的胞外囊泡表面蛋白特异适配体筛选技术。
背景技术:
胞外囊泡(extracellularvesicles)是由细胞分泌,直径为40~5000nm的囊泡,存在于人体多种体液中,如外周血、尿液、唾液和脑脊液。研究发现,胞外囊泡几乎存在于人体各种体液中,相较于ctc和cfdna,数量众多,胞外囊泡表面表达多种蛋白,而癌症患者来源胞外囊泡与健康人来源胞外囊泡表面蛋白的含量有明显差异,因此,胞外囊泡可作为肿瘤检测的靶标,对早期癌症的检测具有重要意义。
胞外囊泡作为肿瘤标志物优势明显,但其作为检测靶标用于实际临床诊断的产品极少,主要原因是胞外囊泡分离困难。目前胞外囊泡的分离方法有超速离心、超滤离心和基于聚合物的沉淀法等,但这些方法耗时长、成本高、不能满足临床应用的需要。新型的粒径选择选择法通过两次过膜的方式,依次滤除细胞培养上清中的细胞碎片等大分子物质与小分子物质,经nanosight检测发现即可获得粒径较为均一的胞外囊泡,该法操作简单,无需超速离心机,可以快速完成胞外囊泡的分离工作,同时选用的纳米滤膜无特异性吸附,胞外囊泡回收率可高达95%。
核酸适配体(aptamer)是指利用指数富集的配体进化技术(systematicevolutionofligandsbyexponentialenrichment,selex)从核酸分子文库中筛选出的寡核苷酸片段。通过链内某些互补碱基间的配对以及静电和氢键等作用,核酸适配体可使自身发生适应性折叠形成一些稳定的结构和空间构象多样性结构而绑定于靶分子上,同时具有可在体外筛选和化学合成、靶分子广泛、稳定性好,可长期保存等优点。目前核酸适配体的筛选主要基于细胞,而且cell-selex技术已经相对成熟,基于此技术,已经筛选出多种肿瘤细胞的特异适配体,但基于粒径选择法的胞外囊泡适配体筛选鲜有报道。
技术实现要素:
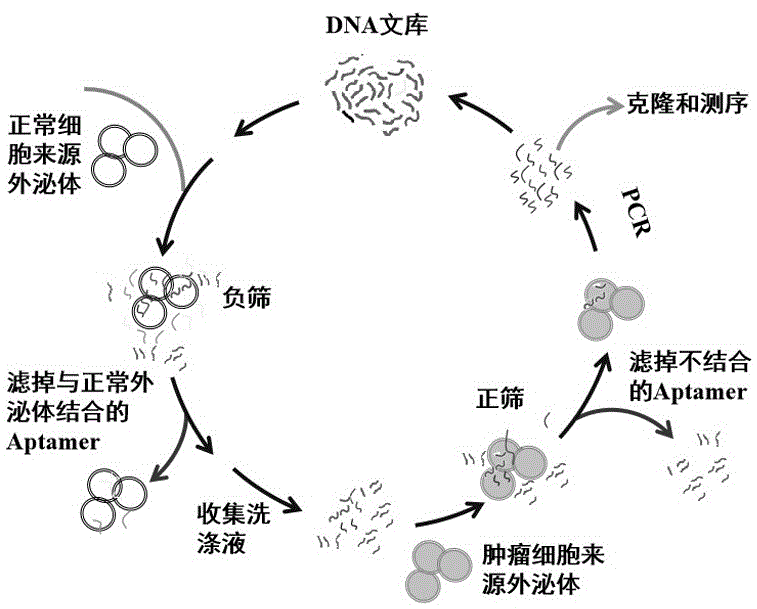
本发明的目的在于提供一种基于粒径选择法的胞外囊泡表面蛋白特异适配体筛选技术,通过粒径选择法分离胞外囊泡,简单快速且胞外囊泡回收率高,将随机文库与胞外囊泡混合孵育,正负筛交替进行以筛选出特异性高的核酸适配体,为癌症的早期液体活检筛查提供了一种更精准高效的技术方案。
为实现上述技术目的,本发明采取的技术方案为:基于粒径选择法的胞外囊泡表面蛋白特异适配体筛选技术,包括以下步骤:
1)合成随机文库及上下游引物;
2)目标细胞的培养与细胞培养上清的获取;
3)粒径选择法提取胞外囊泡;
4)正筛获取与靶标胞外囊泡结合的文库序列;
5)正负交替筛选获得特异性目标核酸适配体;
6)qpcr技术监测文库富集。
进一步地,步骤1)中随机文库为80nt的单链寡核苷酸,由生物公司合成,所述单链寡核苷酸的序列为5’-acgctcggatgccactacag-40nt-ctcatggacgtgctggtgac-3’,其中,40nt表示40个核苷酸(nt)的随机序列,所述上下游引物序列分别为:上游引物f1(seqidno:1):5’-fam-acgctcggatgccactacag-3’;下游引物r1(seqidno:2):5’-biotin-gtcaccagcacgtccatgag-3’;其中fam为荧光标记,biotin为生物素标记。
进一步地,步骤2)中目标细胞的培养与细胞培养上清的获取为:将目标细胞置于胎牛血清(fbs)中培养,待细胞生长至稳定状态时,使用无胞外囊泡的胎牛血清(fbs)继续培养,待细胞生长至铺占皿底70%~80%时,获取细胞培养上清。
进一步地,步骤3)中粒径选择法提取胞外囊泡为:将步骤2)中收集的细胞培养上清通过真空抽滤泵根据需要过20nm-5000nm孔径大小的滤膜过滤,清洗液清洗三遍后,用pbs缓冲液重悬收集胞外囊泡。
进一步地,所述清洗液的配制为4.5g/l葡萄糖和5mmmgcl·6h2o溶于0.01m的pbs缓冲液中。
进一步地,步骤3)提取的胞外囊泡通过nanosight粒度仪进行浓度测定。
进一步地,步骤4)中的正筛包括如下步骤:
4.1)随机文库与胞外囊泡的孵育:将随机文库溶于结合液中,金属浴95℃高温处理5min后立即冰浴10min,形成单链二级结构,然后与步骤3)提取的胞外囊泡混合孵育90min;
进一步地,所述结合液的配制为4.5g/l葡萄糖、5mmmgcl·6h2o、0.1mg/ml酵母trna和1mg/mlbsa溶于0.01m的pbs缓冲液中;
4.2)胞外囊泡与游离dna的分离:使用粒径选择装置将步骤4.1)中孵育后的混合液经20nm滤膜过滤,清洗液清洗后,用te缓冲液重悬收集截留在20nm滤膜上与单链二级结构结合的胞外囊泡;
4.3)次级文库的制备:
4.31)pcr扩增:以步骤4.2)中收集的与单链二级结构结合的胞外囊泡为模板,以步骤1)中合成的上下游引物为特异性引物对,进行pcr扩增,获得pcr扩增产物,pcr扩增的条件为:
扩增体系:上下游引物(10μm)各0.5μl,模板20ng,2×premix10μl,补充ddh2o至总体积为20μl;
扩增程序:95℃5min,95℃30s,58℃30s,72℃30s,共n轮循环,72℃3min;
其中,循环轮数n轮根据前轮筛选中凝胶成像结果优化确定,首轮扩增8个循环;
4.32)磁分离pcr扩增产物:将步骤4.31)中的pcr扩增产物通过磁分离ssdna的分离技术制备次级文库,用超微量紫外分光光度计测量次级文库的浓度。
1.进一步地,步骤4)中的正筛连续进行5-6轮,在进行下一轮正筛时,与步骤3)提取的靶标胞外囊泡结合的单链二级结构为上一轮正筛中制备的次级文库经金属浴95℃高温处理5min后立即冰浴10min所得。
进一步地,步骤5)中的负筛包括如下步骤:
5.1)提取正常细胞胞外囊泡:通过超速离心法超离获得正常细胞胞外囊泡,通过nanosight粒度仪分析分离的正常细胞外囊泡的浓度;
5.2)提取未与正常细胞胞外囊泡结合的核酸适配体:将以步骤4.3)中制备的次级文库与正常细胞胞外囊泡混合孵育,然后使用滤器过20nm孔径多孔阳极氧化铝膜过滤,收集滤液。
进一步地,正负交替筛选为进行一次正筛和一次负筛算一轮筛选,在一轮负筛后,紧接着进行下一轮正筛,在下一轮正筛中,与步骤3)提取的胞外囊泡结合的单链二级结构为上一轮负筛中收集的滤液经金属浴95℃高温处理5min后立即冰浴10min所得。
进一步地,步骤4)中正筛与步骤5)中正负交替筛选的总筛选轮数为10-20轮,在步骤4)中的正筛连续进行5-6轮后,引入负筛进行正负交替筛选,在正负交替筛选中,正筛孵育的时间逐渐缩短,分离时通过逐渐增加清洗次数以逐渐增大清洗力度,负筛时间逐渐增长,逐渐增加筛选压力,以获得特异性核酸适配体。
进一步地,步骤6)中采用qpcr技术检测与次级文库混合孵育后的胞外囊泡的熔解曲线,当筛选达到一定轮数时,检测到qpcr熔解曲线呈现单一的溶解峰,趋于稳定,表明次级文库得到成功富集,筛选达到平台期,可终止筛选。
本发明具有以下有益效果:
1)采用粒径选择法从目标细胞培养上清中提取胞外囊泡,简单快速且胞外囊泡回收率高;
2)通过正筛获得次级文库,正筛连续进行五至六轮,可提高目标核酸适配体回收率;
3)通过在正筛后引入负筛,可去除非特异性核酸适配体,提高筛选效率;
4)通过多轮正负交替筛选,并在此过程中逐渐调整筛选条件,增大筛选压力,提高筛选效率,可获得高特异性的核酸适配体;
5)通过qpcr技术检测连续两轮正负交替筛的次级文库与胞外囊泡结合后的qpcr熔解曲线呈现单一的溶解峰,趋于稳定,可确定筛选的终止,进一步通过qpcr技术检测筛选的目标核酸适配体的特异性,为临床提供一种与目前筛查技术互补的,更加精准、无创、简便和经济的癌症早期液体活检筛查新方法,具有非常重要的社会价值和临床意义。
附图说明
图1是本发明的技术流程图;
图2是qpcr检测文库富集程度结果图,其中:横坐标表示温度,纵坐标表示单位时间内的相对荧光强度,a为对照组:随机文库与mda-mb-231细胞胞外囊泡结合后的qpcr熔解曲线,b为第一实验组:第5轮筛选的次级文库与mda-mb-231细胞胞外囊泡结合后的qpcr熔解曲线,c为第二实验组:第10轮筛选的次级文库与mda-mb-231细胞胞外囊泡结合后的qpcr熔解曲线,d为第二实验组:第17轮筛选的次级文库与mda-mb-231细胞胞外囊泡结合后的qpcr熔解曲线,e为第三实验组:第18轮筛选的次级文库与mda-mb-231细胞胞外囊泡结合后的qpcr熔解曲线;
图3是qpcr检测具体实施例1筛选的核酸适配体特异性结果图,其中:横坐标表示扩增循环数,纵坐标表示荧光强度,a为对照组:测序所得的核酸适配体与mcf-10a细胞胞外囊泡结合后的qpcr扩增曲线,b为实验组,测序所得的核酸适配体与mda-mb-231细胞胞外囊泡结合后的qpcr扩增曲线。
具体实施方式
为了使本领域技术领域人员更好地理解本发明的技术方案,下面通过具体实施例对本发明作进一步说明。
下述实施例中所使用的实验方法,如无特殊说明,均为常规方法,所用的试剂,如无特殊说明,均可从商业途径得到。
具体实施例1
基于粒径选择法的人乳腺癌mda-mb-231细胞胞外囊泡表面蛋白特异适配体的筛选,包括以下步骤:
1)合成随机文库及上下游引物
由上海生工生物有限公司合成特异性引物对f1/r1和随机文库序列,上游引物f1的序列如seqidno:1所示,下游引物r1的序列如seqidno:2所示,随机文库的序列如seqidno:3所示:
上游引物f1(seqidno:1):5’-fam-acgctcggatgccactacag-3’
下游引物r1(seqidno:2):5’-biotin-gtcaccagcacgtccatgag-3’;
随机文库:5’-acgctcggatgccactacag-40nt-ctcatggacgtgctggtgac-3’;
进一步地,步骤1)中随机文库为80nt的单链寡核苷酸,所述单链寡核苷酸中间40nt为40个随机碱基序列,上游引物5’端用荧光标记(fam)修饰,下游引物5’端用生物素(biotin)标记。
2)mda-mb-231细胞的培养与细胞培养上清的获取:将mda-mb-231细胞置于胎牛血清(fbs)中培养,显微镜下观察到细胞生长至稳定状态后,继续在10%不含胞外囊泡血清的dmem培养基中培养24-48h,在细胞丰度达到80%时,收集细胞上清;
3)粒径选择法提取mda-mb-231细胞胞外囊泡:将步骤2)中收集的mda-mb-231细胞培养上清通过真空抽滤泵依次过600nm孔径聚碳酸酯膜-径迹蚀刻膜和20nm孔径多孔阳极氧化铝膜过滤,清洗液清洗三遍后,用pbs缓冲液重悬收集胞外囊泡,使用nanosight粒度仪测定提取的胞外囊泡浓度;
进一步地,清洗液为4.5g/l葡萄糖和5mmmgcl·6h2o溶于0.01m的pbs缓冲液中。
4)正筛获取与胞外囊泡结合的文库序列,具体包括如下步骤:
4.1)随机文库与胞外囊泡的孵育:将随机文库溶于结合液中,金属浴95℃高温处理5min后立即冰浴10min,形成单链二级结构,然后将步骤3)提取的mda-mb-231细胞胞外囊泡、4×结合液和单链二级结构以5:2:1的比例混合孵育90min;
进一步地,结合液为4.5g/l葡萄糖、5mmmgcl·6h2o、0.1mg/ml酵母trna和1mg/mlbsa溶于0.01m的pbs缓冲液中。
4.2)胞外囊泡与游离dna的分离:使用粒径选择装置将步骤4.1)中孵育后的混合液经20nm滤膜过滤,清洗液清洗后,用te缓冲液重悬收集截留在20nm滤膜上与单链二级结构结合的胞外囊泡;
4.3)次级文库的制备:
4.31)pcr扩增:以步骤4.2)中收集的与单链二级结构结合的胞外囊泡为模板,以步骤1)中合成的上下游引物(f1/r1)为特异性扩增引物对进行pcr扩增,获得pcr扩增产物,pcr扩增的条件为:
扩增体系:上下游引物f1/r1(10μm)各2μl,模板20ng,2×premix10μl,补充ddh2o至总体积为20μl;
扩增程序:95℃5min,95℃30s,58℃30s,72℃30s,共n轮循环,72℃3min;
实施例中,循环轮数n轮根据前轮筛选中凝胶成像结果优化确定,首轮扩增8个循环,由实验前对随机文库分别进行2、4、6、8、10、12、14、16、18和20轮循环扩增确定;
4.32)磁分离pcr扩增产物:将步骤4.3)中的pcr扩增产物通过磁分离ssdna的分离技术制备次级文库,用超微量紫外分光光度计测量次级文库的浓度。
进一步地,步骤4)中的正筛连续进行5-6轮,在进行下一轮正筛时,与步骤3)提取的mda-mb-231细胞胞外囊泡结合的单链二级结构为上一轮正筛中制备的次级文库经金属浴95℃高温处理5min后立即冰浴10min所得。
5)引入负筛,正负交替筛选获得特异性目标核酸适配体,其中,负筛包括如下步骤:
5.1)健康人血浆胞外囊泡的提取:通过超速离心法超离获得健康人血浆细胞,通过nanosight粒度仪分析分离的血浆胞外囊泡的浓度;
5.2)未与血浆胞外囊泡结合的核酸适配体的提取:将血浆胞外囊泡、4×结合液和步骤4.32)中制备的次级文库以5:2:1的比例混合孵育30min,然后使用滤器过20nm孔径多孔阳极氧化铝膜过滤,收集滤液;
进一步地,正负交替筛选为进行一次正筛和一次负筛算一轮筛选,在一轮负筛后,紧接着进行下一轮正筛,在下一轮正筛中,与步骤3)提取的mda-mb-231细胞胞外囊泡结合的单链二级结构为上一轮负筛中收集的滤液经金属浴95℃高温处理5min后立即冰浴10min所得。
进一步地,步骤4)中正筛与步骤5)中正负交替筛选的总筛选轮数为10-20轮,在步骤4)中的正筛先连续进行5-6轮后,引入负筛进行正负交替筛选,在正负交替筛选中,正筛孵育的时间逐渐缩短,分离时通过逐渐增加清洗次数以逐渐增大清洗力度,负筛时间逐渐增长,逐渐增加筛选压力,以获得特异性核酸适配体。
6)qpcr技术监测文库富集:qpcr检测与次级文库混合孵育后的mda-mb-231细胞胞外囊泡的熔解曲线,如图2所示,随着筛选轮数的增加,每轮筛选产物qpcr熔解曲线中杂双链体(tm在70-72℃)逐渐降低,同双链体(tm在82-87℃范围内)逐渐增加,当筛选到第10轮(c)时,第10轮(c)、第17轮(d)和第18轮(e)筛选产物的qpcr熔解曲线趋于稳定,均呈现单一的溶解峰,表明次级文库得到成功富集,当筛选到第18轮(e)时,筛选达到平台期,可终止筛选。
其中,qpcr扩增条件为:
利用steponeplustm实时荧光定量pcr仪,使用
反应体系(冰上配制反应混合液):
其中,pcrforwardprimer和pcrreverseprimer分别为上游引物f1(seqidno:1)和下游引物r1(seqidno:2);
反应程序采用两步法程序:预变性:95℃30s;循环反应:95℃5s,72℃30s,40个循环;熔解曲线程序:95℃15s,72℃1min,95℃15s。
进一步地,以随机文库与mda-mb-231细胞胞外囊泡结合后的筛选产物为dna模板,其qpcr熔解曲线,作为对照组(a);以第5轮、第10轮、第17轮和第18轮筛选的次级文库与mda-mb-231细胞胞外囊泡结合后的筛选产物为dna模板,它们的qpcr熔解曲线,分别作为第一实验组(b)、第二实验组(c)和第三实验组(d)和第四实验组(e)。
7)qpcr检测筛选出的目标核酸适配体的特异性:
将第18轮的筛选产物经pcr扩增后,送上海生工生物有限公司进行克隆测序,将测序所得的核酸适配体序列(seqidno:3)分别与mda-mb-231人乳腺癌细胞和mcf-10a人正常乳腺上皮细胞的胞外囊泡结合,孵育15min,pbs缓冲液清洗3遍后,利用steponeplustm实时荧光定量pcr仪对与胞外囊泡表面蛋白结合的核酸适配体序列(seqidno:3)进行特异性检测;
其中,qpcr试剂盒选用
扩增体系:sybrpremixextaq(2×)10μl,上下游引物f1/r1(10μm)各0.4μl,rocreferenvedye(50×)0.4μl,dna模板<100ng,补充ddh2o至总体积为20μl;
两步法扩增程序:holdingstage:95℃30s,cyclingstage:循环数40,step1:95℃5s,step2:72℃30s,meltcurvestage。
其中,以测序所得的核酸适配体与mcf-10a细胞胞外囊泡孵育并清洗后的产物为dna模板,进行qpcr检测,获得qpcr扩增曲线,作为对照组(a),以测序所得的核酸适配体与mda-mb-231细胞胞外囊泡孵育并清洗后的产物为dna模板,进行qpcr检测,获得qpcr扩增曲线,作为实验组(b)。
由图3可见,实验组(b)qpcr扩增曲线的ct值低于对照组(a)qpcr扩增曲线的ct值,这与测序所得的核酸适配体与mda-mb-231乳腺癌细胞特异性结合,与mcf-10a正常乳腺细胞非特异性结合时,它们的qpcr扩增曲线理论ct值大小关系相一致,表明采用本基于粒径选择法的胞外囊泡核酸适配体筛选技术可筛选得到mda-mb-231细胞胞外囊泡表面蛋白特异核酸适配体。
以上仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,应视为本发明的保护范围。
序列表
<110>南京鼓楼医院
<120>基于粒径选择法的胞外囊泡表面蛋白特异适配体筛选技术
<160>3
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
acgctcggatgccactacag20
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
gtcaccagcacgtccatgag20
<210>3
<211>79
<212>dna
<213>人工序列(artificialsequence)
<400>3
cgctcggatgccactacaggaccctgcctcctttattcggtttcgcacctaccttgcgcc60
tcatggacgtgctggtgac79
- 还没有人留言评论。精彩留言会获得点赞!