一株耐低温解纤维素青霉菌及其应用的制作方法
本发明涉及菌株分离及应用技术领域,具体涉及一种耐低温解纤维素青霉菌及其应用。
背景技术:
纤维素是由葡萄糖以β-1,4-糖苷键连接而组成的大分子多糖,为植物细胞壁的重要组成成分,约占植物干重的35%-50%,是自然界中含量最为丰富的碳水化合物。同时,纤维素也是一类十分重要的可再生资源,可作为能源、食品和化工产业的原料,如生产乙醇、乳酸和单细胞蛋白等。然而,由于纤维素含有大量的高能氢键,不易被降解,利用率低,绝大多数的纤维素资源被废弃或直接焚烧,造成了极严重的资源浪费和环境污染问题。因此,纤维素资源的有效开发与利用已经成为当前能源与环境研究的热点之一。
利用自然界中的微生物对纤维素进行生物转化,具有降解效率高、能耗低、安全、无污染等特点,可有效克服物理和化学处理法的弊端,越来越受到人们的重视。然而,由于低温微生物菌株资源的限制,纤维素的微生物转化研究主要集中在常温或高温条件下,对于低温菌株及其产酶能力的研究则相对较少。高效降解纤维素低温菌株的开发与利用,可进一步地节省产业能耗,从而提高纤维素资源的利用效率。
随着全球温室气体浓度升高而引起的全球变化,地球化学循环的研究日益得到重视,尤其是C、N、P这3种最为重要的生命构成元素。而土壤微生物是陆地生态系统的重要组分,在陆地生态系统C、N、P循环中的扮演了核心角色。因此,耐低温解纤维素菌株在高山、深海、极地等低温自然环境的生物地球化学循环中发挥着极为关键的作用,其群落结构和功能特征的变化影响着生物地球化学循环过程。因此,低温解纤维素菌株的研究具有重要的理论意义和应用前景。
技术实现要素:
本发明的目的在于提供一种耐低温解纤维素青霉菌及其应用。
本发明从西藏那曲地区海拔4500m金露梅根际土样中分离得到一株青霉菌,命名为NLS-2。
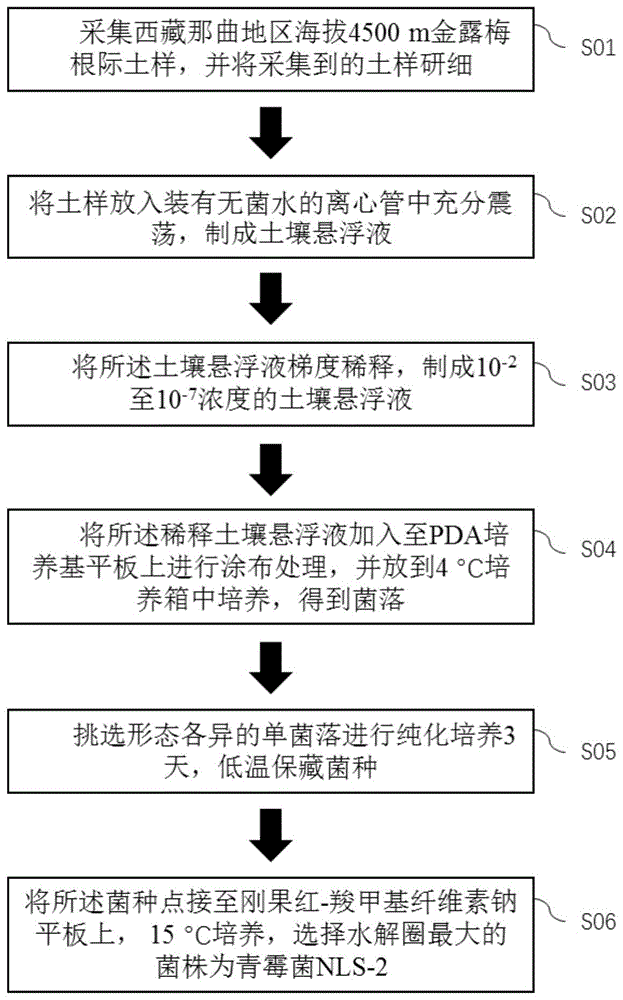
具体分离方法为:采集西藏那曲地区海拔4500m金露梅根际土样;将采集的土样放入装有无菌水的离心管中充分震荡,制成土壤悬浮液;将所述土壤悬浮液梯度稀释,制成10-2至10-7浓度的土壤悬浮液;将所述稀释土壤悬浮液加入至PDA培养基平板上进行涂布处理,并放到4℃培养箱中培养,得到菌落;挑选形态各异的单菌落进行纯化,培养3天,低温保藏菌种;将所述菌种点接至刚果红羧甲基纤维素钠平板上,15℃培养,选择水解圈最大的菌株,经鉴定为青霉菌,并命名NLS-2。
NLS-2的菌落呈灰色隆起,边缘齐整,直径达49mm,表面呈粉末状并伴随菌丝绒毛,出现透明分泌液。
本发明的青霉菌菌株NLS-2已于2019年3月15日保藏于中国典型培养物保藏中心(保藏单位地址:中国武汉,武汉大学;邮政编码: 430072),分类命名为:Penicillium sp.,保藏编号为CCTCC NO:M 2019154。
本发明的青霉菌NLS-2,其能够产纤维素酶,所述纤维素酶包括内切β-葡聚糖酶、外切β-葡聚糖酶、β-葡萄糖苷酶。
本发明的青霉菌NLS-2其能够在低温下生长,所述低温为4-15℃。在该温度条件下,产纤维素酶的能力最强,内切β-葡聚糖酶、外切β-葡聚糖酶、β-葡萄糖苷酶具有较高的酶活力,分别达到17.89U/mL、11.36 U/mL和15.13U/mL。
含有本发明青霉菌NLS-2或其发酵液的菌剂属于本发明的保护范围。
含有本发明青霉菌NLS-2或其发酵液的土壤功能酶活力调节剂属于本发明的保护范围。
本发明提供了青霉菌NLS-2或其发酵液或含有其的菌剂在低温环境下产纤维素酶、解纤维素中的应用。
所述纤维素酶包括内切β-葡聚糖酶、外切β-葡聚糖酶、β-葡萄糖苷酶。
本发明提供了青霉菌NLS-2或其发酵液或含有其的菌剂在低温环境下调节土壤功能酶活力中的应用。
进一步地,所述土壤功能酶包括β-葡萄糖苷酶、蔗糖酶、脲酶、磷酸酶。
优选地,本发明所述的应用均优选在低温条件下进行,所述低温为 4-15℃。
本发明还提供了上述耐低温解纤维素青霉菌NLS-2的菌液制备方法,包括:将青霉菌NLS-2接种在液体培养基中,在15℃下摇床震荡 6天,得到青霉菌NLS-2的发酵液。
优选地,所述摇床震荡的转速为160r/min。
优选地,所述液体培养基为PDA液体培养基,按照浓度包含以下组分:马铃薯200g/L,葡萄糖20g/L。
所述液体培养基的pH为自然,且在121℃高压蒸汽灭菌20min。
本发明提供的耐低温解纤维素青霉菌(Penicillium sp.)NLS-2是在高海拔地区分离得到的,在15℃下具有较强的产纤维素酶能力,所产的内切β-葡聚糖酶、外切β-葡聚糖酶、β-葡萄糖苷酶活性高,为处理纤维素提供了一种高效降解的手段,具有良好的工业化应用前景。同时,该菌株来源于西藏那曲地区海拔4500m左右的金露梅根际土壤,在低温环境下能够有效地调节土壤功能酶活力,具有较好的环境效益和经济效益。
附图说明
图1是本发明实施例提供的青霉菌NLS-2的制备流程图。
图2是本发明实施例提供的青霉菌NLS-2的菌落形态图(15℃,5天)。
图3是本发明实施例提供的青霉菌NLS-2的菌落形态图(4℃,8天)。
图4是本发明实施例提供的青霉菌NLS-2的分生孢子结构示意图。
图5是本发明实施例提供的青霉菌NLS-2的ITS序列构建的系统发育树图。
图6是本发明实施例提供的青霉菌NLS-2的刚果红羧甲基纤维素钠平板水解效果示意图。
图7是本发明实施例提供的青霉菌NLS-2的产纤维素酶测定结果图。
图8是本发明实施例提供的青霉菌NLS-2的调节土壤功能酶的测定结果图。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例中所用的培养基:PDA液体培养基为,按照浓度包含以下组分:马铃薯200g/L,葡萄糖20g/L,pH自然,且在121℃高压蒸汽灭菌30min。
刚果红羧甲基纤维素钠培养基组成按照浓度包括15g/L的羧甲基纤维素钠,5g/L的氯化钠,1g/L的KH2PO4,0.2g/L的MgSO4,10g/L 的蛋白胨,5g/L的酵母粉,pH值为7.2-7.4。培养基在121℃高压蒸汽灭菌20min。
实施例1青霉菌NLS-2的分离与鉴定
请参考图1,图1示出了本发明实施例提供的耐低温解纤维素青霉菌NLS-2的制备流程图。本发明实施例提供的耐低温解纤维素青霉菌 NLS-2的制备步骤为:
采集西藏那曲地区海拔4500m金露梅根际土样;将采集的土样放入装有无菌水的离心管中充分震荡,制成土壤悬浮液;将所述土壤悬浮液梯度稀释,制成10-2至10-7浓度的土壤悬浮液;将所述稀释土壤悬浮液加入至PDA培养基平板上进行涂布处理,并放到4℃培养箱中培养,得到菌落;挑选形态各异的单菌落进行纯化,培养3天,低温保藏菌种;将所述菌种点接至刚果红羧甲基纤维素钠平板上,15℃培养,选择水解圈最大的菌株命名为NLS-2。
1、形态学鉴定
将本发明实施例提供的菌株NLS-2接种到PDA固体培养基上,然后将平板倒转,在温度为15℃的条件下培养5天,观察并记录平板上菌落的生长情况。本发明实施例提供的菌株NLS-2的菌落形态图请参考图2。图2能够看出菌株的菌落为灰色隆起,边缘齐整,直径达49mm,表面呈粉末状并伴随菌丝绒毛,出现透明分泌液。图3为温度为4℃的条件下培养8天的菌落生长情况图。
本实施例还发现在温度为4-15℃的低温条件下,菌株NLS-2生长情况良好。说明本发明的菌株NLS-2具有耐低温的能力。
进一步地,用无菌镊子夹取适量培养好的青霉于载玻片上的棉蓝染液中央,拨动菌丝使其均匀散开,盖上盖玻片,置于显微镜下,观察分生孢子及孢子头类型,分生孢子梗、小梗等的特点,菌株的分生孢子结构示意图请见图4。
从图4能够看出菌株的分生孢子梗发生于基质,壁光滑,顶端不膨大,(38~39)μm×(3.1~3.3)μm;多次分枝,呈扫帚状,梗基每轮2~3 个,(31~32)μm×(2.9~3.0)μm;小梗每轮5~8个,呈圆柱状,(25~26) μm×(2.6~3.0)μm;分子孢子呈典型的圆形,光滑,2.6~2.9μm,呈分散状或串联的孢子链。
2、ITS序列分析
本发明实施例采用Ezup柱式真菌基因组DNA抽提试剂盒提取本菌株中的DNA。其中,25μL的PCR反应体系包括2.5μL的10×PCR buffer, 0.5μL的DNA模板,1μL的dNTPs,0.5μL的上游引物,0.5μL的下游引物,0.2μL的Taq DNA聚合酶,19.8μL的ddH2O。反应条件为:在温度为94℃预变性4min;94℃变性45s;55℃退火45s;72℃延伸1min,30个循环,4℃保存。
PCR产物由上海生工生物工程股份有限公司测序,测序结果参加附表中的核苷酸序列。将所得序列在GenBank中进行BLAST相似性比对,得到相似性较高的序列。运用MEGA7.0软件构建菌株的系统发育树,本菌株的ITS rDNA序列与青霉菌(Penicillium sp.)的同源性达到99%,本菌株的发育树图请见图5。
综合上述形态学观察及ITS序列分析结果,能够确定本菌株NLS-2 为青霉菌属(Penicillium sp.)的成员,其被命名为青霉菌NLS-2。该菌株已于2019年3月15日保藏于中国典型培养物保藏中心(简称CCTCC,保藏单位地址:中国武汉,武汉大学;邮政编码:430072),分离命名: Penicillium sp.),保藏编号为CCTCC NO:M 2019154。
实施例2青霉菌菌株NLS-2的低温下降解纤维素能力测定
本发明实施例提供了耐低温解纤维素青霉菌菌株NLS-2在刚果红羧甲基纤维素钠平板上水解的效果示意图,见图6。从图6中能够看出15℃下,接种有青霉菌菌株NLS-2的刚果红羧甲基纤维素钠平板5天后出现了明显的水解圈,且水解圈的直径在17.4mm以上,由水解圈的出现能够说明本发明实施例提供的青霉菌菌株NLS-2在低温条件下具有较强的降解纤维素的潜力。
实施例3青霉菌菌株NLS-2的低温下产纤维素酶能力测定
本发明实施例对青霉菌菌株NLS-2进行了产纤维素酶能力测定,该测定包括以下内容:
1、粗酶液的制备
将本发明实施例1提供的菌株NLS-2接种至PDA液体培养基中,于15℃,160r/min下培养24h,然后以2%的接种量接种于产酶培养基中,15℃,160r/min下培养7d。期间,每隔24h测定酶活力,取发酵液在6000r/min,4℃,离心10min,每个时间3次重复,上清液即为粗酶液。
所述产酶培养基的组成为:CMC-Na 15.0g/L,酵母粉5.0g/L, KH2PO4 2.0g/L,pH 7.0,121℃灭菌20min。
2、葡萄糖标准曲线的制作
取0-1.2mL(每管差0.2mL)的1mg/mL的葡萄糖标准液于7支刻度试管中,加蒸馏水补足至2mL,再加入DNS 1.5mL,混匀,沸水浴5 min,取出后待冷却至室温,用蒸馏水定容至20mL,颠倒混匀,用分光光度计测量OD540nm。以光密度值为纵坐标,葡萄糖含量(mg)为横坐标,作葡萄糖标准曲线。测样品的OD值,通过标准曲线计算葡萄糖的生成量。
3、酶活的测定
(1)内切型-β-葡聚糖酶活力的测定
以1%羧甲基纤维素钠溶液作为底物,测试组取1%羧甲基纤维素钠溶液1mL,加入pH 4.5的柠檬酸缓冲液0.5mL,上述制得的粗酶液0.5 mL,于50℃水浴锅中反应30min,中止反应后,加入1.5mL DNS试剂,将各管摇匀,沸水浴5min,取出,待冷却至室温后,定容至20mL,加塞,颠倒混匀,在540nm下测定其OD值。空白组不进行50℃水浴,先加DNS以钝化酶活,其它都与测试组相同。以每分钟生成相当于1μg 的葡萄糖为一个酶活单位。
(2)外切型-β-葡聚糖酶活力的测定
在试管中加入1%的微晶纤维素底物溶液和0.5mL缓冲液,再加入 0.5Ml粗酶液,于50℃浴锅中反应30min,中止反应后与内切型-β-葡聚糖酶的处理方式相同,在540nm下测定其OD值。空白组不进行50℃水浴,先加DNS以钝化酶活,其它都与对照组相同。以每分钟生成相当于1μg的葡萄糖为一个酶活力单位。
(3)β-葡萄糖苷酶活力的测定
底物是1%水杨素溶液,取1.0mL底物,加入0.5mL缓冲液和0.5Ml 粗酶液,于50℃水浴锅中反应30min,中止反应后与CMC酶的处理方式相同,在540nm下测定其OD值。空白组不进行50℃水浴,先加 DNS以钝化酶活,其它都与对照组相同。以每分钟生成相当于1μg的葡萄糖为一个酶活力单位。
本发明提供了耐低温解纤维素青霉菌菌株NLS-2产纤维素酶包括内切型-β-葡聚糖酶、外切型-β-葡聚糖酶、β-葡萄糖苷酶的测定结果图,结果图请参考图7。从图7中能够看出在15℃下,菌株具有较强的产酶能力,且在发酵培养6天时,内切型-β-葡聚糖酶、外切型-β-葡聚糖酶、β- 葡萄糖苷酶均具有最高的酶活力,分别达到17.89U/mL、11.36U/mL和 15.13U/mL,具有良好的工业化应用前景。
实施例4青霉菌菌株NLS-2的调节土壤功能酶活力测定
本发明实施例以西藏海拔4500m土壤为例进行了耐低温解纤维素青霉菌NLS-2发酵液调节土壤功能酶活力的研究,如下:
1、供试土壤的准备
(1)土壤的选用本实施例使用的实验土壤采自西藏那曲地区海拔4500 m的草甸土壤。
(2)土壤的预处理将采集的土壤风干7天,去除石块和植物根系后将其研磨捣碎,然后过2mm的筛网,得到供试土样。
(3)土壤的培育将300g的供试土壤放入长宽高为11.5cm×11.5 cm×9.5cm的盆钵中,添加无菌水将土壤含水率调至15%,置于15℃下。
2、发酵液的制备
本实施例使用的发酵液制备方法如下:将青霉菌菌株NLS-2接种于液体培养基,在15℃下,摇床培养6天,转速为160r/min。所述液体培养基为PDA液体培养基,按照浓度包含以下组分:200g/L的马铃薯, 20g/L的葡萄糖,pH自然。
3、具体的实验设计
实验共分为2组:空白组(CK):无菌水;实验组(NLS-2):菌株 NLS-2发酵液。青霉菌NLS-2的发酵液用无菌水将菌液稀释加入供试土壤中搅拌均匀,使浓度达到108CFU/g(干土),空白组添加等量的无菌水。每个处理3个重复,将装有土样的盆钵置于15℃气候箱培养60天。 4、土壤功能酶活力的测定
本实施例测定的土壤功能酶包括β-葡萄糖苷酶、蔗糖酶、脲酶、磷酸酶。本实施例使用的是北京索莱宝科技有限公司的土壤酶活性检测试剂盒,按照其说明书指示要求进行土壤功能酶活力的分析,采用了96孔板和酶标仪进行定量测定。
5、测定结果
本发明提供了耐低温解纤维素青霉菌菌株NLS-2的调节土壤功能酶的测定结果图,结果图请见图8。从图8中能够看出在15℃下,菌株可以显著地调节土壤的蔗糖酶、脲酶、磷酸酶。
具体地,与对照组相比,15℃下菌株NLS-2发酵液能够显著地增强土壤蔗糖酶、脲酶、磷酸酶的活力。对照组酶活分别为90.63U/g、796.23 U/g、13576.40U/g,实验组酶活分别为142.63U/g、1557.76U/g、21037.72 U/g。
综上,本发明提供的耐低温解纤维素青霉菌菌株NLS-2可在低温条件下,有效地调节土壤C、N、P循环相关的功能酶。因此,具有良好的改善土壤生态环境的应用前景。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110> 北京大学
<120> 一株耐低温解纤维素青霉菌及其应用
<130> KHP191111778.6
<160> 3
<170> SIPOSequenceListing 1.0
<210> 1
<211> 559
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
tgcggaagga tcattaccga gtgagggccc tctgggtcca acctcccacc cgtgtttatt 60
taccttgttg cttcggcggg cccgccttaa ctggccgccg gggggctcac gcccccgggc 120
ccgcgcccgc cgaagacacc ctcgaactct gtctgaagat tgtagtctga gtgaaaatat 180
aaattattta aaactttcaa caacggatct cttggttccg gcatcgatga agaacgcagc 240
gaaatgcgat acgtaatgtg aattgcaaat tcagtgaatc atcgagtctt tgaacgcaca 300
ttgcgccccc tggtattccg gggggcatgc ctgtccgagc gtcattgctg ccctcaagca 360
cggcttgtgt gttgggcccc gtcctccgat tccgggggac gggcccgaaa ggcagcggcg 420
gcaccgcgtc cggtcctcca gcgtatgggg ctttgtcacc cgctctgtag gcccggccgg 480
cgcttgccga tcaacccaaa tttttatcca ggttgacctc ggatcaggta gggatacccg 540
ctgaacttaa gcatatcaa 559
<210> 2
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
tccgtaggtg aacctgcgg 19
<210> 3
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
tcctccgctt attgatatgc 20
- 还没有人留言评论。精彩留言会获得点赞!