一种抑制酵母提前絮凝因子产生的方法与流程
本发明属于微生物发酵领域,具体涉及一种抑制酵母提前絮凝因子产生的方法。
背景技术:
中国是啤酒生产与消费大国,2018年我国啤酒产量达3812.2万千升,实现销售收入超过1600亿元,是食品工业的重要组成部分。酵母是啤酒酿造的根本和灵魂,影响啤酒生产过程的稳定性和啤酒质量。在啤酒正常发酵末期,酵母会从悬浮状态逐渐聚集成团,然后自然沉降,即酵母絮凝。酵母提前絮凝(prematureyeastflocculation,pyf)是指啤酒发酵过程中,酵母还没有将可利用的发酵性糖发酵完全就大量沉降了,啤酒表现为发酵残糖高,酒精度低,产生不良风味,同时,伴随易导致微生物侵染、co2溶解率下降、so2含量高、啤酒过滤困难、酵母不可重复利用及发酵过程不易控制。因而,即便在啤酒生产工业化控制非常成熟的今天,若啤酒酿造过程中出现pyf,也必会造成生产企业无法挽回的经济损失,据行业估计每年损失超过1亿元。
本世纪以来,随着自然环境污染、国际环境气候变化及恶劣天气增加,微生物污染导致的啤酒大麦麦芽品质下降,加剧了pyf的发生频率并相继引起世界啤酒集团和国内啤酒、麦芽集团的严重关注。啤酒大麦麦芽微生物污染严重,在制麦过程中微生物会分泌木聚糖酶降解大麦麦芽皮壳和胚乳细胞壁中主要成分阿拉伯木聚糖,产生不同分子量的阿拉伯木聚糖链,其中包括富含结合态阿魏酸(ferulicacid,fa)分子量在20-27kda的pyf因子,导致pyf的发生。但由于制麦和酿造过程的复杂性,加之酵母絮凝影响因素的多样性等原因,科研人员对大麦麦芽导致的pyf作用机理等研究仍停留在推测和假说的层面。
近年来,国内外研究人员主要围绕“pyf因子是什么物质”而开展,进而确定了特定分子量、富含结合态fa的阿拉伯木聚糖可以导致pyf的发生,且其产生与大麦麦芽微生物污染有高度相关性,但对有效控制pyf因子产生的研究相对较少。
关于pyf的控制研究,从啤酒原料大麦的选择开始,尽量避免使用有病害的大麦,对于受潮大麦或是遭受恶劣环境的田间大麦也尽量避免用于生产制麦。此外,还可以多应用无壳大麦(裸大麦)品种,如cdcfreedom,cdcmcgwire等。对成品的大麦或麦芽,其pyf倾向性的控制方法主要有:
(1)制麦前,清洗大麦,减少微生物污染;保持制麦过程中通风,特别是浸麦断水阶段及发芽过程中,降低co2浓度,提高o2含量,保持制麦车间空气清新度;
(2)糖化前,对麦芽进行湿粉碎,或是对成品麦芽进行水洗和烘干;
(3)pyf阳性(pyf+)与阴性(pyf-)麦芽的搭配使用:pyf+麦汁(占10%或25%)与pyf-麦汁搭配,会减轻pyf的严重性。有研究学者也指出,pyf+麦芽比例小于5%,完全没有问题;另高于50%的发酵7d的pyf+发酵液以3:1与发酵3天的pyf-混合;提高发酵温度(10到12.5℃),可使pyf+麦芽用量达40%。研究者史刚提出生产中避免使用高pyf值的麦芽,不同pyf值麦芽混合搭配使用,并确定青岛啤酒股份有限公司麦芽(或混合后麦芽)pyf值在85%~115%之间。
(4)麦汁中添加单宁酸(25-100mg·l-1),能够克服pyf,因单宁酸可以与酵母表面结合,扰乱酵母絮凝,此项技术已经有专利申请(kirinpatentjpn.pat.jp03943122b1)。
(5)构建酵母絮凝基因缺陷型。如李静怡构建了flo8缺陷型啤酒酵母基因工程菌,改良了其絮凝性能,更适用于pyf阳性麦芽的发酵。
以上方法仅仅是在生产过程中采用上述手段减轻或消除酵母提前絮凝现象的发生,但并未从根源上控制pyf因子的产生。
并从大麦本身找寻抵御微生物污染的方法或控制pyf因子的产生,为控制pyf发生提供了另一重要研究思路。
大麦麦芽中pyf因子的产生,主要是由微生物侵染导致,因此,控制pyf因子产生,其根本的方法在于控制微生物对大麦的侵染。pyf因子的物质组成和分子特征也表明,微生物产生的木聚糖酶可以导致麦芽pyf的发生,因此,直接抑制微生物木聚糖酶的作用是控制pyf因子产生更加快速有效的重要方法。2001年,goesaert等人从大麦中分离纯化出一种木聚糖酶抑制剂(hordeumvulgarel.xylanaseinhibitor,hvxi),pi≥9.3是一种没有糖基化的内切木聚糖酶抑制剂蛋白,分子量约40kda,并且对多种微生物的木聚糖酶具有抑制作用,比如黑曲霉(aspergillusniger)、绿色木霉(trichodermaviride)、枯草芽孢杆菌(bacillussubtilis)等产生的木聚糖酶。
至今,对hvxi的研究较少,对其克隆表达及应用也未见报道。采用基因工程的研究技术,可以快速获得目标蛋白,在保证目标蛋白作用活性的基础上,通过发酵工程,高产量表达纯化后再应用于大麦原料储藏、制麦过程及麦芽糖化过程中,以此,在啤酒发酵之前消除pyf因子的产生,达到pyf控制的目的。
本发明将hvxi基因通过gap启动子,在毕赤酵母(pichiapastoris)x33中表达,通过对内切木聚糖酶活性的抑制筛选表达活性最高的转化子,确定初步分离纯化条件,探索应用于糖化过程,研究对pyf的抑制作用,为进一步将其应用于田间大麦或制麦过程中,降低大麦或麦芽中pyf因子的产生提供可行性思路。
技术实现要素:
针对现有问题的不足,本发明的第一个目的是提供一种木聚糖酶抑制剂的基因;本发明的第二个目的是提供一种木聚糖酶抑制剂的氨基酸序列;
本发明的第三个目的是提供一种含有木聚糖酶抑制剂的重组载体;
本发明的第四个目的是提供一种木聚糖酶抑制剂的表达方法;
本发明的第五个目的是提供一种木聚糖酶抑制剂的分离纯化方法;
本发明的第六个目的是提供一种抑制酵母提前絮凝因子产生的方法。
本发明解决其技术问题采用的技术方案是:
一种木聚糖酶抑制剂的基因,所述基因的核苷酸序列为seqidno:1。hvxi基因(genbank:aj581529.1)g+c含量高达72.6%,本发明对以密码子为单位的部分碱基进行了优化,优化后的核苷酸序列为seqidno:1。
上述基因编码的木聚糖酶抑制剂的氨基酸序列为seqidno:2。
一种木聚糖酶抑制剂表达载体,包括上述基因序列的重组质粒。
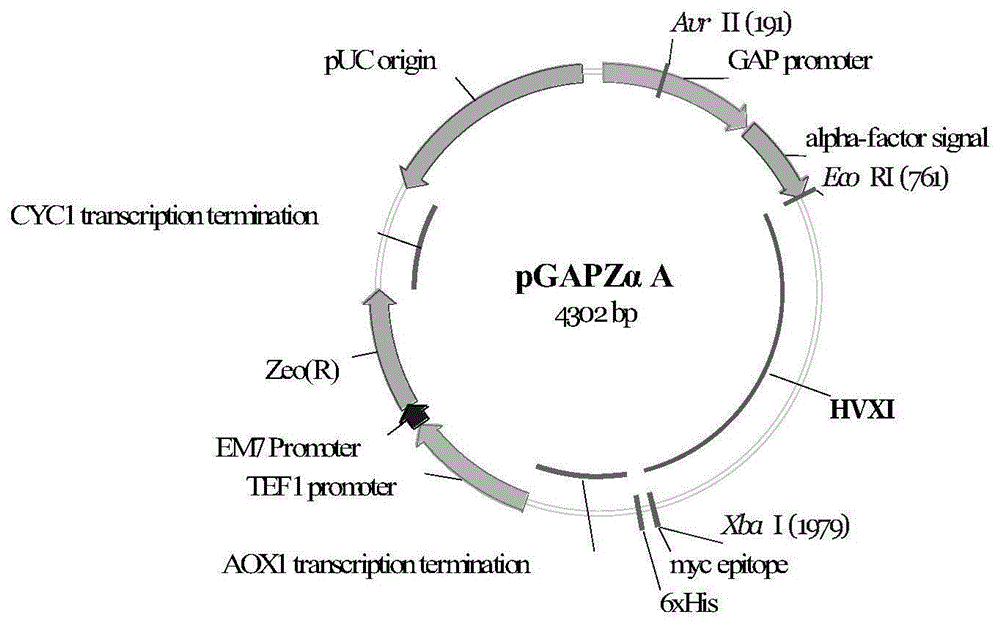
所述表达载体的制备方法如下:扩增木聚糖酶抑制剂的基因,将扩增后的基因经ecori和xbai双酶切后,插入pgapzαa载体,构建组成型gap表达载体。
其中,利用引物扩增木聚糖酶抑制剂的基因,上游引物和下游引物分别如seqidno:3和seqidno:4所示。
一种木聚糖酶抑制剂的表达方法,包括以下步骤,将上述构建好的组成型gap表达载体用限制性内切酶blni(avrii)线性化,然后通过电转,将其转进酵母的感受态细胞中并筛选转化子;将筛选到的菌株,接种于酵母提前絮凝培养基中,30℃恒温摇床振荡培养1-5d;发酵结束后,4℃离心,收集上清液,即可。
优选的,所述酵母为毕赤酵母(pichiapastoris)x33。
优选的,一种木聚糖酶抑制剂的表达方法,包括以下步骤:将上述构建好的组成型gap表达载体用限制性内切酶blni(avrii)线性化,然后通过电转,将其转进毕赤酵母x33的感受态细胞中并筛选转化子;将筛选到的菌株,接种于50mlypd培养基中,于500ml三角瓶中,30℃,250r·min-1恒温摇床振荡培养5d;发酵结束后,4℃,12000×g离心10min,收集上清液,即可。
上述所得木聚糖酶抑制剂的纯化方法,将上清液过0.22μm膜,经过histraptmexcel色谱柱,得纯化后的木聚糖酶抑制剂,采用sds-page电泳检验分离效果。
本发明还保护上述木聚糖酶抑制剂在抑制酵母提前絮凝因子产生中的应用。
一种抑制酵母提前絮凝因子产生的方法,取上述所得木聚糖酶抑制剂,将其用于啤酒发酵过程,即可。
一种抑制酵母提前絮凝因子产生的方法,首先通过基因合成、构建重组载体、酵母转化、目的蛋白表达以及分离纯化得到改性木聚糖酶抑制剂,再将其用于啤酒发酵过程,即可。
具体地,将内切木聚糖酶50u溶于100ml醋酸钠溶液中,加入0.5g木聚糖,及2l发酵液分离纯化的rhvxi约80mg,37℃酶解,10000g离心5min,收集上清液,并加入40%(v/v)乙醇对酶解液中的多糖进行4℃沉淀过夜,12000g离心10min去除上清,沉淀用1ml热水溶解备用,其中,醋酸钠溶液如下:0.1mol·l-1,ph5.5,牛白蛋白含量0.5mg·ml-1。
有益效果
(1)经重组蛋白rhvxi活性测定,筛选到一个转化子gap/s-11,对黑曲霉内切木聚糖酶的抑制活性达40%。重组蛋白rhvxi可以抑制阿拉伯木聚糖酶对阿拉伯木聚糖的水解作用,即抑制pyf因子的产生。
附图说明
图1重组质粒pgapzαa-hvxi的构建;
图2转化菌株gap/s(s-no.)表达重组蛋白rhvxi对黑曲霉内切木聚糖酶的抑制活性;
图3p.pastorisgap/s-11菌株发酵过程中发酵液中蛋白质含量;
图4p.pastorisgap/s-11菌株发酵过程中表达蛋白的sds-page分析;上样量20μl,发酵每24h取样,共发酵5d(1-5泳道);
图5rhvxi分离纯化(上样量20μl)的sds-page图;泳道m:蛋白marker;1:色谱柱纯化;s-11:gap/s-11菌株发酵5d后的上层发酵液;x-33:空载菌株x33发酵5d后的上层清液;
图6重组蛋白rhvxi糖化初始添加对pyf+麦芽pyf的抑制作用蛋白添加量a:2.5mg·50g-1麦芽和b:5.0mg·50g-1麦芽;
图7重组蛋白rhvxi对pyf因子产生的抑制作用。
具体实施方式
以下结合实施例对本发明做进一步详细说明。所用试剂或者仪器设备未注明生产厂商的,均视为可以通过市场购买的常规产品。
实施过程所用酵母菌株均保存于江南大学粮食发酵与技术国家工程实验室。
实施例1:
步骤1:hvxi基因合成。hvxi基因(genbank:aj581529.1)g+c含量高达72.6%,为了便于合成操作,以密码子为单位的部分碱基,对其进行了优化,如seqidno:1所示。
按照技术方案步骤2:毕赤酵母克隆载体和表达载体的构建。经密码子优化的hvxi基因通过引物扩增,扩增后的基因序列经ecori和xbai双酶切后,插入pgapzαa载体,构建组成型gap表达载体;
其中,上游引物:
下游引物:ttttctaaaagttcaagttgcc,seqidno:4;
所述毕赤酵母质粒:
pgapzαa-hvxi(ecori)+:aatgaattc
pgapzαa-hvxi(xbai)-:acatctagattctaaaagttcaagttgccgc。
按照技术方案步骤3:毕赤酵母转化及目的蛋白表达。将构建好的组成型gap表达载体用限制性内切酶blni(avrii)将其线性化,然后通过电转,将其转进毕赤酵母x33的感受态细胞中并筛选转化子。将筛选到的菌株,接种于50mlypd培养基中,于500ml三角瓶中,30℃,250r·min-1恒温摇床振荡培养5d。发酵结束后,4℃,12000g离心10min,收集上清液备用。
按照技术方案步骤4:rhvxi分离纯化。将重组菌发酵液过0.22μm膜,经过histraptmexcel色谱柱,操作方法按照该色谱柱的说明书进行,上样量为10ml,按峰收集流出液,并sds-page电泳检验分离效果。
按照技术方案步骤5:阿拉伯木聚糖酶解液的制备及对pyf的影响
(1)fax-40%:将内切木聚糖酶50u溶于100ml醋酸钠溶液中(0.1mol·l-1,ph5.5,牛白蛋白含量0.5mg·ml-1),加入0.5g木聚糖,37℃酶解5h,10000g离心5min,收集上清液,并加入40%(v/v)乙醇对酶解液中的多糖进行4℃沉淀过夜,12000g离心10min去除上清,沉淀用1ml热水溶解备用。40%乙醇沉淀后的阿拉伯木聚糖含量约为17mg。
(2)fax(rhvxi)-40%:将内切木聚糖酶50u溶于100ml醋酸钠溶液中(同上),加入0.5g木聚糖,及2l发酵液分离纯化的rhvxi约80mg,37℃酶解,10000g离心5min,收集上清液,并加入40%(v/v)乙醇对酶解液中的多糖进行4℃沉淀过夜,12000g离心10min去除上清,沉淀用1ml热水溶解备用。
(3)g3-40%:称取0.1gpyf+麦汁(g3)40%乙醇沉淀的多糖,含阿拉伯木糖17mg,溶于1ml热水备用。
以空白水为对照,测定以上溶液对酵母提前絮凝的影响。
具体测定方法如下:
(1)rhvxi活性测定方法
将内切木聚糖酶溶于0.1mol·l-1,ph5.5醋酸钠溶液中(牛白蛋白含量0.5mg·ml-1),适当稀释后备用。
木聚糖酶活性的测定参照《饲料添加剂木聚糖酶活力的测定分光光度法》gb/t23874-2009。当表达蛋白存在和不存在时,测定其内切木聚糖酶的酶活,以此得出rhvxi对内切木聚糖酶的抑制活性。具体方法如下:内切木聚糖酶溶液1ml,加入发酵后的上层清液1ml,室温反应30min,然后加入木聚糖溶液,37℃恒温水浴30min,加入5mldns终止反应,并按照gb/t23874-2009测定剩余的木聚糖酶酶活。一个酶活力单位的木聚糖酶酶活定义为在测定条件下,每分钟降解木聚糖产生释放1μmol的木糖所需要的酶量。木聚糖酶抑制剂活性(%)定义为在rhvxi存在时,被抑制的内切木聚糖酶活力。
(2)蛋白质含量测定
测定蛋白质含量采用bradford法,以牛血清白蛋白溶液做标准液,制作标准曲线。
(3)快速测定麦汁中pyf因子-吸光度法
对协定糖化麦汁进行快速提取pyf因子并测定其对酵母絮凝的影响。
将斜面保藏酵母,接种到3ml灭菌酵母培养基,25℃培养24h,然后将500μl酵母培养液转接到30ml灭菌酵母培养基中,25℃,180r·min-1摇床培养,收集对数生长后期(培养36h)的酵母,4℃,1500×g离心10min,收集酵母,用去离子水洗涤一次,再用100mmol·l-1edta(ph8.0)洗涤2次,去离子水洗涤2次,然后用15ml去离子水重悬菌体,并测定其a600,4℃冰箱保存备用。
用50mmol·l-1naac,0.1%cacl2重悬菌体,调整其a600为3.0,取2.6ml此酵母悬液和400μl待测定样品,加入4ml比色皿中,用石蜡膜封口,颠倒40次后,室温放置30min,后10次颠倒,4次缓慢颠倒,静置3min后测定a600。以400μl水为空白样,样品中pyf因子的测定值为=加样品a600/加水a600。
结果与分析
1.hvxi基因组成型表达载体的构建及转化
因基因合成的需要,hvxi基因以密码子为单位的部分碱基经优化后,前段和后端分别加入ecori和xbai酶切位点,共1230bp。将带酶切位点的hvxi基因,插入pgapzαa质粒,构建以组成型启动子gap调控的重组蛋白表达载体(见图1)。将成功构建的质粒,用限制性内切酶blni(avrii)将其线性化,然后通过电转,将其转化进入宿主x33的感受态细胞,使其插入宿主细胞基因组,并用ypd抗性标记zeocin平板筛选。组成型菌株转化子标记为gap/s。
挑取抗性平板转化子,快速提取基因组dna,pcr验证插入宿主x33基因组的外源基因。经pcr验证,共得到gap/s转化菌株14株,用gap/s-no.标记。
2.重组蛋白rhvxi的表达及活性测定
将成功转化的菌株gap/s接种于pyd培养基中进行重组表达,同时空转化菌株x33作为空白对照进行发酵实验。发酵5d后,离心发酵液,分离菌体和上层清液,测定上层清液中的rhvxi对a.niger内切木聚糖酶的抑制作用。基于对木聚糖酶活性的抑制作用,对gap/s(14个)转化子进行了筛选(见图2)。
由图2可以看出,转化子gap/s-11具有最高的rhvxi活性,对内切木聚糖酶的抑制活性达40%。
选择重组蛋白表达具有最高活性的gap/s-11菌株进行发酵实验,每24h取样,对发酵过程中蛋白含量(见图3)和表达蛋白质rhvxi进行sds-page分析(见图4)。
由图3可以看出,随着发酵天数的增加,重组菌发酵液中蛋白质含量逐渐升高,在发酵5d时,蛋白含量达到最大,因此在后续的实验中对重组菌发酵产生rhvxi蛋白的发酵时间为5d。通过对发酵液蛋白质sds-page分析(图4),可以看出,在标准分子量45kda条带上面,有一条稍微弱的条带,随着发酵的进行,发酵3d时,条带最亮明显,而空载x33中则没有出现这一条带,但x33在该条带稍高一点的位置出现了同样微弱的条带。为了进一步验证该条带蛋白,对其进行了质谱鉴定,确定其为xylanaseinhibitor[hordeumvulgare]。
3.重组蛋白rhvxi的分离纯化
rhvxi在毕赤酵母x33中的表达属于分泌型蛋白,因其构建载体中含有his标签,故而首先选择亲和色谱柱镍(ni)柱对表达蛋白进行分离纯化。对gap/s-11菌株进行发酵实验,发酵5d后,离心发酵液收集上层清液,过膜处理后,对上层清液过histraptmexcel色谱柱,上样量为10ml,上样流速0.2ml·min-1,洗脱液比例为55%~75%,按峰收集流出液,并sds-page电泳检验分离效果,结果见图5所示。
4.重组蛋白rhvxi对pyf因子产生的抑制作用
将分离纯化的rhvxi蛋白,在协定糖化初始添加,研究其在糖化过程中对麦芽pyf的抑制效果。对pyf+(g3)麦芽协定糖化初始添加rhvxi蛋白,添加量为a:2.5mg·50g-1麦芽和b:5.0mg·50g-1麦芽。采用快速测定麦汁中pyf因子的比色法比较添加rhvxi蛋白对阳性麦芽pyf的抑制作用,结果见图6。
由图6可以看出,糖化初始添加重组蛋白rhvxi后,其麦汁中pyf因子对酵母提前絮凝的影响(g3+a和g3+b)相比pyf+麦芽(g3)有所降低,随着添加量的增加,其pyf现象显著减轻。
由麦芽中pyf因子的形成机制,即微生物侵染田间大麦或制麦过程的大麦,产生阿拉伯木聚糖酶,降解大麦或麦芽皮壳,甚至是大麦内部的胚乳细胞壁,产生不同分子量的多糖(统称为pyf因子),此种多糖经制麦、糖化进入发酵液,影响酵母的絮凝,导致pyf发生,可以确定,麦芽中pyf因子的产生主要在受微生物侵染时。虽然制麦过程的焙焦阶段会杀死大量微生物,但最终成品麦芽中的活菌数仍要比大麦中的多。附着在大麦表面的耐热真菌,高温不能将菌体完全杀死,且部分微生物如曲霉、分支孢菌属、青霉菌仍继续生长,因此麦芽在糖化过程中,残留的微生物会继续作用,产生pyf因子。糖化过程中添加hvxi可以抑制残存的微生物的作用,因此对成品麦芽pyf倾向性的具有抑制效果。
实验另对g3-40%、阿拉伯木聚糖酶降解阿拉伯木聚糖所得40%乙醇沉淀组分、以及在酶解过程中添加rhvxi,相同条件下作用所得40%乙醇沉淀组分,进行了pyf检测。实验结果见图7。
由图7可以看出,通过快速测定pyf因子对酵母提前絮凝的影响作用发现,pyf+(g3)麦汁经40%乙醇沉淀组分(g3-40%)可以导致pyf发生;阿拉伯木聚糖经木聚糖酶作用后,同样40%乙醇沉淀组分(fax-40%)相比g3-40%可以导致更加严重的pyf;而在阿拉伯木聚糖酶解过程中添加rhvxi(fax(rhvxi)-40%),a600与空白水的比值大于0.8,即没有pyf。由此可以说明,rhvxi抑制了酶f对阿拉伯木聚糖的降解,从而使得40%乙醇沉淀组分中pyf因子大量减少,不能导致pyf发生。即rhvxi可以抑制微生物木聚糖酶的产生,并降低或抑制了pyf因子的产生,使得啤酒发酵过程中不再产生pyf。若将rhvxi推广应用到田间大麦或制麦过程中,在微生物生长繁殖阶段抑制微生物木聚糖酶的作用,同样可以发挥其抑制作用,从而抑制麦芽中pyf因子的产生,这对解决pyf问题具有重要的现实意义。
本发明的保护内容不局限于以上实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求为保护范围。
序列表
<110>盐城工学院
<120>一种抑制酵母提前絮凝因子产生的方法
<160>4
<170>siposequencelisting1.0
<210>1
<211>1230
<212>dna
<213>人工序列(artificialsequence)
<400>1
attgaattcatggctcgtgtgctgctgctggcactggcagctaccctggctgcacaagca60
tcttctaaggctctgcctgtactggcaccagttactaaagacgccgctacttccctgtac120
accatcccattccacgacggcgcaaacctggttctggacgtcgctggcccactggtttgg180
tccacctgtgatggtggtcaacgtccacctccagcagaaatcacgtgctcctcccctact240
tgtctgctggctaacgcatacccagcaccaggttgcccagctccatcttgtggttccgat300
cgtcacgacaagccatgtaccgcatatccttccaaccctgtcacgggtgcatgcgcagca360
ggttccctgttccgtgcacgtctggttgcaaacattaccgacggcaaccgtcctgtttcc420
gctgtgactgtgggtgtgctggccgcatgtgctcctactaaactgctggcctctctgcct480
cgtggttctactggtgttgcaggtctggcaggctctggtctggccctgcctgctcaggta540
gcttctgctcagaaagtttctcaccgtttcctgctgtgcctgccaactggcggtgcaggt600
gttgctatcctgggcggtggtcctctgccttggcctcagttcacccagtctatggcttac660
acccctctggtagctaaacagggttctccagcacattacgtgtctggtacctctatccgt720
gtggaggatacccgtgtgcctgttcctgatcgtgcactggctaccggcggtgttatgctg780
tccacgcgtctgccttacgtactgctgcgtcgtgatgtttaccgtccattcgtggatgct840
ttcgccaaagccctggccgctcagcatgctaacggtgctctggctgctcgtggcgtaaac900
ccagtagccccattcggcctgtgctatgacgccaaaaccctgggtaacaacctgggtggt960
tattccgttccaaacgtcgttctggctctggacggcggtggcgaatgggccatgaccggc1020
aaaaactccatggttgatgtaaaaccaggcaccgcctgcgtggccttcgtggaaatggaa1080
gccggcgatggtggcgcccctgccgtcattctgggcggcgcccagatggaagacttcgtc1140
ctggactttgacatggagaaaaagcgtctgggctttatccgtctgccacactttacgggc1200
tgcggcaatctgaatttttaatctagaaca1230
<210>2
<211>403
<212>prt
<213>人工序列(artificialsequence)
<400>2
metalaargvalleuleuleualaleualaalathrleualaalagln
151015
alaserserlysalaleuprovalleualaprovalthrlysaspala
202530
alathrserleutyrthrileprophehisaspglyalaasnleuval
354045
leuaspvalalaglyproleuvaltrpserthrcysaspglyglygln
505560
argproproproalagluilethrcysserserprothrcysleuleu
65707580
alaasnalatyrproalaproglycysproalaprosercysglyser
859095
asparghisasplysprocysthralatyrproserasnprovalthr
100105110
glyalacysalaalaglyserleupheargalaargleuvalalaasn
115120125
ilethraspglyasnargprovalseralavalthrvalglyvalleu
130135140
alaalacysalaprothrlysleuleualaserleuproargglyser
145150155160
thrglyvalalaglyleualaglyserglyleualaleuproalagln
165170175
valalaseralaglnlysvalserhisargpheleuleucysleupro
180185190
thrglyglyalaglyvalalaileleuglyglyglyproleuprotrp
195200205
proglnphethrglnsermetalatyrthrproleuvalalalysgln
210215220
glyserproalahistyrvalserglythrserileargvalgluasp
225230235240
thrargvalprovalproaspargalaleualathrglyglyvalmet
245250255
leuserthrargleuprotyrvalleuleuargargaspvaltyrarg
260265270
prophevalaspalaphealalysalaleualaalaglnhisalaasn
275280285
glyalaleualaalaargglyvalasnprovalalapropheglyleu
290295300
cystyraspalalysthrleuglyasnasnleuglyglytyrserval
305310315320
proasnvalvalleualaleuaspglyglyglyglutrpalametthr
325330335
glylysasnsermetvalaspvallysproglythralacysvalala
340345350
phevalglumetglualaglyaspglyglyalaproalavalileleu
355360365
glyglyalaglnmetgluaspphevalleuasppheaspmetglulys
370375380
lysargleuglypheileargleuprohisphethrglycysglyasn
385390395400
leuasnphe
<210>4
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>4
cagttcacgcagtccatggcac22
<210>4
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>4
ttttctaaaagttcaagttgcc22
- 还没有人留言评论。精彩留言会获得点赞!