一种姜黄素衍生物的制备方法和其抗前列腺癌的应用与流程
单位:温州医科大学附属第二医院
发明人:王义炎、葛仁山、朱琦琦、李晓珩、李林溪
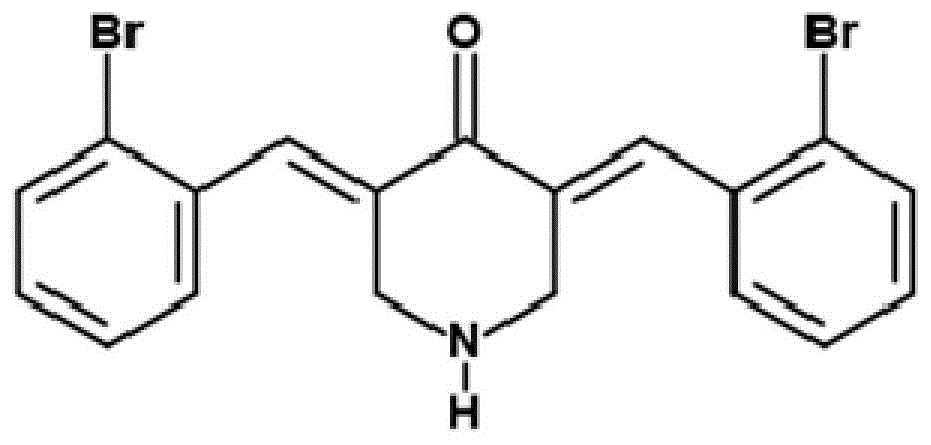
本发明涉及药物合成技术领域,特别涉及一种姜黄素衍生物(3e,5e)-3,5-双(2-溴-苯亚甲基)哌啶-4-酮的制备方法和其抗前列腺癌的应用。
背景技术:
目前,由于经济发展和人类平均寿命的延长,肿瘤疾病的发病率和致死率不断提高,其中前列腺癌的危害日益严重,是男性人群中的主要癌症发病因素之一。
正常前列腺细胞和恶性前列腺癌细胞至少在早期依赖于雄激素。雄激素与雄激素受体结合从而刺激细胞的生长和增生。雄激素撤离中断前列腺细胞的生长。这种中断导致细胞凋亡。因此,调节微环境中的雄激素对于前列腺癌治疗起了重要的作用,可以降低病人死亡率,增加其生存率。
在正常男性,雄激素的平衡是由下丘脑脉冲式释放促性腺激素释放激素(gnrh),也称为黄体激素释放激素(lhrh)。gnrh从下丘脑运输到垂体前叶大约90至120分钟释放。在脑垂体,gnrh结合gnrh受体促进释放黄体促性腺激素(lh)。lh从垂体分泌而进入全身血液循环。lh结合睾丸间质细胞上的lh受体,刺激睾酮生成。睾酮又结合下丘脑和垂体的雄激素受体负反馈作用抑制gnrh和lh释放,而调节睾酮水平。
目前,对于前列腺癌治疗中,减少循环中睾酮水平主要的方法是使用lhrh受体激动剂和拮抗剂、外科睾丸切除术和使用雌激素。有时也使用抗雄激素(甾体和非甾体类),但它们不直接减少循环雄激素水平。
雌激素的应用,如己烯雌酚,已经用于治疗晚期前列腺癌。这个机制包括抑制下丘脑lhrh释放从而抑制lh分泌,进一步抑制睾丸生产睾酮。也可能对前列腺细胞有直接的细胞毒性效应。血清睾酮水平在1到2周内开始下降。尽管己烯雌酚有效地降低睾丸睾酮分泌,但是人们对其安全性担忧。如己烯雌酚有心血管和血栓形成的风险。目前不认为它是主流的疗法。
双侧睾丸切除术的应用。双侧睾丸切除是传统激素治疗的金标准。睾酮的半衰期约为45分钟。实行双侧睾丸切除术,睾酮约在8.6±3.2小时达到最低点。对于癌症转移的患者,双侧睾丸切除术会在24至48小时内显著改善症状。睾酮平均下降至0.15ng/ml。目前睾丸切除术很少应用。有以下几个原因:(1)睾丸切除术过程是不可逆的;(2)睾丸切除术造成显著心理影响;(3)包膜下睾丸切除术,导致白膜和附睾不保,有害心理健康。
目前所用的细胞毒性抗前列腺肿瘤药物的选择性不高,靶向雄激素后又造成雄激素不敏感的前列腺肿瘤。开发新型的细胞毒性抗前列腺肿瘤药物是世界范围内的研究热点,我们也致力于这类药物的研究。
yes相关蛋白2(yap2)是个肿瘤基因。hippo-yap2信号通路通过激酶级联反应调节细胞的增殖和凋亡。当细胞受到外界刺激后激活细胞膜受体,导致一系列的激酶级联反应,从而磷酸化大型肿瘤抑制激酶1/2(lats1/2),磷酸化的lats1/2进一步磷酸化下游的yes相关蛋白(yap)。yap127位点磷酸化后与14-3-3结合导致yap滞留在胞质内,滞留在胞质内的磷酸化yap通过泛素化或者其他降解途径被降解。非磷酸化或者非127位点磷酸化的yap进入细胞核内,作为辅助因子结合tea结构域转录因子(tead),tead含有脱氧核糖核酸(dna)结合域,能够结合下游功能基因,从而发挥其促进增殖或凋亡的功能。yap2和lats1作为该信号通路的靶因子,其mrna和蛋白的表达水平与该化合物的浓度呈负相关,yap的增加导致前列腺癌的恶性转移。
因此化合物(i)可能成为晚期前列腺癌治疗中的一个具有潜力的候选药物,靶向yap通路,可以用于开发成治疗前列腺癌的药物。
技术实现要素:
有鉴于此,本发明目的在于提供一类姜黄素衍生物(3e,5e)-3,5-双(2-溴-苯亚甲基)哌啶-4-酮的制备方法和其抗前列腺癌的应用,本发明提供的姜黄素衍生物的生物利用率高。
本发明提供了一种具有式i所示结构的姜黄素衍生物:
本发明提供了上述具有式i所示结构的姜黄素衍生物的制备方法,包括以下步骤:
1)冰浴下将具有式ii所示结构的化合物、具有式iii结构的化合物、碱金属氢氧化物和甲醇混合,然后撤去冰浴,室温搅拌过夜进行醛酮缩合反应,得到具有式i所示结构的化合物,以乙酸乙酯萃取,有机相用饱和食盐水洗涤,以无水硫酸钠干燥,以石油醚:乙酸乙酯=1:3(体积比)柱层析,收集馏分旋干,真空干燥即得得到i所示结构的化合物的纯品。
9、优选地,所述步骤1)中具有式ii所示结构的化合物、具有式iii结构的化合物和碱金属氢氧化物的用量当量比为1:2.1:7.5。甲醇作为溶剂。
优选地,所述步骤1)中碱金属氢氧化物为氢氧化钾和/或氢氧化钠。
优选地,所述步骤1)醛酮缩合反应的温度为室温,时间为12小时。
本发明还提供了上述具有式i所示结构的姜黄素衍生物在制备抗前列腺癌的药物中的应用,所述抗前列腺癌的药物由具有式i所示结构的姜黄素衍生物和其药学上可接受的载体制备得到。
优选地,所述抗前列腺癌的药物的制剂的形式包括固体制剂或液体制剂。
优选地,所述固体制剂包括片剂、缓释片、控释片、胶囊、滴丸、微丸、散剂或颗粒剂;所述液体制剂包括混悬剂、乳剂、口服液、灭菌的水性或油性溶液、无菌粉针、脂质体或乳剂。
有益技术效果:本发明提供了一种具有式i所示结构的姜黄素衍生物和其应用,本发明提供的姜黄素衍生物对前列腺癌细胞株pc3和du145具有抑制作用,通过诱导细胞凋亡而杀死癌细胞,本发明提供的姜黄素衍生物(3e,5e)-3,5-双(2-溴-苯亚甲基)哌啶-4-酮,哌啶结构增加了其生物利用度,可将其用于制备抗前列腺癌的药物。
本发明还提供了具有式i所示结构的姜黄素衍生物的制备方法,本发明提供的制备方法制备得到的姜黄素衍生物纯度可达99%以上。
附图说明:
图1为实施例1中得到的目标产物化合物i的结构图
图2为实施例1中得到的目标产物化合物i的hplc-pda测定结果;
图3为对实施例1中纯化后的目标产物化合物i的hplc-elsd测定结果;
图4为对实施例1中纯化后的目标产物化合物i的hplc-ms测定结果;
图5为实施例1中纯化后的目标产物化合物i的核磁共振氢谱图;
图6为不同浓度的实施例1中得到的目标产物化合物i作用24、48、72小时后pc3前列腺癌细胞存活率图(h为小时);
图7为不同浓度的实施例1中得到的目标产物化合物i作用24、48、72小时后du145前列腺癌细胞存活率图(h为小时);
图8为不同浓度的实施例1中得到的目标产物化合物i作用24后pc3和du145前列腺癌细胞yap-2基因的信使核糖核酸(mrna)水平;
图9为实施例1中得到的化合物i作用pc3细胞后的细胞存活率和半数抑制浓度;
图10为为实施例1中得到的化合物i作用du145细胞后的细胞存活率和半数抑制浓度;
图11为不同浓度实施例1中得到的化合物i作用于pc3和du145细胞的集落形成率;
具体实施方式
本发明提供了一种具有式i所示结构的姜黄素衍生物:
本发明提供了上述具有式i所示结构的姜黄素衍生物的制备方法,包括以下步骤:
1)冰浴下将具有式ii所示结构的化合物、具有式iii结构的化合物、碱金属氢氧化物和甲醇混合,然后撤去冰浴,室温搅拌过夜进行醛酮缩合反应,得到具有式i所示结构的化合物,以乙酸乙酯萃取,有机相用饱和食盐水洗涤,以无水硫酸钠干燥,以石油醚:乙酸乙酯=1:3(体积比)柱层析,收集馏分旋干,真空干燥即得得到i所示结构的化合物的纯品。
10、在本发明中,具有式ii所示结构的化合物、具有式iii结构的化合物和碱金属氢氧化物的用量当量比优选为1:2.1:7.5。甲醇作为溶剂。
在本发明中,所述碱金属氢氧化物优选为氢氧化钾和/或氢氧化钠。
在本发明中,所述醛酮缩合反应的温度优选为室温;所述醛酮缩合反应的时间优选为12小时。在本发明中,所述醛酮缩合反应优选在搅拌条件下进行,本发明对搅拌条件没有特殊限定,选用本领域技术人员熟知的搅拌条件即可。
本发明对具有式ii所示结构的化合物、具有式iii结构的化合物、碱金属氢氧化物和甲醇混合的方法没有特殊限定,选用本领域技术人员熟知的混合方法即可。本发明优选为在冰浴条件下先将具有式iii结构的化合物、碱金属氢氧化物和甲醇混合,然后分批加入碱金属氢氧化物。在本发明中,所述碱金属氢氧化物分批加入的批次优选为1次。
在本发明中,所述醛酮缩合反应后还优选依次包括加入水猝灭反应、乙酸乙酯萃取、饱和食盐水洗涤和无水硫酸钠干燥。
本发明对加水淬灭反应的方法没有特殊限定,选用本领域技术人员熟知的方法即可。
在本发明中,所述乙酸乙酯萃取优选为对加水淬灭反应后所得产物进行萃取,得到有机相。本发明对萃取的方法和次数没有特殊限定,选用本领域即似乎人员熟知的方法和次数即可。
在本发明中,所述饱和食盐水洗涤优选为对乙酸乙酯萃取后所得有机相进行食盐水洗涤,得到有机相。本发明对饱和食盐水洗涤的方法没有特殊限定,选用本领域技术人员熟知的方法即可。
在本发明中,所述无水硫酸钠干燥优选为对和食盐水洗涤后所得有机相进行干燥,得到具有式i所示结构的化合物。
在本发明中,所述旋干的温度优选为室温。本发明对旋干的方法没有特殊限定,选用本领域技术人员熟知的旋干方法即可。
本发明还提供了上述具有式i所示结构的姜黄素衍生物在制备抗前列腺癌的药物中的应用,所述抗前列腺癌的药物由具有式i所示结构的姜黄素衍生物和其药学上可接受的载体制备得到。
在本发明中,所述抗前列腺癌的药物的制剂的形式优选包括固体制剂或液体制剂。
在本发明中,所述固体制剂优选包括片剂、缓释片、控释片、胶囊、滴丸、微丸、散剂或颗粒剂;所述液体制剂优选包括混悬剂、乳剂、口服液、灭菌的水性或油性溶液、无菌粉针、脂质体或乳剂。
为了更好地理解本发明,下面结合实施例进一步阐明本发明的内容,但本发明的内容不仅仅局限于下面的实施例。
实施例1及应用冰浴下将氢氧化钠(7.5当量)分批加入化合物ii(1当量)和化合物iii(2.1当量)的甲醇溶液中,撤去冰浴,室温搅拌过夜;过夜后加水淬灭反应,以乙酸乙酯萃取2到3次,合并的有机相用饱和食盐水洗涤,以无水硫酸钠干燥;抽滤,旋干,以石油醚:乙酸乙酯=1:3柱层析,收集馏分旋干,然后真空干燥即得化合物i(如图1)。合成反应路径如下:
实施例1中得到的目标产物i的hplc-pda测定结果如图2所示,峰值1.795的峰面积值为99.690%,表明目标产物的纯度为99.690%。
实施例1中得到的目标产物i的hplc-elsd含量测定结果见图3,峰值1.920的峰面积值为99.455%,说明以上合成方法可以制得化合物i,且其纯度达到99%以上。
实施例1中得到的目标产物i的hplc-ms和核磁共振检测结果分别如图4和图5所示,hplc-ms正离子模式下的峰值为434,与化合物i的相对分子质量(433.14)一致。
实施例1中得到的姜黄素衍生物i对前列腺癌细胞形态的影响:
细胞培养方法如下:pc3细胞株培养于含10%进口胎牛血清的f-12培养基中,另加左旋谷氨酰胺(l-glutamine)300mg1.5g/l碳酸氢钠(nahco3)和抗生素(100u/青霉素和100mg/l链霉素);du145和pc3细胞株培养于含10%进口胎牛血清的mem培养基中,另加0.11g/l的丙酮酸钠(sodiumpyruvate)和抗生素(100u/青霉素和100mg/l链霉素)。两种细胞均置于37摄氏度、饱和湿度、含5%二氧化碳(co2)气体的培养箱中培养。
细胞传代方法如下:
a.于倒置相差显微镜观察细胞长到80%左右,即可传代。传代前用紫外灯照射超净工作台半小时以上,及用75%酒精擦拭工作台及双手。
b.用枪头吸去培养瓶中的旧培养液,用磷酸盐缓冲液(pbs)清洗2次。
c.加入胰酶2ml/1ml(75cm2/25cm2培养瓶)进行消化,静止约3分钟,并不时在倒置相差显微镜下观察,当胞质回缩,细胞间不再连接成片时,加入适量含血清培养液终止胰蛋白酶的作用。
d.用滴管将已经消化的细胞吹打成细胞悬液,吸入至15ml离心管,离心5分钟1000转。
e.弃去上清液,用pbs洗两遍,最后弃去上清液,加入5ml培养液,用枪头轻轻吹打至细胞悬液,1:2~1:3分装入新的培养瓶,添加适量培养液于培养箱中继续培养。
细胞形态学观察:将对数生长期和细胞接种于培养皿,过夜培养后分为两组,一组不做任何处理,作为对照组,另一组加入2um浓度的化合物i处理,化合物i溶剂为二甲基亚砜(dmso),作为实验组,6小时、12小时、24小时后分别在倒置相差显微镜下观察细胞形态改变并记录。
由显微镜下观察可知,镜下见对照组细胞贴壁生长,相邻细胞融合成片,细胞呈类圆形或梭形,体积较大,排列紧密,边缘光滑,胞质饱满,核膜、核仁等结构轮廓明显,细胞生长迅速,经化合物处理后,细胞密度逐渐降低,生长速度明显减慢至几乎停滞,细胞逐渐脱落并漂浮于培养液中。细胞体积缩小,胞膜皱缩,成小圆形或不规则形态,胞内多见小颗粒状物质。药物作用时间越长,细胞形态学改变越明显。说明化合物i能够促使前列腺癌细胞株pc3和du145细胞体积减小从而诱导其凋亡。
细胞毒试验(甲基偶氮唑盐法,即mtt法):
a.细胞瓶中的细胞消化成单细胞悬液,细胞计数后按照8000/孔接种于96孔板,每孔加100ul相应的培养基,常规培养于37摄氏度、含5%co2气体的培养箱中,作为实验组。
b.设阴性对照组(有细胞不加药,但加0.1%dmso药物溶剂),空白对照组(有细胞不加药,也不加溶剂),其它与实验组的处理步骤相同。
c.24小时后观察细胞贴壁生长良好,向实验组孔板内分别加入浓度为0.1um、0.25um、0.5um、1um、2um化合物i,每孔设3个重复孔。
d.加药后将96孔板移入37摄氏度、含5%co2气体的培养箱中继续培养24小时。
e.每组实验结束时每孔加mtt液体(5mg/ml)20ul,37摄氏度、含5%co2气体的培养箱继续培养4小时后,吸去上清,每孔加80uldmso,在摇床上摇10分钟。然后用酶标仪中检测在波长450时每孔的吸光度(od)值。
f.将吸光度数值减去空白对照孔平均度数即为细胞mtt检测数据,以非线性回归方法计算出半数致死浓度(ic50)。
图9、图10、图6和图7为0.1um、0.25um、0.5um、1um、2um实施例1中得到的化合物i作用两种细胞24、48、72小时后的存活率。由图9、图10、图6和图7可知,1.0um化合物i作用于pc3和du145细胞24、48、72小时后的存活率分别为12.1%、8.1%、3.2%和36.8%、25.3%、21.4%。2.0um化合物i作用于pc3和du145细胞24、48、72小时后的存活率分别为5.8%、4.3%、1.8%和25.8%、16.2%、11.3%。双因素方差分析后不同浓度与不同时间处理组之间差别具有统计学意义(p<0.05),提示化合物i对pc3和du145的生长抑制作用呈现时间浓度依赖关系。
集落形成试验:对数生长期细胞,计数后按每孔300个细胞接种于6孔板中,每孔加入2ml相应培养液,培养24小时后,分别加入0.1um、0.25um、0.5um、1um、2um实施例1中得到的化合物i,每组设定三个复孔。继续培养14天后,10%甲醇固定,姬姆色素(giemsa)染色,计算每孔集落数(每个集落细胞数大于50)。计算集落形成率:集落总数/接种细胞数×100%。
由分析结果可知,对照组pc3和du145的集落形成率分别为81.33%和67%,而0.1、0.25、0.5、1.0、2.0um的化合物i处理组分别为80%、36.67%、19%、7%、0和64%、28.33、22.33、13%、7.33%(见图11)。以上结果进一步验证了化合物i对pc3和du145前列腺癌细胞具有增殖抑制作用。细胞毒试验和集落形成试验来证明化合物i对前列腺癌细胞株pc3和du145具有抑制作用,且抑制作用具有浓度依赖性和时间依赖性关系。化合物i具有开发成为前列腺癌治疗药物的潜力。
实施例1中得到的姜黄素衍生物i的药理作用机制试验:
以对数生长期pc3和du145细胞,接种适当细胞密度到6cm培养皿中,置于细胞培养箱中培养24小时后,加入0.5um、1um和1.5um的实施例1中得到的姜黄素衍生物化合物i刺激pc3前列腺癌细胞,加入0.1um、0.25um和0.5um的实施例1中得到的姜黄素衍生物化合物i刺激du145前列腺癌细胞,24小时后,用实时荧光定量(qpcr)测定yap2基因的表达量,核糖体蛋白s16(rps16)作为内参。
由试验结果可知,0.5um、1um和1.5um的化合物i刺激pc3前列腺癌细胞,0.1um、0.25um和0.5um的化合物i刺激du145前列腺癌细胞,24小时后,qpcr检测yap2mrna水平的变化,结果显示,随着nl04药物浓度增加,yap2mrna水平逐渐降低(图8)。结果表明,化合物i通过下调yap2基因水平抑制pc3和du145前列腺癌细胞的生长。
- 还没有人留言评论。精彩留言会获得点赞!