一种水蛭活性寡肽的制备方法与流程
本申请涉及一种水蛭活性寡肽的制备方法,属于生物肽的制备领域。
背景技术:
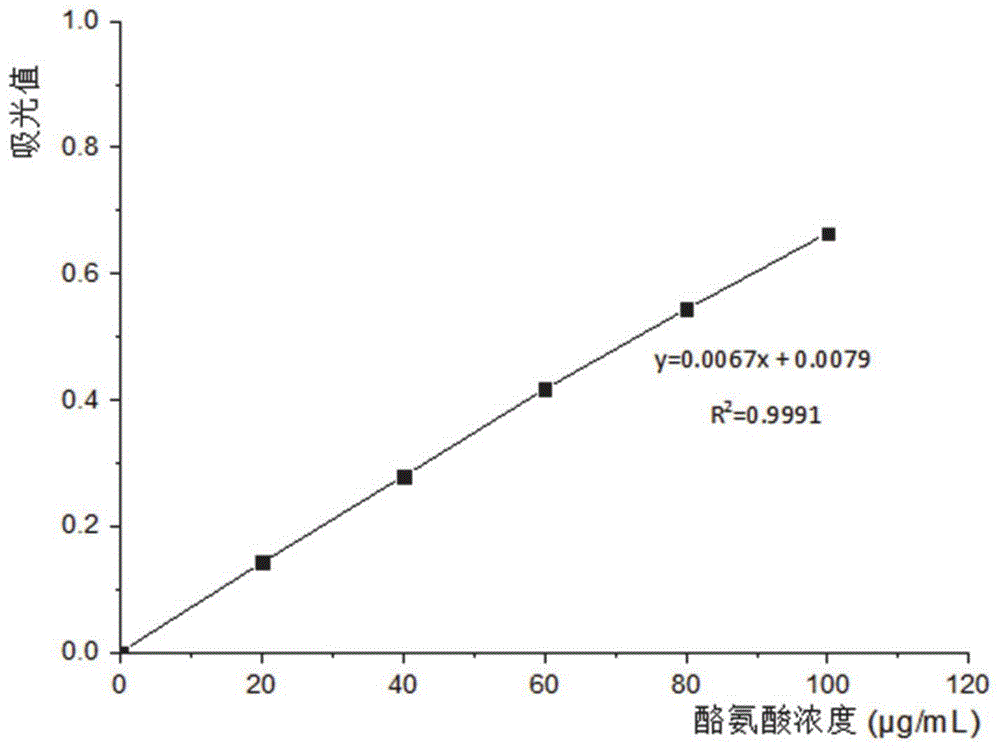
:水蛭始载于《神农本草经》:“主逐恶血,瘀血,月闭,破血瘕积聚,无子,利水道。”具有破血通经、逐瘀消癥之功。现代药理学认为,水蛭具有抗凝、溶栓、抗肿瘤等作用。其抗凝溶栓的活性成分主要是蛋白质、多肽类成分。水蛭唾液中分泌的水蛭素目前被认为最强的抗凝活性物质。但从唾液中提取水蛭素收率低、成本过高,难以大量生产。因此,市场上销售的各种天然水蛭素价格也非常昂贵,纯度、活性难以保证。因此迫切需要一种能够降低成本、简单可行的提取方法,以提高水蛭类抗凝血活性物质在医药和保健领域的应用。水蛭作为中药,传统上采用打粉冲服方式服用,然后经过胃肠道降解后进入体内发挥抗凝溶栓活性,因此水蛭躯体中也一定含有抗凝血活性的功能区片段。目前采用酶法提取水蛭躯体中的活性肽被大量采用,已有不少文献或者专利报道酶法提取水蛭中的活性肽。考虑到人体消化道的天然屏障,只有小分子的肽才能被人体吸收利用。目前这些报道中由于水蛭原料不同,采用的工艺不同,得到的多肽产品有着很大的差异。或者注重高活性肽的提取,而忽略了分子量的大小;或者注重获得寡肽,而忽略了活性的保留。技术实现要素:根据本申请的一个方面,提供了一种水蛭活性寡肽的制备方法,该方法解决了现有技术中水蛭多肽提取物制备方法难以保证多肽分子量较小及分子量分布集中的技术问题、水蛭寡肽制备方法所得产物抗凝血酶活性较低的问题以及水蛭具有腥臭问题。本申请中所述水蛭活性寡肽的制备方法中采取可控酶解的方法,通过优选蛋白酶的种类对水蛭进行酶解,获得既有高活性又具有小分子量的寡肽。在作为药品、保健品或者护肤品时,既保证有较高的生物利用度,又保证其具有较高的活性和稳定性。所述水蛭活性寡肽的制备方法,其特征在于,包括:采用碱性蛋白酶和胰蛋白酶对水蛭进行酶解,得到所述水蛭活性寡肽;其中,所述水蛭活性寡肽的分子量低于500da。可选地,所述水蛭寡肽具有480u/g以上的抗凝血酶活性。可选地,所述水蛭寡肽具有520u/g以上的抗凝血酶活性。可选地,所述水蛭寡肽具有560u/g以上的抗凝血酶活性。可选地,所述水蛭活性寡肽无色无腥臭。可选地,所述酶解的条件为:酶解的ph为7-10;酶解的温度为50-80℃;酶解的时间为1-6小时。可选地,所述酶解的条件中酶解的ph上限选自7.5、8、8.5、9或10;下限选自7、7.5、8、8.5或9。可选地,所述酶解的条件中酶解的温度上限选自55℃、60℃、65℃、70℃、75℃或80℃;下限选自50℃、55℃、60℃、65℃、70℃或75℃。可选地,所述酶解的时间上限选自2小时、3小时、4小时、5小时或6小时;下限选自1小时、2小时、3小时、4小时或5小时。可选地,进行酶解的水蛭为水蛭冻干粉。可选地,所述水蛭冻干粉的获得方法包括:将水蛭活体或其冷冻品解冻,搅拌,得到匀浆液;所述匀浆液冷冻干燥得到冻干粉。可选地,所述水蛭冻干粉加入水中溶解后进行酶解处理。可选地,所述水蛭冻干粉加入10-30倍(重量)水溶解后进行酶解处理。作为其中一种具体的实施方式,所述水蛭活性寡肽的制备方法包括:取冻干粉适量,加5-30倍水溶解后,按冻干粉重量的1%-10%加入碱性蛋白酶,在ph7-10、温度50-80℃,反应1-6小时,再加入1%-10%胰蛋白酶酶,在ph7-10、温度50-80℃反应1-5小时,其后高温灭活,离心,上清液加入活性炭及白陶土,进行脱腥脱色反应后,过滤后,取上清液,调节ph至中性,冷冻干燥,即得低分子高活性的水蛭寡肽。可选地,所述碱性蛋白酶的加入量为水蛭重量的0.8%-10%;所述胰蛋白酶的加入量为水蛭重量的1%-10%;其中,所述水蛭的重量以水蛭冻干粉的重量为准。可选地,所述碱性蛋白酶的加入量为水蛭重量的1%-10%。可选地,所述碱性蛋白酶的加入量为水蛭重量的上限选自0.9%、1%、1.1%、1.4%、1.7%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%或10%;下限选自0.8%、0.9%、1%、1.1%、1.4%、1.7%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%或9.5%。可选地,所述胰蛋白酶的加入量为水蛭重量的上限选自1.1%、1.4%、1.7%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%或10%;下限选自1%、1.1%、1.4%、1.7%、2%、2.5%、3%、3.5%、4%、4.5%、5%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%或9.5%。可选地,所述水蛭活性寡肽的制备方法包括:首先采用碱性蛋白酶对水蛭进行酶解i,然后加入胰蛋白酶进行酶解ii,得到所述水蛭活性寡肽。可选地,所述酶解i的条件为:在ph为7-10,温度为50-80℃,反应为1-6小时的条件下进行酶解;所述酶解ii的条件为:在ph为7-10,温度为50-80℃,反应为1-5小时的条件下进行酶解。可选地,所述酶解i的条件中酶解的ph上限选自7.5、8、8.5、9或10;下限选自7、7.5、8、8.5或9。可选地,所述酶解i的条件中酶解的温度上限选自55℃、60℃、65℃、70℃、75℃或80℃;下限选自50℃、55℃、60℃、65℃、70℃或75℃。可选地,所述酶解i的时间上限选自2小时、3小时、4小时、5小时或6小时;下限选自1小时、2小时、3小时、4小时或5小时。可选地,所述酶解ii的条件中酶解的ph上限选自7.5、8、8.5、9、9.5或10;下限选自7、7.5、8、8.5、9或9.5。可选地,所述酶解ii的条件中酶解的温度上限选自55℃、60℃、65℃、70℃、75℃或80℃;下限选自50℃、55℃、60℃、65℃、70℃或75℃。可选地,所述酶解ii的时间上限选自2小时、3小时、4小时或5小时;下限选自1小时、2小时、3小时或4小时。可选地,所述酶解之后进行灭活处理。可选地,所述灭活处理的条件为:80~100℃处理10~40min。可选地,所述酶解之后进行脱腥脱色处理;所述脱腥脱色处理包括:采用活性炭和白陶土进行脱腥脱色。可选地,所述脱腥脱色处理的条件为:温度为40-70℃;时间为0.3-3小时。可选地,所述活性炭的加入量为酶解液重量的0.5-10%;所述白陶土的加入量为酶解液重量的0.5-10%。所述酶解液为酶解后待处理的酶解液。可选地,酶解后进行灭活,离心处理,得到的上清液为待处理酶解液。可选地,所述脱腥脱色处理过程中温度上限选自50℃、60℃或70℃;下限选自40℃、50℃或60℃。可选地,所述脱腥脱色处理过程中时间上限选自0.5小时、1小时、1.5小时、2小时、2.5小时或3小时;下限选自0.3小时、0.5小时、1小时、1.5小时、2小时或2.5小时。可选地,所述活性炭的加入量为酶解液重量的百分数上限选自1%、2%、2.5%、3%、5%、6%、8%或10%;下限选自0.5%、1%、2%、2.5%、3%、5%、6%或8%。可选地,所述白陶土的加入量为酶解液重量的百分数上限选自1%、2%、2.5%、3%、5%、6%、8%或10%;下限选自0.5%、1%、2%、2.5%、3%、5%、6%或8%。可选地,进行所述脱腥脱色处理后,过滤,取上清液,调节ph至中性,冷冻干燥,得到所述水蛭活性寡肽。可选地,进行酶解的水蛭经过匀浆处理。可选地,所述水蛭活性寡肽的制备方法包括:(1)将水蛭匀浆液冷冻干燥,获得冻干粉;(2)取步骤(1)中所述冻干粉,加水溶解后加入碱性蛋白酶酶解,然后加入胰蛋白酶酶解,灭活,离心得到上清液;(3)将活性炭和白陶土加入到步骤(2)中所述的上清液中,脱腥脱色,过滤后取上清液,调节ph至中性,冷冻干燥,得到所述水蛭活性寡肽。可选地,所述方法制备得到的水蛭活性寡肽在抗凝溶栓的药物、保健品原料、化妆品原料中的应用。作为其中一种具体的实施方式,所述水蛭活性寡肽的制备方法中以水蛭为原料,经匀浆、酶解、脱色脱腥后获得具有高抗凝作用的寡肽。作为其中一种具体的实施方案,所述水蛭活性寡肽的制备方法包括:将水蛭活体或者冷冻品解冻后,放入匀浆机中搅拌至糊状且无块状肉质,制得匀浆液。将匀浆液冷冻干燥后得冻干粉,密封保存备用。取冻干粉适量,加5-30倍水溶解后,按冻干粉重量的0.8%-10%加入碱性蛋白酶,在ph7-10、温度50-80℃,反应1-6小时,再加入1%-10%胰蛋白酶酶,在ph7-10、温度50-80℃反应1-5小时,其后高温灭活,离心,上清液加入活性炭及白陶土,进行脱腥脱色反应后,过滤后,取上清液,调节ph至中性,冷冻干燥,即得低分子高活性的水蛭寡肽。作为其中一种具体的实施方案,所述水蛭活性寡肽的制备方法包括:将水蛭活体,放入匀浆机中搅拌至糊状且无块状肉质,制得匀浆液。将匀浆液冷冻干燥后得冻干粉,密封保存备用。取冻干粉适量,加20倍水溶解后,按冻干粉重量的1.7%加入碱性蛋白酶,在ph9、温度为55度条件下反应2小时,再加入2.5%胰蛋白酶酶,在ph8、60℃之间反应3小时,其后85℃灭活15min,离心,上清液调节ph为3,加入5%活性炭及2.5%白陶土,60℃水浴下进行脱腥脱色反应1h,过滤后,取上清液,调节ph至中性,冷冻干燥,即得低分子高活性的水蛭寡肽。本申请能产生的有益效果包括:(1)本申请所述水蛭活性寡肽的制备方法中结合使用复合酶酶解工艺进行水蛭寡肽提取,控制温度,酸碱度,时间,酶底比的同时,保证所得肽的分子量小且范围稳定,抗凝血活性及多肽保留率高的特点。而现有的提取工艺中,或者注重高活性肽的提取,而忽略了分子量的大小;或者注重获得寡肽,而忽略了活性的保留。(2)与现有的技术相比,本法解决了现有方案中多肽分子量较大及分子量分布不集中的问题以及现有技术中水蛭寡肽制备方法所得产物抗凝血酶活性较低的问题。(3)本申请的制备方法中,选用两种在碱性条件下使用的蛋白酶,反应使用的ph条件相近,制备工艺简单,便于生产;(4)本申请所获得的水蛭活性寡肽可以作为抗凝溶栓的药物、保健品原料,也可以作为化妆品原料使用。附图说明图1为实施例7中酪氨酸溶液标准曲线;图2为实施例8中标准蛋白高效液相色谱图;图3为实施例8中根据保留时间与分子量对数值所得的标准曲线;图4为实施例8中木瓜蛋白酶酶解产物hplc图;图5为实施例8中碱性蛋白酶酶解产物hplc图;图6为实施例8中胰蛋白酶酶解产物hplc色谱图;图7碱性蛋白酶和胰蛋白酶酶解后产物hplc图;图8碱性蛋白酶和木瓜蛋白酶酶解后产物hplc图;图9为实施例12中不同ph条件下活性炭脱色效果图;其中,图中标记分别为活性炭添加量以及ph,从左到右依次为:ph3,3%;ph3,1%;ph4,3%;ph4,1%;ph5,1%;ph5,3%;图10为实施例12中白陶土脱色效果图;从左到右依次为:酶解液原液;白陶土4%;白陶土6%;白陶土8%;图11为实施例12中活性炭和白陶土联合使用脱色效果图;从左到右依次为:原液;5%活性炭,2.5%白陶土;5%活性炭;3%活性炭,2.5%白陶土;1%活性炭,2.5%白陶土。具体实施方式下面结合实施例详述本申请,但本申请并不局限于这些实施例。如无特别说明,本申请的实施例中的原料均通过商业途径购买,其中:水蛭由广西复鑫益集团提供,经鉴定品种为菲牛蛭。酪蛋白(批号:9000719,北京拜尔迪生物技术有限公司),碱性蛋白酶(solarbio,批号:718i022),木瓜蛋白酶(solarbio,批号:518f027),胰蛋白酶(solarbio,批号:310p041),福林酚(solarbio,批号:120i043)。三氯乙酸(aladdin,批号:e1808060),无水碳酸钠(macklin,批号:m33318011),naoh(分析纯,批号:1503041,西陇化工股份有限公司),hcl(分析纯,批号:20170426,北京化工厂),抑肽酶(批号:n26f9w54634,上海源叶科技有限公司),杆菌肽(批号:s19a681,上海源叶科技有限公司),乙氨酸-乙氨酸-乙氨酸(enjy-tech,批号:m10101.5),乙氨酸-乙氨酸-酪氨酸-精氨酸(enjy-tech,批号:m10102.5),乙腈(fisherchemical,批号:184265),甲醇(fisherchemical,批号:164786),三羟甲基氨基甲烷(tris)(批号:77861,北京拜尔迪生物技术有限公司),三氟乙酸(批号:20180112,天津市福晨化学试剂厂),hplc用水为超纯水,其余用水为去离子水。纤维蛋白原(sigmaf8630,批号:ap0036),tt测定试剂盒(批号:121197,上海太阳生物技术有限公司);活性炭(购自北京化工厂,批号20180525);白陶土(购自macklin,批号:m153618079)。本申请的实施例中分析方法如下:采用tu-1901双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司)测定蛋白酶活性及水蛭寡肽脱色率;lg-paber型血小板聚集凝血因子分析仪(北京世帝科学仪器公司)测定凝血酶时间(凝血酶活性);高效液相色谱仪(thermofisherscientific公司)和液相色谱凝胶色谱柱(东曹株式会社,英文名称:tskgelg2000swxl,产品编号:0008540,柱规格:7.8*300)用于测定水蛭寡肽的分子量。本申请的实施例中:ph通过1mol/lnaoh水溶液或hcl进行调节。水蛭匀浆液及其冻干粉的制备将水蛭(菲牛蛭)活体或-80℃冷冻品,解冻后放入匀浆机中搅拌约30min,至糊状且无块状肉质,冷冻干燥24h(温度:-45℃,压强:7.9pa)后得冻干粉,密封保存备用。实施例1将水蛭活体放入匀浆机中搅拌至糊状且无块状肉质,制得匀浆液。将匀浆液冷冻干燥后得冻干粉,密封保存备用。取冻干粉5g,加100ml水中溶解,按冻干粉重量的1.7%加入碱性蛋白酶,在ph为9、温度为55℃条件下反应2小时,再按冻干粉重量的2.5%加入胰蛋白酶,在ph为8、温度为60℃的条件下反应3小时,其后85℃灭活15min,离心,上清液调节ph为3,加入5wt%活性炭及2.5wt%白陶土(以上清液质量为100%计算),60℃水浴下进行脱腥脱色反应1h,过滤后,取上清液,调节ph至中性,冷冻干燥,即得分子量500以下,抗凝活性500u/g以上的水蛭活性寡肽。实施例2将水蛭活体放入匀浆机中搅拌至糊状且无块状肉质,制得匀浆液。将匀浆液冷冻干燥后得冻干粉,密封保存备用。取冻干粉5g,加100ml水中溶解,按冻干粉重量的1.1%加入碱性蛋白酶,在ph为9、温度为55度条件下反应1小时,再按冻干粉重量的2.5%加入胰蛋白酶,在ph为8、温度为60℃的条件下反应4小时,其后85℃灭活15min,离心,上清液调节ph为3,加入3wt%活性炭及2.5wt%白陶土(以上清液质量为100%计算),60℃水浴下进行脱腥脱色反应1h,过滤后,取上清液,调节ph至中性,冷冻干燥,即得分子量500以下,抗凝活性500u/g以上的水蛭活性寡肽。实施例3将水蛭活体放入匀浆机中搅拌至糊状且无块状肉质,制得匀浆液。将匀浆液冷冻干燥后得冻干粉,密封保存备用。取冻干粉5g,加100ml水中溶解,按冻干粉重量的1.4%加入碱性蛋白酶,在ph为8.5、温度为60度条件下反应2小时,再按冻干粉重量的2.5%加入胰蛋白酶,在ph为8、温度为60℃的条件下反应2小时,其后85℃灭活15min,离心,上清液调节ph为3,加入5wt%活性炭及2wt%白陶土(以上清液质量为100%计算),60℃水浴下进行脱腥脱色反应1h,过滤后,取上清液,调节ph至中性,冷冻干燥,即得分子量500以下,抗凝活性500u/g以上的水蛭活性寡肽。实施例4将水蛭活体放入匀浆机中搅拌至糊状且无块状肉质,制得匀浆液。将匀浆液冷冻干燥后得冻干粉,密封保存备用。取冻干粉5g,加100ml水中溶解,按冻干粉重量的1.1%加入碱性蛋白酶,在ph为9.5、温度为65度条件下反应2小时,再按冻干粉重量的2.5%加入胰蛋白酶,在ph为8、温度为60℃的条件下反应2小时,其后85℃灭活15min,离心,上清液调节ph为3,加入5wt%活性炭及3wt%白陶土(以上清液质量为100%计算),60℃水浴下进行脱腥脱色反应1h,过滤后,取上清液,调节ph至中性,冷冻干燥,即得分子量500以下,抗凝活性500u/g以上的水蛭活性寡肽。实施例5将水蛭活体放入匀浆机中搅拌至糊状且无块状肉质,制得匀浆液。将匀浆液冷冻干燥后得冻干粉,密封保存备用。取冻干粉5g,加100ml水中溶解,按冻干粉重量的1.7%加入碱性蛋白酶,在ph为9、温度为60度条件下反应2小时,再2.5%按冻干粉重量的加入胰蛋白酶,在ph为8、温度为60℃的条件下反应3小时,其后85℃灭活15min,离心,上清液调节ph为3,加入3wt%活性炭及6wt%白陶土(以上清液质量为100%计算),60℃水浴下进行脱腥脱色反应1h,过滤后,取上清液,冷冻干燥,即得低分子高活性的水蛭寡肽。实施例6将水蛭活体放入匀浆机中搅拌至糊状且无块状肉质,制得匀浆液。将匀浆液冷冻干燥后得冻干粉,密封保存备用。取冻干粉5g,加100ml水中溶解,按冻干粉重量的1.7%加入碱性蛋白酶和2.5%胰蛋白酶,在ph为8、温度为60度条件下反应3小时,其后85℃灭活15min,离心,上清液调节ph为3,加入5wt%活性炭及2.5wt%白陶土(以上清液质量为100%计算),60℃水浴下进行脱腥脱色反应1h,过滤后,取上清液,调节ph至中性,冷冻干燥,即得分子量500以下,抗凝活性500u/g以上的水蛭活性寡肽。实施例7.酶活力标准曲线制作及多种酶活力的测定为便于统一不同厂家的酶活力不相同问题,对采购的水解酶进行活力测定,后期可按酶活力进行投料。实验中考察了碱性蛋白酶、胰蛋白酶、木瓜酶的酶活力。(7-1)实验方法(7-1-1)酶活力标准曲线制作酪氨酸标准曲线的绘制:取10支比色管编号,平行分两组,每组分别准确加入1ml浓度为20、40、60、80和100μg/ml的标准酪氨酸溶液,再分别加入5ml0.4mol/lna2co3溶液与0.5mlfolin-酚试剂,迅速振荡混匀,置40℃恒温水浴中显色20min,取出以去离子水为空白对照,在660nm处测定各管吸光值。以酪氨酸浓度为横坐标,吸光值为纵坐标,绘制出酪氨酸标准曲线。(7-1-2)待测酶液制备分别取0.1g碱性蛋白酶、0.1g胰蛋白酶,0.1g木瓜蛋白酶,用ph7.4pbs溶液定容至50ml。(7-1-3)测定酶活力取3支比色管编号,每管中加入预先稀释好的蛋白酶溶液1ml(步骤(7-1-2)),1号管为空白对照(平行操作),在1号管中加入蛋白酶液后,立即加入0.4mol/l三氯乙酸溶液2ml,使酶在未接触到底物前失活。另两只试管加入1ml2wt%酪蛋白水溶液,迅速混匀,立即放入40℃恒温水浴中准确计时恒温10min,迅速加入0.4mol/l三氯乙酸溶液2ml,以终止酶反应。同时向1号管中加入1ml2wt%酪蛋白水溶液,摇匀。3支比色管室温下静置10min后4000r/min离心15min,取各管上清液1ml分别移入另3支编号的比色管中,各加入5ml0.4mol/lna2co3溶液与0.5mlfolin-酚试剂,迅速振荡混匀,置40℃恒温水浴中显色20min,取出在660nm处测定各管吸光值。酶活力的计算依照公式:蛋白酶活力式中,u—蛋白水解酶的活力单位数(u/g或u/ml);a—样品平行试验的平均吸光值;k—吸光常数,当吸光度为1时的酪氨酸的量(μg);n—酶液的稀释倍数;4—反应试剂的体积(ml)。(7-2)实验结果与分析根据(7-1-1)上述操作方法对酪氨酸标准曲线进行绘制,结果图1所示。由图1可知,酪氨酸溶液标准曲线公式为y=0.0067x+0.0079,r2=0.9991;线性良好,经计算k值为148.07。对所选用的3种不同来源的蛋白酶(木瓜蛋白酶、胰蛋白酶和碱性蛋白酶)的蛋白酶活力测定结果如表1所示。表1三种蛋白酶的活力值及最适反应条件蛋白酶吸光度活力值u/g碱性蛋白酶0.5971.77x105胰蛋白酶0.5371.59x105木瓜蛋白酶0.1955.8x105实施例8多肽分子量测定不同的水解酶对蛋白质的酶切位点不同,因此酶解完获得的多肽分子量也不同。(8-1)实验方法(8-1-1)单酶酶解取3组离心管加入水蛭冻干粉0.50g,10ml水溶解后,分别将ph调至各酶最适宜的ph,分别为8.5,8.0,7.0。分别加入碱性蛋白酶,胰蛋白酶,木瓜蛋白酶(加入的酶量以2000u/g换算),各组空白对照除不加水蛭冻干粉外,其余操作相同。60℃下反应6h,85℃灭活15min,调ph至7.0,10000r/min离心10min,取上清液。(8-1-2)水蛭酶解产物的分子量测定高效液相色谱仪条件:高效液相色谱仪;液相色谱分析柱(东曹株式会社,英文名称:tskgelg2000swxl,产品编号:0008540,柱规格:7.8*300);波长:220nm;流速:0.5ml/min;柱温:30℃;进样量:10μl。流动相配制方法为:乙腈:水:三氟乙酸=45:55:0.1(体积比),波长:220nm,流速:0.5ml/min,柱温:30℃,进样量:10μl。将酶解液过0.45μm微孔滤膜,作为供试品溶液。取抑肽酶(6500da),杆菌肽(1450da),乙氨酸-乙氨酸-乙氨酸(189da),乙氨酸-乙氨酸-酪氨酸-精氨酸(451da)适量,用流动相溶解后过0.45μm微孔滤膜,作为标准品溶液。(8-2)实验结果与分析(8-2-1)标准蛋白高效液相色谱图和标准曲线抑肽酶(6500da),杆菌肽(1450da),乙氨酸-乙氨酸-酪氨酸-精氨酸(451da),乙氨酸-乙氨酸-乙氨酸(189da)的高效液相色谱图如图2所示。根据保留时间与分子量对数值所得的标准曲线如图3所示。本实验根据不同分子量的标准品在色谱柱上的洗脱时间(t)与标准品的相对分子质量(mr)的对数呈一定线性关系,其原理可用公式logmr=at+b(式中,logmr为标准品相对分子质量的对数,t为洗脱时间,b为标准曲线的截距,a为标准曲线的斜率)。将实验数据代入公式,得到标准品出峰时间-分子量标准曲线方程为y=-0.2561x+7.3798(r2=0.9922)(式1)(8-2-2)水蛭酶解产物高效液相色谱图及分子量分布采用木瓜蛋白酶、碱性蛋白酶和胰蛋白酶根据(8-1-1)项下方法进行酶解,酶解产物进行凝胶色谱分析,得到的hplc如图4、图5、图6所示。其中,图4为实施例8中木瓜蛋白酶酶解产物hplc图;图5为实施例8中碱性蛋白酶酶解产物hplc图;图6为实施例8中胰蛋白酶酶解产物hplc色谱图。根据凝胶色谱流出顺序:分子量大的化合物先流出色谱柱,从木瓜蛋白酶、碱性蛋白酶和胰蛋白酶的hplc色谱图可以看出,碱性蛋白酶酶解后获得的肽类化合物保留时间大部分集中在14-20min之间,即分子量在189-6500之间,且主要集中在17-20min之间,即分子量在3000以下。木瓜蛋白酶和胰蛋白酶产物的出峰时间较早,大部分产物的出峰时间在14min之前,即分子量大于6500.(8-3)结论根据以上分析,选择使用碱性蛋白酶作为水解酶可以获得低分子量的活性肽。实施例9复合酶酶解水蛭经碱性蛋白酶酶解可以获得较小分子量的肽段,为考察碱性蛋白酶+胰蛋白酶、碱性蛋白酶+木瓜酶联用后是否可以获得更小分子量的肽,进行了复合酶酶解实验。(9-1)实验方法取2组离心管加入水蛭冻干粉0.50g,10ml水溶解后,将ph调至8.5,加入碱性蛋白酶(加入的酶量以2000u/g换算),各组空白对照除不加水蛭冻干粉外,其余操作相同。60℃下反应4h后,分别将ph调至8.0,7.0,分别加入胰蛋白酶,木瓜蛋白酶(加入的酶量以2000u/g换算),60℃下反应4h,85℃灭活15min,调ph至7.0,10000r/min离心10min,取上清液。(9-2)实验结果与分析将碱性蛋白酶+胰蛋白酶、碱性蛋白酶+木瓜酶复合酶水解产物按(8-1-2)方法进行凝胶色谱分析测定分子量,所得的hplc色谱图如图7、图8所示。其中,图7碱性蛋白酶和胰蛋白酶酶解后产物hplc图;图8碱性蛋白酶和木瓜蛋白酶酶解后产物hplc图。图7、图8与图5相比,在碱性蛋白酶酶解后,再加入胰蛋白酶或木瓜酶,组分保留时间后移,表明所得的活性肽分子量降低,两种复合酶联用均可获得分子量更低的活性肽,此外从出峰时间看,所有组分出峰的时间更集中,表明采用复合酶解产物分子量更集中。从上述可以看出:将碱性蛋白酶分别与胰蛋白酶和木瓜蛋白酶联用后,可以获得更小分子量的肽段和分子量更集中的活性肽。实施例10碱性蛋白酶酶解条件优化考察酶解过程中酶解温度、ph、加酶量、底物用量等都会对酶解产物的活性影响。为获得最高活性的肽类,以所得酶解液的抗凝活性为指标将碱性蛋白酶的酶解条件进行优化。(10-1)实验方法(10-1-1)活性测定方法(凝血酶时间法)取0.5wt%纤维蛋白原水溶液50μl于测试杯中,分别加入待测溶液50μl,测试珠1粒,37℃孵育5min后,立即取出加入37℃预温的tt试剂50μl,记录凝固时间,同时以试剂空白为参比记录其凝血酶时间(tt)。(10-1-2)实验条件单因素考察单因素实验中,各因素取用5支平行管。取0.5g水蛭冻干粉+10ml水于平行管中(空白对照组除不加水蛭冻干粉外,其余操作相同),用1mol/lnaoh溶液把反应体系的ph调至8.5,在每支管中均加入5.65mg碱性蛋白酶,放入60℃水浴中反应4h,85℃水浴灭活15min,将各因素5支平行管中液体的ph均调为7,10000r/min离心10min,取上清液,稀释15倍,测定tt值,最终以不同水蛭样品tt值判断其活性高低。酶解工艺优化实验,单因素实验中,各因素取用5支平行管,仅改变单因素实验条件,其他实验条件不变。ph梯度实验中,设定ph梯度为:7.5、8、8.5、9、9.5;温度梯度实验中,设定温度梯度为:45℃、50℃、55℃、60℃、65℃;酶量梯度实验中,设定酶量梯度为:0.8%、1.1%、1.4%、1.7%、2.0%、2.5%,即加入的碱性蛋白酶在1416u/g-4425u/g之间;时间梯度实验中,设定时间梯度:1h、2h、3h、4h、5h。其中,本实施例中酶量为按水蛭冻干粉重量的百分数称取。(10-1-3)最佳条件正交设计考察及验证根据单因素考察结果,选取ph为8.5、9、9.5,反应温度55℃、60℃、65℃,加酶量1.1%、1.4%、1.7%,反应时间1h、2h、3h,进行正交实验,确定最适宜的反应条件。取9支50ml离心管,称取0.5g水蛭冻干粉,分别加入10ml水,将管中液体分别调至不同ph,分别加入不同量的碱性蛋白酶,分别在不同温度下酶解不同时间,85℃灭活15min后,调ph至7,10000r/min离心10min,取上清液,稀释15倍,按10-1-1方法测定其tt值。各管中的实验条件见下表2:表2序号温度/℃ph时间/h酶量/%1558.511.1255921.73559.531.44608.521.4560931.16609.511.77658.531.7865911.49659.521.1(10-2)结果与分析(10-2-1)单因素考察结果按(10-1-2)项下方法对水蛭酶解时各因素进行考察,结果如表3所示。表3单因素实验所得水蛭酶解液及其空白对照tt测定结果从表3结果分析,对于反应ph,在ph为9左右表现出最佳的活性;对于温度条件,在60℃左右表现出最佳活性;对于加酶量条件,在1.4%左右表现出最佳的活性;对于反应时间,在2h以上达到最佳活性。(10-2-2)正交实验考察结果根据单因素考察结果,选取ph为8.5、9、9.5,反应温度55℃、60℃、65℃,加酶量1.1%、1.4%、1.7%,反应时间1h、2h、3h,进行正交实验,根据正交实验设计表,进行酶解实验,对每个条件下的酶解产物进行tt活性测定,结果如下:表4不同因素正交试验tt测定结果(n=4)本实验对水蛭冻干粉酶解液的酶解条件进行工艺优化,根据单因素实验和正交试验所得结果,碱性蛋白酶的最适酶解条件为:ph=9,酶量:1.7%碱性蛋白酶,反应温度:55℃,反应时间:2h。再次运用碱性蛋白酶最适酶解条件,以相同方法酶解水蛭冻干粉,并测定其tt值,(样品:50μl样品+700μl水,稀释15倍后测定),结果为:36.8,37.1,36.3,37.9。根据上述分析,水蛭酶解实验在ph7.5-9.5、温度45℃-65℃、加酶量0.8%-2.5%、反应时间2h-6h区间内,与空白组相比,均表现出非常高的抗凝血酶活性。正交试验所得结果,碱性蛋白酶的最适酶解条件为:ph=9,酶量:1.7%碱性蛋白酶,反应温度:55℃,反应时间:2h。实施例11复合酶条件优化实验中选取碱性蛋白酶+胰蛋白酶,碱性蛋白酶+木瓜酶两种方法对水蛭进行复合酶酶解。在碱性蛋白酶酶解完成后,将酶解液分别调整至胰蛋白酶和木瓜酶最适合的ph,分别加入2000u/g的胰蛋白酶和木瓜酶,分别选用胰蛋白酶和木瓜酶最适宜的ph和温度条件,即胰蛋白酶ph8.0,温度60℃;木瓜酶ph7.0,温度60℃,在上述ph和温度条件下,考察不同酶解时间对最终产物活性的影响。(11-1)实验方法取四支离心管,精密称取四份水蛭匀浆液冻干粉0.50g,分别加入10ml去离子水(空白除不加水蛭冻干粉外,其余操作相同),调至碱性蛋白酶适宜ph值9,在各管中加入碱性蛋白酶1.7%(0.0085g),55℃下磁力搅拌2h,85℃灭活15min后,调至胰蛋白酶适宜ph值8.0(木瓜蛋白酶7.0),分别加入胰蛋白酶0.0126g(木瓜蛋白酶0.0034g,加入的酶量以2000u/g换算),分别60℃下磁力搅拌1h,2h,3h,4h,85℃灭活15min,调ph至7.0,10000r/min离心10min,取上清液,得母液,备用。取母液稀释15倍,测定tt活性。(11-2)实验结果根据(11-1)方法,分别采用碱性蛋白酶+胰蛋白酶,碱性蛋白酶+木瓜酶两种方法对水蛭进行复合酶酶解,不同酶解时间条件下酶解产物的凝血酶时间(tt)如表5所示。表5碱性蛋白酶及复合酶酶解产物tt活性(s)从表中结果可以看出,碱性蛋白酶酶解产物活性较高,加入胰蛋白酶和木瓜酶后,活性有所下降,尤其是木瓜酶加入后,活性下降严重。综合考虑分子量与活性双重因素,采用碱性蛋白酶和胰蛋白酶合用可以获得较好的活性和较低的分子量。根据上述分析,采用碱性蛋白酶和胰蛋白酶合用可以获得较好的活性和较低的分子量。复合酶的酶解条件为:称取水蛭匀浆液冻干粉0.50g,加入10ml去离子水,调至碱性蛋白酶适宜ph值9,在各管中加入碱性蛋白酶1.7%,55℃下磁力搅拌2h,85℃灭活15min后,调至ph值8.0,加入胰蛋白酶0.0126g(2000u/g),分别60℃下磁力搅拌3h后,85℃灭活15min,调ph至7.0,10000r/min离心10min,取上清液,即得水蛭活性肽酶解液。相较于碱性蛋白酶和木瓜酶结合酶解水蛭,碱性蛋白酶和胰蛋白酶结合酶解水蛭获得活性寡肽不仅分子量低,而且活性更高。实施例12脱色工艺水蛭碱性蛋白酶和胰蛋白酶酶解液为棕色,具有腥臭味,因此对其进行脱色处理。本实施例中所述酶解液为实施例1所得的酶解液(离心后得到的上清液)。(12-1)实验方法(12-1-1)单用活性炭脱色取10ml酶解液,分别调至不同ph(3,4,5),分别加入不同量活性炭(1wt%,3wt%,5wt%)(以酶解液质量为100%计算),60℃水浴放置1h,10000r/min离心10min,取上清液,观察其颜色。(12-1-2)单用白陶土脱色取10ml酶解液,分别加0.4g、0.6g、0.8g白陶土,50℃水浴放置30min,10000r/min离心10min,取上清液,观察其颜色。(12-1-3)同时用白陶土和活性炭脱色取10ml酶解液,分别调ph至3、5,分别加1wt%、3wt%、5wt%活性炭(以酶解液质量为100%计算),均加入2.5wt%白陶土(以酶解液质量为100%计算),60℃水浴放置1h,10000r/min离心10min,观察其颜色。(12-1-4)脱色率和肽保留率测定及计算(1)脱色率对水蛭酶解液进行紫外全波长扫描,发现在可见光吸收波长范围内575nm处有吸收,故将波长定在575nm处测定脱色前后吸光度a,计算脱色率。脱色率=(脱色前a-脱色后a)/脱色前a。(2)肽保留率以牛血清白蛋白为标准蛋白,采用考马斯亮蓝法对水蛭寡肽进行含量测定,精密称取10.00mg牛血清白蛋白(bsa),加水定容至10ml,摇匀,即得质量浓度为1.0g/l的bsa母液,备用。精密称取10.00mg考马斯亮蓝g-250,加入95%乙醇5ml溶解,再加入85wt%磷酸10ml,加水定容至100ml,摇匀,过滤,得质量浓度为0.10g/l的考马斯亮蓝溶液,备用。取bsa母液,用水稀释成一系列质量浓度(0.05,0.1,0.2,0.4,0.6,0.8,1.0g/l),取不同浓度的bsa标准液各50μl,分别加入4ml考马斯亮蓝溶液,摇匀,避光反应5min后立即取出,选取595nm,测吸光度(空白对照:50μl水加4ml考马斯亮蓝溶液,摇匀后避光保存5min,测吸光度)。最终得到线性回归方程为y=0.38393x+0.04651(r2=0.9980,n=7)。按上述方法在波长595nm处测定水蛭酶解液吸光度,代入回归方程,计算肽含量,计算肽保留率。肽保留率=脱色后肽含量/脱色前肽含量。(12-2)实验结果与分析(12-2-1)单加活性炭实验中考察了单使用活性炭进行脱色时,不同ph条件下的脱色效果,结果如图9所示。随着ph降低,活性炭的脱色效果变好,ph3时具有较好的脱色效果,且随着活性炭加入量增加,脱色效果增强,但不能完全脱色。(12-2-2)单加白陶土单加白陶土时,无法脱去水蛭酶解液的棕褐色,如图10所示。(12-2-3)活性炭和白陶土联合使用在ph为3的条件下,同时加入活性炭(1wt%-5wt%)和白陶土(2.5wt%),脱色效果图11所示。从图11可以看出,活性炭与白陶土合用后,脱色效果比单用活性炭好,并且随着活性炭的加入量从1wt%增加到5wt%,脱色效果更好,脱色后呈现无色透明溶液,此时的脱色率为80%,肽保留率为92%。根据上述测试,活性炭和白陶土混合使用具有较好的脱色效果,最佳条件为ph为3,活性炭添加量5wt%,白陶土添加量2.5wt%。采用此方法对酶解液进行处理,脱腥效果明显,酶解液颜色变浅,同时活性肽的保留率可以达到92%。实施例2至实施例11中其他酶解过程中采用活性炭和白陶土进行脱腥脱色,获得与上述类似的结果:脱腥效果明显,酶解液颜色变浅,同时活性肽的保留率高。实施例13水蛭寡肽抗凝活性和分子量测定(13-1)抗凝活性测定按上述步骤对水蛭进行酶解脱色后,冷冻干燥。取冻干粉用tris-hcl(ph=7.4)缓冲液配制成0.01g/ml的溶液,量取100μl,置小试管中,加入含0.5wt%(牛)纤维蛋白原(以凝固物计)的水缓冲液200μl,摇匀,置水浴中(37℃±0.5℃)温浸5分钟,滴加每1ml中含40单位的凝血酶溶液(每1分钟滴加1次,每次5μl,边滴加边轻轻摇匀)至凝固,记录消耗凝血酶溶液的体积,按下式计算:u=c1v1/c2v2式中u每1g含凝血酶活性单位,u/g;c1—凝血酶溶液的浓度(u/ml);c2—供试品溶液的浓度(g/ml);v1—消耗凝血酶溶液的体积(μl);v2—供试品溶液的加入量(μl),;取三批次水蛭酶解液(实施例1中酶解后上清液、实施例2中酶解后上清液,、实施例3中酶解后上清液)冻干粉,经测定三批次的抗凝血酶活性分别为520u/g、520u/g、560u/g。(13-2)分子量测定根据图7,碱性蛋白酶和胰蛋白酶酶解产物出峰时间和式1推算,酶解产物中分子量500以下(即出峰时间18.3min以后)的寡肽占总产物的90%以上,因此使用碱性蛋白酶和胰蛋白酶可以获得分子量500以下的活性肽。实施例14数据分析:1.分子量对比采用碱性蛋白酶、胰蛋白酶、木瓜蛋白酶、碱性蛋白酶+胰蛋白酶复合酶、碱性蛋白酶+木瓜蛋白酶复合酶分别对水蛭进行酶解,酶解产物进行凝胶色谱法分析,根据保留时间测定分子量信息,得到的结果如图4、5、6、7、8所示,与标准蛋白保留时间比对后,发现采用单酶酶解时,胰蛋白酶和木瓜蛋白酶获得的分子量大部分在6500以上,碱性蛋白酶酶解后水蛭活性肽的分子量主要集中在6500以下;采用碱性蛋白酶+胰蛋白酶复合酶、碱性蛋白酶+胰蛋白酶复合酶进行酶解后,所得活性肽的分子量主要在500以下。而且,从图4、5、6、7、8结果可知,采用碱性蛋白酶+胰蛋白酶复合酶解后,产物出峰时间更集中,即分子量集中。2.活性对比按(11-1)项下方法,采用碱性蛋白酶+胰蛋白酶,碱性蛋白酶+木瓜酶复合酶法对水蛭进行酶解,首先采用碱性蛋白酶酶解,然后分别加入胰蛋白酶和木瓜酶,酶解不同时间。对酶解液脱色后,冻干。将酶解液冻干粉测定抗凝血酶活性,结果如表6所示。表6碱性蛋白酶及复合酶酶解产物抗凝血酶活性(u/g)从表6结果可以看出,采用碱性蛋白酶+胰蛋白酶比碱性蛋白酶+木瓜酶复合酶法具有更高的抗凝活性。以上所述,仅是本申请的几个实施例,并非对本申请做任何形式的限制,虽然本申请以较佳实施例揭示如上,然而并非用以限制本申请,任何熟悉本专业的技术人员,在不脱离本申请技术方案的范围内,利用上述揭示的技术内容做出些许的变动或修饰均等同于等效实施案例,均属于技术方案范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1