核酸的合成方法与流程
本发明涉及核酸合成领域,具体而言,涉及一种核酸的合成方法。
背景技术:
目前,核酸的固相合成是采用三价磷化学,通过四步循环反应,每次连接一个碱基进行合成。此方法的优点是快速,高效。但是同时存在偶联不完全的片段存在,即存在n-1问题。给后续的纯化带来很大的麻烦。以spinraza为例,spinraza的传统的合成方式也是使用固相载体一次连接一个碱基,需要18步连接反应才能够实现。因此,不仅合成步骤较长,并且合成过程中存在n-1等短片段,纯化困难。
因此,仍需要提供一种相对快速高效的核酸合成方法。
技术实现要素:
本发明的主要目的在于提供一种核酸的合成方法,以解决现有方法合成步骤长,效率低的问题。
为了实现上述目的,根据本发明的一个方面,提供了一种核酸的合成方法,该合成方法包括:将待合成的核酸按序列顺序拆分成多组片段进行分别合成,得到多组核酸片段,每组核酸片段包含2~5个碱基;采用固相合成的方式将各核酸片段按序列顺序进行连接,从而得到核酸。
进一步地,将待合成的核酸按从3’端到5’端的顺序拆分成多组片段进行分别合成。
进一步地,将待合成的核酸按从5’端到3’端的顺序拆分成多组片段进行分别合成。
进一步地,每组核酸片段包含2~3个碱基,优选包含3个碱基。
进一步地,多组核酸片段采用液相合成的方式合成。
进一步地,液相合成通过脱保护基反应、偶联反应及氧化反应三个步骤循环的方式,每次连接一个碱基进行合成。
进一步地,固相合成通过脱保护基反应、偶联反应、氧化反应以及覆盖自由羟基反应四个步骤循环的方式,每次连接一个核酸片段进行合成。
进一步地,采用固相合成的方式将各核酸片段按序列顺序进行连接,从而得到核酸包括:步骤a,对固相载体表面的保护基进行脱保护基反应,露出羟基;步骤b,将带有保护基的核酸片段与羟基进行偶联反应,得到偶联物;步骤c,对偶联物进行氧化反应,得到氧化产物;步骤d,对氧化产物进行覆盖自由羟基反应,得到连接有核酸片段的固相载体;循环执行步骤a到步骤d,得到核酸;其中,按照序列顺序,每次循环连接一个核酸片段;优选地,采用脱保护溶液进行脱保护基反应,脱保护溶液为1~5w/v%的二氯乙酸的甲苯溶液、二氯乙酸的二氯甲烷溶液或二氯乙酸的甲醇溶液;优选地,将核酸片段溶于乙腈、二氯甲烷或四氢呋喃中进行偶联反应;优选地,采用((e)-n,n-二甲基-n'-(3-硫代-3h-1,2,4-二硫噻唑-5-基)甲脒或氢化黄原素进行氧化反应;优选地,采用乙酸酐和n-甲基咪唑进行覆盖自由羟基反应;优选地,在步骤a到步骤d的每一步骤后,还包括可选的洗脱纯化步骤,更优选,洗脱纯化步骤采用乙腈、二氯甲烷或四氢呋喃进行。
进一步地,保护基为dmtr、mmtr或tr。
进一步地,核酸片段与羟基的摩尔比为1:1~10:1。
进一步地,核酸为长度为8~30nt的寡核苷酸;优选核酸为15~30nt的反义寡核苷酸,更优选核酸为spinraza;
优选地,spinraza按照从3’端到5’端的顺序依次拆分成tgg、tgc、taa、tca、ctt和tca六组片段进行分别合成,得到6组核酸片段;
采用固相合成的方式将6组核酸片段按照顺序进行连接,得到spinraza。
应用本发明的技术方案,创造性地提出了多碱基的短片段偶联代替单碱基偶联的新的合成策略,首先合成多个含2-5个碱基的短片段,然后使用固相合成按待合成的核酸的序列进行顺序拼接。多个片段可以同时平行合成,并且不受固相载体载量的限制,可以方便的得到大量的高纯度的短片段。采用固相方式进行拼接,将原来的连接步骤缩减了至少1/2,大大缩短了反应时间,提高了反应效率和总收率,减少了固相合成三废的产生,同时还避免了传统合成中n-1非目的片段的产生,提高了产品的纯度。
附图说明
构成本申请的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
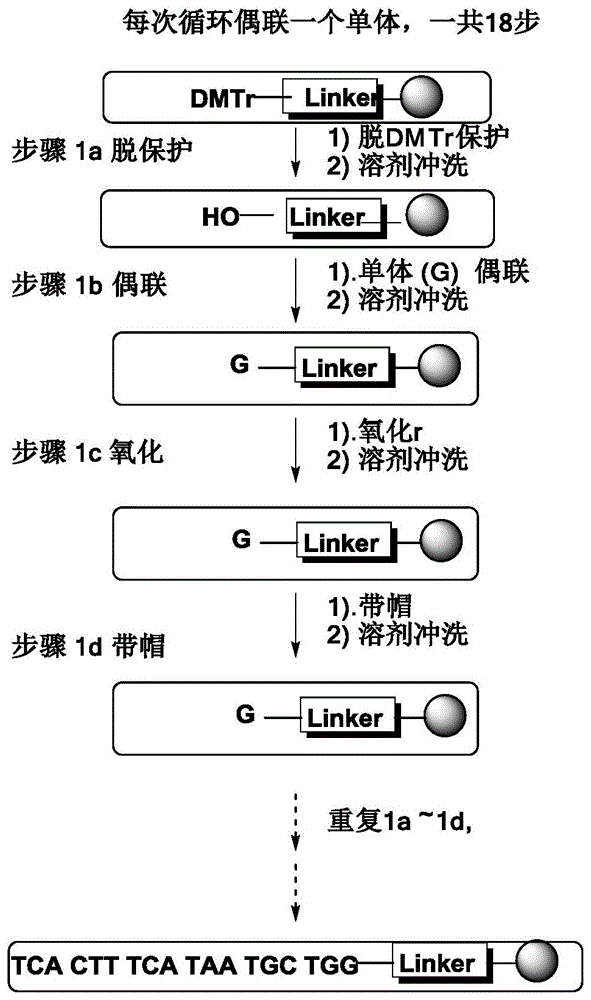
图1示出了根据现有方法对核酸spinraza进行合成的流程示意图;以及
图2示出了根据本申请的一种优选实施例的方法对核酸spinraza进行合成的流程示意图。
具体实施方式
需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互组合。下面将结合实施例来详细说明本发明。
spinraza是一种反义核苷酸,通过与smn2外显子7的剪切位点结合,改变smn2基因剪切,生成更能替代smn1基因功能的蛋白产物,从而达到治疗疾病的作用。其序列为seqidno:1:tcactttcataatgctgg。
如背景技术所提到的,现有的核酸,尤其是用作药物制剂类的核酸,不仅需要的量大,而且对纯度的要求高(需要95%或98%以上,甚至99%以上),因而在合成的时候通常是采用固相载体每次连接一个碱基来进行合成,而每一个碱基的连接都要分别经过脱保护反应、偶联反应、氧化反应以及覆盖自由基反应四个步骤,因此反应时间长,效率低;而且每次偶联一个碱基,容易造成最终产物中存在少一个碱基的现象,造成产物纯化困难。
为了缩短反应时间,提高核酸的合成效率,在本申请一种优选的实施例中,提供了一种核酸的合成方法,该合成方法包括:将待合成的核酸按序列顺序拆分成多组片段进行分别合成,得到多组核酸片段,每组核酸片段包含2~5个碱基;采用固相合成的方式将各核酸片段按序列顺序进行连接,从而得到核酸。
本申请创造性地提出了多碱基的短片段偶联代替单碱基偶联的新的合成策略,首先合成多个2-5个碱基的短片段,然后使用固相合成法按待合成的核酸的序列进行顺序拼接。多个片段可以同时平行合成,并且不受固相载体载量的限制,可以方便的得到大量的高纯度的短片段。采用固相方式进行拼接,将原来的连接步骤缩减了至少1/2,大大缩短了反应时间,提高了反应效率和总收率,减少了固相合成三废的产生,同时还避免了传统合成中n-1非目的片段的产生,提高了产品的纯度。
将待合成的核酸按序列顺序拆分成多组片段进行分别合成时,根据单碱基上的保护基的位置进行合理选择拆分是顺序。比如,当单碱基上的保护基位于5’端时,则从3’端进行拆分,则合成的核酸片段在进行连接时也可以按照3’端到5’端的顺序进行连接。而当单碱基上的保护基位于3’端时,则从5’端进行拆分,则合成的核酸片段在进行连接时也可以按照5’端到3’端的顺序进行连接。因此,在本申请一种优选的实施例中,将待合成的核酸按从3’端到5’端的顺序拆分成多组片段进行分别合成。在本申请另一种优选的实施例中,将待合成的核酸按从5’端到3’端的顺序拆分成多组片段进行分别合成。两种不同方向的合成都可以采用本申请的方法进行,但考虑到目前商业化的核苷酸单体及固相载体大多是在5’端上设置保护基的情况下,优选推荐按照从3’端到5’端的顺序拆分成多组片段进行分别合成,进而后续固相合成时也采用按3’端到5’端的顺序进行合成。
将待合成的核酸按序列顺序拆分成多组片段进行分别合成时,拆分的每个片段所包含的碱基的数目并无特殊限定,可以是2个、3个、4个或5个。从合成效率、合成纯度以及操作难易度角度考虑,优选每个片段含有2个或3个碱基,更优选每个片段含有3个碱基。按照3个碱基一个片段进行拆分和合成时,不仅有利于操作,而且对于反义寡核苷酸而言,还可以使得每个片段与该核酸靶向调控的mrna的3个碱基组成的密码子相对应。同时,还避免了传统合成中n-1非目的片段的产生,后续纯化简单(后续在通过制备色谱柱进行色谱分离纯化时,2~5个碱基的差异相比1个碱基差异,使得目的产物与非目的产物更容易分离开,进而也更容易将目的产物纯化出来),提高了产品的纯度。
为了进一步提高合成效率,缩短反应时间,在本申请一种优选的实施例中,上述多组核酸片段采用液相合成的方式合成。相比固相合成,液相合成不受固相载体的载量限制,具有合成效率高的优势,便于进行批量合成。具体的合成步骤按照现有步骤进行即可。在本申请一种优选的实施例中,液相合成通过脱保护基反应、偶联反应及氧化反应三个步骤循环的方式,每次连接一个碱基进行合成。
本申请在对上述液相合成的核酸片段采用固相合成的方法进行时,连接的对象由单个碱基改为2~5个碱基的核酸片段,每个核酸片段的连接步骤同样需要经过脱保护基反应、偶联反应、氧化反应以及覆盖自由羟基反应四个步骤,循环执行这四个步骤则逐一将各核酸片段连接形成目的序列的核酸。因此,在本申请一种优选的实施例中,固相合成通过脱保护基反应、偶联反应、氧化反应以及覆盖自由羟基反应四个步骤循环的方式,每次连接一个核酸片段进行合成。
在本申请一种优选的实施例中,采用固相合成的方式将各核酸片段按序列顺序进行连接,从而得到核酸包括:步骤a,对固相载体表面的保护基进行脱保护基反应,露出羟基;步骤b,将带有保护基的核酸片段与羟基进行偶联反应,得到偶联物;步骤c,对偶联物进行氧化反应,得到氧化产物;步骤d,对氧化产物进行覆盖自由羟基反应,得到连接有核酸片段的固相载体;循环执行步骤a到步骤d,得到核酸;其中,按照序列顺序,每次循环连接一个核酸片段。
在本申请一种优选的实施例中,采用1~5w/v%脱保护溶液进行脱保护基反应,脱保护溶液为二氯乙酸的甲醇溶液、二氯乙酸的二氯甲烷溶液或二氯乙酸的甲苯溶液。优选地,将核酸片段溶于乙腈、四氢呋喃或二氯甲烷中进行偶联反应;优选地,采用ddtt((e)-n,n-二甲基-n'-(3-硫代-3h-1,2,4-dithiazol-5-基)甲脒,以下均以ddtt为缩写代表)或氢化黄原素进行氧化反应;优选地,采用乙酸酐和n-甲基咪唑进行覆盖自由羟基反应;优选地,在步骤a到步骤d的每一步骤后,还包括可选的洗脱纯化步骤,更优选,洗脱纯化步骤采用乙腈、四氢呋喃或二氯甲烷进行。
根据具体应用时所采用的固相载体或核苷酸单体种类的不同,核苷酸单体上所带的保护基或固相载体表面所带的保护基也有所不同。在本申请一种优选的实施例中,保护基为dmtr(4,4'-二甲氧基三苯甲基)、mmtr(4-甲氧基三苯甲基)或tr(三苯甲基)。
为了进一步提高每个核酸片段的连接效率,在本申请一种优选的实施例中,核酸片段与羟基的摩尔比为1:1~10:1。
本申请的合成方法适用于任何核酸的合成,具体的核酸种类并无特殊限制,但本申请尤其适合作为药物制剂使用的核酸的合成。在本申请一种优选的实施例中,核酸为长度为8~30nt的寡核苷酸;优选核酸为15~30nt的反义寡核苷酸,更优选核酸为spinraza。
在一种优选的实施例中,spinraza的合成方法包括:按照从3’端到5’端的顺序依次拆分成tgg、tgc、taa、tca、ctt和tca六组片段进行分别合成,得到6组核酸片段;采用固相合成的方式将6组核酸片段按照顺序进行连接,得到spinraza。
从spinraza的3’端到5’端,每3个碱基分为一组,所以一共可以拆分为6组,分别为:tgg、tgc、taa、tca、ctt和tca,其中第4组(tca)与第6组(tca)是相同的,所以实际上有5组。分别为:tgg、tgc、taa、tca和ctt。因此,实际合成过程中只需要合成上述的5组即可。然后使用固相合成将其按照目标序列的顺序进行合成。最终得到目标分子spinraza。
5组3碱基组成的片段的具体合成如下:
(1)tgg的合成
(2)tca的合成
(3)ctt的合成
(4)taa的合成
(5)tgc的合成
下面将结合具体的实施例来进一步说明本申请的有益效果,以100μmol的起始合成规模为例。
对比例1spinraza的合成
按照图1所示的步骤逐一合成每个碱基。具体反应条件如下:
第一步:脱保护:
使用的二氯乙酸的甲苯溶液(质量体积比为1%)作为脱保护试剂,脱掉dmtr保护基,反应时间3-5.min。之后使用乙腈进行冲洗。该步骤的溶剂使用量为200ml(脱保护溶液+冲洗乙腈)
第二步:偶联
使用btt(卞巯基四氮唑)作为活化剂,对每个核苷酸单体的乙腈溶液进行偶联,偶联时间3-5min。其中,核苷酸单体与上一步脱掉保护基的固相载体表面的羟基的摩尔比为5:1。之后使用乙腈进行冲洗。该步骤的溶剂使用量为50ml(单体溶液+活化剂溶液+冲洗乙腈)
第三步:氧化
使用ddtt作为氧化剂,使用合成仪进行氧化,反应时间2-5min。之后使用乙腈进行冲洗。该步骤的溶剂使用量为75ml(氧化试剂+冲洗乙腈)
第四步:带帽
使用乙酸酐和n-甲基咪唑两种试剂作为带帽试剂,进行带帽,该步骤的目的是将未反应的羟基进行封端,以避免进一步延伸。反应时间2-5.min。之后使用乙腈进行冲洗。该步骤的溶剂使用量为75ml(带帽试剂+冲洗乙腈)
循环进行18轮,得到全保护产物。
之后经过氨解,制备hplc纯化后得到目标产物。终产品经过紫外分光光度计定量,所得收率为36%,hplc检测纯度为95%。
经统计,每轮循环使用的总的溶剂量为400ml。每轮循环所需时间约为30分钟。
实施例1spinraza的合成
按照图2所示的步骤逐一合成每3个碱基的片段。具体反应条件如下:
合成同实施例1,但是核苷酸单体更换为3个碱基的核酸片段,总循环数减少为6步循环。
最终得到产物收率64%,hplc纯度为98%。
实施例2spinraza的合成
参照图2所示的步骤,先逐一合成每2个碱基的片段。具体反应条件如下:
合成同实施例1,但是核苷酸单体更换为2个碱基的核酸片段,总循环数减少为9步循环。此外,脱保护试剂采用甲苯溶液,体积不变。
最终得到产物收率54%,hplc纯度为95%。
实施例3spinraza的合成
参照图2所示的步骤,先逐一合成每5个碱基的片段。具体反应条件如下:
合成同实施例1,但是核苷酸单体更换为5个碱基的核酸片段(溶于二氯甲烷中),总循环数减少为4步循环。此外,脱保护试剂采用二氯甲烷溶液,体积不变。
最终得到产物收率31%,hplc纯度为96%。
实施例4一条18个核苷酸的rna序列的合成
序列按5’到3’顺序为seqidno:2:aguucaguucucuaggau。
参照图2所示的步骤,先逐一合成每3个碱基的片段。具体反应条件如下:
合成同实施例1,但是核苷酸单体更换为3个碱基的核酸片段(溶于四氢呋喃中),总循环数减少为6步循环。最终得到产物收率30%,hplc纯度为97%。
实施例5一条18个核苷酸的dna序列的合成
序列按5’到3’顺序为seqidno:3:agttcagttctctaggat
参照图2所示的步骤,先逐一合成每3个碱基的片段。具体反应条件如下:
合成同实施例1,但是核苷酸单体更换为3个碱基的核酸片段,总循环数减少为6步循环。最终得到产物收率67%,hplc纯度为98%。
实施例6一条8个核苷酸的dna序列的合成
序列按5’到3’顺序为seqidno:4:agctagct
参照图2所示的步骤,先逐一合成每3个碱基的片段。具体反应条件如下:
合成同实施例1,但是核苷酸单体更换为3个碱基的核酸片段,总循环数减少为3步循环。最终得到产物收率80%,hplc纯度为99%。
实施例7一条30个核苷酸的dna序列的合成
序列按5’到3’顺序为seqidno:5:auttgaactccagataactgacttggagcc
参照图2所示的步骤,先逐一合成每3个碱基的片段。具体反应条件如下:
合成同实施例1,但是核苷酸单体更换为3个碱基的核酸片段,总循环数减少为10步循环。最终得到产物收率55%,hplc纯度为97%。
实施例8一条15个核苷酸的dna序列的合成
序列按5’到3’顺序为seqidno:6:atcgtacttgtaaat
参照图2所示的步骤,先逐一合成每3个碱基的片段。具体反应条件如下:
合成同实施例1,但是核苷酸单体更换为3个碱基的核酸片段,总循环数减少为5步循环。最终得到产物收率:64%,hplc纯度为:98%。
以上各实施例每轮循环使用的总的溶剂量基本一致,不因序列的不同或者碱基片段长度的不同而有差异。
检测:对上述各实施例和对比例的反应总时长、溶剂用量、总收率及纯度等指标进行了统计比较,比较结果见表1。
表1:
从以上的描述中,可以看出,本发明上述的实施例实现了如下技术效果:本申请提出了新的合成策略,采用固相和液相联合的方法,首先使用液相合成多个2~5个碱基的短片段,然后使用固相合成按待合成的核酸的序列进行顺序拼接。多个片段可以同时平行合成,并且不受固相载体载量的限制,可以方便的得到大量的高纯度的短片段。采用固相方式进行拼接,将原来的连接步骤缩减了至少1/2,大大缩短了反应时间,提高了反应效率和总收率。此外,不仅减小了固相合成使用的溶剂量,减少了固相合成三废的产生,同时还避免了传统合成中n-1非目的片段的产生,后续纯化简单,提高了产品的纯度,特别适用于大规模。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110>凯莱英医药集团(天津)股份有限公司
<120>核酸的合成方法
<130>pn115834kly
<160>6
<170>siposequencelisting1.0
<210>1
<211>18
<212>dna
<213>人工序列(artificalsequence)
<220>
<221>misc_feature
<222>(1)..(18)
<223>spinraza
<400>1
tcactttcataatgctgg18
<210>2
<211>18
<212>rna
<213>人工序列(artificalsequence)
<220>
<221>misc_feature
<222>(1)..(18)
<223>用于试验的人为设计的序列
<400>2
aguucaguucucuaggau18
<210>3
<211>18
<212>dna
<213>人工序列(artificalsequence)
<220>
<221>misc_feature
<222>(1)..(18)
<223>用于试验的人为设计序列
<400>3
agttcagttctctaggat18
<210>4
<211>8
<212>dna
<213>人工序列(artificalsequence)
<220>
<221>misc_feature
<222>(1)..(8)
<223>用于试验的人为设计的序列
<400>4
agctagct8
<210>5
<211>23
<212>rna
<213>人工序列(artificalsequence)
<220>
<221>misc_feature
<222>(1)..(23)
<223>用于试验的人为设计的序列
<400>5
augaacccagaaacgacggagcc23
<210>6
<211>9
<212>dna
<213>人工序列(artificalsequence)
<220>
<221>misc_feature
<222>(1)..(9)
<223>用于试验的人为设计序列
<400>6
acgacgaaa9
- 还没有人留言评论。精彩留言会获得点赞!