一种发酵生产1,5-戊二胺的方法与流程
本发明涉及一种发酵方法,特别涉及发酵生产1,5-戊二胺的方法。
背景技术:
戊二胺(diaminopentane;dn),又名尸胺,在农业、医学以及工业上具有广泛的应用。在农业上,外源施加dn可以改善坐果和促进果实成熟;在医学上,dn可以作为一种有效治疗痢疾的药物;在工业上,戊二胺可以代替来自于石油化工产品的二胺类进行聚合反应生成聚酰胺。目前聚酰胺的年产量接近600万t,其中尼龙6.6(polyamide6.6;pa6.6)是聚酰胺类中开发最早、产量最大、应用最广的产品之一,被广泛应用于航空航天、汽车部件、机械零部件、电子电器与包装材料等行业中。pa6.6是由己二酸与己二胺1:1聚合生成的,但己二胺的合成仍然依赖于由石油化工产业。作为一种可以利用微生物发酵生产的可持续性产物,戊二胺可以代替己二胺与己二酸进行聚合反应,因此戊二胺的生物法合成具有重要的战略地位。
现有技术中的一种利用微生物转化合成尸胺的方法,它构建了能分泌表达赖氨酸脱羧酶的微生物,在发酵生产赖氨酸脱羧酶,然后向微生物培养基中投入赖氨酸,从而把赖氨酸转化为尸胺。这种方法需要一定纯度的赖氨酸,需要另外的赖氨酸生产和纯化工艺。公开号为104762336a、公开日为2015-07-08的中国发明专利申请公布了一种向赖氨酸发酵液中加入赖氨酸脱羧酶的方法来生产尸胺。这种方法虽然不需要纯化赖氨酸,但需要生产和纯化赖氨酸脱羧酶,这是一个非常复杂的工艺过程。公开号为cn105441497a、公开日为2016-03-30的中国发明专利申请,公开号为cn105316270a、公开日为2014-06-27的中国发明专利申请公布了利用微生物发酵和微生物转化偶联生产尸胺的方法,利用基因工程技术,将不同来源的赖氨酸脱羧酶基因克隆至高产赖氨酸的大肠杆菌或谷氨酸棒杆菌中进行分泌表达,将重组菌株进行发酵,第一阶段主要是重组菌株合成赖氨酸,第二阶段诱导赖氨酸脱羧酶基因进行分泌表达,并将赖氨酸转化成尸胺。
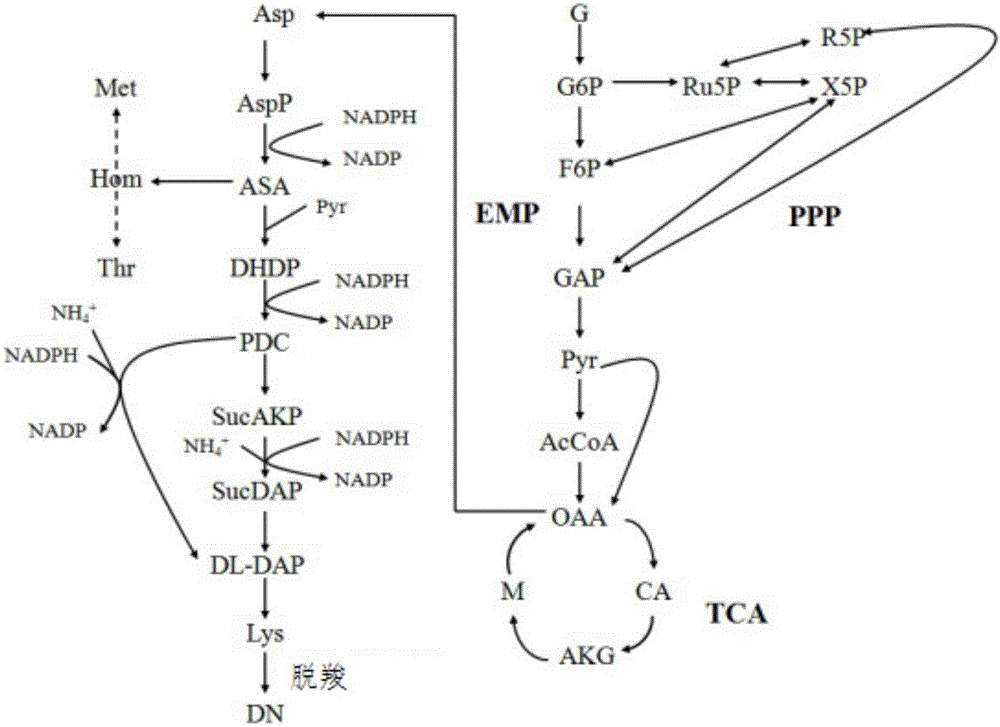
如图1所示,目前常见的生物法合成戊二胺是以菌体内合成的赖氨酸为底物脱羧形成的,而过程中常见的限制性底物为赖氨酸的合成,因此提高赖氨酸的合成速率决定了戊二胺的产生速率。同理,赖氨酸对葡萄糖的得率也最终决定了戊二胺的得率。因此,提高赖氨酸的合成效率以及得率对于生物一步法合成戊二胺来说至关重要。常见的大肠杆菌合成赖氨酸代谢过程如图1所示。可以看出,每合成1mol赖氨酸,需要4mol的nadph,因此提高nadph的量是提高l-赖氨酸积累量的重要手段之一。在细菌内,经由tca循环形成的nadh可以在nadh激酶和atp的共同作用下被转化为nadph,此为赖氨酸合成中还原力nadph的主要来源。1mol葡萄糖经emp以及tca转化的nadh均进入呼吸链产生atp时会消耗6molo2,而经tca时产生6molco2,因此其呼吸商(respiratoryquotient;rq)应为1。
技术实现要素:
本案发明人认为,如果过程中合成的nadh被转化为nadph进入赖氨酸的合成而并不进入呼吸链消耗o2,那么发酵过程中的rq应是大于1。rq越大,说明越多的nadh被转化为nadph进入赖氨酸合成,赖氨酸的转化率越高,相应地戊二胺的转化率也越高。因此,维持较高的rq有利于戊二胺生物发酵过程。
本发明的第一方面目的在于提供一种1,5-戊二胺的生产方法,以解决目前的生产方法中戊二胺的转化率不高的技术问题。
本发明通过以下技术方案解决上述技术问题,达到本发明的目的。
一种发酵生产1,5-戊二胺的方法,包括通过细菌发酵将底物转化为1,5-戊二胺,在发酵过程中分阶段控制rq,所述rq控制为1.2-2.2。
进一步,所述发酵过程包括至少三个阶段,其中,
第一阶段为发酵第一节点开始至第二节点止;
第二阶段为发酵第二节点开始至第三节点止;
第三阶段为发酵第三节点开始至发酵结束;
所述第一节点为发酵第2-4小时;
所述第二节点为发酵第14-16小时;
所述第三节点为发酵第19-21小时;
所述第一阶段,控制所述rq为1.2-1.8。
和/或,所述第二阶段,控制所述rq为1.8-2.2;
和/或,所述第三阶段,控制所述rq为1.5-2.2。
又进一步,所述第一阶段还包括第一阶段内节点;所述第一阶段内节点位于所述第一节点和第二节点之间;所述第一阶段内节点为发酵第8-10小时;
所述第一阶段内节点将所述第一阶段分为第一阶段前阶段和第一阶段后阶段;所述第一阶段前阶段控制所述rq为1.2-1.5;所述第一阶段后阶段控制所述rq为1.5-1.8。
在上述任一技术方案的基础上进一步,所述第三阶段还包括第三阶段内节点;所述第三阶段内节点位于所述第三节点和发酵结束之间;所述第三阶段内节点为发酵第24-26小时;
所述第三阶段内节点将所述第三阶段分为第三阶段前阶段和第三阶段后阶段;所述第三阶段前阶段控制所述rq为1.7-2.2;所述第三阶段后阶段控制所述rq为1.5-1.7。
在上述任一技术方案的基础上进一步,通过控制铵盐的流加速度控制rq;优选地,所述铵盐包括硫酸铵;更优选地,所述铵盐是硫酸铵;又更优选地,控制硫酸铵的流加速度如下:
所述第一阶段硫酸铵的流加速度控制为4.5-14.5g/l/h;
所述第二阶段硫酸铵的流加速度控制为14.5-20.5g/l/h;
所述第三阶段硫酸铵的流加速度控制为9.5-18.5g/l/h;
再更优选地,
所述第一阶段前阶段,硫酸铵的流加速度控制为4.5-9.5g/l/h,所述第一阶段后阶段,硫酸铵的流加速度控制为9.5-14.5g/l/h;
和/或,再更优选地,
所述第三阶段前阶段,硫酸铵的流加速度控制为12.5-18.5g/l/h,所述第三阶段后阶段,硫酸铵的流加速度控制为9.5-14.5g/l/h。
在上述任一技术方案的基础上进一步,所述细菌为大肠杆菌,优选大肠杆菌cib132-3。在上述任一技术方案的基础上进一步,所述底物包括或者是糖;优选地,所述底物包括葡萄糖,更优选地,所述底物是葡萄糖。
在上述任一技术方案的基础上进一步,所述发酵的方法为:5-30l发酵罐,接种比5-12%(v/v),通气比0.4-0.8vvm,温度35-39℃,转速500-800rpm,罐压0.05-0.2mpa,25-28%(v/v)的氨水控ph为6.0-7.0,发酵2-6h后流加发酵补料培养基,发酵周期为30-40h;
优选地,发酵培养基包括:kh2po40.2-0.6g/l,mgso4·7h2o1.0-5.0g/l,mnso4·h2o0.1-0.5g/l,硫酸铵2.0-10g/l,葡萄糖10-60g/l,玉米浆1.0-5.0g/l,苏氨酸0.1-0.3g/l;和/或
优选地,所述发酵补料培养基包括:葡萄糖500g/l-800g/l,硫酸铵200-600g/l,苏氨酸1-10g/l。
在上述任一技术方案的基础上进一步,所述的一种1,5-戊二胺的生产方法还包括种子液的培养,所述种子液的培养的方法如下:
5-30l发酵罐,接种比0.5-1.2%(v/v),通气比0.4-0.8vvm,温度35-39℃,转速300-800rpm,罐压0.05-0.15mpa,氨水控ph为6.0-7.0,在菌浓od562达0.55-1.00(稀释25倍)后,接入发酵罐;优选地,种子培养基包括:kh2po42.0-5.0g/l,mgso4·7h2o1.5-4.5g/l,mnso4·h2o10-20ppm,硫酸铵5.0-25g/l,葡萄糖50-150g/l,玉米浆0.5-3g/l,苏氨酸0.15-0.45g/l。
在上述任一技术方案的基础上进一步,所述rq通过质谱仪测定发酵尾气组分后通过以下公式计算得到(如,一分钟一次):
rq=cer/our
其中fin是通气速率,v是发酵液体积;cinertin、
本发明的发酵生产1,5-戊二胺的方法,根据戊二胺发酵过程中rq与转化率的关系,通过控制rq以提高发酵过程中1,5-戊二胺总的得率。本发明还进一步提出了通过控制发酵过程中流加硫酸铵的速率,以控制rq,该方法不但简单实用,而且因为流加硫酸铵属于现有发酵生产1,5-戊二胺的工艺中本来就有的工艺步骤,所以不会让发酵的工艺步骤复杂化。
附图说明
图1是大肠杆菌生产1,5-戊二胺的代谢途径;其中的缩略语的含义如下:
g:葡萄糖;g6p:6-磷酸-葡萄糖;f6p:6-磷酸-果糖;gap:3-磷酸-甘油醛;pyr:丙酮酸;accoa:乙酰辅酶a;oaa:草酰乙酸;ca:柠檬酸;akg:α-酮戊二酸;m:苹果酸;asp:天冬氨酸;aspp:天冬氨酸-磷酸;asa:天冬氨酸半醛;dhdp:二氢吡啶-2,6-二羧酸;sucakp:琥珀酰-2-氨基-酮庚二酸;sucdap:琥珀酰-二氨基庚二酸;dl-dap:外消旋二氨基庚二酸;lys:赖氨酸;dn:戊二胺;met:甲硫氨酸;hom:高丝氨酸;thr:苏氨酸;emp:糖酵解途径;ppp:磷酸戊糖途径;tca:三羧酸循环nadph:还原型烟酰胺腺嘌呤二核苷酸磷酸;nadp:烟酰胺腺嘌呤二核苷酸磷酸;ru5p:5-磷酸核酮糖;r5p:5-磷酸核糖;x5p:5-磷酸木酮糖
具体实施方式
一种发酵生产1,5-戊二胺的方法,包括通过细菌发酵将底物转化为1,5-戊二胺,优选地,所述细菌为大肠杆菌cib132-3。大肠杆菌cib132-3的构建方法,见申请号为pct/cn2015/094121、公开号为wo2017/079872a1、公开日为2017年5月18日的pct申请,具体见该专利申请说明书实施例1-17。优选地,所述底物包括葡萄糖,更优选地,所述底物是葡萄糖。
该发酵生产1,5-戊二胺的方法包括以下步骤:
a)菌种活化;
b)利用种子培养基在种子罐中制备种子液;5-30l发酵罐,接种比0.5-1.2%(v/v),通气比0.4-0.8vvm,温度35-39℃,转速300-800rpm,罐压0.05-0.15mpa,25-28%(v/v)氨水控ph为6.0-7.0,种子成熟指标为菌浓od562达0.55-1.00(稀释25倍);
优选地,种子培养基包括:kh2po42.0-5.0g/l,mgso4·7h2o1.5-4.5g/l,mnso4·h2o10-20ppm,硫酸铵5.0-25g/l,葡萄糖50-150g/l,玉米浆0.5-3g/l,苏氨酸0.15-0.45g/l;
c)将所述种子液接种到含有发酵培养基的发酵罐中发酵:5-30l发酵罐,接种比5-12%(v/v),通气比0.4-0.8vvm,温度35-39℃,转速500-800rpm,罐压0.05-0.2mpa,25%-28%(v/v)的氨水控ph为6.0-7.0,发酵2-6h后流加发酵补料培养基,发酵周期为30-40h;
优选地,发酵培养基包括:kh2po40.2-0.6g/l,mgso4·7h2o1.0-5.0g/l,mnso4·h2o0.1-0.5g/l,硫酸铵2.0-10g/l,葡萄糖10-60g/l,玉米浆1.0-5.0g/l,苏氨酸0.1-0.3g/l;和/或
优选地,所述发酵补料培养基包括:葡萄糖500g/l-800g/l,硫酸铵200-600g/l,苏氨酸1-10g/l。
在发酵过程中分阶段控制rq,所述rq控制为1.2-2.2。所述发酵过程中分阶段控制rq是分三个阶段控制rq,在一个优选的具体实施方式中,各阶段及rq如下:
第一阶段,为发酵3-15小时,rq控制为1.2-1.8;
第二阶段,为发酵15-20小时,rq控制为1.8-2.2;
第三阶段,为发酵20小时到发酵结束,rq控制为1.5-2.2。
所述第一阶段包括第一阶段前阶段、第一阶段后阶段,所述第一阶段前阶段为发酵3-9小时,rq控制为1.2-1.5,所述第一阶段后阶段为发酵9-15小时,rq控制为1.5-1.8。
所述第三阶段包括第三阶段前阶段、第三阶段后阶段,所述第三阶段前阶段为发酵20-25小时,rq控制为1.7-2.2,所述第三阶段后阶段为发酵25小时到发酵结束,rq控制为1.5-1.7。
表1发酵不同阶段rq控制水平
通过控制铵盐的流加速度控制rq;优选地,所述铵盐包括硫酸铵,更优选地,所述铵盐是硫酸铵。
在上述任一技术方案的基础上进一步,所述rq通过质谱仪测定发酵尾气组分后通过以下公式计算得到(如,一分钟一次):
rq=cer/our
其中fin是通气速率,v是发酵液体积;cinertin、
实施例1
种子培养基:kh2po40.2%(w/v,以下各实施例、对比例的各培养基组分同;0.2%即2g/l),mgso4·7h2o0.45%,mnso4·h2o20ppm,硫酸铵0.5%,葡萄糖10%,玉米浆0.15%(总氮含量2.5wt%,下同),苏氨酸0.035%;发酵培养基:kh2po40.04%,mgso4·7h2o0.32%,mnso4·h2o0.028%,硫酸铵1.0%,葡萄糖3.0%,玉米浆0.26%,苏氨酸0.017%;发酵补料培养基:葡萄糖60%,硫酸铵20%,苏氨酸0.1%。
种子罐培养方法为:10l发酵罐(工作体积4l),接种比0.5%(v/v,以下各实施例、对比例同),通气比0.4vvm,温度35℃,转速300rpm,罐压0.05mpa,25%(v/v)氨水控ph为6.0,在菌浓od562达0.75(稀释25倍)后,接入发酵罐。
发酵罐培养方法为:10l发酵罐(工作体积5l),接种比5%(v/v,以下各实施例、对比例同),通气比0.8vvm,温度37℃,转速800rpm,罐压0.1mpa,25%(v/v)氨水控ph为7.0,发酵2h后流加补料培养基。过程中控制rq如表2所示,最终发酵周期为33h,发酵液中的戊二胺浓度为108.3g/l,其对葡萄糖的转化率为0.366(mol/mol)。
表2实施例1发酵不同阶段rq控制水平
实施例2
种子培养基:kh2po40.5%,mgso4·7h2o0.15%,mnso4·h2o10ppm,硫酸铵2.5%,葡萄糖5%,玉米浆0.30%,苏氨酸0.015%;发酵培养基:kh2po40.02%,mgso4·7h2o0.50%,mnso4·h2o0.010%,硫酸铵0.2%,葡萄糖1.0%,玉米浆0.50%,苏氨酸0.010%;发酵补料培养基:葡萄糖50%,硫酸铵60%,苏氨酸1.0%。
种子罐培养方法为:10l发酵罐(工作体积5l),接种比1.2%,通气比0.8vvm,温度39℃,转速800rpm,罐压0.15mpa,28%(v/v)氨水控ph为7.0,在菌浓od562达1.00(稀释25倍)后,接入发酵罐。
发酵罐培养方法为:30l发酵罐(工作体积15l),接种比5%,通气比0.8vvm,温度39℃,转速800rpm,罐压0.05mpa,28%(v/v)氨水控ph为7.0,发酵2h后流加补料培养基。过程中控制rq如表3所示。发酵周期为30h,最终发酵液中的戊二胺浓度为114.3g/l,其对葡萄糖的转化率为0.386(mol/mol)。
表3实施例2发酵不同阶段rq控制水平
实施例3
种子培养基:kh2po40.35%,mgso4·7h2o0.28%,mnso4·h2o15ppm,硫酸铵1.7%,葡萄糖15%,玉米浆0.05%,苏氨酸0.045%;发酵培养基:kh2po40.06%,mgso4·7h2o0.10%,mnso4·h2o0.050%,硫酸铵0.5%,葡萄糖6.0%,玉米浆0.10%,苏氨酸0.030%;发酵补料培养基:葡萄糖80%,硫酸铵40%,苏氨酸0.5%。
种子罐培养方法为:10l发酵罐(工作体积5l),接种比0.8%,通气比0.6vvm,温度37℃,转速500rpm,罐压0.10mpa,26%(v/v)氨水控ph为6.5,在菌浓od562达0.75后,接入发酵罐。
发酵罐培养方法为:5l发酵罐(工作体积3l),接种比12%,通气比0.4vvm,温度35℃,转速500rpm,罐压0.2mpa,26%(v/v)氨水控ph为6.0,发酵6h后流加补料培养基。过程中控制rq如表4所示,最终发酵周期为40h,发酵液中的戊二胺浓度为101.3g/l,其对葡萄糖的转化率为0.349(mol/mol)。
表4实施例3发酵不同阶段rq控制水平
实施例4
种子培养基:kh2po40.45%,mgso4·7h2o0.38%,mnso4·h2o17ppm,硫酸铵2.2%,葡萄糖12%,玉米浆0.15%,苏氨酸0.035%;发酵培养基:kh2po40.05%,mgso4·7h2o0.35%,mnso4·h2o0.037%,硫酸铵0.7%,葡萄糖3.9%,玉米浆0.36%,苏氨酸0.021%;发酵补料培养基:葡萄糖70%,硫酸铵55%,苏氨酸0.3%。
种子罐培养方法为:10l发酵罐(工作体积6l),接种比1.0%,通气比0.5vvm,温度38℃,转速700rpm,罐压0.12mpa,27%(v/v)氨水控ph为6.7,在菌浓od562达0.65后,接入发酵罐。
发酵罐培养方法为:20l发酵罐(工作体积10l),接种比8%,通气比0.5vvm,温度38℃,转速700rpm,罐压0.15mpa,27%(v/v)氨水控ph为6.7,发酵3h后流加补料培养基。过程中控制rq如表5所示,最终发酵周期为35h,发酵液中的戊二胺浓度为110.3g/l,其对葡萄糖的转化率为0.375(mol/mol)。
表5实施例4发酵不同阶段rq控制水平
对比例未控制rq(对照组)
种子培养基:kh2po40.3%,mgso4·7h2o0.25,mnso4·h2o10ppm,硫酸铵2.5%,葡萄糖15%,玉米浆0.15%,苏氨酸0.045%;发酵培养基:kh2po40.04%,mgso4·7h2o0.30%,mnso4·h2o0.025%,硫酸铵0.7%,葡萄糖4.0%,玉米浆0.30%,苏氨酸0.020%;发酵补料培养基:葡萄糖70%,硫酸铵60%,苏氨酸0.7%。
种子罐培养方法为:10l发酵罐(工作体积5l),接种比0.8%,通气比0.5vvm,温度37℃,转速600rpm,罐压0.10mpa,25%(v/v)氨水控ph为6.7,在菌浓od562达0.75后,接入发酵罐。
发酵罐培养方法为:10l发酵罐(工作体积5l),接种比12%,通气比0.5vvm,温度38℃,转速700rpm,罐压0.15mpa,25%(v/v)氨水控ph为6.5,发酵3h后流加配置好的补料培养基,过程中rq水平如表6所示,最终发酵周期为38h,发酵液中的戊二胺浓度为90.3g/l,其对葡萄糖的转化率为0.288(mol/mol)。
表6发酵不同阶段rq水平
以上实施例、对比例中的一些参数的检测方法如下:
菌浓检测方法:将发酵液稀释到合适浓度后,在562nm处测定其吸光值。
还原糖测定方法:将发酵液稀释到合适浓度后,使用dns方法测定。
戊二胺测定方法:将稀释至适宜浓度的发酵液经丹磺酰氯衍生10min后,使用高效液相色谱法测定。色谱柱为hyersilbdsc18(2.1mm×100mm,3μm),流动相为甲醇和水(80:20,v/v),流速0.2ml/min,柱温30℃,波长254nm。
- 还没有人留言评论。精彩留言会获得点赞!