一种以廉价底物生产亚精胺的方法及工程菌与流程
[0001]
本发明涉及一种以廉价底物生产亚精胺的方法及工程菌,属于生物工程技术领域。
背景技术:
[0002]
亚精胺(spermidine),线性分子式为nh2(ch2)3nh(ch2)4nh2,广泛存在于微生物、植物和动物体内,是一种重要的生理活性物质。亚精胺具有延长动物寿命的功效,并抵消与年龄相关的疾病,如心血管疾病,神经退行性疾病和癌症等。
[0003]
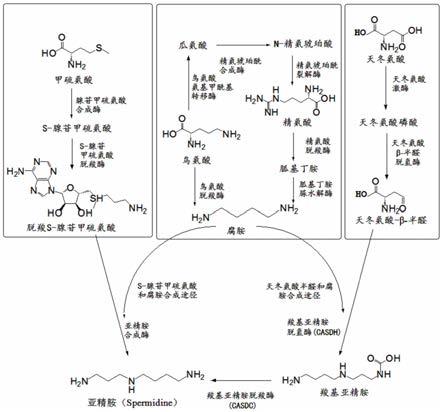
如图1所示,生物体中主要有两条途径合成亚精胺:(1)经由羧基化腺苷甲硫氨酸和腐胺在亚精胺合成酶的作用下直接合成亚精胺,羧基化腺苷甲硫氨酸可由常见的甲硫氨酸(met),经过相关酶的腺苷化和脱羧化催化得到,该途径在动物、植物和微生物体内,是比较常见的传统亚精胺合成的途径;(2)经由天冬氨酸-β-半醛和腐胺在羧基亚精胺脱氢酶和脱羧酶的催化下合成亚精胺,天冬氨酸-β-半醛可经常见氨基酸如天冬氨酸(asp)经相关酶的磷酸化和脱氢化催化合成,该途径为新发现的替代合成途径,主要存在于一些细菌中,包括重要的人类病原体,肠道菌群等。两条途径都涉及到重要的中间体-腐胺(put),腐胺可由常见的氨基酸-鸟氨酸(orn)或精氨酸(arg)经过相关酶催化合成得到,在亚精胺的合成过程中,是重要的中间底物。由于这些途径中的酶受到高度调控,动植物体的亚精胺含量较低,目前也未发现可以大量生产亚精胺的微生物。
技术实现要素:
[0004]
[技术问题]
[0005]
本发明要解决的技术问题是以廉价化合物为底物合成亚精胺,尤其是构建多酶共表达的基因工程菌,利用该基因工程菌以l-谷氨酸与天冬氨酸,或l-谷氨酸与1,3-丙二胺为底物合成亚精胺,实现亚精胺的高效生产。
[0006]
[技术方案]
[0007]
本发明提供了一种以廉价氨基酸为底物合成亚精胺的方法,是以l-谷氨酸与1,3-丙二胺为底物合成亚精胺,l-谷氨酸被γ-谷氨酸激酶(gamma-glutamyl kinase)以atp为辅酶催化生成谷氨酰-β-磷酸和adp,l-谷氨酰-β-磷酸被谷氨酸-5-半醛脱氢酶(glutamate-5-semialdehyde dehydrogenase)以nadph或nadh为辅酶催化生成l-谷氨酸半醛和nad(nadp);羧基亚精胺脱氢酶(carboxyspermidine dehydrogenase)以nadph或nadh为辅酶将l-谷氨酸半醛和1,3-丙二胺合成为异羧基亚精胺(2-amino-5-[(3-aminopropyl)amino]pentanoic acid),辅酶再生为nad(nadp),最后羧基亚精胺脱羧酶(carboxyspermidine decarboxylase)的突变体将异羧基亚精胺脱羧生成亚精胺;在以上过程中由葡萄糖脱氢酶(glucose dehydrogenase)实现nadh(nadph)的再生、由多聚磷酸盐激酶2-i(polyphosphate kinase 2-i,ppk2-i)实现atp的再生。
[0008]
所述1,3-丙二胺可经由以下途径得到:l-天冬氨酸被天冬氨酸激酶
1、prevotella bivia dsm、lactobacillus reuteri dsm 20016 20514购自德国微生物菌种保藏中心dsmz。
[0038]
2、多基因共表达体系的构建及细胞的培养
[0039]
目前大肠杆菌多基因共表达的有多种方法(大肠杆菌多基因共表达策略,中国生物工程杂志,2012,32(4):117-122),本发明采用刘向磊(合成生物学技术改造大肠杆菌生产莽草酸及白藜芦醇,2016,上海医药工业研究院,博士论文)所述方法构建,每个基因前均包含t7启动子和rbs结合点,每个基因后带有t7终止子。理论上来讲因为每个基因前都有t7和rbs,因此基因的表达强度受排列次序的影响不大。每个质粒上包含两个或多个基因,将构建好的质粒热转导入大肠杆菌感受态细胞中,并涂布于单抗或混合抗生素固体平板上,筛选得到阳性转化子,即得到重组大肠杆菌。细胞的培养:根据经典的重组大肠杆菌培养及诱导表达方案,将重组大肠杆菌按体积比为2%的量转接到lb发酵培养基(蛋白胨10g/l、酵母粉5g/l、nacl 10g/l)中,当细胞od
600
达到0.6-0.8后,加入终浓度为0.4mm的iptg,在20℃诱导表达培养8h。诱导表达结束后,4℃、8000rpm、20分钟离心收集细胞。
[0040]
3、相关酶的选择
[0041]
(1)γ-谷氨酸激酶
[0042]
选择来源于escherichia coli bl21(de)的基因ecggk,这样更有利于在大肠杆菌中的强化表达。基因ecggk在ncbi上accession no为cp001509region:264883..265986,对应的氨基酸序列是act42138.1。
[0043]
(2)谷氨酸-5-半醛脱氢酶
[0044]
选择来源于escherichia coli bl21(de)的基因ecgsd,这样更有利于在大肠杆菌中的强化表达。基因ecgsd在ncbi上accession no为1509region:4063302..4064306,对应的氨基酸序列是act45636.1。
[0045]
(3)天冬氨酸激酶
[0046]
从clostridium symbiosum atcc 14940克隆得到l-天冬氨酸激酶基因csak。基因csak在ncbi上的accession no为awsu01000003region:complement(10218..11426),对应氨基酸序列在ncbi上accession no为eri80757.1。
[0047]
(4)天冬氨酸-β-半醛脱氢酶
[0048]
从prevotella bivia dsm 20514中克隆得到天冬氨酸-β-半醛脱氢酶基因pbasadh。基因pbasadh在ncbi上的accession no为jh660660region:605188..606201,对应氨基酸序列在ncbi上accession no为:eim32299.1。
[0049]
(5)胺脱氢酶
[0050]
通常在微生物中采用转氨法将醛变成胺,但在生产中的转氨过程需持续再生氨的供体(如丙氨酸、谷氨酸等),使得工艺较为复杂。因此选择mycolicibacterium confluentis dsm 44017的基因mcad。基因mcad在ncbi上accession no为nlqoq01000021region:complement(253012..254037),对应的氨基酸序列是orv29844.1。
[0051]
(6)l-2,4双胺丁酸脱羧酶
[0052]
选择来源于acinetobacter baumannii atcc 19606的基因abdbd。基因abdbd在ncbi上accession no为gg704575region:251094..252626,对应的氨基酸序列是gg704575.1。
[0053]
(7)羧基亚精胺脱氢酶
[0054]
选择来源于rhodobacter sphaeroides atcc baa-808的基因rscsdh。基因bccsdh在ncbi上accession no为nc_007493region:59748..60986,对应的氨基酸序列是yp_351518.1。在一种实施例中对其进行了突变,得到2个最优突变体rscsdh1和rscsdh2。
[0055]
(8)羧基亚精胺脱羧酶
[0056]
选择来源于bacteroides cellulosilyticus dsm 14838的基因bccsdc。基因bccsdc在ncbi上accession no为acch01000346region:346..1506,对应的氨基酸序列是eef87925.1。在一种实施例中对其进行了突变,得到2个最优突变体bccsdc1和bccsdc2。
[0057]
(9)葡萄糖脱氢酶
[0058]
在生物转化反应中,α-羟基羧酸脱氢酶需要以nadh和/或nadph为辅酶,通常有甲酸脱氢酶、葡萄糖脱氢酶、亚磷酸酸脱氢酶等,葡萄糖脱氢酶相对于其它酶活力最高,因此本发明从bacillus subtilis atcc 13952得到葡萄糖脱氢酶基因bsgdh(相应氨基酸序列是wp_013351020.1)。
[0059]
(10)多聚磷酸盐激酶2-i
[0060]
选择来源于sinorhizobium_meliloti的编码多聚磷酸盐激酶2-i的基因smpkk,基因smpkk在ncbi上accession no为nc_003047region:complement(564142..565044),对应的氨基酸序列是np_384613.1。
[0061]
4、样品的检测分析
[0062]
腐胺、亚精胺、异羧基亚精胺含量的测定方法根据文献进行测定(an alternative polyamine biosynthetic pathway is widespread in bacteria and essential for biofilm formation in vibrio cholerae,j biol chem.2009apr 10;284(15):9899
–
9907.)。
[0063]
羧基亚精胺脱氢酶活力采用经典的nadh生成或减少的方法进行测定(the kinetics and mechanism of liver alcohol dehydrogenase with primary and secondary alcohols as substrates.biochemical journal 1966,100:34.)。比酶活(u mg-1
)定义为每mg酶所具有的酶活力单位。一个酶活力单位(u)定义为1min生成或减少1μmol nadh所需的酶量。
[0064]
羧基亚精胺脱氢酶活力测定:3ml反应体积中1,3丙二胺1mm、谷氨酸-5-半醛1mm、nadh 0.12mm、ph8、温度35℃,340nm测定nadh的减少速率。比酶活(u mg-1
)定义为每mg酶所具有的酶活力单位。一个酶活力单位(u)定义为1min生成或减少1μmol nadh所需的酶量。
[0065]
羧基亚精胺脱羧酶活力测定:于3ml反应体系中含有5mm异羧基亚精胺,50mm磷酸缓冲液(ph8.0),2mm二硫苏糖醇和50μm mplp,37℃水浴30min后,加入1ml 10%三氯乙酸终止反应,离心(8000rpm/min)5min后,hplc分析亚精胺的生成量。比酶活表示为每分钟每mg酶形成的亚精胺的μmol。
[0066]
5.酶的随机突变高通量筛选
[0067]
按照生产商提供的使用说明书,用genemorph ii random mutagenesis试剂盒对目标片段进行易错pcr随机突变。用表1的引物对模板进行pcr扩增。扩增体系为:10
×
mutazyme ii reaction buffer 5μl、模板dna 1μl、sample primers(125ng/μl of each primer)1μl、40mm dntp mix(200μm each final)1μl、mutazyme ii dna polymerase
(2.5u/μl)1μl、ddh2o 41μl。扩增程序为:95℃,2min;95℃,30sec;55℃,30sec;72℃,2min,共30个循环;72℃,10min。
[0068]
将产生的pcr产物和质粒pet28a质粒进行双酶切。酶切体系为:10
×
cut buffer 5μl,dna10μl,限性内切酶1和限制性内切酶2各1μl,无菌水33μl。将pet28a质粒和pcr产物于37℃水浴下双酶切1h。
[0069]
然后分别回收酶切产物,并于16℃水浴下连接12h-16h,连接体系为:10
×
dna ligase buffer 2.5μl,dna片段8μl,载体dna 2μl,t4 dna ligase 1μl,无菌水11.5μl共25μl。随后在连接体系中加入100μl bl21感受态细菌,轻混匀,冰浴30min。放入预热的42℃水浴中,放置90s进行热休克处理。立即冰浴2min。加入1ml不含抗生素的lb培养液,37℃培养1h使菌体复苏。最后将菌体均匀涂布在含氨苄青霉素的lb平板上,培养24h。
[0070]
将平板上所有转化子挑到每孔含1ml lb液体培养基(100μg/ml氨苄青霉和0.2mmol/l iptg)的96深孔板中,放置于多孔板震荡培养箱中,37℃,200r/min培养10小时,从而完成整个突变库的构建。
[0071]
如上步骤完成羧基亚精胺脱氢酶突变库的构建,并在诱导表达结束后,在96孔板中加入20mg/ml蜗牛酶10μl,37℃保温1h。然后取0.5ml破壁液重新放于96孔板中,分别添加50μl 28g/l的l-谷氨酸半醛和1,3-丙二胺,辅酶nadh 0.8mm,检测还原型辅酶nadh在340nm下的数值降低斜率,斜率越大酶活越高。整个过程在enspire多标记检测系统酶标仪中自动完成。经过粗筛后将活性高的酶表达并纯化,采用纯酶测定其活性。
[0072]
如上步骤完成羧基亚精胺脱羧酶突变库的构建,并在诱导表达结束后,在96孔板中加入20mg/ml蜗牛酶10μl,37℃保温1h。然后取0.5ml破壁液重新放于96孔板中,分别添加50μl 28g/l的异羧基亚精胺,辅酶plp 0.8mm。反应10min后,加入50μl溴甲酚绿指示液,颜色越浅,酶活越高。整个过程在enspire多标记检测系统酶标仪中自动完成。经过粗筛后将活性高的酶表达并纯化,采用纯酶测定其活性。
[0073]
实施例1:羧基亚精胺脱氢酶的突变与筛选
[0074]
从rhodobacter sphaeroides atcc baa-808克隆得到羧基亚精胺脱氢酶基因rscsdh。氨基酸序列在ncbi上accession no为yp_351518.1。表达产物用于合成羧基亚精胺。将克隆得到的基因分别连接到petduet-1载体上,转化escherichia coli bl21(de),进行表达纯化。诱导表达纯化方法:将重组大肠杆菌按体积比为2%的量转接到lb发酵培养基(蛋白胨10g/l、酵母粉5g/l、nacl 10g/l)中,当细胞od
600
达到0.6-0.8后,加入终浓度为0.4mm的iptg,在20℃诱导表达培养8h。诱导表达结束后,4℃、8000rpm、20分钟离心收集细胞。破胞后histag标签法纯化酶,得到纯酶后测定活性。
[0075]
因为羟基亚精氨脱氢酶的天然底物是天冬半醛和腐胺(1,4-丁二胺),以1,3-丙二胺和谷氨酸-5-半醛为底物,nadh为辅酶测定酶的活力,羧基亚精胺脱氢酶基因rscsdh表达的酶的比酶活力为:0u/mg。要以1,3-丙二胺和谷氨酸-5-半醛为底物,需要进行突变。基于易错pcr和高通量筛选平台,参照前述“5.酶的随机突变高通量筛选”,筛得到可以进行反应的随机突变基因rscsdh1,rscsdh2,其核酸序列如:seq id no:1、seq id no:2所示。表达的酶的比酶活分别为:43.1、22.6u/mg。
[0076]
实施例2:羧基亚精胺脱羧酶的突变与筛选表达
[0077]
从bacteroides cellulosilyticus dsm 14838中得到羧基亚精胺脱羧酶基因
bccsdc(氨基酸序列是eef87925.1)。与实施例1同样的方法进行诱导表达和纯化。以异羧基亚精胺为底物,测定羧基亚精胺脱羧酶基因bccsdc表达的酶的比活力为0u/mg。参照前述“5.酶的随机突变高通量筛选”,采用随机突变筛选得到酶活性最高的基因bccsdc1,bccsdc2,其核酸序列如seq id no:3、seq id no:4所示。表达的酶的比酶活分别为:32.1、56.6u/mg。
[0078]
实施例3:同时表达6种酶的重组大肠杆菌的构建
[0079]
重组大肠杆菌构建:将6种基因(γ-谷氨酸激酶ecggk、谷氨酸-5-半醛脱氢酶ecgsd、羧基亚精胺脱氢酶rscsdh、羧基亚精胺脱羧酶bccsdc、葡萄糖脱氢酶bsgdh、多聚磷酸盐激酶2-i smpkk)分别连接到petduet-1、pacycduet-1、prsfduet-1或pcdfduet-1质粒上,每个质粒上表达2种基因,每个基因前均包含t7启动子和rbs结合点,基因后带有t7终止子。将3个重组质粒转化入大肠杆菌escherichia coli bl21,利用混合抗生素平板筛选得到阳性转化子,即得到如表1所示的6种可强化表达6个基因的重组大肠杆菌。
[0080]
构建全细胞转化生产体系,所述全细胞转化生产的体系中,包括细胞湿重为200g/l,l-谷氨酸20g/l,1,3-丙二胺20g/l,atp 1g/l,nad 1g/l,六聚偏磷酸钠100g/l,氯化铵80g/l,ph 8;于40℃反应,时间24小时。
[0081]
表1不同菌株的转化结果
[0082][0083][0084]
实施例4:同时表达10种酶的重组大肠杆菌的构建
[0085]
重组大肠杆菌构建:将10种基因进行选择(γ-谷氨酸激酶ecggk、谷氨酸-5-半醛脱氢酶ecgsd、天冬氨酸激酶csak、天冬氨酸-β-半醛脱氢酶pbasadh、胺脱氢酶mcad、l-2,4双胺丁酸脱羧酶abdbd、羧基亚精胺脱氢酶rscsdh、羧基亚精胺脱羧酶bccsdc、葡萄糖脱氢酶bsgdh、多聚磷酸盐激酶2-i smpkk),有选择地连接到petduet-1、pacycduet-1、prsfduet-1、pcdfduet-1质粒上,每个质粒上表达2-3个基因,每个基因前均包含t7启动子和rbs结合点,基因后带有t7终止子。将4个质粒转化入大肠杆菌escherichia colibl21,利用混合抗生平板筛选得到阳性转化子,即得到如表2所示的11种可强化表达10个基因的重组大肠杆菌。
[0086]
将重组大肠杆菌诱导表达完成后收集菌体,于100ml反应体系中,细胞湿重为200g/l,l-谷氨酸20g/l,l-天冬氨酸20g/l,atp 1g/l,nad 1g/l,六聚偏磷酸钠100g/l,氯化铵80g/l,ph 8;于35℃反应,时间24小时。转化结束后利用液相色谱测定反应液中亚精胺的浓度,结果如表2所示。
[0087]
表2不同菌株的转化结果
[0088][0089][0090]
实施例5:构建多个重组大肠杆菌全细胞催化合成亚精胺
[0091]
构建如下2种重组菌escherichia coli bl21(de3)/prsfduet-1-ecggk-ecgsd+pcdfduet-1-smpkk-bsgdh(命名为e1)、escherichia coli bl21(de3)/petduet-1-rscsdh2-bccsdc2-bsgdh(命名为e2)。e1的功能是将l-谷氨酸转化成谷氨酸-5-半醛、e2将1,3丙二胺与谷氨酸-5-半醛合成为亚精胺。e1和e2中均有基于nad辅酶的氧化还原酶,因此均表达了葡萄糖脱氢酶。
[0092]
根据实施例1所述的方法,将e1、e2分别诱导表达,然后收集菌体。于100ml反应体系中,e1细胞湿重为30g/l,e2细胞湿重为30g/l、1,3-丙二胺10g/l,l-谷氨酸10g/l,atp 1g/l,nad 1g/l,六聚偏磷酸钠50g/l,ph 8;于30℃反应,时间12小时。转化结束后液相色谱测定反应液中亚精胺浓度为8.2g/l。
[0093]
实施例6:构建多个重组大肠杆菌全细胞催化合成亚精胺
[0094]
与实施例5类似地构建如下4种重组菌escherichia coli bl21(de3)/prsfduet-1-ecggk-ecgsd+petduet-smpkk-bsgdh(命名为e4)、escherichia coli bl21(de3)/prsfduet-1-csak-pbasadh+petduet-1-smpkk-bsgdh(命名为e5)、escherichia coli bl21(de3)/petduet-1-mcad-bsgdh(命名为e6)、escherichia coli bl21(de3)/petduet-1-rscsdh1-bccsdc1+prsfduet-bsgdh-abdbd(命名为e7)。
[0095]
根据实施例1所述的方法,将e4、e5、e6、e7分别诱导表达,然后收集菌体。于100ml反应体系中,e4细胞湿重为60g/l,e5细胞湿重为60g/l、e6细胞湿重为60g/l、e7细胞湿重为60g/l、l-精氨酸40g/l,l-天冬氨酸40g/l,氯化铵80g/l,atp 1g/l,nad 1g/l,六聚偏磷酸
钠200g/l,ph 7;于40℃反应,时间12小时。转化结束后液相色谱测定反应液中亚精胺浓度为33.5g/l。
[0096]
实施例7:应用十种酶体外合成亚精胺
[0097]
将ecggk、ecgsd、csak、pbasadh、mcad、abdbd、rscsdh1、bccsdc1、bsgdh、smpkk十个基因分别连接到pedtduet-1载体上,采用与实施例1同样的方法表达纯化后得到十种纯酶。然后于100ml反应体系中加入这十种纯酶各1mg,l-谷氨酸20g/l,l-天冬氨酸20g/l,atp 1g/l,nad 0.1g/l,六聚偏磷酸钠200g/l,ph 9;于25℃反应,时间3小时,最终液相色谱测定反应液中亚精胺浓度为18.1g/l。
[0098]
实施例8:应用六种酶体外合成亚精胺
[0099]
将ecggk、ecgsd、rscsdh2、bccsdc2、bsgdh、smpkk六个基因分别连接到pedtduet-1载体上,采用与实施例1同样的方法表达纯化后得到六种纯酶。然后于100ml反应体系中加入这六种纯酶各1mg,l-谷氨酸20g/l,1,3-丙二胺20g/l,atp 0.2g/l,nad 1g/l,ph 8;于30℃反应,时间4小时,最终液相色谱测定反应液中亚精胺浓度为18.6g/l。
[0100]
实施例9:
[0101]
根据实施例1所述的方法,将e.coli bl21(de3)/prsfduet-1-ecggk-ecgsd+petduet-1-rscsdh2-bccsdc2+pcdfduet-1-smpkk-bsgdh,诱导表达,然后收集菌体。于100ml反应体系中,细胞湿重为200g/l、1,3-丙二胺100g/l,l-谷氨酸100g/l,atp 1g/l,nad 1g/l,六聚偏磷酸钠300g/l,ph 8.5;于40℃反应,时间48小时。转化结束后液相色谱测定反应液中亚精胺浓度为90g/l。
[0102]
实施例10:
[0103]
根据实施例1所述的方法,将e.colibl21(de3)/prsfduet-1-ecggk-ecgsd-smpkk+petduet-1-csak-pbasadh-bsgdh+pcdfduet-1-mcad-abdbd+pa cycduet-1-rscsdh1-bccsdc1诱导表达,然后收集菌体。于100ml反应体系中,细胞湿重为200g/l、l-天冬氨酸100g/l,l-谷氨酸100g/l,atp 1g/l,nad 1g/l,六聚偏磷酸钠300g/l,氯化铵80g/l,ph 8.5;于40℃反应,时间48小时。转化结束后液相色谱测定反应液中亚精胺浓度为84g/l。
[0104]
实施例11:
[0105]
根据实施例1所述的方法,将e.coli bl21(de3)/pcdfduet-1-ecggk-ecgsd+prsfduet-1-rscsdh2-bccsdc2+petduet-1-smpkk-bsgdh诱导表达,然后收集菌体。于100ml反应体系中,细胞湿重为1g/l、1,3-丙二胺1l,l-谷氨酸1g/l,atp0.1g/l,nad 0.1g/l,六聚偏磷酸钠10g/l,ph 5于15℃反应,时间1小时。转化结束后液相色谱测定反应液中亚精胺浓度为0.18g/l。
[0106]
实施例12:
[0107]
根据实施例1所述的方法,将e.colibl21(de3)/prsfduet-1-mcad-abdbd-ecgsd+petduet-1-rscsdh2-bccsdc2+pcdfduet-1-ecggk-smpkk+pacy cduet-1-csak-pbasadh-bsgdh诱导表达,然后收集菌体。于100ml反应体系中,细胞湿重为1g/l、l-天冬氨酸1g/l,l-谷氨酸1g/l,氯化铵1g/l,atp 0.1g/l,六聚偏磷酸钠300g/l,ph 5;于15℃反应,时间1小时。转化结束后液相色谱测定反应液中亚精胺浓度为90mg/l。
[0108]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范
围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1