一种利用枯草芽孢杆菌工程菌高产D‑核糖的方法与流程
本发明属于生物工程技术领域,涉及工业微生物的育种及工业品的微生物发酵制备,尤其涉及一种利用枯草芽孢杆菌工程菌高产D-核糖的方法。
背景技术:
D-核糖是一种五碳糖,是生命遗传物质核糖核酸以及生理活性物质ATP、NADH、NADPH、FADH的重要组成部分,是生物体内能量代谢的主要参与者,具有重要的生理功能。
D-核糖在工业中主要用于核黄素维生素B2以及食品鲜味剂的生产,近年来,更多的研究已将D-核糖可作为医药中间体,用于抗病毒、抗肿瘤药物的合成,另外,D-核糖还可以作为辅助药物用于治疗心肌局部缺血、过度劳损引起的肌肉僵硬、肌肉酸痛等病症。
D-核糖的生产方法包括从酵母核酸中提取、化学合成法以及利用微生物菌株发酵转化。提取法和化学合成生产D-核糖因为生产效率低、工艺复杂等诸多原因始终没有形成规模化生产。微生物发酵法生产D-核糖生产效率高、工艺简便、生产成本低,使D-核糖价格大幅度下降,真正实现了D-核糖规模化生产。
D-核糖生产菌株多是通过传统诱变筛选转酮酶缺陷型突变株。1970年Sasajima等人发现一株枯草芽孢杆菌转酮酶缺失突变株积累D-核糖,产量达35g/L,并且发现一株转酮酶缺失回复突变株不再积累D-核糖,证明D-核糖积累是由于转酮酶缺失造成的(Sasajima K et al.Agric Biol Chem,35(4),509-517,1971)。对于D-核糖的发酵生产,开发出发酵性能优良、产率高的工程菌株仍是本领域技术人员面临的主要问题。
技术实现要素:
发明人前期通过传统诱变的手段选育获得一株转酮酶缺失突变株SFR-4,经条件优化后该菌株D-核糖产率可达到62.3g/L(赵祥颖等,食品与药品,7(3):23-26,2005),然而发明人进一步研究发现由于随机诱变产生的负突变积累,菌株SFR-4环境耐受性较差,生长缓慢,在工业生产过程中存在较大的染菌风险,这成为限制该菌株D-核糖发酵效率提升、成本下降的一个重要原因。
针对现有技术存在的上述问题,尤其是针对菌株SFR-4环境耐受性较差、生长缓慢、在工业生产过程中存在较大的染菌风险的问题,本发明提供一株抗逆 性强、生长旺盛、不易染菌的D-核糖发酵的枯草芽孢杆菌工程菌,本发明基于现有传统诱变选育获得转酮酶缺陷型D-核糖高产枯草芽孢杆菌抗逆性差的问题,通过分子生物学手段获得一株具有抗逆性好、耗糖速度快D-核糖生产菌株,进一步的,通过发酵工艺控制和代谢调控条件改变,调控菌株自身的代谢流向,使得该菌株更倾向于发酵生产D-核糖,可显著提高D-核糖的产量和产率。
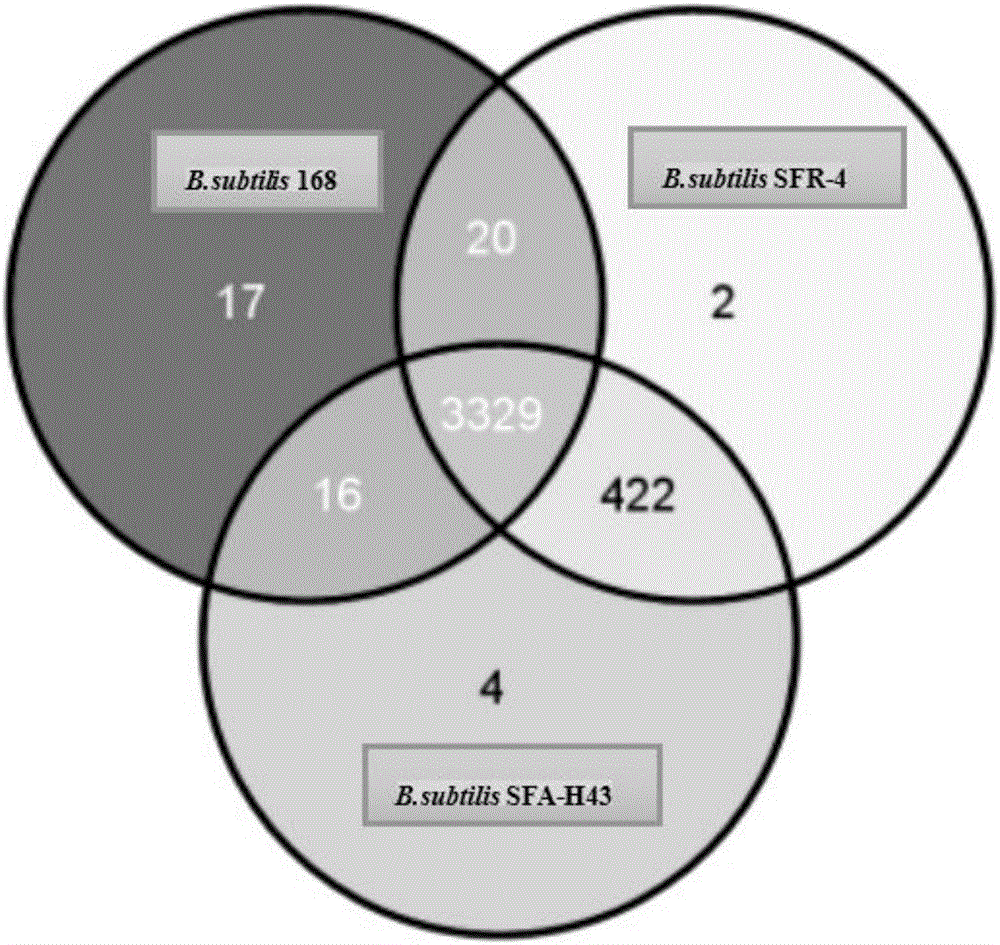
发明人将菌株SFR-4进行了全基因组测序,针对测序结果,发明人偶然发现菌株SFR-4与另一株发明人分离的积累3-羟基丁酮的枯草芽孢杆菌菌株SFA-H43(赵祥颖等,一株产3-羟基丁酮的芽孢杆菌及其应用,中国专利CN 103333842A,保藏号CCTCC No:M2013181)基因组功能基因组成高度相似,而与枯草芽孢杆常用168菌株比较差异相对较大(见附图1)。
进一步的,通过对三菌株的转酮酶基因比对,发现SFR-4菌株转酮酶基因的后50bp基因序列较SFA-H43菌株发生了明显变异(见附图2)。发明人通过对两株菌(SFR-4、SFA-H43)进行比较研究,发现菌株SFA-H43对环境的耐受力比菌株SFR-4强,且生长旺盛,耗糖速度快,发酵过程不易染菌。基于上述分析,发明人预期,如果将菌株SFA-H43正常的转酮酶基因替换成菌株SFR-4发生了变异的转酮酶基因,即可获得转酮酶发生变异的SFA-H43工程菌株,预期该工程菌株可以积累D-核糖,同时仍然保持菌株SFA-H43其他优良特性,提高D-核糖发酵的抗逆性、减少发酵染菌风险。
基于上述分析和试验,具体的,本发明涉及以下技术方案:
首先,本发明提供了一种用于D-核糖生产的枯草芽孢杆菌工程菌,所述工程菌为枯草芽孢杆菌SFA-H43菌株中转酮酶基因替换为SEQ ID NO.7所示基因序列后获得的工程菌。
优选的,SEQ ID NO.7所示基因序列源自枯草芽孢杆菌SFR-4菌株的转酮酶基因。
所述枯草芽孢杆菌SFA-H43菌株,保藏号为CCTCC No:M2013181。
所述枯草芽孢杆菌SFR-4菌株,为发明人早先筛选到的转酮酶缺失突变株,参见赵祥颖等,食品与药品,7(3):23-26,2005;公众可以合理途径获得。
具体的,本发明所述用于D-核糖生产的枯草芽孢杆菌工程菌,为枯草芽孢杆菌SFA-H43菌株中转酮酶基因终止密码子前500bp序列,替换为枯草芽孢杆菌SFR-4菌株的转酮酶基因终止密码子前500bp序列(包含突变位点)获得的 工程菌。
本发明优选的实施方案中,公开了一株用于D-核糖生产的枯草芽孢杆菌(Bacillus subtilis)工程菌SFR-43T,该菌株于2016年11月23日保藏于中国典型培养物保藏中心,保藏地址为:湖北省武汉市武昌珞珈山,保藏号为:CCTCC M 2016666。
所述用于D-核糖生产的枯草芽孢杆菌工程菌株SFR-43T,在LB培养基平板上37℃培养培养12h开始出现菌落,24小时菌落直径约1.0-1.5mm,菌落呈圆形,边缘不整齐,乳白色,扁平、表面光滑,不透明,与菌株SFA-H43菌落有明显区别;在LB液体培养基中,37℃摇床培养12-20小时,细胞呈直杆状,呈单个或短链存在,革兰氏染色阳性,产孢子能力显著降低。
所述菌株SFR-43T,为转酮酶突变工程菌株,控制合适的培养条件(培养温度、pH、溶解氧等)和培养基组分(碳源、氮源、无机盐等),该菌株在发酵液中可以大量积累D-核糖。
所述菌株SFR-43T是通过分子生物学的方法获得的,其亲株为SFA-H43菌株,发生突变的转酮酶基因来自D-核糖生产菌株SFR-4。
所述菌株SFR-43T构建方法,其通过同源重组的方法,将枯草芽孢杆菌SFA-H43菌株中转酮酶基因替换为SEQ ID NO.7所示基因序列。
优选的,SEQ ID NO.7所示基因序列源自枯草芽孢杆菌SFR-4菌株的转酮酶基因。
具体的,用于D-核糖生产的枯草芽孢杆菌工程菌SFR-43T的构建方法中,同源重组替换的基因片段为,枯草芽孢杆菌SFA-H43菌株中转酮酶基因终止密码子前500bp序列替换为枯草芽孢杆菌SFR-4菌株的转酮酶基因终止密码子前500bp序列。
本发明优选的实施方案中,所述菌株SFR-43T是通过下述步骤构建而成的(构建流程参见附图3):
(1)以菌株SFR-4基因组为模板,扩增该菌株转酮酶基因终止密码子前500bp片段(包含突变位点),称为L-tkt(其序列如SEQ ID NO.10所示),其中下游引物含有质粒p7Z6的lox71-zeo-lox66片段前端25bp互补序列;优选的,所用引物序列为SEQ ID NO.1和SEQ ID NO.2所示;
(2)以菌株SFA-H43基因组为模板,扩增其转酮酶基因下游500bp片段, 为R-tkt(其序列如SEQ ID NO.11所示),其中上游引物含有质粒p7Z6的lox71-zeo-lox66末端25bp互补序列;优选的,所用引物序列为SEQ ID NO.3和SEQ ID NO.4所示;
(3)以质粒p7Z6为模板,扩增携带有lox位点的博来霉素抗性基因片段lox71-zeo-lox66;优选的,所用引物序列为SEQ ID NO.5和SEQ ID NO.6所示;
(4)采用融合PCR方法,将L-tkt、lox71-zeo-lox66、R-tkt融合;优选的,融合PCR所用引物序列为SEQ ID NO.1和SEQ ID NO.4所示;
(5)将融合片段转化菌株SFA-H43,通过博来霉素抗性平板筛选整合型重组突变菌株,获得了含有菌株SFR-4转酮酶突变位点的菌株SFA-H43的工程菌株,并采用Cre/lox系统方法敲除工程菌株中的抗性基因zeo(Xin Yan et al.Appled and Environmental Microbiology,2008,74(17):5556-5562.),获得不带抗生素抗性基因的安全转酮酶突变工程菌株,命名为SFR-43T。
本发明目的是提供一种利用枯草芽孢杆菌工程菌SFR-43T高产D-核糖发酵生产工艺。其采用如下方式进行:
(1)菌种培养:将工程菌株活化后接种到种子培养基培养,获得一级种子和/二级种子;
(2)D-核糖发酵:将步骤(1)培养好的一级或二级种子接种到发酵罐中,进行通风搅拌培养,培养过程中,控制pH,通过调节搅拌转速和通风比,控制溶解氧进行发酵;发酵过程中,流加葡萄糖酸内酯进行代谢流的调控。
在本发明一个优选的实施方案中,发酵过程中,进行补料培养,流加葡萄糖和葡萄糖酸内酯,两者重量比例为(2-4):(4-6)。
优选的实施方案中,步骤(1)菌种培养:取35-40℃培养2-3天工程菌株的新鲜斜面,用接种环取1-2环斜面菌种,接种到50ml液体种子培养基中,35-40℃,150-200rpm,摇瓶培养10-16小时,是为一级种子。将一级种子以1-10%的(体积百分数)接种种子培养基,35-40℃培养6-12小时,是为二级种子;
优选的实施方案中,步骤(2)发酵罐发酵:将步骤(1)培养好的一级或二级种子以1-10%(体积百分数)的接种量接种到发酵罐中(55-65%的装液量),35-40℃进行通风搅拌培养,培养过程中,通过流加物料控制pH在5-7,通过调节搅拌转速和通风比,保持发酵液中相对溶解氧浓度10-50%;补料时流加物料为按一定比例配制的葡萄糖和葡萄糖酸内酯,控制发酵过程总碳源添加量为120-150g/L。
进一步地,上述斜面培养所用的斜面菌种培养基的组成为:酵母浸提物5g/L,蛋白胨10g/L,NaCl 3g/L,琼脂20g/L,其余为水,pH7.0-7.2。
进一步地,上述液体一级种子培养基的组成为:葡萄糖20-40g/L,酵母浸提物2-10g/L,玉米浆8-12g/L,pH 7.0-7.2。
进一步地,上述二级种子培养基的组成为:葡萄糖30-60g/L,酵母浸提物2-10g/L,玉米浆8-12g/L,(NH4)2SO4 2-3g/L,MgSO4 2g/L,pH 7.0-7.2。
进一步地,上述发酵罐发酵初始培养基组成为:葡萄糖120-150g/L,酵母浸提物3-6g/L,玉米浆5-10g/L,(NH4)2SO4 2-3g/L,MgSO4 2g/L,MnSO4 0.2g/L,pH 6.0-7.2。
进一步地,上述发酵过程中流加物料组成为:葡萄糖200-400g/L,葡萄糖酸内酯600-400g/L,酵母浸提物0.5-1g/L。
优选的,所述一级种子培养基培养的时间为12-14小时。
优选的,所述二级种子培养基培养的时间为6-8小时。
优选的,所述发酵过程培养温度为36-38℃。
优选的,所述发酵过程pH控制在5.5-6.5。
优选的,所述发酵过程溶解氧浓度保持在20-30%。
优选的,所述流加物料组成为:葡萄糖200-300g/L,葡萄糖酸内酯600-500g/L,酵母浸提物0.4-0.6g/L。
本发明取得了以下优点和积极效果:
(1)本发明基于菌株SFR-4与菌株SFA-H43基因组功能基因组成高度相似的发现以及SFR-4菌株转酮酶基因50bp基因序列较SFA-H43菌株发生了明显变异的特点,将SFR-4菌株与SFA-H43菌株的优势进行组合;本发明选用的转化用亲株SFA-H43为自然筛选的积累3-羟基丁酮的菌株,经全基因组测序比较分析与D-核糖高产菌株SFR-4同源性较高,转酮酶基因序列除突变位点外核酸序列完全相同,本发明采用同源重组的方法将菌株SFR-4菌株的转酮酶基因突变序列转入菌株SFA-43,替换该菌株转酮酶基因的正常序列,获得一株转酮酶发生变异的工程菌株SFR-43T,经发酵试验验证,工程菌株SFR-43T既保持了菌株SFA-43的其他优良性能(抗逆性好、耗糖速度快),同时可以积累高浓度的D-核糖。
(2)SFA-H43菌株为发明人前期分离的适于生产3-羟基丁酮的菌株,将SFA-H43菌株中转酮酶基因替换为SFR-4菌株的转酮酶基因后,获得的工程菌株SFR-43T可以以葡萄糖为原料发酵产D-核糖同时联产3-羟基丁酮。本发明为了提高D-核糖的产率和转化率,降低3-羟基丁酮的产量,对工程菌的发酵培养基组成和发酵工艺控制(流加物和条件)进行优化控制,减少3-羟基丁酮的代谢流,使其更多的流向D-核糖积累,显著提高了D-核糖的产量和产率。
附图说明:
图1菌株SFR-4、菌株SFA-H43、菌株168基因组功能基因相似度分析
图2菌株SFR-4、菌株SFA-H43、菌株168转酮酶基因序列差异位点的比对
图3工程菌SFR-43T的构建路线图
图4工程菌SFR-43T发酵进程
图5菌株SFR-4发酵进程
图6菌株SFR-43T高产D-核糖发酵进程
具体实施方式:
下述实施例中的方法,如无特别说明,均为常规方法,所用引物合成均购自华大基因,所用质粒p7Z6及质粒pDGC由南京农业大学赠与(Xin Yan et al.Appled and Environmental Microbiology,74(17):5556-5562,2008.)。
实施例1菌株SFR-43T构建
(1)以菌株SFR-4基因组为模板,扩增该菌株转酮酶基因终止密码子前500bp片段(包含突变位点),称为L-tkt(其序列如SEQ ID NO.10所示)。其下游引物含有lox71-zeo-lox66前端25bp互补序列。
模板:菌株SFR-4基因组
上游引物:GCAGCATGGAAGCTTGCAG(SEQ ID NO.1)
下游引物:TATAATGTATGCTATACGAACGGTATTATCTTGATACTATATAG AAACATCTCAAGG(SEQ ID NO.2)
PCR反应体系(50uL):菌株SFR-4基因组DNA模板1uL,上游引物1uL,下游引物1uL,2*Buffer 25uL,dNTP 4uL,高保真PCR酶PrimeSTAR 0.5uL,无菌水17.5uL。
PCR反应条件:95℃变性5min,98℃10s,60.3℃30s,72℃30s,33个循环。
扩增产物通过1%琼脂糖凝胶电泳检测并收集。
(2)以菌株SFA-H43基因组为模板,扩增其转酮酶基因下游500bp片段,为R-tkt(其序列如SEQ ID NO.11所示)。其上游引物含有lox71-zeo-lox66末端25bp互补序列。
模板:菌株SFA-H43基因组
上游引物:
ATAACTTCGTATAGCATACATTATAGCTTTTGAAAGAGGATGAGTCAAAT(SEQ ID NO.3)
下游引物:AAAGAATATCGTTTCTGCCTCGTAA(SEQ ID NO.4)
PCR反应体系(50uL):菌株SFA-H43基因组DNA模板1uL,上游引物1uL,下游引物1uL,2*Buffer 25uL,dNTP 4uL,高保真PCR酶PrimeSTAR 0.5uL,无菌水17.5uL。
PCR反应条件:95℃变性5min,98℃10s,60.8℃30s,72℃30s,33个循环。
扩增产物通过1%琼脂糖凝胶电泳检测并收集。
(3)以质粒p7Z6为模板,扩增携带有lox位点的博来霉素抗性基因(zeo)片段lox71-zeo-lox66。
模板:质粒p7Z6
上游引物:TACCGTTCGTATAGCATACATTATACG(SEQ ID NO.5)
下游引物:TATAATGTATGCTATACGAAGTTATTCAGTC(SEQ ID NO.6)
PCR反应体系(50uL):菌株SFA-H43基因组DNA模板1uL,上游引物1uL,下游引物1uL,2*Buffer 25uL,dNTP 4uL,高保真PCR酶PrimeSTAR 0.5uL,无菌水8.5uL。
PCR反应条件:95℃变性5min,98℃10s,59.2℃30s,72℃30s,33个循环。
扩增产物通过1%琼脂糖凝胶电泳检测并收集。
(4)采用融合PCR方法,制备L-tkt、lox71-zeo-lox66、R-tkt融合片段。
①融合反应
融合PCR反应体系:L-tkt基因片段3uL,R-tkt基因片段3uL,lox71-zeo-lox66zeo基因片段3uL,2*Buffer 25uL,dNTP 4uL,高保真PCR酶PrimeSTAR 0.5uL,无菌水11.5uL。
融合PCR反应条件:95℃变性5min,98℃10s,59.2℃30s,72℃90s,10个循环。
②扩增反应
模板:融合片段
上游引物:GCAGCATGGAAGCTTGCAG(SEQ ID NO.1)
下游引物:AAAGAATATCGTTTCTGCCTCGTAA(SEQ ID NO.4)
反应体系:融合片段10uL,上游引物1uL,下游引物1uL,2*Buffer 25uL,dNTP 4uL,高保真PCR酶PrimeSTAR 0.5uL,无菌水8.5uL。
反应条件:95℃变性5min,98℃10s,59.2℃30s,72℃90s,33个循环。
扩增产物通过1%琼脂糖凝胶电泳检测并收集。
(5)采用电转法将该融合片段转化SFA-H43菌株,通过博来霉素抗性平板(25ug/mL)筛选到8株抗性菌株,经多次传代获得4株遗传稳定菌株,经摇瓶发酵发现有3株菌积累D-核糖,挑选其中一株进行下一步抗性基因zeo敲除。
(6)采用电转法将质粒pDGC导入(5)获得的重组工程菌株中,采用IPTG诱导质粒中cre基因的表达,采用Cre/lox系统方法敲除重组体中的zeo基因,经筛选和发酵试验获得一株携带菌株SFR-4转酮酶基因突变序列、且不带抗性基因的转酮酶突变工程菌株,命名为SFR-43T。
该菌株于2016年11月23日保藏于中国典型培养物保藏中心,保藏地址为:湖北省武汉市武昌珞珈山,保藏号为:CCTCC M 2016666。
实施例2菌株SFR-43T产物分析
取37℃培养2天菌株SFR-43T的新鲜斜面,用接种环取1-2环斜面菌种,接种到液体种子培养基中,37℃,180rpm摇床培养14小时,接种量5%,接种入发酵培养基中,37℃,180rpm摇瓶培养72小时。发酵液经4500rpm离心10min,取上清,进行产物分析,结果显示菌株SFR-43T发酵液中同时检出3-羟基丁酮和D-核糖组分。
发酵培养基(g/L):葡萄糖150g/L,酵母浸提物5g/L,玉米浆10g/L,(NH4)2SO42.5g/L,MgSO4 2g/L,MnSO4 0.2g/L,pH6.5。
实施例3发酵培养基优化
本发明以菌株SFR-4D-核糖发酵培养基为基础,对菌株SFR-43T发酵D-核糖的培养基氮源等组分进行了进一步优化。
氮源优选:取37℃培养2天菌株SFR-43T的新鲜斜面,用接种环挑取1-2环,接种到液体种子培养基中,37℃,180rpm摇床培养14小时,接种量5%,接种到含不同氮源的摇瓶发酵培养基(氮源分别为蛋白胨、酵母浸提物、玉米浆干粉、硝酸铵、磷酸氢二铵、硫酸铵,浓度均为10g/L,碳源为葡萄糖,其他组分相同),37℃,180rpm摇瓶培养72小时。发酵液经离心去菌体,上清液用于D-核糖含量测定。结果显示菌株SFR-43T单独利用蛋白胨、酵母浸提物、玉米浆干粉、硝酸铵(NH4NO3)、磷酸氢二铵((NH4)2HPO4)、硫酸铵((NH4)2SO4)为氮源均可产生D-核糖,其中单独利用酵母浸提物为氮源,D-核糖产量最高。考虑到酵母浸提物售价较高,本发明对多种复合氮源的各成分进行组合优选,结果当酵母浸提物3-6g/L,玉米浆6-10g/L,(NH4)2SO4 2-3g/L时,菌株SFR-43T发酵D-核糖产率最高。
葡萄糖浓度优选:取37℃培养2天菌株SFR-43T的新鲜斜面,用接种环挑取1-2环,接种到液体种子培养基中,37℃,180rpm摇床培养14小时,接种量5%,接种到含不同浓度葡萄糖的摇瓶发酵培养基,37℃,180rpm摇瓶培养72小时。发酵液经离心去菌体,上清液用于D-核糖含量测定。结果显示,葡萄糖浓度在120-150g/L的范围内,菌株D-核糖产率及转化率较高。
无机离子优选:取37℃培养2天菌株SFR-43T的新鲜斜面,用接种环挑取1-2环,接种到液体种子培养基中,37℃,180rpm摇床培养14小时,接种量5%,接种到含不同无机离子的摇瓶发酵培养基(无机离子分别为硫酸镁、硫酸铁、硫酸锰、硫酸钠、硫酸锌,浓度均为1g/L,碳源为葡萄糖,氮源为酵母浸提物2-10g/L,玉米浆5-15g/L,(NH4)2SO4 2-3g/L,其他组分相同),37℃,180rpm摇瓶培养72小时。发酵液经离心去菌体,上清液用于D-核糖含量测定。发酵液经4500rpm离心15min,上清液经液相色谱测定D-核糖含量,结果显示菌株SFR-43T在添加有硫酸镁和硫酸锰的培养基中,D-核糖含量较高,经复合优化该无机离子,结果显示,当MgSO4 2g/L,MnSO4 0.2g/L时,菌株SFR-43T发酵D-核糖产率较高。
实施例4菌株SFR-43T与菌株SFR-4对比发酵
本实施例用于对比所提供的基因比较工程菌SFR-43T与菌株SFR-4的D-核糖发酵特征。
分别将培养好的工程菌SFR-43T与菌株SFR-4摇瓶种子接入5L发酵罐中培养,8h取样一次,发酵罐发酵的pH控制在6.5,通风量为2L/min,通过调节转速,溶解氧浓度保持在20-30%。比较菌体量、残糖浓度、D-核糖产量,并绘制发酵进程曲线,如附图4、图5所示,相比于自然诱变选育菌株SFR-4,工程菌SFR-43T菌体生长较快,发酵周期较短,D-核糖产量略低,同时产较高浓度的3-羟基丁酮。
斜面培养基配方:酵母浸提物5g/L,蛋白胨10g/L,NaCl 3g/L,琼脂20g/L,pH7.0。
液体种子培养基配方(g/L):葡萄糖20g/L,酵母浸提物5g/L,玉米浆10g/L,pH7.0。
菌株SFR-43T发酵培养基(g/L):葡萄糖150g/L,酵母浸提物5g/L,玉米浆10g/L,(NH4)2SO4 2.0g/L,MgSO4 2g/L,MnSO4 0.2g/L,pH6.5。
菌株SFR-4发酵培养基(g/L):葡萄糖150g/L,酵母浸提物5g/L,玉米浆3g/L,(NH4)2SO4 3g/L,MgSO4 2g/L,CaCO3 5g/L,pH6.5。
实例5工程菌SFR-43T D-核糖摇瓶发酵
取37℃培养2天菌株SFR-43T的新鲜斜面,接种环取1环斜面菌种,接种到50ml/250mL液体种子培养基中,37℃培养14小时,以5%的接种量接种到50ml/250mL发酵培养基中,37℃、180rpm摇瓶发酵,每隔12h取样,培养周期至72小时,葡萄糖耗尽,结束发酵,D-核糖产量达39.35g/L,3-羟基丁酮产率35.7g/L。
斜面培养基配方:酵母浸提物5g/L,蛋白胨10g/L,NaCl 3g/L,琼脂20g/L,pH7.0。
液体种子培养基配方:葡萄糖20g/L,酵母浸提物5g/L,玉米浆10g/L,pH7.0。
摇瓶发酵培养基配方:葡萄糖150g/L,酵母浸提物5g/L,玉米浆10g/L,(NH4)2SO42.5g/L,MgSO4 2g/L,MnSO4 0.2g/L,pH7.0。
实例6菌株SFR-43T发酵罐发酵
将培养好的菌株SFR-43T的斜面菌种,接种到50ml/250mL液体种子培养 基中,36℃培养14小时,以5%(体积百分数)的接种量接种到5L发酵罐中(装液量为3L),37℃通风搅拌培养,通风量为2L/min,控制pH5.5-6.0。通过调节搅拌转速,保持发酵液中相对溶解氧浓度为20%左右,68h发酵结束,D-核糖产量达40.5g/L,3-羟基丁酮产率为35.6g/L。
液体种子培养基配方:葡萄糖50g/L,酵母浸提物6g/L,玉米浆10g/L,(NH4)2SO42.0g/L,MgSO4 2g/L,pH7.0。
发酵罐发酵培养基配方:葡萄糖150g/L,酵母浸提物5g/L,玉米浆10g/L,(NH4)2SO42.0g/L,MgSO4 2g/L,MnSO4 0.2g/L,pH6.5。
实例7菌株SFR-43T发酵罐发酵
将培养好的菌株SFR-43T的斜面菌种接种到50ml/250mL液体种子培养基中,37℃培养12小时,以5%(体积百分数)的接种量接种到800ml/5L三角瓶中,37℃振荡培养8小时,以10%的接种量接种50L发酵罐,通风搅拌培养,通风比0.5-1.0,控制pH6.0±0.2。通过调节搅拌转速,保持发酵液中相对溶解氧浓度为20-40%,68h发酵结束,D-核糖产量达42.5g/L,3-羟基丁酮产率为33.6g/L。
一级液体种子培养基配方:葡萄糖20g/L,酵母浸提物8g/L,玉米浆8g/L,pH7.0。
二级液体种子培养基配方:葡萄糖60g/L,酵母浸提物6g/L,玉米浆10g/L,(NH4)2SO4 2.0g/L,MgSO4 2g/L,pH7.0。
发酵罐发酵培养基配方:葡萄糖150g/L,酵母浸提物5g/L,玉米浆10g/L,(NH4)2SO42.0g/L,MgSO4 2g/L,MnSO4 0.2g/L,pH6.5。
实例8菌株SFR-43T高产D-核糖发酵
取培养好的菌株SFR-43T的斜面菌种,接种1环到50ml/250mL液体种子培养基中,36℃培养12小时,以5%(体积百分数)的接种量接种到800ml/5L三角瓶中,37℃振荡培养10小时,以10%的接种量接种50L发酵罐,通风搅拌培养,通风比0.5-1.0。培养过程中流加葡萄糖和葡萄糖酸内酯控制pH6.0±0.5,控制总碳源加量140g/L。通过调节搅拌转速,保持发酵液中相对溶解氧浓度为30-40%,64h发酵结束,D-核糖产量达55g/L,3-羟基丁酮产率8.1g/L,发酵结果如图6所示。
一级种子培养基的组成为:葡萄糖20g/L,酵母浸提物5g/L,玉米浆10g/L,pH 7.0-7.2。
二级种子培养基的组成为:葡萄糖50g/L,酵母浸提物6g/L,玉米浆10g/L,(NH4)2SO4 2.0g/L,MgSO4 2g/L,pH7.0。
发酵罐发酵初始培养基组成为:葡萄糖120g/L,酵母浸提物5g/L,玉米浆8g/L,(NH4)2SO4 2g/L,MgSO4 2g/L,MnSO4 0.2g/L,pH 6.5。
发酵过程中流加物料组成为:葡萄糖200g/L,葡萄糖酸内酯600g/L,酵母浸提物0.5g/L。
实例9菌株SFR-43T高产D-核糖发酵
本实施例用于说明所提供的基因工程菌的D-核糖发酵生产能力。
取37℃培养2天菌株SFR-43A的新鲜斜面,接种环取1环斜面菌种,接种到50ml/250mL液体种子培养基中,37℃培养14小时,以5%(体积百分数)的接种量接种到5L发酵罐中(装液量为3L),37℃通风搅拌培养,通风量为2L/min,控制pH6.5,培养过程中流加葡萄糖和葡萄糖酸内酯,流加速度为0.3mL/min,流加至56h,控制总碳源加量160g/L。通过调节搅拌转速,保持发酵液中相对溶解氧浓度为20%左右,64h发酵结束,D-核糖产量达61g/L,3-羟基丁酮产率9.5g/L。
一级种子培养基的组成为:葡萄糖20g/L,酵母浸提物5g/L,玉米浆10g/L,pH 7.0-7.2。
二级种子培养基的组成为:葡萄糖30g/L,酵母浸提物6g/L,玉米浆10g/L,(NH4)2SO4 2.0g/L,MgSO4 2g/L,pH 7.0-7.2。
发酵罐发酵初始培养基配方:葡萄糖150g/L,酵母浸提物5g/L,玉米浆10g/L,(NH4)2SO4 2.5g/L,MgSO4 2g/L,MnSO4 0.2g/L,pH6.5。
发酵罐发酵过程流加物料组成:葡萄糖300g/L,葡萄糖酸内酯500g/L,酵母浸提物0.5g/L。
以上所述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
SEQUENCE LISTING
<110> 山东省食品发酵工业研究设计院
<120> 一种利用枯草芽孢杆菌工程菌高产D-核糖的方法
<130> 11
<160> 11
<170> PatentIn version 3.5
<210> 1
<211> 19
<212> DNA
<213> 人工引物序列
<400> 1
gcagcatgga agcttgcag 19
<210> 2
<211> 57
<212> DNA
<213> 人工引物序列
<400> 2
tataatgtat gctatacgaa cggtattatc ttgatactat atagaaacat ctcaagg 57
<210> 3
<211> 50
<212> DNA
<213> 人工引物序列
<400> 3
ataacttcgt atagcataca ttatagcttt tgaaagagga tgagtcaaat 50
<210> 4
<211> 25
<212> DNA
<213> 人工引物序列
<400> 4
aaagaatatc gtttctgcct cgtaa 25
<210> 5
<211> 27
<212> DNA
<213> 人工引物序列
<400> 5
taccgttcgt atagcataca ttatacg 27
<210> 6
<211> 31
<212> DNA
<213> 人工引物序列
<400> 6
tataatgtat gctatacgaa gttattcagt c 31
<210> 7
<211> 2004
<212> DNA
<213> SFR-4 tkt
<400> 7
atggatacaa ttgaaaagaa atcagttgct accattcgca cactgtcaat agacgctatt 60
gaaaaagcaa attctggtca cccagggatg ccgatgggag ccgctccaat ggcatacacg 120
ctgtggacaa aatttatgaa cgtaagtccg gcaaaccctg gctggtttaa ccgtgaccgt 180
tttgttttat ctgctggaca cgggtcagca ctattataca gcatgcttca tttaagcggg 240
tttgatctta gtattgaaga tcttaaggga ttccgccagt ggggcagcaa aacaccagga 300
catccggaat tcggacatac tgccggtgtt gatgctacaa caggtccgct tggccaagga 360
attgccatgg cagtcggtat ggcaattgct gaacgccatt tagcggaaac atacaaccgc 420
gattcattta acgtagtcga tcattataca tacagtattt gcggtgatgg tgatttaatg 480
gaaggtattt cttctgaagc cgcttcactc gcaggccatc ttcagcttgg ccgtctgatc 540
gtactatacg attctaatga catctctctt gatggagacc tcgaccgttc attctctgaa 600
aacgtgaaac agcgttttga agcaatgaat tgggaagttc tttatgttga ggatggaaac 660
aatattgaag aattaacagc ggctatcgaa aaagcacgcc aaaatgaaaa gaaacctaca 720
ttaattgaag tgaaaacgac aatcggattc ggttcaccta accgtgccgg tacatccggt 780
gttcacggtg cgccgcttgg taaagaggaa agcaaattaa caaaagaagc ttacgcgtgg 840
acatatgaag aagacttcta cgttccgtca gaagtttatg agcatttcgc tgcagctgtt 900
aaagaatcag gtgagaaaaa agaacaagaa tggaatgctc aattcgctaa atataaagaa 960
gtttatcctg aacttgctga acagcttgaa ctggcaatca aaggagagct tccgaaggac 1020
tgggatcaag aggttcctgt gtatgaaaaa ggaagcagcc tggcatcccg tgcatcttcc 1080
ggtgaagttc tcaacggact tgcgaaaaaa attcctttct ttgtcggagg ttctgctgac 1140
ctagcgggat cgaacaaaac gactattaaa aatgccggtg attttacagc ggttgattac 1200
tcaggcaaaa acttctggtt tggtgtacgt gaatttgcga tgggtgcagc cttaaacggt 1260
atggcgcttc atggcggtct tcgtgtattc ggcggaactt tctttgtctt ctctgattac 1320
ctgcgtcctg cgattcgcct tgcagcgtta atgggccttc ctgtgacata tgtcttcaca 1380
catgacagta ttgcggttgg tgaagacggt ccgacgcacg agcctgttga acagcttgct 1440
tcactccgtg cgatgcctaa cctttctttg atccgtccag cagacggcaa tgagacagca 1500
gcagcatgga agcttgcagt gcaaagcact gaccacccaa cagcgctagt gcttacacgt 1560
caaaaccttc ctaccatcga tcaaacagct gaagaagcat tggcaggagt agaaaaaggt 1620
gcatatgtcg tttctaaatc taaaaacgaa acacctgacg ctcttctcat cgcttccgga 1680
tcagaggtag gtcttgcaat tgaagcgcag gctgaattgg caaaagaaaa tatcgatgtt 1740
tctgttgtca gcatgccttc aatggaccgt tttgagaaac aatctgatga atacaaaaac 1800
gaagtccttc ctgcagatgt gaaaaaacgt cttgcaattg aaatgggctc atcatttgga 1860
tggggcaaat acacggggct tgaaggtgac gttctcggca tagaccgatt cggtgcatct 1920
gctccaggtg aaaccatcat taacgaatac gggatggggg gctatttttt cgccttgaga 1980
tgtttctata tagtatcaag ataa 2004
<210> 8
<211> 2004
<212> DNA
<213> SFA-H43 tkt基因
<400> 8
atggatacaa ttgaaaagaa atcagttgct accattcgca cactgtcaat agacgctatt 60
gaaaaagcaa attctggtca cccagggatg ccgatgggag ccgctccaat ggcatacacg 120
ctgtggacaa aatttatgaa cgtaagtccg gcaaaccctg gctggtttaa ccgtgaccgt 180
tttgttttat ctgctggaca cgggtcagca ctattataca gcatgcttca tttaagcggg 240
tttgatctta gtattgaaga tcttaaggga ttccgccagt ggggcagcaa aacaccagga 300
catccggaat tcggacatac tgccggtgtt gatgctacaa caggtccgct tggccaagga 360
attgccatgg cagtcggtat ggcaattgct gaacgccatt tagcggaaac atacaaccgc 420
gattcattta acgtagtcga tcattataca tacagtattt gcggtgatgg tgatttaatg 480
gaaggtattt cttctgaagc cgcttcactc gcaggccatc ttcagcttgg ccgtctgatc 540
gtactatacg attctaatga catctctctt gatggagacc tcgaccgttc attctctgaa 600
aacgtgaaac agcgttttga agcaatgaat tgggaagttc tttatgttga ggatggaaac 660
aatattgaag aattaacagc ggctatcgaa aaagcacgcc aaaatgaaaa gaaacctaca 720
ttaattgaag tgaaaacgac aatcggattc ggttcaccta accgtgccgg tacatccggt 780
gttcacggtg cgccgcttgg taaagaggaa agcaaattaa caaaagaagc ttacgcgtgg 840
acatatgaag aagacttcta cgttccgtca gaagtttatg agcatttcgc tgcagctgtt 900
aaagaatcag gtgagaaaaa agaacaagaa tggaatgctc aattcgctaa atataaagaa 960
gtttatcctg aacttgctga acagcttgaa ctggcaatca aaggagagct tccgaaggac 1020
tgggatcaag aggttcctgt gtatgaaaaa ggaagcagcc tggcatcccg tgcatcttcc 1080
ggtgaagttc tcaacggact tgcgaaaaaa attcctttct ttgtcggagg ttctgctgac 1140
ctagcgggat cgaacaaaac gactattaaa aatgccggtg attttacagc ggttgattac 1200
tcaggcaaaa acttctggtt tggtgtacgt gaatttgcga tgggtgcagc cttaaacggt 1260
atggcgcttc atggcggtct tcgtgtattc ggcggaactt tctttgtctt ctctgattac 1320
ctgcgtcctg cgattcgcct tgcagcgtta atgggccttc ctgtgacata tgtcttcaca 1380
catgacagta ttgcggttgg tgaagacggt ccgacgcacg agcctgttga acagcttgct 1440
tcactccgtg cgatgcctaa cctttctttg atccgtccag cagacggcaa tgagacagca 1500
gcagcatgga agcttgcagt gcaaagcact gaccacccaa cagcgctagt gcttacacgt 1560
caaaaccttc ctaccatcga tcaaacagct gaagaagcat tggcaggagt agaaaaaggt 1620
gcatatgtcg tttctaaatc taaaaacgaa acacctgacg ctcttctcat cgcttccgga 1680
tcagaggtag gtcttgcaat tgaagcgcag gctgaattgg caaaagaaaa tatcgatgtt 1740
tctgttgtca gcatgccttc aatggaccgt tttgagaaac aatctgatga atacaaaaac 1800
gaagtccttc ctgcagatgt gaaaaaacgt cttgcaattg aaatgggctc atcatttgga 1860
tggggcaaat acacggggct tgaaggtgac gttctcggca tagaccgatt cggtgcatct 1920
gctccaggtg aaaccatcat taacgaatac ggcttctcag ttccgaacgt agtgaatcga 1980
gttaaggcat taatcaataa gtaa 2004
<210> 9
<211> 2004
<212> DNA
<213> 168菌株tkt基因序列
<400> 9
atggatacaa ttgaaaagaa atcagttgct accattcgca cactgtcaat agacgctatt 60
gaaaaagcaa attctggtca cccagggatg ccgatgggag ccgctccaat ggcatacacg 120
ctgtggacaa aatttatgaa cgtaagtccg gcaaaccctg gctggtttaa ccgtgaccgt 180
tttgttttat ctgctggaca cgggtcagca ctattataca gcatgcttca tttaagcggg 240
tttgatctta gtattgaaga tcttaaggga ttccgccagt ggggcagcaa aacaccagga 300
catccggaat tcggacatac tgccggtgtt gatgctacaa caggtccgct tggccaagga 360
attgccatgg cagtcggtat ggcaattgct gaacgccatt tagcggaaac atacaaccgc 420
gattcattta acgtagtcga tcattataca tacagtattt gcggtgatgg tgatttaatg 480
gaaggtattt cttctgaagc cgcttcactc gcaggccatc ttcagcttgg ccgtctgatc 540
gtactatacg attctaatga catctctctt gatggagacc tcgaccgttc attctctgaa 600
aacgtgaaac agcgttttga agcaatgaat tgggaagttc tttatgttga ggatggaaac 660
aatattgaag aattaacagc ggctatcgaa aaagcacgcc aaaatgaaaa gaaacctaca 720
ttaattgaag tgaaaacgac aatcggattc ggttcaccta accgtgccgg tacatccggt 780
gttcacggtg cgccgcttgg taaagaagaa agcaaattaa caaaagaagc ttacgcgtgg 840
acatatgaag aagacttcta cgttccgtca gaagtttatg agcatttcgc tgtagctgtt 900
aaagaatcag gtgagaaaaa agaacaagaa tggaatgctc aattcgctaa atataaagaa 960
gtttatcctg aacttgctga acagcttgaa ctggcaatca aaggagagct tccgaaggac 1020
tgggatcaag aggttcctgt gtatgaaaaa ggaagcagtt tggcatcccg tgcatcttcc 1080
ggtgaagttc tcaacggact tgcgaaaaaa attcctttct ttgtcggagg ttctgctgac 1140
ctagcgggat cgaacaaaac gactattaaa aatgccggtg attttacagc ggttgattac 1200
tcaggcaaaa acttctggtt tggtgtacgt gaatttgcga tgggtgcggc cttaaacggt 1260
atggcgcttc atggcggtct tcgtgtattc ggcggaactt tctttgtctt ctctgattac 1320
ctgcgtcctg cgattcgcct tgcagcgtta atgggccttc ctgtgacata tgtcttcaca 1380
catgacagta ttgcggttgg tgaagacggt ccgacgcacg agcctgttga acagcttgct 1440
tcactccgtg cgatgcctaa cctttctttg atccgtccag cagacggcaa tgagacagca 1500
gcagcatgga agcttgcagt gcaaagcact gaccacccaa cagcgctagt gcttacacgt 1560
caaaaccttc ctaccatcga tcaaacatct gaagaagcat tggcaggagt agaaaaaggt 1620
gcatatgtcg tttctaaatc taaaaacgaa acacctgacg ctcttctcat cgcttccgga 1680
tcagaggtag gtcttgcaat tgaagcgcag gctgaattgg caaaagaaaa tatcgatgtt 1740
tctgttgtca gcatgccttc aatggaccgt tttgagaaac aatctgatga atacaaaaac 1800
gaagtccttc ctgcagatgt gaaaaaacgt cttgcaattg aaatgggctc atcatttgga 1860
tggggcaaat acacggggct tgaaggtgac gttctcggca tagaccgatt cggtgcatct 1920
gctcctggtg aaaccatcat taacgaatac ggcttctcag ttccgaacgt agtgaatcga 1980
gttaaggcat taatcaataa gtaa 2004
<210> 10
<211> 500
<212> DNA
<213> 菌株SFR-4转酮酶基因终止子前500bp序列
<400> 10
catggaagct tgcagtgcaa agcactgacc acccaacagc gctagtgctt acacgtcaaa 60
accttcctac catcgatcaa acagctgaag aagcattggc aggagtagaa aaaggtgcat 120
atgtcgtttc taaatctaaa aacgaaacac ctgacgctct tctcatcgct tccggatcag 180
aggtaggtct tgcaattgaa gcgcaggctg aattggcaaa agaaaatatc gatgtttctg 240
ttgtcagcat gccttcaatg gaccgttttg agaaacaatc tgatgaatac aaaaacgaag 300
tccttcctgc agatgtgaaa aaacgtcttg caattgaaat gggctcatca tttggatggg 360
gcaaatacac ggggcttgaa ggtgacgttc tcggcataga ccgattcggt gcatctgctc 420
caggtgaaac catcattaac gaatacggga tggggggcta ttttttcgcc ttgagatgtt 480
tctatatagt atcaagataa 500
<210> 11
<211> 500
<212> DNA
<213> 菌株SFA-H43转酮酶基因终止子后500bp序列
<400> 11
gcttttgaaa gaggatgagt caaatcatcc tctttttctt gtttatccga caaaaatagt 60
attggctgtt taacagtaat agacaattct ttcttttctt cttttgtata atagagagca 120
aatgaaatgc tgctggaaaa ggggatgaaa agatggaacg tcactactat acgtacctga 180
tcaaagagga atttgccaat cactatttcg gccgggaatc ggttatgttt gagctgtttc 240
aagactatca ttggacaagc cttgaaaagc agcagtatga aatgacagag aaacagattc 300
aatatattac acaaccaatc ccgattttac atatgcatca gcggttaaaa atgaatttaa 360
acaagacgga ttacaggcag ctggattata tttatagaat agctttgccg aaagcaaaag 420
gccacgcgac gtttatgatg aaggagcaca tgatagaaat tgtggcttcg ggagattacg 480
aggcagaaac gatattcttt 500
- 还没有人留言评论。精彩留言会获得点赞!