干巴菌胞外多糖及其制备方法和应用与流程
本发明涉及干巴菌多糖技术领域,特别涉及一种干巴菌胞外多糖,还涉及所述干巴菌胞外多糖的制备方法及其应用。
背景技术:
干巴菌(Thelephora ganbajun Zang)是我国特有的革菌属(Thelephora)珍稀野生食用菌,口感好营养价值高,仅仅分布在我国滇中800~2300 m高海拔地区的弱酸性红壤地面上。干巴菌与松树有外生菌根关系,人工栽培难以成功,因此导致干巴菌无序乱采现象严重,产量逐年下降,每年干巴菌上市時总是供不应求,价格逐年升高。由于其分布的局限性,国内外对干巴菌的研究极为有限,主要集中在干巴菌的分类、菌种分离、菌种鉴定和生态环境等方面。因此,干巴菌是一种具有极高经济价值及营养价值的亟待研究开发的菌种资源。
目前应用于化妆品的多糖类保湿剂主要有透明质酸、甲壳素及其衍生物、植物多糖提取物、肝素等。近年来将具有生物活性的食用真菌多糖作为保湿剂应用于化妆品,满足了人们对高品质化妆品的需求,成为保湿化妆品的发展趋势。干巴菌胞外多糖(Exopolysaccharide, EPS)良好的保湿和抗氧化特性是化妆品市场最重要的功能性诉求。
自由基是机体细胞代谢过程中产生的活性物质,如果自由基在体内过多积累就会引起生物膜的不饱和脂类发生氧化反应,形成脂质过氧化物,从而引起细胞结构和功能的改变,造成对机体的损害,引起各种疾病,这就是引起机体衰老的主要原因。干巴菌胞外多糖可以清除体内的自由基,进而起到保护生物膜和延缓衰老的作用。
因此,干巴菌胞外多糖可以作为天然、营养、安全的化妆品保湿剂和抗衰老功能食品,从而为干巴菌资源开发提供有效的途径。
陆文娟等在《响应面法优化提取干巴菌多糖的工艺研究》《南京师范大学学报(工程技术版)》,2015,15(3):84-92,以干巴菌子实体为原料,采用超声细胞破碎法提取其多糖,在单因素实验的基础上,采用响应面法对提取工艺进行优化,通过Box-Behnken设计,建立并分析了各因素与多糖得率关系的数学模型,结果显示,最佳工艺条件为:液料比为38:1,提取时间为3 h,提取温度为88 ℃,超声功率为603 W,重复2次,测定干巴菌多糖的得率为5.96%。但该项目并没有涉及干巴菌的液体发酵培养、干巴菌多糖的分离纯化以及具有清除自由基、抗氧化功效的多糖组分等研究内容。
技术实现要素:
为了解决以上现有技术中干巴菌胞外多糖EPS在提取和应用中存在的利用不充分的问题,本申请提供了由干巴菌菌株(Thelephoraganbajun Zang)TG-1发酵得到的菌丝体胞外多糖EPS。本课题组从云南地区分离纯化得到了一株干巴菌菌株(TG-1),并且研究发现干巴菌在液体发酵培养时菌丝体生长旺盛,胞外多糖产量高,并且通过抗氧化实验和保湿实验证明干巴菌胞外多糖EPS具有良好的保湿和抗氧化特性。
本申请还提供了所述干巴菌胞外多糖EPS的制备方法。
本申请还提供了所述干巴菌胞外多糖EPS的应用。
本发明是通过以下步骤得到的:
一种干巴菌胞外多糖,其特征在于是通过以下步骤得到的:
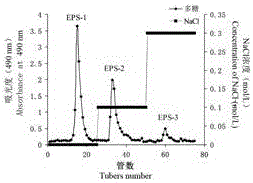
保藏编号为CGMCC No.12977的干巴菌菌株TG-1在液体培养基中发酵,从菌丝体分离后得到的发酵液中,提取干巴菌胞外多糖,然后经过阴离子交换柱层析分离,依次用去离子水和0.1、0.3 mol/L的NaCl溶液进行洗脱,分别得到干巴菌胞外多糖组分EPS-1,EPS-2,EPS-3。
所述的干巴菌胞外多糖EPS,其特征在于EPS、EPS-1、EPS-2、EPS-3中硫酸基的含量分别为15~21%,0.5~2%,25~40%,9~16%;糖醛酸的含量分别为5~10%,2~7%,30~50%,30~50%。
所述的干巴菌胞外多糖,液体培养基中含有马铃薯150~250 g/L,葡萄糖15~25 g/L,硫酸镁0.5~2.5 g/L,磷酸二氢钾0.5~2.5 g/L,蛋白胨1~3 g/L,pH为4.5~7,于15~30 ℃发酵培养。
所述的干巴菌胞外多糖,菌丝体分离,提取干巴菌胞外多糖操作如下:
洗涤菌丝体1~4次,至洗涤液澄清,将收集到的上清液或滤液合并,并浓缩至原体积3/4~1/2,加入1~4倍体积乙醇,静置1~24 h至胞外多糖完全析出,过滤分离胞外多糖,40~60 ℃条件下烘干,溶于去离子水中,除蛋白至少2~3次,冻干后得到干巴菌胞外多糖。
所述的干巴菌胞外多糖,干巴菌胞外多糖经过阴离子交换柱层析分离操作如下:
将干巴菌胞外多糖溶于去离子水中,用0.45 μm的微孔滤膜过滤,得到上样溶液,将上样溶液用规格为1.6 × 30 cm的DEAE-52纤维素阴离子交换柱进行层析分离,依次用去离子水和0.1、0.3 mol/L的NaCl溶液进行洗脱,洗脱液的流速为1 mL/min,洗脱组分冻干后即为干巴菌胞外多糖组分EPS-1,EPS-2和EPS-3。
所述的干巴菌胞外多糖在制备抗衰老保健品和化妆品中的应用。
干巴菌胞外多糖为干巴菌胞外多糖EPS及其组分EPS-1,EPS-2和EPS-3。
所述的保健品是具有清除自由基、抗氧化作用的保健品。
所述的化妆品是具有清除自由基、抗氧化和保湿作用的化妆品。
有益效果:
1)利用液体发酵途径,制备干巴菌胞外多糖,为干巴菌的资源化利用提供了一条有效途径。
2)干巴菌菌株TG-1在液体发酵培养时具有旺盛的胞外多糖分泌能力,因此,干巴菌菌株TG-1对干巴菌的开发利用及干巴菌胞外多糖的规模化生产具有非常重要的意义。
3)抗氧化实验表明,干巴菌胞外多糖EPS及其组分具有优良的抗氧化活性,EPS及3个组分抗氧化能力有差异,还原力的强弱顺序为EPS-2 > EPS-1 > EPS > EPS-3,清除羟基自由基能力的强弱顺序为EPS >EPS-2 > EPS-1 > EPS-3,清除超氧阴离子自由基能力的强弱顺序为EPS-2 > EPS > EPS-1 > EPS-3,清除DPPH自由基能力的强弱顺序为EPS-2 > EPS > EPS-1 > EPS-3,因此,EPS的三个组分中EPS-2的抗氧化能力最强,其次为EPS-1和EPS-3,为干巴菌胞外多糖构效关系的研究、多糖的改造、多糖的活性分析以及多糖抗衰老功能食品的开发奠定了理论基础。
4)干巴菌胞外多糖具有优良的保湿能力。在120 h时,在相对湿度60%的条件下,EPS的保湿率为55~65%;在相对湿度43%的条件下,EPS的保湿率为85~92%;在相对湿度0%的条件下,EPS的保湿率为25~35%。并且在某些条件下,MPS的保湿能力要强于透明质酸(HA)和甘油(Gl),可以用于护肤保健。
菌种保藏信息
保藏时间:2016年 9月 23日,
保藏单位:中国微生物菌种保藏管理委员会普通微生物中心,
保藏编号:CGMCC No. 12977,
保藏单位地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮政编码:100101分类命名:干巴菌 Thelephora ganbajun。
附图说明
图1干巴菌EPS的洗脱曲线,
图2干巴菌EPS、EPS-1、EPS-2、EPS-3的体外抗氧化能力(A:还原力;B:羟基自由基清除能力;C:超氧阴离子自由基清除能力;D:DPPH自由基清除能力),
图3保湿率随时间的变化曲线(RH60%),
图4保湿率随时间的变化曲线(RH43%),
图5保湿率随时间的变化曲线(RH0%)。
具体实施方式
下面结合具体实施例对本发明进行进一步说明:
实施例1菌株的获得
分别于云南省不同地区采集4个新鲜干巴菌子实体,用75%酒精进行表面消毒,再用无菌水冲洗数次后,用灭菌镊子撕取干巴菌内部组织小块接种到含氯霉素的马铃薯葡萄糖(PDA)培养基平板上,移入24 ℃培养箱中培养,待长出菌丝后,反复纯化,直至获得干巴菌纯培养物。于4个干巴菌子实体中分别筛选获得4株干巴菌菌种,并分别命名为TG-1、TG-2、TG-3、TG-4。
实施例2干巴菌胞外多糖(EPS)的提取
进行发酵罐培养实验,① 菌种的活化。将干巴菌TG-1、TG-2、TG-3、TG-4分别接种于活化培养基平板上(马铃薯 200 g/L,葡萄糖 20 g/L,硫酸镁 1 g/L,磷酸二氢钾 1.5 g/L),24 ℃培养7 d。取0.5 cm2干巴菌活化菌种接入液体培养基中(马铃薯 200 g/L,葡萄糖 20 g/L,蛋白胨 2 g/L,硫酸镁 1 g/L,磷酸二氢钾 1.5 g/L),500 mL三角瓶装液量为300 mL,然后于摇床24 ℃振荡培养10 d。② 培养条件。装量:7.5升;接种量:10 %;发酵温度:24 ℃;搅拌速度:350 r/min;泡沫控制:接种后加两滴消泡剂。③ 发酵过程中pH值及DO值的测定。利用pH电极及溶氧电极自动在线测定并记录数据。④ 菌丝体的分离。将干巴菌培养物离心(10000 r/min,10 min),反复离心洗涤菌丝体3遍后,将收集到的上清液或滤液合并,并浓缩至原体积2/3~1/4。⑤ 加入3倍体积乙醇。静置12 h至胞外多糖完全析出,过滤分离胞外多糖,55 ℃条件下烘干。⑥ 将上述多糖溶于去离子水中,除蛋白5次,冻干后得到EPS。
干巴菌TG-1、TG-2、TG-3、TG-4的EPS产量分别为0.78 g/L,0.42 g/L,0.49 g/L,0.56 g/L。因此,干巴菌TG-1菌株的EPS产量最高,是生产干巴菌EPS的理想菌株。
实施例3体外抗氧化实验
(1)还原力的测定
采用普鲁士兰法进行还原力的测定。将干巴菌胞外多糖分别用去离子水进行梯度稀释,配置一系列不同浓度的多糖水溶液。取1 mL多糖样品于试管中,加入2.5 mL磷酸盐缓冲液(pH 6.6,0.2 mol/L)和1 mL铁氰化钾溶液(10 g/L),混匀后置于50 ℃恒温水浴锅中20 min。水浴结束后,再加入2 mL三氯乙酸(100 g/L)和1.2 mL三氯化铁溶液(1 g/L)。混匀后测定700 nm处吸光度,并用2,6-二叔丁-4-甲基苯酚(2, 6 - di - tert - butyl - 4 - methylphenol, BHT)作为阳性对照。
(2)羟基自由基清除能力的测定
采用Fenton法进行羟基自由基清除能力的测定。配置一系列不同浓度的干巴菌胞外多糖水溶液。将1 mL硫酸亚铁溶液(9 mmol/L),1 mL水杨酸乙醇溶液(9 mmol/L),1 mL多糖样品溶液和1 mL过氧化氢溶液(8.8 mmol/L)于试管中混合均匀,37 ℃水浴30 min。离心(5000 r/min,10 min)后取上清液于510 nm处测定吸光度,并用BHT作为阳性对照。按照以下公式计算羟基自由基清除率(Scavenging rate, SR),SR (%) = (A0–A)/A0×100。其中,A0为空白对照的吸光度,A为多糖样品的吸光度。羟基自由基的清除能力以EC50值表示,EC50值代表羟基自由基清除50%時所需要的样品浓度。EC50值越小则代表羟基自由基的清除能力越强。
(3)超氧阴离子自由基清除能力的测定
超氧阴离子自由基清除能力采用邻苯三酚自氧化法进行测定。配置一系列不同浓度的干巴菌胞外多糖水溶液。将1 mL多糖样品水溶液与2 mL Tris-HCl缓冲液(pH 8.2,50 mmol/L)混合均匀,置于25 ℃水浴中20 min,水浴结束后,加入0.4 mL 25 ℃水浴预热过的邻苯三酚溶液(5 mmol/L),迅速混合均匀,于325 nm每隔20 s测定一次吸光度,持续5 min,并用BHT作为阳性对照。按照以下公式计算超氧阴离子自由基清除率(SR),SR(%) = (S0–S)/S0×100。其中,S0为空白对照吸光度的斜率(斜率即为邻苯三酚的自氧化速率),S为多糖样品吸光度的斜率。较低的斜率代表较高的超氧阴离子自由基清除能力。超氧阴离子自由基的清除能力以EC50值表示,EC50值代表超氧阴离子自由基清除50%時的样品浓度。
(4)DPPH自由基清除能力的测定
将干巴菌胞外多糖进行梯度稀释,配置一系列不同浓度的多糖水溶液。取2 mL多糖样品溶液于试管中,加入2 mL DPPH乙醇溶液(0.2 mmol/L),混合均匀后避光反应30 min,然后在517 nm处测定其吸光度,用BHT作为为阳性对照。根据吸光度计算DPPH自由基的清除能力,清除能力(SR)的计算公式为:SR (%) = [1–(A–A0)/A1]×100。其中,A为2 mL多糖样品溶液与2 mL DPPH乙醇溶液混合液的吸光度,A0为2 mL乙醇与2 mL多糖样品溶液混合液的吸光度,A1为2 mL去离子水与2 mL DPPH乙醇溶液混合液的吸光度。DPPH自由基的清除能力以EC50值表示,EC50值代表清除50% DPPH自由基的样品浓度。DPPH自由基的清除能力用BHT作为为阳性对照。
由图2A可见,EPS具有一定的还原力,并且,还原力的大小随着浓度的增加而增强。当浓度为2500 mg/L時,EPS,EPS-1,EPS-2,EPS-3的还原力分别为1.22,1.29,1.42和1.131。因此,还原力的强弱顺序为EPS-2 > EPS-1 > EPS > EPS-3。EPS-2的还原力最强。由图2B可见,EPS及其组分EPS-1,EPS-2,EPS-3都具备羟基自由基的清除能力,并且随着浓度的增加表现出明显的量效关系。EPS,EPS-1,EPS-2,EPS-3清除羟基自由基的EC50值分别为264.74 mg/L,329.55 mg/L,269.05 mg/L和349.27 mg/L。因此,清除羟基自由基能力的强弱顺序为EPS >EPS-2 > EPS-1 > EPS-3。由图2C可见,EPS及其组分都具备超氧阴离子自由基的清除能力,并且,随着浓度的增加都表现出了明显的量效关系。EPS,EPS-1,EPS-2,EPS-3清除超氧阴离子自由基的EC50值分别为2196.79 mg/L,2268.94 mg/L,2162.36 mg/L和2312.16 mg/L。因此,清除超氧阴离子自由基能力的强弱顺序为EPS-2 > EPS > EPS-1 > EPS-3。由图2D可见,EPS及其组分都具备DPPH自由基的清除能力,并且,随着浓度的增加都表现出了明显的量效关系。EPS,EPS-1,EPS-2,EPS-3清除DPPH自由基的EC50值分别为1248.89 mg/L,1500 mg/L,1169.86 mg/L和1524.76 mg/L。因此,清除DPPH自由基能力的强弱顺序为EPS-2 > EPS > EPS-1 > EPS-3。抗氧化实验结果表明,EPS的三个组分中EPS-2的抗氧化能力最强,其次为EPS-1和EPS-3。
实施例4保湿实验:
准确称取干巴菌胞外多糖(EPS)、高分子量透明质酸(HA-H)、低分子量透明质酸(HA-L)和甘油(Gl)样品0.2000g于称量瓶(25×25)中,并配制成质量分数为10%的溶液,分别置于装有饱和醋酸钾(RH60%)、饱和碳酸钠(RH43%)和变色硅胶(RH0%)的干燥器中,用甘油,低分子量及高分子量的透明质酸钠作为对照。将两个干燥器置于25 ℃的恒温箱中,分别在4,8,16,24,32,40,48,60,72,84,96,108,120 h后称重,计算保湿率。保湿率计算公式:保湿率%=(mn﹣m0)/mn×100%,式中:mn为放置之前样品质量,m0为放置之后样品质量。
由图3可以看出,在相对湿度60%的条件下,在120 h时,EPS、HA-H、HA-L和Gl的保湿率分别为61.87%,53.87%,56.96%和50.18%。因此,在该相对湿度条件下,干巴菌胞外多糖(EPS)的保湿能力要高于透明质酸(HA)和甘油(Gl)。由图4可以看出,在相对湿度43%的条件下,在120 h时,EPS、HA-H、HA-L和Gl的保湿率分别为88.47%,88.12%,86.63%和84.19%。因此,在该相对湿度条件下,干巴菌胞外多糖(EPS)的保湿能力要优于透明质酸(HA)和甘油(Gl)。由图5可以看出,在120 h时,EPS、HA-H、HA-L和Gl的保湿率分别为29.87%,38.34%,34.72%和18.71%。因此,在该相对湿度的条件下,干巴菌胞外多糖(EPS)的保湿能力要低于透明质酸(HA)而高于甘油(Gl)。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受实施例的限制,其它任何未背离本发明的精神实质与原理下所做的改变、修饰、组合、替代、简化均应为等效替换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!