一种分离纯化纳豆芽孢杆菌中维生素K2的方法与流程
本发明涉及生物工程技术领域,尤其涉及一种分离纯化纳豆芽孢杆菌中维生素K2的方法。
背景技术:
维生素K2(Menaquinone,MK,VK2)是一类甲萘醌类化合物的统称,化学结构式为2-甲基-3-烯基-1,4-萘醌,根据C-3侧链上异戊二烯单元的个数,MK可分为14种,以MK-n表示(n=1-14)。研究表明,维生素K2不仅可以促进血液凝固,增加骨钙素合成,而且还可降低患肝癌和前列腺癌的风险。最近的研究表明,维生素K2还可用于帕金森氏综合症及肌肉萎缩性侧索硬化症的辅助治疗。维生素K2的安全性已经得到中国食品药品监督管理局、美国药品研究所、美国FDA及欧盟理事会和欧洲议会的认定。现在,欧盟已将维生素K2作为一种功能性食品,在美国,有关VK2的药用研究也已进入了临床三期阶段。
随着我国经济社会的发展、人民生活水平的提高以及人口进入老龄化阶段,高纯度的维生素K2无论作为一种保健品还是药品,都具有广泛的需求。
维生素K2生产菌株主要包括革兰氏阳性菌中的纳豆芽孢杆菌(Bacilus subtilis)和革兰氏阴性菌中的黄杆菌属(Flavobacterium sp.)。其中,纳豆芽孢杆菌主要产维生素K2,又因其菌体本身为益生菌,所产的维生素K2也具有较高的产量和较好的生物相容性,因此,是发酵生产维生素K2的优良菌种。
因此,研究适合于从纳豆芽孢杆菌发酵液中分离纯化维生素K2的一整套工业化方法,对于VK2的产业化,对于改善人民生活质量,具有重要的经济和社会意义。
根据目前文献报道,分离纯化纳豆芽孢杆菌中维生素K2的方法主要或者集中于某一步的研究(Aydin Berenjian et al.Appl Biochem Biotechnol,2014,172:1347-1357;Sato et al.Journal of Industrial Microbiology and Biotechnology,2001,26(3),115-120;Yanagisawa,et al.Journal of Food Biochemistry,2005,29(3),267-277),或者集中于实验室的样品检测(Patrick J.et al.Journal of lipid research,1971,12:442-449;Hiroyuki Wakabayashi et al.Nutrition,2003,19:661-665;)。目前,国内仅有专利CN104262129B公开了一种纳豆枯草芽孢杆菌以及由该菌株提纯维生素甲萘醌-7的方法。而国外尚未见此类报道。本发明更系统性、详细地公开了一种从纳豆芽孢杆菌发酵液中提取分离纯化维生素K2(VK2)的方法。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供一种具备产品纯度高、生物活性高、回收率高,分离纯化工艺操作简单、条件温和、处理能力大,各有机溶剂可回收利用以及便于工业化应用等优点的分离纯化纳豆芽孢杆菌中维生素K2的方法。
本发明是通过以下技术方案实现的:一种分离纯化纳豆芽孢杆菌中维生素K2的方法,包括如下步骤:
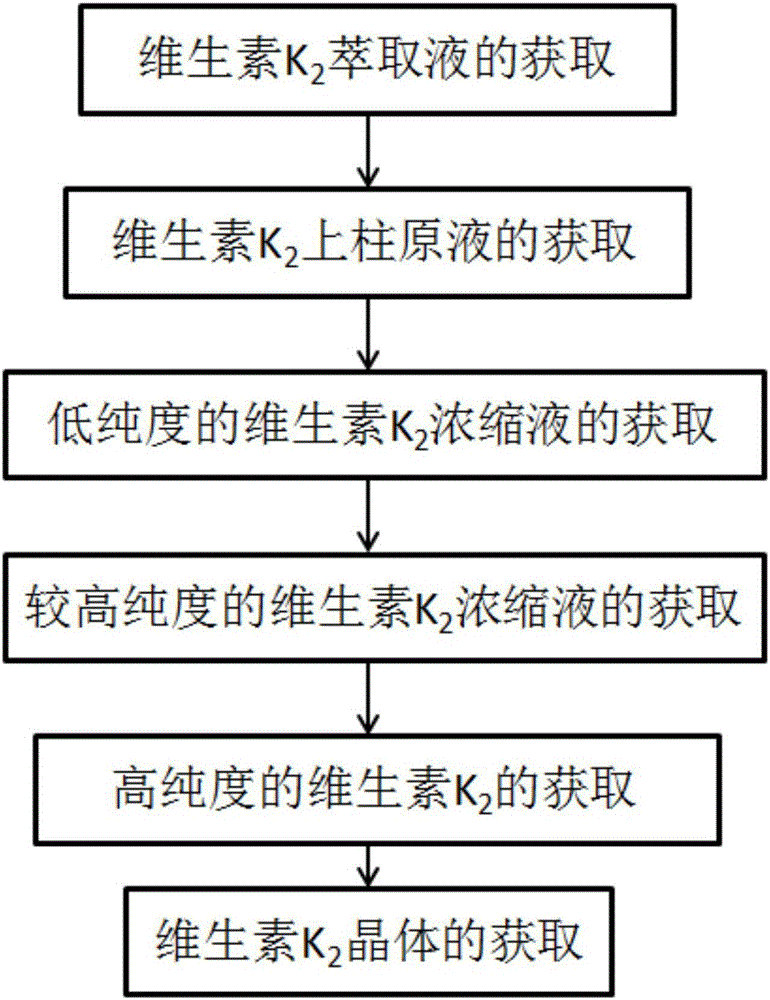
(1)维生素K2萃取液的获取
以纳豆芽孢杆菌发酵液为维生素K2提取原液,离心获取菌体,烘干后,采用第一有机溶剂进行萃取以获取维生素K2萃取液;
(2)维生素K2上柱原液的获取
将维生素K2萃取液通过膜分离设备除去不溶性杂质,将获得的维生素K2滤液蒸干,然后以极性有机溶剂重溶,获取维生素K2上柱原液;
(3)低纯度的维生素K2浓缩液的获取
将维生素K2上柱原液通过大孔吸附树脂柱吸附,采用湿法或干法上柱,然后以第二有机溶剂清洗,最后用第三有机溶剂进行洗脱,收集相应洗脱液并对其进行浓缩,从而获取低纯度的维生素K2浓缩液;
(4)较高纯度的维生素K2浓缩液的获取
将低纯度的维生素K2浓缩液经过分子量排阻层析柱纯化,然后以第四有机溶剂进行洗脱,收集相应洗脱液并对其进行浓缩,从而获取较高纯度的维生素K2浓缩液;
(5)高纯度的维生素K2的获取
将较高纯度的维生素K2浓缩液溶解于第五有机溶剂后,通过反相硅胶柱分离,然后用第六有机溶剂洗脱并分段收集,即可获得高纯度的维生素K2;
(6)维生素K2晶体的获取
以第七有机溶剂将维生素K2高温溶解,低温结晶,并重结晶,即可获得维生素K2晶体。
优选地,所述步骤(1)中纳豆芽孢杆菌发酵液的组成为:大豆粉65g/L,玉米粉60g/L,蛋白胨50g/L;所述发酵液的发酵周期为7-9天。
优选地,所述步骤(1)中萃取条件为:萃取方式为静置萃取或者搅拌萃取,萃取时间20min-60min,萃取次数为1-3次,用于萃取的第一有机溶剂为乙醇、正丁醇、乙酸、二氯甲烷、异戊醇、正己烷、乙酸乙酯、三氯甲烷、四氯化碳、丙酮、乙醚、甲苯中的一种或多种的混合液。
优选地,所述步骤(2)中膜分离设备的膜孔径≤0.45μm,所述极性有机溶剂为甲醇、乙醇、乙二醇、乙腈、丙酮、水中的一种或几种的混合液。
优选地,所述步骤(3)中大孔吸附树脂为非极性和/或弱极性大孔吸附树脂,所述上柱条件为:高径比为3-10:1,流速为0.025-0.110倍柱体积/min。
优选地,所述大孔吸附树脂为芳香族吸附剂。
优选地,所述步骤(4)中分子量排阻层析填料所排阻的物质的分子量为400Da-1000Da;所述填料可分别做柱或分几段装于同一个分子量排阻层析柱中,层析液按照填料排阻极限由小到大或由大到小的顺序依次经过柱填料;所述分子量排阻层析柱高径比为10-25:1,流速为0.004-0.010倍柱体积/min,层析柱高度与维生素K2浓缩液上液高度比为35-50:1。
优选地,所述步骤(3)中第二有机溶剂为极性有机溶剂,用量为大孔吸附树脂柱柱体积的1-3倍;所述第三有机溶剂为二氯甲烷、正丁醇、异丁醇、甲苯、庚烷、环戊烷、环己烷、正己烷、石油醚、正戊烷、异戊烷中的一种或几种的混合液,用量为柱体积的1-4倍;所述步骤(4)中第四有机溶剂为苯、甲苯、四氯化碳、二甲基甲酰胺、酮类、二氯甲烷、二氯代苯、四氯乙烯、四氢呋喃和三氯代苯中的一种或几种的混合液,其用量为分子量排阻层析柱柱体积的1-4倍。
优选地,所述步骤(5)中第五有机溶剂与第六有机溶剂为极性或弱极性有机溶剂,为甲醇、乙醇、乙二醇、乙腈、丙酮、异丙醇、乙酸乙酯、四氢呋喃、丙醇、乙酸丁酯、正丁醇、二氯甲烷、异丁醇中的一种或几种的混合液;所述反相硅胶柱的硅胶粒径为10-80μm,高径比为5-25:1,流速为0.015-0.065倍柱体积/min,柱高与较高纯度的维生素K2浓缩液上液高度比为7-30:1。
优选地,所述步骤(6)中第七有机溶剂为含有一定超纯水的甲醇或者乙醇;所述超纯水的含量为0-30%;所述的高温温度范围为40-85℃,低温温度范围为-40-0℃。
优选地,所述浓缩方法为减压浓缩,减压浓缩温度为40-99℃,真空度小于-0.08MPa;所述蒸干方法为减压蒸干。
优选地,所述低纯度的维生素K2浓缩液的纯度为小于50%,较高纯度的维生素K2浓缩液的纯度为50-80%,高纯度的维生素K2的纯度为大于80%。
优选地,所述维生素K2晶体的纯度为大于或等于98.2%。
优选地,所述维生素K2回收率大于85%。
本发明的优点在于:(1)获得的维生素K2晶体产品纯度高、生物活性高、回收率高;(2)分离纯化工艺操作简单、条件温和、处理能力大;(3)各有机溶剂可回收利用,便于工业化应用。
附图说明
图1是本发明实施例1-3提供的一种分离纯化纳豆芽孢杆菌中维生素K2的方法的流程图;
图2是本发明实施例3提供的一种分离纯化纳豆芽孢杆菌中维生素K2的方法的不同有机溶剂萃取维生素K2效率图;
图3是本发明实施例3提供的一种分离纯化纳豆芽孢杆菌中维生素K2的方法的发酵样品萃取液HPLC液相图谱图;
图4是本发明实施例3提供的一种分离纯化纳豆芽孢杆菌中维生素K2的方法的发酵样品纯化后HPLC液相图谱图。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1
一种分离纯化纳豆芽孢杆菌中维生素K2的方法,如图1所示,包括如下步骤:
(1)维生素K2萃取液的获取
以纳豆芽孢杆菌发酵液为维生素K2提取原液,离心获取菌体,烘干后,采用乙醇进行萃取以获取维生素K2萃取液;其中萃取方式为静置萃取,萃取时间20min,萃取次数为1次。
(2)维生素K2上柱原液的获取
将维生素K2萃取液通过膜分离设备(膜孔径≤0.45μm)除去不溶性杂质,将获得的维生素K2滤液减压蒸干,然后以甲醇重溶,获取维生素K2上柱原液;
(3)低纯度的维生素K2浓缩液的获取
将维生素K2上柱原液通过大孔吸附树脂柱吸附(芳香族吸附剂),采用湿法上柱(上柱条件为:高径比为3:1,流速为0.025倍柱体积/min),然后以极性有机溶剂清洗(用量为大孔吸附树脂柱柱体积的1倍),最后用二氯甲烷进行洗脱(用量为大孔吸附树脂柱柱体积的1倍),收集相应洗脱液并对其进行浓缩,从而获取低纯度的维生素K2浓缩液(纯度小于50%);
(4)较高纯度的维生素K2浓缩液的获取
将低纯度的维生素K2浓缩液经过分子量排阻层析柱纯化,然后以苯进行洗脱(其用量为分子量排阻层析柱柱体积的1倍),收集相应洗脱液并对其进行浓缩,从而获取较高纯度的维生素K2浓缩液(纯度为50-80%);
其中,所述分子量排阻层析填料所排阻的物质的分子量为400Da-1000Da;所述填料可分别做柱或分几段装于同一个分子量排阻层析柱中,层析液按照填料排阻极限由小到大或由大到小的顺序依次经过柱填料;所述分子量排阻层析柱高径比为10:1,流速为0.004倍柱体积/min,层析柱高度与维生素K2浓缩液上液高度比为35:1;
(5)高纯度的维生素K2的获取
将较高纯度的维生素K2浓缩液溶解于甲醇后,通过反相硅胶柱(反相硅胶柱的硅胶粒径为10μm,高径比为5:1,流速为0.015倍柱体积/min,柱高与较高纯度的维生素K2浓缩液上液高度比为7:1)分离,然后用甲醇洗脱并分段收集,即可获得高纯度的维生素K2(纯度大于80%);
(6)维生素K2晶体的获取
以分析纯的甲醇将维生素K2于40℃高温溶解,-40℃低温结晶,并重结晶,即可获得维生素K2晶体(纯度大于或等于98.2%)。
优选地,所述浓缩方法为减压浓缩,所述减压浓缩的温度为40℃,真空度小于-0.08MPa。
实施例2
一种分离纯化纳豆芽孢杆菌中维生素K2的方法,如图1所示,包括如下步骤:
(1)维生素K2萃取液的获取
以纳豆芽孢杆菌发酵液为维生素K2提取原液,离心获取菌体,烘干后,采用甲苯进行萃取以获取维生素K2萃取液;其中萃取方式为静置萃取,萃取时间60min,萃取次数为3次。
(2)维生素K2上柱原液的获取
将维生素K2萃取液通过膜分离设备(膜孔径≤0.45μm)除去不溶性杂质,将获得的维生素K2滤液减压蒸干,然后以丙酮重溶,获取维生素K2上柱原液;
(3)低纯度的维生素K2浓缩液的获取
将维生素K2上柱原液通过非极性大孔吸附树脂柱吸附,采用干法上柱(上柱条件为:高径比为10:1,流速为0.110倍柱体积/min),然后以极性有机溶剂清洗(用量为大孔吸附树脂柱柱体积的3倍),最后用异戊烷进行洗脱(用量为大孔吸附树脂柱柱体积的4倍),收集相应洗脱液并对其进行浓缩,从而获取低纯度的维生素K2浓缩液(纯度小于50%);
(4)较高纯度的维生素K2浓缩液的获取
将低纯度的维生素K2浓缩液经过分子量排阻层析柱纯化,然后以三氯代苯进行洗脱(其用量为分子量排阻层析柱柱体积的4倍),收集相应洗脱液并对其进行浓缩,从而获取较高纯度的维生素K2浓缩液(纯度为50-80%);
其中,所述分子量排阻层析填料所排阻的物质的分子量为400Da-1000Da;所述填料可分别做柱或分几段装于同一个分子量排阻层析柱中,层析液按照填料排阻极限由小到大或由大到小的顺序依次经过柱填料;填充得到的分子量排阻层析柱高径比为25:1,流速为0.010倍柱体积/min,层析柱高度与维生素K2浓缩液上液高度比为50:1;
(5)高纯度的维生素K2的获取
将较高纯度的维生素K2浓缩液溶解于丙酮后,通过反相硅胶柱(反相硅胶柱的硅胶粒径为80μm,高径比为25:1,流速为0.065倍柱体积/min,柱高与较高纯度的维生素K2浓缩液上液高度比为30:1)分离,然后用丙酮洗脱并分段收集,即可获得高纯度的维生素K2(纯度大于80%);
(6)维生素K2晶体的获取
以含有30%超纯水的甲醇将维生素K2于85℃高温溶解,0℃低温结晶,并重结晶,即可获得维生素K2晶体(纯度大于98.2%)。
优选地,所述浓缩方法为减压浓缩,所述减压浓缩的温度为99℃,真空度小于-0.08MPa。
实施例3
一种分离纯化纳豆芽孢杆菌中维生素K2的方法,如图1所示,包括如下步骤:
(1)维生素K2萃取液的获取
以纳豆芽孢杆菌发酵液(组成为:大豆粉65g/L,玉米粉60g/L,蛋白胨50g/L,发酵周期为:7-9天)为维生素K2提取原液,离心获取菌体,烘干后,按照以下步骤提取:
①称取1.0g干菌体若干份于50ml的离心管中,分别加入5ml不同的有机溶剂静置萃取50min,萃取2次,做3个平行样;其中不同的有机溶剂分别为甲醇、乙醇、1,3丙二醇、正丁醇、乙酸、二氯甲烷、异戊醇、正己烷、乙酸乙酯、三氯甲烷、四氯化碳、丙酮、乙醚、甲苯;
②将获得的萃取液定容至5ml,获得检测液;
③用HPLC法(流动相:甲醇:二氯甲烷=4:1,流速1mL/min,检测波长248nm)分别检测各萃取液中维生素K2的浓度含量,其中图3为以正丁醇为萃取剂时发酵样品中维生素K2的HPLC液相图谱图,图2为绘制而成的不同有机溶剂萃取维生素K2效率图,其中甲醇与1,3丙二醇的萃取效率极低,后期试验中将不作为相应萃取剂的选择;
(2)维生素K2上柱原液的获取
将维生素K2萃取液通过膜分离设备(膜孔径≤0.45μm)除去不溶性杂质,将获得的维生素K2滤液减压蒸干,然后以甲醇重溶,获取维生素K2上柱原液;
(3)低纯度的维生素K2浓缩液的获取
①称取一定量的大孔吸附树脂,以95%乙醇浸泡过夜后,湿法上柱,并以95%的乙醇冲洗至流出液与蒸馏水的混合液(1:5,V/V)无浑浊为止,然后以2倍柱体积的甲醇冲洗柱子,制成的层析柱高径比为6:1;
②量取一定量的维生素K2甲醇溶液上柱,以0.0283倍柱体积/min的流速过柱,然后以相同的流速用2倍柱体积的甲醇清洗柱子,之后以相同的流速用2倍柱体积的正己烷洗脱维生素K2;
③重复步骤2两次,作为平行实验,获得第二次、第三次维生素K2洗脱液;
测量各维生素K2洗脱液的体积,用HPLC法(流动相:甲醇:二氯甲烷=4:1,流速1mL/min,检测波长248nm)检测各洗脱液中维生素K2的含量及油脂性杂质情况,计算维生素K2的回收率,接着,合并相应洗脱液并其进行浓缩,从而获取低纯度(纯度小于50%)的维生素K2浓缩液;
其中,获得的低纯度的维生素K2浓缩液不含或含极少量的油脂类极性杂质(质量分数<5%),并且,维生素K2的回收率经计算为80%-99%;
(4)较高纯度的维生素K2浓缩液的获取
①称取一定量的分子量排阻色谱填料(排阻极限为1000Da)预处理后,湿法上柱,以2倍柱体积的四氢呋喃冲洗柱子,制成的层析柱高径比为17:1;
②将低纯度的维生素K2浓缩液经四氢呋喃溶液重溶,量取一定体积的维生素K2四氢呋喃溶液上柱,并以四氢呋喃冲洗柱子,流速为0.0056倍柱体积/min,层析柱高度与维生素K2浓缩液上液高度之比为46:1;
③分段收集各截留段并对其进行浓缩,从而获取较高纯度(纯度为50-80%)的维生素K2浓缩液,其中以HPLC法检测各截留段中维生素K2的浓度;
④称取一定量的分子量排阻色谱填料(排阻极限为400Da)预处理后,湿法上柱,重复①-③,经HPLC检测后,获得维生素K2截留段。
优选地,获得的较高纯度的维生素K2溶液中大分子杂质(分子量>1000Da)与小分子杂质(分子量<400Da)含量之和≤1%,维生素K2回收率≥98%。;
(5)高纯度的维生素K2的获取
①将反相硅胶(粒径为50μm)经过预处理后,湿法上柱,然后以2倍柱体积的甲醇冲洗柱子,制成的层析柱高径比为12:1;
②较高纯度的维生素K2浓缩液以适量甲醇重溶,取适量上柱,层析柱高度与维生素K2浓缩液上液高度之比为10:1,然后以甲醇进行洗脱,流速为0.0163倍柱体积/min;
③分段收集各截留段即可获得高纯度(纯度大于80%)的维生素K2,其中以HPLC法检测各截留段中维生素K2浓度并计算回收率;
(6)维生素K2晶体的获取
①对获得的维生素K2洗脱液进行浓缩,然后以适量的含有10%超纯水的甲醇在80℃温度下重溶;
②将获得维生素K2甲醇溶液至于-20℃的冰箱中静置过夜;
③将上述固液混合物4℃低温过滤,即可获得维生素K2晶体,并重结晶一次;
④将得到的维生素K2晶体以HPLC上样液(甲醇:二氯甲烷=4:1)重溶,再采用HPLC法(流动相:甲醇:二氯甲烷=4:1,流速1mL/min,检测波长248nm)检测维生素K2晶体的浓度含量,其检测图如图4所示,检测发现,其纯度达到98.2%。
优选地,上述浓缩方法均为减压浓缩,温度为40-99℃,真空度小于-0.08MPa。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!