一种基于S1酶切割的适配体截短优化方法与流程
本发明属于医疗诊断领域,特别涉及到利用核酸酶酶切优化已筛选适配体的方法。目前适配体的截短优化主要为软件计算模拟,很少涉及基于实验的直接截短优化。该方法可为适配体的截短优化提供实验方法,并为阐明适配体与靶物的相互作用机制提供依据。
背景技术:
随着我国社会经济高速发展、人口老龄化进程加速,癌症已成为已经成为仅次于心血管疾病的高死亡率疾病。癌症是慢性病,早诊断早治疗对于提高患者生存率具有重大意义。肿瘤标志物检测是癌症早期发现、鉴别、预后的重要手段,而无论患者或健康者体内的肿瘤标志物含量是微量的,因此需要高灵敏的检测方法。目前,肿瘤标记物的检测学方法主要是利用蛋白间的特异性相互作用进行检测。程序性死亡配体1(pd-l1)是一种重要的肿瘤标记物,它是一种跨膜蛋白,在多种癌细胞上过量表达,为程序性细胞死亡受体1(pd-1)的主要配体。pd-l1蛋白在调节抗肿瘤宿主免疫中起着重要作用,使肿瘤细胞逃避宿主免疫系统并促进癌细胞转移。
抗体蛋白的表达纯化成本高昂且易失活,批次间差异大,对肿瘤标志物检测结果产生不良影响。核酸适配体是从dna或rna文库中筛选的、能与靶标物质高特异性结合的单链寡核苷酸序列。核酸适配体通过碱基对堆积、氢键、静电和疏水作用等与靶标物质特异性结合。与蛋白质相比,核酸适配体具有亲和力高、特异性强、分子量小、易合成易修饰、筛选周期短等优点,是蛋白质抗体的良好替代。
直接从文库中筛选得到的核酸适配体可能无法直接运用于成分复杂的待检体系,需要进一步截短优化。随着核酸的长度增加,由于意外的相互作用,它们有更大的机会被锁定成亚稳态非活性构象。核苷酸碱基堆积力允许非活性构象和活性构象分隔,这表明更短的核酸适配体具有较大变为活性构象的倾向。适配体截短主要通过软件进行分子对接模拟,根据模拟适配体-靶物作用位点进行序列截短。本发明以pd-l1为靶分子,以s1核酸酶为截短酶,基于适配体与靶物结合区域对酶切效率产生不利影响,在质谱检测中结合区域片段呈现出较大的离子丰度,而截短优化出亲和力更高的序列。
技术实现要素:
本发明的目的在于克服现有适配体截短优化的不足,提供新型的适配体截短优化方法,相比于基于软件的分子动力学模拟,更具有事实性,并为阐明适配体与靶物的相互作用机制提供依据。本发明以pd-l1为靶分子,以s1核酸酶为截短酶,对已知适配体进行截短优化出亲和力更高的序列。
上述目的通过以下技术方案实现:
1.合成以下序列所示的pd-l1核酸适配体:
5’-gctgtgtgactcctgcaagacggaccagccttgccgcaagacggaccagggattcaaacgagcagctgtatcttgtctcc-3’。
2.利用核酸酶切截短优化适配体
酶切截短优化过程所用试剂:2×蛋白结合液浓度组成为:100mm磷酸钠,600mmnacl,0.02%吐温-20,ph8.0(1×蛋白结合液即把2×蛋白结合液稀释1倍)。
selex结合液:150mmnacl,5mmkcl,1mmmgcl2,1mmcacl2,40mm4-羟乙基哌嗪乙磺酸,ph7.4。
洗脱液:20mm三羟甲基氨基甲烷,500mm咪唑,ph7.5。
5×反应液:200mm乙酸钠,1.5mnacl,10mmznso4,ph4.5。
人pd-l1/b7-h1蛋白,histag(hplc-verified)购买自acrobiosystems(bethesda,md)。
2.1pd-l1蛋白重建
用250μl无菌去离子水将冻干的pd-l1重新构建成400μg/ml的原液,室温下增溶30-60分钟。平分成10份,每份25μl,置于-80℃冰箱。
2.2pd-l1蛋白和磁珠连接
2.2.1取5μlpd-l1蛋白溶液加入到700μl1×蛋白结合液中。
2.2.2在小瓶中混匀磁珠(涡流>30秒或倾斜、旋转5分钟)。
2.2.3将50μl磁珠转移到微离心管上,并放置在磁分离架上2分钟,抽吸并清除上清液。向磁珠中加入样品(在1×蛋白结合液中制好),混匀。
2.2.4在37℃下在滚筒上孵育5分钟,孵育结束置于磁分离架2分钟,弃上清液。
2.2.5取1×蛋白结合液洗涤磁珠-蛋白复合体3次(每次300μl),磁分离2分钟弃上清液。
2.3适配体孵育
2.3.1适配体溶于无菌水,95℃热变性5分钟,冰浴10分钟,与等体积selex结合液混匀。
2.3.2加入到磁珠-蛋白质复合物中,混匀,室温下孵育30分钟。
2.3.3孵育结束磁分离去上清液,用pbs-t缓冲液清洗2次(每次200μl)。
2.4s1核酸酶切实验
2.4.1取2.3.3得到的磁珠复合物及适量s1核酸酶加入到1×反应液体系中,37℃反应30分钟,磁分离,用pbs-t洗涤2次(每次500μl),去上清液。
2.4.2加入200μl洗脱液,混合均匀,100℃沸水浴10分钟(煮沸时注意用胶带缠好离心管口,插在泡沫或者海绵中间放入沸水中),磁分离,取上清液。
3.质谱分析
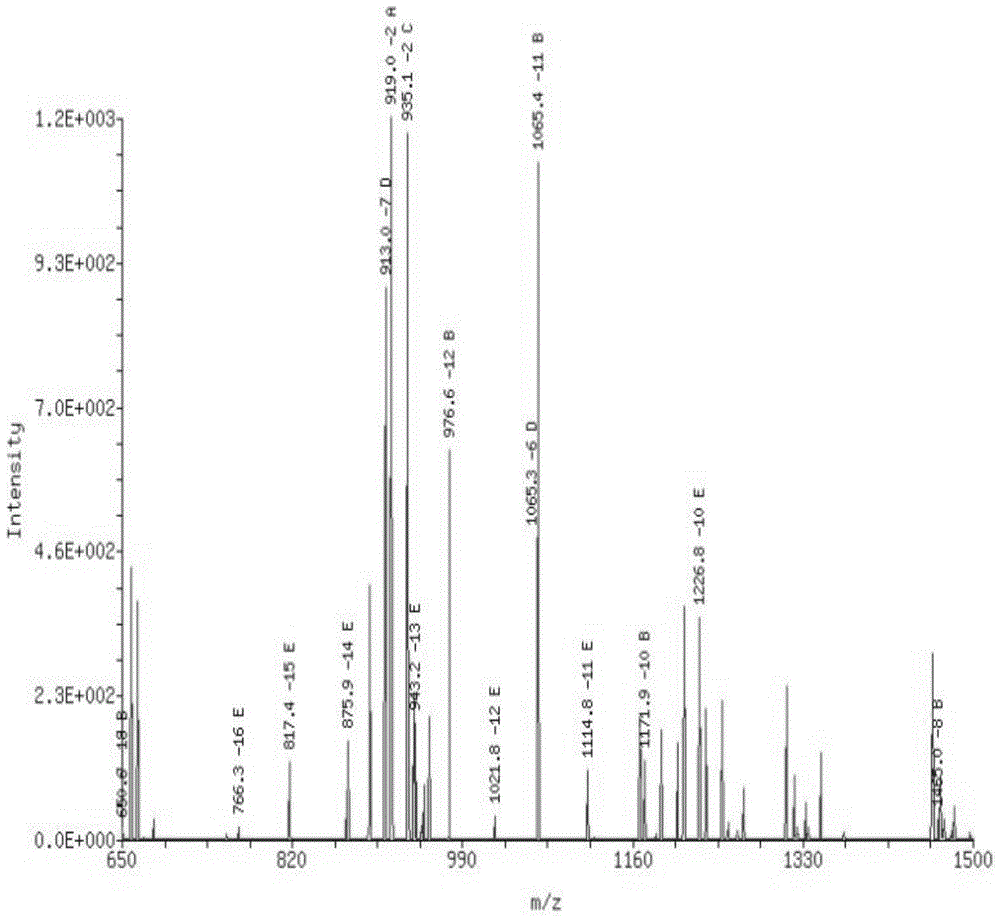
3.1运用赛默飞ltqxl型线性离子阱质谱仪对2.4.2所得上清液分析,结果如图1。
3.2对比质谱图与截短前序列,得到截短优化后序列为:
5’-aagacggaccagccttgccgcaagacggaccagggatt-3’。图2为截短核酸适配体在原适配体中位置的二级结构图。
4亲和力分析:
4.1用selex结合液将5’端标记荧光基团的原pd-l1核酸适配体及截短后pd-l1适配体分别配制成一系列浓度。
4.2每个浓度梯度取100μl,95℃水浴5分钟,冰浴10分钟,将其加入pd-l1-his标签磁珠复合物中,37℃孵育30分钟。
4.3将4.2中磁珠-pd-l1-适配体的复合体用1×蛋白结合液清洗2次(每次200μl),最后重悬于200μl,用酶标仪测荧光强度。
4.4以核酸适配体浓度为横坐标,荧光强度为纵坐标,绘制结合饱和曲线,求得原pd-l1适配体kd值为115.15nm,截短后pd-l1适配体kd值为52.20nm。如图3所示,截短后,适配体kd值降低54.67%,说明适配体进行了有效的截短优化。
本发明的优点:
(1)本发明与传统截短优化技术(软件预测截短)相比,该方法具有基于实验的直接截短优化的优势,且可操作性强。
(2)本发明为阐明适配体与靶物的相互作用机制提供事实依据。
(3)本发明截短优化得到的核酸适配体,能与pd-l1结合,且亲和力比原适配体更高。
(4)本发明中利用该核酸适配体修饰不同的报告分子,可以构建各种生物传感器,用于检测人体血浆中携带pd-l1的外泌体,也可以用于分离检测高表pd-l1的癌细胞。
附图说明
图1:核酸适配体酶切后质谱结果图
图2:截短核酸适配体在原适配体中位置的二级结构图
图3:截短优化前后核酸适配体的kd值非线性拟合(a.原序列;b.截短序列)
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:合成以下序列所示的pd-l1核酸适配体
1.pd-l1核酸适配体:
5’-gctgtgtgactcctgcaagacggaccagccttgccgcaagacggaccagggattcaaacgagcagctgtatcttgtctcc-3’。
实施例2:利用核酸酶切截短优化适配体
2.酶切截短优化
酶切截短优化过程所用试剂:2×蛋白结合液终浓度组成为:100mm磷酸钠,600mmnacl,0.02%吐温-20,ph8.0(2×蛋白结合液即把2×蛋白结合液稀释1倍)。
selex结合液:150mmnacl,5mmkcl,1mmmgcl2,1mmcacl2,40mm4-羟乙基哌嗪乙磺酸,ph7.4。
洗脱液:20mm三羟甲基氨基甲烷,500mm咪唑,ph7.5。
人pd-l1/b7-h1蛋白,histag(hplc-verified)购买自acrobiosystems(bethesda,md)。
2×reactionbuffer:200mm乙酸钠,1.5mnacl,10mmznso4,ph4.5。
2.1pd-l1蛋白重建
用250μl无菌去离子水将冻干的pd-l1重新构建成400μg/ml的原液,室温下增溶30-60分钟。平分成10份,每份25μl,置于-80℃冰箱。
2.2pd-l1蛋白和磁珠连接
2.2.1取5μlpd-l1蛋白溶液加入到700μl1×蛋白结合液中。
2.2.2在小瓶中混匀磁珠(涡流>30秒或倾斜、旋转5分钟)。
2.2.3将50μl磁珠转移到微离心管上,并放置在磁分离架上2分钟,抽吸并清除上清液。向磁珠中加入样品(在1×蛋白结合液缓冲液中制好),混匀。
2.2.4在37℃下在滚筒上孵育5分钟,孵育结束置于磁分离架2分钟,弃上清液。
2.2.5取1×蛋白结合液洗涤磁珠-蛋白复合体3次(每次300μl),磁分离2分钟弃上清液。
2.3适配体孵育
2.3.1适配体溶于无菌水,95℃热变性5分钟,冰浴10分钟,与等体积selex结合液混匀。
2.3.2加入到磁珠-蛋白质复合物中,混匀,室温下孵育30分钟。
2.3.3孵育结束磁分离去上清液,用pbs-t缓冲液清洗2次(每次200μl)。
2.4s1核酸酶切实验
2.4.1取2.3.3得到的磁珠复合物及适量s1核酸酶加入到1×反应液体系中,37℃反应30分钟,磁分离,用pbs-t洗涤2次(每次500μl),去上清液。
2.4.2加入200μl洗脱液,混合均匀,100℃沸水浴10分钟(煮沸时注意用胶带缠好离心管口,插在泡沫或者海绵中间放入沸水中),磁分离,取上清液。
实施例3.质谱分析
3.1运用赛默飞ltqxl型线性离子阱质谱仪对2.4.2所得上清液分析,结果如图1。
3.2对比质谱图与截短前序列,得到截短优化后序列为:5’-aagacggaccagccttgccgcaagacggaccagggatt-3’。图2为截短核酸适配体在原适配体中位置的二级结构图。
实施例4亲和力分析:
4.1用selex结合液将5’端标记荧光基团的原pd-l1核酸适配体及截短后pd-l1适配体分别配制成一系列浓度。
4.2每个浓度梯度取100μl,95℃水浴5分钟,冰浴10分钟,将其加入pd-l1-his标签磁珠复合物中,37℃孵育30分钟。
4.3将4.2中磁珠-pd-l1-适配体的复合体用1×蛋白结合液清洗2次(每次200μl),最后重悬于200μl,用酶标仪测荧光强度。
4.4以核酸适配体浓度为横坐标,荧光强度为纵坐标,绘制结合饱和曲线,求得原pd-l1适配体kd值为115.15nm,截短后pd-l1适配体kd值为52.20nm。如图3所示,截短后,适配体kd值降低54.67%,说明适配体进行了有效的截短优化。
序列表
<110>北京化工大学
<120>一种基于s1酶切割的适配体截短优化方法
<141>2019-01-28
<160>2
<170>siposequencelisting1.0
<210>2
<211>80
<212>dna
<213>2ambystomalateralexambystomajeffersonianum
<400>2
gctgtgtgactcctgcaagacggaccagccttgccgcaagacggaccagggattcaaacg60
agcagctgtatcttgtctcc80
<210>2
<211>38
<212>dna
<213>2ambystomalateralexambystomajeffersonianum
<400>2
aagacggaccagccttgccgcaagacggaccagggatt38
- 还没有人留言评论。精彩留言会获得点赞!