用于序列操纵和治疗应用的系统、方法和组合物的递送、工程化和优化与流程
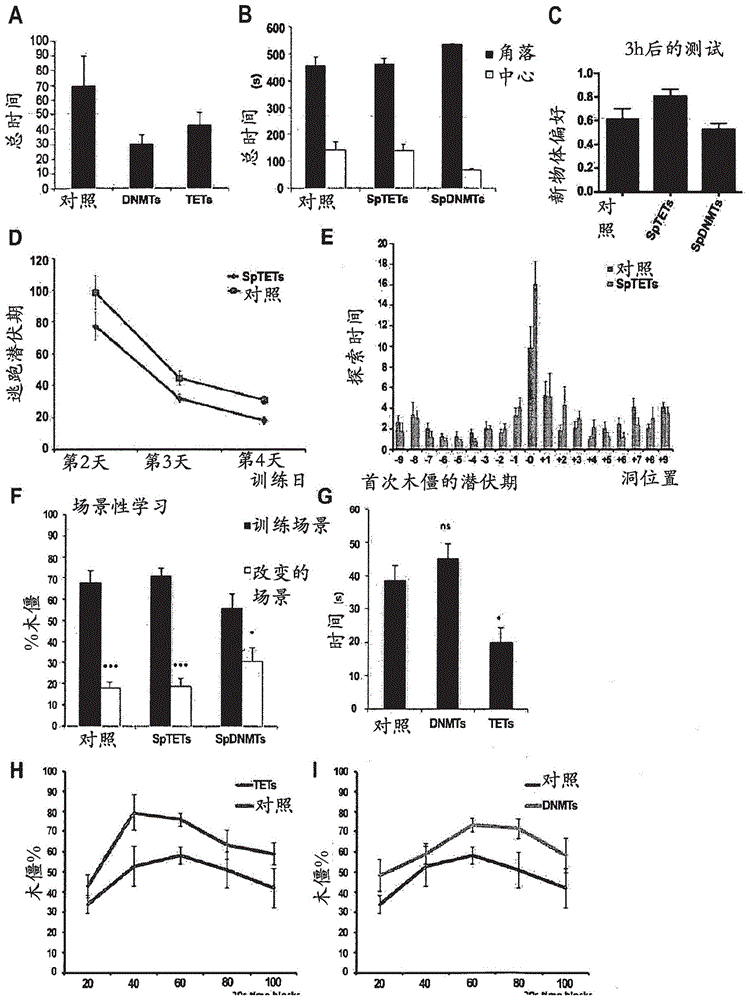
本申请是申请日为2013年12月12日、申请号为2013800727522、发明名称为“用于序列操纵和治疗应用的系统、方法和组合物的递送、工程化和优化”的发明专利申请的分案申请。相关应用和引用参考本申请要求下列美国临时专利申请号的权益和优先权:2012年12月12日提交的61/736,527;2013年1月2日提交的61/748,427;2013年1月30日提交的61/758,468,2013年2月25日提交的61/769,046;2013年3月15日提交的61/791,409和61/802,174,2013年3月28日提交的61/806,375;2013年4月20日提交的61/814,263;2013年5月6日提交的61/819,803;2013年5月28日提交的61/828,130;2013年6月17日提交的61/835,931和61/836,123以及2013年7月17日提交的61/847,537。还参考了下列美国临时专利申请号:2013年3月15日提交的61/799,800;2013年6月17日提交的61/835,931、61/835,936、61/836,127、61/836,101、61/836,080和61/835,973;2013年8月5日提交的61/862,468和61/862,355;2013年8月28日提交的61/871,301;2013年9月25日提交的61/960,777;以及2013年10月28日提交的61/961,980。前述申请、以及在其中或在它们的审查程序期间引用的所有文献或(“申请引用文献”)以及在这些申请引用文献中引用或参考的所有文献、以及在本文中引用或参考的所有文献(“本文引用的文献”)、在本文中引用的文献中引用或参考的所有文献,连同针对在本文中提及或通过引用结合在本文中的任何文献中的任何产品的任何制造商的说明书、说明、产品规格、和产品表,特此通过引用并入本文,并且可以在本发明的实践中采用。更具体地说,所有参考的文献均通过引用并入本文,其程度如同每个单独的文献被确切地并单独地指明通过引用而并入本文。发明领域本发明总体上涉及用于控制涉及序列靶向的基因表达的系统、方法、和组合物的递送、工程化、优化和治疗应用,该序列靶向例如涉及规律间隔成簇短回文重复序列(crispr)及其组分的基因组干扰或基因编辑。关于联邦资助研究的声明本发明是在美国国立卫生研究院颁发的nih先锋奖(pioneeraward)(1dp1mh100706)的政府支持下完成的。美国政府享有本发明的某些权利。发明背景在基因组测序技术和分析方法中的最新进展显著加速了对与范围广泛的生物功能和疾病相关联的遗传因子进行编目和映射的能力。精确的基因组靶向技术对于通过允许个体遗传元件的选择性干扰而使得因果性遗传变异的统性逆向工程成为可能、以及推进合成生物学、生物技术应用、和医学应用是需要的。虽然基因组编辑技术,如设计师锌指、转录激活子样效应因子(tale)、或归巢大范围核酸酶(homingmeganuclease)对于产生靶向的基因组干扰是可得的,但是仍然需要负担得起的、易于建立的、可扩展的、并且便于靶向真核基因组内的多个位置的新的基因组工程技术。发明概述该crispr-cas系统不要求产生针对靶特异性序列的定制蛋白,相反,通过识别特异性dna靶的短rna分子可以对单个cas酶进行程序设计。将该crispr-cas系统添加到基因组测序技术和分析方法的组库中可以显著使该方法论简化并且提高对与范围广泛的生物功能和疾病相关联的遗传因子进行编目和映射的能力。为了有效而无有害作用地利用crispr-cas系统用于基因组编辑,了解这些基因组工程工具的工程化、优化和细胞类型/组织/器官特异性递送等方面是至关重要的,这些方面是所要求的本发明方面。对于用于一系列广泛的应用的核酸序列靶向的替代性的稳健的系统和技术存在着迫切需要。本发明的多个方面着手解决这种需要并且提供了相关优点。示例性crispr复合物包括与一种指导序列复合的crispr酶,该指导序列与靶多核苷酸内的靶序列杂交。该指导序列与一种tracr配对序列连接,该tracr配对序列进而与一种tracr序列杂交。在一方面,本发明提供了使用crispr-cas系统的一个或多个元件的方法。本发明的crispr复合物提供了用于修饰靶多核苷酸的有效手段。本发明的crispr复合物具有多种多样的实用性,包括修饰(例如,缺失、插入、转位、失活、激活)各种组织和器官中的多种细胞类型中的靶多核苷酸。正因为如此,本发明的crispr复合物在例如基因或基因组编辑、基因治疗、药物发现、药物筛选、疾病诊断、以及预后中具有广阔的应用谱。本发明的方面涉及在具备具有优化活性的指导rna的crispr-cas9系统中的、具有改进的靶向特异性的、在长度上小于野生型cas9酶的cas9酶和编码它的核酸分子、和嵌合的cas9酶、以及改进cas9酶的靶特异性或设计crispr-cas9系统的方法,所述方法包括设计或制备具有优化活性的指导rna和/或选择或制备具有比野生型cas9更小的尺寸或长度的cas9酶,由此将编码它的核酸包装到更高级的递送载体(因为在该递送载体中对它的编码少于野生型cas9)中,和/或产生嵌合cas9酶。还提供了本发明的序列、载体、酶或系统在医学中的用途。还提供了它们在基因或基因组编辑中的用途。在本发明的另外方面,cas9酶可以包含一个或多个突变,并且可以用作具有或不具有与功能结构域融合的通用dna结合蛋白。这些突变可以是人工引入的突变或获得性和丢失性功能突变。这些突变可以包括但不限于分别在ruvc和hnh催化结构域中的催化结构域(d10和h840)之一中的突变。已经表征了其他的突变。在本发明的一个方面,该转录激活结构域可以是vp64。在本发明的其他方面,该转录阻抑结构域可以是krab或sid4x。本发明的其他方面涉及融合到结构域上的突变的cas9酶,这些结构域包括但不限于,转录激活剂、阻抑物、重组酶、转座酶、组蛋白重塑剂(histoneremodeler)、脱甲基酶、dna甲基转移酶、隐花色素、光可诱导/可控制结构域或化学可诱导/可控制结构域。在一个另外的实施例中,本发明提供了产生突变体tracrrna和允许增强这些rna在细胞中的性能的同向重复序列或突变体嵌合指导序列的方法。本发明的方面还提供了所述序列的选择。本发明的方面还提供了简化crispr复合物的组分的克隆和递送的方法。在本发明的优选实施例中,适合的启动子,如u6启动子,与dna寡核苷酸一起扩增并且添加到指导rna上。然后将生成的pcr产物转染到细胞中以驱动指导rna的表达。本发明的方面还涉及体外转录的或从合成公司订购并且直接转染的指导rna。在一个方面,本发明提供了通过使用更具活性的聚合酶来提高活性的方法。在一个优选的实施例中,这些指导rna在t7启动子控制下的表达是由该细胞中的t7聚合酶的表达驱动的。在一个有利的实施例中,该细胞是真核细胞。在一个优选的实施例中,该真核细胞是人类细胞。在一个更优选的实施例中,该人类细胞是患者特异性细胞。在一个方面,本发明提供了用于降低cas酶的毒性的方法。在某些方面,该cas酶是如本文描述的任何cas9,例如任何天然存在的细菌cas9以及任何嵌合体、突变体、同源物或直向同源物。在一个优选的实施例中,该cas9以mrna的形式递送到该细胞中。这允许该酶的瞬时表达,由此降低毒性。在另一个优选实施例中,本发明还提供了在诱导型启动子的控制下表达cas9的方法、以及在其中使用的构建体。在另一方面,本发明提供了用于改进crispr-cas系统的体内应用的方法。在该优选实施例中,该cas酶是本文描述的野生型cas9或任何修改版本,包括任何天然存在的细菌cas9以及任何嵌合体、突变体、同源物或直向同源物。本发明的一个有利方面提供了易于被包装到病毒载体以便递送的cas9同源物的选择。cas9直向同源物典型地共享3-4个ruvc结构域和一个hnh结构域的通用结构。最5'的ruvc结构域切割非互补链,而hnh结构域切割互补链。所有符号都是就指导序列而言的。在5'ruvc结构域中的催化残基是通过该感兴趣的cas9与其他cas9直向同源物(来自化脓链球菌ii型crispr位点、嗜热链球菌crispr位点1、嗜热链球菌crispr位点3、以及凶手弗朗西斯菌(franciscillanovicida)ii型crispr位点)的同源性比较而鉴定的,并且保守性asp残基(d10)被突变为丙氨酸以将cas9转化成互补链切口酶。类似地,在hnh结构域中的保守性his和asn残基被突变为丙氨酸以将cas9转化为非互补链切口酶。在一些实施例中,这两组突变都可以进行,将cas9转化为非切割酶。在一些实施例中,该crispr酶是i型或iii型crispr酶,优选ii型crispr酶。这种ii型crispr酶可以是任何cas酶。优选的cas酶可以被鉴定为cas9,因为这可以是指与来自ii型crispr系统的具有多个核酸酶结构域的最大核酸酶共享同源性的酶的通用类别。最优选地,该cas9酶来自或衍生自spcas9或sacas9。关于衍生,申请人意指该衍生的酶在很大程度上是基于与野生型酶具有高度序列同源性的含义,但是如本文所述它在某些方面已经被突变(修饰)。应当理解的是,术语cas和crispr酶在本文中通常可互换地使用,除非另外说明。如上提及的,在本文中使用的许多残基编号是指来自化脓链球菌中的ii型crispr位点的cas9酶。然而,应当理解的是,本发明包括更多的来自其他微生物物种的cas9s,如spcas9、sacas9、st1cas9等等。在本文中提供了另外的实例。熟练的技术人员将能够通过比较相关氨基酸序列而确定在除了spcas9之外的cas9酶中的适当的相应残基。因此,在特异性氨基酸置换是指使用spcas9编号的情况下,那么,除非上下文清楚说明,这并不预期是指其他cas9酶,本披露预期涵盖在其他cas9酶中的相应修饰。本文中提供了在这种情形下针对人类进行优化(即,针对在人类中表达进行优化)的密码子优化序列的实例,参见sacas9人类密码子优化序列。在这被优化的同时,应当理解其他实例是可能的并且针对宿主物种的密码子优化是已知的。在另外的实施例中,本发明提供了通过产生嵌合cas9蛋白而增强cas9的功能的方法。嵌合cas9蛋白嵌合cas9可以是含有来自一种以上的天然存在的cas9的片段的新cas9。这些方法可包括使一种cas9同源物的n末端片段与另一种cas9同源物的c末端片段融合。这些方法还允许选择这些嵌合cas9蛋白所展示的新特性。应当理解的是,在本发明的方法中,在该生物是一种动物或植物的情况下,该修饰可以离体地或在体外例如在细胞培养物中进行,在一些情况下不在体内进行。在其他实施例中,可以在体内进行。在一个方面,本发明提供了一种通过操纵在感兴趣的基因组座位中的靶序列来修饰一种生物或非人类生物的方法,该方法包括:递送一种非天然存在的或工程化的组合物,该组合物包含:a)-i.一种crispr-cas系统嵌合rna(chirna)多核苷酸序列,其中该多核苷酸序列包含:(a)一种指导序列,该指导序列能够杂交到真核细胞中的靶序列上,(b)一种tracr配对序列,和(c)一种tracr序列,以及ii.对包含至少一个或多个核定位序列的crispr酶进行编码的多核苷酸序列,其中(a)、(b)和(c)以5’到3’方向排列,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列指导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的指导序列、和(2)杂交到该tracr序列上的tracr配对序列复合的crispr酶,并且该编码crispr酶的多核苷酸序列是dna或rna,或者(b)i.多核苷酸,其包含:(a)一种指导序列,该指导序列能够杂交到真核细胞中的靶序列上,和(b)至少一个或多个tracr配对序列,ii.一种编码crispr酶的多核苷酸序列,以及iii.一种包含tracr序列的多核苷酸序列,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列指导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的指导序列、和(2)杂交到该tracr序列上的tracr配对序列复合的crispr酶,并且该编码crispr酶的多核苷酸序列是dna或rna。编码crispr酶的多核苷酸序列、指导序列、tracr配对序列或tracr序列的任一者或全部可以是rna。对编码crispr酶的序列、指导序列、tracr配对序列或tracr序列进行编码的多核苷酸可以是rna并且可以经由脂质体、纳米粒子、外泌体、微囊泡、或基因枪进行递送。应当理解的是,在提及作为rna并且被认为‘包含’这样一种tracr配对序列的特征的多核苷酸的情况下,该rna序列包括该特征。在该多核苷酸是dna并且被认为包含这样一种tracr配对序列的特征的情况下,该dna序列被或者可以被转录成包括该讨论中的特征的rna。在该特征是蛋白质的情况下,如crispr酶,所提及的该dna或rna序列被或者可以被翻译(以及在dna首先被转录的情况下)。因此,在某些实施例中,本发明提供了一种通过操纵在感兴趣的基因组座位中的靶序列来修饰一种生物(例如包括人类的哺乳动物或非人类哺乳动物或生物)的方法,该方法包括递送一种包含病毒或质粒载体系统的非天然存在的或工程化的组合物,该载体系统包含可操作地编码用于其表达的组合物的一种或多种病毒或质粒载体,其中该组合物包括:(a)一种非天然存在的或工程化的组合物,该组合物包含一种载体系统,该载体系统包含一种或多种载体,该一种或多种载体包含:i.一种第一调节元件,该第一调节元件可操作地连接到一个crispr-cas系统嵌合rna(chirna)多核苷酸序列上,其中该多核苷酸序列包含(a)一个能够杂交到真核细胞中的靶序列上的指导序列,(b)一种tracr配对序列,和(c)一种tracr序列,以及ii.一种第二调节元件,该第二调节元件可操作地连接到编码crispr酶的酶编码序列上,该crispr酶包含至少一个或多个核定位序列(或者任选地至少一个或多个核定位序列,因为在一些实施例中可能不涉及nls),其中(a)、(b)和(c)以5’到3’方向排列,其中组分i和ii位于该系统的相同或不同载体上,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列指导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的指导序列、和(2)杂交到该tracr序列上的tracr配对序列复合的crispr酶,或者(b)一种非天然存在的或工程化的组合物,该组合物包含一种载体系统,该载体系统含有一种或多种载体,该一种或多种载体包含i.一种第一调节元件,该第一调节元件可操作地连接到(a)能够杂交到真核细胞中的靶序列上的指导序列、和(b)至少一个或多个tracr配对序列,ii.一种第二调节元件,该第二调节元件可操作地连接到编码crispr酶的酶编码序列上,以及iii.一种第三调节元件,该第三调节元件可操作地连接到tracr序列上,其中组分i、ii和iii位于该系统的相同或不同载体上,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列指导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的指导序列、和(2)杂交到该tracr序列上的tracr配对序列复合的crispr酶。在一些实施例中,组分i、ii和iii位于相同载体上。在其他实施例中,组分i和ii位于相同载体上,而组分iii位于另一种载体上。在其他实施例中,组分i和iii位于相同载体上,而组分ii位于另一种载体上。在其他实施例中,组分ii和iii位于相同载体上,而组分i位于另一种载体上。在其他实施例中,组分i、ii和iii各自位于不同的载体上。本发明还提供了如本文所述的病毒或质粒载体系统。优选地,该载体可以是病毒载体,如慢病毒或杆状病毒或优选地腺病毒/腺病毒相关病毒载体,但是其他递送手段也是已知的(如酵母系统、微囊泡、基因枪/将载体附接到金纳米粒子上的手段)并且被提供。在一些实施例中,可以经由脂质体、纳米粒子、外泌体、微囊泡、或基因枪递送一种或多种病毒载体或质粒载体。通过操纵靶序列,申请人还打算靶序列的表观遗传操纵。这可以是靶序列的染色质状态的操纵,如借助于修饰靶序列的甲基化状态(即,甲基化或甲基化模式或cpg岛的添加或去除)、组蛋白修饰,从而增加或降低靶序列的可及性,或者借助于3d折叠。应当理解的是,在提及一种通过操纵在感兴趣的基因组座位中的靶序列来修饰一种生物或哺乳动物(包括人类或非人类哺乳动物或生物)的方法的情况下,这可适用于作为整体的生物(或哺乳动物)或者仅仅是来自这种生物的单个细胞或细胞群(如果该生物是多细胞的话)。在人类的情况下,例如,申请人特别地设想到单个细胞或细胞群,并且这些细胞可以优选地进行离体修饰,进而重新引入。在这种情况下,活组织检查或其他组织或生物流体样品可以必要的。在这方面,干细胞也是特别优选的。但是,当然还设想了体内实施例。在某些实施例中,本发明提供了一种治疗或抑制对其有需要的受试者(例如哺乳动物或人类)或非人类受试者(例如,哺乳动物)中感兴趣的基因组座位中的靶序列缺陷所引起的病症的方法,该方法包括通过操纵该靶序列而修饰该受试者或非人类受试者,并且其中该病症对于借助于包括提供治疗的靶序列操纵的治疗或抑制是敏感的,该治疗包括:递送包含aav或慢病毒载体系统的非天然存在的或工程化的组合物,该载体系统含有一种或多种aav或慢病毒载体,所述载体可操作地编码用于其表达的组合物,其中在表达时该靶序列由该非天然存在的或工程化的组合物操纵,其中该非天然存在的或工程化的组合物包括:(a)一种非天然存在的或工程化的组合物,该组合物包含一种载体系统,该载体系统包含一种或多种载体,该一种或多种载体包含:i.一种第一调节元件,该第一调节元件可操作地连接到一个crispr-cas系统嵌合rna(chirna)多核苷酸序列上,其中该多核苷酸序列包含(a)一个能够杂交到真核细胞中的靶序列上的指导序列,(b)一种tracr配对序列,和(c)一种tracr序列,以及ii.一种第二调节元件,该第二调节元件可操作地连接到编码crispr酶的酶编码序列上,该crispr酶包含至少一个或多个核定位序列(或者任选地至少一个或多个核定位序列,因为在一些实施例中可能不涉及nls),其中(a)、(b)和(c)以5’到3’方向排列,其中组分i和ii位于该系统的相同或不同载体上,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列指导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的指导序列、和(2)杂交到该tracr序列上的tracr配对序列复合的crispr酶,或者(b)一种非天然存在的或工程化的组合物,该组合物包含一种载体系统,该载体系统含有一种或多种载体,该一种或多种载体包含i.一种第一调节元件,该第一调节元件可操作地连接到(a)能够杂交到真核细胞中的靶序列上的指导序列、和(b)至少一个或多个tracr配对序列,ii.一种第二调节元件,该第二调节元件可操作地连接到编码crispr酶的酶编码序列上,以及iii.一种第三调节元件,该第三调节元件可操作地连接到tracr序列上,其中组分i、ii和iii位于该系统的相同或不同载体上,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列指导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的指导序列、和(2)杂交到该tracr序列上的tracr配对序列复合的crispr酶。在一些实施例中,组分i、ii和iii位于相同载体上。在其他实施例中,组分i和ii位于相同载体上,而组分iii位于另一种载体上。在其他实施例中,组分i和iii位于相同载体上,而组分ii位于另一种载体上。在其他实施例中,组分ii和iii位于相同载体上,而组分i位于另一种载体上。在其他实施例中,组分i、ii和iii各自位于不同的载体上。本发明还提供了如本文所述的病毒(例如,aav或慢病毒)载体系统,并且可以是如本文所述的载体系统的一部分。本发明的一些方法可以包括诱导表达。在本发明的一些方法中,该生物或受试者是真核生物(包括人类在内的哺乳动物)或非人类真核生物或非人类动物或非人类哺乳动物。在一些实施例中,该生物或受试者是非人类动物,并且可以是节肢动物例如昆虫,或者可以是线虫。在本发明的一些方法中,该生物或受试者是植物。在本发明的一些方法中,该生物或受试者是哺乳动物或非人类哺乳动物。非人类哺乳动物可以是例如啮齿动物(优选小鼠或大鼠)、有蹄动物、或灵长动物。在本发明的一些方法中,该生物或受试者是包括微藻在内的藻类,或者是真菌。在本发明的一些方法中,该病毒载体是aav或慢病毒,并且可以是如本文所述的载体系统的一部分。在本发明的一些方法中,该crispr酶是cas9。在本发明的一些方法中,该指导序列的表达是在t7启动子控制下并且是由t7聚合酶的表达驱动的。在一些实施例中,本发明包括一种递送crispr酶的方法,该方法包括向细胞递送编码该crispr酶的mrna。在本发明的这些方法的一些中,该crispr酶是cas9。本发明还提供了制备本发明的载体系统尤其是如本文所述的病毒载体系统的方法。在一些实施例中,本发明包括一种制备本发明的aav的方法,该方法包括将含有或其基本组成为编码aav的一种或多种核酸分子的一种或多种质粒转染到感染aav的细胞中,并且提供对于aav的复制和包装必须的aavrep和/或cap。在一些实施例中,对于aav的复制和包装必须的aavrep和/或cap是通过用一种或多种辅助质粒或一种或多种辅助病毒转染这些细胞而提供的。在一些实施例中,该辅助病毒是痘病毒、腺病毒、疱疹病毒或杆状病毒。在一些实施例中,该痘病毒是牛痘病毒。在一些实施例中,这些细胞是哺乳动物细胞。并且在一些实施例中,这些细胞是昆虫细胞,并且该辅助病毒是杆状病毒。在其他实施例中,该病毒是慢病毒。在植物中,病原体常常是宿主特异性的。例如,番茄尖镰孢菌番茄专化型(fusariumoxysporumf.sp.lycopersici)引起番茄枯萎病,而且只攻击番茄,并且香石竹尖镰孢禾柄锈菌小麦专化型(f.oxysporumf.dianthiipucciniagraminisf.sp.tritici)只攻击小麦。植物具有抵抗大多数病原体的现有的和诱导性的防御。跨植物代的突变和重组事件导致产生敏感性的遗传变异性,特别是当病原体以比植物更高的频率繁殖时。在植物中可以存在非宿主抗性,例如,该宿主和病原体是不相容的。还可以存在水平抗性,例如典型地由许多基因控制的针对所有种的病原体的部分抗性,以及垂直抗性,例如典型地由很少的基因控制的针对病原体的某些种而不是其他种的完全抗性。在基因对基因水平中,植物和病原体一起演化,并且在一者中的遗传变化使在另一者中的变化平衡。因此,使用自然变异,育种者针对产率、质量、均匀性、耐性、抗性将最有用的基因进行结合。抗性基因的来源包括天然或外来品种、传家宝品种(heirloomvarieties)、近缘野生植物、以及诱导的突变,例如用诱变剂处理植物材料。利用本发明,向植物育种者提供了一种新的诱导突变的工具。因此,本领域的技术人员可以分析抗性基因的来源的基因组,并且在具有所希望的特征或性状的品种方面,采用本发明来诱导抗性基因的发生,这样具有比先前的诱变剂更好的精确性,并且因此加速并改良植物育种计划。本发明进一步包括本发明的组合物或其crispr酶(包括或可替代地是编码crispr酶的mrna),其用于在医学或治疗中使用。在一些实施例中,本发明包括根据本发明的组合物或其crispr酶(包括或可替代地是编码crispr酶的mrna),其用于在根据本发明的方法中使用。在一些实施例中,本发明提供了本发明的组合物或其crispr酶(包括或可替代地是编码crispr酶的mrna)在离体基因或基因组编辑中的用途。在某些实施例中,本发明包括本发明的组合物或其crispr酶(包括或可替代地是编码crispr酶的mrna)在用于离体基因或基因组编辑中或在根据本发明的方法中使用的药剂的制造中的用途。在一些实施例中,本发明包括本发明的组合物或其crispr酶(包括或可替代地是编码crispr酶的mrna),其中该靶序列在其3’端的侧翼为pam(原型间隔子邻近基序)序列,该pam序列包含5’-基序,尤其是在cas9是(或衍生自)化脓链球菌或金黄色葡萄球菌cas9的情况下。例如,适合的pam是分别针对spcas9或sacas9酶(或衍生的酶)的5'-nrg或5'-nngrr(其中n是任何核苷酸),如下文提及的。应当理解的是,spcas9或sacas9是来自或衍生自化脓链球菌或金黄色葡萄球菌cas9的那些。本发明的方面包括提高crispr酶例如cas9介导的基因靶向的特异性,以及降低经由crispr酶例如cas9的脱靶修饰的可能性。在一些实施例中,本发明包括通过借助于操纵在细胞中的感兴趣基因组座位中的dna双链体的相对链上的第一和第二靶序列而将脱靶修饰降低到最低限度来修饰一种生物或非人类生物的方法,该方法包括递送一种非天然存在的或工程化的组合物,该组合物包含:i.一种第一crispr-cas系统嵌合rna(chirna)多核苷酸序列,其中该第一多核苷酸序列包含:(a)一个第一指导序列,该第一指导序列能够杂交到该第一靶序列上,(b)一个第一tracr配对序列,和(c)一个第一tracr序列,ii.一种第二crispr-cas系统chirna多核苷酸序列,其中该第二多核苷酸序列包含:(a)一个第二指导序列,该第二指导序列能够杂交到该第二靶序列上,(b)一个第二tracr配对序列,和(c)一个第二tracr序列,以及iii.一种对包含至少一个或多个核定位序列并且包含一个或多个突变的crispr酶进行编码的多核苷酸序列,其中(a)、(b)和(c)以5’到3’方向排列,其中在转录时,该第一和第二tracr配对序列分别杂交到该第一和第二tracr序列上,并且该第一和第二指导序列分别指导第一和第二crispr复合物与该第一和第二靶序列的序列特异性结合,其中该第一crispr复合物包含与(1)杂交到该第一靶序列上的第一指导序列、和(2)杂交到该第一tracr序列上的第一tracr配对序列复合的crispr酶,其中该第二crispr复合物包含与(1)杂交到该第二靶序列上的第二指导序列、和(2)杂交到该第二tracr序列上的第二tracr配对序列复合的crispr酶,其中编码crispr酶的多核苷酸序列是dna或rna,并且其中该第一指导序列指导邻近该第一靶序列的dna双链体的一条链的切割,并且该第二指导序列指导邻近该第二靶序列的另一条链的切割,从而诱导双链的断裂,由此通过将脱靶修饰降低到最低限度而修饰该生物或非人类生物。在本发明的一些方法中,编码crispr酶的多核苷酸序列、该第一和第二指导序列、该第一和第二tracr配对序列或该第一和第二tracr序列中的任一者或全部是rna。在本发明另外的实施例中,编码crispr酶的编码序列的多核苷酸、该第一和第二指导序列、该第一和第二tracr配对序列或该第一和第二tracr序列是rna,并且是经由脂质体、纳米粒子、外泌体、微囊泡、或基因枪递送的。在本发明的某些实施例中,该第一和第二tracr配对序列共享100%的一致性和/或该第一和第二tracr序列共享100%的一致性。在一些实施例中,这些多核苷酸可以被包含在含有一种或多种载体的载体系统中。在本发明的优选实施例中,该crispr酶是一种cas9酶,例如spcas9。在本发明的一个方面,该crispr酶包含在催化结构域中的一个或多个突变,其中该一个或多个突变选自下组,该组由以下各项组成:d10a、e762a、h840a、n854a、n863a和d986a。在一个高度优选的实施例中,该crispr酶具有d10a突变。在优选的实施例中,该第一crispr酶具有一个或多个突变,使得该酶是一种互补链切口酶,并且该第二crispr酶具有一个或多个突变,使得该酶是一种非互补链切口酶。可替代地,该第一酶可以是一种非互补链切口酶,而该第二酶可以是一种互补链切口酶。在本发明的优选方法中,指导邻近该第一靶序列的dna双链体的一条链的切割的第一指导序列以及指导邻近该第二靶序列的另一条链的切割的第二指导序列导致一个5’突出端。在本发明的实施例中,该5’突出端具有至多200个碱基对、优选至多100个碱基对、或更优选至多50个碱基对。在本发明的实施例中,该5’突出端具有至少26个碱基对、优选至少30个碱基对、或更优选34-50个碱基对。在一些实施例中,本发明包括通过借助于操纵在细胞中的感兴趣基因组座位中的dna双链体的相对链上的第一和第二靶序列而将脱靶修饰降低到最低限度来修饰一种生物或非人类生物的方法,该方法包括递送一种非天然存在的或工程化的组合物,该组合物包含一种载体系统,该载体系统包含一种或多种载体,该一种或多种载体包含i.一种第一调节元件,该第一调节元件可操作地连接至(a)一个第一指导序列,该第一指导序列能够杂交到该第一靶序列上,和(b)至少一个或多个tracr配对序列,ii.一种第二调节元件,该第二调节元件可操作地连接至(a)一个第二指导序列,该第二指导序列能够杂交到该第二靶序列上,和(b)至少一个或多个tracr配对序列,iii.一种第三调节元件,该第三调节元件可操作地连接至编码crispr酶的酶编码序列,以及iv.一个第四调节元件,该第四调节元件可操作地连接至一种tracr序列,其中组分i、ii、iii和iv位于该系统的相同或不同载体上,在转录时,该tracr配对序列杂交到该tracr序列上,并且该第一和第二指导序列分别指导第一和第二crispr复合物与该第一和第二靶序列的序列特异性结合,其中该第一crispr复合物包含与(1)杂交到该第一靶序列上的第一指导序列、和(2)杂交到该tracr序列上的tracr配对序列复合的crispr酶,其中该第二crispr复合物包含与(1)杂交到该第二靶序列上的第二指导序列、和(2)杂交到该tracr序列上的tracr配对序列复合的crispr酶,其中编码crispr酶的多核苷酸序列是dna或rna,并且其中该第一指导序列指导邻近该第一靶序列的dna双链体的一条链的切割,并且该第二指导序列指导邻近该第二靶序列的另一条链的切割,从而诱导双链的断裂,由此通过将脱靶修饰降低到最低限度而修饰该生物或非人类生物。本发明还提供了如本文所述的载体系统。该系统可以包含一个、二个、三个或四个不同的载体。组分i、ii、iii和iv因此可以位于一个、二个、三个或四个不同的载体上,并且本文设想了对于这些组分的可能位置的所有组合,例如:组分i、ii、iii和iv可以位于相同的载体上;组分i、ii、iii和iv可以各自位于不同的载体上;组分i、ii、iii和iv可以位于总共二个或三个不同的载体上,其中设想了所有的位置组合,等等。在本发明的一些方法中,编码crispr酶的多核苷酸序列、该第一和第二指导序列、该第一和第二tracr配对序列或该第一和第二tracr序列中的任一者或全部是rna。在本发明另外的实施例中,该第一和第二tracr配对序列共享100%的一致性和/或该第一和第二tracr序列共享100%的一致性。在本发明的优选实施例中,该crispr酶是一种cas9酶,例如spcas9。在本发明的一个方面,该crispr酶包含在催化结构域中的一个或多个突变,其中该一个或多个突变选自下组,该组由以下各项组成:d10a、e762a、h840a、n854a、n863a和d986a。在一个高度优选的实施例中,该crispr酶具有d10a突变。在优选的实施例中,该第一crispr酶具有一个或多个突变,使得该酶是一种互补链切口酶,并且该第二crispr酶具有一个或多个突变,使得该酶是一种非互补链切口酶。可替代地,该第一酶可以是一种非互补链切口酶,而该第二酶可以是一种互补链切口酶。在本发明的一个另外的实施例中,这些病毒载体的一种或多种可以经由脂质体、纳米粒子、外泌体、微囊泡、或基因枪进行递送。在本发明的优选方法中,指导邻近该第一靶序列的dna双链体的一条链的切割的第一指导序列以及指导邻近该第二靶序列的另一条链的切割的第二指导序列产生一个5’突出端。在本发明的实施例中,该5’突出端具有至多200个碱基对、优选至多100个碱基对、或更优选至多50个碱基对。在本发明的实施例中,该5’突出端具有至少26个碱基对、优选至少30个碱基对、或更优选34-50个碱基对。在一些实施例中,本发明包括一种通过借助于向含有和表达编码感兴趣的基因产物的双链dna分子的细胞中引入一种工程化的、非天然存在的crispr-cas系统将脱靶修饰降低至最低限度而修饰感兴趣的基因组的方法,该crispr-cas系统包含具有一个或多个突变的cas蛋白和两个分别靶向该dna分子的第一链和第二链的指导rna,由此这些指导rna靶向编码该基因产物的dna分子,并且该cas蛋白使编码该基因产物的dna分子的第一链和第二链的每一者产生切口,由此改变该基因产物的表达;并且,其中该cas蛋白和这两个指导rna并不一起天然存在。在本发明的优选方法中,该cas蛋白使编码该基因产物的dna分子的第一链和第二链的每一者产生切口导致一个5’突出端。在本发明的实施例中,该5’突出端具有至多200个碱基对、优选至多100个碱基对、或更优选至多50个碱基对。在本发明的实施例中,该5’突出端具有至少26个碱基对、优选至少30个碱基对、或更优选34-50个碱基对。本发明的实施例还包括包含融合到tracr配对序列和tracr序列上的指导序列的指导rna。在本发明的一个方面,该cas蛋白经密码子优化以便在真核细胞,优选哺乳动物细胞或人类细胞中中表达。在本发明另外的实施例中,该cas蛋白是一种ii型crispr-cas蛋白,例如一种cas9蛋白。在一个高度优选的实施例中,该cas蛋白是一种cas9蛋白,例如spcas9。在本发明的方面中,该cas蛋白具有一个或多个选自下组的突变,该组由以下各项组成:d10a、e762a、h840a、n854a、n863a和d986a。在一个高度优选的实施例中,该cas蛋白具有d10a突变。本发明的方面涉及被减少的基因产物或被进一步引入到编码基因产物的dna分子中的模板多核苷酸或通过允许两个5’突出端重新退火并连接而被精确切断的间插序列的表达、或被改变的基因产物的活性或功能、或被增加的基因产物的表达。在本发明的一个实施例中,该基因产物是一种蛋白质。本发明还包括一种工程化的、非天然存在的crispr-cas系统,该系统包含具有一个或多个突变的cas蛋白和两个分别靶向在细胞中编码基因产物的双链dna分子的第一链和第二链的指导rna,由此这些指导rna靶向编码该基因产物的dna分子,并且该cas蛋白使编码该基因产物的dna分子的第一链和第二链的每一者产生切口,由此改变该基因产物的表达;并且,其中该cas蛋白和这两个指导rna并不一起天然存在。在本发明的方面中,这些指导rna可包含融合到tracr配对序列和tracr序列上的指导序列。在本发明的一个实施例中,该cas蛋白是一种ii型crispr-cas蛋白。在本发明的一个方面,该cas蛋白经密码子优化以便在真核细胞,优选哺乳动物细胞或人类细胞中中表达。在本发明另外的实施例中,该cas蛋白是一种ii型crispr-cas蛋白,例如一种cas9蛋白。在一个高度优选的实施例中,该cas蛋白是一种cas9蛋白,例如spcas9。在本发明的方面中,该cas蛋白具有一个或多个选自下组的突变,该组由以下各项组成:d10a、e762a、h840a、n854a、n863a和d986a。在一个高度优选的实施例中,该cas蛋白具有d10a突变。本发明的方面涉及被减少的基因产物或被进一步引入到编码基因产物的dna分子中的模板多核苷酸或通过允许两个5’突出端重新退火并连接而被精确切断的间插序列的表达、或被改变的基因产物的活性或功能、或被增加的基因产物的表达。在本发明的一个实施例中,该基因产物是一种蛋白质。本发明还包括包含一种或多种载体的工程化的、非天然存在的载体系统,所述载体包含:a)一种第一调节元件,该第一调节元件可操作地连接到两个crispr-cas系统指导rna的每一者上,这两个指导rna分别靶向编码基因产物的双链dna分子的第一链和第二链,b)一种第二调节元件,该第二调节元件可操作地连接至cas蛋白,其中组分(a)和(b)位于该系统的相同或不同载体上,由此这些指导rna靶向编码该基因产物的dna分子,并且该cas蛋白使编码该基因产物的dna分子的第一链和第二链的每一者产生切口,由此改变该基因产物的表达;并且,其中该cas蛋白和这两个指导rna并不一起天然存在。在本发明的方面中,这些指导rna可包含融合到tracr配对序列和tracr序列上的指导序列。在本发明的一个实施例中,该cas蛋白是一种ii型crispr-cas蛋白。在本发明的一个方面,该cas蛋白经密码子优化以便在真核细胞,优选哺乳动物细胞或人类细胞中表达。在本发明另外的实施例中,该cas蛋白是一种ii型crispr-cas蛋白,例如一种cas9蛋白。在一个高度优选的实施例中,该cas蛋白是一种cas9蛋白,例如spcas9。在本发明的方面中,该cas蛋白具有一个或多个选自下组的突变,该组由以下各项组成:d10a、e762a、h840a、n854a、n863a和d986a。在一个高度优选的实施例中,该cas蛋白具有d10a突变。本发明的方面涉及被减少的基因产物或被进一步引入到编码基因产物的dna分子中的模板多核苷酸或通过允许两个5’突出端重新退火并连接而被精确切断的间插序列的表达、或被改变的基因产物的活性或功能、或被增加的基因产物的表达。在本发明的一个实施例中,该基因产物是一种蛋白质。在本发明的优选实施例中,该系统的这些载体是病毒载体。一个另外的实施例中,该系统的这些载体经由脂质体、纳米粒子、外泌体、微囊泡、或基因枪进行递送。在一个方面,本发明提供了修饰在一种真核细胞中的靶多核苷酸的方法。在一些实施例中,该方法包括允许一种crispr复合物结合到该靶多核苷酸上以实施所述靶多核苷酸的切割,由此修饰该靶多核苷酸,其中该crispr复合物包括与杂交到在所述靶多核苷酸内的一个靶序列上的指导序列复合的crispr酶,其中所述指导序列连接到一种tracr配对序列上,该tracr配对序列进而杂交到一种tracr序列上。在一些实施例中,所述切割包括通过所述crispr酶切割在该靶序列位置的一条或两条链。在一些实施例中,所述切割导致靶基因的转录降低。在一些实施例中,该方法进一步包括通过与外源模板多核苷酸同源重组修复所述切割的靶多核苷酸,其中所述修复导致一种突变,包括所述靶多核苷酸的一个或多个核苷酸的插入、缺失、或取代。在一些实施例中,所述突变导致在从包含该靶序列的基因表达的蛋白质中的一个或多个氨基酸改变。在一些实施例中,该方法进一步包括将一种或多种载体递送到所述真核细胞,其中该一种或多种载体驱动下列一者或多者的表达:该crispr酶、连接到该tracr配对序列上的指导序列、以及该tracr序列。在一些实施例中,所述载体被递送到受试者内的真核细胞中。在一些实施例中,所述修饰发生在细胞培养物中的所述真核细胞中。在一些实施例中,该方法进一步包括在所述修饰之前从受试者中分离所述真核细胞。在一些实施例中,该方法进一步包括使所述真核细胞和/或从中衍生的细胞返回到所述受试者中。在一个方面,本发明提供了修饰一种多核苷酸在真核细胞中的表达的方法。在一些实施例中,该方法包括允许一种crispr复合物结合到该多核苷酸上,这样使得所述结合导致所述多核苷酸的表达增加或降低;其中该crispr复合物包括与杂交到在所述多核苷酸内的一个靶序列上的指导序列复合的crispr酶,其中所述指导序列连接到一种tracr配对序列上,该tracr配对序列进而杂交到一种tracr序列上。在一些实施例中,该方法进一步包括将一种或多种载体递送到所述真核细胞,其中该一种或多种载体驱动下列一者或多者的表达:该crispr酶、连接到该tracr配对序列上的指导序列、以及该tracr序列。在一个方面,本发明提供了一种产生包含突变的疾病基因的模式真核细胞的方法。在一些实施例中,疾病基因是与患有或产生一种疾病的风险的增加相关联的任何基因。在一些实施例中,该方法包括(a)将一种或多种载体引入真核细胞中,其中该一种或多种载体驱动下列一者或多者的表达:crispr酶、连接到tracr配对序列上的指导序列、以及tracr序列;以及(b)允许一种crispr复合物结合到一个靶多核苷酸上以实施在所述疾病基因内的该靶多核苷酸的切割,其中该crispr复合物包含与(1)杂交到该靶多核苷酸内的该靶序列上的指导序列、和(2)杂交到该tracr上的该tracr配对序列复合的crispr酶,由此产生包含突变的疾病基因的模式真核细胞。在一些实施例中,所述切割包括通过所述crispr酶切割在该靶序列位置的一条或两条链。在一些实施例中,所述切割导致靶基因的转录降低。在一些实施例中,该方法进一步包括通过与外源模板多核苷酸同源重组修复所述切割的靶多核苷酸,其中所述修复导致一种突变,包括所述靶多核苷酸的一个或多个核苷酸的插入、缺失、或取代。在一些实施例中,所述突变导致在从包含该靶序列的基因表达的蛋白质中的一个或多个氨基酸改变。在一个方面,本发明提供了一种通过在一个或多个原核细胞中的基因中引入一个或多个突变来选择一个或多个原核细胞的方法,该方法包括:将一种或多种载体引入一种或多种原核细胞中,其中该一种或多种载体驱动下列一者或多者的表达:crispr酶、连接到tracr配对序列上的指导序列、tracr序列、以及编辑模板;其中该编辑模板包含消除crispr酶切割的一个或多个突变;允许该编辑模板与在有待选择的一个或多个细胞中的靶多核苷酸同源重组;允许crispr复合物结合到靶多核苷酸上以实施在所述基因内的靶多核苷酸的切割,其中该crispr复合物包含与(1)杂交到该靶多核苷酸内的靶序列上的指导序列、和(2)杂交到该tracr序列上的tracr配对序列复合的crispr酶,其中该crispr复合物到该靶多核苷酸上的结合诱导细胞死亡,由此允许选择其中已经引入一个或多个突变的一个或多个原核细胞。在一个优选的实施例中,该crispr酶是cas9。在本发明的另一方面,该有待选择的细胞可以是真核细胞。本发明的方面允许选择特异细胞,而不需要选择标记或可能包括反选择系统的两步法。在一个方面,本发明提供了用于修饰在一种真核细胞中的靶多核苷酸的方法。在一些实施例中,该方法包括允许一种crispr复合物结合到该靶多核苷酸上以实施所述靶多核苷酸的切割,由此修饰该靶多核苷酸,其中该crispr复合物包括与杂交到在所述靶多核苷酸内的一个靶序列上的指导序列复合的crispr酶,其中所述指导序列连接到一种tracr配对序列上,该tracr配对序列进而杂交到一种tracr序列上。在其他实施例中,本发明提供了一种修饰多核苷酸在真核细胞中的表达的方法。该方法包括通过使用结合到多核苷酸上的crispr复合物增加或降低靶多核苷酸的表达。在希望的情况下,为了实施在细胞中的表达的修饰,将包含tracr序列、连接到该tracr配对序列上的指导序列、编码crispr酶的序列的一种或多种载体递送到细胞。在一些方法中,该一种或多种载体包含可操作地连接到编码所述crispr酶的酶编码序列上的一种调节元件,所述crispr酶包含核定位序列;和可操作地连接到tracr配对序列的一种调节元件以及用于在该tracr配对序列的上游插入一种指导序列的一个或多个插入位点。当表达时,该指导序列指导crispr复合物与细胞中的一个靶序列的序列特异性结合。典型地,该crispr复合物包含与(1)杂交到该靶序列上的指导序列、和(2)杂交到该tracr序列上的tracr配对序列复合的crispr酶。在一些方法中,可以使靶多核苷酸失活以实施细胞中的表达的修饰。例如,当crispr复合物结合到细胞中的一个靶序列上时,该靶多核苷酸失活,这样使得该序列不被转录,该编码蛋白不被产生,或者该序列不会像野生型序列一样起作用。例如,可以使蛋白质或微小rna编码序列失活,这样使得该蛋白质不被产生。在某些实施例中,该crispr酶包含一个或多个选自下组的突变,该组由以下各项组成:d10a、e762a、h840a、n854a、n863a或d986a和/或该一个或多个突变在该crispr酶的ruvc1或hnh结构域中或者为如本文另外论述的突变。在一些实施例中,该crispr酶具有一个或多个在催化结构域中的突变,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列指导crispr复合物与该靶序列的序列特异性结合,并且其中该酶进一步包含一个功能结构域。在一些实施例中,该功能结构域是一个转录激活结构域,优选vp64。在一些实施例中,该功能结构域一个转录阻抑结构域,优选krab。在一些实施例中,该转录阻抑结构域是sid、或sid的多联体(例如sid4x)。在一些实施例中,该功能结构域是一个表观遗传修饰结构域,从而提供了一种表观遗传修饰酶。在一些实施例中,该功能结构域是一种激活结构域,其可以是p65激活结构域。在一些实施例中,该crispr酶是i型或iii型crispr酶,但是优选ii型crispr酶。这种ii型crispr酶可以是任何cas酶。一种cas酶可以被鉴定为cas9,因为这可以是指与来自ii型crispr系统的具有多个核酸酶结构域的最大核酸酶共享同源性的酶的通用类别。最优选地,该cas9酶来自或衍生自spcas9或sacas9。关于衍生,申请人意指该衍生的酶在很大程度上是基于与野生型酶具有高度序列同源性的含义,但是如本文所述它在某些方面已经被突变(修饰)。应当理解的是,术语cas和crispr酶在本文中通常可互换地使用,除非另外说明。如上提及的,在本文中使用的许多残基编号是指来自化脓链球菌中的ii型crispr座位的cas9酶。然而,应当理解的是,本发明包括更多的来自其他微生物物种的cas9s,如spcas9、saca9、st1cas9等等。本文中提供了在这种情形下针对人类进行优化(即,针对在人类中表达进行优化)的密码子优化序列的实例,参见sacas9人类密码子优化序列。在这被优化的同时,应当理解其他实例是可能的并且针对宿主物种的密码子优化是已知的。优选地,递送是以载体形式进行的,该载体可以是病毒载体,如慢病毒或杆状病毒或优选地腺病毒/腺病毒相关病毒载体,但是其他递送手段也是已知的(如酵母系统、微囊泡、基因枪/将载体附接到金纳米粒子上的手段)并且被提供。一种载体可能不仅是指病毒或酵母系统(例如,在感兴趣的核酸可被可操作地连接到一个启动子上并且在其控制下(就表达而言,从而最终提供加工的rna)的情况下),而且指导核酸递送到宿主细胞中。虽然在本文的方法中该载体可以是病毒载体并且aav在这里是有利的,但是可以采用如本文论述的其他病毒载体,如慢病毒。例如,杆状病毒可以用于昆虫细胞中的表达。这些昆虫细胞进而可用于产生大量的其他载体,如适合于本发明递送的aav或慢病毒载体。还设想了一种递送本发明crispr酶的方法,该方法包括向细胞递送编码该crispr酶的mrna。应当理解的是,在某些实施例中,该crispr酶被截短,和/或由少于一千个氨基酸或少于四千个氨基酸组成,和/或是一种核酸酶或切口酶,和/或是经密码子优化的,和/或包含一个或多个突变,和/或包含嵌合crispr酶,和/或如本文论述的其他选项。aav和慢病毒载体是优选的。在某些实施例中,该靶序列在其3’端的侧翼或下游为适合于crispr酶(典型地cas,并且尤其是cas9)的pam。例如,适合的pam是分别针对spcas9或sacas9酶(或衍生的酶)的5'-nrg或5'-nngrr。应当理解的是,spcas9或sacas9是来自或衍生自化脓链球菌或金黄色葡萄球菌cas9的那些。因此,本发明的目的在于,在本发明中不涵盖任何先前已知的产品、制造该产品的过程、或使用该产品的方法,使得申请人保留和特此公开放弃任何先前已知的产品、过程、或方法的权利。进一步指出的是,在本发明的范围之内,本发明并不旨在涵盖任何产品、过程、或该产品的制造或使用该产品的方法,其不符合uspto(35u.s.c.§112,第一段)或epo(epc的第83条)的书面说明和可实施性要求,使得申请人保留和特此公开放弃任何先前描述的产品、制造该产品的过程、或使用该产品的方法的权利。应当指出的是,在本披露中尤其是在权利要求书和/或段落中,术语如“包含(comprises)”、“包含(comprised)”、“包含(comprising)”等等可具有在美国专利法中属于它的含义;例如,它们可以表示“包括(includes)”、“包括(included)”、“包括(including)”等等;并且这些术语如“基本上由……组成(consistingessentiallyof)”和“基本上由……组成(consistsessentiallyof)”具有在美国专利法中归于它们的含义,例如,它们允许未被清楚叙述的要素,但是排除在现有技术中发现或者影响本发明的基本或新颖特征的要素。这些和其他实施例披露于以下详细说明中,或者据其显而易见并且由其涵盖。本发明还涉及以下项目:1.一种通过操纵在感兴趣的基因组座位中的靶序列来修饰一种生物或非人类生物的方法,该方法包括递送一种非天然存在的或工程化的组合物,该组合物包含:a)-i.一种crispr-cas系统嵌合rna(chirna)多核苷酸序列,其中该多核苷酸序列包含:(a)一种指导序列,该指导序列能够杂交到真核细胞中的靶序列上,(b)一种tracr配对序列,和(c)一种tracr序列,以及ii.一种编码crispr酶的多核苷酸序列,该crispr酶任选地包含至少一个或多个核定位序列,其中(a)、(b)和(c)以5’到3’方向排列,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列引导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的该指导序列、和(2)杂交到该tracr序列上的该tracr配对序列复合的crispr酶,并且该编码crispr酶的多核苷酸序列是dna或rna,或者(b)i.多核苷酸,其包含:(a)一种指导序列,该指导序列能够杂交到真核细胞中的靶序列上,和(b)至少一个或多个tracr配对序列,ii.一种编码crispr酶的多核苷酸序列,以及iii.一种包含tracr序列的多核苷酸序列,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列引导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的该指导序列、和(2)杂交到该tracr序列上的该tracr配对序列复合的crispr酶,并且该编码crispr酶的多核苷酸序列是dna或rna。2.如项目1所述的方法,其中该编码crispr酶的多核苷酸序列、指导序列、tracr配对序列或tracr序列的任一者或全部可以是rna。3.如项目1或2所述的方法,其中对该编码crispr酶的序列、该指导序列、tracr配对序列或tracr序列进行编码的多核苷酸可以是rna并且可以经由脂质体、纳米粒子、外泌体、微囊泡、或基因枪进行递送。4.如项目1到3中任一项所述的方法,其中这些多核苷酸被包含在含有一种或多种载体的载体系统中。5.一种通过操纵在感兴趣的基因组座位中的靶序列来修饰一种生物或非人类生物的方法,该方法包括递送一种包含病毒载体系统的非天然存在的或工程化的组合物,该病毒载体系统包含一种或多种病毒载体,该一种或多种病毒载体可操作地编码一种用于其表达的组合物,其中该非天然存在的或工程化的组合物包括:(a)一种非天然存在的或工程化的组合物,该组合物包含一种载体系统,该载体系统包含一种或多种载体,该一种或多种载体包含i.一种第一调节元件,该第一调节元件可操作地连接到一种crispr-cas系统嵌合rna(chirna)多核苷酸序列上,其中该多核苷酸序列包含(a)一种指导序列,该指导序列能够杂交到真核细胞中的靶序列上,(b)一种tracr配对序列,和(c)一种tracr序列,以及ii.一种第二调节元件,该第二调节元件可操作地连接到编码crispr酶的酶编码序列上,该crispr酶任选地包含至少一个或多个核定位序列,其中(a)、(b)和(c)以5’到3’方向排列,其中组分i和ii位于该系统的相同或不同载体上,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列引导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的该指导序列、和(2)杂交到该tracr序列上的该tracr配对序列复合的crispr酶,或者(b)一种非天然存在的或工程化的组合物,该组合物包含一种载体系统,该载体系统包含一种或多种载体,该一种或多种载体包含i.一种第一调节元件,该第一调节元件可操作地连接至(a)一种指导序列,该指导序列能够杂交到真核细胞中的靶序列上,和(b)至少一个或多个tracr配对序列,ii.一种第二调节元件,该第二调节元件可操作地连接至编码crispr酶的酶编码序列,以及iii.一种第三调节元件,该第三调节元件可操作地连接至一种tracr序列,其中组分i、ii和iii位于该系统的相同或不同载体上,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列引导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的该指导序列、和(2)杂交到该tracr序列上的该tracr配对序列复合的crispr酶。6.如项目5所述的方法,其中这些病毒载体的一种或多种可以经由脂质体、纳米粒子、外泌体、微囊泡、或基因枪进行递送。7.一种在对其有需要的受试者或非人类受试者中治疗或抑制由感兴趣基因组座位内的靶序列的缺陷引起的病症的方法,该方法包括通过操纵该靶序列来修饰该受试者或非人类受试者,并且其中该病症对于通过操纵该靶序列的治疗或抑制是敏感的,该方法包括提供包括以下项的治疗:递送一种包含aav或慢病毒载体系统的非天然存在的或工程化的组合物,该载体系统包含一种或多种aav或慢病毒载体,该一种或多种aav或慢病毒载体可操作地编码用于其表达的组合物,其中在表达时该靶序列由该非天然存在的或工程化的组合物操纵,其中该非天然存在的或工程化的组合物包括:(a)一种非天然存在的或工程化的组合物,该组合物包含一种载体系统,该载体系统包含一种或多种载体,该一种或多种载体包含i.一种第一调节元件,该第一调节元件可操作地连接到一种crispr-cas系统嵌合rna(chirna)多核苷酸序列上,其中该多核苷酸序列包含(a)一种指导序列,该指导序列能够杂交到真核细胞中的靶序列上,(b)一种tracr配对序列,和(c)一种tracr序列,以及ii.一种第二调节元件,该第二调节元件可操作地连接到编码crispr酶的酶编码序列上,该crispr酶包含至少一个或多个核定位序列,其中(a)、(b)和(c)以5’到3’方向排列,其中组分i和ii位于该系统的相同或不同载体上,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列引导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的该指导序列、和(2)杂交到该tracr序列上的该tracr配对序列复合的crispr酶,或者(b)一种非天然存在的或工程化的组合物,该组合物包含一种载体系统,该载体系统包含一种或多种载体,该一种或多种载体包含i.一种第一调节元件,该第一调节元件可操作地连接至(a)一种指导序列,该指导序列能够杂交到真核细胞中的靶序列上,和(b)至少一个或多个tracr配对序列,ii.一种第二调节元件,该第二调节元件可操作地连接至编码crispr酶的酶编码序列,以及iii.一种第三调节元件,该第三调节元件可操作地连接至一种tracr序列,其中组分i、ii和iii位于该系统的相同或不同载体上,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列引导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的该指导序列、和(2)杂交到该tracr序列上的该tracr配对序列复合的crispr酶。8.如以上项目中任一项所述的方法,其中该方法是在体外、和/或离体地进行的。9.如以上项目中任一项所述的方法,包括诱导表达。10.如以上项目中任一项所述的方法,其中该生物或受试者是一种真核生物。11.如项目10所述的方法,其中该生物或受试者是一种非人类真核生物。12.如项目1到11中任一项所述的方法,其中该生物或受试者是一种哺乳动物或非人类哺乳动物。13.如项目4到8中任一项所述的方法,其中该病毒载体是一种aav或慢病毒载体。14.根据以上项目中任一项所述的方法,其中该crispr酶是一种cas9。15.根据以上项目中任一项所述的方法,其中该指导序列的表达是在t7启动子控制下并且是由t7聚合酶的表达驱动的。16.一种递送如以上项目中任一项所述的crispr酶的方法,该方法包括向一种细胞递送编码该crispr酶的mrna。17.如项目1到16中任一项所述的方法,其中通过将编码该crispr酶的mrna递送到该细胞而将编码该crispr酶的该多核苷酸或酶编码序列递送至该细胞。18.一种制备如项目7所述的aav或慢病毒载体的方法,该方法包括将含有编码该aav或慢病毒的一种或多种核酸分子或基本上由该一种或多种核酸分子组成的一种或多种质粒转染到aav感染的或慢病毒感染的细胞中,并且提供对于该aav或慢病毒的复制和包装必须的aavaav或慢病毒rep和/或cap和/或辅助核酸分子。19.一种制备用于在项目7所述的方法中使用的aav或慢病毒载体的方法,该方法包括将含有编码该aav或慢病毒的一种或多种核酸分子或基本上由该一种或多种核酸分子组成的一种或多种质粒转染到aav感染的或慢病毒感染的细胞中,并且提供对于该aav或慢病毒的复制和包装必须的aavaav或慢病毒rep和/或cap和/或辅助核酸分子。20.如项目18或19所述的方法,其中对于该aav或慢病毒的复制和包装必须的aav或慢病毒rep和/或cap是通过用一种或多种辅助质粒或一种或多种辅助病毒转染这些细胞而提供的。21.如项目20所述的方法,其中该辅助病毒是一种痘病毒、腺病毒、慢病毒、疱疹病毒或杆状病毒。22.如项目21所述的方法,其中该痘病毒是牛痘病毒。23.如项目18到22中任一项所述的方法,其中这些细胞是哺乳动物细胞。24.如项目18到22中任一项所述的方法,其中这些细胞是昆虫细胞并且该辅助病毒(如果存在的话)是杆状病毒。25.如项目1到15中任一项所述的方法,其中该靶序列在其3’端的侧翼为或在其之后为5’-nrg(其中n是任何核苷酸)、或者其中该crispr酶是(或来源于)属于下组的属,该组由以下各项组成:棒状杆菌属、萨特氏菌属、军团杆菌属、密螺旋体属、产线菌属、优杆菌属、链球菌属、乳杆菌属、支原体属、拟杆菌属、flaviivola、黄杆菌属、sphaerochaeta、固氮螺菌属、葡糖醋杆菌属、奈瑟菌属、罗氏菌属、细小棒菌属(parvibaculum)、葡萄球菌属、nitratifractor、支原体属以及弯曲杆菌属。26.一种如项目1-25中任一项中定义的组合物,用于在医药中或在疗法中使用。27.一种如项目1-25中任一项定义的组合物,用于在一种通过操纵感兴趣的基因组座位中的靶序列来修饰生物或非人类生物的方法中使用、或者在一种治疗或抑制由感兴趣基因组座位中的靶序列的缺陷引起的病症的方法中使用。28.如项目1-25中任一项中定义的组合物在离体基因或基因组编辑中的用途。29.一种如项目1-25中任一项中定义的组合物在制造用于离体基因或基因组编辑的药剂中、或用于在一种通过操纵感兴趣的基因组座位中的靶序列来修饰生物或非人类生物的方法中使用、或者在一种治疗或抑制由感兴趣基因组座位中的靶序列的缺陷引起的病症的方法中使用的用途。30.一种组合物,其包含:a)-i.一种crispr-cas系统嵌合rna(chirna)多核苷酸序列,其中该多核苷酸序列包含:(a)一种指导序列,该指导序列能够杂交到真核细胞中的靶序列上,(b)一种tracr配对序列,和(c)一种tracr序列,以及ii.一种编码crispr酶的多核苷酸序列,该crispr酶任选地包含至少一个或多个核定位序列,其中(a)、(b)和(c)以5’到3’方向排列,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列引导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的该指导序列、和(2)杂交到该tracr序列上的该tracr配对序列复合的crispr酶,并且该编码crispr酶的多核苷酸序列是dna或rna,或者(b)i.多核苷酸,其包含:(a)一种指导序列,该指导序列能够杂交到真核细胞中的靶序列上,和(b)至少一个或多个tracr配对序列,ii.一种编码crispr酶的多核苷酸序列,以及iii.一种包含tracr序列的多核苷酸序列,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列引导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的该指导序列、和(2)杂交到该tracr序列上的该tracr配对序列复合的crispr酶,并且该编码crispr酶的多核苷酸序列是dna或rna;用于在医药或疗法中使用;或者用于在一种通过操纵感兴趣的基因组座位中的靶序列来修饰生物或非人类生物的方法中使用;或者用于在一种治疗或抑制由感兴趣基因组座位中的靶序列的缺陷引起的病症的方法中使用;或者用于在离体基因或基因组编辑中使用。31.如项目30所述的组合物,其中这些多核苷酸被包含在含有一种或多种载体的载体系统中。附图简要说明本发明的新颖特征在所附权利要求书中具体提出。通过参考对说明性实施例进行叙述的以下详细说明,将获得对本发明的特征和优点的更好理解,在这些实施例中利用了本发明的原理,并且在这些附图中:图1显示了该crispr系统的示意模型。来自化脓链球菌(黄色)的cas9核酸酶经由合成的指导rna(sgrna)而被靶向基因组dna,该指导rna由20个nt的指导序列(蓝色)和支架(红色)组成。与dna靶(蓝色)的指导序列碱基对,直接地在必要的5’-ngg原型间隔子邻近基序(pam;红紫色)的上游,并且cas9在该pam(红色三角形)的上游约3bp介导了双链断裂(dsb)。图2a-f显示了一个示例性crispr系统、一个可能的作用机制、一个针对在真核细胞中的表达的示例性适应性改变、以及评估核定位和crispr活性的试验的结果。图3a-d显示了针对示例性靶标的spcas9特异性的评估结果。图4a-g显示了一个示例性载体系统以及它在指导真核细胞中的同源重组中的使用结果。图5提供了原型间隔子序列的表,并且总结了基于示例性脓链球菌和嗜热链球菌crispr系统设计的原型间隔子靶标的修饰效率结果,这些crispr系统具有针对人类和小鼠基因组中的座位的相应pam。用cas9以及pre-crrna/tracrrna或嵌合rna转染细胞,在转染72小时之后进行分析。基于来自指示细胞系的检验员(surveyor)分析结果,计算了插入缺失(indel)百分比(对于所有原型间隔子靶标n=3,误差为s.e.m.,n.d.表示使用surveyor测定未检测到,并且n.t.表示在本研究中未检测)。图6a-c显示了对于cas9介导的基因靶向而言的不同tracrrna转录本的比较。图7显示了对于双链断裂诱导的微插入和微缺失的检测的surveyor核酸酶测定的示意图。图8a-b显示了用于crispr系统元件在真核细胞中的表达的示例性双顺反子表达载体。图9a-c显示了在人类基因组中在邻近的化脓链球菌sf370座位1pam(ngg)(图9a)和嗜热链球菌lmd9座位2pam(nnagaaw)(图9b)之间的距离、以及对于每个pam就染色体(chr)而言的距离(图9c)的直方图。图10a-d显示了一个示例性crispr系统、一个针对在真核细胞中的表达的示例性适应性改变、以及评估crispr活性的试验的结果。图11a-c显示了用于靶向哺乳动物细胞中的基因组座位的crispr系统的示例性操纵。图12a-b显示了在哺乳动物中的crrna加工的northern印迹分析的结果。图13a-b显示了在人pvalb和小鼠th座位中的原型间隔子的示例性选择。图14显示了在人emx1座位中的嗜热链球菌crispr系统的示例性原型间隔子和相应pam序列靶标。图15提供了用于surveyor、rflp、基因组测序、以及northern印迹分析的引物和探针序列的表。图16a-c显示了具有嵌合rna的crispr系统的示例性操纵以及在真核细胞中针对系统活性的surveyor分析的结果。图17a-b显示了在真核细胞中的crispr系统活性的surveyor分析的结果的图示。图18显示了使用ucsc基因组浏览器进行的在人类基因组中的一些化脓链球菌cas9靶位点的示例性可视化。图19a-d显示了系统发生分析的环状描绘,该系统发生分析揭示五个cas9家族,这五个家族包括三组大的cas9(约1400个氨基酸)和两组小的cas9(约1100个氨基酸)。图20a-f显示了系统发生分析的线性描绘,该系统发生分析揭示五个cas9家族,这五个家族包括三组大的cas9(约1400个氨基酸)和两组个小的cas9(约1100个氨基酸)。图21a-d显示了经由同源重组的基因组编辑。(a)spcas9切口酶的示意图,具有在ruvci催化结构域中的d10a突变。(b)示意图,表示使用有义或反义单链寡核苷酸作为修复模板在人emx1座位处的同源重组(hr)。以上红色箭头表示sgrna切割位点;用于基因分型的pcr引物(表j和k)表示为右图中的箭头。(c)由hr修饰的区域的序列。d对于野生型(wt)和切口酶(d10a)spcas9-介导的在emx1靶标1座位处的插入缺失而言的surveyor分析(n=3)。箭头指示预期片段大小的位置。图22a-b显示了用于spcas9的单个载体设计。图23显示了代表cas9直向同源物的长度分布的曲线图。图24a-m显示了在突变点位于spcas9基因内的情况下的序列。图25a显示了条件型cas9、rosa26靶向载体图谱。图25b显示了组成型cas9、rosa26靶向载体图谱。图26显示了在组成型和条件型cas9构建体中的重要元件的示意图。图27显示了递送和体内小鼠脑cas9表达数据。图28显示了cas9和嵌合rna到细胞中的rna递送(a)gfp报告基因作为dna或mrna到neuro-2a细胞中的递送。(b)针对作为rna的icam2基因的cas9和嵌合rna的递送导致测试的两个间隔子之一的切割。(c)针对作为rna的f7基因的cas9和嵌合rna的递送导致测试的两个间隔子之一的切割。图29显示dna双链断裂(dsb)修复如何促进基因编辑。在易错非同源末端连接(nhej)途径中,dsb的末端由内源dna修复机构加工并重新连接在一起,可导致在连接位点的随机插入缺失(indel)突变。发生在基因编码区内的插入缺失突变可产生移码和提前终止密码子,导致基因敲除。可替代地,处于质粒或单链寡脱氧核苷酸(ssodn)形式的修复模板可以被提供为利用同源定向修复(hdr)途径,该途径允许高保真和精确编辑。图30a-c显示了在hek和hues9细胞中的hdr的预期结果。(a)具有同源臂的靶向质粒或ssodn(有义或反义)可以用来编辑在靶基因组座位处由cas9(红色三角形)切割的序列。为了分析hdr的效率,我们在靶座位中引入了hindiii位点(红条),用在同源区外部退火的引物进行pcr扩增。用hindiii消化该pcr产物揭示了hdr事件的存在。(b)相对于感兴趣基因组的有义方向或反义方向(s或a)定向的ssodn可以与cas9组合使用,以实现有效的在该靶座位处的hdr介导的编辑。在该修饰(红条)的任一侧面上,推荐40bp、并且优选90bp的最小同源区。(c)使用野生型cas9和cas9切口酶(d10a)两者,显示了在emx1座位中的hdr上的ssodn的作用的实例。每个ssodn含有90bp的同源臂,这些同源臂侧接两个限制性位点的12-bp插入片物。图31a-c显示了囊性纤维化δf508突变的修复策略。图32a-b:a显示了在fxn内含子1中的gaa重复扩展的示意图并且b显示了所采用的使用该crispr/cas系统切除该gaa扩展区的策略的示意图。图33显示了tet1-3和dnmt1、3a和3b座位的有效的spcas9介导的靶向的筛选。通过使用不同的grna,在来自转染的n2a细胞的dna上的surveyor测定证明了有效的dna切割。图34显示了使用aav1/2递送系统中的2载体系统进行的多元基因组靶向策略。tet1-3和dnmt1、3a和3bgrna在u6启动子的控制之下。gfp-kash在人突触蛋白启动子的控制之下。限制性侧面显示了经由亚克隆的简单grna置换策略。显示了侧翼为两个核定位信号(nls)的、ha标记的spcas9。两种载体都以1:1比率通过aav1/2病毒递送到脑中。图35显示了使用surveyor测定进行的多元dnmt靶向载体#1的功能性的验证。用dnmt靶向载体#1(+)和spcas9编码载体共转染n2a细胞,以便检测spcas9介导的dnmt基因家族座位的切割。阴性对照是仅有grna(-)。收获细胞用于dna纯化,并且在转染后48小时进行下游加工。图36显示了使用surveyor测定进行的多元dnmt靶向载体#2的功能性的验证。用dnmt靶向载体#1(+)和spcas9编码载体共转染n2a细胞,以便检测spcas9介导的dnmt基因家族座位的切割。阴性对照是仅有grna(-)。收获细胞用于dna纯化,并且在转染后48小时进行下游加工。图37显示了用于体内ha-spcas9表达的短启动子和短polya版本的示意性概述。从l-itr到r-itr的编码区的大小显示在右边。图38显示了用于体内ha-sacas9表达的短启动子和短polya版本的示意性概述。从l-itr到r-itr的编码区的大小显示在右边。图39显示了spcas9和sacas9在n2a细胞中的表达。在不同的短启动子的控制之下并且具有短polya(spa)序列的、ha标记的spcas9和sacas9版本的代表性western印迹。微管蛋白是加载对照。mcherry(mch)是一种转染对照。收获细胞并进一步加工,以便在转染后48小时进行western印迹。图40显示了有效的sacas9介导的tet3基因座位的靶向的筛选。通过使用具有nngggtpum序列的不同的grna,在来自转染的n2a细胞的dna上的surveyor测定证明了有效的dna切割。gfp转染的细胞和仅仅表达sacas9的细胞是对照。图41显示了ha-sacas9在小鼠脑中的表达。用在人突触蛋白启动子控制之下驱动ha-sacas9表达的病毒注射到动物的齿状脑回中。在手术后2周将动物处死。使用兔单克隆抗体c29f4(细胞信号传导)检测ha标签。用dapi染料将细胞核染成蓝色。图42显示了spcas9和sacas9在转导后7天的培养物中的皮层初级神经元中的表达。在不同的启动子的控制之下并且具有bgh或短polya(spa)序列的、ha标记的spcas9和sacas9版本的代表性western印迹。微管蛋白是加载对照。图43显示了在用携带具有不同启动子的spcas9和多元grna构建体(显示在dnmt的最后一个小图上的实例)的aav1粒子转导之后7天的初级皮层神经元的live/dead染色。将aav转导之后的神经元与未转导的对照神经元进行比较。红色细胞核指示渗透化处理的死细胞(小图的第二条线)。活细胞标记为绿色(小图的第三条线)。图44显示了用携带具有不同启动子的sacas9的aav1粒子转导之后7天的初级皮层神经元的live/dead染色。红色细胞核指示渗透化处理的死细胞(小图的第二条线)。活细胞标记为绿色(小图的第三条线)。图45显示了在用携带用于tet和dnmt基因座位的spcas9和grna多元体的aav1病毒转导之后的神经元的形态学比较。未转导的神经元作为对照示出。图46显示了在初级皮层神经元中使用surveyor测定进行的多元dnmt靶向载体#1的功能性的验证。用dnmt靶向载体#1和具有不同启动子的spcas9病毒共转导细胞,以便检测spcas9介导的dnmt基因家族座位的切割。图47显示了在脑中spcas9切割的体内效率。用携带多元靶向dnmt家族基因座位的grna的aav1/2病毒连同在2个不同的启动子(小鼠mecp2和大鼠map1b)控制之下的spcas9病毒注射小鼠。在注射两周之后提取脑组织,并且基于由来自grna多元构建体的突触蛋白启动子驱动的gfp表达,使用facs制备和分选细胞核。在gdna提取之后,进行surveyor测定。+指示gfp阳性细胞核,且–为对照,来自相同动物的gfp阴性细胞核。在凝胶上的数字指示评估的spcas9效率。图48显示了gfp-kash标记的、来海马神经元的细胞核的纯化。用gfp与kash蛋白跨膜结构域的融合体标记细胞核膜的外层核膜(onm)。在立体定向手术和aav1/2注射之后一周gfp在脑中强表达。进行密度梯度离心步骤纯化来自完整脑的细胞核。显示了纯化的细胞核。通过dyecycletmruby染色的染色质染色显示为红色,gfp标记的细胞核为绿色。gfp+和gfp-细胞核的代表性facs分布图(红紫色:dyecycletmruby染色,绿色:gfp)。图49显示了在小鼠脑中spcas9切割的效率。用携带多元靶向tet家族基因座位的grna的aav1/2病毒连同在2个不同的启动子(小鼠mecp2和大鼠map1b)控制之下的spcas9病毒注射小鼠。在注射三周之后提取脑组织,基于由来自grna多元构建体的突触蛋白启动子驱动的gfp表达,使用facs制备和分选细胞核。在gdna提取之后,进行surveyor测定。+指示gfp阳性细胞核,–为对照,来自相同动物的gfp阴性细胞核。在凝胶上的数字指示评估的spcas9效率。图50显示了在培养物中的皮层神经元中的gfp-kash表达。用携带靶向tet基因座位的grna多元构建体的aav1病毒转导神经元。由于kash结构域定位,最强信号位于细胞核周围。图51显示了(上)在指导rna对之间的间隔的清单(如由两个pam序列的排列模式指示)。当与spcas9(d10a)切口酶一起使用时,仅有满足模式1、2、3、4的指导rna对展现出插入缺失。(下)凝胶图像显示,spcas9(d10a)与满足模式1、2、3、4的指导rna对的组合导致靶位点中的插入缺失的形成。图52显示了用来产生u6-指导rna表达盒的u6反向引物序列的清单。每个引物需要与u6正向引物“gcactgagggcctatttcccatgattc”配对,以便产生含有u6和所希望的指导rna的扩增子。图53显示了来自人emx1座位的基因组序列图谱,显示了在图33中列出的24个模式的位置。图54显示了(右侧)指示当由不同指导rna对靶向的cas9切口酶切割之后存在可变5’突出端时在靶位点处的插入缺失信息的凝胶图像。(左侧)为指示在右侧凝胶上的泳道数目和不同参数的表,这些参数包括鉴定所使用的指导rna对和在由cas9切口酶切割之后存在的5’突出端的长度。图55显示了来自人emx1座位的基因组序列图谱,其显示了导致图54(右侧)的凝胶模式并且在实例35中进一步描述的不同的指导rna对的位置。图56显示了在注射编码mecp2-ha-spcas9和具有syn-kash-gfp的3xgrna-tets的病毒之后8周在背侧和腹侧海马中的ha-spcas9的染色。图57显示在3xgrna病毒注射之后8周的syn_gfp-kash表达对于神经元是特异性的(neun阳性细胞)而对于神经胶质细胞不是特异性的(gfap阳性)。图58显示了在齿状脑回(腹侧或背侧部分)中crispr介导的、tet和dnmt的kd之后5周进行的行为试验,其显示出焦虑水平的增加和学习缺陷。a)在高架十字迷宫试验期间在开放臂中花费的时间。b)旷场试验,测量了在舞台的中心花费的时间与在角落中的时间。c)新物体识别试验,在熟悉阶段之后3小时测量了结果。d)巴恩斯迷宫;在训练的3天之内找到逃跑路线的效率。e)巴恩斯迷宫结果。f)在场景性恐惧条件化期间的木僵行为。g)在场景性恐惧条件化期间的首次木僵发作的潜伏期。h)对于tetkd和dnmtkd的痕迹恐惧条件化结果(i)。对照–用spcas9病毒和没有grna的gfp-kash构建体注射动物。tet–用spcas9和编码针对tet1、tet2和tet3的grna的构建体两者注射动物。dnmt-用spcas9和编码针对dnmt1、dnmt3a和dnmt3b的grna的构建体两者注射动物。图59显示了在mecp_spcas9病毒注射之后8周与仅仅用mecp2_spcas9病毒注射的对照动物相比较的在脑中的tet座位的切割效率。图60显示了在mecp_spcas9病毒注射之后8周与仅仅用mecp2_spcas9病毒注射的对照动物相比较的在脑中的dnmt座位的切割效率。图61显示了在用编码mecp2_spcas9的病毒和靶向dnmt座位的grna进行脑立体定向注射之后8周在脑中的dnmt3a染色。下部小图显示了在上部小图中指示的roi的放大。图62显示了在注射病毒之后4周在背侧海马中的syn_ha-sacas9的染色。第一栏显示了仅仅用sa-cas9注射的动物,中间栏为用sacas9和针对tet座位的grna两者注射的动物,并且右栏代表仅仅用编码grna的病毒注射的动物。sacas9核定位取决于grna的存在。图63显示了在n2a细胞中的spcas9。a)靶向载体与spcas9表达载体。b)在不同的启动子控制之下表达ha标记的spcas9的n2a细胞的western印迹分析。c)dnmt座位的切割效率。d)证明dnmt3a的有效敲低的western印迹分析。e)tet座位的切割效率。图64显示了在初级神经元中的spcas9。a)在本研究中使用的spcas9克隆策略的示意性概述。用于有效包装到aav递送系统中的短启动子和短polya。b)组合的多元靶向和核包膜标记策略的示意性概述。c)显示在rmap1b和mmecp2启动子以及bgh和spa信号的控制之下的、ha标记的spcas9的表达的western印迹分析。d)证明spcas9和gfp-kash在初级神经元中的共表达的免疫细胞化学。spcas9在mmecp2启动子控制之下在神经元(map1b,neun)中表达但是在星形神经胶质细胞(gfap)中不表达。图65显示了在初级神经元中dnmt3a的敲低。a)证明在用多元靶向载体和mmecp2-spcas9靶向之后dnmt3a的有效敲低的免疫细胞化学。b)在对照和靶向的神经元中的dnmt3a抗体染色的定量。c)证明dnmt3a蛋白水平降低的western印迹分析。d)western印迹分析的定量,证明在混合初级神经元培养物(神经元和星形神经胶质)中大约75%的dnmt3a蛋白水平的总体敲低。图66显示了体内dnmt3a的敲低。a)在mecp_spcas9病毒注射之后8周与仅仅用mecp2_spcas9病毒注射的对照动物相比较的在脑中的dnmt座位的切割效率。b)western印迹分析,显示在使用facs进行细胞核分选之后与对照细胞核(rubydye阳性)相比较在靶向的神经元核(kash-gfp阳性)中dnmt3a蛋白水平降低。图67显示了sacas9在初级神经元中的表达。a)使用人突触蛋白启动子和bgh信号的sacas9表达载体的大小。b)sacas9在初级神经元(neun)中表达但是在星形神经胶质(gfap)中不表达。c)sacas9在grna不存在下的核外定位。c’显示在c)中的sacas9阳性神经元的更高放大倍数。d)sacas9在grna存在下的核定位。d’)显示在d)中的sacas9阳性神经元的更高放大倍数。e)证明ha标记的sacas9和gfp-kash的表达的western印迹分析。f)在aav感染之后1周的dnmt座位切割效率。图68显示了依赖于grna的sacas9的核定位。a)共聚焦成像分析,证明在初级神经元中在grna不存在下sacas9的核外定位。b)sacas9在grna存在下的核定位。c)共聚焦图片a)的线扫描分析,显示在grna不存在下sacas9的核外定位(红色,sacas9信号;蓝色,dapi信号;绿色,gfp-kash信号)。d)共聚焦图片b)的线扫描分析,显示在grna存在下sacas9的核定位(红色,sacas9信号;蓝色,dapi信号;绿色,gfp-kash信号)。e)sacas9和spcas9在不具有(-)和具有(+)grna条件下在n2a细胞中的亚细胞定位。在细胞质部分(微管蛋白阳性)中在250kda处的sacas9信号,指示sacas9在细胞质中二聚化。在grna存在下,可见sacas9蛋白移动到核部分(sun2阳性)中。在100kda处的sacas9信号指示sacas9同聚体的grna依赖性形成和向细胞核中转运。相比之下,spcas9主要以同聚体存在,并且它的核定位不依赖于grna。图69显示了aav-sa-cas9载体、肝脏特异性aav-sa-cas9载体、以及可替代的aav-sa-cas9载体。图70显示了关于优化的cmv-sacas9-nls-u6-sgrna载体(最后一次提交的载体设计)的数据;新的数据比较了n’-末端与c’-末端标记的sacas9,并且显示了使用c’-末端nls标记的切割效率提高。图71显示了示出通过新的pcsk9靶标产生的插入缺失的surveyor图像。图72显示了sacas9特异性:基于2个标准预测了全基因组脱靶位点(gwot):它们相对于预期sacas9靶含有4个或更少的错配碱基,并且对于sacas9具有最小的限制性pam(nngrr)。用在靶位点(emx1:tagggttaggggccccaggc)处具有它们的相应sgrna的spcas9或sacas9转染hek293ft细胞,该靶位点具有cggggt作为pam,使得它可以被spcas9(cgg)或被sacas9(cggggt)切割。从细胞中收获dna并且通过illumina测序分析在中靶和41个预测的脱靶座位处的插入缺失(遵循来自徐(hsu)等人的《自然生物技术》(naturebiotech)2013方案和由大卫·斯科特(davidscott)和乔什·温斯坦(joshweinstein)开发的数据分析流程)。图73显示sacas9在某些座位处比spcas9可具有更高水平的脱靶活性。本文的这些图仅仅是出于说明性的目的,并且不一定是按比例绘制的。本发明的详细说明本发明涉及用于控制涉及序列靶向的基因表达的系统、方法、和组合物的工程化和优化,该序列靶向例如涉及crispr-cas系统及其组分的基因组干扰或基因编辑。在有利的实施例中,该cas酶是cas9。本发明方法的一个优点在于,该crispr系统避免了脱靶结合及其所产生的副作用。这是通过使用被安排为具有针对靶dna的高度序列特异性的系统而实现的。cas9cas9优化可以用来增强功能或者用来开发新的功能,人们可以产生嵌合cas9蛋白。申请人已经产生的例子提供在实例6中。可以通过组合来自不同的cas9同源物的片段而制成嵌合cas9蛋白。例如,两种示例性嵌合cas9蛋白来自本文描述的cas9。例如,申请人使st1cas9的n-末端(来自这种蛋白质的片段是粗体的)与spcas9的c-末端融合。制造嵌合cas9的益处包括下列任一项或全部:毒性降低;在真核细胞中改进表达;特异性增强;蛋白质分子量降低,例如,通过组合来自不同cas9同源物的最小结构域使蛋白质更小;和/或改变pam序列要求。该cas9可以用作通用的dna结合蛋白。例如,如实例7中所示,通过使负责切割该dna靶的两条链的两个催化结构域(d10和h840)突变,申请人使用cas9作为通用的dna结合蛋白。为了上调在靶座位处的基因转录,申请人使转录激活结构结构域(vp64)融合到cas9上。其他的转录激活结构域是已知的。如实例17中所示,转录激活是可能的。还如实例17中所示,使用结合到靶基因序列上的cas9阻抑物(dna结合域),基因阻抑(在β-连环蛋白基因的这种情况下)是可能的,由此阻抑其活性。cas9以及一种或多种指导rna可以使用腺相关病毒(aav)、慢病毒、腺病毒或其他质粒或病毒载体类型进行递送,尤其是,使用来自以下文献的配方和剂量:例如,美国专利号8,454,972(针对腺病毒的配方、剂量)、8,404,658(针对aav的配方、剂量)和5,846,946(针对dna质粒的配方、剂量)以及来自临床试验和关于涉及慢病毒、aav、和腺病毒的临床试验的出版物。例如,对于aav,给药途径、配方和剂量可以如美国专利号8,454,972并且如涉及aav的临床试验。对于腺病毒,给药途径、配方和剂量可以如美国专利号8,404,658并且如涉及腺病毒的临床试验。对于质粒递送,给药途径、配方和剂量可以如美国专利号5,846,946并且如涉及质粒的临床试验。剂量可以基于或推断为平均70kg的个体,并且可以针对患者、受试者、不同重量和物种的哺乳动物进行调整。给药频率在医学或兽医学从业者(例如,医师、兽医师)的范围之内,其取决于常规因素,包括患者或受试者的年龄、性别、一般健康状况、其他状况以及着手解决的特殊状况或症状。可以将病毒载体注射到感兴趣的组织中。对于细胞类型特异性基因组修饰,cas9的表达可以由细胞类型特异性启动子驱动。例如,肝脏特异性表达可以使用白蛋白启动子,而神经元特异性表达可以使用突触蛋白i启动子。转基因动物和植物还提供了转基因动物。优选实例包括含有cas9(就编码cas9的多核苷酸或该蛋白质自身而言)的动物。小鼠、大鼠和兔是优选的。为了用如本文示例的这些构建体产生转基因小鼠,人们可以将纯的线性dna注射到来自假孕雌性(例如,cb56雌性)的合子的前核中。然后对首建者小鼠(founder)进行鉴定、基因分型、并且与cb57回交。然后,例如通过桑格(sanger)测序将这些构建体克隆和任选地进行证实。在例如一个或多个基因在模型中被敲除的情况下,设想了敲除。然而,还设想了敲入(单独或以组合方式)。产生了一种示例性敲入cas9小鼠,并且这是示例性的,但是cas9敲入是优选的。为了产生cas9敲入小鼠,人们可以将相同的组成型或条件型构建体靶向到rosa26座位上,如本文所述(图25a-b和26)。可以修饰针对靶向rosa座位的、转让给桑加莫生物科学公司(sangamobiosciences,inc.)的美国专利公开号20120017290和20110265198的方法,以便利用本发明的crisprcas系统。在另一个实施例中,也可以修饰针对靶向rosa座位的、转让给cellectis公司的美国专利公开号20130236946的方法,以便利用本发明的crisprcas系统。条件型cas9小鼠的实用性:申请人已经在293细胞中显示,可以通过与cre共表达而激活cas9条件型表达构建体。申请人还显示,当表达cre时,正确靶向的r1mesc可以具有活性cas9。因为在cas9之后为p2a肽切割序列并且然后为egfp,申请人通过观察egfp而鉴定成功表达。申请人已经表明在mescs中的cas9激活。这个相同的观念在于,什么使条件型cas9小鼠如此有用。申请人可以将其条件型cas9小鼠与普遍表达cre的小鼠(actb-cre系)杂交并且可以得到在每个细胞中表达cas9的小鼠。应当仅仅采用嵌合的rna的递送,以便诱导在胚胎小鼠或成年小鼠中的基因组编辑。有趣的是,如果条件型cas9小鼠与在组织特异的启动子下表达cre的小鼠杂交,在也表达cre的组织中将会仅有cas9。通过将嵌合的rna递送到相同的组织中,此途径可以用来仅仅在精确的组织中编辑基因组。如上提及的,还提供了转基因动物,正如转基因植物一样,尤其是作物和藻类。这些转基因植物可用于在除了提供疾病模型之外的应用中。通过表达例如比通常在野生型中可见的更高的蛋白质、碳水化合物、营养素或维生素水平,这些应用可包括食物或饲料生产。在这方面,转基因植物,尤其是豆类和块茎类,以及动物,尤其是哺乳动物,如家畜(奶牛、绵羊、山羊和猪),而且还有禽类和食用昆虫,是优选的。转基因藻类或其他植物,如油菜,可以在植物油或生物燃料例如像醇类(尤其是甲醇和乙醇)的生产中特别有用。这些可以被工程化为表达或过表达高水平的油或醇类,以供在油或生物燃料行业中使用。腺相关病毒(aav)就体内递送而言,aav相比于其他病毒载体是有利的,这是由于几个原因:低毒性(这可以是由于纯化方法不需要细胞粒子的超速离心所致,而超速离心可能激活免疫反应)引起插入诱变的低概率,原因在于它未整合到宿主基因组中。aav具有4.5或4.75kb的包装限制。这意味着cas9以及启动子和转录终止子必须都配合在同一个病毒载体中。大于4.5或4.75kb的构建体将导致病毒产生的显著降低。spcas9是相当大的,其基因自身超过4.1kb,使其难于包装到aav中。因此本发明的实施例包括利用更短的cas9同源物。例如:因此这些物种总体上是优选的cas9物种。申请人已经示出了递送和体内小鼠脑cas9表达数据。介导体内基因组修饰的、将cas9编码核酸分子例如dna包装到病毒载体中的两种方式是优选的:为了实现nhej介导的基因敲除:单病毒载体:含有两个或更多个表达盒的载体:启动子-cas9编码核酸分子-终止子启动子-grna1-终止子启动子-grna2-终止子启动子-grna(n)-终止子(一直到载体的大小限制)双病毒载体:含有一个用于驱动cas9表达的表达盒的载体1启动子-cas9编码核酸分子-终止子含有一个或多个用于驱动一个或多个指导rna表达的表达盒的载体2启动子-grna1-终止子启动子-grna(n)-终止子(一直到载体的大小限制)为了介导同源定向修复。除了上述单和双病毒载体途径之外,另外的载体可以用来递送同源定向修复模板。用来驱动cas9编码核酸分子表达的启动子包括:aavitr可以用作一种启动子:这对于消除另外的启动子元件(可在载体中占用空间)的需要是有利的。空出来的另外的空间可以用来驱动另外的元件的表达(grna,等等)。同样,itr活性是较弱的,因此可以用来降低由于cas9的过表达所致的毒性。对于遍存表达,可以使用启动子:cmv、cag、cbh、pgk、sv40、铁蛋白重链或轻链,等等。对于脑表达,可以使用启动子:用于所有神经元的突触蛋白i、用于兴奋性神经元的camkiiα、用于gaba能神经元的gad67或gad65或vgat,等等。对于肝脏表达,可以使用白蛋白启动子。对于肺表达,可以使用sp-b。对于内皮细胞,可以使用icam。对于造血细胞,可以使用ifnβ或cd45。对于成骨细胞,可以使用og-2。用来驱动指导rna的启动子可以包括:poliii启动子,如u6或h1使用polii启动子和内含子盒来表达grna关于aav,aav可以是aav1、aav2、aav5或任何其组合。可以相对于有待被靶向的细胞而选择aav;例如,可以选择用于靶向脑或神经元细胞的aav血清型1、2、5或杂交体或衣壳aav1、aav2、aav5或其任何组合;并且可以选择用于靶向心脏组织的aav4。aav8可用于递送到肝脏。以上启动子和载体是单独优选的。rna递送也是一种有用的体内递送方法。图27显示了递送和体内小鼠脑cas9表达数据。有可能使用脂质体或纳米粒子将cas9和grna(并且,例如,hr修复模板)递送到细胞中。因此,crispr酶如cas9的递送和/或本发明的rna的递送可以处于rna的形式并且经由微囊泡、脂质体或纳米粒子来进行。例如,cas9mrna和grna可以被包装到脂质体粒子中用于体内递送。脂质体转染试剂例如来自生命技术公司(lifetechnologies)的lipofectamine以及市售的其他试剂可以有效地将rna分子递送到肝脏中。提高nhej或hr效率也有助于递送。优选的是,nhej效率通过共表达末端加工酶(co-expressingend-processingenzyme)如trex2而增强(杜米特拉切(dumitrache)等人《遗传学》(genetics)2011年8月;188(4):787–797)。优选的是,hr效率通过瞬时抑制nhej机构如ku70和ku86而增加。hr效率也可以通过共表达原核或真核同源重组酶如recbcd、reca而增加。本文描述了各种递送手段,并且进一步在这个部分中进行论述。病毒递送:该crispr酶,例如cas9,和/或任何本发明的rna,例如指导rna,可以使用腺相关病毒(aav)、慢病毒、腺病毒或其他病毒载体类型、或其组合进行递送。cas9以及一种或多种指导rna可以包装到一种或多种病毒载体中。在一些实施例中,病毒载体可以,例如,通过肌肉注射递送到感兴趣组织中,而有时经由静脉内、经皮、鼻内、经口、粘膜、或其他递送方法进行病毒递送。这样的递送可以经由单剂量或多剂量来进行。本领域技术人员理解的是,本文有待递送的实际剂量可以在很大程度上取决于多种因素而变化,如载体选择、靶细胞、生物、或组织、有待治疗的受试者的一般状况、所寻求的转化/修饰的程度、给药途径、给药方式、所寻求的转化/修饰的类型,等等。这样的剂量可以进一步含有,例如,载体(水、盐水、乙醇、甘油、乳糖、蔗糖、磷酸钙、明胶、葡聚糖、琼脂、果胶、花生油、芝麻油,等等)、稀释剂、药学上可接受的载体(例如,磷酸盐缓冲盐水)、药学上可接受的赋形剂、增强抗原性的佐剂、免疫刺激化合物或分子、和/或本领域已知的其他化合物。本文的佐剂可以含有抗原被吸附到其上的矿物质(明矾、氢氧化铝、磷酸铝)的悬浮液;或油包水乳剂,其中抗原溶液被乳化在油中(mf-59,弗氏不完全佐剂),有时包含有杀死的分枝杆菌(弗氏完全佐剂)以进一步增强抗原性(抑制抗原的降解和/或引起巨噬细胞的移入)。佐剂还包括免疫刺激分子,如细胞因子、共刺激分子,例如,免疫刺激dna或rna分子,如cpg寡核苷酸。这样一种剂量配方可由本领域技术人员容易地确定。该剂型可以进一步含有一种或多种药学上可接受的盐,例如像,无机酸盐如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐、等等;以及有机酸盐,如乙酸盐、丙酸盐、丙二酸盐、苯甲酸盐等等。另外,本文也可以存在辅助物质,如润湿剂或乳化剂、ph缓冲物质、凝胶或胶凝材料、调味剂、着色剂、微球体、聚合物、悬浮剂等等。另外,也可以存在一种或多种其他常规药用成分,如防腐剂、保湿剂、悬浮剂、表面活性剂、抗氧化剂、抗结剂、填充剂、螯合剂、包衣剂、化学稳定剂等等,尤其是该剂型是可复原形式时。适合的示例性成分包括微晶纤维素、羧甲基纤维素钠、聚山梨酯80、苯乙醇、三氯叔丁醇、山梨酸钾、抗坏血酸、二氧化硫、没食子酸丙酯、对羟基苯甲酸酯、乙基香兰素、甘油、苯酚、对氯酚、明胶、白蛋白和它们的组合。药学上可接受的赋形剂的彻底论述可获自《雷明顿药物科学》(remington'spharmaceuticalsciences)(马克出版公司,纽约,1991),通过引用将其并入本文。在本文的一个实施例中,递送是经由腺病毒进行的,其可以是含有至少1x105个腺病毒载体粒子(也称为粒子单位,pu)的单次加强剂量。在本文的一个实施例中,该剂量优选地是该腺病毒载体的至少约1x106个粒子(例如,约1x106-1x1012个粒子),更优选至少约1x107个粒子,更优选至少约1x108个粒子(例如,约1x108-1x1011个粒子或约1x108-1x1012个粒子),并且最优选至少约1x100个粒子(例如,约1*x109-1x1010个粒子或约1x109-1x1012个粒子),或者甚至至少约1x1010个粒子(例如,约1x1010-1x1012个粒子)。可替代地,该剂量包含不多于约1x1014个粒子,优选不多于约1x1013个粒子,甚至更优选不多于约1x1012个粒子,甚至更优选不多于约1x1011个粒子,并且最优选不多于约1x1010个粒子(例如,不多于约1x109个粒子)。因此,该剂量可以含有单剂量的腺病毒载体,其具有例如、约1x106粒子单位(pu)、约2x106pu、约4x106pu、约1x107pu、约2x107pu、约4x107pu、约1x108pu、约2x108pu、约4x108pu、约1x109pu、约2x109pu、约4x109pu、约1x1010pu、约2x1010pu、约4x1010pu、约1x1011pu、约2x1011pu、约4x1011pu、约1x1012pu、约2x1012pu、或约4x1012pu的腺病毒载体。参见,例如,在2013年6月4日授权的授予纳贝尔(nabel)等人的美国专利号8,454,972b2中的腺病毒载体(通过引用并入本文)以及在其第29栏第36-58行的剂量。在本文的一个实施例中,该腺病毒是经由多剂量递送的。在本文的一个实施例中,该递送是经由aav进行的。用于针对人类的aav的体内递送的治疗有效剂量被认为处于含有从约1x1010到约1x1010个功能aav/ml溶液的从约20到约50ml的盐水溶液的范围内。该剂量可以调整以便使治疗益处相对于任何副作用的平衡。在本文的一个实施例中,aav剂量大致处于从约1x105到1x1050个基因组aav、从约1x108到1x1020个基因组aav、从约1x1010到约1x1016个基因组、或约1x1011到约1x1016个基因组aav的浓度范围内。人类剂量可以是约1x1013个基因组aav。这样的浓度能以从约0.001ml到约100ml、约0.05到约50ml、或约10到约25ml的载体溶液进行递送。通过建立剂量反应曲线的常规试验,本领域普通技术人员可以容易地确立其他有效剂量。参见,例如,2013年3月26日授权的授予哈加(hajjar)等人的美国专利号8,404,658b2,在第27栏第45-60行。在本文的一个实施例中,该递送是经由质粒进行的。在这样的质粒组合物中,该剂量应当是足以引出反应的质粒的量。例如,在质粒组合物中的质粒dna的适当量可以是从约0.1到约2mg,或从约1μg到约10μg。本文的剂量是基于平均70kg的个体。给药频率在医学或兽医学从业者(例如医师、兽医师)或本领域熟练的科学家的范围之内。慢病毒慢病毒是复杂的反转录病毒,其具有在有丝分裂细胞和有丝分裂后细胞两者中感染并表达其基因的能力。最为人熟知的慢病毒是人类免疫缺陷病毒(hiv),其利其他病毒的包膜糖蛋白来靶向广泛范围的细胞类型。慢病毒可以制备如下。在克隆pcases10(含有慢病毒转移质粒骨架)之后,将处于低传代数(p=5)的hek293ft接种在t-75烧瓶中,直到在转染之前的一天在具有10%胎牛血清而没有抗生素的dmem中50%汇合。在20小时之后,培养基更换为optimem(无血清)培养基,并且在4小时后进行转染。将细胞用10μg的慢病毒转移质粒(pcases10)和下列包装质粒转染:5μg的pmd2.g(vsv-g假型)、和7.5μg的pspax2(gag/pol/rev/tat)。在具有阳离子脂质递送剂(50μl的lipofectamine2000和100μl的plus试剂)的4mloptimem中进行转染。在6小时之后,培养基更换为具有10%胎牛血清的无抗生素的dmem。慢病毒可以如下纯化。在48小时后收获病毒上清液。首先清除上清液的碎片并通过0.45μm的低蛋白结合(pvdf)滤膜进行过滤。然后将它们在超速离心机中以24,000rpm旋转2小时。将病毒沉淀重新悬浮在50μl的dmem中在4c过夜。然后将它们等分,并且立即在-80c冷冻。在另一个实施例中,还考虑了基于马传染性贫血病毒(eiav)的最小非灵长类慢病毒载体,尤其是对于眼基因治疗而言(参见,例如,巴鲁谷安(balagaan),《基因医学杂志》(jgenemed)2006;8:275-285,2005年11月21日在《威利在线期刊》(wileyinterscience)(www.interscience.wiley.com).doi:10.1002/jgm.845)在线公开。在另一个实施例中,还考虑了一种经由视网膜下注射用于治疗湿型的年龄相关性黄斑变性的、表达血管生成抑制蛋白(内皮抑素和血管抑素)的基于马传染性贫血病毒的慢病毒基因治疗载体(参见,例如,宾利(binley)等人,《人类基因治疗》(humangenetherapy)23:980–991(2012年9月)),其可以经修饰用于本发明的crispr-cas系统。在另一个实施例中,自灭活慢病毒载体可以用于和/或适合于本发明的crispr-cas系统,该自灭活慢病毒载体具有靶向由hivtat/rev共享的共有外显子的sirna、核仁定位tar诱饵、和抗ccr5特异性锤头状核酶(参见,例如,迪吉斯托(digiusto)等人(2010)《科学转化医学》(scitranslmed)2:36ra43)。可以收集最少2.5×106个cd34+细胞/每千克患者体重,并且以2×106个细胞/ml的密度在x-vivo15培养基中(龙沙公司(lonza))预刺激16到20个小时,该培养基含有2mml-谷氨酰胺、干细胞因子(100ng/ml)、flt-3配体(flt-3l)(100ng/ml)、和促血小板生成素(10ng/ml)(cellgenix公司)。可以用慢病毒以感染复数5在75-cm2的包被有纤连蛋白(25mg/cm2)(重组人纤维蛋白片段(retronectin),宝生物工程株式会社(takarabioinc.))的组织培养瓶中转导预刺激的细胞16到24小时。慢病毒载体还披露于帕金森病的治疗中,参见,例如,美国专利公开号20120295960以及美国专利号7303910和7351585。慢病毒载体还披露于眼病的治疗中,参见,例如,美国专利公开号20060281180、20090007284、us20110117189;us20090017543;us20070054961、us20100317109。还披露了将慢病毒载体递送到脑,参见,例如,美国专利公开号us20110293571;us20110293571、us20040013648、us20070025970、us20090111106和美国专利号us7259015。rna递送rna递送:该crispr酶,例如cas9,和/或任何本发明的rna,例如指导rna,也可以按rna的形式递送。可以使用体外转录产生cas9mrna。例如,可以使用含有下列元件的pcr盒来合成cas9mrna:来自β珠蛋白-polya尾(一串120个或更多的腺嘌呤)的t7_启动子-科扎克(kozak)序列(gccacc)-cas9-3’utr。该盒可以用于经由t7聚合酶的转录。也可以使用体外转录从含有t7_启动子-gg-指导rna序列的盒来转录指导rna。为了增强表达并且降低毒性,可以使用假-u或5-甲基-c修饰该crispr酶和/或指导rna。mrna递送方法用于当前的肝脏递送是特别有希望的。具体地说,aav8对于递送到肝脏是特别优选的。纳米粒子可以使用纳米粒子或脂质包膜同时递送crispr酶mrna和指导rna。例如,苏x(sux)、弗里克j(frickej)、卡瓦纳dg(kavanaghdg)、欧文dj(irvinedj)(“使用脂质包封的ph响应性聚合物纳米粒子的体外和体内mrna递送”(“invitroandinvivomrnadeliveryusinglipid-envelopedph-responsivepolymernanoparticles”)《分子药理学》(molpharm.)2011年6月6;8(3):774-87.doi:10.1021/mp100390w。2011年4月1日电子版描述了生物可降解的核-壳结构纳米粒子,其具有由磷脂双层壳包封的聚(β-氨基酯)(pbae)核。这些被开发为用于体内mrna递送。该ph响应性pbae被选择为促进内体破裂,而该脂质表面层被选择为将聚阳离子核的毒性降低到最低限度。因此,这些对于递送本发明的rna是优选的。在一个实施例中,考虑了基于自组装生物粘附聚合物的纳米粒子,其可应用于肽的经口递送、肽的静脉内递送以及肽的鼻递送,均递送到脑。其他实施例,还考虑了例如疏水性药物的经口吸收和眼部递送。分子包膜技术涉及被保护并递送到疾病部位的工程化聚合物包膜(参见,例如,马萨(mazza)m.等人《acs纳米》(acsnano),2013.7(2):1016-1026;秀(siew)a.等人《分子药理学》(molpharm),2012.9(1):14-28;拉拉特萨(lalatsa)a.等人《控释杂志》(jcontrrel),2012.161(2):523-36;拉拉特萨(lalatsa)a.等人,《分子药理学》(molpharm),2012.9(6):1665-80;拉拉特萨(lalatsa)a.等人《分子药理学》(molpharm),2012.9(6):1764-74;加勒特(garrett)n.l.等人《生物光电杂志》(jbiophotonics),2012.5(5-6):458-68;加勒特(garrett)n.l.等人《拉曼光谱杂志》(jramanspect),2012.43(5):681-688;阿哈默德(ahmad)s.等人《皇家学会界面杂志》(jroyalsocinterface)2010.7:s423-33;乌切克布(uchegbu)i.f.《药物递送专家评论》(expertopindrugdeliv),2006.3(5):629-40;曲(qu)x.等人《生物大分子》(biomacromolecules),2006.7(12):3452-9和乌切克布(uchegbu)i.f.等人《国际药学杂志》(intjpharm),2001.224:185-199)。考虑了约5mg/kg的剂量,呈单剂量或多剂量形式,这取决于靶组织。在一个实施例中,可以使用由丹·安德森实验室(dananderson’slab)在mit开发的可将rna递送到癌细胞以便使肿瘤生长停止的纳米粒子/并且或使其适用于本发明的crisprcas系统。具体地说,安德森实验室开发了用于新生物材料和纳米制剂的合成、纯化、表征、和配制的全自动化组合系统。参见,例如,阿拉比(alabi)等人,《美国国家科学院院刊》(procnatlacadsciusa.)2013年8月6日;110(32):12881-6;张(zhang)等人,《先进材料》(advmater.)2013年9月6日;25(33):4641-5;江(jiang)等人,《纳米通讯》(nanolett.)2013年3月13日;13(3):1059-64;卡拉吉安尼斯(karagiannis)等人,《acs纳米》(acsnano.)2012年10月23日;6(10):8484-7;怀特海德(whitehead)等人,《acs纳米》(acsnano.)2012年8月28日;6(8):6922-9和李(lee)等人,《自然纳米技术》(natnanotechnol.)2012年6月3日;7(6):389-93。美国专利申请20110293703涉及类脂质化合物,这些化合物在多核苷酸的给药中也是特别有用的,其可适用于递送本发明的crisprcas系统。在一个方面,氨基醇类脂质化合物与有待递送到细胞或受试者的药剂结合而形成微粒子、纳米粒子、脂质体、或胶束。有待通过粒子、脂质体、或胶束递送的药剂可以处于气体、液体、或固体的形式,并且该药剂可以是一种多核苷酸、蛋白质、肽、或小分子。这些氨基醇类脂质化合物可以与其他氨基醇类脂质化合物、聚合物(合成的或天然的)、表面活性剂、胆固醇、碳水化合物、蛋白质、脂质、等等形成粒子。然后这些粒子可以任选地与药用赋形剂结合而形成药物组合物。美国专利公开号0110293703也提供了制备氨基醇类脂质化合物的方法。使胺的一种或多种等效物与环氧化物封端化合物的一种或多种等效物在适当条件下反应而形成本发明的氨基醇类脂质化合物。在某些实施例中,胺的所有氨基基团与环氧化物封端化合物充分反应而形成叔胺。在其他实施例中,胺的所有氨基基团未与环氧化物封端化合物完全反应形成叔胺,由此生成在氨基醇类脂质化合物中的伯胺或仲胺。这些伯胺或仲胺照原样留下或者可以与另一种亲电体如一种不同的环氧化物封端化合物反应。正如本领域技术人员将理解的,胺与未过量的环氧化物封端化合物反应将产生多种不同的具有不同数目的尾部的氨基醇类脂质化合物。某些胺类可以用两个环氧化物衍生的化合物尾部将其完全功能化,而其他分子用环氧化物衍生的化合物尾部将不会被完全功能化。例如,二胺或多胺可包括离开该分子的不同氨基部分的一个、二个、三个、或四个环氧化物衍生的化合物尾部,从而产生伯胺、仲胺、和叔胺。在某些实施例中,并不是所有氨基基团都被完全功能化。在某些实施例中,使用相同类型的环氧化物封端化合物中的两种。在其他实施例中,使用两种或更多种不同的环氧化物封端化合物。氨基醇类脂质化合物的合成是用或不用溶剂进行的,并且该合成可以在范围从30-100c,优选在大致50-90c的较高温度下进行。任选地,可以将制备的氨基醇类脂质化合物纯化。例如,可以纯化氨基醇类脂质化合物的混合物而产生具有特定数目的、环氧化物衍生的化合物尾部的氨基醇类脂质化合物。或者,该混合物可以被纯化而产生特定的立体异构体或区域异构体。也可以使用烷基卤化物(例如,碘甲烷)或其他烷化剂将这些氨基醇类脂质化合物烷化,和/或它们可以被酰化。美国专利公开号0110293703还提供了通过发明方法制备的氨基醇类脂质化合物的文库。使用涉及液体处理器、机器人、微量滴定板、计算机、等等的高通量技术,可以制备和/或筛选这些氨基醇类脂质化合物。在某些实施例中,筛选了这些氨基醇类脂质化合物的将多核苷酸或其他药剂(例如,蛋白质、肽、小分子)转染到细胞中的能力。美国专利公开号20130302401涉及已经使用组合聚合制备的一类聚(β-氨基醇)(pbaas)。这些发明的pbaa可以在生物技术和生物医学应用中用作涂层(如用于医疗装置或植入物的薄膜或多层薄膜的涂层)、添加剂、材料、赋形剂、生物防污剂(non-biofoulingagent)、微图像化剂(micropatterningagent)、以及细胞封装剂(cellularencapsulationagent)。当用作表面涂层时,这些pbaa在体外和体内均引出不同水平的炎症,这取决于它们的化学结构。这类材料的巨大化学多样性允许我们鉴定出体外抑制巨噬细胞激活的聚合物涂层。此外,在羧化聚苯乙烯微粒的皮下移植之后,这些涂层减少了炎症细胞的募集,并且减轻了纤维化。这些聚合物可以用来形成用于细胞封装的聚电解质复合物胶囊。本发明还可具有许多其他的生物应用,如抗微生物涂层、dna或sirna递送、以及干细胞组织工程。美国专利公开号20130302401的传授内容可以适用于本发明的crisprcas系统。在另一个实施例中,考虑了脂质纳米粒子(lnp)。具体地说,封装在脂质纳米粒子中的抗转甲状腺素蛋白小干扰rna(参见,例如,科尔贺(coelho)等人,《新英格兰医学杂志》(nengljmed)2013;369:819-29)可以适用于本发明的crisprcas系统。考虑到静脉内给予约0.01到约1mg/kg体重的剂量。考虑了降低输注相关反应的风险的用药,如考虑到地塞米松、对乙酰氨基酚(acetampinophen)、苯海拉明或西替利嗪、以及雷尼替丁。考虑了约0.3mg/千克的多剂量,每4周一次,五个剂量。lnp已经显示在将sirna递送到肝脏中是高度有效的(参见,例如,塔韦内罗(tabernero)等人,《癌症发现》(cancerdiscovery),2013年4月,第3卷,第4期,第363-470页),并且因此被考虑用于递送crisprcas到肝脏。考虑了6mg/kg的lnp的约四个剂量的用量,每两周一次。塔韦内罗(tabernero)等人证明,在以0.7mg/kg给予lnp的前2个周期之后,观察到肿瘤消退,并且在6个周期结束之后,患者已经实现了部分应答,具有淋巴结转移完全消退以及肝脏肿瘤的显著萎缩。在此患者中给予40个剂量之后获得完全应答,在接受经过26个月的剂量之后其保持缓解和完全治疗。具有rcc和在用vegf途径抑制剂进行的在先治疗之后进展的包括肾脏、肺、以及淋巴结在内的肝外部位疾病的两位患者在所有部位的疾病都保持稳定大约8到12个月,并且一位具有pnet和肝转移的患者继续在18个月(36个剂量)的延伸研究中保持疾病稳定。然而,必须将lnp的电荷考虑在内。当阳离子脂质与带负电的脂质结合时,诱导促进细胞内递送的非双层结构。由于带电荷的lnp在静脉注射之后迅速从循环中清除,开发了具有低于7的pka值的可电离阳离子脂质(参见,例如,罗辛(rosin)等人,《分子治疗》(moleculartherapy),第19卷,第12期,第1286-2200页,2011年12月)。带负电荷的聚合物如sirna寡核苷酸可以低ph值(例如,ph4)加载到lnp中,在此ph时可电离脂质展示出正电荷。然而,在生理学ph值时,lnp展现出与更长的循环时间相容的低表面电荷。已经关注了四种可电离阳离子脂质,即1,2-二亚油酰基-3-二甲基铵-丙烷(dlindap)、1,2-二亚油基氧基-3-n,n-二甲基氨基丙烷(dlindma)、1,2-二亚油基氧基-酮基-n,n-二甲基-3-氨基丙烷(dlinkdma)、以及1,2-二亚油基-4-(2-二甲基氨基乙基)-[1,3]-二氧戊环(dlinkc2-dma)。已经表明,含有这些脂质的lnpsirna系统在体内肝细胞中展现出显著不同的基因沉默特性,具有根据采用因子vii基因沉默模型的dlinkc2-dma>dlinkdma>dlindma>>dlindap系列而变化的潜能(参见,例如,罗辛(rosin)等人,《分子治疗》(moleculartherapy),第19卷,第12期,第1286-2200页,2011年12月)。可以考虑1μg/ml水平的剂量,尤其是对于含有dlinkc2-dma的配制品而言。lnp的制备和crisprcas封装可以使用/和或改编自罗辛(rosin)等人的《分子治疗》(moleculartherapy),第19卷,第12期,第1286-2200页,2011年12月)。阳离子脂质1,2-二亚油酰基-3-二甲基铵-丙烷(dlindap)、1,2-二亚油基氧基-3-n,n-二甲基氨基丙烷(dlindma)、1,2-二亚油基氧基酮基-n,n-二甲基-3-氨基丙烷(dlink-dma)、1,2-二亚油基-4-(2-二甲基氨基乙基)-[1,3]-二氧戊环(dlinkc2-dma)、(3-o-[2″-(甲氧基聚乙二醇2000)琥珀酰]-1,2-二肉豆蔻酰基-sn-二肉豆蔻酰基(peg-s-dmg)、以及r-3-[(ω-甲氧基-聚(乙二醇)2000)氨甲酰]-1,2-二肉豆蔻酰氧基丙基-3-胺(peg-c-domg)可以由tekmira制药公司(tekmirapharmaceuticals)(温哥华,加拿大)提供或者合成。胆固醇可以购自西格玛公司(圣路易斯,密苏里州)。特异性crisprcasrna可以封装在含有dlindap、dlindma、dlink-dma、和dlinkc2-dma的lnp中(阳离子脂质:dspc:chol:pegs-dmg或peg-c-domg的摩尔比为40:10:40:10)。在需要时,可以结合0.2%sp-dioc18(英杰公司,伯灵顿,加拿大)来评估细胞摄取、细胞内递送、和生物分布。通过将由阳离子脂质:dspc:胆固醇:peg-c-domg(40:10:40:10摩尔比)组成的混合物溶解在乙醇中直到最终脂质浓度为10mmol/l来进行封装。可以将脂质的这种乙醇溶液逐滴加入到ph4.0的50mmol/l柠檬酸盐中而形成多层囊泡,从而产生30%(vol/vol)乙醇的最终浓度。在使用挤出机(北方脂质公司(northernlipids),温哥华,加拿大)通过两个重叠的80nmnuclepore聚碳酸酯滤膜挤出多层囊泡之后,可以形成大的单层囊泡。可以通过如下步骤实现封装:将溶解在含有30%乙醇(vol/vol)的ph4.0的50mmol/l柠檬酸盐中的2mg/ml的rna逐滴加入到挤出的形成的大单层囊泡中,并且在31℃孵育30分钟,伴随持续混合直到最终的rna/脂质重量比为0.06/1(wt/wt)。通过使用spectra/por2再生纤维素透析膜在ph为7.4的磷酸盐缓冲盐水(pbs)中透析16小时进行乙醇的去除以及配制缓冲液的中和。使用nicomp370型粒径分析仪、囊泡/强度模式、以及高斯拟合,通过动态光散射,可以测定纳米粒子粒径分布(nicomp粒径分析仪公司,圣巴巴拉市,加利福尼亚州)。对于所有三个lnp系统的粒径可以是约70nm的直径。可以通过使用vivapuredminih柱(赛多利斯斯泰迪生物技术公司(sartoriusstedimbiotech))从分析前后收集的样品中去除游离sirna来确定sirna封装效率。从洗脱的纳米粒子提取封装的rna并且将其在260nm定量。通过使用来自美国瓦克化学公司(wakochemicalsusa)(里士满(richmond),弗吉尼亚州)的胆固醇e酶法测定法测量囊泡中的胆固醇含量,确定了sirna与脂质的比率。大lnp的制备可以使用/和或改编自罗辛(rosin)等人的《分子治疗》(moleculartherapy),第19卷,第12期,第1286-2200页,2011年12月。可以在含有50:10:38.5的摩尔比的dlinkc2-dma、dspc、和胆固醇的乙醇中制备脂质预混物溶液(20.4mg/ml总脂质浓度)。可以按照0.75:1的摩尔比(乙酸钠:dlinkc2-dma)将乙酸钠添加到脂质预混物中。随后可以通过将该混合物与1.85倍体积的柠檬酸盐缓冲液(10mmol/l,ph3.0)在剧烈搅拌下合并而使脂质水合,从而导致在含有35%的在水性缓冲液中的自发脂质体形成。可以在37℃孵育该脂质体溶液以允许粒径的时间依赖性增加。可以通过动态光散射(纳米粒径电位分析仪(zetasizernanozs),马尔文仪器公司(malverninstruments),乌斯特郡(worcestershire),英国)在孵育的不同时间去除等分试样以研究脂质体大小的变化。一旦实现所希望的粒径,可以将水性peg脂质溶液(储备溶液=在35%(vol/vol)乙醇中的10mg/mlpeg-dmg)添加到该脂质体混合物中,以便产生3.5%总脂质的最终peg摩尔浓度。在添加peg-脂质之后,这些脂质体应该其大小,有效抑制进一步生长。然后以大约1:10(wt:wt)的sirna与总脂质比率将rna添加到空脂质体,然后在37℃孵育30分钟以形成加载的lnp。随后将该混合物在pbs中透析过夜,并且用0.45-μm的注射器过滤器。球形核酸(snatm)构建体和其他纳米粒子(尤其是金纳米粒子)也被考虑为将crispr/cas系统递送到预期靶标的手段。重要数据表明,基于核酸功能化的金纳米粒子的aurasense治疗性球形核酸(snatm)构建体优于替代平台,其基于多个关键成功因素,如:高体内稳定性。由于它们的密集加载,大多数负荷(dna或sirna)保持接合到细胞内部的构建体上,从而赋予核酸稳定性和对酶促降解的抗性。可递送性。对于所研究的所有细胞类型(例如,神经元、肿瘤细胞系,等等),这些构建体证明了在不需要载体或转染剂时99%的转染效率。治疗靶向性。这些构建体的独特靶结合亲和力和特异性允许对于匹配的靶序列的精密特异性(即,限制性脱靶效应)。优良效能。这些构建体显著胜过一流的常规转染试剂(lipofectamine2000和细胞转染剂(cytofectin))。低毒性。这些构建体可以进入多种培养的细胞、原代细胞、和组织中,没有明显的毒性。没有显著的免疫反应。这些构建体在全局基因表达上引起最小的变化,正如通过全基因组微阵列研究和细胞因子特异性蛋白质分析所测量。化学可修整性。任何数目的单个或组合药剂(例如,蛋白质、肽、小分子)可以用来修整这些构建体的表面。对于基于核酸治疗剂的这个平台可以适用于许多疾病状态,包括炎症和感染性疾病、癌症、皮肤病症和心血管疾病。可引用的文献包括:卡特勒(cutler)人,《美国化学会志》(j.am.chem.soc.)2011133:9254-9257,郝(hao)等人,small.20117:3158-3162,张(zhang)等人,《acs纳米》(acsnano.)20115:6962-6970,卡特勒(cutler)等人,《美国化学会志》(j.am.chem.soc.)2012134:1376-1391,杨(young)等人,《纳米通讯》(nanolett.)201212:3867-71,郑(zheng)等人,《美国国家科学院院刊》(proc.natl.acad.sci.usa.)2012109:11975-80,米尔金(mirkin),《纳米医学》(nanomedicine)20127:635-638张(zhang)等人,《美国化学会志》(j.am.chem.soc.)2012134:16488-1691,因特劳布(weintraub),《自然》(nature)2013495:s14-s16,崔(choi)等人,《美国国家科学院院刊》(proc.natl.acad.sci.usa.)2013110(19):7625-7630,詹森(jensen)等人,《科学转化医学》(scitranslmed)5,209ra152(2013)以及米尔金(mirkin)等人,small,doi.org/10.1002/smll.201302143。具有sirna的自组装纳米粒子可以用被聚乙二醇化的聚乙烯亚胺(pei)构建,其中arg-gly-asp(rgd)肽配体附接在聚乙二醇(peg)的远端,例如,作为靶向表达整合素的肿瘤新血管系统的手段和用来递送抑制血管内皮生长因子受体2(vegfr2)表达以及由此抑制肿瘤血管形成的sirna的手段(参见,例如,施弗勒斯(schiffelers)等人,《核酸研究》(nucleicacidsresearch),2004,第32卷,第19期)。通过将等体积的阳离子聚合物水溶液和核酸水溶液混合从而产生在2到6范围上的可电离氮(聚合物)相比磷酸盐(核酸)的净摩尔过量,从而制备纳米束。在阳离子聚合物与核酸之间的静电相互作用导致聚复合物的形成,其具有约100nm的平均粒径分布,此后称为纳米束。设想了crisprcas的约100到200mg的剂量,用于施弗勒斯(schiffelers)等人的自组装纳米粒子中的递送。巴特利特(bartlett)等人的纳米束(pnas,2007年9月25日,第104卷,第39期)也可以应用于本发明。通过将等体积的阳离子聚合物水溶液和核酸水溶液混合从而产生在2到6范围上的可电离氮(聚合物)相比磷酸盐(核酸)的净摩尔过量,从而制备巴特利特(bartlett)等人的纳米束。在阳离子聚合物与核酸之间的静电相互作用导致聚复合物的形成,其具有约100nm的平均粒径分布,此后称为纳米束。巴特利特(bartlett)等人的dota-sirna合成如下:1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸单(n-羟基琥珀酰亚胺酯)(dota-nhsester)订购自macrocyclics公司(达拉斯(dallas),德克萨斯州)。将碳酸盐缓冲液(ph9)中的具有100倍摩尔过量的dota-nhs-酯的胺修饰的rna有义链加入到微量离心管中。通过在室温搅拌4小时使这些内容物反应。将该dota-rna有义缀合物用乙醇沉淀,重新悬浮在水中,并且退火到未修饰的反义链上而产生dota-sirna。所有液体用chelex-100(伯乐公司(bio-rad),赫库斯(hercules),加利福尼亚州)预处理,以便去除微量金属污染物。通过使用含有环糊精的聚阳离子可以形成tf靶向和非靶向的sirna纳米粒子。典型地,纳米粒子以3(+/-)的进料比和0.5g/升的sirna浓度在水中形成。用tf(金刚烷-peg-tf)修饰在靶向纳米粒子表面上的百分之一的金刚烷-peg分子。将纳米粒子悬浮在用于注射的5%(wt/vol)的葡萄糖载体溶液中。戴维斯(davis)等人(《自然》,第464卷,2010年4月15日)使用靶向的纳米粒子递送系统进行了sirna临床试验(临床试验登记号nct00689065)。在21天周期的第1、3、8和10天通过30分钟的静脉输注对患有标准护理治疗难治的实体癌的患者给予靶向纳米粒子剂量。这些纳米粒子包含合成递送系统,该系统含有:(1)一种线性的、基于环糊精的聚合物(cdp),(2)一种展示在纳米粒子的外部上的用于接合癌细胞表面上的tf受体(tfr)的人转铁蛋白蛋白(tf)靶向配体,(3)一种亲水聚合物(用来促进在生物流体中的纳米粒子稳定性的聚乙二醇(peg)),以及(4)被设计为降低rrm2(在临床中使用的序列,先前表示为sir2b+5)表达的sirna。tfr已经久为所知在恶性细胞中被下调,并且rrm2是一种确立的抗癌靶标。已经显示这些纳米粒子(临床版本表示为calaa-01)在非人类灵长动物中的多剂量研究中良好耐受。虽然已经通过脂质体递送向患有慢性粒细胞白血病的单一患者给予了sirna,但是戴维斯等人的临床试验是初期人类试验,该试验用一个靶向的递送系统全身性地递送sirna并且治疗患有实体癌的患者。为了确定该靶向的递送系统是否能够将功能性sirna有效递送到人类肿瘤,戴维斯等人研究了来自三个不同的剂量组群的三位患者的活组织检查;患者a、b和c均患有转移性黑素瘤并且分别接受了18、24和30mgm-2sirna的calaa-01剂量。还可以针对本发明的crisprcas系统考虑相似的剂量。用含有一种线性的基于环糊精的聚合物(cdp)、一种展示在纳米粒子的外部上的用于接合癌细胞表面上的tf受体(tfr)的人转铁蛋白(tf)靶向配体和/或一种亲水聚合物(例如,用来促进在生物流体中的纳米粒子稳定性的聚乙二醇(peg))的纳米粒子,可以实现本发明的递送。外泌体外泌体是可以向小鼠脑中递送短干扰(si)rna的转运rna和蛋白质的内源纳米囊泡。为了降低免疫原性,阿尔瓦雷斯-尔维蒂(alvarez-erviti)等人(2011,《自然生物技术》29:341)使用了用于外泌体产生的自我衍生的树突细胞。通过将树突细胞工程化为表达lamp2b(一种外泌体膜蛋白,融合到神经元特异性rvg肽3上)而实现了靶向。通过电穿孔使纯化的外泌体加载外源sirna。静脉注射的rvg靶向的外泌体特异性地将gapdhsirna递送到脑中的神经元、小胶质细胞、少突神经胶质细胞,导致特异性的基因敲除。预暴露于rvg外泌体未减弱敲低,并且在其他组织中未观察到非特异性摄取。通过bace1的强的mrna(60%)和蛋白质(62%)敲低证明了外泌体介导的sirna递送的治疗潜能,bace1是一种阿尔茨海默病中的治疗靶标。为了获得免疫惰性的外泌体池,阿尔瓦雷斯-尔维蒂(alvarez-erviti)等人收获了来自具有同源主要组织相容性复合体(mhc)单体型的近交c57bl/6小鼠的骨髓。由于未成熟树突细胞产生大量的缺乏t细胞激活剂如mhc-ii和cd86的外泌体,阿尔瓦雷斯-尔维蒂(alvarez-erviti)等人选择具有粒细胞/巨噬细胞集落刺激因子(gm-csf)的树突细胞持续7天。次日,使用良好建立的超速离心方案从培养上清从纯化外泌体。这些产生的外泌体在物理上是同质的,具有直径为80nm的粒径分布峰,正如通过纳米粒子跟踪分析(nta)和电子显微镜检查所测定。阿尔瓦雷斯-尔维蒂(alvarez-erviti)等人获得了6-12μg的外泌体(基于蛋白质浓度测量的)/每106个细胞。其次,阿尔瓦雷斯-尔维蒂(alvarez-erviti)等人研究了使用适用于纳米级应用的穿孔方案给修饰的外泌体加载外源负荷的可能性。由于电穿孔对于纳米级的膜粒子尚未良好表征,使用非特异性cy5标记的sirna用于电穿孔方案的经验优化。在外泌体超速离心和溶解之后测定了封装的sirna的量。在400v和125μf的电穿孔导致sirna的最好保留并且用于所有的后续实验。阿尔瓦雷斯-尔维蒂(alvarez-erviti)向正常c57bl/6小鼠给予被包封在150μg的rvg外泌体中的150μg的每种bace1sirna并且将敲低效率与四个对照进行比较:未处理的小鼠、仅仅用rvg外泌体注射的小鼠,用与一种体内阳离子脂质体试剂络合的bace1sirna注射的小鼠、以及用与rvg-9r络合的bace1sirna注射的小鼠,该rvg肽与静电结合到sirna上的9个d-精氨酸缀合。在给药之后3天,分析皮层组织样品,并且在sirna-rvg-9r处理的和sirnarvg外泌体处理的小鼠中均观察到显著的蛋白质敲低(45%,p<0.05,相对于62%,p<0.01),这是由于显著的bace1mrna水平降低(分别为66%[+或-]15%,p<0.001以及61%[+或-]13%,p<0.01)。而且,申请人证明了在rvg-外泌体处理的动物中在总[β]-淀粉样蛋白1-42水平上的显著降低(55%,p<0.05),其中β淀粉样蛋白为一种在阿尔茨海默病理学中的淀粉样斑块的主要成分。所观察到的降低大于在心室内注射bace1抑制剂之后的正常小鼠中证明的β淀粉样蛋白1-40降低。阿尔瓦雷斯-尔维蒂(alvarez-erviti)在bace1切割产物上进行了5'-cdna末端快速扩增(race),其提供了经由sirna的rnai-介导的敲低的证据。最后,阿尔瓦雷斯-尔维蒂(alvarez-erviti)等人通过评定il-6、ip-10、tnfα和ifn-α血清浓度研究了sirna-rvg外泌体是否诱导了体内免疫反应。在sirna-rvg外泌体处理之后,类似于与有力地刺激il-6分泌的sirna-rvg-9r相反的sirna转染试剂处理,登记了在所有细胞因子上的非显著性变化,证实了该外泌体处理的免疫惰性属性。假定外泌体仅仅封装20%的sirna,用rvg-外泌体递送比rvg-9r递送显得更有效,因为用少五倍的sirna实现了相当的mrna敲低和更好的蛋白质敲低,而没有相应水平的免疫刺激。这个实验证明了rvg-外泌体技术的治疗潜力,其潜在地适合于与神经退行性疾病相关的基因的长期沉默。阿尔瓦雷斯-尔维蒂(alvarez-erviti)等人的外泌体递送系统可以用于将本发明的crispr-cas系统递送至治疗靶标,尤其是神经退行性疾病。对于本发明可以考虑封装在约100到1000mg的rvg外泌体中的约100到1000mg的crisprcas的剂量。艾尔·安达卢西(el-andaloussi)等人(《自然实验手册》(natureprotocols)7,2112–2126(2012))披露了可以如何利用来源于培养的细胞的外泌体用于体外和体内递送sirna。这个方案首先描述了通过转染一种包含与肽配体融合的外泌体蛋白的表达载体的靶向外泌体的产生。其次,艾尔·安达卢西(el-andaloussi)等人解释了如何纯化和表征来自转染的细胞上清液的外泌体。接着,艾尔·安达卢西(el-andaloussi)等人详述了将sirna加载到外泌体中的关键步骤。最后,艾尔·安达卢西(el-andaloussi)等人概述了如何使用外泌体有效体外递送sirna以及体内递送到小鼠脑中。还提供了预期结果的实例,其中外泌体介导的sirna递送通过功能分析和成像而评估。整个方案进行约3周。根据本发明的递送或给药可以使用从自我衍生的树突细胞产生的外泌体来进行。在另一个实施例中,考虑了瓦尔格伦(wahlgren)等人的血浆外泌体(《核酸研究》(nucleicacidsresearch),2012年,第40卷,第17期,e130)。外泌体是由包括树突细胞(dc)、b细胞、t细胞、肥大细胞、上皮细胞和肿瘤细胞在内的许多细胞类型产生的纳米囊泡(30–90nm大小)。这些囊泡通过晚期核内体的向内出芽而形成,并且然后在与质膜融合后释放到细胞外环境中。由于外泌体天然地在细胞之间运送rna,这种特性在基因治疗中可能有用。来自血浆的外泌体通过如下制备:在900g离心血沉棕黄层持续20分钟以便分离血浆,之后收获细胞上清液,在300g离心10分钟以便去除细胞,并且在16500g离心30分钟,之后通过0.22mm过滤器进行过滤。通过在120000g离心70分钟使外泌体沉淀。根据在rnai人/小鼠启动试剂盒(quiagen,希尔顿(hilden),德国)中的制造商的说明进行sirna到外泌体中的化学转染。sirna以终浓度2mmol/ml添加到100mlpbs中。在加入hiperfect转染试剂之后,将该混合物在室温下孵育10分钟。为了去除过量的胶束,使用醛/硫酸盐乳胶珠再分离外泌体。可以类似于sirna进行crisprcas到外泌体中的化学转染。外泌体可以与从健康供体的外周血中分离的单核细胞和淋巴细胞共培养。因此,可以考虑的是,可以将含有crisprcas的外泌体引入人单核细胞和淋巴细胞中并且以自体方式再引入。因此,可以使用血浆外泌体进行根据本发明的递送或给药。脂质体可以用脂质体进行根据本发明的递送或给药。脂质体是球形囊泡结构,其组成为围绕内部水性区室的单层或多层脂质双层以及相对不可渗透的外部亲脂性磷脂双层。脂质体作为药物递送载体受到了相当的重视,因为它们是生物相容、无毒的,可以递送亲水和亲脂性药物分子,包护它们的负荷物免于被血浆酶降解,并且运送它们的负荷跨过生物膜和血脑屏障(bbb)(对于评述,参见,例如,斯普奇(spuch)和纳瓦罗(navarro)《药物递送杂志》(journalofdrugdelivery),2011卷,文献标识码469679,第12页,2011.doi:10.1155/2011/469679)。可以从几种不同类型的脂质制造脂质体;然而,磷脂最常用来产生作为药物载体的脂质体。虽然当脂质膜与一种水性溶液混合时脂质体形成是自发的,但也可通过使用一个均质机、超声发生器、或挤出设备以振摇的形式施加力使其加速(对于评述,参见,例如,斯普奇(spuch)和纳瓦罗(navarro)《药物递送杂志》(journalofdrugdelivery),2011卷,文献标识码469679,第12页,2011.doi:10.1155/2011/469679)。可以将几种其他的添加剂添加到脂质体,以便修饰其结构和特性。例如,可以将胆固醇或鞘磷脂添加到脂质体混合物中,以便帮助稳定脂质体结构并且防止脂质体内部负荷物的泄漏。此外,从氢化卵磷脂酰胆碱或卵磷脂酰胆碱、胆固醇、和磷酸二鲸蜡脂制备脂质体,并且脂质体的平均囊泡大小被调整到约50至100nm。(对于评述,参见,例如,斯普奇(spuch)和纳瓦罗(navarro)《药物递送杂志》(journalofdrugdelivery),2011卷,文献标识码469679,第12页,2011.doi:10.1155/2011/469679)。常规的脂质体配制品主要由天然磷脂和脂质如1,2-二硬脂酰-sn-甘油基-3-磷脂酰胆碱(dspc)、鞘磷脂、卵磷脂酰胆碱和单唾液酸神经节苷酯构成。由于这种配制品仅仅由磷脂组成,脂质体配制品已经遇到了许多挑战,其中之一是在血浆中的不稳定性。已经作出战胜这些挑战的若干尝试,特别是在脂质膜的处理方面。这些尝试之一集中于胆固醇的处理。将胆固醇添加到常规配制品中减缓了封装的生物活性化合物到血浆中的迅速释放,或者添加1,2-二油酰基-sn-甘油基-3-磷酸乙醇胺(dope)增加稳定性(对于评述,参见,例如,斯普奇(spuch)和纳瓦罗(navarro)《药物递送杂志》(journalofdrugdelivery),2011卷,文献标识码469679,第12页,2011.doi:10.1155/2011/469679)。在一个特别有利的实施例中,特洛伊木马(trojanhorse)脂质体(也称为分子木马)是令人希望的并且方案可见于http://cshprotocols.cshlp.org/content/2010/4/pdb.prot5407.long。这些粒子允许转基因在血管内注射之后递送到整个脑。不受到限制,表面结合有特异性抗体的中性脂质粒子允许经由胞吞作用跨过血脑屏障。申请人假定利用特洛伊木马脂质体将核酸酶的crispr家族经由血管内注射递送到脑,这将允许全脑转基因动物,而不需要胚胎操作。对于在脂质体中的体内给药,可以考虑约1-5g的dna。在另一个实施例中,该crisprcas系统可以在脂质体中给药,如一种稳定的核酸-脂质粒子(snalp)(参见,例如,莫里西(morrissey)等人,《自然生物技术》(naturebiotechnology),第23卷,第8期,2005年8月)。考虑了约1、3或5mg/kg/天的靶向snalp中的特异性crisprcas的每日静脉注射。日治疗可以经过约三天,然后每周治疗持续约五周。在另一个实施例中,还考虑了通过以约1或2.5mg/kg的剂量静脉注射给药的封装有特异性crisprcas的snalp(参见,例如,齐默尔曼(zimmerman)等人,《自然通讯》(natureletters),第441卷,2006年5月4日)。该snalp配制品可含有以2:40:10:48的摩尔百分比的脂质3-n-[(w甲氧基聚(乙二醇)2000)氨甲酰]-1,2-二肉豆蔻氧基-丙胺(peg-c-dma)、1,2-二亚油基氧基-n,n-二甲基-3-氨基丙烷(dlindma)、1,2-二硬脂酰-sn-甘油基-3-磷酸胆碱(dspc)和胆固醇,(参见,例如,齐默尔曼(zimmerman)等人,《自然通讯》(natureletters),第441卷,2006年5月4日)。在另一个实施例中,已经证明稳定的核酸-脂质粒子(snalp)将分子有效递送到高度血管化的hepg2-衍生的肝脏肿瘤,但是不递送到血管化不良的hct-116衍生的肝脏肿瘤(参见,例如,李(li),《基因治疗》(genetherapy)(2012)19,775–780)。可以通过如下制备这些snalp脂质体:使用25:1的脂质/sirna比率和48/40/10/2的胆固醇/d-lin-dma/dspc/peg-c-dma的摩尔比,用二硬脂酰磷脂酰胆碱(dspc)、胆固醇和sirna配制d-lin-dma和peg-c-dma。生成的snalp脂质体在大小上为约80-100nm。在又另一个实施例中,snalp可以包含合成胆固醇(西格玛-奥德里奇公司(sigma-aldrich),圣路易斯,密苏里州,美国)、二棕榈酰磷脂酰胆碱(avantipolarlipids公司,阿拉巴斯特(alabaster),阿拉巴马州,美国)、3-n-[(w-甲氧基聚(乙二醇)2000)氨甲酰]-1,2-二肉豆蔻氧基丙基胺、和阳离子的1,2-二亚油基氧基-3-n,n二甲基氨基丙烷(参见,例如,盖斯伯特(geisbert)等人,《柳叶刀》(lancet)2010;375:1896-905)。例如可以考虑静脉推注给予约2mg/kg总crisprcas/剂的剂量。在又另一个实施例中,snalp可以包含合成胆固醇(西格玛-奥德里奇公司(sigma-aldrich))、1,2-二硬脂酰基-sn-甘油基-3-磷酸胆碱(dspc;avantipolarlipids公司)、peg-cdma、和1,2-二亚油基氧基-3-(n;n-二甲基)氨基丙烷(dlindma)(参见,例如,贾奇(judge),《临床研究杂志》(j.clin.invest.)119:661-673(2009))。用于体内研究的配制品可包含约9:1的最终脂质/rna质量比。已经由阿尔尼拉姆制药公司(alnylampharmaceuticals)的巴洛斯(barros)和格罗布(gollob)评论了rnai纳米药物的安全性(参见,例如,《先进药物递送评论》(advanceddrugdeliveryreviews)64(2012)1730–1737)。稳定的核酸脂质粒子(snalp)由四种不同的脂质构成—一种在低ph时为阳离子的可电离脂质(dlindma)、一种中性辅助脂质、胆固醇、和一种可扩散的聚乙二醇(peg)-脂质。该粒子直径大约为80nm并且在生理ph时是电中性的。在配制过程中,该可电离脂质用于在粒子形成过程中使脂质与阴离子sirna缩合。当在渐增的酸性内体条件下带正电荷时,该可电离的脂质还介导了snalp与内体膜的融合,从而使得能够将sirna释放到细胞质中。该peg-脂质在配制过程中使该粒子稳定并且减少聚集,随后提供中性的亲水性外部,以改进药代动力学特性。到目前为止,已经使用snalpsirna配制品开始两个临床项目。tekmira制药公司最近完成了snalp-apob在具有增高的ldl胆固醇的成年志愿者中的i期单剂量研究。apob主要在肝脏和空肠中表达,并且对于vldl和ldl的组装和分泌是必需的。十七位受试者接受了snalp-apob的单剂量(跨7个剂量水平的剂量递增)。没有肝脏毒性(预期为基于临床前研究的潜在剂量限制性毒性)的证据。处于最高剂量的(两位中的)一位受试者经历了与免疫系统刺激一致的流感样症状,于是做出结束该试验的决定。阿尔尼拉姆制药公司(alnylampharmaceuticals)已经类似地推出了aln-ttr01,其采用上述snalp技术并且靶向突变体和野生型ttr的肝细胞产生,从而治疗ttr淀粉样变性(attr)。已经描述了三个attr综合征:家族性淀粉样多发性神经病变(fap)和家族性淀粉样心肌病(fac)—两者均由ttr中的常染色体显性突变引起;以及由野生型ttr引起的老年全身性淀粉样变性(ssa)。最近在具有attr的患者中完成了aln-ttr01的安慰剂对照单剂量递增i期试验。向31位患者(23位用研究药物,8位用安慰剂)在0.01到1.0mg/kg(基于sirna)的剂量范围内以15分钟静脉内输注给予aln-ttr01。治疗耐受良好,其中在肝功能试验中没有显著增加。在≥0.4mg/kg时在23位患者的3位中注意到输注相关反应;对所有患者均做出减慢输注速率的反应并且所有患者继续参与研究。在处于1mg/kg的最高剂量(如根据临床前和nhp研究预期的)的两位患者中注意到血清细胞因子il-6、ip-10和il-1ra的最小与瞬时升高。在1mg/kg时观察到aln-ttr01的预期药理效应,即,血清ttr的降低。在又另一个实施例中,可以通过将阳离子脂质、dspc、胆固醇以及peg-脂质以40:10:40:10的摩尔比分别溶解在乙醇中来制作snalp(参见,森普尔(semple)等人,《自然生物技术》(natureniotechnology),第28卷,第2期,2010年2月,第172-177页)。将该脂质混合物添加到水性缓冲液中(50mm柠檬酸盐,ph4),混合至最终的乙醇和脂质浓度分别为30%(vol/vol)和6.1mg/ml,允许在22℃平衡2分钟,然后挤出。使用lipex挤出仪(北方脂质公司(northernlipids)),在22℃将水合脂质通过两层80nm孔径大小的过滤器(nuclepore)直到获得70–90nm直径的囊泡时为止,正如通过动态光散射分析测定的。这大致需要1–3次通过。将该sirna(溶解在50mm柠檬酸盐中,ph为4的含有30%乙醇的水溶液)以约5ml/min的速率在混合下添加到预平衡的(35℃)囊泡中。在达到0.06(wt/wt)的最终靶sirna/脂质比率之后,将该混合物在35℃另外孵育30分钟,以允许囊泡重组和该sirna的封装。然后去除乙醇并且通过透析或切向流渗滤用pbs(155mmnacl、3mmna2hpo4、1mmkh2po4,ph7.5)替换外部缓冲液。使用控制的逐步稀释法工艺将sirna封装在snalp中。kc2-snalp的脂质组分为以57.1:7.1:34.3:1.4的摩尔比使用的dlin-kc2-dma(阳离子脂质)、二棕榈酰磷脂酰胆碱(dppc;avantipolarlipids公司)、合成胆固醇(西格玛公司)和peg-c-dma。在形成加载的粒子后,将snalp在pbs中透析并且在使用之前通过0.2μm的滤膜消毒过滤。平均粒径为75–85nm,并且将90%-95%的sirna封装在脂质粒子内。用于体内测试的在配制品中的最终sirna/脂质比率是大约0.15(wt/wt)。在使用之前即刻将含有因子viisirna的lnp-sirna系统在无菌pbs中稀释到适当浓度,并且通过侧尾静脉以10ml/kg的总体积静脉内给药。这种方法可以类推到本发明的crisprcas系统。其他脂质其他阳离子脂质,如氨基脂质2,2-二亚油基-4-二甲基氨基乙基-[1,3]-二氧戊环(dlin-kc2-dma)可以类似于sirna地用来封装crisprcas(参见,例如,加雅拉曼(jayaraman),《德国应用化学》(angew.chem.int.ed.)2012,51,8529-8533)。可以考虑具有下列脂质组成的预成型囊泡:分别处于摩尔比40/10/40/10的氨基脂质、二硬脂酰卵磷脂(dspc)、胆固醇和(r)-2,3-双(十八烷氧基)丙基-1-(甲氧基聚(乙二醇)2000)丙基碳酸酯(peg-脂质),以及大约0.05(w/w)的fviisirna/总脂质比率。为了确保在70–90nm范围内的窄粒径分布以及0.11_0.04(n=56)的低多分散性指数,可以在添加crisprcasrna之前将粒子通过80nm的膜挤出达三次。可以使用含有高度有效的氨基脂质16的粒子,其中四种脂质组分16、dspc、胆固醇和peg-脂质的摩尔比(50/10/38.5/1.5)可以被进一步优化,以增强体内活性。迈克尔sd科尔曼(michaelsdkormann)等人(“在小鼠中递送化学修饰的mrna之后治疗蛋白的表达)("expressionoftherapeuticproteinsafterdeliveryofchemicallymodifiedmrnainmice):《自然生物技术》(naturebiotechnology),第29卷,第154–157页,(2011)2011年1月9日在线公开)描述了脂质包膜用于递送rna的用途。脂质包膜的用途在本发明中也是优选的。在另一个实施例中,脂质可以与本发明的crisprcas系统配制在一起而形成脂质纳米粒子(lnp)。脂质包括但不限于,dlin-kc2-dma4、c12-200和辅助脂质二硬脂酰磷脂酰胆碱、胆固醇和peg-dmg,可以使用自发囊泡形成程序将其与crisprcas而不是sirna一起配制(参见,例如,novobrantseva,《分子治疗–核酸》(moleculartherapy–nucleicacids)(2012)1,e4;doi:10.1038/mtna.2011.3)。组分摩尔比可以是约50/10/38.5/1.5(dlin-kc2-dma或c12-200/二硬脂酰磷脂酰胆碱/胆固醇/peg-dmg)。在dlin-kc2-dma和c12-200脂质纳米粒子(lnp)的情况下,最终脂质:sirna重量比可以分别是约12:1和9:1。配制品可以具有约80nm的平均粒径,具有>90%的包覆效率。可以考虑3mg/kg的剂量。tekmira公司在美国和国外具有一组针对lnp和lnp配制品的不同方面的大约95个同族专利(参见,例如,美国专利号7,982,027;7,799,565;8,058,069;8,283,333;7,901,708;7,745,651;7,803,397;8,101,741;8,188,263;7,915,399;8,236,943和7,838,658以及欧洲专利号1766035;1519714;1781593和1664316),所有这些专利均可用于和/或适用于本发明。该crisprcas系统可以封装在plga微球中进行递送,例如进一步描述于美国公开申请20130252281和20130245107以及20130244279(转让给modernatherapeutics公司)中,其涉及包含修饰的核酸分子的组合物的配制品方面,所述核酸分子可以编码一种蛋白质、一种蛋白质前体、或该蛋白质或蛋白质前体的部分或完全加工形式。该配制品具有50:10:38.5:1.5-3.0(阳离子脂质:融合脂质:胆固醇:peg脂质)的摩尔比。该peg脂质可以选自,但不限于peg-c-domg、peg-dmg。该融合脂质可以是dspc。还参见,施鲁姆(schrum)等人,“工程化核酸的递送和配制”(deliveryandformulationofengineerednucleicacids),美国公开申请20120251618。nanomerics公司的技术着手解决针对广泛治疗学的生物利用度挑战,包括基于低分子量疏水药物、肽以及核酸(质粒、sirna、mirna)的治疗学。该技术已经证明了明显优势的特异性的给药途径包括口服途径、跨血脑屏障的运送、向实体瘤以及眼部的递送。参见,例如,马萨(mazza)等人,2013,《acs纳米》(acsnano.)2013年2月26日;7(2):1016-26;乌切克布(uchegbu)和秀(siew),2013,《制药科学杂志》(jpharmsci.)102(2):305-10和拉拉特萨(lalatsa)等人,2012,《控释杂志》(jcontrolrelease),2012年7月20日;161(2):523-36。美国专利公开号20050019923描述了用于向哺乳动物身体递送生物活性分子例如多核苷酸分子、肽和多肽和/或药剂的阳离子树状聚合物。这些树状聚合物适合于将生物活性分子的递送靶向到例如肝、脾、肺、肾或心脏。树状聚合物是从简单的支化单体单元以逐步方式制备的3维大分子,其性质和功能性可以容易地进行控制和改变。经由向多功能核(发散式合成法)或朝向多功能核(收敛式合成法)重复加成结构单元(buildingblocks)而合成树状聚合物,并且结构单元的3维壳的各次加成导致更高级别的树状聚合物的形成。聚丙烯亚胺树状聚合物从二氨基丁烷核开始,通过对伯胺的丙烯腈的双迈克尔加成反应向其上添加两倍数目的氨基基团,继之为腈的氢化。这导致氨基基团的加倍。聚丙烯亚胺树状聚合物含有100%的可质子化氮以及高达64个末端氨基基团(5级,dab64)。可质子化基团常常为能够在中性ph时接受质子的胺基。树状聚合物作为基因递送剂的用途在很大程度上集中于聚酰胺-胺和含磷化合物的用途,其中胺/酰胺的混合物或n--p(o2)s分别作为缀合单元,没有报道关于更低级别的聚丙烯亚胺树状聚合物用于基因递送的用途的工作。还研究了作为ph敏感的控制释放系统的聚丙烯亚胺树状聚合物,其用于药物递送以及当被外周氨基酸基团化学修饰时用于它们的客体分子的封装。还研究了聚丙烯亚胺树状聚合物的细胞毒性和与dna的相互作用以及dab64的转染效力。美国专利公开号20050019923是基于与早期报道相反的观察:阳离子树状聚合物例如聚丙烯亚胺树状聚合物展示出适当的特性,如,特异性靶向和低毒性,其用于在生物活性分子如基因材料的靶向递送中使用。另外,阳离子树状聚合物的衍生物也展示出适当的用于生物活性分子的靶向递送的特性。还参见,《生物活性聚合物》(bioactivepolymers)、美国公开申请20080267903,其披露了“不同的聚合物,包括阳离子聚胺聚合物和树枝状聚合物,其显示具有抗增殖活性,并且因此可用于治疗其特征为不希望的细胞增殖的失调,如新生物和肿瘤、炎性失调(包括自身免疫性失调)、银屑病和动脉粥样硬化。这些聚合物可以作为活性剂单独使用、或者作为其他治疗剂(如药物分子或用于基因治疗的核酸)的递送载体。在这样的情况下,这些聚合物自身固有的抗肿瘤活性可以补足有待递送的药剂的活性。超电荷蛋白超电荷蛋白是一类具有非常高的正或负的理论净电荷的工程化的或天然存在的蛋白质。超负电荷蛋白和超正电荷蛋白两者都展示出显著的抵抗热诱导或化学诱导的聚集的能力。超正电荷蛋白还能够渗透哺乳动物细胞。使负荷物与这些蛋白质结合,如质粒dna、sirna、或其他蛋白质,可使得这些大分子到体外和体内的哺乳动物细胞中的功能递送成为可能。刘大卫实验室(davidliu’slab)在2007年报道了超电荷蛋白的建立和表征(劳伦斯(lawrence)等人,2007,《美国化学会志》(journaloftheamericanchemicalsociety)129,10110–10112)。sirna和质粒dna到哺乳动物细胞中的非病毒递送对于研究和治疗应用都是有价值的(阿肯克(akinc)等人,2010,《自然生物技术》(nat.biotech.)26,561–569)。纯化的+36gfp蛋白(或其他超正电荷蛋白)与sirna在适当的无血清培养基中混合并且允许在添加到细胞中之前复合。在这个阶段的血清的包含将会抑制超电荷蛋白-sirna复合物的形成和降低治疗效果。已经发现以下方案对于多种细胞系是有效的(麦克诺顿(mcnaughton)等人,2009,《美国国家科学院院刊》(proc.natl.acad.sci.usa)106,6111–6116)。然而,应当进行改变蛋白质和sirna剂量的先导实验来优化用于特异性细胞系的程序。(1)在治疗前一天,以1x105个细胞/孔铺板于48孔板中。(2)在治疗当天,在无血清的培养基中稀释纯化的+36gfp蛋白直到终浓度200nm。添加sirna到50nm的终浓度。涡旋混合并且在室温孵育10分钟。(3)在孵育过程中,抽吸培养基离开细胞并且再次用pbs洗涤。(4)在孵育+36gfp和sirna之后,向细胞加入蛋白质-sirna复合物。(5)将细胞与复合物在37c孵育4小时。(6)在孵育之后,抽出培养基并且用20u/ml的肝素pbs洗涤三次。用含血清培养基另外孵育细胞48小时或更长,这取决于用于敲低的试验。(7)通过免疫印迹、qpcr、表型分析、或其他适当的方法分析细胞。刘大卫实验室(davidliu’slab)已经进一步发现+36gfp在一些列细胞中是一种有效的质粒递送试剂。由于质粒dna是一种比sirna大的负荷物,有效复合质粒需要成比例地更大的+36gfp蛋白。为了有效质粒递送,申请人已经开发了一种带有c末端ha2肽标签的+36gfp变体,这种肽是一种已知的从流感病毒血凝素蛋白衍生的内体破坏肽。下列方案在多种细胞中是有效的,但是如上所述,建议针对特异性细胞系和递送应用优化质粒dna的超电荷蛋白的剂量。(1)在治疗前一天,以1x105/孔铺板于48孔板中。(2)在治疗当天,在无血清的培养基中稀释纯化的gfp蛋白直到终浓度2mm。加入1mg的质粒dna。涡旋混合并且在室温孵育10分钟。(3)在孵育过程中,抽吸培养基离开细胞并且再次用pbs洗涤。(4)在孵育gfp和质粒dna之后,向细胞轻轻加入蛋白质-dna复合物。(5)将细胞与复合物在37孵育4小时。(6)在孵育之后,抽出培养基并且用pbs洗涤。在含血清培养基中孵育细胞,并且另外孵育24-48小时。(7)在适当时分析质粒递送(例如,通过质粒驱动的基因表达)。还参见,例如,麦克诺顿(mcnaughton)等人,《美国国家科学院院刊》(proc.natl.acad.sci.usa)106,6111-6116(2009);克罗尼肯(cronican)等人,《acs化学生物学》(acschemicalbiology)5,747-752(2010);克罗尼肯(cronican)等人,《化学与生物学》(chemistry&biology)18,833-838(2011);汤普森(thompson)等人,《酶学方法》(methodsinenzymology)503,293-319(2012);汤普森(thompson)d.b.,等人,《化学与生物学》(chemistry&biology)19(7),831-843(2012)。超电荷蛋白的这些方法可以使用和/或适用于本发明的crisprcas系统的递送。可植入装置在另一个实施例中,还考虑了用于crisprcas系统的递送的可植入装置。例如,美国专利公开20110195123披露了一种可植入医用装置,其局部地并且在延长的时期内洗脱药物,包括几种类型的这种装置、实施的治疗方式和植入方法。该装置包含聚合物基材,例如,用作装置主体的基质、以及药物,并且在一些情况下包含另外的支架材料,如金属或另外的聚合物,以及增强可见度和成像的材料。药物的选择是基于局部地并且在延长的时期内释放药物的优点,其中药物直接释放到患病区域的细胞外基质(ecm),所述患病区域如肿瘤、炎症、退化,或用于针对症状的目的,或者释放到受损的平滑肌细胞,或者用于预防。一种药物是基rna干扰(rnai)的基因沉默药物,包括但不限于sirna、shrna、或反义rna/dna、核酶和核苷类似物。因此,这个系统可以用于和/或适用于本发明的crisprcas系统。在一些实施例中,植入方式为用于包括近距离放射疗法和针吸活组织检查在内的其他治疗的、当今开发和使用的现有植入程序。在这样的情况下,在本发明中描述的新植入物的尺寸类似于初始植入物。典型地在相同的治疗程序中植物很少的装置。正如在美国专利公开20110195123中所述,提供了一种药物递送可植入或可插入系统,包括适用于空腔例如腹腔和/或其中药物递送系统未被锚定或附接的任何其他类型的给药,其包含生物稳定的和/或可降解的和/或生物可吸收的聚合物基材,其可以例如任选地是一种基质。应当指出的是术语“插入”也包括植入。该药物递送系统优选地被实施为如美国专利公开20110195123中描述的“装填器(loder)”。聚合物或多种聚合物是生物相容的,其结合一种药剂和/或多种药剂,使得药剂以控制的速率释放,其中该聚合物基材如基质的总体积,例如在一些实施例中是任选地并且优选地不大于容许达到该药剂的治疗水平的最大体积。作为一个非限制性实例,这样的体积优选在0.1m3到1000mm3的范围内,正如该药剂负荷的体积所要求的。该装填器任选地是更大的,例如当结合有一个其大小由功能性决定的装置时,例如而不限于,膝关节、宫内节育环或子宫颈环等等。在一些实施例中,该药物递送系统(用于递送该组合物)被设计为优选地采用可降解聚合物,其中主要释放机制是本体溶蚀(bulkerosion);或者在一些实施例中,使用了不可降解的、或缓慢降解的聚合物,其中主要释放机制是扩散而不是本体溶蚀,使得外部部分用作一种膜,而其内部部分用作一种储药池,该储药池在一个延长的时期内(例如从约一周到约几个月)实际上不受环境的影响。还可以任选地使用具有不同释放机制的不同聚合物的组合。在总药物释放期的重要时段期间,在表面处的浓度梯度优选地被维持有效地恒定,并且因此扩散速率是有效地恒定的(称为“零模式”扩散)。关于术语“恒定”,它意指优选地维持在治疗效果的低阈值以上的扩散速率,但是可以仍然任选地具有初期突释的特征和/或波动,例如增加和降低到一定程度。该扩散速率优选地被如此维持一个延长的时期,并且它被考虑为相对于一定的水平是恒定的,以便优化治疗有效期,例如该有效沉默期。该药物递送系统任选地并且优选地被设计为保护基于核苷酸的治疗剂免于降解,而不论化学性质或由于受试者体内的酶和其他因素的攻击。如描述于美国专利公开20110195123中的该药物递送系统任选地与传感和/或激活器具相关联,这些器具通过激活和/或加速/减速的无创和/或微创方法在该装置的植入之时和/或之后被操作,例如任选地包括但不限于热力加热和冷却、激光束和超声波,包括聚焦超声和/或rf(射频)方法或装置。根据美国专利公开20110195123的以下实施例,用于局部递送的部位可以任选地包括其特征为高度异常的细胞增殖、受到抑制的细胞凋亡的靶部位,包括肿瘤、活动性和或慢性炎症和感染,包括自身免疫性疾病状态、退化组织(包括肌肉和神经组织)、慢性疼痛、退行性部位,以及用于增强组织再生的骨折位置以及其他伤口位置,以及损伤的心肌、平滑肌和横纹肌。用于局部递送的部位还任选地可包括能够进行预防活动(包括怀孕)、预防感染和衰老的部位。用于植入该组合物的部位、或靶部位,优选地其特征为用于靶向局部递送的足够小的半径、面积和/或体积。例如,该靶部位任选地具有在从约0.1mm到约5cm范围内的直径。该靶部位的位置优选地针对最大治疗效力而选择。例如,该药物递送系统的组合物(任选地与如上所述的用于植入的装置一起)任选地并且优选地被植入在肿瘤环境或与之相关的血供之内或者附近。例如该组合物(任选地与该装置一起)任选地植入在胰脏、前列腺、乳房、肝脏之内或附近,通过乳头,在血管系统之内,等等。靶位置任选地选自下组,该组由以下各项组成(仅仅作为非限制性实例,因为任选地在身体内的任何部位可以适合于植入一个装填器):1.在退行性部位的脑,像在帕金森病或阿尔茨海默病中的基底神经节、白质和灰质;2.如在肌萎缩性脊髓侧索硬化症(als)的情况下的脊柱;3.预防hpv感染的子宫颈;4.活动性或慢性炎性关节;5.在银屑病情况下的真皮;6.用于止痛作用的交感神经部位和感觉神经部位;7.骨内植入;8.急性和慢性感染部位;9.阴道内;10.耳内--听觉系统、内耳的迷路、前庭系统;11.气管内;12.心内;冠状动脉、心外膜;13.膀胱;14.胆道系统;15.实质组织,包括且不限于肾脏、肝脏、脾脏;16.淋巴结;17.唾液腺;18.牙龈;19.关节内(进入关节);20.眼内;21.脑组织;22.脑室;23.空腔,包括腹腔(例如但不限于,卵巢癌);24.食管内以及25.直肠内。任选地,该系统(例如含有该组合物的装置)的插入与向在该靶部位和该部位附近的ecm注射材料有关,从而影响该靶部位和这个部位附近的ecm中的局部ph和/或温度和/或影响该药物的扩散和/或药物动力学的其他生物因素。任选地,根据一些实施例,所述药剂的释放可以与传感和/或激活器具相关联,这些器具通过激活和/或加速/减速的无创和/或微创方法和/或别的方法在插入之前和/或之时和/或之后被操作,所述方法包括激光束、放射、热力加热和冷却、和超声波,包括聚焦超声和/或rf(射频)方法或装置、以及化学激活剂。根据美国专利公开20110195123的其他实施例,该药物优选地包括基因沉默性生物rnai药物,例如,对于局限性癌症情况,在乳房、胰脏、脑、肾脏、膀胱、肺、以及前列腺中,如下文所述。而且,除了sirna之外的许多药物可适用于封装在装填器中,并且可以与本发明相关联,只要这样的药物可以被封装在装填器基材(例如像一种基质)中即可。这样的药物包括当今通过除了本发明之外的方法递送的经批准的药物,包括用于真菌感染的两性霉素b;例如用于骨髓炎中的抗生素;止痛剂,如麻醉药;例如在阿尔茨海默病或帕金森病中的抗退行性剂,在背痛的情况其在植入脊柱附近的一个装填器中。这样的系统可以用于和/或适用于递送本发明的crisprcas系统。例如,对于特殊应用,如预防平滑肌细胞(在支架置放程序中受损并且因此而倾向增殖)的生长和再生长,该药物可以任选地是使平滑肌细胞沉默(包括h19沉默)的sirna,或者为选自下组的药物,该组由以下各项组成:紫杉醇、雷帕霉素和雷帕霉素类似物。在这样的情况下,该装填器优选地是一种药物洗脱支架(des),其以恒定速率延长释放,或者是一个与该支架关联的单独植入的专用装置。这都可以用于和/或适用于本发明的crisprcas系统。作为特殊应用的另一个实例,神经肌肉退行性疾病由于异常基因表达而发生。沉默rna的局部递送可以具有干扰这样的异常基因表达的治疗特性。包括小分子药物和大分子在内的抗凋亡、抗炎和抗退行性药物的局部递送也可以任选地是治疗性的。在这样的情况下,该装填器用于以恒定速率和/或通过单独植入的专用装置延长释放。这都可以用于和/或适用于本发明的crisprcas系统。作为特殊应用的又另一个实例,用基因修饰剂治疗精神和认知障碍。用沉默rna的基因敲低是一个治疗选项。向中枢神经系统部位局部递送基于核苷酸的药剂的装填器是对于精神和认知障碍的治疗选项,这些精神和认知障碍包括但不限于,精神病、双极性疾病、神经性障碍和行为疾病(behavioralmaladies)。这些装填器也可以在特定脑部位进行植入时局部递送包括小分子药物和大分子的药物。这都可以用于和/或适用于本发明的crisprcas系统。作为特殊应用的另一个实例,在局部部位的先天性和/或适应性免疫介质的沉默使得能够预防器官移植排斥。用植入到移植器官和/或植入部位的装填器局部递送沉默rna和免疫调节试剂致使经由排斥性免疫细胞(如针对移植器官而被激活的cd8)的局部免疫抑制。这都可以用于和/或适用于本发明的crisprcas系统。作为特殊应用的另一个实例,包括vegf和血管生成素及其他在内的血管生长因子对于新血管形成是必需的。这些因子、肽、肽模拟物的局部递送或抑制它们的抑制物是一种重要的治疗模式;使阻抑物沉默以及用装填器局部递送刺激血管发生的这些因子、肽、大分子和小分子药物对于周围血管疾病、全身性血管疾病和心血管疾病是治疗性的。插入的方法,如植入,可以任选地已用于其他类型的组织植入和/或用于插入和/或用于组织取样,任选地在这样的方法中没有修改,或者可替代地任选地仅仅具有非重点修改。这样的方法任选地包括但不限于,近距离放射治疗方法、活组织检查、用和/或不用超声的内窥镜检查如ercp、进入脑组织的立体定向法、腹腔镜检查,包括用腹腔镜进入关节、腹腔器官、膀胱壁和体腔的植入。crispr酶mrna和指导rna也可以单独递送crispr酶mrna和指导rna。可以在该指导rna在给出时间以待crispr酶表达之前递送crispr酶mrna。可以在给予指导rna之前1-12小时(优选约2-6小时)给予crispr酶mrna。可替代地,可以一起给予crispr酶mrna和指导rna。有利地,可以在初始给予crispr酶mrna+指导rna之后1-12小时(优选约2-6小时)给予指导rna的第二加强剂量。为了实现基因组修饰的最有效水平,另外给予crispr酶mrna和/或指导rna可以是有用的。为了将毒性和脱靶效应降低到最低限度,重要的是控制所递送的crispr酶mrna和指导rna的浓度。crispr酶mrna和指导rna的最佳浓度可以通过在细胞或动物模型中测试不同的浓度并且使用深度测序分析在潜在的脱靶基因组座位处的修饰的范围而确定。例如,对于靶向人类基因组的emx1基因中的5’-gagtccgagcagaagaagaa-3’的指导序列,可以使用深度测序来评定在下列两个脱靶位点处的修饰水平,1:5’-gagtcctagcaggagaagaa-3’和2:5’-gagtctaagcagaagaagaa-3’。对于体内递送,应当选择产生最高的中靶修饰水平同时将脱靶修饰水平降低到最低限度的浓度。可替代地,为了将毒性水平和脱靶效应降低到最低限度,可以用一对靶向感兴趣部位的指导rna来递送crispr酶切口酶mrna(例如,具有d10a修饰的化脓链球菌cas9)。这两个指导rna需要如下间隔开。分别处于红色(单下划线)和蓝色(双下划线)的指导序列(这些实例是基于化脓链球菌cas9需要的pam)。该系统的进一步询问向申请人提供了5’突出端的证据(参见,例如,拉恩(ran)等人,《细胞》(cell)2013年9月12日;154(6):1380-9和2013年8月28日提交的美国临时专利申请序列号61/871,301)。申请人进一步鉴定了涉及当与两个指导rna结合时通过cas9切口酶突变体的有效切割的参数,并且这些参数包括但不限于该5’突出端的长度。在本发明的实施例中,该5’突出端具有至多200个碱基对、优选至多100个碱基对、或更优选至多50个碱基对。在本发明的实施例中,该5’突出端具有至少26个碱基对、优选至少30个碱基对、或更优选34-50个碱基对或1-34个碱基对。在本发明的其他优选方法中,指导邻近该第一靶序列的dna双链体的一条链的切割的第一指导序列以及指导邻近该第二靶序列的另一条链的切割的第二指导序列产生一个钝切口或一个3’突出端。在本发明的实施例中,该3’突出端具有至多150、100或25个碱基对,或至少15、10或1个碱基对。在优选的实施例中,该3’突出端具有1-100个碱基对。本发明的方面涉及被减少的基因产物或被进一步引入到编码基因产物的dna分子中的模板多核苷酸或通过允许两个5’突出端重新退火并连接而被精确切断的间插序列的表达、或被改变的基因产物的活性或功能、或被增加的基因产物的表达。在本发明的一个实施例中,该基因产物是一种蛋白质。只有产生在这些指导序列(大于-8bp的偏移)之间具有小于8bp重叠的5’突出端的sgrna对才能介导可检测的插入缺失信息。重要的是,当与野生型cas9配对时,在这些分析中使用的每个指导对于有效诱导插入缺失是重要的,表明这些指导对的相对位置在预测双切割活性中是最重要的参数。由于cas9n和cas9h840a切割dna的相对链,对于一个给定的sgrna对而言,用cas9h840a取代cas9n会导致该突出端类型的倒转。例如,将产生具有cas9n的5’突出端的一对sgrna原则上会相反地产生相应的3’突出端。因此,导致具有cas9n的3’突出端产生的sgrna对可以与cas9h840a一起使用,以产生一个5’突出端。出人意料地,申请人利用被设计为产生5’和3’突出端两者(偏移范围从–278到+58bp)的一组sgrna对测试了cas9h840a,但是不能观察插入缺失信息。可能需要进一步的工作来鉴定用于sgrna配对的必要的设计规则,以允许经由cas9h840a进行双切割。肝脏,前蛋白转化酶枯草杆菌蛋白酶kexin9(pcsk9)前蛋白转化酶枯草杆菌蛋白酶kexin9(pcsk9)是枯草杆菌蛋白酶丝氨酸蛋白酶家族的一个成员。pcsk9主要由肝脏表达并且对于肝细胞ldl受体表达的下调是关键的。血浆中的ldl-c水平在获得pcsk9功能突变的人体中高度上升,这些人被归类为患有严重的高胆固醇血症。因此,pcsk9是针对crispr的有吸引力的靶标。可以将pcs9k靶向的crispr配制在脂质粒子中并且例如以约15、45、90、150、250和400μg/kg静脉内给予(参见,例如,http://www.alnylam.com/capella/wp-content/uploads/2013/08/aln-pcs02-001-protocol-lancet.pdf)。贝利(bailey)等人的《分子医学杂志》(jmolmed(berl),1999年1月;77(1):244-9)披露了借助于离体体细胞基因治疗的胰岛素递送,其涉及从糖尿病患者移除非b细胞体细胞(例如成纤维细胞),并且将其进行体外遗传改变以产生和分泌胰岛素。这些细胞可在培养物中生长,并且将其作为胰岛素替代来源输回到供体。可以在植入之前评估以这种方式修饰的细胞,并且将储备原液冷冻保存。通过使用患者自身的细胞,该程序将避免免疫抑制的需要,并且克服了组织供应的问题,同时避免了细胞破坏的重现。离体体细胞基因治疗要求经得起多重转染并且服从受控增殖的、可取得的且稳健的细胞类型。与使用非b细胞体细胞相关联的特殊问题包括胰岛素原到胰岛素的加工、以及葡萄糖刺激的胰岛素原合成和调节性胰岛素释放的敏感性的赋予。使用成纤维细胞、垂体细胞、肾(cos)细胞和卵巢(cho)细胞的初步研究表明,可能遇到这些挑战,并且离体体细胞基因治疗提供了针对胰岛素替代治疗的可行途径。贝利(bailey)等人的系统可以使用和/或适用于递送到肝脏的本发明的crisprcas系统。萨托(sato)等人的方法(《自然生物技术》(naturebiotechnology),第26卷,2008年4月第4期,第431-442页)可以适用于递送到肝脏的本发明的crisprcas系统。萨托(sato)等人发现,在具有另外的致死性二甲基亚硝胺诱导的肝硬化小鼠中,用荷sirna的偶联维生素a的脂质体治疗以剂量依赖性方式和持续时间依赖性方式几乎完全解决了肝纤维化并且延长了存活期。含有摩尔比为4:3:3的作为阳离子脂质的o,o’-双十四酰-n-(a-三甲基铵基乙酰基)二乙醇胺氯化物(dc-6-14)、胆固醇和二油酰基磷脂酰乙醇胺的阳离子脂质体(lipotrust)(其显示对于在含血清条件下的体外和体内基因递送具有高转染效率)购自(北海道系统科学株式会社(hokkaidosystemscience))。使用冷冻干燥的空脂质体方法制造这些脂质体,并且通过在使用之前在涡旋之下将双蒸馏水(ddw)添加到该冻干的脂质混合物中配制为1mm的浓度(dc-16-4)。为了制备va偶联的脂质体,通过在1.5ml的管中在251c下将溶解在dmso中的200nmol的维生素a(视黄醇,西格玛公司)与脂质体悬浮液(作为dc-16-4100nmol)混合。为了制备携带sirnagp46的va偶联的脂质体(va-lip-sirnagp46),在25c搅拌下将sirnagp46溶液(580pmol/ml,在ddw中)添加到该视黄醇偶联的脂质体溶液中。sirna与dc-16-4的比率为1:11.5(mol/mol)并且sirna与脂质体的比率(wt/wt)为1:1。使用微分区系统(vivaspin2浓缩器30,000mwcopes,vivascience公司),将任何未被脂质体吸收的游离维生素a或sirna从脂质体制剂中分离。将该脂质体悬浮液添加到过滤器并且在1,500g在251c离心5分钟,进行3次。收集各个级分,并且将截留在过滤器中的物质用pbs复原,以实现所希望的用于体外或体内使用的剂量。每隔一天向大鼠给予0.75mg/kgsirna,注射三次。通过将如萨托(sato)等人所述的在脂质体中的约0.5到1mg/kg的crisprcasrna递送给人类,萨托(sato)等人的系统可用于和/或适用于递送到肝脏的本发明的crisprcas系统。针对用于递送sirna到体外和体内肝细胞两者的载体,已被罗泽马(rozema)等人命名为sirna动态多聚缀合物(sirnadynamicpolyconjugates)的罗泽马(rozema)等人的方法(pnas,2007年8月7日,第104卷,第32期)也可应用于本发明。动态多聚缀合物技术的关键特征包括膜活性聚合物、可逆地掩蔽这种聚合物的活性直到它到达内体的酸性环境时为止的能力、以及使这种修饰的聚合物和它的sirna负荷物在简单的低压静脉注射之后特异性靶向体内肝细胞的能力。通过使5’胺修饰的sirna与1个重量当量(wteq)的n-琥珀酰亚胺基-s-乙酰硫代乙酸酯(sata)试剂(皮尔斯(pierce)公司)和0.36wteq的在水中的nahco3在4℃反应16h合成sata修饰的sirna。然后通过加入9倍体积的乙醇并且在80℃孵育2h使修饰的sirna沉淀。将该沉淀重新悬浮在1xsirna缓冲液中(dharmacon公司)并且通过在260-nm波长处测量吸光度进行定量。通过添加1.5wt%smpt(皮尔斯(pierce)公司)修饰pbave(30mg/ml,在5mmtaps中,ph9)。在1小时的孵育之后,将0.8mg的smpt-pbave添加到400μl的含有5mmtaps的等渗葡萄糖溶液中(ph9)。向此溶液中添加50μg的sata修饰的sirna。对于其中[pbave]是恒定的剂量反应实验,添加不同量的sirna。然后将该混合物孵育16小时。然后向此溶液中加入5.6mg的hepes游离碱,接着加入3.7mg的cdm-nag与1.9mg的cdm-peg的混合物。然后在注射之前将该溶液在室温下孵育至少1小时。从经由使用草酰氯产生的酰基氯合成cdm-peg和cdm-nag。向该酰基氯加入1.1摩尔当量的聚乙二醇单甲醚(平均分子量450)以产生cdm-peg或(氨基乙氧基)乙氧基-2-(乙酰氨基)-2-脱氧-β-d-吡喃葡萄糖苷,从而产生cdm-nag。通过使用反相hplc以0.1%tfa水/乙腈梯度纯化终产物。向小鼠递送约25到50μg的sirna。例如,通过设想用于递送到人类的约50到约200mg剂量的crisprcas,罗泽马(rozema)等人的系统可应用于递送到肝脏的本发明的crisprcas系统。骨奥克斯(oakes)和利伯曼(lieberman)《临床矫形学及相关学科研究》(clinorthoprelatres.)2000年10月;(379增刊):s101-12)论述了向骨的基因递送。通过将基因转移到在特定解剖部位的细胞中,可以使用持续一段时间的生理学剂量的生长因子的骨诱导特性来促进更显著的愈合反应。该特定的解剖部位、骨的质量、以及软组织包膜,影响区域性基因治疗的靶细胞的选择。在骨诱导载体中递送到治疗部位的基因治疗载体产生了有希望的结果。若干研究者在动物模型中使用离体和体内区域性基因治疗显示出令人兴奋的结果。这样的系统可以用于和/或适用于递送到骨的本发明的crisprcas系统。脑用于脑的递送选项包括将处于dna或rna形式的crispr酶和指导rna封装到脂质体中并且结合到用于跨血脑屏障(bbb)递送的分子特洛伊木马上。分子特洛伊木马已经显示对于将b-gal表达载体递送到非人类灵长动物的脑中是有效的。可以使用相同的途径来递送含有crispr酶和指导rna的递送载体。例如,夏cf(xiacf)和博阿多rj(boadorj)、帕德瑞吉wm(pardridgewm)“使用亲和素-生物素技术经由人胰岛素受体的sirna的抗体介导的靶向”("antibody-mediatedtargetingofsirnaviathehumaninsulinreceptorusingavidin-biotintechnology."《分子药理学》(molpharm.)2009年5月-6月;6(3):747-51.doi:10.1021/mp800194)描述了如何将短干扰rna(sirna)递送到培养物中以及体内的细胞,并且可以与受体特异性单克隆抗体(mab)和亲和素-生物素技术联合使用。作者还报道,就亲和素-生物素技术而言,由于在靶向mab与sirna之间的键是稳定的,在静脉给予该靶向的sirna之后,体内观察到在远处部位(例如脑)的rnai效应。张(zhang)等人《分子治疗学》(molther.)2003年1月;7(1):11-8.))描述了编码报道分子如萤光素酶的表达质粒如何被包封在一种“人工病毒”的内部,该“人工病毒”包含85nm的聚乙二醇化的免疫脂质体,其在体内与一种针对人胰岛素受体(hir)的单克隆抗体(mab)一起靶向到恒河猴脑。该hirmab使得携带外源基因的脂质体在静脉注射之后经历跨血脑屏障的转胞吞作用和跨神经元质膜的胞吞作用。与大鼠比较,在恒河猴的脑中的萤光素酶基因表达水平高50倍。通过组织化学和共聚焦显微镜检查都证明了β-半乳糖苷酶基因在灵长动物脑中的广泛神经元表达。作者指明,这种途径使得在24小时内的可逆成年转基因可行。因此,免疫脂质体的使用是优选的。这些可以与抗体结合靶向特定的组织或细胞表面蛋白。其他递送手段或rna也是优选的,如经由纳米粒子(卓(cho)s.、金伯格(goldberg)m.、松(son)s.、许(xu)q.、杨(yang)f.、梅(mei)y.、博加特廖夫(bogatyrev)s.、朗格(langer)r.和安德森(anderson)d.,“用于将小干扰rna递送到内皮细胞的脂质样纳米粒子”(lipid-likenanoparticlesforsmallinterferingrnadeliverytoendothelialcells),《先进功能材料》(advancedfunctionalmaterials),19:3112-3118,2010)或外泌体(施罗德(schroeder)a.、莱文斯(levins)c.、科特斯(cortez)c.、朗格(langer)r.、和安德森(anderson)d.,“用于sirna递送的基于脂质的纳米治疗剂”(lipid-basednanotherapeuticsforsirnadelivery),《内科学杂志》(journalofinternalmedicine),267:9-21,2010,pmid:20059641)。事实上,已经表明外泌体在递送sirna中特别有用,其为与crispr系统有一些相似之处的系统。例如,艾尔·安达卢西(el-andaloussi)等人“外泌体诱导的体外和体内sirna递送”(“exosome-mediateddeliveryofsirnainvitroandinvivo.”)《自然-实验手册》(natprotoc.)2012年12月;7(12):2112-26.doi:10.1038/nprot.2012.131。电子版2012年11月15日描述了外泌体对于跨不同的生物屏障的药物递送是有希望的工具并且可以用于体外和体内递送sirna。其途径在于通过转染一种包含与肽配体融合的外泌体蛋白的表达载体产生靶向外泌体。然后将这些外泌体纯化并且从转染的细胞上清液中表征,然后将sirna加载到外泌体中。根据本发明的递送或给药可以用外泌体进行,尤其是但不限于脑。维生素e(α-生育酚)可以与crisprcas结合并且连同高密度脂蛋白(hdl)一起递送到脑,例如以与乌诺(uno)等人完成的用于将短干扰rna(sirna)递送到脑的类似方式《人类基因治疗》(humangenetherapy)22:711-719(2011年6月)。经由用磷酸盐缓冲盐水(pbs)或游离tocsibace或toc-sibace/hdl充满的并且与脑灌注试剂盒3(braininfusionkit3)(alzet公司)连接的微渗透压泵(型号1007d;alzet公司,库比蒂诺(cupertino),ca)灌注小鼠。将一根脑灌注导管置于在正中线的前囱的后方约0.5mm,用于灌注到背侧第三脑室中。乌诺(uno)等人发现,通过相同的icv灌注方法,少至3nmol的toc-sirna与hdl可诱导相当程度的靶减少。可以考虑结合至α-生育酚的并且与hdl共同给予靶向脑的相似剂量的crisprcas用于本发明,例如,可以考虑靶向脑的约3nmol到约3μmol的crisprcas。邹(zou)等人(《人类基因治疗》(humangenetherapy22:465-475(2011年4月))描述了靶向pkcγ的短发夹rna的慢病毒介导的递送方法,其用于在大鼠脊髓中的体内基因沉默。邹(zou)等人通过鞘内导管给予约10μl的具有1x109个转导单位(tu)/ml的滴度的重组慢病毒。在本发明中可以考虑相似剂量的在靶向脑的慢病毒载体中表达的crisprcas用于人类,例如,可以考虑靶向脑的在具有1x109个转导单位(tu)/ml的滴度的慢病毒中的约10-50ml的crisprcas。靶向缺失、治疗应用基因的靶向缺失是优选的。例子示例于实例18中。因此优选的是涉及胆固醇生物合成、脂肪酸生物合成、以及其他代谢障碍的基因,编码涉及淀粉样蛋白以及其他疾病的错误折叠蛋白的基因,导致细胞转化的癌基因,潜伏病毒基因,以及导致负显性疾病(dominant-negativedisorder)、其他失调的基因。在这里作为示例,申请人提出使用病毒或纳米粒子递送系统向对其有需要的受试者或患者的肝脏、脑、眼、上皮、造血、或另一种组织进行crispr-cas系统的基因递送,该受试者或患者具有代谢障碍、淀粉样变性、蛋白聚积相关疾病、由于基因突变和基因异位所致的细胞转化、基因突变的负显性作用、潜伏病毒感染、以及其他相关症状。crispr-cas系统的治疗应用包括青光眼、淀粉样变性、和亨廷顿病。这些示例于实例20中,并且在其中描述的特征是单独地或以组合方式优选的。可以通过本发明治疗的多聚谷氨酰胺扩增疾病(polyglutamineexpansiondisease)的另一个实例包括脊髓小脑共济失调1型(sca1)。在小脑内注射后,表达短发夹rna的重组腺相关病毒(aav)载体深刻改进了动作协调、恢复了小脑形态并且溶解了在sca1小鼠的浦肯野细胞中的特征性脊髓小脑失调症蛋白1包涵体(参见,例如,夏(xia)等人,《自然医学》(naturemedicine),第10卷,第8期,2004年8月)。具体地说,aav1和aav5载体是优选的,并且约1x1012个载体基因组/ml的aav滴度是令人希望的。作为一个实例,可以治疗或预防由hiv-1引起的慢性感染。为了实现这个目标,可以产生靶向绝大多数hiv-1基因组的crispr-cas指导rna,同时考虑hiv-1株变体,以使覆盖面和效力最大。通过宿主免疫系统的常规腺病毒或慢病毒介导的感染,可以实现crispr-cas系统的递送。取决于途径,宿主免疫细胞可以是a)分离的、用crispr-cas转导的、选择的、并且重新引入该宿主中的或b)通过全身递送crispr-cas系统体内转导的。第一种途径允许产生抗性免疫群体,而第二种更可能靶向宿主体内的潜伏病毒储库。这在实例部分中更详细地论述。在另一个实例中,转让给桑加莫生物科学公司(sangamobiosciences,inc.)的美国专利公开号20130171732涉及抗hiv转基因到该基因组中的插入,其方法可应用于本发明的crisprcas系统。在另一个实施例中,该cxcr4基因可以被靶向并且转让给桑加莫生物科学公司(sangamobiosciences,inc.)的美国专利公开号20100291048的tale系统可以被修饰为本发明的crisprcas系统。转让给桑加莫生物科学公司(sangamobiosciences,inc.)美国专利公开号20130137104和和20130122591以转让给cellectis公司的美国专利公开号20100146651的方法通常可应用于转基因表达,因为它涉及修饰用于增加基因修饰的频率的次黄嘌呤鸟嘌呤磷酸核糖转移酶(hprt)座位。还可以设想的是,本发明产生一个基因敲除细胞文库。每个细胞可以有单基因被敲除。这被示例于实例23中。人们可以制作es细胞的文库,其中每个细胞有单基因被敲除,并且es细胞的整个文库将有每个单基因被敲除。此文库对于筛选细胞过程以及疾病的基因功能是有用的。为了制作这个细胞文库,人们可以将由诱导型启动子(例如,多西环素诱导型启动子)驱动的cas9整合到es细胞中。另外,人们可以将靶向特异性基因的单个指导rna整合到es细胞中。为了制作es细胞文库,人们可以简单地将es细胞与编码靶向人类基因组中的每个基因的指导rna的基因的文库混合。人们可以首先将单个bxb1attb位点引入到人es细胞的aavs1座位中。然后可以使用bxb1整合酶来促进单独的指导rna基因整合到aavs1座位中的bxb1attb位点中。为了促进整合,每个指导rna基因可以被包含在携带单个attp位点的质粒上。这样,bxb1将使基因组中的attb位点与含有指导rna的质粒上的attp位点重组。为了生成该细胞文库,人们可以采用具有整合的单个指导rna的细胞的文库,并且诱导cas9表达。在诱导之后,cas9介导由该指导rna指定的位点处的双链断裂。蛋白质治疗剂的长期给药可以引出针对该特殊蛋白质的不可接受的免疫反应。蛋白质药物的免疫原性可以归因于少数免疫显性辅助性t淋巴细胞(htl)表位。降低包含在这些蛋白质内的这些htl表位的mhc结合亲和力可以产生具有更低免疫原性的药物(腾格里s(tangris)等人“具有降低免疫原性的合理工程化的治疗蛋白”(“rationallyengineeredtherapeuticproteinswithreducedimmunogenicity”《免疫学杂志》(jimmunol.)2005年3月15日;174(6):3187-96。)在本发明中,可以具体地遵循首先由腾格里(tangri)等人针对促红细胞生成素提出并且随后开发的方法来降低该crispr酶的免疫原性。因此,定向演化或合理设计可以用来降低在宿主物种(人类或其他物种)中的crispr酶(例如cas9)的免疫原性。在实例28中,申请人使用了3种感兴趣的指导rna,并且这些指导rna能够将仅仅发生在一个小的细胞亚群中的有效体内dna切割可视化。实质上,申请人在这里示出的是靶向性体内切割。具体地说,这提供了也可以在高级生物(如哺乳动物)中实现特异性靶向的概念证明。还强调的多元方面在于,可以同时使用多重指导序列(即,分开的靶标)(从共同递送的意义上说)。换言之,申请人使用了多重途径,其中几种不同的序列被同时而独立地靶向。适合的用于产生aav(本发明的一种优选的载体)的方案的实例提供在实例34中。三核苷酸重复障碍是优选的有待治疗的病症。这些也示例于本文中。例如,美国专利公开号20110016540描述了使用锌指核酸酶基因修饰与三核苷酸重复扩增障碍相关的细胞、动物以及蛋白质。三核苷酸重复扩增障碍是复杂的、进行性的疾病,其涉及发育神经生物学并且常常影响认知以及感觉运动功能。三核苷酸重复扩增蛋白是一套多样化的蛋白质,这些蛋白质与发生三核苷酸重复扩增障碍的易感性、三核苷酸重复扩增障碍的存在、三核苷酸重复扩增障碍的严重性或其任何组合相关联。三核苷酸重复扩增障碍被分为由重复类型决定的两个类别。最常见的重复是三联体cag,当出现在一个基因的编码区中时,其编码氨基酸谷氨酰胺(q)。因此,这些障碍被称为多聚谷氨酰胺(polyq)障碍并且包括下列疾病:亨廷顿病(hd);脊延髓肌萎缩症(sbma);脊髓小脑性共济失调(sca型1、2、3、6、7、和17);以及齿状核红核苍白球丘脑下部核萎缩(drpla)。其余的三核苷酸重复扩增障碍不涉及cag三联体,或者该cag三联体不在该基因的编码区中,并且因此被称为非多聚谷氨酰胺障碍。非多聚谷氨酰胺障碍包括脆性x综合征(fraxa);脆性xe精神发育迟滞(fraxe);弗里德赖希共济失调(frda);肌强直性营养不良(dm);和脊髓小脑性共济失调(sca型8、和12)。与三核苷酸重复扩增障碍相关联的蛋白质典型地是基于三核苷酸重复扩增障碍相关性蛋白质与三核苷酸重复扩增障碍的实验性关联而选择的。例如,相对于没有三核苷酸重复扩增障碍的群体,在具有三核苷酸重复扩增障碍的群体中,与三核苷酸重复扩增障碍相关的蛋白质的产生率或循环浓度可以升高或降低。可以使用蛋白质组技术评估蛋白质水平差异,包括但不限于蛋白质印迹、免疫组织化学染色、酶联免疫吸附测定(elisa)以及质谱法。可替代地,可以使用基因组技术通过获得编码这些蛋白质的基因的基因表达谱而鉴定与三核苷酸重复扩增障碍相关的蛋白质,包括但不限于dna微阵列分析、基因表达系列分析(sage)以及定量实时聚合酶链式反应(q-pcr)。与三核苷酸重复扩增障碍相关联的蛋白质的非限制性实例包括ar(雄激素受体)、fmr1(脆性x精神发育迟滞1)、htt(亨廷丁)、dmpk(肌强直性营养不良蛋白激酶)、fxn(线粒体型共济失调蛋白)、atxn2(脊髓小脑共济失调蛋白2)、atn1(萎缩蛋白1)、fen1(片段结构特异内切核酸酶1)、tnrc6a(含有6a的三核苷酸重复)、pabpn1(多聚(a)结合蛋白,核1)、jph3(亲联蛋白3)、med15(介体复合物亚基15)、atxn1(脊髓小脑共济失调蛋白1)、atxn3(脊髓小脑共济失调蛋白3)、tbp(tata盒结合蛋白)、cacna1a(钙通道,电压依赖性,p/q型、α1a亚基)、atxn80s(atxn8相反链(非蛋白质编码))、ppp2r2b(蛋白磷酸酶2,调节亚基b,β)、atxn7(脊髓小脑共济失调蛋白7)、tnrc6b(含有6b的三核苷酸重复)、tnrc6c(含有6c的三核苷酸重复)、celf3(cugbp、elav样家族成员3)、mab21l1(mab-21-样1(秀丽隐杆线虫))、msh2(muts同源物2,结肠癌,无息肉病型1(大肠杆菌))、tmem185a(跨膜蛋白185a)、six5(six同源框5)、cnpy3(冠层3同源物(斑马鱼))、fraxe(脆性部位,叶酸型,罕见型,fra(x)(q28)e)、gnb2(鸟嘌呤核苷酸结合蛋白(g蛋白)、β多肽2)、rpl14(核糖体蛋白l14)、atxn8(脊髓小脑共济失调蛋白8)、insr(胰岛素受体)、ttr(转甲状腺素蛋白)、ep400(e1a结合蛋白p400)、gigyf2(grb10相互作用gyf蛋白2)、ogg1(8-氧鸟嘌呤dna糖基化酶)、stc1(斯钙素1)、cndp1(肌肽二肽酶1(金属肽酶m20家族))、c10orf2(染色体10开放阅读框2)、maml3智者基因样3(果蝇)、dkc1(先天性角化不全症1,角化不良蛋白)、paxip1(pax相互作用(具有转录激活域)蛋白1)、cask(钙/钙调蛋白依赖性丝氨酸蛋白激酶(maguk家族)、mapt(微管相关蛋白tau)、sp1(sp1转录因子)、polg(聚合酶(dna指导的),γ)、aff2(af4/fmr2家族,成员2)、thbs1(凝血酶敏感蛋白1)、tp53(肿瘤蛋白p53)、esr1(雌激素受体1)、cggbp1(cgg三联体重复结合蛋白1)、abt1(基本转录激活因子1)、klk3(激肽释放酶相关肽酶3)、prnp(朊病毒蛋白)、jun(jun癌基因)、kcnn3(钾中间/小电导钙激活通道,亚家族n,成员3)、bax(bcl2相关x蛋白)、fraxa(脆性部位,叶酸型,罕见型,fra(x)(q27.3)a(巨睾丸,精神发育迟滞))、kbtbd10(kelch重复和btb(poz)域包含蛋白10)、mbnl1(盲肌样(果蝇))、rad51(rad51同源物(reca同源物,大肠杆菌)(酿酒酵母))、ncoa3(核受体共激活因子3)、erda1(扩展重复结构域,cag/ctg1)、tsc1(结节性硬化1)、comp(软骨寡聚基质蛋白)、gclc(谷氨酰半胱氨酸连接酶,催化亚基)、rrad(ras相关关联糖尿病)、msh3(muts同源物3(大肠杆菌))、drd2(多巴胺受体d2)、cd44(cd44分子(印度血型))、ctcf(ccctc结合因子(锌指蛋白))、ccnd1(细胞周期蛋白d1)、clspn(扣蛋白同源物(非洲爪蟾))、mef2a(肌细胞增强因子2a)、ptpru(蛋白酪氨酸磷酸酶,受体型,u)、gapdh(3-磷酸甘油醛脱氢酶)、trim22(三基序蛋白22)、wt1(维尔姆斯瘤1)、ahr(芳香烃受体)、gpx1(谷胱甘肽过氧化物酶1)、tpmt(硫嘌呤甲基转移酶)、ndp(诺里病(假神经胶质瘤))、arx(无芒相关同源框)、mus81(mus81内切核酸酶同源物(酿酒酵母))、tyr(酪氨酸酶(眼皮肤白化病ia))、egr1(早期生长反应蛋白1)、ung(尿嘧啶dna糖基化酶)、numbl(麻木同源物(果蝇)样)、fabp2(脂肪酸结合蛋白2,肠)、en2(锯齿状同源框2)、crygc(晶状体蛋白,γc)、srp14(信号识别粒子14kda(同源alurna结合蛋白))、crygb(晶状体蛋白,γb)、pdcd1(程序性细胞死亡1)、hoxa1(同源框a1)、atxn2l(脊髓小脑共济失调蛋白2样)、pms2(pms2减数分裂后分离增加2样蛋白(酿酒酵母))、gla(半乳糖苷酶,α)、cbl(cas-br-m(鼠)热带逆转录病毒转化序列)、fth1(铁蛋白,重多肽1)、il12rb2(白细胞介素12受体,β2)、otx2(正小齿同源框2)、hoxa5(同源框a5)、polg2(聚合酶(dna指导的),γ2,辅助亚基)、dlx2(末端减少同源框2)、sirpa(信号调节蛋白α)、otx1(正小齿同源框1)、ahrr(芳香烃受体阻抑物)、manf(中脑星形胶质细胞衍生神经营养因子)、tmem158(跨膜蛋白158(基因/假基因))、以及ensg00000078687。与三核苷酸重复扩增障碍相关联的优选蛋白质包括htt(亨廷丁)、ar(雄激素受体)、fxn(线粒体型共济失调蛋白)、atxn3(脊髓小脑共济失调蛋白)、atxn1(脊髓小脑共济失调蛋白)、atxn2(脊髓小脑共济失调蛋白)、atxn7(脊髓小脑共济失调蛋白)、atxn10(脊髓小脑共济失调蛋白)、dmpk(肌强直性营养不良蛋白激酶)、atn1(萎缩蛋白1)、cbp(creb结合蛋白)、vldlr(极低密度脂蛋白受体)、及其任何组合。根据另一个方面,提供了一种用于治疗具有在cftr基因中的突变的受试者的基因治疗方法,并且该方法包括任选地经由一种生物相容性药用载体向受试者的细胞给予治疗有效量的crispr-cas基因治疗粒子。优选地,该靶dna包含突变δf508。通常,优选的是该突变被修复为野生型。在这种情况下,该突变是三个核苷酸的缺失,这些核苷酸包括在位置508处的针对苯丙氨酸(f)的密码子。因此,在这种情况下的修复要求将缺失密码子重新引入该突变体中。为了实施这个基因修复策略,优选的是将一个腺病毒/aav载体系统引入该宿主细胞、多个细胞或患者中。优选地,该系统包含cas9(或cas9切口酶)和指导rna连同腺病毒/aav载体系统,其包含含有f508残基的同源性修复模板。这可以经由较早论述的递送方法之一引入受试者。该crispr-cas系统可以由该cftrδ508嵌合指导rna指导。它靶向有待切割或切割的cftr基因组座位的特定位点。在切割之后,将修复模板经由同源重组插入切割位点中,从而修正导致囊性纤维化或引起囊性纤维化相关症状的缺失。可以采用用来指导rna递送并提供crispr系统的系统性引入的这个策略来靶向基因突变,以编辑或另外地操纵如那些在表b中的引起代谢障碍、肝脏、肾和蛋白质病和障碍的基因。基因组编辑本发明的crispr/cas9系统可以用来校正基因突变,先前使用talen和zfn尝试了这些突变,但是成功有限。例如,wo2013163628a2,《突变基因的基因校正》(geneticcorrectionofmutatedgenes),杜克大学的公开申请,描述了例如校正一种框移突变的努力,该框移突变引起提前终止密码子和可经由核酸酶介导的非同源末端连接进行校正的截短基因产物,该基因产物如引起迪谢内肌营养不良(“dmd”)的那些,迪谢内肌营养不良是一种隐性遗传的、致命的、x连锁疾病,其导致由于肌营养不良蛋白基因突变所致的肌肉变性。引起dmd的大多数肌营养不良蛋白突变是破坏该阅读框并且引起肌营养不良蛋白基因的提前翻译终止的外显子缺失。肌营养不良蛋白是一种细胞质蛋白,其提供负责调节肌细胞完整性和功能的细胞膜肌营养不良蛋白聚糖复合物的结构稳定性。如在此可互换地使用的肌营养不良蛋白基因或“dmd基因”是在座位xp21处的2.2兆碱基。初级转录测量了约2,400kb,其中成熟mrna为约14kb。79个外显子编码超过3500个氨基酸的蛋白质。在dmd患者中,外显子51常常接近破坏框的缺失并且已经在临床试验中被靶向基于寡核苷酸的外显子跳跃。对于外显子51跳跃化合物依替利森(eteplirsen)的临床试验最近报道了跨48周的显著功能益处,相比于基线具有47%的肌营养不良蛋白阳性纤维。外显子51的突变理想地适合于经由基于nhej的基因组编辑的持久校正。涉及从人类肌营养不良蛋白基因(dmd)切割靶序列的大范围核酸酶变体的转让给cellectis公司的美国专利公开号20130145487的方法也可以针对本发明的crisprcas系统进行修改。血液本发明还考虑了向血液递送该crispr-cas系统。瓦尔格伦(wahlgren)等人的血浆外泌体(《核酸研究》(nucleicacidsresearch),2012年,第40卷,第17期,e130)被较早描述并且利用为向血液递送该crisprcas系统。还考虑本发明的crisprcas系统用来治疗血红蛋白病,如地中海贫血和镰状细胞病。参见,例如,可以被本发明的crisprcas系统靶向的潜在靶标的国际专利公开号wo2013/126794。转让给cellectis公司的美国专利公开号20110225664、20110091441、20100229252、20090271881和20090222937,涉及crei变体,其中两个i-crei单体的至少一个具有至少两个取代,一个在分别位于从i-crei的位置26到40以及44到77的laglidadg核心域的两个功能性亚结构域的每一个中,能够从人白细胞介素2受体γ链(il2rg)基因切割dna靶序列的所述变体也称为普通细胞因子受体γ链基因或γc基因。在美国专利公开号20110225664、20110091441、20100229252、20090271881和20090222937中鉴定的靶序列可以用于本发明的crisprcas系统。由于在淋巴细胞t成熟方面的缺陷所致的严重联合免疫缺陷(scid)总是与淋巴细胞b的功能缺陷相关联(卡瓦扎纳-卡尔沃(cavazzana-calvo)等人,《医学年鉴》(annu.rev.med.),2005,56,585-602;费舍尔(fischer)等人,《免疫学评论》(immunol.rev.),2005,203,98-109)。总发病率估计为每75000个出生人数有1个。患有未经治疗的scid的患者遭受多重机会性微生物感染,并且通常不能活过一年。scid可以通过同种异体造血干细胞(来自家族供体)转移进行治疗。对于供体而言的组织相容性可在很大程度上变化。在腺苷脱氨酶(ada)缺陷的情况下,scid之一形成,患者可以通过注射酶重组腺苷脱氨酶进行治疗。由于已经显示ada基因在scid患者中突变(吉布勒特(giblett)等人,《柳叶刀》(lancet),1972,2,1067-1069),已经鉴定了几种其他的涉及scid的基因(卡瓦扎纳-卡尔沃(cavazzana-calvo)等人,《医学年鉴》(annu.rev.med.),2005,56,585-602;费舍尔(fischer)等人,《免疫学评论》(immunol.rev.),2005,203,98-109)。对于scid有四种主要原因:(i)最常见的scid形式,scid-x1(x连锁的scid或x-scid),是由il2rg基因的突变引起的,导致成熟t淋巴细胞和nk细胞的缺乏。il2rg编码γc蛋白(野口(noguchi)等人,《细胞》(cell),1993,73,147-157),其为至少五种白细胞介素受体复合物的一种共有组分。这些受体通过jak3激酶激活几种靶标(马基(macchi)等人,《自然》(nature),1995,377,65-68),其失活导致与γc失活相同的综合征;(ii)ada基因的突变导致嘌呤代谢缺陷,这对于淋巴细胞前体是致命的,进而导致b、t和nk细胞的准缺乏;(iii)v(d)j重组在免疫球蛋白和t淋巴细胞受体(tcr)的成熟中是一个重要步骤。在涉及这个过程的三种基因重组活化基因1和2(rag1和rag2)以及阿蒂米斯(artemis)中的突变导致成熟t和b淋巴细胞的缺乏;以及(iv)还报道了在涉及t细胞特异性信号传导的其他基因如cd45中的突变,虽然它们代表少数情形(卡瓦扎纳-卡尔沃(cavazzana-calvo)等人,《医学年鉴》(annu.rev.med.),2005,56,585-602;费舍尔(fischer)等人,《免疫学评论》(immunol.rev.),2005,203,98-109)。出于两个主要原因,自从它们的遗传基础已经鉴定以来,不同的scid形式已经成为基因治疗方法的范例(费舍尔(fischer)等人,《免疫学评论》(immunol.rev.),2005,203,98-109)。首先,是由于在所有血液疾病中可以设想离体治疗。造血干细胞(hsc)可以从骨髓恢复,并且在较少的细胞分裂中保持了它们的多能性。因此,可以将它们进行体外处理,然后重新注射到患者中,它们入驻骨髓中。其次,由于淋巴细胞的成熟在scid患者中受损,经校正的细胞具有选择性优势。因此,少量的校正细胞可恢复功能性免疫系统。这种假设借助于下列各项确认数次(i)与scid患者中的突变的逆转相关联的免疫功能的部分恢复(赫希霍恩(hirschhorn)等人,《自然-遗传学》(nat.genet.),1996,13,290-295;斯蒂芬(stephan)等人,《新英格兰医学杂志》(n.engl.j.med.),1996,335,1563-1567;布索(bousso)等人,《美国国家科学院院刊》(proc.natl.,acad.sci.usa),2000,97,274-278;和田(wada)等人,《美国国家科学院院刊》,2001,98,8697-8702;西小森(nishikomori)等人,《血液》(blood),2004,103,4565-4572),(ii)在造血细胞中的体外scid-x1缺陷的校正(坎多蒂(candotti)等人,《血液》,1996,87,3097-3102;卡瓦扎纳-卡尔沃(cavazzana-calvo)等人,《血液》,1996,《血液》,88,3901-3909;泰勒(taylor)等人,《血液》,1996,87,3103-3107;哈辛-贝(hacein-bey)等人,《血液》,1998,92,4090-4097),(iii)scid-x1的校正(苏戴斯(soudais)等人,《血液》,2000,95,3071-3077;蔡(tsai)等人,《血液》,2002,100,72-79),jak-3(邦廷(bunting)等人,《自然医学》(nat.med.),1998,4,58-64;邦廷等人,《人类基因治疗》(hum.genether.),2000,11,2353-2364)和rag2(耶茨(yates)等人,《血液》,2002,100,3942-3949)在动物模型中的体内缺陷以及(iv)基因治疗临床试验的结果(卡瓦扎纳-卡尔沃等人,《科学》,2000,288,669-672;艾尔迪(aiuti)等人,《自然医学》(nat.med.),2002;8,423-425;加斯帕(gaspar)等人,《柳叶刀》(lancet),2004,364,2181-2187)。转让给儿童医疗中心有限公司(children’smedicalcentercorporation)和哈弗大学(presidentandfellowsofharvardcollege)的美国专利公开号20110182867涉及经由bcl11a表达或活性抑制剂(如rnai和抗体)在造血祖细胞中调节胎儿血红蛋白(hbf)表达的方法和用途。在美国专利公开号20110182867中披露的靶标,如bcl11a,可以被本发明的crisprcas系统靶向,以便调节胎儿血红蛋白表达。对于另外的bcl11a靶标,还参见鲍尔(bauer)等人(《科学》(science)2013年10月11日:第342卷,第6155期,第253-257页)和许(xu)等人(《科学》2011年11月18日:第334卷,第6058期,第993-996页)。耳本发明还考虑了向一只或两只耳递送该crispr-cas系统。研究者正在调查基因治疗是否可以用来辅助当前的耳聋治疗—即,耳蜗植入物。耳聋常常由毛细胞的缺失或损害引起,其不能将信号传递到听觉神经元。在这样的情况下,可以使用耳蜗植入物对声音做出响应并且将电信号传输到神经细胞。但是,由于受损的毛细胞释放释放更少的生长因子,这些神经元常常退化并从耳蜗缩回。美国专利申请20120328580描述了例如使用一个注射器(例如单剂量注射器)将一种药物组合物注射到耳中(例如,耳部施用),如注射到耳蜗的腔(luminae)中(例如,中阶、前庭阶、和鼓阶)。例如,可以通过鼓室内注射(例如,进入中耳)、和/或注射到外耳、中耳、和/或内耳给予本文描述的一种或多种化合物。这样的方法在本领域中常规使用,例如,用于将甾体和抗生素给予到人耳中。例如,可以通过耳的圆窗或通过耳蜗囊进行注射。其他内耳施用方法是本领域已知的(参见,例如,索尔特(salt)和普兰特克(plontke),《今日药物发现》(drugdiscoverytoday),10:1299-1306,2005)。在另一种给药方式中,可以经由一根导管或泵原位施用该药物组合物。导管或泵可以,例如,将药物组合物导向到耳蜗腔或耳的圆窗和/或结肠腔中。适合于将本文所述的一种或多种化合物施用到耳(例如,人耳)中的示例性药物递送设备和方法由麦肯纳(mckenna)等人,(美国公开号2006/0030837)和雅各布森(jacobsen)等人,(美国专利号7,206,639)描述。在一些实施例中,可以在外科手术过程中将导管或泵定位在例如患者的耳中(例如,外耳、中耳和/或内耳)。在一些实施例中,可以将导管或泵定位在例如患者的耳中(例如,外耳、中耳和/或内耳),而不需要外科手术。可替代地或另外地,本文所述的一种或多种化合物可以与一种佩戴在外耳中的机械装置(如一种耳蜗植入物或助听器)联合使用。适合于与本发明一起使用的示例性耳蜗植入物由埃奇(edge)等人(美国公开号2007/0093878)描述。在一些实施例中,上述给药方式可以按照任何顺序组合并且可以是同时的或者散布的。可替代地或另外地,本发明可以根据食品药品监督管理局批准的任何方法给药,例如,如描述于《cder数据标准手册》(cderdatastandardsmanual),版本号004(在fda.give/cder/dsm/drg/drg00301.htm可获得)。一般而言,在美国专利申请20120328580中描述的这些细胞治疗方法可以用来体外促进细胞向或朝向内耳的成熟细胞类型(例如,毛细胞)的完全或部分分化。从这样的方法得到的细胞然后可以移植或植入到需要这种治疗的患者中。下面描述了实践这些方法所需的细胞培养方法,包括用于鉴定和选择适当细胞类型的方法、用于促进选定细胞的完全或部分分化的方法、用于鉴定完全或部分分化的细胞类型的方法、以及用于植入完全或部分分化的细胞的方法。适合于在本发明中使用的细胞包括但不限于,当与本文所述的一种或多种化合物例如体外接触时能够完全或部分分化成内耳的成熟细胞,例如,毛细胞(例如,内耳和/或外耳毛细胞)的细胞。能够分化成毛细胞的示例性细胞包括但不限于干细胞(例如,内耳干细胞、成体干细胞、骨髓源性干细胞、胚胎干细胞、间充质干细胞、皮肤干细胞、ips细胞、和脂肪来源干细胞)、祖细胞(例如,内耳祖细胞)、支持细胞(例如,戴特斯细胞(deiters'cell)、柱细胞、内指状细胞、顶盖细胞和汉森细胞)、和/或生殖细胞。干细胞用于替代内耳感觉细胞的用途描述于li等人(美国公开号2005/0287127)和李(li)等人(美国专利序列号11/953,797)。骨髓源性干细胞用于替代内耳感觉细胞的用途描述于埃奇(edge)等人的pct/us2007/084654。ips细胞描述于,例如,高桥(takahashi)等人,《细胞》(cell),第131卷,第5次发行,第861-872页(2007);高桥(takahashi)和山中(yamanaka),《细胞》126,663-76(2006);冲田(okita)等人,《自然》(nature)448,260-262(2007);余(yu)j.等人,《科学》(science)318(5858):1917-1920(2007);中川(nakagawa)等人,《自然生物技术》(nat.biotechnol.)26:101-106(2008);以及扎瑞斯(zaehres)和肖勒(scholer),《细胞》131(5):834-835(2007)。可以通过分析(例如,定性或定量)一种或多种组织特异型基因的存在来鉴定这种适合的细胞。例如,可以通过检测一种或多种组织特异型基因的蛋白质产物来检测基因表达。蛋白质检测技术包括使用针对适当抗原的抗体将蛋白质染色(例如,使用细胞提取物或全细胞)。在这种情况下,该适当抗原是该组织特异型基因表达的蛋白质产物。虽然在原则上可以标记第一抗体(即,结合该抗原的抗体),更普遍的是(并且改进可视化)使用针对该第一抗体的第二抗体(例如,一种抗igg)。这种第二抗体与荧光染料、或适当的用于比色反应的酶、或金珠(用于电子显微镜检查)、或者与生物素-亲和素系统结合,使得该一级抗体进而该抗原的位置可以被识别。通过将药物组合物直接应用于外耳,本发明的crisprcas分子可以递送到耳,其中组合物从美国公开申请20110142917修改而来。在一些实施例中,该药物组合物应用于耳道。递送至耳还可以称为听觉或耳递送。在一些实施例中,本发明的rna分子在脂质体或阳离子脂质体配制品等等中进行递送并且可以通过本领域技术人员熟知的方法进行制备。这样的方法描述于,例如,美国专利号5,593,972、5,589,466、和5,580,859中,将其通过引用并入本文。已经开发了专门针对增强和改进递送sirna到哺乳动物细胞中的递送系统,(参见,例如,沈(shen)等人《欧洲生化学会联合会快报》(febslet.)2003,539:111-114;夏(xia)等人,《自然生物技术》(nat.biotech.)2002,20:1006-1010;赖希(reich)等人,《分子视界》(mol.vision.)2003,9:210-216;索伦森(sorensen)等人,《分子生物学杂志》(j.mol.biol.)2003,327:761-766;路易斯(lewis)等人,《自然遗传学》(nat.gen.)2002,32:107-108以及西梅奥尼(simeoni)等人,nar2003,31,11:2717-2724)并且可以将其应用于本发明。最近,sirna已经成功用于抑制灵长动物中的基因表达(参见例如托伦蒂诺(tolentino)等人,《视网膜》(retina)24(4):660,它也可应用于本发明。齐(qi)等人披露了通过可应用于本发明的crisprcas系统的新蛋白质递送技术经由完整圆窗到内耳的有效sirna转染方法(参见,例如,齐(qi)等人,《基因治疗》(genetherapy)(2013),1-9)。具体地说,可将cy3标记的sirna经由完整圆窗渗透转染到内耳的细胞中(包括内和外毛细胞、壶腹嵴、椭圆囊斑和球囊斑)的tat双链rna结合结构域(tat-drbd)成功用于体内递送双链sirna,用于治疗各种内耳疾病和保留听觉功能。可以考虑约40μl的10mmrna作为施用至耳的剂量。根据瑞嘉利(rejali)等人(《听力研究》(hearres.)2007年6月;228(1-2):180-7),耳蜗植入物的功能借助于良好保留螺旋神经节神经元而得以改善,这些神经元是经由植入物电刺激的靶标,并且先前已经表明脑源性神经营养因子(bdnf)在实验性变聋的耳中增强了螺旋神经节的存活。瑞嘉利(rejali)等人测试了耳蜗植入物电极的改良设计,该电极包括被具有bdnf基因插入片段的病毒载体转导的成纤维细胞的涂层。为了完成这种类型的离体基因转移,瑞嘉利(rejali)等人用具有bdnf基因盒插入片段的腺病毒转导豚鼠,并且确定这些细胞分泌bdnf,进而将bdnf分泌细胞经由琼脂糖凝胶附着在该耳蜗植入物电极上,并且将该电极植入鼓阶中。瑞嘉利(rejali)等人确定,该bdnf表达电极与对照电极相比在植入48天之后能够保留显著更多的在耳蜗底回中的螺旋神经节神经元,并且证明了耳蜗植入物治疗与用于增强螺旋神经节神经元存活的离体基因转移相结合的可行性。这样一种系统可以应用于递送到耳的本发明的crisprcas系统。穆科吉(mukherjea)等人(《抗氧化剂与氧化还原信号》(antioxidants&redoxsignaling),第13卷,第5期,2010)证明,使用短干扰(si)rna敲低nox3消除了顺铂的耳毒性,正如保护ohc免于损害以及在听觉脑干反应(abr)中降低的阈值位移所证明。将不同剂量的sinox3(0.3、0.6、和0.9μg)施用至大鼠并且通过实时rt-pcr评估nox3表达。当与序列打乱的(scrambled)sirna的经鼓膜施用或未治疗的耳蜗比较时,使用的最低剂量的nox3sirna(0.3μg)未显示对nox3mrna的任何抑制。然而,与序列打乱的对照sirna相比,给予更高剂量的nox3sirna(0.6和0.9μg)降低了nox3表达。这样一种系统系统可应用于经鼓膜给药的本发明的crisprcas系统,其中向人类给药的crisprcas的剂量为约2mg到约4mg。荣格(jung)等人(《分子治疗》(moleculartherapy),第21卷,第4期,834-841,2013年4月)证明,在椭圆囊中的hes5水平在应用sirna之后降低,并且在这些椭圆囊中的毛细胞的数目显著大于对照处理之后的数目。这些数据表明,sirna技术可以用于诱导内耳中的修复和再生,并且notch信号通路对于特异性基因表达抑制是一个潜在有用的靶标。荣格(jung)等人将通过将无菌生理盐水加入冻干sirna而制备的8μg的hes5sirna以2μl体积注射到耳的前庭上皮。这样一种系统系统可应用于向耳的前庭上皮给药的本发明的crisprcas系统,其中向人类给药的crisprcas的剂量为约1到约30mg。眼本发明还考虑了向一只或两只眼耳递送该crispr-cas系统。在本发明的又另一个方面,该crispr-cas系统可以用来矫正几种基因突变引起的眼部缺陷,其进一步描述于《眼的遗传疾病》(geneticdiseasesoftheeye),第二次编辑,由伊莱亚斯(elias)i.特拉布勒西(traboulsi)编辑,牛津大学出版社,2012年。为了向眼部给药,慢病毒载体,尤其是马传染性贫血病毒(eiav)是特别优选的。在另一个实施例中,还考虑了基于马传染性贫血病毒(eiav)的最小非灵长类慢病毒载体,尤其是对于眼基因治疗而言(参见,例如,巴鲁谷安(balagaan),《基因医学杂志》(jgenemed)2006;8:275-285,2005年11月21日在《威利在线期刊》(wileyinterscience)(www.interscience.wiley.com),doi:10.1002/jgm.845)在线公开。考虑这些载体具有驱动靶基因表达的巨细胞病毒(cmv)启动子。前房内、视网膜下、眼内和玻璃体内注射菌均予以考虑(参见,例如,巴鲁谷安(balagaan),《基因医学杂志》(jgenemed)2006;8:275-285,2005年11月21日在《威利在线期刊》(wileyinterscience)(www.interscience.wiley.com),doi:10.1002/jgm.845)在线公开。可以在手术显微镜的辅助下进行眼内注射。为了视网膜下和玻璃体内注射,通过轻轻指压可以使眼睛突出,并且使用接触镜系统看见眼底,该接触镜系统包含在角膜上的一滴耦合介质溶液,角膜用玻璃显微镜载玻片盖玻片覆盖。为了视网膜下注射,安装在5-μl的汉密尔顿注射器上的10-mm34号针的尖端可以在直接可视化之下穿过巩膜赤道部上部朝向后极切向行进,直到该针的孔在视网膜下空间中可见时为止。然而,可以注射2μl的载体悬浮液以产生上部泡状视网膜脱离,从而证实视网膜下载体给药。这种方法建立了一种自我愈合的巩膜切开术,允许载体悬浮液保留在视网膜下空间中,直到它在该操作的48小时之内被rpe吸收为止。可以在半球下方重复这个操作以产生下部视网膜脱离。这种技术导致大约70%的感觉神经性视网膜和rpe暴露于该载体悬浮液。为了玻璃体内注射,针尖可以在角巩膜缘后方1mm穿过巩膜并且将2μl的载体悬浮液注射到玻璃体腔中。为了前房内注射,针尖可以通过角巩膜缘穿刺朝向中央角膜行进,并且可以注射2μl的载体悬浮液。为了前房内注射,针尖可以通过角巩膜缘穿刺朝向中央角膜行进,并且可以注射2μl的载体悬浮液。可以1.0-1.4×1010或1.0-1.4×109个转导单位(tu)/ml的滴度注射这些载体。在另一个实施例中,还考虑了一种经由视网膜下注射用于治疗湿型的年龄相关性黄斑变性的表达血管生成抑制蛋白(内皮抑素和血管抑素)的基于马传染性贫血病毒的慢病毒基因治疗载体(参见,例如,宾利(binley)等人,《人类基因治疗》(humangenetherapy)23:980-991(2012年9月))。这样一种载体可以改良为本发明的crispr-cas系统。每只眼可以用以1.1x105个转导单位/眼(tu/眼)以总体积100μl进行治疗。在另一个实施例中,对于递送至眼可以考虑e1-、部分e3-、e4-缺失的腺病毒载体。对患有晚期新生血管性年龄相关性黄斑变性(amd)的二十八位患者给予表达人色素上皮源性因子(adpedf.ll)的e1-、部分e3-、e4-缺失的腺病毒载体的单次玻璃体内注射(参见,例如,坎波基亚罗(campochiaro)等人,《人类基因治疗》(humangenetherapy)17:167-176(2006年2月))。研究了从106到109.5个粒子单位(pu)范围的剂量,没有与adpedf.ll有关的严重不良事件且没有剂量限制性毒性(参见,例如,坎波基亚罗(campochiaro)等人,《人类基因治疗》(humangenetherapy)17:167-176(2006年2月))。腺病毒载体介导的眼部基因转移显得是一种可行的用于治疗眼部病症的方法,并且可应用于该crisprcas系统。在另一个实施例中,rxi制药公司(rxipharmaceuticals)的系统可以用于和/或适用于将crisprcas递送至眼。在这个系统中,3μg的sd-rxrna的单次玻璃体内给药导致ppibmrna水平的序列特异性降低,持续14天。该系统可以应用于本发明的crisprcas系统,考虑向人类给药的剂量为约3到20mg的crispr。米林顿-华德(millington-ward)等人(《分子治疗》(moleculartherapy),第19卷,第4期,642-649,2011年4月)描述了腺相关病毒(aav)载体,其用来递送基于rna干扰(rnai)的视紫红质抑制剂和由于在rnai靶位点上的简并位置处的核苷酸改变而抵抗抑制的密码子修饰的视紫红质代替基因。由米林顿-华德(millington-ward)等人将6.0x108vp或1.8x1010vpaav的注射剂经视网膜下注射到眼中。米林顿-华德(millington-ward)等人的aav载体可以应用于本发明的crisprcas系统,考虑向人类给药的剂量为约2x1011到约6x1013vp。戴尔卡拉(dalkara)等人(《科学转化医学》(scitranslmed)5,189ra76(2013))还涉及用于形成一种aav载体的体内定向演化,该aav载体在将野生型缺陷型基因无损伤地注射到眼的玻璃体液中之后递送至整个视网膜。戴尔卡拉(dalkara)描述了7聚体肽展示文库和通过从aav1、2、4、5、6、8、和9的cap基因的dna改组构建的aav文库。将这些rcaav文库和在cag或rho启动子之下表达gfp的raav载体进行包装,并且通过定量pcr获得抗脱氧核糖核酸酶的基因组滴度。汇集这些文库,并且进行两轮演化,每轮演化包括初始文库多样化继之以三个体内选择步骤。在每个这样的步骤中,用2ml的碘克沙醇纯化的磷酸盐缓冲盐水(pbs)透析的文库以约1×1012vg/ml的基因组滴度对p30rho-gfp小鼠进行玻璃体内注射。戴尔卡拉(dalkara)等人的aav载体可以应用于本发明的crisprcas系统,考虑向人类给药的剂量为约1x1015到约1x1016vg/ml。在另一个实施例中,该视紫红质基因可以被靶向用于治疗色素性视网膜炎(rp),其中转让给桑加莫生物科学公司(sangamobiosciences,inc.)的美国专利公开号20120204282的系统可以依照本发明的crisprcas系统进行修饰。在另一个实施例中,针对从人类视紫红质基因切割靶序列的方法的转让给cellectis公司的美国专利公开号20130183282的方法也可以针对本发明的crisprcas系统进行修改。转让给台湾研究院(academiasinica)的美国专利公开号20130202678涉及用于治疗视网膜病变和视力威胁性眼科疾病(sight-threateningophthalmologicdisorders)的方法,这些方法涉及向眼的视网膜下或玻璃体内空间中递送puf-a基因(在眼组织的视网膜神经节和色素细胞中表达并且展示出独特的抗凋亡活性)。具体地说,令人希望的靶标是zgc:193933、prdm1a、spata2、tex10、rbb4、ddx3、zp2.2、blimp-1和htra2,均可以由本发明的crisprcas系统靶向。吴(wu)(《细胞—干细胞》(cellstemcell),13:659-62,2013)设计了一种指导rna,其将cas9导向到单个碱基突变,该突变在小鼠中引起白内障,其中它诱导dna切割。然后,在突变小鼠中,使用针对接合子修复机制给予的另一种野生型等位基因或寡核苷酸(oligos)校正断裂的等位基因的序列并且校正引起白内障的基因缺陷。美国专利公开号20120159653描述了使用锌指核酸酶基因修饰与黄斑变性(md)相关的细胞、动物以及蛋白质。黄斑变性(md)是老年人视力损害的主要原因,但也是儿童疾病如斯塔加特病(stargardtdisease)、索斯比基底营养不良(sorsbyfundus)、和儿童致死性神经变性疾病(在如婴儿期一般年幼的年龄就开始)的标志性症状。由于对视网膜的损害,黄斑变性导致视野中心(黄斑)的视力丧失。当前存在的动物模型并未概括该疾病的主要标志,因为它是在人类中观察到的。包含编码与md相关的蛋白质的突变基因的可得到的动物模型也产生高度可变的表型,使得针对人类疾病和治疗开发的翻译是有问题的。美国专利公开号20120159653的一个方面包括编辑任何编码与md相关的蛋白质的染色体序列,这些序列可以应用于本发明的crisprcas系统。典型地,基于与md相关的蛋白质与md病症的实验性关联,选择与md相关的蛋白质。例如,相对于缺乏md病症的群体,在具有md病症的群体中,与md相关的蛋白质的产生率或循环浓度可以升高或降低。可以使用蛋白质组技术评估蛋白质水平差异,包括但不限于蛋白质印迹、免疫组织化学染色、酶联免疫吸附测定(elisa)以及质谱法。可替代地,可以使用基因组技术通过获得编码这些蛋白质的基因的基因表达谱而鉴定与md相关的蛋白质,包括但不限于dna微阵列分析、基因表达系列分析(sage)以及定量实时聚合酶链式反应(q-pcr)。通过非限制性实例的方式,与md相关的蛋白质包括但不限以下蛋白质:(abca4)atp结合盒,亚家族a(abc1),成员4、achm1全色盲(视杆单色色盲)1、apoe,载脂蛋白e(apoe)、c1qtnf5(ctrp5),c1q和肿瘤坏死因子相关蛋白5(c1qtnf5)、c2补体,补体2(c2)、c3补体,补体(c3)、ccl2,趋化因子(c-c基序)配体2(ccl2)、ccr2,趋化因子(c-c基序)受体2(ccr2)、cd36分化抗原簇36、cfb,补体受体b、cfh,补体因子cfhh、cfhr1,补体因子h相关1、cfhr3,补体因子h相关3、cngb3环核苷酸门控通道β3、cp血浆铜蓝蛋白(cp)、crp,c反应蛋白(crp)、cst3半胱氨酸蛋白酶抑制剂c或半胱氨酸蛋白酶抑制剂3(cst3)、ctsd,组织蛋白酶d(ctsd)、cx3cr1,趋化因子(c-x3-c基序)受体1、elovl4,超长链脂肪酸延伸4、ercc6,切除修复交叉互补啮齿动物修复缺陷,互补群6、fbln5,抗衰老蛋白-5,fbln5,抗衰老蛋白5、fbln6,抗衰老蛋白6fscn2聚束蛋白(fscn2)、hmcn1,半椎蛋白1,hmcn1,半椎蛋白1、htra1,htra丝氨酸肽酶1(htra1),htra1、htra丝氨酸肽酶1、il-6,白细胞介素6、il-8,白细胞介素8、loc387715、假定蛋白、lekha1、含血小板白细胞c激酶底物同源性域家族a成员1(plekha1)、prom1,普罗敏蛋白1(prom1或cd133)、prph2,外周蛋白-2rpgr色素性视网膜炎gtp酶调节剂、serping1,丝氨酸蛋白酶抑制剂肽酶抑制剂,进化枝g,成员1(c1-抑制剂)、tcof1,糖蜜timp3金属蛋白酶抑制剂3(timp3)、tlr3toll样受体3。与md相关的其染色体序列被编辑的蛋白质的一致性可以并且应该变化。在优选的实施例中,与其染色体序列被编辑的md相关的蛋白质可以是atp结合盒、由abcr基因编码的亚家族a(abc1)成员4蛋白(abca4)、由apoe基因编码的载脂蛋白e蛋白(apoe)、由ccl2基因编码的趋化因子(c-c基序)配体2蛋白(ccl2)、由ccr2基因编码的趋化因子(c-c基序)受体2蛋白(ccr2)、由cp基因编码的血浆铜蓝蛋白蛋白(cp)、由ctsd基因编码的组织蛋白酶d蛋白(ctsd)、或由timp3基因编码的金属蛋白酶抑制剂3蛋白(timp3)。在一个示例性实施例中,该遗传修饰的动物是大鼠,并且与编码与md相关的蛋白质的编辑的染色体序列可以是:(abca4)atp结合盒nm_000350亚家族a(abc1),成员4、apoe,载脂蛋白enm_138828(apoe)、ccl2,趋化因子(c-cnm_031530基序)配体2(ccl2)、ccr2趋化因子(c-cnm_021866基序)受体2(ccr2)、cp血浆铜蓝蛋白(cp)nm_012532、ctsd组织蛋白酶d(ctsd)nm_134334、timp3金属蛋白酶nm_012886抑制剂3(timp3)。该动物或细胞可以包括1、2、3、4、5、6、7个或更多个破坏的编码与md相关的蛋白质的染色体序列以及零、1、2、3、4、5、6、7个或更多个编码破坏的与md相关的蛋白质的染色体整合序列。编辑的或整合的染色体序列可以被修饰为编码一种改变的与md相关的蛋白质。md相关染色体序列中的几种突变已经与md相关。在与md相关的染色体序列中的突变的非限制性实例包括可引起md的那些,包括在abcr蛋白中的:e471k(即,在位置471的谷氨酸被改变为赖氨酸)、r1129l(即,在位置1129处的精氨酸被改变为亮氨酸)、t1428m(即,在位置1428处的苏氨酸被改变为甲硫氨酸)、r1517s(即,在位置1517处的精氨酸被改变为丝氨酸)、i1562t(即,在位置1562处的异亮氨酸被改变为苏氨酸)、以及g1578r(即,在位置1578处的甘氨酸被改变为精氨酸);在ccr2蛋白中的:v64i(即,在位置192处的缬氨酸被改变为异亮氨酸);在cp蛋白质中的:g969b(即,在位置969处的甘氨酸被改变为天冬酰胺或天冬氨酸);在timp3蛋白中的:s156c(即,在位置156处的丝氨酸被改变为半胱氨酸)、g166c(即,在位置166处的甘氨酸被改变为半胱氨酸)、g167c(即,在位置167处的甘氨酸被改变为半胱氨酸)、y168c(即,在位置168处的酪氨酸被改变为半胱氨酸)、s170c(即,在位置170处的丝氨酸被改变为半胱氨酸)、y172c(即,在位置172处的酪氨酸被改变为半胱氨酸)以及s181c(即,在位置181处的丝氨酸被改变为半胱氨酸)。md相关基因和疾病的遗传变体的其他关联在本领域是已知的。心脏本发明还考虑了向心脏递送该crispr-cas系统。对于心脏,心肌热带腺相关病毒(aavm)优选的,尤其是在心脏中显示出优先基因转移的aavm41(参见,例如,林-扬加(lin-yanga)等人,pnas,3月10日,2009年,第106卷,第10期)。给药可以是全身性的或局部的。对于全身给药可以考虑约1-10x1014个载体基因组的剂量。还参见,例如,埃拉里奥(eulalio)等人(2012)《自然》(nature)492:376和索马森达拉姆(somasuntharam)等人(2013)《生物材料》(biomaterials)34:7790。例如,美国专利公开号20110023139描述了使用锌指核酸酶基因修饰与心血管疾病相关的细胞、动物以及蛋白质。心血管疾病通常包括高血压、心脏病发作、心力衰竭、以及中风和tia。涉及心血管疾病的任何染色体序列或由涉及心血管疾病的任何染色体序列编码的蛋白质都可以在本披露中描述的方法中加以利用。典型地,基于心血管相关蛋白与心血管疾病的发展的实验性关联,选择心血管相关蛋白。例如,相对于缺乏心血管障碍的群体,在具有心血管障碍的群体中,心血管相关蛋白的产生率或循环浓度可以升高或降低。可以使用蛋白质组技术评估蛋白质水平差异,包括但不限于蛋白质印迹、免疫组织化学染色、酶联免疫吸附测定(elisa)以及质谱法。可替代地,可以使用基因组技术通过获得编码这些蛋白质的基因的基因表达谱而鉴定心血管相关蛋白,包括但不限于dna微阵列分析、基因表达系列分析(sage)以及定量实时聚合酶链式反应(q-pcr)。作为举例,该染色体序列可以包括但不限于,il1b(白细胞介素1,β)、xdh(黄嘌呤脱氢酶)、tp53(肿瘤蛋白p53)、ptgis(前列腺素12(前列环素)合酶)、mb(肌红蛋白)、il4(白细胞介素4)、angpt1(血管生成素1)、abcg8(atp结合盒,亚家族g(白),成员8)、ctsk(组织蛋白酶k)、ptgir(前列腺素12(前列环素)受体(ip))、kcnj11(内向整流钾通道,亚家族j,成员11)、ins(胰岛素)、crp(c反应蛋白,正五聚蛋白相关的)、pdgfrb(血小板源生长因子受体,β多肽)、ccna2(细胞周期蛋白a2)、pdgfb(血小板源生长因子β多肽(猴肉瘤病毒(v-sis)癌基因同源物))、kcnj5(内向整流钾通道,亚家族j,成员5)、kcnn3(钾中间小电导钙激活通道,亚家族n,成员3)、capn10(卡配因10)、ptges(前列腺素e合酶)、adra2b(肾上腺素能,α-2b-,受体)、abcg5(atp结合盒,亚家族g(white)、成员5)、prdx2(过氧化物氧化还原酶2)、capn5(卡配因5)、parp14(聚(adp-核糖)聚合酶家族,成员14)、mex3c(mex-3同源物c(秀丽隐杆线虫))、ace血管紧张素i转化酶(肽基二肽酶a)1)、tnf(肿瘤坏死因子(tnf超家族,成员2))、il6(白细胞介素6(干扰素,β2))、stn(抑制素)、serpine1(丝氨酸蛋白酶抑制蛋白肽酶抑制剂,进化枝e(微管连接蛋白,纤溶酶原激活物抑制剂1型)、成员1)、alb(白蛋白)、adipoq(脂联素,含c1q和胶原蛋白域)、apob(载脂蛋白b(包括ag(x)抗原))、apoe(载脂蛋白e)、lep(瘦素)、mthfr(5,10-亚甲基四氢叶酸还原酶(nadph))、apoa1(载脂蛋白a-i)、edn1(内皮素1)、nppb(利钠肽前体b)、nos3(一氧化氮合酶3(内皮细胞))、pparg(过氧化物酶体增殖物活化受体γ)、plat(纤溶酶原激活物,组织)、ptgs2(前列腺素内过氧化物合酶2(前列腺素g/h合酶和环加氧酶))、cetp(胆固醇酯转移蛋白,血浆)、agtr1(血管紧张素ii受体,1型)、hmgcr(3-羟基-3-甲基戊二酸单酰辅酶a还原酶)、igf1(胰岛素样生长因子1(生长素调节素c))、sele(选择素e)、ren(肾素)、ppara(过氧化物酶体增殖物活化受体α)、pon1(对氧磷酶1)、kng1(激肽原1)、ccl2(趋化因子(c-c基序)配体2)、lpl(脂蛋白脂酶)、vwf(冯·维勒布兰德因子)、f2(凝血因子ii(凝血酶))、icam1(细胞间粘附分子1)、tgfb1(转化生长因子,β1)、nppa(利钠肽前体a)、il10(白细胞介素10)、epo(促红细胞生成素)、sod1(超氧化物歧化酶1,可溶性)、vcam1(血管细胞粘附分子1)、ifng(干扰素,γ)、lpa(脂蛋白,lp(a))、mpo(髓过氧化物酶)、esr1(雌激素受体1)、mapk1(丝裂原活化蛋白激酶1)、hp(触珠蛋白)、f3(凝血因子iii(促凝血酶原激酶,组织因子))、cst3(半胱氨酸蛋白酶抑制剂c)、cog2(寡聚高尔基复合体成分2)、mmp9(基质金属肽酶9(明胶酶b,92kda明胶酶,92kdai型v胶原酶))、serpinc1(丝氨酸蛋白酶抑制蛋白肽酶抑制剂,进化枝c(抗凝血酶)、成员1)、f8(凝血因子viii,促凝血成分)、hmox1(血红素加氧酶(解环)1)、apoc3(载脂蛋白c-iii)、il8(白细胞介素8)、prok1(前动力蛋白1)、cbs(胱硫醚-β-合酶)、nos2(一氧化氮合酶2,诱导型)、tlr4(toll样受体4)、selp(选择素p(颗粒膜蛋白140kda,抗原cd62))、abca1(atp结合盒,亚家族a(abc1)、成员1)、agt(血管紧张素原(丝氨酸蛋白酶抑制蛋白肽酶抑制剂,进化枝a,成员8))、ldlr(低密度脂蛋白受体)、gpt(谷丙转氨酶(丙氨酸转氨酶))、vegfa(血管内皮生长因子a)、nr3c2(细胞核受体亚家族3,型c,成员2)、il18(白细胞介素18(干扰素-γ-诱导因子))、nos1(一氧化氮合酶1(神经元的))、nr3c1(细胞核受体亚家族3,c组,成员1(糖皮质激素受体))、fgb(纤维蛋白原β链)、hgf(肝细胞生长因子(肝细胞生长因子a;分散因子))、il1a(白细胞介素1,α)、retn(抵抗素)、akt1(v-akt鼠科胸腺瘤病毒癌基因同源物1)、lipc(脂肪酶,肝脏的)、hspd1(热休克60kda蛋白1(伴侣蛋白))、mapk14(丝裂原活化蛋白激酶14)、spp1(分泌磷蛋白1)、itgb3(整合素,β3(血小板糖蛋白111a,抗原cd61))、cat(过氧化氢酶)、uts2(尾加压素2)、thbd(血栓调节蛋白)、f10(凝血因子x)、cp(血浆铜蓝蛋白(亚铁氧化酶))、tnfrsf11b(肿瘤坏死因子受体超家族,成员11b)、ednra(内皮素a型受体)、egfr(表皮生长因子受体(红白血病病毒(v-erb-b)癌基因同源物,鸟类的))、mmp2(基质金属肽酶2(明胶酶a,72kda明胶酶,72kdai型v胶原酶))、plg(纤维蛋白溶酶原)、npy(神经肽y)、rhod(ras同源物基因家族,成员d)、mapk8(丝裂原活化蛋白激酶8)、myc(v-myc骨髓细胞瘤病毒癌基因同源物(鸟类的))、fn1(纤连蛋白1)、cma1(糜酶1,肥大细胞)、plau(纤溶酶原激活物,尿激酶)、gnb3(鸟嘌呤核苷酸结合蛋白(g蛋白)、β多肽3)、adrb2(肾上腺素能,β-2-,受体,表面)、apoa5(载脂蛋白a-v)、sod2(超氧化物歧化酶2,线粒体的)、f5(凝血因子v(促凝血球蛋白原,不稳定因子))、vdr(维生素d(1,25-二羟维生素d3)受体)、alox5(花生四烯酸盐5-脂氧合酶)、hla-drb1(主要组织相容性复合物,i类i,drβ1)、parp1(聚(adp-核糖)聚合酶1)、cd40lg(cd40配体)、pon2(对氧磷酶2)、ager(晚期糖基化终末产物特异性受体)、irs1(胰岛素受体底物1)、ptgs1(前列腺素内过氧化物合酶1(前列腺素g/h合酶和环加氧酶))、ece1(内皮素转化酶1)、f7(凝血因子vii(血清凝血酶原转变加速因子))、urn(白细胞介素1受体拮抗剂)、ephx2(环氧化物水解酶2,细胞质的)、igfbp1(胰岛素样生长因子结合蛋白1)、mapk10(丝裂原活化蛋白激酶10)、fas(fas(tnf受体超家族,成员6))、abcb1(atp结合盒,亚家族b(mdr/tap),成员1)、jun(jun癌基因)、igfbp3(胰岛素样生长因子结合蛋白3)、cd14(cd14分子)、pde5a(磷酸二酯酶5a,cgmp特异性)、agtr2(血管紧张素ii受体,2型)、cd40(cd40分子,tnf受体超家族成员5)、lcat(卵磷脂胆甾醇酰基转移酶)、ccr5(趋化因子(c-c基序)受体5)、mmp1(基质金属肽酶1(间质胶原酶))、timp1(timp金属肽酶抑制剂1)、adm(肾上腺髓质素)、dyt10(肌张力障碍10)、stat3(信号传导和转录激活因子3(急性期反应因子))、mmp3(基质金属肽酶3(基质溶解素1,前白明胶酶))、eln(弹性蛋白)、usf1(上游转录因子1)、cfh(补体因子h)、hspa4(热休克70kda蛋白4)、mmp12(基质金属肽酶12(巨噬细胞弹性蛋白酶))、mme(膜金属肽链内切酶)、f2r(凝血因子ii(凝血酶)受体)、sell(选择素l)、ctsb(组织蛋白酶b)、anxa5(膜联蛋白a5)、adrb1(肾上腺素能,β-1-,受体)、cyba(细胞色素b-245,α多肽)、fga(纤维蛋白原α链)、ggt1(γ-谷氨酰转肽酶1)、lipg(脂肪酶,内皮的)、hif1a(缺氧诱导因子1,α亚基(碱性-螺旋-环-螺旋转录因子))、cxcr4(趋化因子(c-x-c基序)受体4)、proc(蛋白c(凝血因子va和viiia抑制因子)、scarb1(清道夫受体b类,成员1)、cd79a(cd79a分子,免疫球蛋白相关α)、pltp(磷脂转移蛋白)、add1(内收蛋白1(α))、fgg(纤维蛋白原γ链)、saa1(血清淀粉样蛋白a1)、kcnh2(电压门控钾离子通道,亚家族h(触角电位相关)、成员2)、dpp4(二肽基肽酶4)、g6pd(6-磷酸葡萄糖脱氢酶)、npr1(钠尿肽受体a/鸟苷酸环化酶a(心房钠尿肽受体a))、vtn(玻连蛋白)、kiaa0101(kiaa0101)、fos(fbj鼠科骨肉瘤病毒癌基因同源物)、tlr2(toll样受体2)、ppig(肽基脯氨酰异构酶g(亲环素g))、il1r1(白细胞介素1受体,i型)、ar(雄激素受体)、cyp1a1(细胞色素p450,家族1,亚家族a,多肽1)、serpina1(丝氨酸蛋白酶抑制蛋白肽酶抑制剂,进化枝a(α-1抗蛋白酶,抗胰蛋白酶),成员1)、mtr(5-甲基四氢叶酸高半胱胺酸甲基转移酶)、rbp4(视黄醇结合蛋白4,血浆)、apoa4(载脂蛋白a-iv)、cdkn2a(细胞周期蛋白依赖性激酶抑制剂2a(黑素瘤p16,抑制cdk4))、fgf2(成纤维细胞生长因子2(碱性))、ednrb(内皮素受体b型)、itga2(整合素,α2(cd49b,vla-2受体α2亚基))、cabin1(钙调神经磷酸酶结合蛋白1)、shbg(性激素结合球蛋白)、hmgb1(高迁移率族1)、hsp90b2p(热休克蛋白90kdaβ(grp94),成员2(假基因))、cyp3a4(细胞色素p450,家族3,亚家族a,多肽4)、gja1(间隙连接蛋白,α1,43kda)、cav1(小窝蛋白1,细胞质膜微囊蛋白,22kda)、esr2(雌激素受体2(erβ))、lta(淋巴毒素α(tnf超家族,成员1))、gdf15(生长分化因子15)、bdnf(脑源性神经营养因子)、cyp2d6(细胞色素p450,家族2,亚家族d,多肽6)、ngf(神经生长因子(β多肽))、sp1(sp1转录因子)、tgif1(tgfb-诱导因子同源框1)、src(v-src肉瘤(施密特-鲁平(schmidt-ruppin)a-2)病毒癌基因同源物(鸟类的))、egf(表皮生长因子(β-抑胃素))、pik3cg(磷酸肌醇-3-激酶,催化的,γ多肽)、hla-a(主要组织相容性复合物,i类,a)、kcnq1(电压门控钾通道,kqt样亚家族,成员1)、cnr1(大麻素受体1(脑))、fbn1(微纤维蛋白1)、chka(胆碱激酶α)、best1(卵黄状黄斑病蛋白1)、app(淀粉样蛋白β(a4)前体蛋白)、ctnnb1(连环蛋白(钙粘着蛋白关联蛋白),β1,88kda)、il2(白细胞介素2)、cd36(cd36分子(凝血酶敏感蛋白受体))、prkab1(蛋白激酶,amp活化的,β1非催化亚基)、tpo(甲状腺过氧化物酶)、aldh7a1(醛脱氢酶7家族,成员a1)、cx3cr1(趋化因子(c-x3-c基序)受体1)、th(酪氨酸羟化酶)、f9(凝血因子ix)、gh1(生长激素1)、tf(转铁蛋白)、hfe(血色素沉着病)、il17a(白细胞介素17a)、pten(磷酸酯酶与张力蛋白同源物)、gstm1(谷胱甘肽s-转移酶μ1)、dmd(肌营养不良蛋白)、gata4(gata结合蛋白4)、f13a1(凝血因子xiii,a1多肽)、ttr(转甲状腺素蛋白)、fabp4(脂肪酸结合蛋白4,脂肪细胞)、pon3(对氧磷酶3)、apoc1(载脂蛋白c-i)、insr(胰岛素受体)、tnfrsf1b(肿瘤坏死因子受体超家族,成员1b)、htr2a(5-羟色胺(血清素)受体2a)、csf3(集落刺激因子3(粒细胞))、cyp2c9(细胞色素p450,家族2,亚家族c,多肽9)、txn(硫氧还蛋白)、cyp11b2(细胞色素p450,家族11,亚家族b,多肽2)、pth(甲状旁腺素、csf2(集落刺激因子2(粒细胞-巨噬细胞))、kdr(激酶插入结构域受体受体(ai型ii受体酪氨酸激酶))、pla2g2a(磷脂酶a2,型iia(血小板,滑液))、b2m(β-2-微球蛋白)、thbs1(凝血酶敏感蛋白1)、gcg(胰高血糖素)、rhoa(ras同源物基因家族,成员a)、aldh2(醛脱氢酶2家族(线粒体的))、tcf7l2(转录因子7样2(t细胞特异性hmg盒))、bdkrb2(缓激肽受体b2)、nfe2l2(红细胞衍生核因子2样蛋白)、notch1(notch同源物1,易位相关的(果蝇))、ugt1a1(udp葡糖醛酸基转移酶1家族,多肽a1)、ifna1(干扰素,α1)、ppard(过氧化物酶体增殖物活化受体δ)、sirt1(长寿蛋白(沉默交配i型信息调控2同源物)1(酿酒酵母))、gnrh1(促性腺素释放激素1(黄体生成素释放激素))、pappa(妊娠相关血浆蛋白a,冠毛素1)、arr3(抑制蛋白3,视网膜的(x-抑制蛋白))、nppc(利钠肽前体c)、ahsp(α血红蛋白稳定蛋白)、ptk2(ptk2蛋白酪氨酸激酶2)、il13(白细胞介素13)、mtor(雷帕霉素机械靶(丝氨酸/苏氨酸激酶))、itgb2(整合素,β2(补体成分3受体3和4亚基))、gstt1(谷胱甘肽s-转移酶θ1)、il6st(白细胞介素6信号传导因子(gp130,抑瘤素m受体))、cpb2(羧肽酶b2(血浆))、cyp1a2(细胞色素p450,家族1,亚家族a,多肽2)、hnf4a(肝细胞核因子4,α)、slc6a4(溶质载体家族6(神经递质转运蛋白,血清素),成员4)、pla2g6(磷脂酶a2,型vi(细胞溶质的,钙依赖性))、tnfsf11(肿瘤坏死因子(配体)超家族,成员11)、slc8a1(溶质载体家族8(钠/钙交换蛋白),成员1)、f2rl1(凝血因子ii(凝血酶)受体样1)、akr1a1(醛酮还原酶家族1,成员a1(醛还原酶))、aldh9a1(醛脱氢酶9家族,成员a1)、bglap(骨γ-羧谷氨酸(gla)蛋白)、mttp(微粒体甘油三酯转移蛋白)、mtrr(5-甲基四氢叶酸-高半胱氨酸甲基转移酶还原酶)、sult1a3(磺基转移酶家族,细胞溶质的,1a,酚优选,成员3)、rage(肾肿瘤抗原)、c4b(补体成分4b(奇都血型)、p2ry12(嘌呤能受体p2y,g-蛋白偶联的,12)、rnls(肾酶,fad依赖性胺氧化酶)、creb1(camp应答元件结合蛋白1)、pomc(阿黑皮素原)、rac1(ras相关c3肉毒毒素底物1(rho家族,小gtp结合蛋白rac1))、lmna(核纤层蛋白nc)、cd59(cd59分子,补体调节蛋白)、scn5a(钠通道,电压门控,v型,α亚基)、cyp1b1(细胞色素p450,家族1,亚家族b,多肽1)、mif(巨噬细胞游走抑制因子(糖基化抑制因子))、mmp13(基质金属肽酶13(胶原酶3))、timp2(timp金属肽酶抑制剂2)、cyp19a1(细胞色素p450,家族19,亚家族a,多肽1)、cyp21a2(细胞色素p450,家族21,亚家族a,多肽2)、ptpn22(蛋白酪氨酸磷酸酶,非受体型22(淋巴样))、myh14(肌球蛋白,重链14,非肌肉)、mbl2(甘露糖结合凝集素(蛋白c)2,可溶性(调理素缺陷))、selplg(选择素p配体)、aoc3(胺氧化酶,含铜3(血管粘附蛋白1))、ctsl1(组织蛋白酶l1)、pcna(增殖细胞核抗原)、igf2(胰岛素样生长因子2(生长素调节素a))、itgb1(整合素,β1(纤连蛋白受体,β多肽,抗原cd29包括mdf2,msk12))、cast(钙蛋白酶抑制蛋白)、cxcl12(趋化因子(c-x-c基序)配体12(基质细胞衍生因子1))、ighe(免疫球蛋白恒定区ε)、kcne1(电压门控钾通道,isk相关家族,成员1)、tfrc(转铁蛋白受体(p90,cd71))、col1a1(胶原,i型,α1)、col1a2(胶原,i型,α2)、il2rb(白细胞介素2受体,β)、pla2g10(磷脂酶a2,型x)、angpt2(血管生成素2)、procr(蛋白c受体,内皮的(epcr))、nox4(nadph氧化酶4)、hamp(海帕西啶抗微生物肽)、ptpn11(蛋白酪氨酸磷酸酶,非受体1型1)、slc2a1(溶质载体家族2(易化葡萄糖转运蛋白),成员1)、il2ra(白细胞介素2受体,α)、ccl5(趋化因子(c-c基序)配体5)、irf1(干扰素调节因子1)、cflar(casp8和fadd样凋亡调节因子)、calca(降钙素相关多肽α)、eif4e(真核翻译起始因子4e)、gstp1(谷胱甘肽s-转移酶pi1)、jak2(janus激酶2)、cyp3a5(细胞色素p450,家族3,亚家族a,多肽5)、hspg2(类肝素硫酸蛋白聚糖2)、ccl3(趋化因子(c-c基序)配体3)、myd88(髓性分化原发反应基因(88))、vip(血管活性肠肽)、soat1(甾醇o-酰基转移酶1)、adrbk1(肾上腺素能,β,受体激酶1)、nr4a2(细胞核受体亚家族4,型a,成员2)、mmp8(基质金属肽酶8(中性白细胞胶原酶))、npr2(钠尿肽受体b/鸟苷酸环化酶b(心房钠尿肽受体b))、gch1(gtp环化水解酶1)、eprs(谷氨酰-脯氨酰-trna合成酶)、ppargc1a(过氧化物酶体增殖物活化受体γ,共激活剂1α)、f12(凝血因子xii(哈格曼因子))、pecam1(血小板/内皮细胞粘附分子)、ccl4(趋化因子(c-c基序)配体4)、serpina3(丝氨酸蛋白酶抑制蛋白肽酶抑制剂,进化枝a(α-1抗蛋白酶,抗胰蛋白酶),成员3)、casr(钙传感受体)、gja5(间隙连接蛋白,α5,40kda)、fabp2(脂肪酸结合蛋白2,肠)、ttf2(转录终止因子,rna聚合酶ii)、pros1(蛋白s(α))、ctf1(心脏营养素1)、sgcb(肌聚糖,β(43kda肌营养不良蛋白相关糖蛋白))、yme1l1(yme1样1(酿酒酵母))、camp(卡色力西丁抗微生物肽)、zc3h12a(含锌指ccch型12a)、akr1b1(醛酮还原酶家族1,成员b1(醛糖还原酶))、des(结蛋白)、mmp7(基质金属肽酶7(基质溶解因子,子宫的))、ahr(芳香烃受体)、csf1(集落刺激因子1(巨噬细胞))、hdac9(组蛋白去乙酰化酶9)、ctgf(结缔组织生长因子)、kcnma1(大电导钙激活钾通道,亚家族m,α成员1)、ugt1a(udp葡糖醛酸基转移酶1家族,多肽a复合体座位)、prkca(蛋白激酶c,α)、comt(儿茶酚-β-甲基转移酶)、s100b(s100calcium结合蛋白b)、egr1(早期生长反应蛋白1)、prl(催乳素)、il15(白细胞介素15)、drd4(多巴胺受体d4)、camk2g(钙-钙调蛋白依赖性蛋白激酶iiγ)、slc22a2(溶质载体家族22(有机阳离子转运蛋白),成员2)、ccl11(趋化因子(c-c基序)配体11)、pgf(b321胎盘生长因子)、thpo(血小板生成素)、gp6(糖蛋白vi(血小板))、tacr1(速激肽受体1)、nts(神经降压肽)、hnf1a(hnf1同源框a)、sst(生长抑素)、kcnd1(电压门控钾通道,shal相关亚家族,成员1)、loc646627(磷脂酶抑制剂)、tbxas1(血栓烷a合酶1(血小板))、cyp2j2(细胞色素p450,家族2,亚家族j,多肽2)、tbxa2r(血栓烷a2受体)、adh1c(醇脱氢酶1c(i类),γ多肽)、alox12(花生四烯酸盐12-脂氧合酶)、ahsg(α-2-hs-糖蛋白)、bhmt(甜菜碱同型半胱氨酸甲基转移酶)、gja4(间隙连接蛋白,α4,37kda)、slc25a4(溶质载体家族25(线粒体载体;腺嘌呤核苷酸转运蛋白),成员4)、acly(atp柠檬酸裂合酶)、alox5ap(花生四烯酸盐5-脂氧合酶-活化蛋白)、numa1(核有丝分裂器蛋白1)、cyp27b1(细胞色素p450,家族27,亚家族b,多肽1)、cysltr2(半胱氨酰白三烯受体2)、sod3(超氧化物歧化酶3,细胞外的)、ltc4s(白三烯c4合酶)、ucn(尿皮质素)、ghrl(胃促生长素/肥胖抑制素前体肽)、apoc2(载脂蛋白c-ii)、clec4a(c型凝集素结构域家族4,成员a)、kbtbd10(kelch重复和btb(poz)域包含蛋白)、tnc(腱生蛋白c)、tyms(胸苷酸合成酶)、shcl(shc(含src同源物2域)转化蛋白1)、lrp1(低密度脂蛋白受体相关蛋白1)、socs3(细胞因子信号传导抑制因子3)、adh1b(醇脱氢酶1b(i类),β多肽)、klk3(激肽释放酶相关肽酶3)、hsd11b1(羟基固醇(11-β)脱氢酶1)、vkorc1(生素k环氧化物还原酶复合体,亚基1)、serpinb2(丝氨酸蛋白酶抑制蛋白肽酶抑制剂,进化枝b(卵清蛋白),成员2)、tns1(张力蛋白1)、rnf19a(环指蛋白9a)、epor(促红细胞生成素受体)、itgam(整合素,αm(补体成分3受体3亚基))、pitx2(配对样同源域2)、mapk7(丝裂原活化蛋白激酶7)、fcgr3a(igg的fc片段,低亲和力111a,受体(cd16a))、lepr(瘦素受体)、eng(内皮糖蛋白)、gpx1(谷胱甘肽过氧化酶1)、got2(谷草转氨酶2,线粒体(天冬氨酸氨基转移酶2))、hrh1(组胺受体h1)、nr112(细胞核受体亚家族1,型i,成员2)、crh(促肾上腺皮质素释放激素)、htr1a(5-羟色胺(血清素)受体1a)、vdac1(电压依赖性阴离子通道1)、hpse(类肝素酶)、sftpd(表面活性蛋白d)、tap2(转运蛋白2,atp结合盒,亚家族b(mdr/tap))、rnf123(环指蛋白123)、ptk2b(ptk2b蛋白酪氨酸激酶2β)、ntrk2(神经营养酪氨酸激酶,受体,2型)、il6r(白细胞介素6受体)、ache(乙酰胆碱酯酶(yt血型))、glp1r(胰高血糖素样肽1受体)、ghr(生长激素受体)、gsr(谷胱甘肽还原酶)、nqo1(nad(p)h脱氢酶,醌1)、nr5a1(细胞核受体亚家族5,型a,成员1)、gjb2(间隙连接蛋白,β2,26kda)、slc9a1(溶质载体家族9(钠/氢交换体)、成员1)、maoa(单胺氧化酶a)、pcsk9(前蛋白转化酶枯草杆菌蛋白酶/kexin9型)、fcgr2a(igg的fc片段,低亲和力iia,受体(cd32))、serpinf1(丝氨酸蛋白酶抑制蛋白肽酶抑制剂,进化枝f(α-2抗纤维蛋白溶酶,色素上皮衍生因子),成员1)、edn3(内皮素3)、dhfr(二氢叶酸还原酶)、gas6(生长停滞特异蛋白6)、smpd1(鞘磷脂磷酸二酯酶1,酸溶酶体)、ucp2(解偶联蛋白2(线粒体的,质子载体))、tfap2a(转录因子ap-2α(激活增强子结合蛋白2α))、c4bpa(补体成分4结合蛋白,α)、serpinf2(丝氨酸蛋白酶抑制蛋白肽酶抑制剂,进化枝f(α-2抗纤维蛋白溶酶,色素上皮衍生因子),成员2)、tymp(胸苛酸磷酸化酶)、alpp(碱性磷酸酶,胎盘的(regan同工酶))、cxcr2(趋化因子(c-x-c基序)受体2)、slc39a3(溶质载体家族39(锌转运蛋白)、成员3)、abcg2(atp结合盒,亚家族g(white)、成员2)、ada(腺苷脱氨酶)、jak3(janus激酶3)、hspa1a(热休克70kda蛋白1a)、fasn(脂肪酸合酶)、fgf1(成纤维细胞生长因子1(酸性))、f11(凝血因子xi)、atp7a(atp酶,cu++转运的,α多肽)、cr1(补体成分(3b/4b)受体1(knops血型))、gfap(胶质细胞原纤维酸性蛋白)、rock1(rho相关,含卷曲螺旋蛋白激酶1)、mecp2(甲基cpg结合蛋白2(雷特综合征))、mylk(肌球蛋白轻链激酶)、bche(丁酰胆碱酯酶)、lipe(脂肪酶,激素敏感的)、prdx5(过氧化物氧化还原酶5)、adora1(腺苷a1受体)、wrn(维尔纳综合征,recq解旋酶样)、cxcr3(趋化因子(c-x-c基序)受体3)、cd81(cd81分子)、smad7(smad家族成员7)、lamc2(层粘连蛋白,γ2)、map3k5(丝裂原活化蛋白激酶激酶激酶5)、chga(嗜铬粒蛋白a(甲状旁腺分泌蛋白1))、iapp(胰岛淀粉样蛋白多肽)、rho(视紫红质)、enpp1(外核苷酸焦磷酸酶/磷酸二酯酶1)、pthlh(甲状旁腺激素样激素)、nrg1(神经调节蛋白1)、vegfc(血管内皮生长因子c)、enpep(谷氨酰基氨肽酶(氨基肽酶a))、cebpb(ccaat/增强子结合蛋白(c/ebp),β)、naglu(n-乙酰氨基葡糖苷酶,α-)、f2rl3(凝血因子ii(凝血酶)受体样3)、cx3cl1(趋化因子(c-x3-c基序)配体1)、bdkrb1(缓激肽受体b1)、adamts13(具有凝血酶敏感蛋白1型基序的adam金属肽酶,13)、elane(弹性蛋白酶,嗜中性粒细胞表达的)、enpp2(外核苷酸焦磷酸酶/磷酸二酯酶2)、cish(细胞因子诱导的含sh2的蛋白)、gast(胃泌素)、myoc(肌纤蛋白,小梁网可诱导糖皮质激素应答)、atp1a2(atp酶,na+/k+转运的,α2多肽)、nf1(神经纤维瘤蛋白1)、gjb1(间隙连接蛋白,β1,32kda)、mef2a(肌细胞增强因子2a)、vcl(纽蛋白)、bmpr2(骨形态发生蛋白受体,ii型(丝氨酸/苏氨酸激酶))、tubb(微管蛋白,β)、cdc42(细胞分裂周期42(gtp结合蛋白,25kda))、krt18(角蛋白18)、hsf1(热休克转录因子1)、myb(v-myb成髓细胞瘤病毒癌基因同源物(鸟类))、prkaa2(蛋白激酶,amp活化的,α2催化亚基)、rock2(rho关联含卷曲螺旋蛋白激酶2)、tfpi(组织因子途径抑制物(脂蛋白相关凝血抑制剂))、prkg1(蛋白激酶,cgmp依赖性,i型)、bmp2(骨形态发生蛋白2)、ctnnd1(连环蛋白(钙粘着蛋白关联蛋白),δ1)、cth(胱硫醚酶(胱硫醚γ-裂解酶))、ctss(组织蛋白酶s)、vav2(vav2鸟苷酸交换因子)、npy2r(神经肽y受体y2)、igfbp2(胰岛素样生长因子结合蛋白2,36kda)、cd28(cd28分子)、gsta1(谷胱甘肽s-转移酶α1)、ppia(肽基脯氨酰异构酶a(亲环素a))、apoh(载脂蛋白h(β-2-糖蛋白i))、s100a8(s100钙结合蛋白a8)、il11(白细胞介素11)、alox15(花生四烯酸盐15-脂氧合酶)、fbln1(腓骨蛋白1)、nr1h3(细胞核受体亚家族1,型h,成员3)、scd(硬脂酰基-辅酶a去饱和酶(δ-9-去饱和酶))、gip(抑胃多肽)、chgb(嗜铬粒蛋白b(分泌粒蛋白1))、prkcb(蛋白激酶c,β)、srd5a1(类固醇-5-α还原酶α多肽1(3-氧代-5α-类固醇δ4-脱氢酶α1))、hsd11b2(羟基固醇(11-β)脱氢酶2)、calcrl(降钙素受体样)、galnt(udp-n-乙酰基-α-d-半乳糖胺:多肽n-乙酰半乳糖胺基转移酶2(galnac-t2))、angptl4(血管生成素样4)、kcnn4(钾中间/小电导钙激活通道,亚家族n,成员4)、pik3c2a(磷酸肌醇-3-激酶,2类,α多肽)、hbegf(肝素结合egf样生长因子)、cyp7a1(细胞色素p450,家族7,亚家族a,多肽1)、hla-drb5(主要组织相容性复合物,i类i,drβ5)、bnip3(bcl2/腺病毒e1b19kda相互作用蛋白3)、gckr(葡糖激酶(己糖激酶4)调节蛋白)、s100a12(s100钙结合蛋白a12)、padi4(肽基精氨酸脱亚氨酶,i型v)、hspa14(热休克70kda蛋白14)、cxcr1(趋化因子(c-x-c基序)受体1)、h19(h19,母系印记表达转录物(非蛋白质编码))、krtap19-3(角蛋白关联蛋白19-3)、iddm2(胰岛素依赖型糖尿病2)、rac2(ras相关c3肉毒毒素底物2(rho家族,小gtp结合蛋白rac2))、ryr1(兰尼碱受体1(骨骼))、clock(clock同源物(小鼠))、ngfr(神经生长因子受体(tnfr超家族,成员16))、dbh(多巴胺β-羟化酶(多巴胺β-单加氧酶))、chrna4(胆碱能受体,烟碱的,α4)、cacna1c(钙通道,电压依赖性,l型,α1c亚基)、prkag2(蛋白激酶,amp激活的,γ2非催化亚基)、chat(胆碱乙酰转移酶)、ptgds(前列腺素d2合酶21kda(脑))、nr1h2(细胞核受体亚家族1,型h,成员2)、tek(tek酪氨酸激酶,内皮的)、vegfb(血管内皮生长因子b)、mef2c(肌细胞增强因子2c)、mapkapk2(丝裂原活化的蛋白激酶活化的蛋白激酶2)、tnfrsf11a(肿瘤坏死因子受体超家族,成员11a,nfkb激活剂)、hspa9(热休克70kda蛋白9(致死蛋白))、cysltr1(半胱胺酰白三烯受体1)、mat1a(甲硫氨酸腺苷转移酶i,α)、oprl1(阿片受体样1)、impa1(肌醇(肌肉)-1(或4)-单磷酸酶1)、clcn2(氯通道2)、dld(二氢硫辛酰胺脱氢酶)、psma6(蛋白酶体(前体,巨蛋白因子)亚基,α型,6)、psmb8(蛋白酶体(前体,巨蛋白因子)亚基,β型,8(大型多功能肽酶7))、chi3l1(壳多糖酶3样1(软骨糖蛋白-39))、aldh1b1(醛脱氢酶1家族,成员b1)、parp2(聚(adp-核糖)聚合酶2)、star(类固醇生成性急性期调节蛋白)、lbp(脂多糖结合蛋白)、abcc6(atp结合盒,亚家族c(cftr/mrp),成员6)、rgs2(g蛋白信号传导调节因子2,24kda)、efnb2(肝配蛋白-b2)、gjb6(间隙连接蛋白,β6,30kda)、apoa2(载脂蛋白a-ii)、ampd1(腺苷单磷酸脱氨酶1)、dysf(迪斯弗林(dysferlin),肢带型肌营养不良2b(常染色体隐性))、fdft1(法呢酰二磷酸酯法呢酰基转移酶1)、edn2(内皮素2)、ccr6(趋化因子(c-c基序)受体6)、gjb3(间隙连接蛋白,β3,31kda)、il1rl1(白细胞介素1受体样1)、entpd1(外核苷三磷酸二磷酸水解酶1)、bbs4(巴-比二氏综合征(bardet-biedlsyndrome)4)、celsr2(钙粘着蛋白,egflag七经g型受体2(火烈鸟同源物,果蝇))、f11r(f11受体)、rapgef3(rap鸟苷酸交换因子(gef)3)、hyal1(透明质酸葡糖胺酶1)、znf259(锌指蛋白259)、atox1(atx1抗氧化剂蛋白1同源物(酵母))、atf6(活化转录因子6)、khk(已酮糖激酶(果糖激酶))、sat1(亚精胺/精胺n1-乙酰转移酶1)、ggh(γ-谷氨酰水解酶(结合酶,叶酰聚γ谷氨酰水解酶))、timp4(timp金属肽酶抑制剂4)、slc4a4(溶质载体家族4,碳酸氢钠协同转运蛋白,成员4)、pde2a(磷酸二酯酶2a,cgmp刺激的)、pde3b(磷酸二酯酶3b,cgmp抑制的)、fads1(脂肪酸去饱和酶1)、fads2(脂肪酸去饱和酶2)、tmsb4x(胸腺素β4,x连锁的)、txnip(硫氧还蛋白相互作用蛋白)、lims1(lim和衰老细胞抗原样域1)、rhob(ras同源物基因家族,成员b)、ly96(淋巴细胞抗原96)、foxo1(叉头框o1)、pnpla2(含patatin样磷脂酶域2)、trh(促甲状腺激素释放激素)、gjc1(间隙连接蛋白,γ1,45kda)、slc17a5(溶质载体家族17(阴离子/糖转运蛋白),成员5)、fto(脂肪量和肥胖相关)、gjd2(间隙连接蛋白,δ2,36kda)、psrc1(富含脯氨酸/丝氨酸卷曲螺旋蛋白1)、casp12(半胱天冬酶12(基因/假基因))、gpbar1(g蛋白耦联胆汁酸受体1)、pxk(含px域丝氨酸/苏氨酸激酶)、il33(白细胞介素33)、trib1(tribbles同源物1(果蝇))、pbx4(前b细胞白血病同源框4)、nupr1(核蛋白,转录调节子,1)、15-sep(15kda硒蛋白)、cilp2(软骨中间层蛋白2)、terc(端粒酶rna组分)、ggt2(γ-谷氨酰转肽酶2)、mt-co1(线粒体编码细胞色素c氧化酶i)、以及uox(尿酸氧化酶,假基因)。在另一个实施例中,该染色体序列可以进一步选自pon1(对氧磷酶1)、ldlr(ldl受体)、apoe(载脂蛋白e)、apob-100(载脂蛋白b-100)、apoa(载脂蛋白(a))、apoa1(载脂蛋白a1)、cbs(胱硫醚(cystathione)b-合酶)、糖蛋白iib/iib、mthrf(5,10-亚甲基四氢叶酸还原酶(nadph)、及其组合。在一次迭代中,这些染色体序列和由涉及心血管疾病的染色体序列编码的蛋白质可以选自cacna1c、sod1、pten、ppar(α)、apoe、瘦素、及其组合。肾脏本发明还考虑了向肾脏递送该crispr-cas系统。诱导治疗性核酸的细胞摄取的递送策略包括物理力或载体系统,如基于病毒、脂质或复合体的递送、或纳米载体。根据具有较低可能的临床相关性的最初应用,当以全身性流体动力高压注射将核酸寻址(addressed)于肾细胞时,许多种基因治疗性病毒和非病毒载体已经被应用于体内靶向不同的动物肾脏疾病模型中的转录后事件(csabarévész和péterhamar(2011)。“靶向肾脏中的rna的递送方法”(deliverymethodstotargetrnasinthekidney),《基因治疗应用》(genetherapyapplications),康春生教授(prof.chunshengkang)(编辑),isbn:978-953-307-541-9,印天科技(intech),可获自:http://www.intechopen.com/books/gene-therapy-applications/delivery-methods-to-target-rnas-in-the-kidney)。针对肾脏的递送方法总结如下:袁(yuan)等人(《美国生理学-肾脏生理学杂志》(amjphysiolrenalphysiol)295:f605–f617,2008)研究了在注射链脲佐菌素的1型糖尿病小鼠模型中体内递送靶向花生四烯酸代谢的12/15-脂氧合酶(12/15-lo)途径的小干扰rna(sirna)是否能够改善肾损伤和糖尿病肾病(dn)。为了实现更好的体内通路以及在肾脏中的sirna表达,袁(yuan)等人使用与胆固醇结合的双链12/15-losirna寡核苷酸。将约400μg的sirna皮下注射到小鼠中。袁(yuang)等人的方法可应用于本发明的crisprcas系统,其中考虑将1-2g的与胆固醇结合的crisprcas皮下注射至人,以便递送到肾脏。莫利托里斯(molitoris)等人(《美国肾脏病学会杂志》(jamsocnephrol)20:1754-1764,2009年)采用了近端小管细胞(ptc)作为在肾脏内的寡核苷酸再吸收部位,以便检验靶向p53(凋亡途径中的一种关键蛋白质)的sirna的效力,从而预防肾损伤。在缺血性损伤之后4小时静脉内注射针对p53的裸露的合成sirna最大限度地保护了ptc和肾功能。莫利托里斯(molitoris)等人的数据表明,在静脉内给药之后sirna被快速递送到近端小管细胞。为了剂量反应分析,用在相同的四个时间点给予的0.33、1、3、或5mg/kg剂量的sip53注射大鼠,分别产生1.32、4、12、和20mg/kg的累积剂量。与pbs处理的缺血对照大鼠相比较,所有检验的sirna剂量在第一天产生了scr降低作用,其中更高的剂量在经过大约五天中更有效。12和20mg/kg的累积剂量提供了最好的保护作用。莫利托里斯(molitoris)等人的方法可应用于本发明的crisprcas系统,其中对于人类考虑递送到肾脏的12和20mg/kg累积剂量。汤普森(thompson)等人(《核酸治疗学》(nucleicacidtherapeutics),第22卷,第4期,2012年)报道了合成的小干扰rnai5np在啮齿类和非人类灵长动物中静脉内给药之后的毒理学和药代动力学特性。i5np被设计为经由rna干扰(rnai)途径起作用以便暂时抑制促凋亡蛋白p53的表达并且被开发为保护细胞免于诸如急性肾损伤之类的急性缺血/再灌注损伤,急性缺血/再灌注损伤可能在重大心脏手术以及在肾移植后可能出现的移植功能延迟中发生。在啮齿类中的800mg/kgi5np以及在非人类灵长动物中的1,000mg/kgi5np的剂量对于引出不良作用是需要的,在猴中被分离为导向对血液的作用,包括补体的亚临床激活和凝血时间的轻度增加。在大鼠中,用i5np的大鼠类似物未观察到另外的不良作用,表明这些作用很可能代表合成rna双链体的类作用,而不是与i5np的预期药理学活性有关的毒性。总之,这些数据支持用于在急性缺血/再灌注损伤之后保留肾功能的i5np的静脉内给药的临床测试。在猴子中的无明显损害作用水平(noael)是500mg/kg。在猴中,在以高达25mg/kg的剂量水平静脉内给药之后未观察到对心血管、呼吸、以及神经系统参数的影响。因此,对于向人的肾脏静脉内给予crisprcas可以考虑相似的剂量。清水(shimizu)等人(《美国肾脏病学会杂志》(jamsocnephrol)21:622-633,2010)开发了一种经由基于聚(乙二醇)-聚(l-赖氨酸)的载体将sirna靶向递送到肾小球的系统。该sirna/纳米载体复合物在直径上大约为10到20nm,该大小将允许它移动跨过有窗孔的内皮细胞而接近肾小球膜。在腹膜内注射荧光标记的sirna/纳米载体复合物之后,清水(shimizu)等人在血液循环中检测到sirna,持续一段延长的时间。在肾小球肾炎的小鼠模型中,丝裂原活化蛋白激酶1(mapk1)sirna/纳米载体复合物的重复腹膜内给药抑制了肾小球mapk1mrna和蛋白质的表达。为了研究sirna累积,向balb-c小鼠给予与pic纳米载体复合的cy5标记的sirna(0.5ml,5nmol的sirna含量)、裸露的cy5标记的sirna(0.5ml,5nmol)、或封装在hvj-e中的cy5标记的sirna(0.5ml,5nmol的sirna含量)。清水(shimizu)等人的方法可应用于本发明的crisprcas系统,其中考虑将约10-20μmol的与纳米载体复合的crisprcas以约1-2升腹膜内注射至人并且递送到肾脏。肺本发明还考虑了向一侧或两侧肺部递送该crispr-cas系统。虽然基于aav-2的载体最初被提议用于向cf气道的cftr递送,但其他血清型如aav-1、aav-5、aav-6、和aav-9在肺上皮细胞的多种模型中也展示出提高的基因转移效率(参见,例如,李(li)等人,《分子治疗》(moleculartherapy),第17卷,第12期,2067-2077,2009年12月)。在体外转导人气道上皮细胞上,aav-1被证明比aav-2和aav-5更有效约100倍,5虽然aav-1体内转导的鼠类气管气道上皮具有与aav-5相等的效率。其他研究已经表明,在针对体外人气道上皮(hae)的基因递送上,aav-5比aav-2更有效50倍,并且在体内小鼠肺气道上皮中显著更有效。还已经表明,在体外人气道上皮细胞中以及在体内鼠类气道中,aav-6比aav-2更有效。8更为近期的分离物,aav-9,显示出在体内鼠类鼻和肺泡上皮中展示了比aav-5更好的基因转移效率,其中检测出基因表达持续超过9个月,表明aav可使得体内长期基因表达成为可能,这是对于cftr基因递送载体而言的理想特性。此外,证明了aav-9可以被再次给予至鼠类的肺部,而不丧失cftr表达并且具有最低限度的免疫后果。可以在cf和非cfhae培养物的顶面用100μl的aav载体接种,维持数小时(参见,例如,李(li)等人,《分子治疗》(moleculartherapy),第17卷,第12期,2067-2077,2009年12月)。moi可以从1×103到4×105个载体基因组/细胞而变化,这取决于病毒浓度和这些实验的目的。以上引用的载体被考虑用于本发明的递送和/或给药。萨莫拉(zamora)等人(《美国呼吸道与危重护理学杂志》(amjrespircritcaremed)第183卷,第531-538页,2011年)报道了针对人类感染性疾病治疗的rna干扰治疗法的应用以及抗病毒药物在呼吸道合胞病毒(rsv)感染的肺移植受体中的随机试验。萨莫拉(zamora)等人进行了一项在具有rsv呼吸道感染的ltx受体中的随机化、双盲、安慰剂对照的试验。容许患者接受针对rsv的护理标准。每天给予雾化的aln-rsv01(0.6mg/kg)或安慰剂,持续3天。这项研究证明,可以安全地向具有rsv感染的ltx受体给予靶向rsv的rnai治疗剂。aln-rsv01的三个每日剂量并不导致任何呼吸道症状的恶化或肺功能的损害,并且未展示任何出全身性致炎作用,如细胞因子或crp的诱导。在吸入之后,药代动力学仅仅显示出低的短暂的全身性暴露,与临床前动物数据一致,表明静脉内或通过吸入给予的aln-rsv01通过外切核酸酶介导的消化和肾脏排泄而从循环中迅速清除。萨莫拉(zamora)等人的方法可以应用于本发明的crisprcas系统,并且雾化的crisprcas,例如以0.6mg/kg的剂量,可以被考虑用于本发明。对于cftrδ508嵌合的指导rna的实例,参见实例22,其使用腺相关病毒(aav)粒子证明了crispr-cas系统在对其有需要的受试者或患者的气道中的基因转移或基因递送,所述受试者或患者患有囊性纤维化或囊性纤维化(cf)相关症状。具体地说,他们示例了囊性纤维化δf508突变的修复策略。这种策略类型可应用于所有生物。特别提到cf,适合的患者可以包括:人类、非人类灵长动物、犬、猫、牛、马和其他家养动物。在这种情况下,申请人利用包含cas9酶的crispr-cas系统来靶向δf508或其他cftr诱导的突变。在这种情况下,这些经治疗的受试者的每一侧肺接受支气管内递送的药学上有效量的雾化aav载体系统,同时自然地呼吸。像这样,通常对于aav递送而言,雾化递送是优选的。腺病毒或aav粒子可以用于递送。每一者都可操作地连接至一个或多个调节序列上的适合的基因构建体可以被克隆到递送载体中。在这种情况下,提供下列构建体作为实例:用于cas9的cbh或ef1a启动子、用于嵌合指导rna的u6或h1启动子:一种优选的安排是使用靶向嵌合指导的cftrδ508、用于δf508突变的修复模板以及密码子优化的cas9酶(优选的cas9是具有核酸酶或切口酶活性的那些),所述酶具有任选地一个或多个核定位信号或序列(nls),例如,两(2)个nls。还设想了没有nls的构建体。为了鉴定该cas9靶位点,申请人分析了人cftr基因组座位并且鉴定了该cas9靶位点。优选地,一般而言并且在这种cf的情况下,该pam可以含有一个ngg或一个nnagaaw基序。因此,在cf的情况下,本方法包括操纵在感兴趣的基因组座位中的靶序列,该方法包括:递送一种包含病毒载体系统的非天然存在的或工程化的组合物,该病毒载体系统包含一种或多种病毒载体,该一种或多种病毒载体可操作地编码用于其表达的组合物,其中该非天然存在的或工程化的组合物包括:一种非天然存在的或工程化的组合物,该组合物包含一种载体系统,该载体系统包含一种或多种载体,该一种或多种载体包含i.一种第一调节元件,该第一调节元件可操作地连接到crispr-cas系统嵌合rna(chirna)多核苷酸序列上,其中该第一多核苷酸序列包含(a)一种指导序列,该指导序列能够杂交到适合的哺乳动物细胞中的cf靶序列上,(b)一种tracr配对序列,和(c)一种tracr序列,以及ii.一种第二调节元件,该第二调节元件可操作地连接到编码crispr酶的酶编码序列上,该crispr酶包含至少一个或多个核定位序列,其中(a)、(b)和(c)以5’到3’方向排列,其中组分i和ii位于该系统的相同或不同载体上,其中在转录时,该tracr配对序列杂交到该tracr序列上,并且该指导序列指导crispr复合物与该靶序列的序列特异性结合,并且其中该crispr复合物包含与(1)杂交到该靶序列上的指导序列、和(2)杂交到该tracr序列上的tracr配对序列复合的crispr酶。就cf而言,优选的靶dna序列包含该cftrδ508突变。上文描述了优选的pam。优选的crispr酶是任何cas(在本文中描述,但是特别地描述于实例22中)。对于cf的替代物包括任何基因缺陷并且这些实例是众所周知的。本发明的另一个优选方法或用途是用于校正emp2a和emp2b基因的缺陷,这些基因已经被鉴定为与拉福拉病(laforadisease)相关。在一些实施例中,一个“指导序列”可以与“指导rna”不同。一种指导序列可以是指在该指导rna内的大约20bp的序列,其指定该靶位点。在一些实施例中,该cas9是(或衍生自)spcas9。在这样的实施例中,优选的突变是在spcas9的任何或所有的10、762、840、854、863和/或986位置或在其他cas9的相应位置(其可以例如通过标准序列比较工具进行确定)。具体地说,在spcas9中的任何或所有下列突变是优选的:d10a、e762a、h840a、n854a、n863a和/或d986a;并且还设想了这些置换氨基酸的任何一种的保守性取代。在其他cas9中的相应位置处的相同取代(或这些突变的保守性取代)也是优选的。特别优选的是在spcas9中的d10和h840。然而,在其他cas9中,相应于spcas9d10和h840的残基也是优选的。这些是有利的,因为它们提供了切口酶活性。这样的突变可以应用于本发明的所有方面,不仅是治疗cf。施万克(schwank)等人(《细胞—干细胞》(cellstemcell),13:653-58,2013)使用了crispr/cas9来校正在人类干细胞中的与囊性纤维化相关联的缺陷。该研究组的目标是离子通道囊性纤维化跨膜传导受体(cftr)的基因。在cftr中的缺失引起该蛋白质在囊性纤维化患者中的错误折叠。使用从患有囊性纤维化的两个儿童的细胞样品中发育而来的培养的肠干细胞,施万克(schwank)等人能够利用crispr连同含有有待插入的修补序列的供体质粒来校正该缺陷。然后这些研究者使这些细胞生长成肠“类器官”或微型肠,并且显示它们正常地起作用。在这种情况下,约一半的克隆类器官经历正确的基因修正。肌肉本发明还考虑了向肌肉递送该crispr-cas系统。bortolanza等人(《分子治疗》(moleculartherapy)第19卷,第11期,2055-2064,2011年11月)表明,在面肩肱型肌营养不良(fshd)发作之后的frg1小鼠中,干扰rna表达盒的全身性递送导致剂量依赖性长期frg1敲低,而没有毒性征象。bortolanza等人发现,单次静脉内注射5×1012vg的raav6-sh1frg1挽救了frg1小鼠的肌肉组织病理学和肌肉功能。详细而言,使用一个25号的泰尔茂(terumo)注射器将200μl的含有2×1012或5×1012vg的在生理溶液中的载体在注射到尾静脉中。bortolanza等人的方法可以应用于表达crisprcas的aav,并且将其以约2×1015或2×1016vg载体的剂量注射到人体内。dumonceaux等人(《分子治疗》(moleculartherapy)第18卷,第5期,881-887,2010年5月)使用针对肌肉生长抑制素受体acvriibmrna(sh-acvriib)的rna干扰技术抑制了肌肉生长抑制素途径。由矢量化(vectorized)u7外显子跳跃技术(u7-dys)介导准肌营养不良蛋白(quasi-dystrophin)的恢复。将携带单独的sh-acvriib构建体、单独的u7-dys构建体、或这两种构建体的组合的腺相关载体注射到营养不良mdx小鼠的胫骨前肌(ta)肌肉中。以1011个aav病毒基因组进行注射。dumonceaux等人的方法可以应用于表达crisprcas的aav,并且将其以例如约1014到1015vg载体的剂量注射到人体内。木内(kinouchi)等人(《基因治疗》(genetherapy)(2008)15,1126-1130)报道了通过未经化学修饰的sirna与缺端胶原(atcol)的纳米粒子形成的到正常或患病小鼠骨骼肌的体内sirna递送的有效性。靶向肌肉生长抑制素(一种骨骼肌生长的负调节剂)的sirna的atcol介导的在小鼠骨骼肌中的局部应用或者经由静脉内在应用之后几周之内引起肌肉质量的显著增加。这些结果暗示sirna的atcol介导的应用是一种强大的用于包括肌肉萎缩在内的疾病的未来治疗用途的工具。根据制造商的说明,将mst-sirna(终浓度,10mm)与atcol(对于局部给药的终浓度,0.5%)(atelogene,高研株式会社(kohken),东京,日本)混合。在通过戊巴比妥钠(25mg/kg,腹膜内注射)麻醉小鼠(20周大,雄性c57bl/6)之后,将mst-sirna/atcol复合物注射到咬肌和股二头肌中。木内(kinouchi)等人的方法可以应用于crisprcas,并且例如将其以40μm溶液的约500到1000ml的剂量注射到人体内。哈格斯特龙(hagstrom)等人(《分子治疗》(moleculartherapy)第10卷,第2期,2004年8月)描述了一种使得能够将核酸有效且可重复地递送到遍及哺乳动物四肢肌肉的肌细胞(肌纤维)的血管内、非病毒方法。该程序涉及注射裸质粒dna或sirna到暂时由止血带或血压袖带分离的肢体的远端静脉中。通过以足够的体积将其迅速注射,促进了向肌纤维的核酸递送,使得该核酸溶液能够溢出到肌肉组织中。在小动物和大动物中都以最低毒性实现了在骨骼肌中的高水平转基因表达。还获得了向四肢肌肉递送sirna的证据。为了将质粒dna静脉注射到恒河猴中,将一个三通旋塞连接到各自加载有单个注射器的两个注射器泵(型号phd2000;哈佛仪器公司(harvardinstruments))上。在罂粟碱注射五分钟之后,以1.7或2.0ml/s的速率注射pdna(15.5到25.7mg,在40-100ml盐水中)。对于本发明的表达crisprcas的质粒dna,这可以按比例增加,对于人类,注射在800到2000ml盐水中的约300到500mg。对于到大鼠中的腺病毒载体注射,注射在3ml的生理盐水溶液中的(nss)2x109个感染粒子。对于本发明的表达crisprcas的腺病毒载体,这可以按比例增加,对于人类,注射在10升nss中的约1x1013个感染粒子。对于sirna,以12.5μg的sirna注射到大鼠的大隐静脉中,并且以750μg的sirna注射到灵长动物的大隐静脉中。对于本发明的crisprcas,这可以按比例增加,例如,向人的大隐静脉注射约15到约50mg。皮肤本发明还考虑了向皮肤递送该crispr-cas系统。希克森(hickerson)等人(《分子治疗-核酸》(moleculartherapy-nucleicacids)(2013)2,e129)涉及一种用于向人类和鼠类皮肤递送自我递送(sd)-sirna的机动化的微针阵列皮肤递送装置。将基于sirna的皮肤治疗剂转化到临床的主要挑战是有效递送系统的开发。在多种皮肤递送技术中已经投入了实质性的努力,但是成功有限。在其中用sirna治疗皮肤的临床研究中,与皮下针注射相关的剧烈疼痛预先排除了试验中额外患者的纳入,这凸显了对于改进的、更为“患者友好的”(即,很少或没有疼痛)递送方法的需要。微针代表行包括sirna在内的大的带电负荷物跨越一级屏障、角质层进行递送的有效途径,并且通常被认为比常规皮下针疼痛更少。机动化的“冲压型”微针装置,包括由希克森(hickerson)等人使用的机动化的微针阵列(mmna)装置,已经显示在无毛小鼠研究中是安全的并且引起很少的或没有疼痛,其证据为:(i)在美容业中广泛使用以及(ii)其中几乎所有志愿者发现使用该装置比流感疫苗针剂(flushot)疼痛少得多的有限测试,表明使用这种装置的sirna递送将产生比使用皮下针注射的先前临床试验中所体验的少得多的疼痛。该mmna装置(作为triple-m或tri-m由韩国首尔的bomtech电子有限公司在市场上销售)适用于将sirna递送到小鼠和人类皮肤。将sd-sirna溶液(高达300μl的0.1mg/mlrna)引入被设定为0.1mm深度的一次性tri-m针盒(bomtech)的腔室中。为了处理皮肤,在处理之前将未鉴定的皮肤(在外科手术之后立即获得)手动拉伸并且钉在软木平台上。使用具有28号0.5英寸针头的胰岛素注射器进行所有皮内注射。该mmna装置和希克森(hickerson)等人的方法可以用于和/或适用于,例如,以高达300μl的0.1mg/mlcrisprcas的剂量向皮肤递送本发明的crisprcas。里奇曼(leachman)等人(《分子治疗》(moleculartherapy),第18卷,第2期,442-446,2010年2月)涉及利用基于针对皮肤的第一短干扰rna(sirna)的治疗剂用于治疗罕见的皮肤病症先天性厚甲(pc)的ib期临床试验,先天性厚甲为一种常染色体显性综合征,其包括致残性的掌跖角化病。这种sirna,称为td101,特异性地并且有力地靶向角蛋白6a(k6a)n171k突变体mrna,而不影响野生型k6amrna。剂量递增计划提出如下:最初,向对称的胼胝给予0.1ml的td101或单独的载体(没有钙或镁的杜尔贝科磷酸盐缓冲盐水)的1.0mg/ml溶液。完成六个渐增的剂量体积,对于增加没有不良反应:每次注射0.1、0.25、0.5、1.0、1.5、和2.0ml的1.0mg/mltd101溶液。由于最高计划体积(2.0ml)被良好耐受,然后每周将td101的浓度从1mg/ml增加到8.5mg/ml的终浓度。对于给予特异性地并且有力地靶向角蛋白6a(k6a)n171k突变体mrna的crisprcas考虑了相似的剂量。郑(zheng)等人(pnas,7月24日,2012年,第109卷,第30期,11975-11980)表明,球形核酸纳米粒子结合物(sna-nc),由高度定向的、共价固定的sirna的致密壳围绕的金核,在应用之后数小时之内在体外自由地穿透几乎100%的角化细胞、小鼠皮肤、以及人表皮。郑(zheng)等人证明,在人类皮肤中单次应用25nm的表皮生长因子受体(egfr)sna-nc持续60小时显示出有效的基因敲低。对于向皮肤给予固定在sna-nc中的crisprcas可以考虑了相似的剂量。肝炎病毒本发明还可应用于治疗b型肝炎病毒(hbv)。然而,通过例如优化剂量和序列,该crisprcas系统必须适应于避免rnai的缺点,如内源小rna途径的过度饱和风险(参见,例如,格林姆(grimm)等人,《自然》第441卷,2006年5月26日)。例如,考虑例如约每人1-10x1014个粒子的低剂量。在另一个实施例中,针对hbv的该crisprcas系统可以在脂质体中给药,如一种稳定的核酸-脂质粒子(snalp)(参见,例如,莫里西(morrissey)等人,《自然生物技术》(naturebiotechnology),第23卷,第8期,2005年8月)。考虑了约1、3或5mg/kg/天的靶向snalp中的hbvrna的crisprcas的每日静脉注射。每天治疗可以经过约三天,然后每周治疗持续约五周。在另一个实施例中,陈(chen)等人的系统(《基因治疗》(2007)14,11-19)可以使用和/或适用于本发明的crisprcas系统。陈(chen)等人使用双链腺相关病毒8-假型载体(dsaav2/8)来递送shrna。在hbv转基因小鼠的肝脏中,携带hbv特异性shrna的dsaav2/8载体(1x1012个载体基因组/小鼠)的单次给药有效抑制了hbv蛋白、mrna和复制型dna的稳定水平,从而导致在循环中的hbv负荷的高达2-3个log10减少。在载体给药之后,显著的hbv抑制持续了至少120天。shrna的治疗作用是靶序列依赖性的并且不涉及干扰素的激活。对于本发明,可以将针对hbv的crisprcas系统克隆到aav载体如dsaav2/8载体中,并且给予至人,例如,以1x1015个载体基因组到约1x1016个载体基因组/人的剂量。在另一个实施例中,伍德尔(wooddell)等人的方法(《分子治疗》第21卷,第5期,973-985,2013年5月)可以使用和/或适用于本发明的crisprcas系统。伍德尔(wooddell)等人表明,肝细胞靶向的、n-乙酰半乳糖胺结合的蜂毒肽样肽(nag-mlp)与靶向凝血因子vii(f7)的嗜肝胆固醇结合的sirna(chol-sirna)的简单共注射导致在小鼠和非人类灵长动物中的有效f7敲低,而在细胞因子的临床化学或诱导上没有变化。使用hbv感染的瞬时转基因小鼠模型,伍德尔(wooddell)等人表明,nag-mlp与有效的靶向保守hbv序列的chol-sirna的简单共注射导致病毒rna、蛋白质、和病毒dna的多对数(multilog)阻抑。对于本发明可以设想例如,约6mg/kg的nag-mlp和6mg/k的hbv特异性crisprcas的静脉内共注射。在替代方案中,约3mg/kg的nag-mlp和3mg/kg的hbv特异性crisprcas可以在第一天递送,随后在两周之后给予约2-3mg/kg的nag-mlp和2-3mg/kg的hbv特异性crisprcas。本发明还可应用于治疗c型肝炎病毒(hcv)。roelvinki等人的这些方法(《分子治疗》第20卷,第9期,1737-1749,2012年9月)可以应用于该crisprcas系统。例如,aav载体如aav8可以是考虑的载体,并且可以考虑例如约1.25×1011到1.25×1013个载体基因组/千克体重(vg/kg)的剂量。将易于清楚的是,可以按照相似的方式治疗具有其他疾病的宿主。本文提供了由突变引起的遗传疾病的一些实例,但是更多的疾病是已知的。以上策略可以应用于这些疾病。亨廷顿病(hd)通过降低htt(亨廷顿病的致病基因)的表达,rna干扰(rnai)对这种病症提供了治疗潜能(参见,例如,麦克布赖德(mcbride)等人,《分子治疗》(moleculartherapy)第19卷,第12期,2011年12月,第2152-2162页),因此申请人假定它可以用于/或适用于该crispr-cas系统。可以使用一种算法来生成该crispr-cas系统,以便降低反义序列的脱靶可能性。这些crispr-cas序列可以靶向小鼠、恒河猴或人类亨廷丁的外显子52中的一个序列并且表达于一种病毒载体如aav中。可以按照约三次微量注射/半球(总共六次注射)来注射包括人类在内的动物:第一次在前连合的吻侧1mm(12μl),并且用1e12vg/ml的aav以约1μl/分的速率在第一次注射的尾侧间隔3mm和6mm进行其余两次注射(分别为12μl和10μl),并且将针留在适当位置持续另外的5分钟,以允许注射物从针尖扩散。迪费吉里亚(difiglia)等人(pnas,10月23日,2007年,第104卷,第43期,17204-17209)观察到,向成熟的纹状体中单次给予靶向htt的sirna可以使突变体htt沉默,减弱神经元病理,并且延迟在急骤起病的hd的病毒性转基因小鼠模型中观察到的异常行为表现。迪费吉里亚(difiglia)用2μl的cy3标记的cc-sirna-htt或10μm的未结合的sirna-htt注射到小鼠的纹状体内。在本发明中对于人类可以考虑靶向htt的crisprcas的相似剂量,例如,可以将约5-10ml的10μm的靶向htt的crisprcas注射到纹状体内。在另一个实施例中,布德罗(boudreau)等人(《分子治疗》(moleculartherapy)第17卷,第6期,2009年6月)将5μl的表达htt特异性rnai病毒的重组aav血清型2/1载体(以4x1012病毒基因组/ml)注射到纹状体(straiatum)中。在本发明中对于人类可以考虑靶向htt的crisprcas的相似剂量,例如,可以将约10-20ml的4x1012个病毒基因组/ml靶向htt的crisprcas注射到纹状体内。在另一个实施例中,可以连续给予靶向htt的crisprcas(参见,例如,于(yu)等人,《细胞》(cell)150,895-908,8月31日,2012年)。于(yu)等人利用递送0.25ml/小时的渗透泵(型号2004)来递送300mg/天的ss-sirna或磷酸盐缓冲盐水(pbs)(西格玛奥德里奇公司(sigmaaldrich),持续28天,并且使用被设计为递送0.5μl/小时的泵(型号2002)来递送75mg/天的阳性对照moeaso,持续14天。用稀释在无菌pbs中的ss-sirna或moe充满泵(度瑞公司(durectcorporation),进而在植入之前将其在37℃孵育24或48(型号2004)小时。用2.5%异氟烷麻醉小鼠,并且在头盖骨底部做正中切口。使用脑功能区定位导子,将套管植入右侧脑室并且用乐泰胶(loctiteadhesive)固定。将一根附接到alzet微渗透压泵的导管附接到该套管上,并且将该泵皮下置于肩胛间区(midscapulararea)中。用5.0号尼龙缝线将该切口闭合。在本发明中对于人类可以考虑靶向htt的crisprcas的相似剂量,例如,可以给予约500到1000g/天的靶向htt的crisprcas。在连续输注的另一个实例中,斯泰尔斯(stiles)等人(《实验神经病学》(experimentalneurology)233(2012)463-471)将一根具有钛针尖的脑实质导管植入到右侧壳核中。将该导管连接到一个皮下植入在腹部的ii泵(美敦力神经调控部门(medtronicneurological),明尼阿波里斯市,明尼苏达州)上。在以6μl/天输注磷酸盐缓冲盐水7天之后,用试验品将这些泵重新充满并且编程为连续递送7天。以约0.1到0.5μl/分的变化输注速率输注约约2.3到11.52mg/d的sirna。在本发明中对于人类可以考虑靶向htt的crisprcas的相似剂量,例如,可以给予约20到200mg/天的靶向htt的crisprcas。在另一个实施例中,转让给桑加莫(sangamo)的美国专利公开号20130253040的这些方法也可以适合于用于治疗亨廷顿病的从塔乐斯(tales)到本发明的crisprcas系统。核酸、氨基酸和蛋白质本发明使用核酸来结合靶tdna序列。这是有利的,因为产生核酸比产生蛋白质容易且价廉得多,并且特异性可以根据其中寻求同源性的拉伸长度而变化。例如多指的复杂3-d复杂定位是不需要的。术语“多核苷酸”、“核苷酸”、“核苷酸序列”、“核酸”和“寡核苷酸”可互换地使用。它们是指具有任何长度的核苷酸的聚合形式,是脱氧核糖核苷酸或核糖核苷酸、或其类似物。多核苷酸可具有任何三维结构,并且可以执行已知或未知的任何功能。以下是多核苷酸的非限制性实例:基因或基因片段的编码区或非编码区、根据连接分析定义的多个座位(一个座位)、外显子、内含子、信使rna(mrna)、转运rna、核糖体rna、短干扰rna(sirna)、短发夹rna(shrna)、micro-rna(mirna)、核酶、cdna、重组多核苷酸、分支多核苷酸、质粒、载体、任何序列的分离的dna、任何序列的分离的rna、核酸探针、和引物。该术语还涵盖具有合成骨架的核酸样结构,参见,例如,埃克斯坦(eckstein),1991;巴塞加(baserga)等人,1992;米利根(milligan),1993;wo97/03211;wo96/39154;马塔(mata),1997;施特劳斯-绍库普(strauss-soukup),1997;和扎姆斯塔(samstag),1996。多核苷酸可以包含一个或多个经修饰的核苷酸,如甲基化的核苷酸和核苷酸类似物。如果存在,可以在聚合物组装之前或之后进行核苷酸结构的修饰。核苷酸的序列可以被非核苷酸组分中断。多核苷酸可以在聚合后,如通过与标记的组分缀合来进一步修饰。如本文所用的术语“野生型”是本领域技术人员所理解的术语,并且表示生物、菌株、基因的典型形式或者当它在自然界存在时区别于突变体或变体形式的特征。如本文所用的术语“变体”应当被理解为表示具有衍生自在自然界中存在的模式的性质的展示。术语“非天然存在的”或“工程化的”可互换地使用并且表面人工的参与。这些术语,当指核酸分子或多肽时,表示该核酸分子或多肽至少基本上从它们在自然界中或如发现于自然界中的与其结合的至少另一种组分游离出来。“互补性”是指核酸与另一个核酸序列借助于传统的沃森-克里克碱基配对或其他非传统类型形成一个或多个氢键的能力。互补百分比表示一个核酸分子中可与一个第二核酸序列形成氢键(例如,沃森-克里克碱基配对)的残基的百分比(例如,10个之中有5、6、7、8、9、10个即为50%、60%、70%、80%、90%、和100%互补)。“完全互补”表示一个核酸序列的所有连续残基与一个第二核酸序列中的相同数目的连续残基形成氢键。如本文使用的“基本上互补”是指在一个具有8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50个或更多个核苷酸的区域上至少为60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%、或100%的互补程度,或者是指在严格条件下杂交的两个核酸。如本文使用的对于杂交的“严格条件”是指与靶序列具有互补性的一个核酸主要地与该靶序列杂交并且基本上不杂交到非靶序列上的条件。严格条件通常是序列依赖性的,并且取决于许多因素而变化。一般而言,该序列越长,则该序列特异性地杂交到其靶序列上的温度就越高。严格条件的非限制性实例描述于蒂森(tijssen)(1993)的《生物化学和分子生物学中的实验室技术-核酸探针杂交》(laboratorytechniquesinbiochemistryandmolecularbiology-hybridizationwithnucleicacidprobes),第i部分,第二章,“杂交原理概述和核酸探针分析策略”(“overviewofprinciplesofhybridizationandthestrategyofnucleicacidprobeassay”),爱思唯尔(elsevier),纽约。在提及一个多核苷酸序列时,那么也设想了互补的或部分互补的序列。能够在高严格条件下杂交到参考序列上的这些序列是优选的。通常,为了使杂交率最大化,选择了相对低严格性的杂交条件:低于热熔点(tm)约20℃到25℃。tm是50%的特异性靶序列在具有规定的离子强度和ph的溶液中杂交到完全互补的探针上的温度。通常,为了要求杂交序列的至少约85%的核苷酸互补性,高严格洗涤条件被选择为低于tm约5℃到15℃。为了要求杂交序列的至少约70%的核苷酸互补性,中等严格洗涤条件被选择为低于tm约15℃到30℃。高容许(极低严格性)洗涤条件可以低至在tm之下50℃,从而允许在杂交序列之间的高水平错配。本领域技术人员将认识到,在杂交和洗涤阶段中的其他物理和化学参数也可以改变,从而影响来自在靶序列与探针序列之间的特定同源性水平的可检测杂交信号的结果。优选的高严格条件包括在50%甲酰胺、5×ssc、和1%sds中在42℃孵育,或者在5×ssc和1%sds中在65℃孵育,在0.2×ssc和0.1%sds中在65℃洗涤。“杂交”是指其中一个或多个多核苷酸反应形成一种复合物的反应,该复合物经由这些核苷酸残基之间的碱基的氢键键合而稳定化。氢键键合可以借助于沃森-克里克碱基配对、hoogstein结合或以任何其他序列特异性方式而发生。该复合物可包含形成一个双链体的两条链、形成多链复合物的三条或多条链、单个自我杂交链、或这些的任何组合。杂交反应可以构成一个更广泛的过程(如pcr的开始、或经由一种酶的多核苷酸的切割)中的一个步骤。能够与一个给定序列杂交的序列被称为该给定序列的“互补物”。如本文使用的,术语“基因组座位(locus)”或“座位(locus)”(复数是座位(loci))是在一个染色体上的一个基因或dna序列的特定位置。“基因”是指编码多肽或rna链的dna或rna的段(stretch),其在生物中发挥功能作用并且因此是活生物体遗传的分子单元。出于本发明的目的,可以考虑包括调节基因产物的产生的区域的基因,而不论这样的调节序列是否接近编码和/或转录的序列。因此,基因包括而不必限于,启动子序列、终止子、翻译调节序列(如核糖体结合位点和内部核糖体进入位点)、增强子、沉默子、隔离子、边界元件、复制起点、核基质附着位点和座位控制区。如本文使用的“基因组座位的表达”或“基因表达”是藉此在功能性基因产物的合成中使用来自基因的信息的过程。基因表达的产物常常是蛋白质,但是在非蛋白质编码基因如rrna基因或trna基因中,产物是功能性rna。基因表达的过程由所有已知的生物利用-产生功能性产物以便存活的真核生物(包括多细胞生物)、原核生物(细菌和古细菌)以及病毒。如本文使用的基因或核酸的“表达”不仅涵盖细胞基因表达,而且涵盖在克隆系统中或在任何其他背景下的一个或多个核酸的转录和翻译。如本文使用的“表达”是指藉此从dna模板转录成多核苷酸(如转录成mrna或其他rna转录物)的过程和/或转录的mrna随后藉此翻译成肽、多肽或蛋白质的过程。转录物和编码的多肽可以总称为“基因产物”。如果多核苷酸来源于基因组dna,表达可以包括真核细胞中mrna的剪接。术语“多肽”、“肽”和“蛋白质”在本文可互换地使用,是指具有任何长度的氨基酸的聚合物。该聚合物可以是可以是直链或支链的,它可以包含修饰的氨基酸,并且它可以被非氨基酸中断。这些术语还涵盖已经被修饰的氨基酸聚合物;这些修饰例如二硫键形成、糖基化、脂化(lipidation)、乙酰化、磷酸化、或任何其他操纵,如与标记组分的结合。如本文使用的术语“氨基酸”包括天然的和/或非天然的或者合成的氨基酸,包括甘氨酸以及d和l旋光异构体、以及氨基酸类似物和肽模拟物。如本文使用的,术语“结构域”或“蛋白质结构域”是指可以独立于该蛋白质链的其余部分而存在并且起作用的蛋白质序列的一部分。正如在本发明的多个方面中所描述,序列一致性与序列同源性有关。可以通过肉眼、更通常地借助于可得的序列比较程序来进行同源性比较。这些可商购的计算机程序可以计算在两个或更多个序列之间的同源性的百分比(%)并且还可以计算由两个或更多个氨基酸或核酸序列共享的序列一致性。在一些优选的实施例中,本文描述的dtale的封端区具有与本文提供的封端区氨基酸序列至少95%一致性或共享一致性的序列。可以通过本领域已知的许多计算机程序(例如blast或fasta等等)来生成序列同源性。用于进行这样的比对的适合的计算机程序是gcg威斯康星bestfit软件包(美国威斯康星大学;德弗罗(devereux)等人,1984,《核酸研究》(nucleicacidsresearch)12:387)。可以进行序列比较的其他软件的实例包括但不限于,blast软件包(参见奥苏贝尔(ausubel)等人,1999,出处同上-第18章)、fasta(阿尔丘尔(atschul)等人,1990,《分子生物学杂志》(j.mol.biol.),403-410)以及geneworks系列比较工具。blast和fasta均可用于离线和在线搜索(参见奥苏贝尔(ausubel)等人,1999,出处同上,7-58页到7-60页)。然而,优选使用gcgbestfit程序。可以计算在连续序列上的序列同源性百分比(%),即,将一个序列与另一个序列比对,并且将一个序列中的每个氨基酸或核苷酸与另一个序列中的相应氨基酸或核苷酸直接进行比较,一次比较一个残基。这被称为“无空位”比对。典型地,这样的无空位比对仅仅在较少数目的残基上进行。虽然这是一种非常简单和一致的方法,但是它未能考虑的是,例如,在其他方面完全相同的序列对中,一个插入或缺失可以引起随后的氨基酸残基被排除在比对之外,因此当进行全局比对时可能导致在同源性%上的大幅降低。因此,大多数序列比较方法被设计为产生考虑到可能的插入和缺失的优化比对,而没有过度地使总体同源性或一致性评分不利。这是通过在序列比对中插入“空位”来实现的,以便试图将局部同源性或一致性最大化。然而,这些更复杂的方法向出现在该比对中的每个空位分配“空位罚分”,从而对于相同数目的一致的氨基酸而言,具有尽可能少的空位的序列比对-反映了在这两个比较的序列之间的更高关联性-可以比具有许多空位者实现更高的分数。“亲合空位成本”(“affinitygapcosts”)典型地用于对空位的存在要求相对高的成本并对空位中的每个后续残基施加较小的罚分。这是最常用的空位评分系统。高空位罚分当然将产生具有更少空位的最佳比对。大多数比对程序允许修改空位罚分。然而,当使用这种序列比较软件时优选使用默认值。例如当使用gcg威斯康星bestfit软件包时,氨基酸序列的默认空位罚分为对于每个空位的-12,以及对于每个延伸的-4。因此计算最大同源性%首先要求产生最佳比对,考虑空位罚分。用于进行这样的比对的适合的计算机程序是gcg威斯康星bestfit软件包(德弗罗(devereux)等人,1984,《核酸研究》(nucleicacidsresearch)12p387)。可以进行序列比较的其他软件的实例包括但不限于,blast软件包(参见奥苏贝尔(ausubel)等人,1999《精编分子生物学实验指南》(shortprotocolsinmolecularbiology),第4次编辑-第18章)、fasta(阿尔丘尔(altschul)等人,1990《分子生物学杂志》(j.mol.biol)。blast和fasta均可用于离线和在线搜索(参见奥苏贝尔(ausubel)等人,1999,《精编分子生物学实验指南》(shortprotocolsinmolecularbiology),7-58页到7-60页)。然而,对于一些应用,优选使用gcgbestfit程序。一种新的工具,称为blast2序列,也可用于比较蛋白质和核苷酸序列(参见《欧洲微生物学会联合会微生物学快报》(femsmicrobiollett)(femsmicrobiollett.)1999174(2):247-50;《欧洲微生物学会联合会微生物学快报》(femsmicrobiollett)1999177(1):187-8以及在国立卫生研究院的网址的国家生物技术信息中心的网址)。虽然最终同源性%可以按照一致性进行测量,但是比对过程自身典型地不是基于全或无配对比较(all-or-nothingpaircomparison)。相反,通常使用尺度相似性评分矩阵(scaledsimilarityscorematrix),基于化学相似性或进化距离对各个成对比较评分。通常使用的这种矩阵的实例为blosum62矩阵-blast系列程序的默认矩阵。gcg威斯康星程序通常使用公开的默认值或自定义符号比较表(更多细节详见用户手册)。对于一些应用,优选使用gcg软件包的公共默认值,或在其他软件情况下的默认矩阵,如blosum62。可替代地,可以基于类似于clustal(希金斯dg(higginsdg)和夏普pm(sharppm)(1988),《基因》(gene)73(1),237-244)的一种算法,使用在dnasistm(日立软件公司(hitachisoftware))中的多重比对特征来计算同源性百分比。一旦软件已经产生最佳比对,就有可能计算同源性%,优选序列一致性%。软件典型地这样进行,作为序列比较的一部分,并且产生数字结果。这些序列也可以具有氨基酸残基的缺失、插入或取代,其产生沉默变化并生成功能上等同的物质。可以基于氨基酸特性(如残基的极性、电荷、可溶性、疏水性、亲水性、和/或两亲性)的相似性做出有意氨基酸取代,并且因此它在将氨基酸集合成官能团中是有用的。可以仅仅基于氨基酸的侧链特性将它们集合在一起。然而,包括突变数据同样是更有用的。出于结构原因,如此衍生的氨基酸的集合很有可能是保守性的。这些集合可以被描述为文氏图形式(venndiagram)(利文斯敦c.d.(livingstonec.d.)和巴顿g.j.(bartong.j.)(1993)“蛋白质序列比对:用于残基保守些的分级分析的策略”(“proteinsequencealignments:astrategyforthehierarchicalanalysisofresidueconservation”)《生物科学计算应用》(comput.appl.biosci.)9:745-756)(泰勒(taylor)w.r.(1986)“氨基酸保守性的分类”(“theclassificationofaminoacidconservation”)《理论生物学杂志》(j.theor.biol.)119;205-218)。例如可以根据下表做出保守性取代,该表描述了普遍接受的氨基酸的文氏图分组。本发明的实施例包括可包含同源取代(本文使用取代和置换两者来表示现有氨基酸残基或核苷酸与替代残基和核苷酸之间的互换)的序列(多核苷酸或多肽两者),该同源取代,即,在氨基酸的情况下发生同类取代(like-for-likesubstitution),如碱性对碱性、酸性对酸性、极性对极性。也可以发生非同源取代,即,从一类残基到另一类残基,或者可替代地涉及包含非天然氨基酸如鸟氨酸(在下文称为z)、二氨基丁酸鸟氨酸(在下文称为b)、正亮氨酸鸟氨酸(在下文称为o)、吡啶基丙氨酸、噻吩基丙氨酸、萘基丙氨酸和苯基甘氨酸。变体氨基酸序列可以包括适合的可插入在该序列的任何两个氨基酸残基之间的间隔基团,包括除了氨基酸间隔物(如甘氨酸或β-丙氨酸)之外的烷基基团,如甲基、乙基或丙基基团。一个另外的变化形式,其涉及处于类肽形式的一个或多个氨基酸残基的存在,也是本领域技术人员熟知的。为避免疑义,“该类肽形式”用来指代变体氨基酸残基,其中该α-碳取代基在该残基的氮原子上,而不是在该α-碳上。用于制备处于该类肽形式的肽的方法是本领域已知的,例如西蒙rj(simonrj)等人,pnas(1992)89(20),9367-9371和豪威尔dc(horwelldc),《生物技术趋势》(trendsbiotechnol.)(1995)13(4),132-134。除非另有说明,本发明的实践采用免疫学、生物化学、化学、分子生物学、微生物学、细胞生物学、基因组学和重组dna的常规技术,这些在本领域的技能之内。参见萨姆布鲁克(sambrook)、弗里奇(fritsch)和马尼亚蒂斯(maniatis),《分子克隆:实验室手册》(molecularcloning:alaboratorymanual),第2次编辑(1989);《当代分子生物学实验手册》(currentprotocolsinmolecularbiology)(f.m.奥苏贝尔(f.m.ausubel)等人编辑,(1987));《酶学方法》(methodsinenzymology)系列(学术出版公司):《pcr2:实用方法》(pcr2:apracticalapproach)(m.j.麦克弗森(m.j.macpherson)、b.d.黑姆斯(b.d.hames)和g.r.泰勒(g.r.taylor)编辑(1995))、哈洛(harlow)和拉内(lane)编辑(1988)《抗体:实验室手册》(antibodies,alaboratorymanual),以及《动物细胞培养》(animalcellculture)(r.i.弗雷谢尼(r.i.freshney)编辑(1987))。载体在一个方面,本发明提供了在crispr-cas系统的工程化和优化中使用的载体。如本文使用的,“载体”是一种允许或促进一个实体从一个环境转移到另一个环境中的工具。它是一种复制子,如质粒、噬菌体、或粘粒,另一个dna片段可以插入其中,从而引起该插入的片段的复制。通常,当与适当的控制元件关联时,一种载体能够复制。一般而言,术语“载体”是指一种核酸分子,其能够运送与其连接的另一种核酸分子。载体包括但不限于,单链、双链、或部分双链的核酸分子;包括一个或多个自由端、无自由端(例如环状的)的核酸分子;包括dna、rna、或两者的核酸分子;以及本领域已知的其他多种多样的多核苷酸。一种类型的载体是“质粒”,其是指其中可以例如通过标准分子克隆技术插入另外的dna片段的环状双链dna环。另一种类型的载体是病毒载体,其中病毒衍生的dna或rna序列存在于用于包装病毒(例如,逆转录病毒、复制缺陷型逆转录病毒、腺病毒、复制缺陷型腺病毒、以及腺相关病毒(aav))的载体中。病毒载体还包含由用于转染到一种宿主细胞中的病毒携带的多核苷酸。某些载体(例如,具有细菌复制起点的细菌载体和附加型哺乳动物载体)能够在它们被导入的宿主细胞中自主复制。其他载体(例如,非附加型哺乳动物载体)在引入宿主细胞后整合到该宿主细胞的基因组中,并且由此与该宿主基因组一起复制。而且,某些载体能够指导它们可操作连接的基因的表达。这样的载体在此被称为“表达载体”。在重组dna技术中使用的普通表达栽体通常是质粒形式。重组表达载体可包含处于适合于在宿主细胞中的核酸表达的形式的本发明的核酸,这意味着这些重组表达载体包含基于待用于表达的宿主细胞而选择的一种或多种调节元件,所述调节元件可操作地连接至待表达的核酸序列。在重组表达载体内,“可操作地连接”旨在表示感兴趣的核苷酸序列以一种允许该核苷酸序列的表达的方式被连接至该一种或多种调节元件(例如,处于一种体外转录/翻译系统中或当该载体被引入到宿主细胞中时,处于该宿主细胞中)。关于重组和克隆方法,提及2004年9月2日以us2004-0171156a1公开的美国专利申请10/815,730,该专利的内容通过引用以其全文并入本文。本发明的多个方面涉及用于嵌合的rna与cas9的双顺反子载体。用于嵌合的rna与cas9的双顺反子表达载体是优选的。一般而言并且特别地,在这个实施例中,cas9优选由cbh启动子驱动。嵌合rna可以优选地由u6启动子驱动。理想地,将这两者结合。嵌合的指导rna典型地由20bp指导序列(n)组成并且这可以接合到tracr序列上(从下链的第一个“u”到该转录本的结尾)。该tracr序列可以在如指示的不同位置被截短。指导序列和tracr序列被该tracr配对序列隔开,该tracr配对序列可以是guuuuagagcua。这之后可以是如所示的环序列gaaa。这两者都是优选的实例。申请人已经通过surveyor分析证明了在人emx1和pvalb座位处的cas9介导的插入缺失。chirna由其“+n”标志指示,并且crrna是指指导和tracr序列被表达为分开的转录本的杂交体rna。贯穿本申请,嵌合rna也可以被称为单指导、或合成指导rna(sgrna)。该环优选地是gaaa,但是并并限于这个序列或者实际上在长度上仅仅为4bp。实际上,用于在发夹结构中使用的优选环形成序列在长度上为四个核苷酸,并且最优选地具有序列gaaa。然而,可以使用更长或更短的环序列,正如可替代的序列。这些序列优选地包括三联体(例如,aaa)、和另外的核苷酸(例如c或g)。环形成序列的实例包括caaa和aaag。术语“调节元件”旨在包括启动子、增强子、内部核糖体进入位点(ires)、和其他表达控制元件(例如转录终止信号,如多聚腺苷酸化信号和多聚u序列)。这样的调节序列例如描述于戈德尔(goeddel),《基因表达技术:酶学方法》(geneexpressiontechnology:methodsinenzymology)185,学术出版社(academicpress),圣地亚哥(sandiego),加利福尼亚州(1990)中。调节元件包括指导一个核苷酸序列在许多类型的宿主细胞中的组成型表达的那些序列以及指导该核苷酸序列只在某些宿主细胞中表达的那些序列(例如,组织特异型调节序列)。组织特异型启动子可主要指导在感兴趣的期望组织中的表达,所述组织例如肌肉、神经元、骨、皮肤、血液、特定的器官(例如肝脏、胰腺)、或特殊的细胞类型(例如淋巴细胞)。调节元件还可以时序依赖性方式(如以细胞周期依赖性或发育阶段依赖性方式)指导表达,该方式可以是或者可以不是组织或细胞类型特异性的。在一些实施例中,一个载体包含一个或多个poliii启动子(例如1、2、3、4、5、或更多个poliii启动子)、一个或多个polii启动子(例如1、2、3、4、5、或更多个polii启动子)、一个或多个poli启动子(例如1、2、3、4、5、或更多个poli启动子)、或其组合。poliii启动子的实例包括但不限于u6和h1启动子。polii启动子的实例包括但不限于逆转录劳斯肉瘤病毒(rsv)ltr启动子(任选地具有rsv增强子)、巨细胞病毒(cmv)启动子(任选地具有cmv增强子)[参见,例如,波沙特(boshart)等人,《细胞》(cell)41:521-530(1985)]、sv40启动子、二氢叶酸还原酶启动子、β-肌动蛋白启动子、磷酸甘油激酶(pgk)启动子、和ef1α启动子。还被术语“调节元件”涵盖的是增强子元件,如wpre;cmv增强子;在htlv-i的ltr中的r-u5’片段《分子细胞生物学》(mol.cell.biol.,第8(1)卷,第466-472页,1988);sv40增强子;以及在兔β-珠蛋白的外显子2与3之间的内含子序列(《美国国家科学院院刊》(proc.natl.acad.sci.usa.),第78(3)卷,第1527-31页,1981)。本领域技术人员将理解,表达载体的设计可取决于诸如待转化的宿主细胞的选择、所希望的表达水平等因素。一种载体可以被引入到宿主细胞中而由此产生转录物、蛋白质、或肽,包括由如本文所述的核酸编码的融合蛋白或肽(例如,成簇的规律间隔的短回文重复(crispr)转录物、蛋白质、酶、其突变体形式、其融合蛋白,等等)。关于调节序列,提及美国专利申请10/491,026,该专利的内容通过引用以其全文并入本文。关于启动子,提及pct公开wo2011/028929和美国申请12/511,940,这些专利的内容通过引用以其全文并入本文。载体可以被设计为用于在原核或真核细胞中表达crispr转录物(例如核酸转录物、蛋白质、或酶)。例如,crispr转录物可表达于例如大肠杆菌的细菌细胞、昆虫细胞(使用杆状病毒表达载体)、酵母细胞、或哺乳动物细胞中。适合的宿主细胞进一步讨论于goeddel(戈德尔),《基因表达技术:酶学方法》(geneexpressiontechnology:methodsinenzymology)185,学术出版社(academicpress),圣地亚哥(sandiego),加利福尼亚州(calif.)(1990年)中。可替代地,重组表达载体可在体外例如使用t7启动子调节序列和t7聚合酶来转录和翻译。载体可以被引入原核生物或原核细胞中并且在其中增殖。在一些实施例中,原核生物用来扩增有待引入真核细胞中的载体的多个拷贝,或者作为有待引入真核细胞中的载体的产生中的中间载体(例如,扩增质粒作为病毒载体包装系统的一部分)。在一些实施例中,原核生物用来扩增一个载体的多个拷贝并且表达一种或多种核酸,如提供用于递送到宿主细胞或宿主生物中的一种或多种蛋白质的来源。蛋白质在原核生物中的表达最经常在大肠杆菌中用含有指导融合或非融合蛋白的表达的组成型或诱导型启动子的载体来进行。融合载体将多个氨基酸添加到在其中编码的蛋白质上,如该重组蛋白的氨基端上。这样的融合载体可以用于一个或多个目的,如:(i)增加重组蛋白的表达;(ii)增加重组蛋白的溶解性;以及(iii)通过在亲和纯化中充当配体来辅助重组蛋白的纯化。通常,在融合表达载体中,将蛋白切割位点引入至融合部分与重组蛋白的接合处以使得能够在纯化融合蛋白之后将重组蛋白与融合部分分离。这类酶以及它们的同源识别序列包括因子xa、凝血酶以及肠激酶。示例性融合表达载体包括pgex(发玛西亚生物技术有限公司(pharmaciabiotechinc);史密斯和约翰逊,1988,《基因》(gene)67:31-40)、pmal(纽英伦生物技术公司(newenglandbiolabs),贝弗利(beverly),马萨诸塞州(mass.))以及prit5(发玛西亚公司,皮斯卡塔韦(piscataway),新泽西州(n.j.)),它们分别将谷胱甘肽s-转移酶(gst)、麦芽糖e结合蛋白或蛋白a融合至靶重组蛋白。适合的诱导型非融合大肠杆菌表达载体的实例包括ptrc(amrann(阿姆兰)等人,(1988年)《基因》(gene)69:301-315)以及pet11d(studier(斯图迪尔)等人,《基因表达技术:酶学方法》(geneexpressiontechnology:methodsinenzymology)185,学术出版社(academicpress),圣地亚哥(sandiego),加利福尼亚州(calif.)(1990年)60-89。在一些实施例中,载体是酵母表达载体。用于在酵母酿酒中表达的载体的实例包括pyepsec1(巴尔戴利(baldari)等人,1987,《欧洲分子生物学学会杂志》(emboj)6:229-234)、pmfa(库尔坚(kurjan)和赫斯库伍特兹(herskowitz),1982,《细胞》(cell)30:933-943)、pjry88(舒尔茨(schultz)等人,1987,《基因》(gene)54:113-123)、pyes2(invitrogencorporation(英杰公司),sandiego(圣地亚哥),calif(加利福尼亚州))、以及picz(invitrogencorp(英杰公司),sandiego(圣地亚哥),calif(加利福尼亚州))。在一些实施例中,使用杆状病毒载体,载体驱动昆虫细胞中的蛋白质表达。可用于在培养的昆虫细胞(例如,sf9细胞)中表达蛋白质的杆状病毒载体包括pac系列(史密斯(smith)等人,1983,《分子细胞生物学》(mol.cell.biol.)3:2156-2165)和pvl系列(拉克瑙(lucklow)和萨莫斯(summers),1989,《病毒学》(virology)170:31-39)。在一些实施例中,使用哺乳动物表达载体,载体能够驱动一种或多种序列在哺乳动物细胞中表达。哺乳动物表达载体的实例包括pcdm8(锡德(seed),1987,《自然》(nature)329:840)和pmt2pc(考夫曼(kaufman)等人,1987,《欧洲分子生物学学会杂志》(emboj.)6:187-195)。当用于哺乳动物细胞中时,表达载体的控制功能典型地由一种或多种调节元件提供。例如,常用的启动子来源于多瘤、腺病毒2、巨细胞病毒、猴病毒40、以及本文所述和本领域已知的其他病毒。对于用于原核细胞和真核细胞两者的其他适合的表达系统参见例如萨姆布鲁克(sambrook)等人的《分子克隆实验指南》(molecularcloning:alaboratorymanual.)(第2版)的第16和第17章,冷泉港实验室(coldspringharborlaboratory),冷泉港实验室出版社(coldspringharborlaboratorypress),冷泉港(coldspringharbor),纽约,1989。在一些实施例中,重组哺乳动物表达载体能够指导核酸优先在特定细胞类型中表达(例如,使用组织特异型调节元件来表达核酸)。组织特异型调节元件是本领域中已知的。适合的组织特异型启动子的非限制性实例包括白蛋白启动子(肝脏特异性的;平克特(pinkert)等人,1987.《基因发育》(genesdev.)1:268-277),淋巴特异性启动子(卡里曼(calame)和伊顿(eaton),1988.《免疫学进展》(adv.immunol)43:235-275),特别是t细胞受体的启动子(维纳图(winoto)和巴尔迪莫(baltimore),1989.《欧洲分子生物学学会杂志》(emboj.)8:729-733)和免疫球蛋白(巴纳吉(baneiji)等人,1983.《细胞》(cell)33:729-740;奎恩(queen)和巴尔迪莫(baltimore),1983.《细胞》(cell)33:741-748),神经元特异性启动子(例如,神经丝启动子;伯恩(byrne)和鲁德尔(ruddle),1989.《美国科学院院刊》(proc.natl.acad.sciusa)86:5473-5477),胰腺特异性启动子(艾德兰德(edlund)等人,1985.《科学》(science)230:912-916),以及乳腺特异性启动子(例如,乳清启动子;美国专利号4,873,316和欧洲申请公开号264,166)。还涵盖发育型调节启动子,例如,鼠科动物同源框蛋白(hox)启动子凯赛尔((kessel)和格鲁斯(gruss),1990.《科学》(science)249:374-379)和α-甲胎蛋白启动子(卡姆皮斯(campes)和蒂尔曼(tilghman),1989.《基因发育》(genesdev.)3:537-546)。关于这些原核和真核载体,提及美国专利6,750,059,该专利的内容通过引用以其全文并入本文。本发明的其他实施例可涉及病毒载体的使用,关于它提及美国专利申请13/092,085,该专利的内容通过引用以其全文并入本文。组织特异型调节元件是本领域中已知的,并且在这个方面提及美国专利7,776,321,该专利的内容通过引用以其全文并入本文。调节元件在一些实施例中,调节元件可操作地连接至crispr系统的一个或多个元件,从而驱动该crispr系统的该一个或多个元件的表达。一般而言,crispr(规律间隔成簇短回文重复),也称为spidr(spacer间隔开的同向重复),构成通常对于特定细菌物种而言特异性的dna基因座的家族。该crispr座位包含在大肠杆菌中被识别的间隔开的短序列重复(ssr)的一个不同类(石野(ishino)等人,《细菌学杂志》(j.bacteriol.),169:5429-5433;和中田(nakata)等人,《细菌学杂志》(j.bacteriol.),171:3553-3556)、以及相关基因。类似的间隔开的ssr已经鉴定于地中海富盐菌(haloferaxmediterranei)、化脓链球菌、鱼腥藻属、和结核分枝杆菌中(参见,格鲁恩(groenen)等人,《分子微生物学》(mol.microbiol.),10:1057-1065;霍(hoe)等人,《新发感染性疾病》(emerg.infect.dis.),5:254-263;马斯波尔(masepohl)等人,《生物化学与生物物理学学报》(biochim.biophys.acta)1307:26-30;以及莫吉卡(mojica)等人,《分子微生物学》,17:85-93)。这些crispr座位典型地不同于其他ssr的重复结构,这些重复已被称为规律间隔的短重复(srsr)(詹森(janssen)等人,《omics:整合生物学杂志》(omicsj.integ.biol.),6:23-33;以及莫吉卡(mojica)等人,《分子微生物学》(mol.microbiol.),36:244-246)。一般而言,这些重复是以簇存在的短元件,其被具有基本上恒定长度的独特间插序列规律地间隔开(莫吉卡(mojica)等人,,同上)。虽然重复序列在菌株之间是高度保守的,许多间隔开的重复和这些间隔区的序列一般在菌株与菌株之间不同(冯·埃姆登(vanembden)等人,《细菌学杂志》(j.bacteriol.),182:2393-2401)。已经在40种以上的原核生物中鉴定出crispr座位(参见,例如,詹森(janssen)等人,《分子微生物学》(mol.microbiol.),43:1565-1575;以及莫吉卡(mojica)等人,),包括但不限于:气火菌属(aeropyrum)、热棒菌属(pyrobaculum)、硫化叶菌属(sulfolobus)、古球菌属(archaeoglobus)、盐盒菌属(halocarcula)、甲烷杆菌属(methanobacterium)、甲烷球菌属(methanococcus)、甲烷八叠球菌属(methanosarcina)、甲烷火菌属(methanopyrus)、焦球菌属(pyrococcus)、嗜酸菌属(picrophilus)、热原体属(thermoplasma)、棒状杆菌属(corynebacterium)、分枝杆菌属(mycobacterium)、链霉菌属(streptomyces)、产水菌属(aquifex)、紫单胞菌属(porphyromonas)、绿菌属(chlorobium)、栖热菌属(thermus)、芽孢杆菌属(bacillus)、利斯特菌属(listeria)、葡萄球菌属(staphylococcus)、梭菌属(clostridium)、好热厌氧杆菌属(thermoanaerobacter)、支原体属(mycoplasma)、梭杆菌属(fusobacterium)、固氮弓菌属(azarcus)、色杆菌属(chromobacterium)、奈瑟菌属(neisseria)、亚硝化单胞菌属(nitrosomonas)、脱硫弧菌属(desulfovibrio)、地杆菌属(geobacter)、粘球菌属(myxococcus)、弯曲杆菌属(campylobacter)、类杆菌属(wolinella)、不动杆菌属(acinetobacter)、欧文菌属(erwinia)、埃希菌属(escherichia)、军团杆菌属(legionella)、甲基球菌属(methylococcus)、巴斯德菌属(pasteurella)、发光细菌属(photobacterium)、沙门菌属(salmonella)、黄单胞菌属(xanthomonas)、耶尔森菌属(yersinia)、密螺旋体属(treponema)、和栖热袍菌属(thermotoga)。一般而言,“crispr系统”统称为转录物和涉及crispr相关(“cas”)基因的表达或指导其活性的其他元件,包括编码cas基因的序列、tracr(反式激活crispr)序列(例如tracrrna或活性部分tracrrna)、tracr配对序列(涵盖“同向重复”和在内源crispr系统背景下的tracrrna加工的部分同向重复)、指导序列(在内源crispr系统背景下也称为“spacer”)、或来自crispr座位的其他序列和转录物。在本发明的实施例中,术语指导序列和指导rna可互换地使用。在一些实施例中,crispr系统的一个或多个元件来源于i型、ii型、或iii型crispr系统。在一些实施例中,crispr系统的一个或多个元件来源于包含内源crispr系统的特殊生物,如化脓链球菌。一般而言,crispr系统的特征为促进在靶序列的位点处的crispr复合物(在内源crispr系统的背景下也称为原型间隔子)的形成的元件。在crispr复合物形成的背景下,“靶序列”是指指导序列被设计为对其具有互补性的序列,其中在靶序列与指导序列之间的杂交促进crispr复合物的形成。一个靶序列可以包含任何多核苷酸,如dna或rna多核苷酸。在一些实施例中,靶序列位于细胞的细胞核或细胞质中。在一些实施例中,可以通过计算机搜索重复基序来鉴定同向重复,其满足下列标准的任一项或全部:1.发现一个在ii型crispr座位侧翼的基因组序列的2kb窗口;2.跨从20到50bp;以及3.以20到50bp间隔开。在一些实施例中,可以使用这些标准中的2条,例如1和2、2和3、或1和3。在一些实施例中,可以使用所有这3条标准。在一些实施例中,随后可以通过满足下列标准的任一项或全部的序列来预测候选tracrrna:1.与同向重复同源的序列(在geneious中搜索的具有高达18-bp错配的基序);2.在转录方向上的预测的不依赖rho的转录终止子的存在;以及3.在tracrrna与同向重复之间的稳定发夹二级结构。在一些实施例中,可以使用这些标准中的2条,例如1和2、2和3、或1和3。在一些实施例中,可以使用所有这3条标准。在一些实施例中,嵌合的合成指导rna(sgrna)设计可以在同向重复与tracrrna之间掺入至少12bp的双链体结构。在本发明的优选实施例中,该crispr系统是一个ii型crispr系统,并且该cas酶是cas9,其催化dna切割。通过来源于化脓链球菌或cas9或任何密切相关的cas9的酶促作用,产生了在靶位点序列处的双链断裂,所述靶位点序列杂交到该指导序列的20个核苷酸上并且具有在该靶序列的20个核苷酸之后的原型间隔子相邻基序(pam)序列(实例包括ngg/nrg或可以如本文所述进行确定的pam)。经由cas9的对于位点特异性dna识别和切割的crispr活性是由该指导序列、部分杂交到该指导序列上的tracr序列以及该pam序列定义的。该crispr系统的更多方面描述于卡吉诺夫(karginov)和汉农(hannon)的“crispr系统:在细菌和古细菌中的小rna指导的防御”(thecrisprsystem:smallrna-guideddefenceinbacteriaandarchaea),《分子细胞学杂志》(molecell)2010,1月15日;37(1):7。ii型crispr座位来自化脓链球菌sf370,该座位含有四个基因cas9、cas1、cas2和csn1的聚簇以及两个非编码rna元件tracrrna和由非重复序列的短段(间隔子,每个约30bp)间隔开的重复序列(同向重复)的特征性阵列。在此系统中,以四个连续步骤产生靶向的dna双链断裂(dsb)(图2a)。第一步,从crispr座位转录两个非编码rnapre-crrna阵列和tracrrna。第二步,将tracrrna杂交到pre-crrna的同向重复上,然后将其加工成含有单独的间隔子序列的成熟crrna。第三步,该成熟crrna:tracrrna复合物经由在crrna的间隔子区与原型间隔子dna之间形成异源双链体而将cas9指向由原型间隔子和对应的pam组成的dna靶标。最后,cas9介导pam上游的靶dna的切割,以在原型间隔子内产生一个dsb(图2a)。图2b证明了该密码子优化的cas9的核定位。为了促进转录精确起始,选择基于rna聚合酶iii的u6启动子,以驱动tracrrna的表达(图2c)。类似地,研发基于u6启动子的构建体,以表达包含侧翼为两个同向重复(dr,还被术语“tracr配对序列”所涵盖;图2c)的单个间隔子的pre-crrna阵列。将起始间隔子设计成靶向人emx1座位(图2c)中的33-碱基对(bp)靶位点(满足cas9的ngg识别基序的30-bp原型间隔子加3-bpcrispr基序(pam)序列),该座位是大脑皮层的发育中的一个关键基因。典型地,在内源crispr系统的背景下,crispr复合物(包含杂交到靶序列上并且与一种或多种cas蛋白复合的指导序列)的形成导致在该靶序列中或其附近(例如在1、2、3、4、5、6、7、8、9、10、20、50、或更多个碱基对之内)的一条链或两条链的切割。不希望受到理论的束缚,该tracr序列(其可以包含或其组成为野生型tracr序列的全部或部分(例如野生型tracr序列的约或多于约20、26、32、45、48、54、63、67、85个、或更多个核苷酸))也可以形成crispr复合物的一部分,如通过沿着该tracr序列的至少一部分杂交到与该指导序列可操作地连接的tracr配对序列的全部或部分上。在一些实施例中,将驱动crispr系统的一个或多个元件的表达的一种或多种载体引入到宿主细胞中,使得该crispr系统的这些元件的表达在一个或多个靶位点指导crispr复合物的形成。例如,cas酶、连接到tracr配对序列上的指导序列、以及tracr序列可以各自可操作地连接到在分开的载体上的分开的调节元件上。可替代地,从相同或不同调节元件表达的二个或更多个元件可以结合在单个载体中,其中提供该crispr系统的任何组分的一个或多个另外的载体不包括在第一载体中。结合在单个载体中的crispr系统元件可以按照任何适合的取向排列,如一个元件相对于第二元件位于5’(“上游”)或3’(“下游”)。一个元件的编码序列可以位于第二元件的编码序列的同一条链或相对链上,并且取向为相同或相对的方向。在一些实施例中,单个启动子驱动编码crispr酶的转录物以及该指导序列、tracr配对序列(任选地可操作地连接到该指导序列上)、和嵌入在一个或多个内含子序列之内(例如,各自在不同的内含子中,两个或更多个在至少一个内含子中,或者全部都在单个内含子中)的tracr序列中的一者或多者的表达。在一些实施例中,该crispr酶、指导序列、tracr配对序列、和tracr序列可操作地连接到相同的启动子上并且从其表达。在一些实施例中,一个载体包含一个或多个插入位点,如限制性核酸内切酶识别序列(也称为“克隆位点”)。在一些实施例中,一个或多个插入位点(例如,约或多于约1、2、3、4、5、6、7、8、9、10个、或更多个插入位点)位于一种或多种载体的一个或多个序列元件的上游和/或下游。在一些实施例中,一个载体包含在tracr配对序列的上游、并且任选地在可操作地连接到该tracr配对序列上的调节元件的下游的插入位点,使得在将指导序列插入到该插入位点中之后并且在表达时该指导序列指导crispr复合物与真核细胞中的靶序列的序列特异性结合。在一些实施例中,一个载体包含一个或多个插入位点,每个插入位点位于两个tracr配对序列之间,从而允许在每个位点插入指导序列。在这样一种安排中,两个或更多个指导序列可以包含两个或更多个拷贝的单指导序列、两个或更多个不同的指导序列、或这些的组合。当使用多个不同的指导序列时,可以使用单个表达构建体使crispr活性靶向到细胞内的多个不同的相应靶序列。例如,单个载体可以包含约或多于约1、2、3、4、5、6、7、8、9、10、15、20个、或更多个指导序列。在一些实施例中,可以提供约或多于约1、2、3、4、5、6、7、8、9、10个、或更多个这样的含有靶序列的载体,并且任选地将其递送到细胞中。在一些实施例中,一个载体包含可操作地连接到编码crispr酶(如cas蛋白)的酶编码序列上的调节元件。cas蛋白的非限制性实例包括:cas1、cas1b、cas2、cas3、cas4、cas5、cas6、cas7、cas8,cas9(也称为csn1和csx12)、cas10、csy1、csy2、csy3、cse1、cse2、csc1、csc2、csa5、csn2、csm2、csm3、csm4、csm5、csm6、cmr1、cmr3、cmr4、cmr5、cmr6、csb1、csb2、csb3、csx17、csx14、csx10、csx16、csax、csx3、csx1、csx15、csf1、csf2、csf3、csf4、其同源物、或其修饰形式。在一些实施例中,未修饰的crispr酶如cas9具有dna切割活性。在一些实施例中,该crispr酶指导在靶序列位置处(例如在该靶序列之内和/或在该靶序列的互补物之内)的一条链或两条链的切割。在一些实施例中,该crispr酶指导距离靶序列的第一个或最后一个核苷酸约1、2、3、4、5、6、7、8、9、10、15、20、25、50、100、200、500个、或更多个碱基对之内的一条链或两条链的切割。在一些实施例中,一个载体编码相对于相应的野生型酶被突变的crispr酶,使得该突变的crispr酶缺乏切割含有一个靶序列的靶多核苷酸的一条链和两条链的能力。例如,在来自化脓链球菌的cas9的ruvci催化结构域中的天冬氨酸到丙氨酸取代(d10a)将cas9从切割两条链的核酸酶转化成切口酶(切割单条链)。致使cas9为切口酶的其他突变实例包括而不限于h840a、n854a、和n863a。作为一个另外的实例,cas9的两个或更多个催化结构域(ruvci、ruvcii、和ruvciii或该hnh结构域)可以被突变为产生实质上缺乏所有dna切割活性的突变的cas9。在一些实施例中,d10a突变与h840a、n854a、或n863a突变的一者或多者相组合,以便产生实质上缺乏所有dna切割活性的cas9酶。在一些实施例中,当该突变的crispr酶的dna切割活性比它的非突变形式低约25%、10%、5%、1%、0.1%、0.01%、或更少时,则该酶被考虑为实质上缺乏所有dna切割活性。在该酶不是spcas9的情况下,可以在相应于spcas9的位置10、762、840、854、863和/或986的任何或所有残基处进行突变(其可以例如通过标准序列比较工具进行确定)。具体地说,在spcas9中的任何或所有下列突变是优选的:d10a、e762a、h840a、n854a、n863a和/或d986a;并且还设想了这些置换氨基酸的任何一种的保守性取代。在其他cas9中的相应位置处的相同取代(或这些突变的保守性取代)也是优选的。特别优选的是在spcas9中的d10和h840。然而,在其他cas9中,相应于spcas9d10和h840的残基也是优选的。另外,将spcas9的ruvci催化结构域中的天冬氨酸至丙氨酸取代(d10a)工程化,以将核酸酶转化为切口酶(spcas9n)(参见例如萨普拉诺萨克斯(sapranauskas)等人,2011,《核酸研究》(nucleicacisresearch),39:9275;加索纳斯(gasiunas)等人,2012,《美国国家科学院院刊》(proc.natl.acad.sci.usa),109:e2579),这样使得带切口的基因组dna经历高保真同源定向修复(hdr)。surveyor测定确认到,spcas9n在emx1原型间隔子靶标处不产生插入缺失。靶向emx1的嵌合crrna(同样具有tracrrna组分)与spcas9的共表达在靶位点中产生插入缺失,而与spcas9n的共表达则不然(n=3)。此外,327个扩增子的测序未检测到由spcas9n诱导的任何插入缺失。选择相同的座位,以通过用靶向emx1、hspcas9或hspcas9n的嵌合的rna以及用于在原型间隔子附近引入一对限制酶切位点(hindiii和nhei)的hr模板共转染hek293ft细胞而测试crispr介导的hr。本文描述了优选的直向同源物。一种cas酶可以被鉴定为cas9,因为这可以是指与来自ii型crispr系统的具有多个核酸酶结构域的最大核酸酶共享同源性的酶的通用类别。最优选地,该cas9酶来自或衍生自spcas9或sacas9。关于衍生,申请人意指该衍生的酶在很大程度上是基于与野生型酶具有高度序列同源性的含义,但是如本文所述它在某些方面已经被突变(修饰)。应当理解的是,术语cas和crispr酶在本文中通常可互换地使用,除非另外说明。如上提及的,在本文中使用的许多残基编号是指来自化脓链球菌中的ii型crispr位点的cas9酶。然而,应当理解的是,本发明包括更多的来自其他微生物物种的cas9s,如spcas9、saca9、st1cas9等等。密码子优化本文中提供了在这种情形下针对人类进行优化(即,针对在人类中表达进行优化)的密码子优化序列的实例,参见sacas9人类密码子优化序列。在这被优化的同时,应当理解其他实例是可能的并且针对宿主物种的密码子优化是已知的。在一些实施例中,编码crispr酶的酶编码序列经密码子优化,以便在特定的细胞如真核细胞中表达。这些真核细胞可以是特定生物的那些或来源于特定生物,如哺乳动物,包括但不限于人、小鼠、大鼠、兔、狗、或非人类哺乳动物或灵长动物。在一些实施例中,对于人类或动物而言很可能使得他们(它们)受苦而没有任何实质性医学益处的用于修饰人类的种系遗传同一性的方法和/或用于修饰动物的遗传同一性的方法、以及还有作为这样的方法的结果的动物,可以被排除在外。一般而言,密码子优化是指通过用在宿主细胞的基因中更频繁地或者最频繁地使用的密码子代替天然序列的至少一个密码子(例如约或多于约1、2、3、4、5、10、15、20、25、50个、或更多个密码子同时维持该天然氨基酸序列而修饰一个核酸序列以便增强在感兴趣宿主细胞中的表达的方法。不同的物种对于具有特定氨基酸的某些密码子展示出特定的偏好。密码子偏好性(在生物之间的密码子使用的差异)经常与信使rna(mrna)的翻译效率相关,而该翻译效率则被认为依赖于(除其他之外)被翻译的密码子的性质和特定的转运rna(trna)分子的可用性。细胞内选定的trna的优势一般反映了最频繁用于肽合成的密码子。因此,可以将基因定制为基于密码子优化在给定生物中的最佳基因表达。密码子利用率表可以容易地获得,例如在www.kazusa.orjp/codon/(2002年7月9日访问)上可获得的密码子使用数据库(“codonusagedatabase”)中,并且这些表可以通过不同的方式调整适用。参见,中村y.(nakamuray.)等人,“从国际dna序列数据库中制表的密码子使用:2000年的状态”(codonusagetabulatedfromtheinternationaldnasequencedatabases:statusfortheyear2000)”《核酸研究》(nucl.acidsres.)28:292(2000年)。用于密码子优化特定的数列以便在特定的宿主细胞中表达的计算机算法也是可得的,如基因制造(geneforge)(aptagen公司;雅各布斯(jacobus),pa),也是可得的。在一些实施例中,在编码crispr酶的序列中的一个或多个密码子(例如1、2、3、4、5、10、15、20、25、50个、或更多个、或所有密码子)相应于对于特定氨基酸最频繁使用的密码子。核定位序列(nls)在一些实施例中,一种载体编码包含一个或多个核定位序列(nls)如约或多于约1、2、3、4、5、6、7、8、9、10个、或更多个nls的crispr酶。在一些实施例中,该crispr酶包含在或接近于氨基端的约或多于约1、2、3、4、5、6、7、8、9、10个、或更多个nls,在或接近于羧基端约或多于约1、2、3、4、5、6、7、8、9、10个、或更多个nls,或这些的组合(例如在氨基端的一个或多个nls以及在羧基端的一个或多个nls)。当存在多于一个nls时,每一个可以被选择为不依赖于其他nls,使得在多于一个拷贝中可以存在单个nls和/或与在一个或多个拷贝中存在一个或多个其他nls相组合。在本发明的一个优选实施例中,该crispr酶包含至多6个nls。在一些实施例中,当nls的最近的氨基酸是在从n端或c端沿着该多肽链的约1、2、3、4、5、10、15、20、25、30、40、50个、或更多个氨基酸之内时,nls可以被视为接近该n端或c端。nls的非限制性实例包括来源于以下项的nls序列:sv40病毒大t抗原的nls,其具有氨基酸序列pkkkrkv;来自核质蛋白的nls(例如,具有序列krpaatkkagqakkkk的核质蛋白二分nls);c-mycnls,其具有氨基酸序列paakrvkld或rqrrnelkrsp;hrnpa1m9nls,其具有序列nqssnfgpmkggnfggrssgpyggggqyfakprnqggy;来自输入蛋白-α的ibb结构域的序列rmrizfknkgkdtaelrrrrvevsvelrkakkdeqilkrrnv;肌瘤t蛋白的序列vsrkrprp和ppkkared;人p53的序列popkkkpl;小鼠c-abliv的序列salikkkkkmap;流感病毒ns1的序列drlrr和pkqkkrk;肝炎病毒δ抗原的序列rklkkkikkl;小鼠mx1蛋白的序列rekkkflkrr;人聚(adp-核糖)聚合酶的序列krkgdevdgvdevakkkskk;以及类固醇激素受体(人)糖皮质激素的序列rkclqagmnlearktkk。一般而言,该一个或多个nls具有足够的强度,以便在真核细胞的核中驱动该crispr复合物以可检测到的量积聚。一般而言,核定位活性的强度可以驱动在该crispr酶中的nls的数目、所使用的一个或多个特定的nls、或这些因素的组合。可以通过任何适合的技术进行细胞核中积聚的检测。例如,一种检测标记可以融合到crispr酶上,使得细胞内的位置可以被可视化,如与检测细胞核的位置的手段(例如,对于细胞核特异的染料,如dapi)相结合。还可以将细胞核从细胞中分离出来,然后可以通过任何适合的用于检测蛋白质的方法分析其内容物,如免疫组织化学、蛋白质印迹或酶活性测定。如通过测定crispr复合物形成的作用(例如,测定在靶序列处的dna切割或突变、或测定由于crispr复合物形成和/或crispr酶活性的影响而改变的基因表达活性),与没有暴露于crispr酶或复合物、或暴露于缺乏该一个或多个nls的crispr酶的对照相比较,还可以间接地确定细胞核中的积聚。指导序列一般而言,指导序列是与靶多核苷酸序列具有足够互补性以便与该靶序列杂交并且指导crispr复合物与该靶序列的序列特异性结合的任何多核苷酸序列。在一些实施例中,当使用适合的比对算法进行最佳比对是,在指导序列与其相应的靶序列之间的互补程度是约或多于约50%、60%、75%、80%、85%、90%、95%、97.5%、99%、或更多。可以使用用于比对序列的任何适合的算法来确定最佳比对,其非限制性实例包括史密斯-沃特曼(smith-waterman)算法、尼德曼-翁施(needleman-wunsch)算法、基于伯罗斯-惠勒变换(burrows-wheelertransform)的算法(例如伯罗斯-惠勒比对工具(burrowswheeleraligner))、clustalw、clustalx、blat、novoalign(novocraft技术公司;在www.novocraft.com可获得)、eland(亿明达公司(illumina),圣地亚哥,加利福尼亚州)、soap(在soap.genomics.org.cn可获得)、以及maq(在maq.sourceforge.net可获得)。在一些实施例中,指导序列在长度上为约或多于约5、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50、75个、或更多个核苷酸。在一些实施例中,指导序列在长度上为少于约75、50、45、40、35、30、25、20、15、12个、或更少的核苷酸。可以通过任何适合的测定法来评估指导序列指导crispr复合物与靶序列的序列特异性结合的能力。例如,足以形成crispr复合物的crispr系统的组分,包括有待测试的指导序列在内,可以例如通过用编码该crispr序列的组分的载体进行转染而被提供到具有相应靶序列的宿主细胞中,随后通过如本文所述的测量员测定来评估在该靶序列之内的优先切割。类似地,通过提供该靶序列、包括有待测试的指导序列在内的crispr复合物的组分、和不同于该测试指导序列的对照指导序列,并且比较在该测试指导序列与该对照指导序列反应之间的靶序列处的结合或切割率,可以在一个试管中评估靶多核苷酸序列的切割。其他测定法是可能的,并且将由本领域技术人员想到。指导序列可以被选择为靶向任何靶序列。在一些实施例中,该靶序列是在细胞的基因组内的序列。示例性靶序列包括在靶基因组中为独特的那些。例如,对于化脓链球菌cas9,在基因组中的独特靶序列可以包括形式mmmmmmmmnnnnnnnnnnnnxgg的cas9靶位点,其中nnnnnnnnnnnnxgg(n是a、g、t、或c;并且x可以是任何物)在该基因组中单次出现。在基因组中的独特靶序列可以包括形式mmmmmmmmmnnnnnnnnnnnxgg的化脓链球菌cas9靶位点,其中nnnnnnnnnnnxgg(n是a、g、t、或c;并且x可以是任何物)在该基因组中单次出现。对于嗜热链球菌crispr1cas9,在基因组中的独特靶序列可以包括形式mmmmmmmmnnnnnnnnnnnnxxagaaw的cas9靶位点,其中nnnnnnnnnnnnxxagaaw(n是a、g、t、或c;x可以是任何物;并且w是a或t)在该基因组中单次出现。在基因组中的独特靶序列可以包括形式mmmmmmmmmnnnnnnnnnnnxxagaaw的嗜热链球菌crispr1cas9靶位点,其中nnnnnnnnnnnxxagaaw(n是a、g、t、或c;x可以是任何物;并且w是a或t)在该基因组中单次出现。对于化脓链球菌cas9,在基因组中的独特靶序列可以包括形式mmmmmmmmnnnnnnnnnnnnxggxg的cas9靶位点,其中nnnnnnnnnnnnxggxg(n是a、g、t、或c;并且x可以是任何物)在该基因组中单次出现。在基因组中的独特靶序列可以包括形式mmmmmmmmmnnnnnnnnnnnxggxg的化脓链球菌cas9靶位点,其中nnnnnnnnnnnxggxg(n是a、g、t、或c;并且x可以是任何物)在该基因组中单次出现。在这些序列的每一个中,“m”可以是a、g、t、或c,并且在序列鉴定中不必考虑为是独特的。在一些实施例中,指导序列被选择为降低在该指导序列内的二级结构程度。在一些实施例中,在最佳地折叠时,该指导序列的约或少于约75%、50%、40%、30%、25%、20%、15%、10%、5%、1%、或更少的核苷酸参与自我互补碱基配对。可以通过任何适合的多核苷酸折叠算法来确定最佳折叠。一些算法是基于计算最小吉布斯(gibbs)自由能。一种这样的算法的实例是mfold,正如祖克(zuker)和施蒂格勒(stiegler)《核酸研究》(nucleicacidsres.)9(1981),133-148)所描述。折叠算法的另一个实例是使用由维也纳大学(universityofvienna)的理论化学研究所(institutefortheoreticalchemistry)研发的在线网络服务器rnafold(参见例如a.r.格鲁伯(a.r.gruber)等人,2008,《细胞》(cell)106(1):23-24;以及pa卡尔(pacarr)和gm丘奇(gmchurch),2009,《自然生物技术》(naturebiotechnology)27(12):1151-62)。tracr配对序列一般而言,tracr配对序列包括与tracr序列具有足够互补性以促进下列一项或多项的任何序列:(1)在含有相应tracr序列的细胞中的侧翼为tracr配对序列的指导序列的切除;以及(2)在靶序列处的crispr复合物的形成,其中该crispr复合物包含杂交到tracr序列上的tracr配对序列。通常,互补程度是就tracr配对序列与tracr序列沿着这两个序列的较短者的长度的最佳比对而言。可以通过任何适合的比对算法来确定最佳比对,并且可以可以进一步对二级结构做出解释,如在该tracr序列或tracr配对序列之内的自我互补性。在一些实施例中,在进行最佳比对时,在该tracr序列与tracr配对序列之间沿着这两者的较短者的长度的互补程度是约或多于约25%、30%、40%、50%、60%、70%、80%、90%、95%、97.5%、99%、或更高。在一些实施例中,该tracr序列在长度上为约或多于约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、25、30、40、50个、或更多个核苷酸。在一些实施例中,该tracr序列和tracr配对序列被包含在单个转录物中,使得在这两者之间的杂交产生具有二级结构(如发夹)的转录物。在本发明的一个实施例中,该转录物或转录的多核苷酸序列具有至少两个或更多个发夹。在优选的实施例中,该转录物具有两个、三个、四个或五个发夹。在本发明的一个另外的实施例中,该转录物具有至多五个发夹。在一个发夹结构中,在该环的最终“n”和上游的序列5’的部分相应于该tracr配对序列,并且该环的序列3’的部分相应于该tracr序列。另外的包含指导序列、tracr配对序列、和tracr序列的单个多核苷酸的非限制性实例如下(列出为5’到3’),其中“n”代表指导序列的碱基,小写字体的第一区代表tracr配对序列,且小写字体的第二区代表tracr序列,并且该最后的多聚t序列代表转录终止子:(1)nnnnnnnnnnnnnnnnnnnngtttttgtactctcaagatttagaaataaatcttgcagaagctacaaagataaggcttcatgccgaaatcaacaccctgtcattttatggcagggtgttttcgttatttaatttttt;(2)nnnnnnnnnnnnnnnnnnnngtttttgtactctcagaaatgcagaagctacaaagataaggcttcatgccgaaatcaacaccctgtcattttatggcagggtgttttcgttatttaatttttt;(3)nnnnnnnnnnnnnnnnnnnngtttttgtactctcagaaatgcagaagctacaaagataaggcttcatgccgaaatcaacaccctgtcattttatggcagggtgttttttt;(4)nnnnnnnnnnnnnnnnnnnngttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgctttttt;(5)nnnnnnnnnnnnnnnnnnnngttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtgttttttt;和(6)nnnnnnnnnnnnnnnnnnnngttttagagctagaaatagcaagttaaaataaggctagtccgttatcatttttttt。在一些实施例中,序列(1)到(3)与来自嗜热链球菌crispr1的cas9结合使用。在一些实施例中,序列(4)到(6)与来自化脓链球菌crispr1的cas9结合使用。在一些实施例中,该tracr序列是一个与包含该tracr配对序列的转录物分开的转录物。重组模板在一些实施例中,还提供了重组模板。重组模板可以是如本文所述的另一个载体的组分,其被包含在一个分开的载体中,或者被提供为一个分开的多核苷酸。在一些实施例中,重组模板被设计为用作在同源重组中的模板,如在被作为crispr复合物的一部分的crispr酶切开或切割的靶序列之内或在其附近。模板多核苷酸可以具有任何适合的长度,如约或多于约10、15、20、25、50、75、100、150、200、500、1000个、或更多个核苷酸长度。在一些实施例中,该模板多核苷酸与包含该靶序列的多核苷酸的一部分互补。当进行最佳比对时,模板多核苷酸可能与靶序列的一个或多个核苷酸(例如约或多于约1、5、10、15、20个、或更多个核苷酸)重叠。在一些实施例中,当一个模板序列与包含靶序列的多核苷酸进行最佳比对时,该模板多核苷酸的最近的核苷酸在距离该靶序列的约1、5、10、15、20、25、50、75、100、200、300、400、500、1000、5000、10000个、或更多个核苷酸之内。融合蛋白在一些实施例中,该crispr酶是包含一个或多个异源蛋白结构域(例如除了该crispr酶之外的约或多于约1、2、3、4、5、6、7、8、9、10个、或更多个结构域)的融合蛋白的一部分。crispr酶融合蛋白可以包含任何其他蛋白质,以及任选地在任何两个结构域之间的连接序列。可以融合到crispr酶上的蛋白质结构域的实例包括但不限于,表位标签、报告基因序列、以及具有下列活性的一者或多者的蛋白质结构域:甲基酶活性、脱甲基酶活性、转录激活活性、转录阻抑活性、转录释放因子活性、组蛋白修饰活性、rna切割活性和核酸结合活性。表位标签的非限制性实例包括组氨酸(his)标签、v5标签、flag标签、流感病毒血凝素(ha)标签、myc标签、vsv-g标签、和硫氧还蛋白(trx)标签。报告基因的实例包括,但不限于,谷胱甘肽-s-转移酶(gst)、辣根过氧化物酶(hrp)、氯霉素乙酰转移酶(cat)、β-半乳糖苷酶、β-葡糖醛酸糖苷酶、萤光素酶、绿色荧光蛋白(gfp)、hcred、dsred、青荧光蛋白(cfp)、黄色荧光蛋白(yfp)、以包括蓝色荧光蛋白(bfp)的自发荧光蛋白。crispr酶可以融合到编码一种蛋白质或蛋白质片段的基因序列上,所述蛋白质或蛋白质片段结合dna分子或结合其他细胞分子,其包括,但不限于,麦芽糖结合蛋白(mbp)、s-tag、lexadna结合结构域(dbd)融合物、gal4dna结合结构域融合物、以及单纯疱疹病毒(hsv)bp16蛋白融合物。可以形成包含crispr酶的融合蛋白的一部分的另外的结构域描述于us20110059502中,通过引用将其并入本文。在一些实施例中,使用标记的crispr酶来鉴定靶序列的位置。可诱导系统在一些实施例中,crispr酶可以形成可诱导系统的组分。该系统的诱导性质将允许该系统利用一种能量形式对基因编辑或基因表达进行时空控制。该能量形式可以包括但不限于,电磁辐射、声能、化学能和热能。可诱导系统的实例包括四环素诱导型启动子(tet-on或tet-off)、小分子双杂交转录激活系统(fkbp、aba等))或光可诱导系统(光敏色素、lov结构域或隐花色素)。在一个实施例中,该crispr酶可以是以序列特异性方式指导转录活性的变化的光诱导的转录效应因子(lite)的一部分。光的组分可以包括crispr酶、光响应细胞色素异二聚体(例如,来自拟南芥)、以及转录激活/抑制结构域。诱导型dna结合蛋白和关于使用它们的方法的其他实例提供在us61/736465和us61/721,283中,特此通过引用以其全文并入。递送在一些方面,本发明提供了以下方法,这些方法包括向宿主细胞递送一种或多种多核苷酸,如或如在此描述的一种或多种载体、其一种或多种转录本和/或一种或自其转录的蛋白。在一些方面,本发明进一步提供了通过这样的方法产生的细胞以及包括这样的细胞或由这样的细胞产生的动物。在一些实施例中,将与(并且任选地与其复合)指导序列组合的crispr酶递送至细胞。可以使用常规的病毒和非病毒基的基因转移方法将核酸引入哺乳动物细胞或靶组织中。可以使用这样的方法向培养物中或宿主生物中的细胞给予编码crispr系统的组分的核酸。非病毒载体递送系统包括dna质粒、rna(例如在此描述的载体的转录本)、裸核酸以及与递送赋形剂(如脂质体)复合的核酸。病毒载体递送系统包括dna和rna病毒,在被递送至细胞后它们具有游离型或整合型基因组。关于基因疗法程序的综述,参见安德森(anderson),《科学》(science)256:808-813(1992);纳贝尔(nabel)&费尔格纳(felgner),tibtech11:211-217(1993);三谷(mitani)&卡斯基(caskey),tibtech11:162-166(1993);狄龙(dillon),tibtech11:167-175(1993);米勒(miller),《自然》(nature)357:455-460(1992);范·布朗特(vanbrunt),《生物技术》(biotechnology)6(10):1149-1154(1988);维涅(vigne),《恢复神经学和神经科学》(restorativeneurologyandneuroscience)8:35-36(1995);克雷默(kremer)&佩里科德特(perricaudet),《英国医学公报》(britishmedicalbulletin)51(1):31-44(1995);哈嗒嗒(haddada)等人,在《微生物学和免疫学当前主题》(currenttopicsinmicrobiologyandimmunology)中多尔夫勒(doerfler)和博姆(编辑)(1995);以及余(yu)等人,《基因疗法》(genetherapy)1:13-26(1994)。核酸的非病毒递送方法包括脂转染、显微注射、基因枪、病毒颗粒、脂质体、免疫脂质体、聚阳离子或脂质:核酸共轭物、裸dna、人工病毒体以及dna的试剂增强的摄取。脂转染描述于例如美国专利号5,049,386、4,946,787和4,897,355中并且脂转染试剂是市售的(例如,transfectamtm和lipofectintm)。适于多核苷酸的有效的受体识别脂转染的阳离子和中性脂质包括felgner(费尔格纳),wo91/17424;wo91/16024的那些。递送可以针对细胞(例如体外或离体给予)或靶组织(例如体内给予)。脂质:核酸复合物(包括靶向的脂质体,如免疫脂质复合物)的制备是本领域的技术人员熟知的(参见例如,克丽丝特尔(crystal),《科学》(science)270:404-410(1995);布莱泽(blaese)等人,《癌症基因疗法》(cancergenether.)2:291-297(1995);贝尔(behr)等人,《生物共轭化学》(bioconjugatechem.)5:382-389(1994);雷米(remy)等人,《生物共轭化学》5:647-654(1994);高(gao)等人,《基因疗法》(genetherapy)2:710-722(1995);艾哈迈德(ahmad)等人,《癌症研究》(cancerres.)52:4817-4820(1992);美国专利号4,186,183、4,217,344、4,235,871、4,261,975、4,485,054、4,501,728、4,774,085、4,837,028以及4,946,787)。使用rna或dna病毒基的系统递送核酸利用将病毒靶向体内的特定细胞并将病毒有效负荷(payload)运至细胞核中的高度进化的过程。可以将病毒载体直接给予至患者(体内)或可以使用它们在体外处理细胞,并且任选地,可以将修饰的细胞给予至患者(离体)。常规的病毒基的系统可以包括用于基因转移的逆转录病毒载体、慢病毒载体、腺病毒载体、腺相关病毒载体以及单纯疱疹病毒载体。用逆转录病毒、慢病毒和腺相关病毒基因转移方法整合进宿主基因组中是可能的,这通常导致插入转基因的长期表达。另外,已经在不同细胞类型和靶组织中观察到高转导效率。可以通过掺入外源包膜蛋白,扩展靶细胞的潜在靶群而改变逆转录病毒的向性。慢病毒载体是能够转导或感染非分裂细胞并典型地产生较高病毒效价的逆转录病毒载体。因此,逆转录病毒基因转移系统的选择将依赖于靶组织。逆转录病毒载体由顺式作用长末端重复组成,这些长末端重复具有包装多达6-10kb的外源序列的能力。最低量的顺式作用ltr对于载体的复制和包装而言是足够的,然后使用这些载体将治疗基因整合进靶细胞中,以提供永久的转基因表达。广泛使用的逆转录病毒载体包括基于鼠白血病病毒(mulv)、长臂猿白血病病毒(galv)、猴免疫缺陷病毒(siv)、人类免疫缺陷病毒(hiv)及其组合的那些(参见例如,布赫谢尔(buchscher)等人,《病毒学杂志》(j.virol.)66:2731-2739(1992);约翰(johann)等人,《病毒学杂志》66:1635-1640(1992);佐姆内尔费尔特(sommnerfelt)等人,《病毒学》(virol.)176:58-59(1990);威尔逊(wilson)等人,《病毒学杂志》63:2374-2378(1989);米勒(miller)等人,《病毒学杂志》65:2220-2224(1991);pct/us94/05700)。在另一个实施例中,考虑了科卡尔(cocal)水泡性病毒包膜假型逆转录病毒载体粒子(参见例如,转让给弗雷德·哈钦森癌症研究中心(fredhutchinsoncancerresearchcenter)的美国专利公开号20120164118)。科卡尔病毒属于水泡性病毒属,并且是一种哺乳动物水泡性口炎病原体。科卡尔病毒最初分离自特立尼达拉岛(trinidad)的螨(琼克斯(jonkers)等人,《美国兽医研究杂志》(am.j.vet.res.)25:236-242(1964)),并且已经在特立尼达拉岛、巴西和阿根廷从昆虫、牛和马体内鉴定出感染。已经从天然地感染的节肢动物体内分离出感染哺乳动物的水泡性病毒中的许多,表明它们是媒介传播的。水疱性病毒抗体在居住于这些病毒是地方性的且是实验室获得的农村地区的人中间是常见的;人类感染通常导致流感样症状。科卡尔病毒包膜糖蛋白在氨基酸水平上与印第安纳vsv-g(vsv-gindiana)具有71.5%一致性,并且水疱性病毒的包膜基因的系统发育比较显示科卡尔病毒在血清学上与印第安纳vsv-g株不同,但是在水疱性病毒中间与其最密切相关。琼克斯(jonkers)等人,《美国兽医研究杂志》(am.j.vet.res.)25:236-242(1964)和特拉瓦索德罗萨(travassosdarosa)等人,《美国热带药学与卫生学杂志》(am.j.tropicalmed.&hygiene)33:999-1006(1984)。科卡尔水疱性病毒包膜假型逆转录病毒载体粒子可以包括例如慢病毒、α逆转录病毒、β逆转录病毒、γ逆转录病毒、δ逆转录病毒以及ε逆转录病毒载体粒子,这些粒子可以包括逆转录病毒gag、pol和/或一种或多种辅助蛋白以及科卡尔水疱性病毒包膜蛋白。在这些实施例的某些方面内,gag、pol和辅助蛋白是慢病毒的和/或γ逆转录病毒的。在瞬时表达是优选的应用中,可以使用腺病毒基系统。腺病毒基载体在许多细胞类型中能够具有非常高的转导效并且无需细胞分裂。用这样的载体,已经获得了较高的效价和表达水平。可以在相对简单的系统中大量地产生此载体。还可以使用腺相关病毒(“aav”)载体转导具有靶核酸的细胞,例如,在体外产生核酸和肽,以及用于体内和离体基因疗法程序(参见例如,韦斯特(west)等人,《病毒学》(virology)160:38-47(1987);美国专利号4,797,368;wo93/24641;科丁(kotin),《人类基因疗法》(humangenetherapy)5:793-801(1994);缪斯科斯卡(muzyczka),《临床研究杂志》(j.clin.invest.)94:1351(1994))。重组aav载体的构建描述于多个出版物中,包括美国专利号5,173,414;特拉特斯金(tratschin)等人,《分子与细胞生物学》(mol.cell.biol.)5:3251-3260(1985);特拉特斯金等人,《分子与细胞生物学》4:2072-2081(1984);埃尔莫奈特(hermonat)&缪斯科斯卡(muzyczka),《美国国家科学院院刊》(pnas)81:6466-6470(1984);以及萨穆尔斯基(samulski)等人,《病毒学杂志》(j.virol.)63:03822-3828(1989)。典型地使用包装细胞形成能够感染宿主细胞的病毒粒子。这样的细胞包括包装腺病毒的293细胞和包含逆转录病毒的ψ2细胞或pa317细胞。在基因疗法中使用的病毒载体通常由将核酸载体包装进病毒粒子的细胞系产生。这些载体典型地包含包装并且随后整合进宿主所需的最低量序列,其他病毒序列由用于有待表达的一个或多个多核苷酸的表达盒替换。失去的病毒功能典型地由包装细胞系反式地提供。例如,在基因疗法中使用的aav载体典型地仅具有来自aav基因组的itr序列,这些序列为包装并整合进宿主基因组所需。将病毒dna包装进以下细胞系中,该细胞系包含编码辅助质粒的其他aav基因,即rep和cap,但缺少itr序列。该细胞系还可以被作为辅助者的腺病毒感染。该辅助病毒促进aav载体的复制和从辅助质粒表达aav基因。由于缺少itr序列,未以显著的量包装该辅助质粒。可以通过例如与aav相比腺病毒更加敏感的热处理减少腺病毒的污染。因此,aav被认为是用作转导载体的理想候选物。这样的aav转导载体可以包括足够的顺式作用功能,以在反式地提供的腺病毒或疱疹病毒或痘病毒(例如,牛痘病毒)辅助功能的存在下进行复制。可以使用重组aav(raav)将外源基因携带进多种谱系的细胞中。在这些载体中,将aavcap和/或rep基因从病毒基因组中缺失并且用选择的dna区段置换。当前的aav载体可以容纳多达插入dna的4300个碱基。存在多种产生raav的方式,并且本发明提供了raav以及用于制备raav的方法。例如,一个或多个质粒包含或基本包含希望的病毒构建体,将其转染进aav感染的细胞中。此外,将第二或另外的辅助质粒共转染进这些细胞中,以提供重组病毒构建体的复制和包装必需的aavrep和/或cap基因。在这些条件下,aav的rep和/或cap蛋白反式地作用,以刺激raav构建体的复制和包装。转染后两至三天,收获raav。传统地,从细胞中收获raav连同腺病毒。然后,通过热处理使污染的腺病毒失活。在本发明中,有利地不从细胞自身收获raav,而是从细胞上清液收获raav。因此,在初始方面,本发明提供了制备raav,并且除前述内容之外,可以通过以下方法制备raav,该方法包括或基本由以下组成:用包含外源dna(包括供表达的dna)和辅助病毒(例如,腺病毒、疱疹病毒、痘病毒如牛痘病毒)的raav感染易感细胞,其中该raav缺少功能性cap和/或rep(以及提供该raav缺少的cap和/或rev功能的辅助病毒(例如,腺病毒、疱疹病毒、痘病毒如牛痘病毒));或用包含外源dna(包括供表达的dna)的raav感染易感细胞,其中该重组体缺少功能性cap和/或rep,并且用提供该raav缺少的cap和/或rep功能的质粒转染所述细胞;或用包含外源dna(包括供表达的dna)的raav感染易感细胞,其中该重组体缺少功能性cap和/或rep,其中所述细胞提供该重组体缺少的cap和/或rep功能;或用缺少功能性cap和/或rep的aav和用于将外源dna插入该重组体中这样使得由该重组体表达该外源dna并且用于提供rep和/或cap功能的质粒转染易感细胞,由此转染产生包含该外源dna(包括供表达的dna)的缺少功能性cap和/或rep的raav。该raav可以来自如在此描述的aav,并且有利地可以是raav1、raav2、aav5或具有杂交体或衣壳的raav,该raav可以包括aav1、aav2、aav5或其任何组合。可以相对于有待被raav靶向的细胞而选择raav的aav;例如,可以选择用于靶向脑或神经元细胞的aav血清型1、2、5或杂交体或衣壳aav1、aav2、aav5或其任何组合;并且可以选择用于靶向心脏组织的aav4。除293细胞之外,可以在本发明的实践中使用的其他细胞以及这些细胞的某些体外aav血清型的相对感染性(参见格林,d.(grimm,d.)等人,《病毒学杂志》(j.virol.)82:5887-5911(2008))如下:本发明提供了包含或基本上由编码crispr(规律间隔成簇短回文重复)系统的外源核酸分子组成的raav,例如,多个盒,该多个盒包括或包含第一盒,该第一盒包括或基本上由一个启动子、一个编码crispr相关(cas)蛋白(假定的核酸酶或解旋酶蛋白)(例如,cas9)的核酸分子和一个终止子组成,以及两个或更多个,有利地直到载体的包装尺寸极限,例如总共(包括第一盒)五个盒,这些盒包括或基本上由一个启动子、一个编码指导rna(grna)的核酸分子和一个终止子组成(例如,每个盒示意性地由启动子-grna1-终止子、启动子-grna2-终止子...启动子-grna(n)-终止子表示(其中n是可以插入的处于载体的包装尺寸极限的上限的数目)),或两个或更多个单独的raav,每个raav包含一个或多于一个crispr系统盒,例如,第一raav包含第一盒,该第一盒包括或基本上由一个启动子、一个编码cas(例如,cas9)的核酸分子和一个终止子组成,并且第二raav包含多个,四个,盒,这些盒包括或基本上由一个启动子、编码指导rna(grna)的核酸分子和一个终止子组成(例如,每个盒示意性地由启动子-grna1-终止子、启动子-grna2-终止子...启动子-grna(n)-终止子表示(其中n是可以插入的处于载体的包装尺寸极限的上限的数目))。由于raav是一种dna病毒,因此涉及aav或raav的在此讨论中的核酸分子有利地是dna。在一些实施例中,启动子有利地是人类突触蛋白i启动子(hsyn)。用于将核酸递送至细胞的另外的方法是本领域的技术人员已知的。参见例如通过引用结合在此的us20030087817。在一些实施例中,用一个或多个在此描述的载体瞬时地或非瞬时地转染宿主细胞。在一些实施例中,当细胞天然地出现在受试者体内时将其转染。在一些实施例中,被转染的细胞取自受试者。在一些实施例中,该细胞来源于取自受试者的细胞,如细胞系。用于组织培养的多种多样的细胞系在本领域是已知的。细胞系的实例包括但不限于,c8161、ccrf-cem、molt、mimcd-3、nhdf、hela-s3、huh1、huh4、huh7、huvec、hasmc、hekn、heka、miapacell、panc1、pc-3、tf1、ctll-2、c1r、rat6、cv1、rpte、a10、t24、j82、a375、arh-77、calu1、sw480、sw620、skov3、sk-ut、caco2、p388d1、sem-k2、wehi-231、hb56、tib55、jurkat、j45.01、lrmb、bcl-1、bc-3、ic21、dld2、raw264.7、nrk、nrk-52e、mrc5、mef、hepg2、海拉b、海拉t4、cos、cos-1、cos-6、cos-m6a、bs-c-1猴肾上皮细胞、balb/3t3小鼠胚胎成纤维细胞、3t3swiss、3t3-l1、132-d5人类胎儿成纤维细胞;10.1小鼠成纤维细胞、293-t、3t3、721、9l、a2780、a2780adr、a2780cis、a172、a20、a253、a431、a-549、alc、b16、b35、bcp-1细胞、beas-2b、bend.3、bhk-21、br293、bxpc3、c3h-10t1/2、c6/36、cal-27、cho、cho-7、cho-ir、cho-k1、cho-k2、cho-t、chodhfr-/-、cor-l23、cor-l23/cpr、cor-l23/5010、cor-l23/r23、cos-7、cov-434、cmlt1、cmt、ct26、d17、dh82、du145、ducap、el4、em2、em3、emt6/ar1、emt6/ar10.0、fm3、h1299、h69、hb54、hb55、hca2、hek-293、hela、hepa1c1c7、hl-60、hmec、ht-29、jurkat、jy细胞、k562细胞、ku812、kcl22、kg1、kyo1、lncap、ma-mel1-48、mc-38、mcf-7、mcf-10a、mda-mb-231、mda-mb-468、mda-mb-435、mdckii、mdckii、mor/0.2r、mono-mac6、mtd-1a、myend、nci-h69/cpr、nci-h69/lx10、nci-h69/lx20、nci-h69/lx4、nih-3t3、nalm-1、nw-145、opcn/opct细胞系、peer、pnt-1a/pnt2、renca、rin-5f、rma/rmas、saos-2细胞、sf-9、skbr3、t2、t-47d、t84、thp1细胞系、u373、u87、u937、vcap、维洛(vero)细胞、wm39、wt-49、x63、yac-1、yar及其转基因变种。细胞系可获得自本领域的技术人员已知的多种来源(参见例如,美国典型培养物保藏中心(americantypeculturecollection)(atcc)(马纳萨斯(manassus),弗吉尼亚州))。在一些实施例中,使用用一种或多种在此描述的载体转染的细胞建立新的细胞系,该新的细胞系包括一种或多种载体来源的序列。在一些实施例中,使用用如在此描述的crispr系统的组分转染(如通过用一种或多种载体进行瞬时转染或用rna进行转染)且通过crispr复合物的活性修饰的细胞建立新的细胞系,该新的细胞系包括以下细胞,这些细胞包含吸水但是缺少任何其他外源序列。在一些实施例中,在评估一种或多种测试化合物中使用用一个或多个在此描述的载体瞬时或非瞬时转染的细胞或来源于这样的细胞的细胞系。在一些实施例中,使用一个或多个在此描述的载体产生非人转基因动物或转基因植物。在一些实施例中,该转基因动物是一种哺乳动物,如小鼠、大鼠或兔。用于产生转基因动物和植物的方法在本领域是已知的,并且通常以如在此描述的细胞转染方法开始。在另一个实施例中,可以考虑用具有针阵列的流体递送装置(参见例如,转让给弗雷德·哈钦森癌症研究中心的美国专利公开号20110230839)将crisprcas递送至实体组织。用于将流体递送至实体组织的美国专利公开号20110230839的装置可以包括多个排列为阵列的针;多个储库,每个储库都与该多个针中的对应的针处于流体联通;以及多个致动器,这些致动器可操作地耦合至该多个储库中的对应的储库并被配置为控制该储库内的流体压力。在某些实施例中,该多个致动器中的每个都可以包括多个柱塞中的一个,该多个柱塞中的每个的第一端都被接收进该多个储库中的对应的储库中,并且在某些另外的实施例中,该多个柱塞中的柱塞在其对应的第二端被可操作地耦合在一起,以便可以同时被按下。某些仍另外的实施例可以包括一个柱塞驱动器,该柱塞驱动器被配置为以选择性地可变速率按下所有该多个柱塞。在其他实施例中,该多个致动器中的每个都可以包括多个流体传输线中的一个,这些流体传输线具有第一和第二端,该多个流体传输线中的每个的第一端被耦合至该多个储库中的对应的储库。在其他实施例中,该装置可以包括一个流体压力源,并且该多个致动器中的每个在该流体压力源与该多个储库中的对应的储库之间都包括一个液压耦合器。在另外的实施例中,该流体压力源可以包括压缩机、真空蓄能器、蠕动泵、主缸、微流体泵以及阀中的至少一个。在另一个实施例中,该多个针中的每个都可以包括多个沿其长度分布的端口。修饰靶标在一个方面,本发明提供了修饰真核细胞中的靶多核苷酸的方法,这些方法可以在体内、离体或在体外。在一些实施例中,该方法包括从人或非人动物或植物取样细胞或细胞群,并且修饰该细胞或这些细胞。培养可以发生在离体的任何阶段。该细胞或这些细胞甚至可以被重新引入该非人动物或植物中。对于重新引入的细胞,特别优选的是这些细胞是干细胞。在一些实施例中,该方法包括允许一种crispr复合物结合到该靶多核苷酸上以实施所述靶多核苷酸的切割,由此修饰该靶多核苷酸,其中该crispr复合物包括与杂交到在所述靶多核苷酸内的一个靶序列上的指导序列复合的crispr酶,其中所述指导序列连接到一种tracr配对序列上,该tracr配对序列进而杂交到一种tracr序列上。在一个方面,本发明提供了修饰一种多核苷酸在真核细胞中的表达的方法。在一些实施例中,该方法包括允许一种crispr复合物结合到该多核苷酸上,这样使得所述结合导致所述多核苷酸的表达增加或降低;其中该crispr复合物包括与杂交到在所述多核苷酸内的一个靶序列上的指导序列复合的crispr酶,其中所述指导序列连接到一种tracr配对序列上,该tracr配对序列进而杂交到一种tracr序列上。类似的考虑因素和条件适用如上文针对修饰靶多核苷酸的方法。事实上,这些取样、培养和重新引入选择跨本发明的多个方面而适用。确实,在本发明的任何方面,该crispr复合物可以包括与杂交到一个靶序列上的指导序列复合的crispr酶,其中所述指导序列可以连接到一种tracr配对序列上,该tracr配对序列进而可以杂交到一种tracr序列上。类似的考虑因素和条件适用如上文针对修饰靶多核苷酸的方法。试剂盒在一个方面,本发明提供了以下试剂盒,这些试剂盒包含披露于以上方法和组合物中的元件中的任何一个或多个。元件可以单独地或组合地提供,并且可以被提供于任何适合的容器中,如小瓶、瓶子或管。在一些实施例中,该试剂盒包括一种或多种语言,例如多于一种语言的说明书。在一些实施例中,试剂盒包括一种或多种用于在利用在此描述的元件中的一种或多种的方法中使用的试剂。试剂可以被提供于任何适合的容器中。例如,试剂盒可以提供一种或多种反应或存储缓冲液。可以按在具体测定中可用的形式或按在使用之前需要添加一种或多种其他组分的形式(例如按浓缩或冻干形式)提供试剂。缓冲液可以是任何缓冲液,包括但不限于碳酸钠缓冲液、碳酸氢钠缓冲液、硼酸盐缓冲液、tris缓冲液、mops缓冲液、hepes缓冲液及其组合。在一些实施例中,该缓冲液是碱性的。在一些实施例中,该缓冲液具有从约7至约10的ph。在一些实施例中,该试剂盒包括一个或多个寡核苷酸,该一个或多个寡核苷酸对应于一个用于插入进载体中的指导序列,以便可操作地连接该指导序列和一个调节元件。在一些实施例中,该试剂盒包括一个同源重组模板多核苷酸。在一些实施例中,该试剂盒包括在此描述的载体中的一个或多个和/或在此描述的多核苷酸中的一个或多个。该试剂盒可以有利地允许提供本发明的系统的所有元件。crispr复合物在一个方面,本发明提供了用于使用crispr系统的一个或多个元件的方法。本发明的crispr复合物提供了用于修饰靶多核苷酸的有效手段。本发明的crispr复合物具有多种多样的实用性,包括修饰(例如,缺失、插入、转位、失活、激活)多种细胞类型中的靶多核苷酸。正因为如此,本发明的crispr复合物在例如基因疗法、药物筛选、疾病诊断以及预后中具有广阔的应用谱。示例性crispr复合物包括与一种指导序列复合的crispr酶,该指导序列与靶多核苷酸内的靶序列杂交。该指导序列与一种tracr配对序列连接,该tracr配对序列进而与一种tracr序列杂交。在一个实施例中,本发明提供了一种切割靶多核苷酸的方法。该方法包括使用一种crispr复合物修饰靶多核苷酸,该crispr复合物结合到该靶多核苷酸上并且实施所述靶多核苷酸的切割。典型地,当被引入进细胞中时,本发明的crispr复合物在基因组序列中产生一个断裂(例如,单链或双链断裂)。例如,可以使用该方法切割细胞中的疾病基因。由该crispr复合物产生的断裂可以通过修复过程进行修复,如易出错的非同源末端连接(nhej)途径或高保真同源定向修复(hdr)(图29)。在这些修复过程期间,可以将一个外源多核苷酸模板引入进基因组序列中。在一些方法中,该hdr过程被用于修饰基因组序列。例如,将一个外源多核苷酸模板引入进细胞中,该外源多核苷酸模板包括一个有待整合的侧翼为一个上游序列和一个下游序列的序列。上游和下游序列与染色体中的整合位点的任一侧都具有序列相似性。在希望的情况下,供体多核苷酸可以是dna,例如dna质粒、细菌人工染色体(bac)、酵母人工染色体(yac)、病毒载体、一段线性dna、pcr片段、裸核酸或与递送赋形剂(如脂质体或泊洛沙姆)复合的核酸。该外源多核苷酸模板包括一个有待整合的序列(例如,突变的基因)。供整合的序列可以是一个对细胞而言内源或外源的序列。有待整合的序列的实例包括编码蛋白质的多核苷酸或非编码rna(例如,微小rna)。因此,供整合的序列可以可操作地连接到一个或多个适当的控制序列上。可替代地,有待整合的序列可以提供一种调节功能。选择外源多核苷酸模板中的上游和下游序列,以促进感兴趣的染色体序列与供体多核苷酸之间的重组。该上游序列是一个与供整合的靶向位点的上游的基因组序列具有序列相似性的核酸序列。类似地,该下游序列是一个与供整合的靶向位点的染色体序列下游具有序列相似性的核酸序列。外源多核苷酸模板中的上游和下游序列与靶向的基因组序列可以具有75%、80%、85%、90%、95%或100%序列一致性。优选地,外源多核苷酸模板中的上游和下游序列与靶向的基因组序列具有约95%、96%、97%、98%、99%或100%序列一致性。在一些方法中,外源多核苷酸模板中的上游和下游序列与靶向的基因组序列具有约99%或100%序列一致性。上游或下游序列可以包括从约20bp至约2500bp,例如约50、100、200、300、400、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400或2500bp。在一些方法中,示例性上游或下游序列具有约200bp至约2000bp、约600bp至约1000bp或更具体地约700bp至约1000bp。在一些方法中,该外源多核苷酸模板可以进一步包括一种标记。这样的一种标记使得容易地筛选靶向的整合。适合的标记的实例包括限制性位点、荧光蛋白或选择性标记。可以使用重组技术构建本发明的外源多核苷酸模板(参见例如,萨姆布鲁克(sambrook)等人,2001和奥苏贝尔(ausubel)等人,1996)。在一种用于通过整合外源多核苷酸模板而修饰靶多核苷酸的示例性方法中,通过crispr复合物将双链断裂引入进基因组序列中,经由同源重组一个外源多核苷酸模板而修复该断裂,这样使得将该模板整合进基因组中。双链断裂的存在促进模板的整合。在其他实施例中,本发明提供了一种修饰多核苷酸在真核细胞中的表达的方法。该方法包括通过使用结合到多核苷酸上的crispr复合物增加或降低靶多核苷酸的表达。在一些方法中,可以使靶多核苷酸失活以实施细胞中的表达的修饰。例如,当crispr复合物结合到细胞中的一个靶序列上时,该靶多核苷酸失活,这样使得该序列不被转录,该编码蛋白不被产生,或者该序列不会像野生型序列一样起作用。例如,可以使蛋白质或微小rna编码序列失活,这样使得该蛋白质不被产生。在一些方法中,可以使控制序列失活,这样使得它不再作为控制序列起作用。如在此使用,“控制序列”是指影响核酸序列的转录、翻译或可及性的任何核酸序列。控制序列的实例包括启动子、转录终止子和增强子,它们是控制序列。失活的靶序列可以包括缺失突变(即,缺失一个或多个核苷酸)、插入突变(即,插入一个或多个核苷酸)或无义突变(即,用另一个核苷酸取代一个单核苷酸,这样使得引入终止密码子)。在一些方法中,靶序列的失活导致该靶序列的“敲除(knock-out)”。疾病模型可以使用本发明的方法产生可以用作疾病模型的植物、动物或细胞。如在此使用,“疾病”是指受试者的疾病、障碍或适应症。例如,可以使用本发明的方法产生以下动物或细胞,该动物或细胞在一个或多个与疾病相关的核酸序列中包括修饰,或以下植物、动物或细胞,一个或多个与疾病相关的核酸序列的表达在该植物、动物或细胞中被改变。这样的一个核酸序列可以编码一个疾病相关蛋白序列或可以是一个疾病相关控制序列。因此,应该理解的是在本发明的实施例中,植物、受试者、患者、生物或细胞可以是非人受试者、患者、生物或细胞。因此,本发明提供了由本发明方法产生的植物、动物或细胞或其子代。该子代可以是产生的植物或动物的克隆或可以通过与同一物种的其他个体杂交而由有性繁殖产生,以在其后代中基因渗入另外的令人希望的性状。在多细胞生物(特别是动物或植物)的情况下,该细胞可以是在体内或离体的。在该细胞处于培养中的情况下,如果满足适当的培养条件并且优选地,如果该细胞适合地适于此目的(例如,干细胞),则可以建立细胞系。还设想了通过本发明产生的细菌细胞系。因此,还设想了细胞系。在一些方法中,可以使用疾病模型研究突变对动物或细胞的影响以及使用在疾病研究中常用的措施对疾病的发展和/或进展的影响。可替代地,这样的一种疾病模型有用于研究药物活性化合物对疾病的影响。在一些方法中,可以使用疾病模型评估潜在的基因疗法策略的效力。也就是说,可以将疾病相关基因或多核苷酸进行修饰,这样使得疾病发展和/或进展被抑制或减少。具体而言,该方法包括修饰一个疾病相关基因或多核苷酸,这样使得产生一种改变的蛋白质,其结果是,该动物或细胞具有改变的反应。因此,在一些方法中,可以将基因修饰动物与易患该疾病的动物进行比较,这样使得可以评估基因疗法事件的效果。在另一个实施例中,本发明提供了一种研发生物活性剂的方法,该生物活性剂调制与疾病基因相关的细胞信号传导事件。该方法包括使一种测试化合物与一个细胞接触,该细胞包括一种或多种载体,这一种或多种载体驱动crispr酶、连接到tracr配对序列上的指导序列和tracr序列中的一种或多种的表达;并且检测读出的变化,该变化指示与例如包含在该细胞中的疾病基因的突变相关的细胞信号传导事件的减少或增加。可以与用于筛选细胞功能变化的本发明的方法组合构建细胞模型或动物模型。可以使用这样的一种模型研究由本发明的crispr复合物修饰的基因组序列对感兴趣的细胞功能的影响。例如,可以使用细胞功能模型研究修饰的基因组序列对细胞内信号传导或细胞外信号传导的影响。可替代地,可以使用细胞功能模型研究修饰的基因组序列对感知觉的影响。在一些这样的模型中,修饰一个或多个与该模型中的信号传导生化学途径相关的基因组序列。已经具体研究了若干疾病模型。这些疾病模型包括新生自闭症风险基因chd8、katnal2和scn2a;以及综合征性自闭症(安格曼综合征(angelmansyndrome))基因ube3a。这些基因以及所得的自闭症模型当然是优选的,但用于显示本发明的跨基因和对应的模型的广阔的适用性。可以通过当将测试模型细胞和对照细胞与候选试剂接触时,测定它们之间的对应的基因的mrna水平差异而确定一个或多个与信号传导生化途径相关的基因组序列的改变的表达。可替代地,通过检测编码的多肽或基因产物的水平差异而确定与信号传导生化途径相关的序列的差异表达。为了在mrna转录本或对应的多核苷酸水平上测定试剂诱导的变化,首先根据本领域的标准方法提取包含在样品中的核酸。例如,可以根据陈述于萨姆布鲁克(sambrook)等人(1989)中的程序使用各种水解酶分离mrna或遵循由制造商提供的随附说明书通过核酸结合树脂提取mrna。然后,根据本领域广泛已知的方法或基于在此示例的方法,通过扩增程序或常规的杂交测定(例如northern印迹分析)检测包含在提取的核酸样品中的mrna。出于本发明的目的,扩增意指利用引物和聚合酶的能够以合理的保真度复制靶序列的任何方法。可以通过天然或重组dna聚合酶,如taqgoldtm、t7dna聚合酶、大肠杆菌dna聚合酶的klenow片段以及逆转录酶进行扩增。一种优选的扩增方法是pcr。具体而言,可以使分离的rna经受逆转录测定,该测定与定量聚合酶链式反应(rt-pcr)耦合,以便定量与信号传导生化途径相关的序列的表达水平。在扩增测定中可以实时地执行基因表达水平的检测。在一个方面,可以用荧光dna结合剂直接使扩增产物可视化,这些荧光dna结合剂包括但不限于dna嵌入剂和dna沟结合剂。因为掺入进双链dna分子中的嵌入剂的量典型地与扩增dna产物的量成比例,可以常规地通过使用本领域的常规光学系统定量嵌入的染料的荧光而确定扩增产物的量。适于本申请的dna结合染料包括sybr绿、sybr蓝、dapi、碘化丙锭、hoeste、sybr金、溴化乙锭、吖啶、原黄素、吖啶橙、吖啶黄、氟香豆素(fluorcoumanin)、玫瑰树碱、道诺霉素、氯喹、偏端霉素d、色霉素、乙菲啶(homidium)、光辉霉素、多吡啶钌、安曲霉素等。在另一个方面,可以在扩增反应中利用其他荧光标记物(如序列特异的探针),以促进扩增产物的检测和定量。基于探针的定量扩增依赖于希望的扩增产物的序列特异的检测。它利用荧光的靶标特异的探针(例如,探针),从而导致增加的特异性和敏感性。用于进行基于探针的定量扩增的方法本领域是确立的并且教导于美国专利号5,210,015中。在又另一个方面,可以使用与以下序列具有序列同源性的杂交探针进行常规的杂交测定,这些序列与信号传导生化途径相关。典型地,在杂交反应中,允许探针和与信号传导生化途径相关的序列形成稳定的复合物,这些序列被包含在来源于测试受试者的生物样品内。本领域的技术人员应该意识到的是,在将反义核酸用作探针核酸的情况下,提供于样品中的靶多核苷酸被选择为与该反义核酸的序列互补。相反地,在核苷酸探针是有义核酸的情况下,该靶多核苷酸被选择为与该有义核酸的序列互补。可以在不同严格度条件下进行杂交。用于实践本发明的适合的杂交条件是这样的,使得探针和与信号传导生化途径相关的序列之间的识别相互作用既是充分特异的又是充分稳定的。增加杂交反应的严格度的条件在本领域是广泛已知且公开的。参见例如,(萨姆布鲁克(sambrook)等人,(1989);非放射性原位杂交应用手册(nonradioactiveinsituhybridizationapplicationmanual),宝灵曼公司(boehringermannheim),第二版)。可以使用固定在任何固体支持物上的探针进行杂交测定,所述固体支持物包括但不限于硝化纤维、玻璃、硅以及多种基因阵列。如描述于美国专利号5,445,934中,在高密度基因芯片上执行优选的杂交测定。对于在杂交测定过程中形成的探针-靶标复合物的常规检测,将核苷酸探针络合至可检测标记物上。适于在本发明中使用的可检测标记物包括通过光化学、生物化学、光谱学、免疫化学、电学、光学或化学手段可检测的任何组合物。多种多样的适当的可检测标记物在本领域是已知的,包括荧光或化学发光标记物、放射性同位素标记物、酶或其他配体。在优选的实施例中,可能希望的是利用荧光标记物或酶标签,如地高辛、β-半乳糖苷酶、脲酶、碱性磷酸酶或过氧化物酶、亲和素/生物素复合物。用于检测或定量杂交强度的检测方法将典型地取决于以上选择的标记物。例如,可以使用照相底片或感光成像仪检测放射性标记物。可以使用检测发射光的光检测器检测并定量荧光标记物。典型地通过为酶提供底物并测量由酶对底物的作用而产生的反应产物来检测酶标记物;并且最后,通过简单地使着色的标记物可视化而检测比色标记物。还可以通过检查对应的基因产物确定与信号传导生化途径相关的序列的试剂诱导的表达变化。确定蛋白质水平典型地涉及a)使包含在生物样品中的蛋白质与特异性结合到与信号传导生化途径相关的蛋白质上的试剂接触;并且(b)鉴定这样形成的任何试剂:蛋白质复合物。在此实施例的一个方面,特异性结合与信号传导生化途径相关的蛋白质的该试剂是一种抗体,优选单克隆抗体。通过在将允许在该试剂和与信号传导生化途径相关的蛋白质之间形成复合物的条件下,通过使该试剂与来源于测试样品的与信号传导生化途径相关的蛋白质的样品接触而进行该反应。可以根据本领域中的标准程序直接地或间接地检测复合物的形成。在直接检测方法中,这些试剂提供有可检测的标记物并且未反应的试剂可以从复合物中除去;由此剩余的标记物的量指示形成的复合物的量。对于这样的方法,优选的是选择即使在严格洗涤条件过程中仍附接至这些试剂上的标记物。优选的是,该标记物不干扰结合反应。在替代方案中,间接检测程序可以使用包含用化学方法或酶方法引入的标记物的试剂。令人希望的标记物通常不干扰所得的试剂:多肽复合物的结合或稳定性。然而,标记物典型地被设计成是用于有效结合并且因此产生可检测的信号的抗体可及的。适于检测蛋白质水平的多种多样的标记物在本领域是已知的。非限制性实例包括放射性同位素、酶、胶体金属、荧光化合物、生物发光化合物以及化学发光化合物。可以通过标准定量测定定量在结合反应过程中形成的试剂:多肽复合物的量。如上所示,可以通过仍留在结合位点处的标记物的量直接测量试剂:多肽复合物的形成。在一个替代方案中,测试与信号传导生化途径相关的蛋白质与标记的类似物结合特定试剂上的位点的竞争能力。在此竞争测定中,捕获的标记物的量与存在于测试样品中的与信号传导生化途径相关的蛋白质序列的量成反比。多种用于蛋白质分析的基于以上概括的总则的技术在本领域是可获得的。它们包括但不限于放射免疫测定、elisa(酶联免疫放射测定)、“夹层”免疫测定、免疫放射测定、原位免疫测定(使用例如,胶体金、酶或放射性同位素标记物)、蛋白质印迹分析、免疫沉淀测定、免疫荧光测定以及sds-page。特异性识别或结合到与信号传导生化途径相关的蛋白质上的抗体对于执行前述蛋白质分析而言是优选的。在希望的情况下,可以使用识别特定类型的翻译后修饰(例如,信号传导生化途径诱导的修饰)的抗体。翻译后修饰包括但不限于糖基化、脂化、乙酰化以及磷酸化。这些抗体可以购自商业供应商。例如,特异性识别酪氨酸磷酸化蛋白质的抗磷酸酪氨酸抗体可以获得自多个供应商,包括英杰公司和珀金埃尔默公司(perkinelmer)。抗磷酸酪氨酸抗体在检测响应于er应激而在其酪氨酸残基上存在差异磷酸化的蛋白质中是特别有用的。这样的蛋白质包括但不限于真核翻译起始因子2α(eif-2α)。可替代地,可以通过用展示出希望的翻译后修饰的靶蛋白免疫宿主动物或抗体产生细胞而使用常规的多克隆或单克隆抗体技术产生这些抗体。在实践主题方法中,可以令人希望的是,在不同身体组织中、在不同细胞类型中和/或在不同亚细胞结构中辨别与信号传导生化途径相关的蛋白质的表达谱。可以通过使用能够结合到优先表达于某些组织、细胞类型或亚细胞结构中的蛋白质标记的组织特异的、细胞特异的或亚细胞结构特异的抗体进行这些研究。还可以通过检查基因产物相对于对照细胞的活性变化而确定与信号传导生化途径相关的基因的改变的表达。与信号传导生化途径相关的蛋白质的试剂诱导的活性变化的测定将取决于处于研究之下的生物活性和/或信号传导途径。例如,在该蛋白质是一种激酶的情况下,可以通过本领域已知的多种测定确定它磷酸化一种或多种下游底物的能力的变化。代表性测定包括但不限于用抗体进行免疫印迹和免疫沉淀,这些抗体是如识别磷酸化蛋白质的抗磷酸酪氨酸抗体。此外,可以通过高通量化学发光测定检测激酶活性,如alphascreentm(可获得自珀金埃尔默公司)和etagtm测定(陈-辉(chan-hui)等人(2003)《临床免疫学》(clinicalimmunology)111:162-174)。在与信号传导生化途径相关的蛋白质是使得细胞内ph条件波动的信号传导级联的一部分的情况下,可以将ph敏感的分子(如荧光ph染料)用作报道分子。在与信号传导生化途径相关的蛋白质是一种离子通道的另一个实例中,可以监测膜电位和/或细胞内离子浓度的波动。多种商业试剂盒和高通量装置特别适于快速且稳健地筛选离子通道调节剂。代表性仪器包括fliprtm(分子设备公司(moleculardevices,inc.))和vipr(奥罗拉生物科学公司(aurorabiosciences)))。这些仪器能够同时检测微板的1000多个样品孔中的反应,并且能够提供一秒内或甚至一毫秒内的实时测量和功能数据。在实践在此披露的任何方法中,可以经由本领域已知的一种或多种方法将适合的载体引入进细胞或胚胎中,这些方法包括但不限于,显微注射、电穿孔、声致穿孔、基因枪、磷酸钙介导的转染、阳离子转染、脂质体转染、树枝状聚合物转染、热休克转染、核转染、磁转染、脂转染、刺穿转染(impalefection)、光学转染、专有剂增强的核酸摄取以及经由脂质体、免疫脂质体、病毒颗粒或人工病毒体进行递送。在一些方法中,通过显微注射将该载体引入进胚胎中。可以将这个或这些载体显微注射进胚胎的细胞核或细胞质中。在一些方法中,通过核转染将这个或这些载体引入进细胞中。crispr复合物的靶多核苷酸可以是对真核细胞而言内源或外源的任何多核苷酸。例如,该靶多核苷酸可以是一种驻留在真核细胞的细胞核中的多核苷酸。该靶多核苷酸可以是一个编码基因产物(例如,蛋白质)的序列或一个非编码序列(例如,调节多核苷酸或无用dna)。靶多核苷酸的实例包括与信号传导生化途径相关的序列,例如信号传导生化途径相关基因或多核苷酸。靶多核苷酸的实例包括疾病相关基因或多核苷酸。“疾病相关”基因或多核苷酸是指与非疾病对照的组织或细胞相比,在来源于疾病影响的组织的细胞中以异常水平或以异常形式产生转录或翻译产物的任何基因或多核苷酸。在改变的表达与疾病的出现和/或进展相关的情况下,它可以是一个以异常高的水平被表达的基因;它可以是一个以异常低的水平被表达的基因。疾病相关基因还指具有一个或多个突变或直接负责或与一个或多个负责疾病的病因学的基因连锁不平衡的遗传变异的基因。转录的或翻译的产物可以是已知的或未知的,并且可以处于正常或异常水平。crispr复合物的靶多核苷酸可以是对真核细胞而言内源或外源的任何多核苷酸。例如,该靶多核苷酸可以是一种驻留在真核细胞的细胞核中的多核苷酸。该靶多核苷酸可以是一个编码基因产物(例如,蛋白质)的序列或一个非编码序列(例如,调节多核苷酸或无用dna)。不希望被理论所束缚,据信该靶序列应该与pam(原型间隔子邻近基序)相关;也就是说,与由crispr复合物识别的短序列相关。对pam的精确序列和长度要求取决于使用的crispr酶而不同,但是pam典型地是临近原型间隔子(也就是说,靶序列)的2-5个碱基对序列。在以下实例部分中给出pam序列的实例,并且熟练人员将能够鉴定与给定的crispr酶一起使用的另外的pam序列。crispr复合物的靶多核苷酸可以包括多个疾病相关基因和多核苷酸以及信号传导生化途径相基因和多核苷酸,如分别提交于2012年12月12日和2013年1月2日、标题均为用于序列操纵的系统方法和组合物(systemsmethodsandcompositionsforsequencemanipulation)的分别具有博德(broad)参考号bi-2011/008/wsgr案卷号44063-701.101和bi-2011/008/wsgr案卷号44063-701.102的美国临时专利申请61/736,527和61/748,427中所列举,将所有这些申请的内容通过引用以其全文结合在此。靶多核苷酸的实例包括与信号传导生化途径相关的序列,例如信号传导生化途径相关基因或多核苷酸。靶多核苷酸的实例包括疾病相关基因或多核苷酸。“疾病相关”基因或多核苷酸是指与非疾病对照的组织或细胞相比,在来源于疾病影响的组织的细胞中以异常水平或以异常形式产生转录或翻译产物的任何基因或多核苷酸。在改变的表达与疾病的出现和/或进展相关的情况下,它可以是一个以异常高的水平被表达的基因;它可以是一个以异常低的水平被表达的基因。疾病相关基因还指具有一个或多个突变或直接负责或与一个或多个负责疾病的病因学的基因连锁不平衡的遗传变异的基因。转录的或翻译的产物可以是已知的或未知的,并且可以处于正常或异常水平。疾病相关基因和多核苷酸的实例列于表a和b中。在万维网上可获得的疾病具体信息可获得自约翰斯·霍普金斯大学的麦考斯克-纳森遗传医学研究所(mckusick-nathansinstituteofgeneticmedicine,johnshopkinsuniversity)(巴尔的摩,马里兰州)和国立医学图书馆的国家生物技术信息中心(nationalcenterforbiotechnologyinformation,nationallibraryofmedicine)(贝塞斯达,马里兰州)。信号传导生化途径相关基因和多核苷酸的实例列于表c中。这些基因和途径的突变可以导致产生不当的蛋白质或以不当的量影响功能的蛋白质。通过引用而特此结合来自于2012年12月12日提交的美国临时申请61/736,527的基因、疾病和蛋白质的另外的实例。这样的基因、蛋白质和途径可以是crispr复合物的靶多核苷酸。表a表b:表c:本发明的实施例还涉及与敲除基因、扩增基因以及修复与dna重复不稳定性和神经障碍相关的具体突变有关的方法和组合物(罗伯特d.·威尔斯(robertd.wells)、芦沢哲夫(tetsuoashizawa),遗传不稳定性与神经疾病(geneticinstabilitiesandneurologicaldiseases),第二版,学术出版社(academicpress),2011年10月13日-《医学》(medical))。已经发现串联重复序列的特定方面对超过二十种人类疾病负责(重复不稳定新见:rna·dna杂交体的作用(newinsightsintorepeatinstability:roleofrna·dnahybrids),麦基弗ei(mcivorei)、波拉克u(polaku)、纳皮尔拉拉m(napieralam),《rna生物学》(rnabiol.)2010年9月-10月;7(5):551-8)。可以利用crispr-cas系统修正基因组不稳定性缺陷。本发明的一个另外的方面涉及利用crispr-cas系统修正emp2a和emp2b基因缺陷,这些基因已经被鉴定为与拉福拉病(laforadisease)相关。拉福拉病是一种由可以作为青年期的癫痫发作而开始的进行性肌阵挛性癫痫表征的常染色体隐性病症。该疾病的少数病可以由尚未鉴定的基因的突变引起。该疾病引起发作、肌肉痉挛、行走困难、痴呆,并且最终引起死亡。当前没有疗法被证明有效对抗疾病进展。与癫痫相关的其他遗传异常还可以靶向crispr-cas系统并且基础遗传学进一步描述于由朱利亚诺阿文济尼(giulianoavanzini)、杰弗里l.诺贝尔斯(jeffreyl.noebels)编辑的《癫痫与遗传癫痫遗传学》(geneticsofepilepsyandgeneticepilepsies),马里亚尼儿科神经学基金会(marianifoundationpaediatricneurology):20;2009)中。转让给加莫生物科技公司(sangamobiosciences,inc.)的美国专利公开号20110158957的涉及使t细胞受体(tcr)基因失活的方法也可以被修饰为本发明的crisprcas系统。在另一个实例中,转让给加莫生物科技公司的美国专利公开号20100311124和转让给cellectis公司的美国专利公开号20110225664的方法(两者都涉及使谷氨酰胺合成酶基因表达基因失活)也可以被修饰为本发明的crisprcas系统。。本发明的若干另外的方面涉及修正与范围广泛的遗传性疾病相关的缺陷,这些遗传性疾病在专题小节遗传性障碍(geneticdisorders)下被进一步描述于国立卫生研究院的网站(网址为health.nih.gov/topic/geneticdisorders)。遗传性脑病可以包括但不限于,肾上腺脑白质营养不良、胼胝体发育不全、艾卡尔迪综合征(aicardisyndrome)、阿尔佩斯病(alpers'disease)、阿尔茨海默病、巴特综合征(barthsyndrome)、巴藤病(battendisease)、cadasil、小脑变性、费波瑞病(fabry'sdisease)、格斯特曼-施特劳斯纳病(gerstmann-straussler-scheinkerdisease)、亨廷顿病以及其他三联体重复障碍、莱氏病(leigh'sdisease)、莱施-奈恩综合征、门克斯病、线粒体肌病以及ninds空洞脑(colpocephaly)。这些疾病在小节遗传性脑部障碍(geneticbraindisorders)下被进一步描述于国立卫生研究院的网站。在一些实施例中,该病症可以是瘤形成。在一些实施例中,在该病症是瘤形成的情况下,有待被靶向的基因是列于表a中的那些基因中的任一种(在这种情况下是pten等)。在一些实施例中,该病症可以是年龄相关性黄斑变性。在一些实施例中,该病症可以是一种精神分裂症障碍。在一些实施例中,该病症可以是一种三核苷酸重复障碍。在一些实施例中,该病症可以是脆性x综合征。在一些实施例中,该病症可以是一种分泌酶相关障碍。在一些实施例中,该病症可以是一种朊病毒相关障碍。在一些实施例中,该病症可以是als。在一些实施例中,该病症可以是一种药物成瘾。在一些实施例中,该病症可以是自闭症。在一些实施例中,该病症可以是阿尔茨海默病。在一些实施例中,该病症可以是炎症。在一些实施例中,该病症可以是帕金森病。例如,美国专利公开号20110023145描述了使用锌指核酸酶基因修饰与自闭症谱系障碍(asd)相关的细胞、动物以及蛋白质。自闭症谱系障碍(asd)是一组由社会交往和沟通的质量损伤以及行为、兴趣和活动的限制性重复和刻板性模式表征的障碍。这三种障碍自闭症、阿斯佩格综合征(as)和未另行规定的广泛性发育障碍(pdd-nos)是具有不同的严重程度、相关智力功能和医疗条件的同一障碍的连续体。asd是主要由遗传决定的障碍,具有大约90%遗传力。美国专利公开号20110023145包括编辑任何编码与asd相关的蛋白质的染色体序列,这些序列可以被应用于本发明的crisprcas系统。典型地基于与asd相关的蛋白质与asd的发生率或适应症的实验相关性选择与asd相关的蛋白质。例如,相对于缺少asd的群体,在具有asd的群体中,与asd相关的蛋白质的产生率或循环浓度可以升高或降低。可以使用蛋白质组技术评估蛋白质水平差异,包括但不限于蛋白质印迹、免疫组织化学染色、酶联免疫吸附测定(elisa)以及质谱法。可替代地,可以使用基因组技术通过获得编码这些蛋白质的基因的基因表达谱而鉴定与asd相关的蛋白质,包括但不限于dna微阵列分析、基因表达序列分析(sage)以及定量实时聚合酶链式反应(q-pcr)。可能和与asd相关的蛋白质相关的疾病状态或障碍的非限制性实例包括自闭症、阿斯佩格综合征(as)、未另行规定的广泛性发育障碍(pdd-nos)、雷特综合征、结节性硬化、苯丙酮尿症、史-伦-奥三氏综合征(smith-lemli-opitzsyndrome)以及脆性x综合征。通过非限制性实例的方式,与asd相关的蛋白质包括但不限于以下蛋白质:atp10c氨基磷脂-metmet受体转运atp酶酪氨酸激酶(atp10c)bzrap1mglur5(grm5)代谢型谷氨酸受体5(mglur5)cdh10钙粘素-10mglur6(grm6)代谢型谷氨酸受体6(mglur6)cdh9钙粘素-9nlgn1神经连接蛋白-1cntn4接触蛋白-4nlgn2神经连接蛋白-2cntnap2接触蛋白相关的sema5a神经连接蛋白-3蛋白样2(cntnap2)dhcr77-脱氢胆固醇nlgn4x神经连接蛋白-4x-还原酶(dhcr7)连接的doc2a双重c2样-结构域-nlgn4y神经连接蛋白-4y-包含蛋白α连接的dpp6二肽基nlgn5神经连接蛋白-5氨肽酶样蛋白6en2锯齿状2(en2)nrcam神经细胞粘附分子(nrcam)mdga2脆性x智力迟钝nrxn1轴突蛋白-11(mdga2)fmr2(aff2)af4/fmr2家族成员2or4m2嗅觉受体(aff2)4m2foxp2叉头框蛋白p2or4n4嗅觉受体(foxp2)4n4fxr1脆性x智力oxtr催产素受体阻滞,常染色体(oxtr)同系物1(fxr1)fxr2脆性x智力pah苯丙氨酸阻滞,常染色体羟化酶(pah)同系物2(fxr2)gabra1γ-氨基丁酸pten磷酸酶和受体亚基α-1张力蛋白同源物(gabra1)(pten)gabra5gabaa(.γ.-氨基丁酸ptprz1受体类型酸)受体α5酪氨酸蛋白亚基(gabra5)磷酸酶ζ(ptprz1)gabrb1γ-氨基丁酸reln颤蛋白受体亚基β-1(gabrb1)gabrb3gabaa(.γ.-氨基丁酸rpl1060s核糖体酸)受体.β.3亚基蛋白l10(gabrb3)gabrg1γ-氨基丁酸sema5a脑信号蛋白(semaphorin)-5a受体亚基γ-1(sema5a)(gabrg1)hirip3hira-相互作用蛋白3sez6l2发作相关6同系物(小鼠)样2hoxa1同源盒蛋白hox-a1shank3sh3和多重(hoxa1)锚蛋白重复结构域3(shank3)il6白介素-6shbzrap1sh3和多重锚蛋白重复结构域3(shbzrap1)lamb1层粘连蛋白亚基β-1slc6a4血清素(lamb1)转运体(sert)mapk3丝裂原激活蛋白tas2r1味觉受体激酶3类型2成员1tas2r1mazmyc相关的锌指tsc1结节性硬化蛋白的蛋白1mdga2mam结构域包含tsc2结节性硬化糖基磷脂酰肌醇蛋白2锚定物2(mdga2)mecp2甲基cpg结合ube3a泛素蛋白蛋白2(mecp2)连接酶e3a(ube3a)mecp2甲基cpg结合wnt2无翅型蛋白2(mecp2)mmtv整合位点家族,成员2(wnt2)。与asd相关的其染色体序列被编辑的蛋白质的一致性可以并且将会变化。在优选实施例中,与asd相关的其染色体序列被编辑的蛋白质可以是由bzrap1基因编码的苯二氮卓受体(外周)相关蛋白1(bzrap1)、由aff2基因编码的af4/fmr2家族成员2蛋白(aff2)(亦称mfr2)、由fxr1基因编码的脆性x智力迟钝常染色体同系物1蛋白(fxr1)、由fxr2基因编码的脆性x智力迟钝常染色体同系物2蛋白(fxr2),由mdga2基因编码的含mam结构域的糖基磷脂酰肌醇锚定物2蛋白(mdga2)、由mecp2基因编码的甲基cpg结合蛋白2(mecp2)、由mglur5-1基因编码的代谢型谷氨酸受体5(mglur5)(亦称grm5)、由nrxn1基因编码的轴突蛋白1蛋白或由sema5a基因编码的脑信号蛋白-5a蛋白(sema5a)。在一个示例性实施例中,该基因修饰动物是大鼠,并且编码与asd相关的蛋白质的编辑的染色体序列如下所列:bzrap1苯二氮卓受体xm_002727789,(外周)相关xm_213427,蛋白1(bzrap1)xm_002724533,xm_001081125aff2(fmr2)af4/fmr2家族成员2xm_219832,(aff2)xm_001054673fxr1脆性x智力nm_001012179迟钝,常染色体同系物1(fxr1)fxr2脆性x智力nm_001100647迟钝,常染色体同系物2(fxr2)mdga2含mam结构域的nm_199269糖基磷脂酰肌醇锚定物2(mdga2)mecp2甲基cpg结合nm_022673蛋白2(mecp2)mglur5代谢型谷氨酸nm_017012(grm5)受体5(mglur5)nrxn1轴突蛋白-1nm_021767sema5a脑信号蛋白-5a(sema5a)nm_001107659。示例性动物或细胞可以包括一、二、三、四、五、六、七、八或九个或更多个失活的编码与asd相关的蛋白质的染色体序列,以及零、一、二、三、四、五、六、七、八、九个或更多个编码与asd相关的蛋白质的染色体整合的序列。编辑的或整合的染色体序列可以被修饰为编码一种改变的与asd相关的蛋白质。与asd相关的蛋白质的突变的非限制性实例包括轴突蛋白1中的l18q突变,其中位置18处的亮氨酸被谷氨酰胺替换;神经连接蛋白3中的r451c突变,其中位置451处的精氨酸被半胱氨酸替换;神经连接蛋白4中的r87w突变,其中位置87处的精氨酸被色氨酸替换;以及血清素转运体中的i425v突变,其中位置425处的异亮氨酸被缬氨酸替换。asd相关染色体序列中的许多其他突变和染色体重排已经与asd相关并且在本领域是已知的。参见例如,弗赖塔格(freitag)等人(2010)《欧洲儿童与青少年精神病学》(eur.child.adolesc.psychiatry)19:169-178,以及布坎(bucan)等人(2009)《plos遗传学》(plosgenetics)5:e1000536,将其披露通过引用以其全文结合在此。与帕金森病相关的蛋白质的实例包括但不限于α-突触核蛋白、dj-1、lrrk2、pink1、帕金蛋白、uchl1、synphilin-1以及nurr1。成瘾相关的蛋白质的实例可以包括例如abat。炎症相关蛋白的实例可以包括例如由ccr2基因编码的单核细胞趋化蛋白-1(mcp1)、由ccr5基因编码的c-c趋化因子受体类型5(ccr5)、由fcgr2b基因编码的igg受体iib(fcgr2b,亦称cd32)或由fcer1g基因编码的fcεr1g(fcer1g)蛋白。心血管疾病相关蛋白的实例可以包括例如il1b(白介素1,β)、xdh(黄嘌呤脱氢酶)、tp53(肿瘤蛋白p53)、ptgis(前列腺素i2(前列腺环素)合酶)、mb(肌红蛋白)、il4(白介素4)、angpt1(血管生成素1)、abcg8(atp-结合盒,亚家族g(white),成员8)或ctsk(组织蛋白酶k)。例如,美国专利公开号20110023153描述了使用锌指核酸酶基因修饰与阿尔茨海默病相关的细胞、动物以及蛋白质。曾经修饰的细胞和动物可以进一步使用已知的用于研究靶向突变对ad的发展和/或进展的影响的方法,使用ad研究中常用的措施进行测试-如但不限于,学习和记忆、焦虑、抑郁、成瘾、感觉运动功能以及测量行为、功能、病理、代谢和生化功能的测定。本披露包括编码与ad相关的蛋白质的任何染色体序列的编辑。典型地基于ad相关蛋白与ad障碍的实验相关性选择ad相关蛋白。例如,相对于缺少ad障碍的群体,在具有ad障碍的群体中,ad相关蛋白的产生率或循环浓度可以升高或降低。可以使用蛋白质组技术评估蛋白质水平差异,包括但不限于蛋白质印迹、免疫组织化学染色、酶联免疫吸附测定(elisa)以及质谱法。可替代地,可以使用基因组技术通过获得编码这些蛋白质的基因的基因表达谱而鉴定ad相关蛋白,包括但不限于dna微阵列分析、基因表达序列分析(sage)以及定量实时聚合酶链式反应(q-pcr)。阿尔茨海默病相关蛋白的实例可以包括例如由vldlr基因编码的极低密度脂蛋白受体蛋白(vldlr)、由uba1基因编码的泛素样改性剂激活酶1(uba1)或由uba3基因编码的nedd8-激活酶e1催化亚基蛋白(ube1c)。通过非限制性实例的方式,与ad相关的蛋白质包括但不限于如下所列的蛋白质:染色体序列编码蛋白alas2δ-氨基酮戊酸合酶2(alas2)abca1atp-结合盒转运体(abca1)ace血管紧张素i-转化酶(ace)apoe载脂蛋白e前体(apoe)app淀粉样蛋白前体蛋白(app)aqp1水通道蛋白1(aqp1)bin1myc盒依赖性相互作用蛋白1或桥接整合蛋白1(bin1)bdnf脑源性神经营养因子(bdnf)btnl8嗜乳脂蛋白样蛋白8(btnl8)c1orf491号染色体开放阅读框49cdh4钙粘素-4chrnb2神经元乙酰胆碱受体亚基β-2cklfsf2cklf样marvel跨膜结构域-包含蛋白2(cklfsf2)clec4ec型凝集素结构域家族4,成员e(clec4e)clu簇集蛋白(也称为载脂蛋白j)cr1红细胞补体受体1(cr1,也称为cd35、c3b/c4b受体和免疫粘附受体)cr1l红细胞补体受体1(cr1l)csf3r粒细胞集落刺激因子3受体(csf3r)cst3胱抑素c或胱抑素3cyp2c细胞色素p4502cdapk1死亡相关蛋白激酶1(dapk1)esr1雌激素受体1fcariga受体的fc片段(fcar,也称为cd89)fcgr3bigg的fc片段,低亲和性iiib,受体(fcgr3b或cd16b)ffa2游离脂肪酸受体2(ffa2)fga纤维蛋白原(因子i)gab2grb2-相关结合蛋白2(gab2)gab2grb2-相关结合蛋白2(gab2)galp甘丙肽样肽gapdhs甘油醛-3-磷酸脱氢酶,精子发生的(gapdhs)gmpbgmbphp结合珠蛋白(hp)htr75-羟色胺(血清素)受体7(腺苷酸环化酶偶联的)ide胰岛素降解酶if127if127ifi6干扰素,α-可诱导蛋白6(ifi6)ifit2具有三角形四肽重复的干扰素诱导的蛋白2(ifit2)il1rn白介素-1受体拮抗剂(il-1ra)il8ra白介素8受体,α(il8ra或cd181)il8rb白介素8受体,β(il8rb)jag1锯齿状1(jag1)kcnj15钾内向整流通道,亚家族j,成员15(kcnj15)lrp6低密度脂蛋白受体相关蛋白6(lrp6)mapt微管相关蛋白tau(mapt)mark4map/微管亲和性调节激酶4(mark4)mphosph1m期磷蛋白1mthfr5,10-亚甲基四氢叶酸还原酶mx2干扰素诱导的gtp-结合蛋白mx2nbnnibrin,也称为nbnncstn呆蛋白niacr2烟酸受体2(niacr2,也称为gpr109b)nmnat3烟酰胺核苷酸腺苷酰转移酶3ntmneurotrimin(或hnt)orm1血清类粘蛋白(orosmucoid)1(orm1)或α-1-酸性糖蛋白1p2ry13p2y嘌呤受体13(p2ry13)pbef1烟酰胺磷酸核糖转移酶(namprtase或nampt)也称为前b细胞集落增强因子1(pbef1)或内脂素pck1磷酸烯醇丙酮酸羧激酶picalm磷脂酰肌醇结合网格蛋白装配蛋白(picalm)plau尿激酶型纤维蛋白溶酶原激活剂(plau)plxnc1丛状蛋白(plexin)c1(plxnc1)prnp朊病毒蛋白psen1早老素1蛋白(psen1)psen2早老素2蛋白(psen2)ptpra蛋白质酪氨酸磷酸酶受体a型蛋白(ptpra)ralgps2具有ph结构域和sh3结合基序的ralgef2(ralgps2)rgsl2g-蛋白信号传导样调节剂2(rgsl2)selenbp1含硒结合蛋白1(selnbp1)slc25a37线粒体铁转运蛋白(mitoferrin)-1sorl1含分拣蛋白相关受体l(dlr类别)a重复的蛋白质(sorl1)tf转铁蛋白tfam线粒体转录因子atnf肿瘤坏死因子tnfrsf10c肿瘤坏死因子受体超家族成员10c(tnfrsf10c)tnfsf10肿瘤坏死因子受体超家族,(trail)成员10a(tnfsf10)uba1泛素样改性剂激活酶1(uba1)uba3nedd8-激活酶e1催化亚基蛋白(ube1c)ubb泛素b蛋白(ubb)ubqln1泛醌蛋白(ubiquilin)-1uchl1泛素羧基末端酯酶l1蛋白(uchl1)uchl3泛素羧基末端水解酶同工酶l3蛋白(uchl3)vldlr极低密度脂蛋白受体蛋白(vldlr)在示例性实施例中,与ad相关的其染色体序列被编辑的蛋白质可以是由vldlr基因编码的极低密度脂蛋白受体蛋白(vldlr)、由uba1基因编码的泛素样改性剂激活酶1(uba1)、由uba3基因编码的nedd8-激活酶e1催化亚基蛋白(ube1c)、由aqp1基因编码的水通道蛋白1(aqp1)、由uchl1基因编码的泛素羧基末端酯酶l1蛋白(uchl1)、由uchl3基因编码的泛素羧基末端水解酶同工酶l3蛋白(uchl3)、由ubb基因编码的泛素b蛋白(ubb)、由mapt基因编码的微管相关蛋白tau(mapt)、由ptpra基因编码的蛋白质酪氨酸磷酸酶受体a型蛋白(ptpra)、由picalm基因编码的磷脂酰肌醇结合网格蛋白装配蛋白(picalm)、由clu基因编码的簇集蛋白(也称为载脂蛋白j)、由psen1基因编码的早老素1蛋白、由psen2基因编码的早老素2蛋白、由sorl1基因编码的含分拣蛋白相关受体l(dlr类别)a重复的蛋白质(sorl1)蛋白质、由app基因编码的淀粉样蛋白前体蛋白(app)、由apoe基因编码的载脂蛋白e前体(apoe)或由bdnf基因编码的脑源性神经营养因子(bdnf)。在一个示例性实施例中,该基因修饰动物是大鼠,并且编码与ad相关的蛋白质的编辑的染色体序列如下:app淀粉样蛋白前体蛋白(app)nm_019288aqp1水通道蛋白1(aqp1)nm_012778bdnf脑源性神经营养因子nm_012513clu簇集蛋白(也称为nm_053021载脂蛋白j)mapt微管相关蛋白nm_017212tau(mapt)picalm磷脂酰肌醇结合nm_053554网格蛋白装配蛋白(picalm)psen1早老素1蛋白(psen1)nm_019163psen2早老素2蛋白(psen2)nm_031087ptpra酪氨酸磷酸酶nm_012763受体a型蛋白(ptpra)sorl1含分拣蛋白相关受体l(dlrnm_053519,类别)a重复的xm_001065506,蛋白质(sorl1)xm_217115uba1泛素样改性剂激活nm_001014080酶1(uba1)uba3nedd8-激活酶e1nm_057205催化亚基蛋白(ube1c)ubb泛素b蛋白(ubb)nm_138895uchl1泛素羧基末端nm_017237酯酶l1蛋白(uchl1)uchl3泛素羧基末端nm_001110165水解酶同工酶l3蛋白(uchl3)vldlr极低密度脂蛋白nm_013155受体蛋白(vldlr)。该动物或细胞可以包括1、2、3、4、5、6、7、8、9、10、11、12、13、14、15个或更多个破坏的、编码与ad相关的蛋白质的染色体序列以及零、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15个或更多个编码与ad相关的蛋白质的染色体整合序列。编辑的或整合的染色体序列可以被修饰为编码一种改变的与ad相关的蛋白质。ad相关染色体序列中的许多突变已经与ad相关。例如,app中的v7171(即位置717处的缬氨酸变为异亮氨酸)错义突变引起家族性ad。早老素-1蛋白中的多重突变,如h163r(即位置163处的组氨酸变为精氨酸)、a246e(即位置246处的丙氨酸变为谷氨酸)、l286v(即位置286处的亮氨酸变为缬氨酸)以及c410y(即位置410处的半胱氨酸变为酪氨酸)引起家族性3型阿尔茨海默病。早老素-2蛋白中的突变,如n141i(即位置141处的天冬酰胺变为异亮氨酸)、m239v(即位置239处的甲硫氨酸变为缬氨酸)以及d439a(即位置439处的天冬氨酸变为丙氨酸)引起家族性4型阿尔茨海默病。ad相关基因和疾病的遗传变体的其他相关性在本领域是已知的。参见例如,韦林(waring)等人(2008)《神经病学年鉴》(arch.neurol.)65:329-334,将其披露通过引用以其全文结合在此。自闭症谱系障碍相关蛋白的实例可以包括例如由bzrap1基因编码的苯二氮卓受体(外周)相关蛋白1(bzrap1)、由aff2基因编码的af4/fmr2家族成员2蛋白(aff2)(亦称mfr2)、由fxr1基因编码的脆性x智力迟钝常染色体同系物1蛋白(fxr1)或由fxr2基因编码的脆性x智力迟钝常染色体同系物2蛋白(fxr2)。黄斑变性相关蛋白的实例可以包括例如由abcr基因编码的atp-结合盒,亚家族a(abc1)成员4蛋白(abca4)、由apoe基因编码的载脂蛋白e蛋白(apoe)或由ccl2基因编码的趋化因子(c-c基序)配体2蛋白(ccl2)。精神分裂症相关蛋白的实例可以包括nrg1、erbb4、cplx1、tph1、tph2、nrxn1、gsk3a、bdnf、disc1、gsk3b及其组合。涉及肿瘤抑制的蛋白质的实例可以包括例如atm(共济失调性毛细血管扩张突变的)、atr(共济失调性毛细血管扩张和rad3相关的)、egfr(表皮生长因子受体)、erbb2(v-erb-b2红白血病病毒癌基因同系物2)、erbb3(v-erb-b2红白血病病毒癌基因同系物3)、erbb4(v-erb-b2红白血病病毒癌基因同系物4)、notch1、notch2、notch3或notch4。与分泌酶障碍相关的蛋白质的实例可以包括例如psenen(早老素增强子2同系物(秀丽隐杆线虫))、ctsb(组织蛋白酶b)、psen1(早老素1)、app(淀粉样蛋白β(a4)前体蛋白)、aph1b(前咽缺陷1同系物b(秀丽隐杆线虫))、psen2(早老素2(阿尔茨海默病4))或bace1(β-位点app-切割酶1)。例如,美国专利公开号20110023146描述了使用锌指核酸酶基因修饰与分泌酶相关障碍相关的细胞、动物以及蛋白质。分泌酶对于将前蛋白加工成其生物活性形式是必需的。分泌酶途径的各种组分的缺陷促成许多障碍,特别是具有标志性淀粉样蛋白生成或淀粉样蛋白斑块的那些,如阿尔茨海默病(ad)。分泌酶障碍以及与这些障碍相关的蛋白质是一套影响众多障碍的易感性、障碍的存在、障碍的严重性或其任何组合的相异蛋白质。本披露包括编码与分泌酶障碍相关的蛋白质的任何染色体序列的编辑。典型地基于分泌酶相关蛋白质与分泌酶障碍的发展的实验相关性选择与分泌酶障碍相关的蛋白质。例如,相对于没有分泌酶障碍的群体,在具有分泌酶障碍的群体中,与分泌酶障碍相关的蛋白质的产生率或循环浓度可以升高或降低。可以使用蛋白质组技术评估蛋白质水平差异,包括但不限于蛋白质印迹、免疫组织化学染色、酶联免疫吸附测定(elisa)以及质谱法。可替代地,可以使用基因组技术通过获得编码这些蛋白质的基因的基因表达谱而鉴定与分泌酶障碍相关的蛋白质,包括但不限于dna微阵列分析、基因表达序列分析(sage)以及定量实时聚合酶链式反应(q-pcr)。通过非限制性实例的方式,与分泌酶障碍相关的蛋白质包括psenen(早老素增强子2同系物(秀丽隐杆线虫))、ctsb(组织蛋白酶b)、psen1(早老素1)、app(淀粉样蛋白β(a4)前体蛋白)、aph1b(前咽缺陷1同系物b(秀丽隐杆线虫))、psen2(早老素2(阿尔茨海默病4))、bace1(β-位点app-切割酶1)、itm2b(膜内在蛋白2b)、ctsd(组织蛋白酶d)、notch1(notch同系物1、易位相关(果蝇))、tnf(肿瘤坏死因子(tnf超家族,成员2))、ins(胰岛素)、dyt10(肌张力障碍10)、adam17(adam金属肽酶结构域17)、apoe(载脂蛋白e)、ace(血管紧张素i转化酶(肽基二肽酶a)1)、stn(他汀)、tp53(肿瘤蛋白p53)、il6(白介素6(干扰素,β2))、ngfr(神经生长因子受体(tnfr超家族,成员16))、il1b(白介素1,β)、ache(乙酰胆碱酯酶(yt血型))、ctnnb1(连环蛋白(钙粘素相关蛋白),β1,88kda)、igf1(胰岛素样生长因子1(生长调节素c))、ifng(干扰素,γ)、nrg1(神经调节蛋白1)、casp3(半胱天冬酶3,凋亡相关半胱氨酸肽酶)、mapk1(丝裂原激活蛋白激酶1)、cdh1(钙粘素1,1型,e-钙粘素(上皮))、apbb1(淀粉样蛋白β(a4)前体蛋白结合,家族b,成员1(fe65))、hmgcr(3-羟基-3-甲基戊二酰-辅酶a还原酶)、creb1(camp反应元件结合蛋白1)、ptgs2(前列腺素内过氧化物合酶2(前列腺素g/h合酶和环氧合酶))、hes1(长毛和裂口增强蛋白(hairyandenhancerofsplit)1,(果蝇))、cat(过氧化氢酶)、tgfb1(转化生长因子,β1)、eno2(烯醇酶2(γ,神经元的))、erbb4(v-erb-a红白血病病毒癌基因同系物4(禽的))、trappc10(运输蛋白粒子复合物10)、maob(单胺氧化酶b)、ngf(神经生长因子(β多肽))、mmp12(基质金属肽酶12(巨噬细胞弹性蛋白酶))、jag1(锯齿状1(艾欧吉勒综合征(alagillesyndrome)))、cd40lg(cd40配体)、pparg(过氧化物酶体增殖剂激活的受体γ)、fgf2(成纤维细胞生长因子2(碱性的))、il3(白介素3(集落刺激因子,多重的))、lrp1(低密度脂蛋白受体相关蛋白1)、notch4(notch同系物4(果蝇))、mapk8(丝裂原激活蛋白激酶8)、prep(脯氨酰内肽酶)、notch3(notch同系物3(果蝇))、prnp(朊病毒蛋白)、ctsg(组织蛋白酶g)、egf(表皮生长因子(β-尿抑胃素))、ren(肾素)、cd44(cd44分子(印度血型))、selp(选择素p(颗粒膜蛋白140kda,抗原cd62))、ghr(生长激素体)、adcyap1(腺苷酸环化酶激活多肽1(脑垂体的))、insr(胰岛素受体)、gfap(胶质酸性蛋白)、mmp3(基质金属肽酶3(溶基质素1,前明胶酶(progelatinase)))、mapk10(丝裂原激活蛋白激酶10)、sp1(sp1转录因子)、myc(v-myc骨髓细胞瘤病病毒癌基因同系物(禽的))、ctse(组织蛋白酶e)、ppara(过氧化物酶体增殖剂激活受体α)、jun(jun癌基因)、timp1(timp金属肽酶抑制剂1)、il5(白介素5(集落刺激因子,嗜酸性粒细胞))、il1a(白介素1,α)、mmp9(基质金属肽酶9(明胶酶b,92kda明胶酶,92kdaiv型胶原酶))、htr4(5-羟色胺(血清素)受体4)、hspg2(硫酸乙酰肝素蛋白多糖2)、kras(v-ki-ras2柯尔斯顿(kirsten)大鼠肉瘤病毒癌基因同系物)、cycs(细胞色素c,躯体的)、smg1(smg1同系物,磷脂酰肌醇3-激酶相关激酶(秀丽隐杆线虫))、il1r1(白介素1受体,i型)、prok1(前动力蛋白1)、mapk3(丝裂原激活蛋白激酶3)、ntrk1(神经营养酪氨酸激酶受体,1型)、il13(白介素13)、mme(膜金属内肽酶)、tkt(转酮醇酶)、cxcr2(趋化因子(c-x-c基序)受体2)、igf1r(胰岛素样生长因子1受体)、rara(视黄酸受体,α)、crebbp(creb结合蛋白)、ptgs1(前列腺素内过氧化物合酶1(前列腺素g/h合酶和环氧合酶))、galt(半乳糖-1-磷酸尿甙基转移酶(uridylyltransferase))、chrm1(胆碱能受体,毒蕈碱1)、atxn1(共济失调蛋白1)、pawr(prkc,凋亡,wt1,调节剂)、notch2(notch同系物2(果蝇))、m6pr(甘露糖-6-磷酸受体(阳离子依赖性的))、cyp46a1(细胞色素p450,家族46、亚家族a,多肽1)、csnk1d(酪蛋白激酶1,δ)、mapk14(丝裂原激活蛋白激酶14)、prg2(蛋白多糖2,骨髓(自然杀伤细胞激活剂,嗜酸性粒细胞颗粒主要碱性蛋白))、prkca(蛋白激酶c,α)、l1cam(l1细胞粘附分子)、cd40(cd40分子,tnf受体超家族成员5)、nr1i2(核受体亚家族1,i组,成员2)、jag2(锯齿状2)、ctnnd1(连环蛋白(钙粘素相关蛋白)、δ1)、cdh2(钙粘素2,1型、n-钙粘素(神经元的))、cma1(糜酶1、肥大细胞)、sort1(分拣蛋白1)、dlk1(δ样1同系物(果蝇))、them4(硫酯酶超家族成员4)、jup(连接斑珠蛋白(junctionplakoglobin))、cd46(cd46分子,补体调节蛋白)、ccl11(趋化因子(c-c基序)配体11)、cav3(小窝蛋白3)、rnase3(核糖核酸酶,rna酶a家族、3(嗜酸性粒细胞阳离子蛋白))、hspa8(热休克70kda蛋白8)、casp9(半胱天冬酶9,凋亡相关半胱氨酸肽酶)、cyp3a4(细胞色素p450,家族3,亚家族a,多肽4)、ccr3(趋化因子(c-c基序)受体3)、tfap2a(转录因子ap-2α(激活增强子结合蛋白2α))、scp2(固醇载体蛋白2)、cdk4(细胞周期蛋白依赖性激酶4)、hif1a(缺氧可诱导的因子1,α亚基(基本螺旋-环-螺旋转录因子))、tcf7l2(转录因子7样2(t细胞特异的,hmg盒))、il1r2(白介素1受体,ii型)、b3galtl(β1,3-半乳糖转移酶样)、mdm2(mdm2p53结合蛋白同系物(小鼠))、rela(v-rel网状内皮组织增殖病毒癌基因同系物a(禽的))、casp7(半胱天冬酶7,凋亡相关半胱氨酸肽酶)、ide(胰岛素降解酶)、fabp4(脂肪酸结合蛋白4,脂肪细胞)、cask(钙/钙调蛋白依赖性丝氨酸蛋白激酶(maguk家族))、adcyap1r1(腺苷酸环化酶激活多肽1(脑垂体的)受体类型i)、atf4(激活转录因子4(tax-反应增强子元件b67))、pdgfa(血小板衍生的生长因子α多肽)、c21或f33(21号染色体开放阅读框33)、scg5(分泌粒蛋白v(7b2蛋白))、rnf123(环指蛋白123)、nfkb1(b细胞中的κ轻多肽基因增强子的核因子1)、erbb2(v-erb-b2红白血病病毒癌基因同系物2、神经/胶质母细胞瘤衍生的癌基因同系物(禽的))、cav1(小窝蛋白1,胞膜窖蛋白,22kda)、mmp7(基质金属肽酶7(基质溶解素,子宫的))、tgfa(转化生长因子,α)、rxra(类视黄醇x受体,α)、stx1a(突触融合蛋白1a(脑的))、psmc4(蛋白酶体(前体,巨蛋白因子)26s亚基,atp酶,4)、p2ry2(嘌呤能受体p2y,g蛋白偶联的,2)、tnfrsf21(肿瘤坏死因子受体超家族,成员21)、dlg1(discs,大的同系物1(果蝇))、numbl(numb同系物(果蝇)样)、spn(涎福林(sialophorin))、plscr1(磷脂混杂酶1)、ubqln2(泛醌蛋白2)、ubqln1(泛醌蛋白1)、pcsk7(前蛋白转化酶枯草杆菌/科信(kexin)类型7)、spon1(脊椎蛋白1,细胞外基质蛋白)、silv(西尔弗(silver)同系物(小鼠))、qpct(谷氨酰胺-肽环转移酶)、hess(长毛和裂口增强蛋白5(果蝇))、gcc1(grip和含卷曲螺旋结构域的1)及其任何组合。该基因修饰动物或细胞可以包括1、2、3、4、5、6、7、8、9、10个或更多个破坏的、编码与分泌酶障碍相关的蛋白质的染色体序列以及零、1、2、3、4、5、6、7、8、9、10个或更多个编码破坏的与分泌酶障碍相关的蛋白质的染色体整合序列。与肌萎缩性侧索硬化相关的蛋白质的实例可以包括sod1(超氧化物歧化酶1)、als2(肌萎缩性侧索硬化2)、fus(融合在肉瘤中)、tardbp(tardna结合蛋白)、vagfa(血管内皮生长因子a)、vagfb(血管内皮生长因子b)以及vagfc(血管内皮生长因子c)及其任何组合。例如,美国专利公开号20110023144描述了使用锌指核酸酶基因修饰与肌萎缩性侧索硬化(als)疾病相关的细胞、动物以及蛋白质。als由涉及随意运动的脑皮层、脑干和脊髓中的某些神经细胞的逐步稳定退化表征。运动神经元障碍以及与这些障碍相关的蛋白质是一套影响患上运动神经元障碍的易感性、运动神经元障碍的存在、运动神经元障碍的严重性或其任何组合的相异蛋白质。本披露包括编码与一种特定的运动神经元障碍als疾病相关的蛋白质的任何染色体序列的编辑。典型地基于als相关蛋白与als的实验相关性选择与als相关的蛋白质。例如,相对于没有als的群体,在具有als的群体中,与als相关的蛋白质的产生率或循环浓度可以升高或降低。可以使用蛋白质组技术评估蛋白质水平差异,包括但不限于蛋白质印迹、免疫组织化学染色、酶联免疫吸附测定(elisa)以及质谱法。可替代地,可以使用基因组技术通过获得编码这些蛋白质的基因的基因表达谱而鉴定与als相关的蛋白质,包括但不限于dna微阵列分析、基因表达序列分析(sage)以及定量实时聚合酶链式反应(q-pcr)。通过非限制性实例的方式,与als相关的蛋白质包括但不限以下蛋白质:sod1超氧化物歧化酶1,als3肌萎缩性侧索可溶性硬化3setxsenataxinals5肌萎缩性侧索硬化5fus融合在肉瘤中als7肌萎缩性侧索硬化7als2肌萎缩性侧索dpp6二肽基肽酶6硬化2nefh神经微丝,重ptgs1前列腺素-多肽内过氧化物合酶1slc1a2溶质载体家族1tnfrsf10b肿瘤坏死因子(胶质高亲和性受体超家族,谷氨酸转运体),成员10b成员2prph外周蛋白hsp90aa1热休克蛋白90kdaα(胞质的),类别a成员1gria2谷氨酸受体,ifng干扰素,γ离子型的,ampa2s100bs100钙结合fgf2成纤维细胞生长因子2蛋白质baox1醛氧化酶1cs柠檬酸合酶tardbptardna结合蛋白txn硫氧还原蛋白raph1ras缔合map3k5丝裂原激活蛋白质(raigds/af-6)和激酶5普列克底物蛋白(pleckstrin)同源性结构域1nbeal1蛋白激酶锚定蛋白(neurobeachin)样1gpx1谷胱甘肽过氧化物酶1ica1l胰岛细胞自身抗原rac1ras-相关c3肉毒菌1.69kda样毒素底物1mapt微管相关itpr2肌醇1,4,5-蛋白tau三磷酸受体,2型als2cr4肌萎缩性侧索gls谷氨酰胺酶硬化2(青少年)染色体区域,候选物4als2cr8肌萎缩性侧索cntfr睫状神经营养因子硬化2(青少年)受体染色体区域,候选物8als2cr11肌萎缩性侧索folh1叶酸水解酶1硬化2(青少年)染色体区域,候选物11fam117b具有序列p4hb的家族脯氨酰基4-羟化酶,相似性117,成员bβ多肽cntf睫状神经营养因子sqstm1死骨片(sequestosome)1stradbste20相关激酶naipnlr家族,凋亡适配器β抑制蛋白ywhaq酪氨酸3-slc33a1溶质载体家族33单加氧酶/色氨酸(乙酰-coa转运体),一种5-单加氧酶成员1激活蛋白,θ多肽trak2运输蛋白,图4图4同系物,sac1驱动蛋白结合2脂质磷酸酶结构域包含nif3l1nif3ngg1相互作用ina互联蛋白(internexin)神经因子3样1中间丝蛋白,αpard3bpar-3分区cox8a细胞色素c氧化酶缺陷3同系物b亚基viiiacdk15细胞周期蛋白依赖性激酶hecw1hect,c2和ww15结构域包含e3泛素蛋白连接酶1nos1一氧化氮合酶1metmet原癌基因sod2超氧化物歧化酶2,hspb1热休克27kda线粒体蛋白1nefl神经微丝,轻ctsb组织蛋白酶b多肽ang血管生成素,hspa8热休克70kda核糖核酸酶,rna酶a蛋白8家族,5vapbvamp(囊泡-esr1雌激素受体1相关膜蛋白)-相关蛋白b和csnca突触核蛋白,αhgf肝细胞生长因子cat过氧化氢酶actb肌动蛋白,βnefm神经微丝,介质th酪氨酸羟化酶多肽bcl2b-细胞cll/淋巴瘤2fasfas(tnf受体超家族,成员6)casp3半胱天冬酶3,凋亡-clu簇集蛋白相关半胱氨酸肽酶smn1运动神经元的存活g6pd葡萄糖-6-磷酸1,端粒脱氢酶baxbcl2-相关xhsf1热休克转录蛋白因子1rnf19a环指蛋白19ajunjun癌基因als2cr12肌萎缩性侧索hspa5热休克70kda硬化2(青少年)蛋白5染色体区域,候选物12mapk14丝裂原激活蛋白il10白介素10激酶14apex1apex核酸酶txnrd1硫氧还原蛋白还原酶1(多功能dna修复酶)1nos2一氧化氮合酶2,timp1timp金属肽酶可诱导的抑制剂1casp9半胱天冬酶9,相关半胱氨酸凋亡肽酶的凋亡-xiapx-连接的抑制剂glg1高尔基体糖蛋白1epo促红细胞生成素vegfa血管内皮eln弹性蛋白生长因子agdnf胶质细胞衍生的nfe2l2核因子(红系(erythroid)-神经营养因子衍生的2)样2slc6a3溶质载体家族6hspa4热休克70kda(神经递质蛋白4转运体,多巴胺),成员3apoe载脂蛋白epsmb8蛋白酶体(前体,巨蛋白因子)亚基,β类型,8dctn1动力蛋白激活蛋白(dynactin)1timp3timp金属肽酶抑制剂3kifap3驱动蛋白相关slc1a1溶质载体家族1蛋白3(神经元/上皮高亲和性谷氨酸转运体,系统xag),成员1smn2运动神经元的存活ccnc细胞周期蛋白c2,着丝粒mpp4膜蛋白,stub1stip1同源性和u-棕榈酰化的4盒包含蛋白1als2淀粉样蛋白β(a4)prdx6过氧化物酶6前体蛋白syp突触素cabin1钙调磷酸酶结合蛋白1casp1半胱天冬酶1,凋亡-gart磷酸核糖甘氨酰胺相关半胱氨酸甲酰转移酶,肽酶磷酸核糖甘氨酰胺合成酶,磷酸核糖氨基咪唑合成酶cdk5细胞周期蛋白依赖性激酶5atxn3共济失调蛋白3rtn4浆膜蛋白(reticulon)4c1qb补体成分1,q亚成分,b链vegfc神经生长因子htt亨廷顿蛋白(huntingtin)受体park7帕金森病7xdh黄嘌呤脱氢酶gfap胶质纤维酸性map2微管相关蛋白2cycs细胞色素c,躯体的fcgr3bigg的fc片段,低亲和性iiib,ccsubl5(泛素样5超氧化物歧化酶)的铜分子伴侣mmp9基质金属肽酶slc18a3溶质载体家族189((囊状乙酰胆碱),成员3trpm7瞬时受体hspb2热休克27kda潜在的阳离子通道,蛋白2亚家族m,成员7akt1v-akt鼠胸腺瘤derl1der1样结构域家族,病毒癌基因同系物1成员1ccl2趋化因子(c--c基序)ngrn突触生长相关蛋白(neugrin),轴突配体2赘生物(outgrowth)相关gsr谷胱甘肽还原酶tppp3促微管蛋白聚合蛋白家族成员3apaf1凋亡肽酶btbd10btb(poz)结构域激活因子1包含10glud1谷氨酸cxcr4趋化因子(c--x--c基序)脱氢酶1受体4slc1a3溶质载体家族1flt1fms相关酪氨酸(胶质高亲和性谷氨酸转运体),成员3激酶1pon1对氧磷酶1ar雄激素受体lif白血病抑制因子erbb3v-erb-b2红白血病病毒癌基因同系物3lgals1凝集素,半乳糖苷-cd44cd44分子结合,可溶的,1tp53肿瘤蛋白p53tlr3toll样受体3gria1谷氨酸受体,gapdh甘油-3-离子型的,ampa1磷酸脱氢酶grik1谷氨酸受体,des结蛋白离子型的,红藻氨酸(kainate)1chat胆碱乙酰转移酶flt4fms相关酪氨酸激酶4chmp2b染色质修饰的bag1bcl2相关蛋白2b永生基因(athanogene)mt3金属硫蛋白3chrna4胆碱能受体,烟碱的,α4gss谷胱甘肽合成酶bak1bcl2-拮抗剂(antagonist/killer)1kdr激酶插入结构域gstp1谷胱甘肽s-转移酶受体(iii型pi1受体酪氨酸激酶)ogg18-氧桥鸟嘌呤(oxoguanine)dnail6白介素6(干扰素,糖基化酶β2)。该动物或细胞可以包括1、2、3、4、5、6、7、8、9、10个或更多个破坏的、编码与als相关的蛋白质的染色体序列以及零、1、2、3、4、5、6、7、8、9、10个或更多个编码破坏的与als相关的蛋白质的染色体整合序列。与als相关的优选蛋白包括sod1(超氧化物歧化酶1)、als2(肌萎缩性侧索硬化2)、fus(融合在肉瘤中)、tardbp(tardna结合蛋白)、vagfa(血管内皮生长因子a)、vagfb(血管内皮生长因子b)以及vagfc(血管内皮生长因子c)及其任何组合。与朊病毒病相关的蛋白质的实例可以包括sod1(超氧化物歧化酶1)、als2(肌萎缩性侧索硬化2)、fus(融合在肉瘤中)、tardbp(tardna结合蛋白)、vagfa(血管内皮生长因子a)、vagfb(血管内皮生长因子b)以及vagfc(血管内皮生长因子c)及其任何组合。与朊病毒病症中的神经退行性疾病相关的蛋白质的实例可以包括例如a2m(α-2-巨球蛋白)、aatf(凋亡拮抗转录因子)、acpp(前列腺的酸性磷酸酶)、acta2(肌动蛋白α2平滑肌主动脉)、adam22(adam金属肽酶结构域)、adora3(腺苷a3受体)或adra1d(α-1d肾上腺素能受体(alpha-1dadrenergicreceptor或alpha-1dadrenoreceptor))。与免疫缺陷相关的蛋白质的实例可以包括例如a2m[α-2-巨球蛋白];aanat[芳烷基胺n-乙酰转移酶];abca1[atp-结合盒,亚家族a(abc1),成员1];abca2[atp-结合盒,亚家族a(abc1),成员2];或abca3[atp-结合盒,亚家族a(abc1),成员3]。与三核苷酸重复障碍相关的蛋白质的实例包括例如ar(雄激素受体)、fmr1(脆性x智力迟钝1)、htt(亨廷顿蛋白)或dmpk(强直性肌营养不良蛋白激酶)、fxn(弗氏共济失调蛋白(frataxin))、atxn2(共济失调蛋白2)。与神经传递障碍相关的蛋白质的实例包括例如sst(生长抑素)、nos1(一氧化氮合酶1(神经元的))、adra2a(肾上腺素能的,α-2a-,受体)、adra2c(肾上腺素能的,α-2c-,受体)、tacr1(速激肽受体1)或htr2c(5-羟色胺(血清素)受体2c)。神经发育相关序列的实例包括例如a2bp1[共济失调蛋白2-结合蛋白1]、aadat[氨基己二酸氨基转移酶],aanat[芳烷基胺n-乙酰转移酶]、abat[4-氨基丁酸氨基转移酶]、abca1[atp-结合盒,亚家族a(abc1),成员1]或abca13[atp-结合盒,亚家族a(abc1),成员13]。可用本发明系统治疗的优选病症的另外的实例可以选自:艾卡迪-古铁雷斯综合征(aicardi-goutièressyndrome);亚历山大病;阿伦-赫恩登-达德利综合征(allan-herndon-dudleysyndrome);polg相关障碍;α-甘露糖苷贮积症(ii和iii型);阿尔斯特伦综合征(syndrome);安格曼;综合征;共济失调-毛细血管扩张;神经元蜡样-脂褐质沉积;β-地中海贫血;双侧视神经萎缩和1型(婴儿)视神经萎缩;视网膜母细胞瘤(双侧的);卡纳万病(canavandisease);脑-眼-面-骨骼综合征(cerebrooculofacioskeletalsyndrome)1[cofs1];脑腱黄瘤病;科尼利亚迪兰吉综合征(corneliadelangesyndrome);mapt相关障碍;遗传性朊病毒病;德拉韦综合征(dravetsyndrome);早期发病家族性阿尔茨海默病;弗里德赖希共济失调[frda];多发性畸形;岩藻糖苷贮积症;福山(fukuyama)先天性肌营养不良;半乳糖唾液酸贮积症;戈谢病(gaucherdisease);有机酸血症;噬血细胞淋巴组织细胞增生症;早衰症;粘脂贮积症ii;婴儿游离唾液酸贮积病;pla2g6相关神经变性;耶韦尔和朗格-尼尔森综合征(jervellandlange-nielsensyndrome);结合性大疱性表皮松解;亨廷顿病;克拉伯病(krabbedisease)(婴儿的);线粒体dna相关雷吉综合征(mitochondrialdna-associatedleighsyndrome)和narp;莱施-奈恩综合征;lis1相关无脑回;洛氏综合征(lowesyndrome);槭糖尿病;mecp2复制综合征;atp7a相关铜转运障碍;lama2相关肌营养不良;芳基硫酸酯酶a缺乏;i、ii或iii型粘多糖贮积症;过氧化物酶体生物发生障碍,齐薇格谱系综合征(zellwegersyndromespectrum);伴随脑铁累积障碍的神经变性;酸性鞘磷脂酶缺乏;c型尼曼-皮克病;甘氨酸脑病;arx相关障碍;尿素循环障碍;col1a1/2相关成骨不全;线粒体dna缺失综合征;plp1相关障碍;佩里综合征(perrysyndrome);费伦-麦克德米德综合征(phelan-mcdermidsyndrome);ii型糖原贮积症(蓬佩病(pompedisease))(婴儿的);mapt相关障碍;mecp2相关障碍;1型肢近端型点状软骨发育不全(rhizomelicchondrodysplasiapunctatatype1);罗伯茨综合征(robertssyndrome);桑德霍夫病(sandhoffdisease);辛德勒病(schindlerdisease)-1型;腺苷脱氨酶缺乏;史-伦-奥三氏综合征;脊髓性肌萎缩;婴儿发病脊髓小脑性共济失调;己糖胺酶a缺乏;1型致死性发育不良;胶原vi型相关障碍;i型乌谢尔综合征(ushersyndrome);先天性肌营养不良;沃尔夫-赫奇霍恩综合征(wolf-hirschhornsyndrome);溶酶体酸脂酶缺乏;以及着色性干皮病。如将是显而易见的,设想的是可以使用本发明系统靶向任何感兴趣的多核苷酸序列。使用本发明系统进行治疗可能是有用的病症或疾病的一些实例被包括在上表中并且当前与那些病症相关的基因的实例也被提供于此。然而,示例的基因并不是穷尽性的。例如,“野生型stcas9”是指来自嗜热链球菌的野生型cas9,其蛋白质序列在登录号g3ecr1下给出于swissprot数据库中。类似地,化脓链球菌cas9在登录号q99zw2下被包括在swissprot中。使用crispr-cas系统进行有效且符合成本效益的基因编辑和操纵的能力将允许快速选择并比较单个和多元遗传操作,以转化这样的基因组,以便改善生产并增强性状。在此方面,参考美国专利和出版物:美国专利号6,603,061-农杆菌介导的植物转化法(agrobacterium-mediatedplanttransformationmethod);美国专利号7,868,149-植物基因组序列及其用途(plantgenomesequencesandusesthereof)以及us2009/0100536-转具有增强的农艺性状的基因植物(transgenicplantswithenhancedagronomictraits),将每者的所有内容和披露通过引用以其全文结合在此。在本发明的实践中,莫雷尔(morrell)等人“作物基因组学:进展与应用(cropgenomics:advancesandapplications)”《遗传学自然评论》(natrevgenet.)2011年12月29日;13(2):85-96的内容和披露也通过引用以其全文结合在此。实例以下实例出于说明本发明的不同实施例的目的而给出并且并不意在以任何方式限制本发明。本发明实例连同在此描述的方法目前代表优选的实施例,是示例性的,并且并不旨在限制本发明的范围。涵盖在如由权利要求书的范围所定义的本发明的精神内的在此的变化以及其他用途是本领域普通技术人员可以想到的。实例1:真核细胞的细胞核中的crispr复合物活性一个示例性ii型crispr系统是来自化脓链球菌sf370的ii型crispr座位,该座位包含四个基因cas9、cas1、cas2和csn1的聚簇以及两个非编码rna元件tracrrna和由非重复序列的短段(间隔子,每个约30bp)间隔开的重复序列(同向重复)的特征性阵列。在此系统中,以四个连续步骤产生靶向的dna双链断裂(dsb)(图2a)。第一步,从crispr座位转录两个非编码rna、pre-crrna阵列和tracrrna。第二步,将tracrrna杂交到pre-crrna的同向重复上,然后将其加工成包含单独的间隔子序列的成熟crrna。第三步,该成熟crrna:tracrrna复合物经由在crrna的间隔子区与原型间隔子dna之间形成异源双链体而指导cas9到由原型间隔子和对应的pam组成的dna靶标。最后,cas9介导pam上游的靶dna的切割,以在原型间隔子内产生一个dsb(图2a)。此实例描述了一种用于将此rna可编程的核酸酶系统适配成指导真核细胞的细胞核中的crispr复合物活性的示例性过程。细胞培养和转染在37℃下,伴随5%co2孵育,将人类胚肾(hek)细胞系hek293ft(生命技术公司)维持在补充有10%胎牛血清(海可隆公司(hyclone))、2mmglutamax(生命技术公司)、100u/ml青霉素及100μg/ml链霉素的杜尔贝科改良伊格尔培养基(dulbecco’smodifiedeagle’smedium)(dmem)中。在37℃下,在5%co2下,用补充有5%胎牛血清(海可隆公司)、2mmglutamax(生命技术公司)、100u/ml青霉素及100μg/ml链霉素的dmem维持小鼠neuro2a(n2a)细胞系(atcc)。在转染前一天,将hek293ft或n2a细胞以200,000个细胞/孔的密度接种到24孔板(康宁公司(corning))中。遵循制造商推荐的方案,使用lipofectamine2000(生命技术公司)转染细胞。对于24孔板的每个孔,使用总共800ng的质粒。基因组修饰的surveyor测定和测序分析如上所述,用质粒dna转染hek293ft或n2a细胞。转染后,在基因组dna提取之前,将细胞在37℃下孵育72小时。遵循制造商的方案,使用quickextractdna提取试剂盒(epicentre)提取基因组dna。简言之,将细胞重悬于quickextract溶液中并在65℃下孵育15分钟并且在98℃下孵育10分钟。将提取的基因组dna立即加工或存储在-20℃下。对于每个基因而言,pcr扩增围绕crispr靶位点的基因组区域,并且遵循制造商的方案,使用qiaquickspin柱(凯杰公司(qiagen))纯化产物。将总共400ng的纯化的pcr产物与2μl10xtaq聚合酶pcr缓冲液(enzymatics公司)和超纯水混合,至终体积为20μl,并使其经受重退火过程,以使得可以形成异源双链体:95℃持续10min,以-2℃/s95℃降至85℃,以-0.25℃/s85℃降至25℃,并且在25℃保持1分钟。重退火后,遵循制造商推荐的方案,将产物用surveyor核酸酶和surveyor增强子s(转基因组学公司(transgenomics))处理,并且在4%-20%novextbe聚丙烯酰胺凝胶(生命技术公司)上进行分析。将凝胶用sybrgolddna染色剂(生命技术公司)染色30分钟并用geldoc凝胶成像系统(伯乐公司(bio-rad))成像。定量是基于作为切割的dna的部分的量度的相对条带强度。图7提供了此surveyor测定的一个示意图。用于检测同源重组的限制性片段长度多态性测定。将hek293ft和n2a细胞用质粒dna转染,并且如上所述,在基因组dna提取之前,将其在37℃下孵育72小时。使用引物在同源重组(hr)模板的同源臂外pcr扩增靶基因组区域。将pcr产物分离在1%琼脂糖凝胶上并用minelutegelextraction试剂盒(凯杰公司)提取。将纯化产物用hindiii(费尔芒斯公司(fermentas))消化并在6%novextbe聚丙烯酰胺凝胶(生命技术公司)上进行分析。rna二级结构预测和分析使用质心结构预测算法,使用由维也纳大(universityofvienna)的理论化学研究所(institutefortheoreticalchemistry)研发的在线网络服务器rnafold进行rna二级结构预测(参见例如a.r.格鲁伯(a.r.gruber)等人,2008,《细胞》(cell)106(1):23-24;以及pa卡尔(pacarr)和gm丘奇(gmchurch),2009,《自然生物技术》(naturebiotechnology)27(12):1151-62)。rna纯化将hek293ft细胞如上所述地维持和转染。通过胰酶消化收获细胞,随后在磷酸盐缓冲生理盐水(pbs)中洗涤。遵循制造商的方案,用tri试剂(西格玛公司)提取总细胞rna。使用naonodrop(赛默飞世尔科技公司(thermoscientific))对提取的总rna进行定量并标准化至同一浓度。哺乳动物细胞中的crrna和tracrrna表达的northern印迹分析将rna与等体积的2x加样缓冲液(ambion)混合,加热至95℃持续5min,在冰上冷冻1min,并且然后在将凝胶预跑胶至少30分钟后,加样到8%变性聚丙烯酰胺凝胶(sequagel,国家诊断(nationaldiagnostics))上。将样品以40w极限电泳1.5小时。之后,在室温下,将rna转移到半干转移设备(伯乐公司(bio-rad))中的300ma的hybondn+膜(通用电气医疗公司(gehealthcare))上,持续1.5小时。使用stratageneuvcrosslinkerthestratalinker(stratagene)上的自动交联按钮将rna交联到该膜上。在42℃下,伴随旋转,将该膜在ultrahyb-oligo杂交缓冲液(ambion)中预杂交30min,并且然后添加探针并杂交过夜。探针订购自idt并将其用具有t4多核苷酸激酶(新英格兰生物实验室(newenglandbiolabs)))的[γ-32p]atp(珀金埃尔默公司)标记。将该膜用预加温的(42℃)2xssc、0.5%sds洗涤一次,持续1min,随后在42℃下洗涤两次,持续30分钟。将该膜在室温下向荧光屏暴露一小时或过夜并且然后用感光成像仪(typhoon)扫描。细菌crispr系统构建和评价从具有用于吉布森拼接(gibsonassembly)的侧翼同源臂的化脓链球菌sf370基因组dnapcr扩增crispr座位元件(包括tracrrna、cas9和前导子)。将两个bsai类型iis位点引入在两个同向重复之间,以促进方便地插入间隔子(图8)。使用gibsonassemblymastermix(neb)将pcr产物克隆进ecorv-消化的pacyc184中,在tet启动子的下游。省略其他内源crispr系统元件,csn2的最后50bp除外。将编码具有互补突出端的间隔子的寡聚物(整合dna技术公司(integrateddnatechnology))克隆进bsai-消化的载体pdc000(neb)中并且然后用t7连接酶(enzymatics公司)连接,以产生pcrispr质粒。包含具有pam的间隔子的激发质粒在哺乳动物细胞中的表达(图6a中所示出的表达构建体,其中功能性是如显示于图6b中的surveyor测定的结果所确定的)。将转录起始位点标为+1,并且还指示了转录终止子和通过northern印迹探测的序列。还通过northern印迹确认了加工的tracrrna的表达。图6c显示了提取自293ft细胞的总rna的northern印迹分析的结果,用携带长或短tracrrna以及spcas9和dr-emx1(1)-dr的u6表达构建体转染这些细胞。左图和右图分别是来自用或没用sprna酶iii转染的293ft细胞。u6指示用靶向人类u6snrna的探针进行印迹的加样对照。短tracrrna表达构建体的转染产生丰富水平的加工形式的tracrrna(~75bp)。在northern印迹上检测极低量的长tracrrna。为了促进转录精确起始,选择基于rna聚合酶iii的u6启动子,以驱动tracrrna的表达(图2c)。类似地,研发基于u6启动子的构建体,以表达由单个间隔子组成的pre-crrna阵列,该单个间隔子侧翼为两个同向重复(dr,还被术语“tracr配对序列”所涵盖;图2c)。将起始间隔子设计成靶向人emx1座位(图2c)中的33-碱基对(bp)靶位点(满足cas9的ngg识别基序的30-bp原型间隔子加3-bpcrispr基序(pam)序列),该座位是大脑皮层的发育中的一个关键基因。为了测试crispr系统(spcas9、sprna酶iii、tracrrna以及pre-crrna)在哺乳动物细胞中的异源表达是否可以实现哺乳动物染色体的靶向切割,用crispr组分的组合转染hek293ft细胞。由于哺乳动物细胞核中的dsb通过导致形成插入缺失的非同源末端连接(nhej)途径而部分地修复,使用surveyor测定检测靶emx1座位处的潜在的切割活性(图7)(参见例如格斯钦(guschin)等人,2010,《分子生物学方法》(methodsmolbiol)649:247)。所有四种crispr组分的共转染能够在原型间隔子中诱导高达5.0%切割(参见图2d)。所有crispr组分(减去sprna酶iii)的共转染在原型间隔子中也诱导高达4.7%插入缺失,表明可能存在能够辅助crrna成熟的内源性哺乳动物rnase,如例如相关的dicer和drosha酶。除去剩余的三种组分中的任何组分消除crispr系统的基因组切割活性(图2d)。包含已证实切割活性的靶座位的扩增子的桑格测序:在43个测序的克隆中,发现5个突变的等位基因(11.6%)。使用多种指导序列的类似实验产生了高达29%的插入缺失百分比(参见图3-6、10和11)。这些结果定义了一种在哺乳动物细胞中的有效的crispr介导的基因组修饰的三组分系统。为了优化切割效率,申请人还测试了tracrrna的不同亚型是否影响切割效率并且发现,在实例系统中,仅仅短(89-bp)转录本形式能够介导人emx1基因组座位的切割(图6b)。图12提供了哺乳动物细胞中的crrna加工的另外的northern印迹分析。图12a示出了一个示意图,显示了侧翼为两个同向重复(dr-emx1(1)-dr)的单个间隔子的表达载体。靶向人emx1座位原型间隔子1(参见图6)的30bp间隔子和同向重复序列显示于图12a下方的序列中。直线指示其反向互补系列用于产生供emx1(1)crrna检测用的northern印迹探针的区域。图12b显示了提取自293ft细胞的总rna的northern印迹分析,用携带dr-emx1(1)-dr的u6表达构建体转染这些细胞。左图和右图分别是来自用或没用sprna酶iii转染的293ft细胞。dr-emx1(1)-dr仅在存在spcas9和短tracrrna的情况下被加工为成熟crrna并且不依赖于sprna酶iii的存在。检测的来自转染的293ft总rna的成熟crrna是~33bp并且比来自化脓链球菌的39-42bp成熟crrna短。这些结果证明,crispr系统可以被移植进真核细胞中并被重新编程,以促进内源哺乳动物靶多核苷酸的切割。图2示出了描述于此实例中的细菌crispr系统。图2a示出了一个示意图,显示了来自化脓链球菌sf370的crispr座位和通过此系统crispr介导的dna切割的建议机制。加工自同向重复-间隔子阵列的成熟crrna指导cas9到以下基因组靶标,这些靶标由互补原型间隔子和原型间隔子相邻基序(pam)组成。靶标-间隔子碱基配对后,cas9介导靶dna中的双链断裂。图2b示出了具有使得可以导入到哺乳动物细胞核中的核定位信号(nls)的化脓链球菌cas9(spcas9)和rna酶iii(sprna酶iii)的工程化。图2c示出了由组成型ef1a启动子驱动的spcas9和sprna酶iii以及由rnapol3启动子u6驱动的tracrrna和pre-crrna阵列(dr-间隔子-dr)的哺乳动物表达,上述启动子促进转录精确起始和终止。将来自具有令人满意的pam序列的人emx1座位的原型间隔子用作pre-crrna阵列中的间隔子。图2d示出了spcas9介导的次要插入和缺失的surveyor核酸酶测定。用和不用sprna酶iii、tracrrna以及携带emx1-靶间隔子的pre-crrna阵列表达spcas9。图2e示出了靶座位与emx1-靶向crrna之间的碱基配对的一个示意表示以及一个显示了与spcas9切割位点邻近的微小缺失的示例性层析谱。图2f示出了从43个克隆扩增子的测序分析鉴定出的突变的等位基因,这些扩增子显示出多种微小插入和缺失。破折号指示缺失的碱基,并且非比对或错配碱基指示插入或突变。比例尺=10μm。为了进一步简化该三组分系统,改编嵌合的crrna-tracrrna杂交体设计,其中成熟crrna(包括一种指导序列)可以经由茎-环而融合到部分tracrrna上,以模拟天然的crrna:tracrrna双链体。为了增加共递送效率,产生双顺反子表达载体,以驱动嵌合的rna和spcas9在转染细胞中的共表达。平行地,使用该双顺反子载体表达pre-crrna(dr-指导序列-dr)与spcas9,以诱导用分开表达的tracrrna加工为crrna(比较图11b的上图和底图)。图8提供了pre-crrna阵列(图8a)或嵌合的crrna(由图8b中的指导序列插入位点的下游和ef1α启动子的上游的短线表示)与hspcas9的双顺反子表达载体的示意图,显示了各种元件的位置和指导序列插入点。图8b中的围绕指导序列插入位点的位置的展开的序列还显示了部分dr序列(gtttagagcta)和部分tracrrna序列(tagcaagttaaaataaggctagtccgttttt)。可以使用退火的寡核苷酸将指导序列插入在bbsi位点之间。寡核苷酸的序列设计显示在图8中的示意图的下方,其中指示了适当的连接适配子。wpre表示土拨鼠肝炎病毒转录后调节元件。通过靶向与上述相同的emx1座位而测试嵌合的rna介导的切割效率。使用扩增子的surveyor测定和桑格测序两者,申请人确认到嵌合的rna设计以大约4.7%的修饰率而促进人emx1座位的切割(图3)。通过设计靶向人emx1和pvalb以及小鼠th座位中的多个位点的嵌合的rna,通过靶向人类和小鼠细胞两者中的另外的基因组座位而测试crispr介导的切割在真核细胞中的普遍性。图13示出了人类pvalb(图13a)和小鼠th(图13b)座位中的一些另外的靶向原型间隔子的选择。提供了各自的最后的外显子内的基因座位位和三个原型间隔子的位置的示意图。加下划线的序列包括30bp的原型间隔子序列和对应于pam序列的3’端处的3bp。分别在dna序列的上方和下方指示了有义链和反义链上的原型间隔子。人类pvalb和小鼠th座位分别达到了6.3%和0.75%的修饰率,证明了crispr系统跨多种生物在修饰不同座位方面的广阔适用性(图5)。虽然对于每个座位而言,使用嵌合的构建体仅伴随三分之一的间隔子检测切割,但是当使用共表达的pre-crrna安排时,所有靶序列都被切割,伴随达到27%的有效的插入缺失产生(图6和13)。图11提供了可以被重新编程为靶向哺乳动物细胞中的多个基因组座位的spcas9的另外的图解。图11a提供了人emx1座位的示意图,显示了五个原型间隔子的位置,由加下划线的序列指示。图11b提供了pre-crrna/trcrrna复合物的示意图,显示了pre-crrna和tracrrna的同向重复区之间的杂交(上),以及嵌合的rna设计的示意图,包括一个20bp指导序列和由部分同向重复组成的tracr配对和tracr序列以及以发夹结构杂交的tracrrna序列(下)。比较人emx1座位中的五个原型间隔子处的cas9介导的切割的效率的surveyor测定的结果示于图11c中。使用加工的pre-crrna/tracrrna复合物(crrna)或嵌合的rna(chirna)靶向每个原型间隔子。由于rna的二级结构对于分子间相互作用可以是决定性的,使用基于最小自由能和玻尔兹曼(boltzmann)加权结构集合的结构预测算法比较基因组靶向实验中使用的所有指导序列的假定的二级结构(参见例如格鲁贝尔(gruber)等人,2008,《核酸研究》(nucleicacidsresearch),36:w70)。分析揭示到在大多数情况下,在嵌合的crrna背景下有效的指导序列基本上不含二级结构基序,而无效的指导序列更可能形成可以阻止与靶原型间隔子dna进行碱基配对的内部二级结构。因此,可能的是,当使用嵌合的crrna时,间隔子二级结构的变异性可能影响crispr介导的干扰的效率。spcas9的另外的载体设计显示于图22中,示出了掺入连接到指导寡核苷酸的插入位点的u6启动子和连接到spcas9编码序列上的cbh启动子的单个表达载体。显示于图22b中的载体包括一个连接到h1启动子上的tracrrna编码序列。在细菌测定中,所有的间隔子均促进有效的crispr干扰(图3c)。这些结果表明,可能存在影响哺乳动物细胞中的crispr活性效率的另外的因素。为了研究crispr介导的切割的特异性,使用一系列具有单点突变的emx1-靶向嵌合的crrna分析指导序列中的单核苷酸突变对哺乳动物基因组中的原型间隔子切割的影响(图3a)。图3b示出了比较当与不同突变的嵌合的rna配对时cas9的切割效率的surveyor核酸酶测定的结果。pam的5’的高达12-bp的单碱基错配基本上消除了由spcas9进行的基因组切割,而在离上游位置更远处具有突变的间隔子保留针对原始原型间隔子靶标的活性(图3b)。除pam之外,spcas9在间隔子的最后12-bp内具有单碱基特异性。此外,crispr能够像一对靶向同一emx1原型间隔子的tale核酸酶(talen)一样有效地介导基因组切割。图3c提供了一个示意图,显示了靶向emx1的talen的设计并且图3d显示了比较talen和cas9的效率的surveyor凝胶(n=3)。已经通过易错nhej机制建立了一套用于在哺乳动物细胞中实现crispr介导的基因编辑的组分,测试crispr刺激同源重组(hr)的能力,同源重组是一种用于使得基因组中的编辑精确的高保真基因修复途径。野生型spcas9能够介导位点特异的dsb,这些dsb可以通过nhej和hr两者进行修复。另外,将spcas9的ruvci催化结构域中的天冬氨酸至丙氨酸取代(d10a)工程化,以将核酸酶转化为切口酶(spcas9n;示于图4a中)(参见例如萨普拉诺萨克斯(sapranausaks)等人,2011,《核酸研究》(nucleicacidsresearch),39:9275;加索纳斯(gasiunas)等人,2012,《美国国家科学院院刊》(proc.natl.acad.sci.usa),109:e2579),这样使得带切口的基因组dna经历高保真同源定向修复(hdr)。surveyor测定确认到,spcas9n在emx1原型间隔子靶标处不产生插入缺失。如图4b所示,emx1-靶向的嵌合crrna与spcas9的共表达在靶位点中产生插入缺失,而与spcas9n的共表达不产生插入缺失(n=3)。此外,327个扩增子的测序未检测到由spcas9n诱导的任何插入缺失。选择相同的座位,以通过用靶向emx1、hspcas9或hspcas9n的嵌合的rna以及用于在原型间隔子附近引入一对限制酶切位点(hindiii和nhei)的hr模板共转染hek293ft细胞而测试crispr介导的hr。图4c提供了hr策略的示意图,包含重组点的相对位置和引物退火序列(箭头)。spcas9和spcas9n的确催化将hr模板整合进emx1座位中。pcr扩增靶区域,随后用hindiii进行限制酶切消化揭示了对应于期望片段尺寸的切割产物(显示于图4d中的限制性片段长度多态性分析中的箭头),其中spcas9和spcas9n介导类似水平的hr效率。申请人使用基因组扩增子的桑格测序进一步证实了hr(图4e)。这些结果证明了crispr促进哺乳动物基因组中的靶向基因插入的实用性。鉴于14-bp(来自间隔子的12-bp和来自pam的2-bp)特异地靶向野生型spcas9,切口酶的可获得性可以显著减少脱靶修饰的可能性,因为单链断裂不是易错nhej途径的底物。构建模拟具有阵列的间隔子的crispr座位的天然构造的表达构建体(图2a),以测试多元序列靶向的可能性。使用编码一对emx1-和pvalb-靶向间隔子的单crispr阵列,在两个座位处都检测到了有效的切割(图4f,显示了crrna阵列的示意设计和显示出切割的有效修饰的检验员印迹两者)。使用针对由119bp间隔开的emx1内的两个靶标的间隔子通过共存dsb还检测到了较大基因组区的靶向缺失,并且检测到了1.6%缺失效率(182个扩增子中的3个;图4g)。这证明,crispr系统可以介导单个基因组中的多元编辑。实例2:crispr系统修饰和替代方案使用rna编程序列特异的dna切割的能力定义了一个新类别的针对多种研究和工业应用的基因组工程化工具。可以进一步改善crispr系统的若干方面,以增加crispr靶向的效率和通用性。优化的cas9活性可以依赖于处于比存在于哺乳动物细胞核中的游离mg2+高的水平的游离mg2+的可获得性(参见例如季聂克(jinek)等人,2012,《科学》(science),337:816),并且对恰好位于原型间隔子的下游的ngg基序的偏好限制靶向人类基因组中的平均每12-bp的能力(图9,评价了人类染色体序列的正链和负链两者)。这些约束中的一些可以通过探索crispr座位跨微生物宏基因组的多样性而克服(参见例如马卡洛娃(makarova)等人,2011,《自然微生物学综述》(natrevmicrobiol),9:467)。可以通过类似于实例1中描述的方法将其他crispr座位移植进哺乳动物细胞环境中。例如,图10示出了来自嗜热链球菌lmd-9的crispr1的用于在哺乳动物细胞中进行异源表达的ii型crispr系统的适应,以实现crispr介导的基因组编辑。图10a提供了来自嗜热链球菌lmd-9的crispr1的示意图。图10b示出了嗜热链球菌crispr系统的表达系统的设计。使用组成型ef1α启动子表达人类密码子优化的hstcas9。使用促进转录精确起始的u6启动子表达tracrrna和crrna的成熟版本。示出了来自成熟crrna和tracrrna的序列。crrna序列中的由小写字母“a”指示的单个碱基用于除去作为rnapoliii转录终止子的polyu序列。图10c提供了一个示意图,显示了靶向人emx1座位的指导序列。图10d显示了使用surveyor测定的靶座位中的hstcas9介导的切割的结果。rna指导间隔子1和2分别诱导了14%和6.4%。在这两个原型间隔子位点处跨生物复制物的切割活性的统计分析还提供于图5中的。图14提供了嗜热链球菌crispr系统的另外的原型间隔子和在人emx1座位中的对应的pam序列靶标示意图。两个原型间隔子序列被高亮并且通过相对于对应的高亮序列为3’加下划线而指示满足nnagaaw基序的对应的pam序列。两个原型间隔子均靶向反义链。实例3:样品靶序列选择算法设计一个软件程序,以基于指定的crispr酶的希望的指导序列长度和crispr基序序列(pam),在输入dna序列的两条链上鉴定候选crispr靶序列。例如,可以通过在输入序列和该输入序列的反向互补体两者上检索5’-nx-ngg-3’而鉴定来自化脓链球菌的cas9的具有pam序列ngg的靶位点。同样地,可以通过在输入序列和该输入序列的反向互补体两者上检索5’-nx-nnagaaw-3’而鉴定化脓链球菌crispr1的cas9的具有pam序列nnagaaw的靶位点。同样地,可以通过在输入序列和该输入序列的反向互补体两者上检索5’-nx-nggng-3’而鉴定化脓链球菌crispr3的cas9的具有pam序列nggng的靶位点。可以通过程序固定或由使用者指定nx中的值“x”,如20。由于在dna靶位点的基因组中出现多次可以导致非特异的基因组编辑,因此在鉴定所有潜在的位点后,基于序列在相关参比基因组中出现的次数,该程序将其滤出。对于其序列特异性是通过‘种子(seed)’序列(如来自pam序列的11-12bp5’,包括pam序列本身)确定的那些crispr酶,过滤步骤可以基于该种子序列。因此,为了避免另外的基因组座位处的编辑,基于种子:pam序列在相关基因组中出现的次数过滤结果。可以允许使用者选择种子序列的长度。处于通过过滤器的目的,还可以允许使用者指定种子:pam序列在基因组中出现的次数。默认筛选独特序列。通过改变种子序列的长度和该序列在基因组中出现的次数两者而改变过滤水平。该程序可以另外或可替代地通过提供鉴定的一个或多个靶序列的反向互补体而提供与报告的一个或多个靶序列互补的指导序列的序列。一些靶位点在人类基因组中的示例性可视化提供于图18中。用于优化序列选择的方法和算法的另外的细节可以发现于通过引用结合在此的美国申请序列号61/064,798(代理人案号44790.11.2022;博德参考号bi-2012/084)中。实例4:多种嵌合的crrna-tracrrna杂交体的评价此实例描述了针对具有掺入不同长度的野生型tracrrna序列的tracr序列的嵌合的rna(chirnas;在单个转录本中包括指导序列、tracr配对序列以及tracr序列)而获得的结果。图16a示出了嵌合的rna和cas9的双顺反子表达载体的示意图。cas9由cbh启动子驱动并且嵌合的rna由u6启动子驱动。嵌合的指导rna由接合到tracr序列的20bp指导序列(n)组成(从下链的第一个“u”到该转录本的结尾),其在如指示的各点被截短。指导和tracr序列由tracr-配对序列guuuuagagcua,随后是环序列gaaa隔开。人emx1和pvalb座位处的cas9介导的插入缺失的surveyor测定的结果分别示于图16b和16c中。箭头指示预期的surveyor片段。chirna由其“+n”标志指示,并且crrna是指指导序列和tracr序列被表达为分开的转录本的杂交体rna。一式三份地进行的这些结果的定量示于图17a和17b的直方图中,分别对应于图16b和16c(“n.d.”指示未检测到插入缺失)。原型间隔子id及其对应的基因组靶标、原型间隔子、pam序列以及链位置提供于表d中。将指导序列设计成与整个原型间隔子序列互补(在杂交体系统中的分开的转录本的情况下),或仅为部分加下划线(在嵌合的rna的情况下)。表d:用于优化指导序列的另外的细节可以发现于通过引用结合在此的美国申请序列号61/836,127(代理人案号44790.08.2022;博德参考号bi-2013/004g)中。初始,靶向人hek293ft细胞中的emx1座位内的三个位点。使用surveyor核酸酶测定评估每种chirna的基因组修饰效率,该测定检测由dna双链断裂(dsb)及其通过非同源末端连接(nhej)dna损伤修复途径进行的随后修复造成的突变。被指定为chirna(+n)的构建体指示,野生型tracrrna的直达第+n个核苷酸被包括在嵌合的rna构建体中,其中48、54、67和85的值用于n。嵌合的rna在所有三个emx1靶位点处都包含长片段的野生型tracrrna(chirna(+67)和chirna(+85))介导的dna切割,其中chirna(+85)尤其展示出比以分开的转录本形式表达指导序列和tracr序列的对应的crrna/tracrrna杂交体显著更高水平的dna切割(图16b和17a)。还使用chirna靶向pvalb座位中的两个位点,其不产生使用杂交体系统(作为分开的转录本而表达的指导序列和tracr序列)的可检测的切割。chirna(+67)和chirna(+85)能够在两个pvalb原型间隔子处介导显著的切割(图16c和17b)。对于emx1和pvalb座位中的所有五个靶标,伴随增加的tracr序列长度观察到一致增加的基因组修饰效率。不希望受任何理论的束缚,由tracrrna的3’端形成的二级结构可以在增强crispr复合物形成率方面发挥一定作用。实例5:cas9多样性crispr-cas系统是一种由跨细菌和古生菌的相异物种利用的针对侵入型外源dna的获得性免疫机制。ii型crispr-cas9系统由一套编码负责将外源dna“捕获(acquisition)”进crispr座位中的蛋白质的基因以及一套编码负责“执行(execution)”dna切割机制的蛋白质的基因组成;这些包括dna核酸酶(cas9)、非编码反式激活cr-rna(tracrrna)以及侧翼为同向重复的外源dna衍生的间隔子阵列(crrna)。当被cas9成熟后,tracrna和crrna双链体指导cas9核酸酶到由间隔子指导序列规定的靶dna序列,并且在靶dna中介导短序列基序附近的dna中的双链断裂,该导短序列基序为切割所需并且对于每种crispr-cas系统而言是特异的。ii型crispr-cas系统发现在整个细菌界中并且在用于靶标切割的cas9蛋白序列和尺寸、tracrrna和crrna同向重复序列、这些元件的基因组组织以及基序要求方面高度相异。一个物种可以具有多种相异的crispr-cas系统。申请人评价了来自基于与已知cas9的序列同源性和与已知亚结构域直向同源的结构鉴定的细菌物种的207个假定的cas9,这些亚结构域包括hnh内切核酸酶结构域和ruvc内切核酸酶结构域[信息来自尤金库宁(eugenekoonin)和基拉马卡洛娃(kiramakarova)]。基于此套的蛋白质序列保守的系统发生分析揭示了五个cas9家族,包括三组大的cas9(~1400个氨基酸)和两组小的cas9(~1100个氨基酸)(参见图19和20a-f)。cas9和cas9酶转化为切口酶或dna结合蛋白的突变及其具有的改变的功能性的用途的另外的细节可以发现于通过引用结合在此的美国申请序列号61/836,101和61/835,936(代理人案号分别为44790.09.2022和4790.07.2022并且博德参考号分别为bi-2013/004e和bi-2013/004f)中。实例6:cas9直向同源物申请人分析了cas9直向同源物,以鉴定相关的pam序列和对应的嵌合的指导rna。具有一套展开的pam提供了跨基因组的更广泛的靶向并且还显著增加独特靶位点的数目并且提供了在基因组中鉴定具有增加水平的特异性的新颖的cas9的潜力。可以通过测试每种cas9容忍指导rna及其dna靶标之间的错配的能力评价cas9直向同源物的特异性。例如,已经通过测试指导rna中的突变对切割效率的影响表征了spcas9的特异性。用指导序列与靶dna之间的单个或多个错配建立指导rna文库。基于这些发现,可以基于以下准则选择spcas9的靶位点:为了最大化spcas9编辑具体基因的特异性,应该在感兴趣的座位内选择一个靶位点,这样使得潜在的‘脱靶’基因组序列遵守以下四个约束:首先,它们的后面不应该是具有的5’-ngg或nag序列的pam。其次,它们与靶序列的整体序列相似性应该是最小化的。第三,最大数目的错配应该位于脱靶位点的pam-近侧区内。最后,最大数目的错配应该是连续的或由少于四个碱基隔开。可以使用类似的方法评价其他cas9直向同源物的特异性和建立在靶标种类的基因组内选择特定靶位点的标准。如前所述,基于此套的蛋白质序列保守的系统发生分析揭示了五个cas9家族,包括三组大的cas9(~1400个氨基酸)和两组小的cas9(~1100个氨基酸)(参见图19和20a-f)。cas直向同源物的另外的细节可以发现于通过引用结合在此的美国申请序列号61/836,101和61/835,936(代理人案号分别为44790.09.2022和4790.07.2022并且博德参考号分别为bi-2013/004e和bi-2013/004f)中。实例7:用于简化克隆和递送的方法改进。并非在质粒上编码u6-启动子和指导rna,申请人用dna寡核苷酸扩增了u6启动子,以添加到指导rna上。可以将生成的pcr产物转染到细胞中,以驱动指导rna的表达。允许产生由靶向人emx1座位的u6-启动子::指导rna组成的pcr产物的示例性引物对:正向引物:aaactctagagagggcctatttcccatgattc反向引物(携带指导rna,该指导rna已加下划线):acctctagaaaaaaagcaccgactcggtgccactttttcaagttgataacggactagccttattttaacttgctatgctgttttgtttccaaaacagcatagctctaaaacccctagtcattggaggtgacggtgtttcgtcctttccacaag实例8:用于改善活性的方法改进:并非使用pol3启动子(特别是rna聚合酶iii(例如u6或h1启动子)在真核细胞中表达指导rna,申请人在真核细胞中表达t7聚合酶,以使用t7启动子驱动指导rna的表达。此系统的一个实例可以涉及引入三段dna:1.cas9的表达载体2.t7聚合酶的表达载体3.包含融合到t7启动子上的指导rna的表达载体实例9:用于减少cas9的毒性的方法改进:将cas9以mrna的形式递送。将cas9以mrna的形式递送使得可以在细胞中瞬时表达cas9,以减少毒性。例如,可以使用以下引物对扩增人源化spcas9:正向引物(用以添加到用于体外转录的t7启动子上):taatacgactcactataggaagtgcgccaccatggccccaaagaagaagcgg反向引物(用以添加到polya尾上):ggttttttttttttttttttttttttttttttttcttactttttcttttttgcctggccg申请人用处于rna或dna盒形式的指导rna将cas9mrna转染进细胞中,以驱动指导rna在真核细胞中的表达。实例10:用于减少cas9的毒性的方法改进:使用诱导型启动子申请人仅当需要进行基因组修饰时才瞬时开启cas9表达。可诱导系统的实例包括四环素诱导型启动子(tet-on或tet-off)、小分子双杂交体转录激活系统(fkbp、aba等))或光可诱导系统(光敏素、lov结构域或隐花色素)。实例11:cas9系统用于体内应用的改进申请人执行了具有小分子量的cas9的宏基因组检索。大多数cas9同系物相当大。例如,spcas9的长度为1368aa左右,这对于容易包装进供递送的病毒载体中而言太大。从存放在genbank中的序列生成表示出cas9同系物的长度分布的图表(图23)。一些序列可能已经被错误注释并且因此每个长度的准确频率不一定是精确的。尽管如此,但是它提供了对cas9蛋白分布的模糊认识并且表明存在较短的cas9同系物。通过计算分析,申请人发现在细菌菌株弯曲杆菌属中,存在两个具有少于1000个氨基酸的cas9蛋白。下文呈现了来自空肠弯曲杆菌的一种cas9的序列。以此长度,cjcas9可以被容易地包装进aav、慢病毒、腺病毒以及其他用于稳健地递送进原代细胞和递送进动物模型体内的病毒载体中。在本发明的一个优选实施例中,使用来自金黄色葡萄球菌的cas9蛋白。>空肠弯曲杆菌cas9(cjcas9)marilafdigissigwafsendelkdcgvriftkvenpktgeslalprrlarsarkrlarrkarlnhlkhlianefklnyedyqsfdeslakaykgslispyelrfralnellskqdfarvilhiakrrgyddiknsddkekgailkaikqneeklanyqsvgeylykeyfqkfkenskeftnvrnkkesyerciaqsflkdelklifkkqrefgfsfskkfeeevlsvafykralkdfshlvgncsfftdekrapknsplafmfvaltriinllnnlkntegilytkddlnallnevlkngtltykqtkkllglsddyefkgekgtyfiefkkykefikalgehnlsqddlneiakditlikdeiklkkalakydlnqnqidslsklefkdhlnisfkalklvtplmlegkkydeacnelnlkvainedkkdflpafnetyykdevtnpvvlraikeyrkvlnallkkygkvhkinielarevgknhsqrakiekeqnenykakkdaeleceklglkinsknilklrlfkeqkefcaysgekikisdlqdekmleidhiypysrsfddsymnkvlvftkqnqeklnqtpfeafgndsakwqkievlaknlptkkqkrildknykdkeqknfkdrnlndtryiarlvlnytkdyldflplsddentklndtqkgskvhveaksgmltsalrhtwgfsakdrnnhlhhaidaviiayannsivkafsdfkkeqesnsaelyakkiseldyknkrkffepfsgfrqkvldkideifvskperkkpsgalheetfrkeeefyqsyggkegvlkalelgkirkvngkivkngdmfrvdifkhkktnkfyavpiytmdfalkvlpnkavarskkgeikdwilmdenyefcfslykdsliliqtkdmqepefvyynaftsstvslivskhdnkfetlsknqkilfknanekeviaksigiqnlkvfekyivsalgevtkaefrqredfkk。此cjcas9的假定的tracrrna元件是:tataatctcataagaaatttaaaaagggactaaaataaagagtttgcgggactctgcggggttacaatcccctaaaaccgcttttaaaatt同向重复序列是:attttaccataaagaaatttaaaaagggactaaaaccjcas9的嵌合的指导rna的一个实例是:nnnnnnnnnnnnnnnnnnnnguuuuagucccgaaagggacuaaaauaaagaguuugcgggacucugcgggguuacaauccccuaaaaccgcuuuu实例12:cas9优化用于增强功能或用于开发新的功能,申请人通过组合来自不同cas9同系物的片段而产生了嵌合的cas9蛋白。例如,嵌合的cas9蛋白的两个实例:例如,申请人将st1cas9(来自此蛋白的片段为粗体)的n-末端与spcas9(来自此蛋白的片段被加下划线)的c-末端融合。>st1(n)sp(c)cas9>sp(n)st1(c)cas9制备嵌合的cas9的益处包括:减少毒性改善在真核细胞中的表达增强特异性减少蛋白质的分子量,通过组合来自不同cas9同系物的最小结构域使得蛋白质更小。改变pam序列要求实例13:将cas9作为通用dna结合蛋白而利用通过使负责切割dna靶标的两条链的两个催化结构域(d10和h840)突变,申请人使用cas9作为通用dna结合蛋白。为了上调在靶座位的基因转录,申请人将转录激活结构域(vp64)融合到cas9上。申请人推测见到cas9-vp64融合蛋白的较强的核定位应该是重要的,因为转录因子激活强度是在靶标处花费的时间的函数。因此,申请人克隆了一套cas9-vp64-gfp构建体,将它们转染进293细胞中并在转染后12小时在荧光显微镜下评估其定位。将相同的构建体克隆为2a-gfp而非直接融合,以便在功能上测试不存在庞大gfp干扰的构建体。申请人选择用cas9反式激活因子靶向sox2座位,因为这对于细胞重新编程可以是有用的并且该座位已经被验证为tale-tf介导的转录激活的靶标。对于sox2座位,申请人选择了转录起始位点(tss)附近的八个靶标。每个靶标的长度均为20bp,具有一个相邻的ngg原型间隔子邻近基序(pam)。将每个cas9-vp64构建体与每个pcr产生的嵌合的crisprrna(chirna)共转染进293细胞中。转染后72小时,使用rt-qpcr评估转录激活。为了进一步优化转录激活因子,申请人滴定了转染进293细胞中的chirna(sox2.1和sox2.5)与cas9(nls-vp64-nls-hspcas9-nls-vp64-nls)的比例,并使用rt-qpcr进行定量。这些结果指示可以将cas9用作通用dna结合结构域,以上调靶座位处的基因转录。申请人设计了第二代构建体。(下表)。plenti-ef1a-gfp-2a-6xhis-nls-vp64-nls-hspcsn1(d10a,h840a)-nlsplenti-ef1a-gfp-2a-6xhis-nls-vp64-nls-hspcsn1(d10a,h840a)plenti-ef1a-gfp-2a-6xhis-nls-vp64-nls-nls-hspcsn1(d10a,h840a)plenti-ef1a-gfp-2a-6xhis-nls-hspcsn1(d10a,h840a)-nlsplenti-ef1a-gfp-2a-6xhis-nls-hspcsn1(d10a,h840a)plenti-ef1a-gfp-2a-6xhis-nls-nls-hspcsn1(d10a,h840a)申请人使用这些构建体通过rt-qpcr评估转录激活(vp64融合的构建体)和阻抑(仅有cas9)。申请人使用抗-his抗体评估每个构建体的细胞定位,使用surveyor核酸酶测定评估核酸酶活性,并使用凝胶迁移测定评估dna结合亲和性。在本发明的一个优选实施例中,该凝胶迁移测定是emsa凝胶迁移测定。实例14:cas9转基因和基因敲入小鼠为了产生表达cas9核酸酶的小鼠,申请人提交了两个通用策略转基因和基因敲入。可以应用这些策略产生任何其他感兴趣的模式生物,例如大鼠。对于这些通用策略中的每个策略,申请人制备了组成型活性cas9和条件表达的cas9(cre重组酶依赖性的)。在以下背景下表达组成型活性cas9核酸酶:pcag-nls-cas9-nls-p2a-egfp-wpre-bghpolya。pcag是启动子,nls是核定位信号,p2a是肽切割序列,egfp是增强型绿色荧光蛋白,wpre是土拨鼠肝炎病毒转录后调节元件,并且bghpolya是牛生长激素poly-a信号序列(图25a-b)。该条件版本在启动子之后nls-cas9-nls之前具有一个另外的终止盒元件loxp-sv40polyax3-loxp(即pcag-loxp-sv40polyax3-loxp-nls-cas9-nls-p2a-egfp-wpre-bghpolya)。这些重要的表达元件可以如在图26中可视化。组成型构建体应该在整个发育过程中在所有细胞类型中进行表达,而条件型构建体将仅当同一细胞正在表达cre重组酶时才允许cas9表达。当cre处于组织特异的启动子的表达之下时,后一版本才将允许cas9的组织特异的表达。此外,可以通过将cre置于诱导型启动子(如teton或off系统)的表达之下而在成年小鼠中诱导cas9表达。cas9构建体的验证:以三种方式在功能上验证每个质粒:1)瞬时转染进293个细胞中,随后确认gfp表达;2)瞬时转染进293细胞中,随后使用识别p2a序列的抗体进行免疫荧光;以及3)瞬时转染,随后是surveyor核酸酶测定。取决于感兴趣的细胞,这些293细胞可以是293ft或293t细胞。在一个优选的实施例中,这些细胞是293ft细胞。条件型和组成型构建体的surveyor的结果分别示于凝胶的顶行和底行。在存在和不存在靶向hemx1座位的嵌合的rna(嵌合的rnahemx1.1)的情况下测试每个构建体。结果指示,构建体仅在嵌合的rna的存在下才可以成功地靶向hemx1座位(并且在条件型构建体的情况下,是cre)。将凝胶定量并且将结果呈现为三个样品的平均的切割效率和标准差。转基因的cas9小鼠:为了产生具有构建体的转基因小鼠,申请人将纯的线性dna注射进来自假怀孕的cb56雌鼠的受精卵的原核中。对首建者小鼠进行鉴定、基因分型,并与cb57小鼠回交。将构建体成功地克隆并通过桑格测序进行证实。基因敲入cas9小鼠:为了产生cas9基因敲入小鼠,申请人将相同的组成型和条件型构建体靶向rosa26座位。申请人通过将每个构建体克隆进具有以下元件的rosa26靶向载体中而将其完成:rosa26短同源臂-组成型/条件型cas9表达盒-ppgk-neo-rosa26长同源臂-ppgk-dta。ppgk是赋予对新霉素的抗性的阳性选择标记neo、1kb短臂,4.3kb长臂以及由pgk驱动的阴性选择白喉毒素(dta)的启动子。将这两种构建体在r1mesc中电穿孔并且在应用新霉素选择之前,允许生长2天。挑选存活5-7天的单独的菌落并使其在单独的孔中生长。5-7天后,收获菌落,将一半冷冻并且将另一半用于基因分型。通过基因组pcr进行基因分型,其中一个引物在供体质粒(attpf)内退火并且另一引物在短同源臂(rosa26-r)外退火。在针对条件构建体情况下收获的22个菌落中,7个是阳性的(左侧)。在针对组成型构建体情况下收获的27个菌落中,零个是阳性的(右侧)。可能的是cas9在mesc中引起一定水平的毒性并且出于此原因,不存在阳性克隆。为了对其进行测试,申请人将cre表达质粒引入正确靶向的条件型cas9细胞中并且在多天后在培养物中发现了极低的毒性。正确靶向的条件型cas9细胞中的cas9的减少的拷贝数(1-2个拷贝/个细胞)足以允许稳定表达和相对地没有细胞毒性。此外,此数据指示,cas9拷贝数决定毒性。电穿孔后,每个细胞都应该得到若干拷贝的cas9并且这可能是为什么在组成型cas9构建体的情况下没有发现阳性菌落。这提供了较强的证据,即利用条件型cre依赖性策略应该显示出减少的毒性。申请人将正确靶向的细胞注射进囊胚中并植入雌性小鼠体内。鉴定并回交嵌合体。对首建者小鼠进行鉴定和基因分型。条件型cas9小鼠的实用性:申请人已经在293细胞中显示,可以通过与cre共表达而激活cas9条件型表达构建体。申请人还显示,当表达cre时,正确靶向的r1mesc可以具有活性cas9。因为在cas9之后为p2a肽切割序列并且然后为egfp,申请人通过观察egfp而鉴定成功表达。这个相同的观念在于,什么使条件型cas9小鼠如此有用。申请人可以将其条件型cas9小鼠与普遍表达cre的小鼠(actb-cre系)杂交并且可以得到在每个细胞中表达cas9的小鼠。应当仅仅采用嵌合的rna的递送,以便诱导在胚胎小鼠或成年小鼠中的基因组编辑。有趣的是,如果条件型cas9小鼠与在组织特异的启动子下表达cre的小鼠杂交,在也表达cre的组织中将会仅有cas9。通过将嵌合的rna递送到相同的组织中,此途径可以用来仅仅在精确的组织中编辑基因组。实例15:cas9多样性和嵌合的rnacrispr-cas系统是一种由跨细菌和古生菌的相异物种利用的针对侵入型外源dna的获得性免疫机制。ii型crispr-cas系统由一套编码负责将外源dna“捕获”进crispr座位中的蛋白质的基因以及一套编码负责“执行”dna切割机制的蛋白质的基因组成;这些包括dna核酸酶(cas9)、非编码反式激活cr-rna(tracrrna)以及侧翼为同向重复的外源dna衍生的间隔子阵列(crrna)。当被cas9成熟后,tracrrna和crrna双链体指导cas9核酸酶到由间隔子指导序列规定的靶dna序列,并且在靶dna中介导短序列基序附近的dna中的双链断裂,该导短序列基序为切割所需并且对于每种crispr-cas系统而言是特异的。ii型crispr-cas系统发现在整个细菌界中并且在用于靶标切割的cas9蛋白序列和尺寸、tracrrna和crrna同向重复序列、这些元件的基因组组织以及基序要求方面高度相异。一个物种可以具有多种相异的crispr-cas系统。申请人评价了来自基于与已知cas9的序列同源性和与已知亚结构域直向同源的结构鉴定的细菌种类的207个假定的cas9,这些亚结构域包括hnh内切核酸酶结构域和ruvc内切核酸酶结构域[信息来自尤金库宁(eugenekoonin)和基拉马卡洛娃(kiramakarova)]。基于此套的蛋白质序列保守的系统发生分析揭示了五个cas9家族,包括三组大的cas9(~1400个氨基酸)和两组小的cas9(~1100个氨基酸)(参见图19a-d和20a-f)。申请人还已经使用体外方法优化了cas9指导rna。实例16:cas9突变在此实例中,申请人显示以下突变可以将spcas9转化为切口酶:d10a、e762a、h840a、n854a、n863a、d986a。申请人提供了显示出序列突变点位于spcas9基因内何处的序列(图24a-m)。申请人还显示,这些切口酶仍能够介导同源重组。此外,申请人显示,具有这些突变的spcas9(单独地)不诱导双链断裂。所有cas9直向同源物共享3-4个ruvc结构域和一个hnh结构域的通用结构。最5'的ruvc结构域切割非互补链,而hnh结构域切割互补链。所有符号都是就指导序列而言的。在5'ruvc结构域中的催化残基是通过感兴趣的cas9与其他cas9直向同源物(来自化脓链球菌ii型crispr座位、嗜热链球菌crispr座位1、嗜热链球菌crispr座位3以及凶手弗朗西斯菌(franciscillanovicida)ii型crispr座位)的同源性比较而鉴定的,并且保守性asp残基被突变为丙氨酸以将cas9转化成互补链切口酶。类似地,在hnh结构域中的保守性his和asn残基被突变为丙氨酸以将cas9转化为非互补链切口酶。实例17:cas9转录激活和cas9阻抑物cas9转录激活设计并测试第二代构建体(表1)。使用这些构建体通过rt-qpcr评估转录激活(vp64融合的构建体)和阻抑(仅有cas9)。申请人使用抗-his抗体评估每个构建体的细胞定位,使用surveyor核酸酶测定评估核酸酶活性,并使用凝胶迁移测定评估dna结合亲和性。cas阻抑物先前已经显示,可以将dcas9用作通用dna结合结构域,以阻抑基因表达。申请人报告了改进的dcas9设计以及至阻抑物结构域krab和sid4x的dcas9融合。从表1中的建立用于使用cas9来调制转录的质粒文库中,通过qpcr在功能上表征了以下阻抑物质粒:pxrp27、pxrp28、pxrp29、pxrp48、pxrp49、pxrp50、pxrp51、pxrp52、pxrp53、pxrp56、pxrp58、pxrp59、pxrp61以及pxrp62。将每个dcas9阻抑物质粒都与两个靶向β-连环蛋白基因的编码链的指导rna共转染。转染后72小时,分离rna并通过rt-qpcr定量基因表达。内源对照基因为gapdh。将两个验证的shrna用作阳性对照。阴性对照是某些未用grna转染的质粒,这些质粒被表示为“pxrp##对照”。当使用指定的靶向策略时,质粒pxrp28、pxrp29、pxrp48以及pxrp49可以阻抑β-连环蛋白基因。这些质粒对应于没有功能性结构域的dcas9(pxrp28和pxrp28)和融合到sid4x上的dcas9(pxrp48和pxrp49)。另外的工作研究:重复以上实验,靶向不同基因,利用其他grna确定最优靶向位置和多元阻抑。表1实例18:涉及胆固醇生物合成、脂肪酸生物合成以及其他代谢障碍的基因,编码涉及淀粉样蛋白以及其他疾病的错误折叠蛋白的基因,导致细胞转化的癌基因,潜伏病毒基因,以及导致负显性障碍(在其他障碍中)的基因的靶向缺失。申请人证明使用病毒或纳米粒子递送系统向对其有需要的受试者或患者的肝脏、脑、眼、上皮、造血或另一组织进行crispr-cas系统的基因递送,该受试者或患者罹患代谢障碍、淀粉样变性和蛋白聚积相关疾病、由于基因突变和基因转位所致的细胞转化、基因突变的负显性作用、潜伏病毒感染以及其他相关症状。研究设计:罹患代谢障碍、淀粉样变性和蛋白聚积相关疾病的对其有需要的受试者或患者,包括但不限于人类、非灵长类人类、犬、猫、牛、马、其他家养动物以及相关哺乳动物。crispr-cas系统由嵌合的指导rna指导并靶向有待切割的人类基因组座位的一个特定位点。切割和非同源末端连接介导的修复之后,移码突变导致基因的敲除。申请人选择靶向涉及上述障碍的基因的指导-rna,使其以最小脱靶活性对内源座位特异。可以将两个或更多个指导rna编码进单个crispr阵列中,以在dna中诱导同时的双链断裂,从而导致受影响的基因或染色体区域的微小缺失。基因靶标的鉴定和设计对于每个候选疾病基因,申请人都选择了包括蛋白质编码外显子的感兴趣dna序列、包括并侧翼于已知的负显性突变位点的序列、包括并侧翼于病理重复序列的序列。对于基因敲除途径,离起始密码子最近的早期编码外显子为实现完全敲除提供了最佳选择并使截短的蛋白质产物保留部分功能的可能性最小化。申请人分析了紧邻ngg基序(对于spcas9系统)或nnagaaw(对于st1cas9系统)的5’的所有可能的可靶向的20-bp序列的感兴趣的序列。申请人选择了用于在基因组中识别独特的单个rna-指导的cas9的序列,以使基于计算算法的脱靶效应最小化,以确定特异性。将指导序列克隆进递送系统中将指导序列合成为双链的20-24bp寡核苷酸。对寡核苷酸进行5’-磷酸化处理和退火以形成双链体后,取决于递送方法,将寡核苷酸连接进适合的载体中:基于病毒的递送方法已经在别处描述了基于aav的载体(px260、330、334、335)基于慢病毒的载体使用类似的克隆策略,即将指导序列直接连接进单个载体中,该载体携带一个u6启动子驱动的嵌合的rna支架和一种ef1a启动子驱动的cas9或cas9切口酶。在别处描述了病毒产生。基于纳米粒子的rna递送方法1.将指导序列合成为编码t7启动子—指导序列—嵌合的rna的寡核苷酸双链。通过pcr方法将一个t7启动子添加到cas9的5’上。2.将t7驱动的cas9和指导-嵌合的rna在体外转录,并且使用商业试剂盒为cas9mrna进一步加帽和a-添尾(a-tailed)。根据试剂盒说明书纯化rna产物。流体动力尾静脉递送方法(用于小鼠)如在上文和在本申请别处所描述的,将指导序列克隆进aav质粒中。细胞系的体外验证转染1.dna质粒转染使用基于脂质、化学或电穿孔的方法将携带指导序列的质粒转染进人类胚肾(hek293t)或人类胚胎干(hes)细胞、其他相关细胞类型中。对于hek293t细胞(~260,000个细胞)的24孔转染,使用lipofectamine2000将总共500ng的dna转染进每个单孔中。对于hes细胞的12孔转染,使用fugenehd将总共1ug的dna转染进单孔中。2.rna转染将如上所述的纯化rna用于转染进hek293t细胞中。根据制造商的说明,可以使用lipofectamine2000将1-2ug的rna转染进~260,000个细胞中。cas9和嵌合的rna的rna递送显示于图28中。体外插入缺失形成的测定转染后72小时收获细胞并且测定作为双链断裂的指征的插入缺失形成。简言之,使用高保真聚合酶pcr扩增靶序列周围的基因组区域(~400-600bp扩增子尺寸)。将产物纯化,标准化至相等浓度,并从95℃缓慢退火至4℃,以允许形成dna异源双链体。退火后,使用cel-i酶切割异源双链体,并且将生成的产物在聚丙烯酰胺凝胶上分离并计算插入缺失效率。动物的体内原理论证递送机制在别处描述了aav或慢病毒产生。纳米粒子配制品:将rna混合进纳米粒子配制品中使用商业试剂盒在小鼠中执行dna质粒的流体动力尾静脉注射。将cas9和指导序列作为病毒、纳米粒子-包衣的rna混合物或dna质粒而递送,并注射进受试动物体内。一个平行组的对照动物注射无菌盐水、cas9和gfp或指导序列以及单独的gfp。注射后三周,测试动物的症状的改善并将其处死。针对插入缺失形分析相关器官系统。表型测定包括hdl、ldl、脂质的血液水平。插入缺失形成的测定使用商业试剂盒从组织中提取dna;将如针对体外证明所描述的进行插入缺失测定。crispr-cas系统的治疗应用可适合于实现候选疾病基因的组织特异的且暂时受控的靶向缺失。实例包括涉及胆固醇和脂肪酸代谢、淀粉样蛋白疾病、负显性疾病、潜伏病毒感染(在其他障碍中)的基因。用于在座位位处引入靶向的插入缺失的单个指导-rna的实例用于在基因座位位处引入染色体微小缺失的指导-rna对的实例实例19:携带引起疾病的突变的基因的修复的靶向整合;酶缺陷以及其他相关疾病的重构。研究设计i.基因靶标的鉴定和设计·描述于实例22中ii.将指导序列和修复模板克隆进递送系统中·以上描述于实例22中·申请人将dna修复模板克隆为包括具有疾病等位基因的同源臂以及一个野生型修复模板iii.细胞系的体外验证a.以上转染描述于实例22中;将cas9、指导rna和修复模板共转染进相关细胞类型中。b.体外修复的测定i.申请人在转染后72小时收获细胞并测定修复ii.简言之,申请人使用高保真聚合酶pcr扩增了修复模板周围的基因组区域。针对突变体等位基因的减少的发生率,申请人对产物进行了测序。iv.动物的体内原理论证a.以上递送机制描述于实例22和34中。b.体内修复的测定i.如描述于体外证明中的,申请人进行了修复测定。v.治疗应用crispr-cas系统可适合于实现候选疾病基因的组织特异的且暂时受控的靶向缺失。实例包括涉及胆固醇和脂肪酸代谢、淀粉样蛋白疾病、负显性疾病、潜伏病毒感染(在其他障碍中)的基因。修复模板的一个单个错义突变的实例:v30m等位基因cctgccatcaatgtggccatgcatgtgttcagaaaggctwt等位基因cctgccatcaatgtggccgtgcatgtgttcagaaaggct实例20:crispr-cas系统在青光眼、淀粉样变性和亨廷顿病中的治疗应用青光眼:申请人设计了靶向mycilin(myoc)基因的第一个外显子的指导rna。申请人使用腺病毒载体(ad5)包装cas9以及靶向myoc基因的指导rna两者。申请人将腺病毒载体注射进小梁网中,其中的细胞已经牵涉于青光眼的病理生理学中。申请人最初在携带突变的myoc基因的小鼠模型中对其进行了测试,以察看它们是否改善视敏度并降低眼压。人类中的治疗应用利用类似的策略。淀粉样变性:申请人设计了靶向肝脏中的运甲状腺素蛋白(ttr)基因的第一个外显子的指导rna。申请人使用aav8包装cas9以及靶向ttr基因的第一个外显子的指导rna。aav8已经显示具有有效的肝脏靶向并且将被静脉内给予。可以使用肝脏特异的启动子(如白蛋白启动子)或使用组成型启动子驱动cas9。pol3启动子驱动指导rna。可替代地,申请人利用质粒dna的流体动力递送来敲除ttr基因。申请人递送了一个编码cas9的质粒和靶向ttr的外显子1的指导rna。作为一种另外的替代途径,申请人给予了rna的组合(cas9的mrna和指导rna)。可以使用脂质体(如来自生命技术公司的invivofectamine)包装rna并静脉内递送。为了减少rna诱导的免疫原性、增加cas9表达的水平和指导rna稳定性,申请人使用5’加帽修饰了cas9mrna。申请人还将修饰的rna核苷酸掺入了cas9mrna和指导rna中,以增加其稳定性并减少免疫原性(例如tlr的激活)。为了增加效率,申请人给予了多剂量的病毒、dna或rna。亨廷顿病:申请人基于患者的htt基因中的等位基因特异的突变设计了指导rna。例如,在对htt而言杂合的、具有扩增的cag重复的患者体内,申请人鉴定了对于突变htt等位基因而言独特的的核苷酸序列并将其用于设计指导rna。申请人保证突变甲基位于指导rna的最后9bp内(诸位申请人已经确定具有区别靶标尺寸与指导rna之间的单个dna碱基错配的能力)。申请人将突变htt等位基因特异的指导rna和cas9包装进aav9中并递送进亨廷顿病患者的纹状体中。经由开颅术将病毒立体定向地注射进纹状体中。已知aav9有效地转导神经元。申请人使用神经元特异的启动子(如人类突触蛋白i)驱动cas9。实例21:crispr-cas系统在hiv中的治疗应用慢性病毒感染是显著的发病率和死亡率的来源。虽然针对这些病毒中的许多病毒存在有效靶向病毒复制的不同方面的常规的抗病毒疗法,但是由于“病毒潜伏期”当前治疗形式在本质上通常是非治愈性的。就其本质而言,病毒潜伏期由病毒生命周期中的未进行活性病毒产生的休眠期表征。在此阶段过程中,病毒在很大程度上能够逃避免疫监视和常规治疗两者,从而允许它在宿主体内建立长期存在的病毒储库,从这些病毒储库随后重新激活可以允许病毒继续繁殖和传播。病毒潜伏期的关键在于通过游离型或前病毒潜伏而完成的稳定地维持病毒基因组,该游离型或前病毒潜伏分别将病毒基因组存储在细胞质中或将它整合在宿主基因组中。在不存在预防初次感染的有效疫苗接种的情况下,由潜伏贮存器表征的慢性病毒感染和溶解活性的发作可以具有显著的后果:人乳头瘤病毒(hpv)可以导致宫颈癌,丙型肝炎病毒(hcv)容易诱发肝细胞癌,并且人类免疫缺陷病毒最终摧毁宿主免疫系统,从而使得对机会性感染易感。因此,这些感染需要终生使用当前可获得的抗病毒治疗。更复杂的事情是这些病毒基因组中的许多的较高的可突变性,这导致了对其而言不存在有效疗法的抗性菌株的进化。crispr-cas系统是一种能够以可以多元的、序列特异的方式诱导双链dna断裂(dsb)的细菌获得性免疫系统并且最近已经在哺乳动物细胞系统内重构。已经显示,用一个或众多指导-rna靶向dna可以分别导致间插序列的插入缺失和缺失两者。因此,这一新的技术代表了一种手段,通过该手段可以在单个细胞中以较高效率和特异性完成靶向和多元dna诱变。结果,递送直接针对病毒dna序列的crispr-cas系统甚至在不存在正在进行的病毒产生的情况下仍可以允许靶向破坏和缺失潜伏的病毒基因组。作为一个实例,被hiv-1慢性感染代表了一个全球性健康问题,其中影响的个人为3300万并且年发生率为260万次感染。使用同时靶向病毒复制的多个方面的高效抗逆转录病毒疗法(haart)已经允许在很大程度上将hiv感染作为一种慢性而非晚期病疾进行管理。不进行治疗的话,hiv进展为aids通常在9-10年内发生,从而导致耗竭宿主免疫系统并且机会性感染的出现通常将在之后不久导致死亡。继发于病毒潜伏期,haart的中断总是导致病毒反跳。此外,针对通过可获得的手段无法控制的hiv抗性菌株,甚至可以在疗法方面选择暂时中断。另外,haart治疗的费用是显著的:在美国每年每人$10,000-15,0000。因此,直接靶向hiv基因组而非病毒复制过程的治疗途径代表了一种手段,通过该手段潜伏的贮存器的根除可以允许治愈性治疗选择。hiv-1靶向的crispr-cas系统的研发和递送代表了一种可与现存的靶向dna诱变的手段可区分的独特途径,即具有众多治疗意义的zfn和talen。crispr介导的dsb对hiv-1基因组的靶向破坏和缺失以及与haart结合的插入缺失可以允许同时预防活性病毒产生以及宿主体内的潜伏的病毒储库的耗竭。一旦整合进宿主免疫系统内,crispr-cas系统允许产生hiv-1抗性亚群体,该亚群体即使在不存在彻底的病毒根除的情况下仍可以允许维持和重构宿主免疫活性。这可以通过破坏病毒基因组而潜在地预防初次感染,从而预防病毒产生和整合,代表了一种“疫苗接种”手段。crispr-cas系统的多元性质允许同时靶向单独细胞内的基因组的多个方面。如在haart中,通过需要同时获取多个获得性突变而使病毒通过诱变而进行的逃避最小化。可以同时靶向hiv-1的多种菌株,这使重复感染的机会最小化并防止随后产生新的重组菌株。核苷酸而非蛋白质介导的crispr-cas系统的序列特异性允许快速产生治疗而无需显著改变递送机制。为了将其完成,申请人产生了靶向绝大多数hiv-1基因组的crispr-cas指导rna,同时考虑了hiv-1株变体,以使覆盖面和效力最大。hiv-1亚型和变体之间的基因组保守的序列分析应该允许靶向基因组的侧翼保守区,目的是缺失间插病毒序列或诱导将破坏病毒基因功能的移码突变。通过宿主免疫系统的常规腺病毒或慢病毒介导的感染,申请人完成了crispr-cas系统的递送。取决于途径,宿主免疫细胞可以是a)分离的、用crispr-cas转导的、选择的、并且重新引入该宿主中的或b)通过全身递送crispr-cas系统体内转导的。第一种途径允许产生抗性免疫群体,而第二种更可能靶向宿主体内的潜伏病毒储库。实例22:囊性纤维化中的δf508或其他突变的靶向修正本发明的一个方面提供了一种药物组合物,该药物组合物可以包括一种crispr-cas基因疗法粒子和一种生物相容的药物载体。根据另一个方面,一种用于治疗在cftr基因中具有突变的受试者的基因疗法方法包括向受试者的细胞给予治疗有效量的crispr-cas基因疗法粒子。此实例展示了使用腺相关病毒(aav)粒子的crispr-cas系统在对其有需要的受试者或患者的气道中的基因转移或基因递送,所述受试者或患者患有囊性纤维化或囊性纤维化相关症状。研究设计:对其有需要的受试者或患者:相关的人类、非灵长类人类、犬、猫、牛、马以及其他家养动物。此研究测试了通过aav载体对crispr-cas系统进行基因转移的效力。申请人确定了足以进行基因表达的转基因水平并利用了一种包括靶向δf508或其他cftr诱导的突变的cas9酶的crispr-cas系统。这些经治疗的受试者的每一侧肺接受支气管内递送的药学上有效量的雾化aav载体系统,同时自然地呼吸。对照受试者接受等量的具有内部对照基因的假型aav载体系统。该载体系统可以与一种药学上可接受的生物或相容的药物载体一起递送。给予载体三周或适当的时间间期后,测试经治疗的受试者的囊性纤维化相关症状的改善。申请人使用了一种腺病毒或一种aav粒子。申请人将以下各自可操作地连接到一种或多种调节序列(对于cas9而言是cbh或ef1a启动子,对于嵌合的指导rna是u6或h1启动子)上的基因构建体克隆进一种或多种腺病毒或aav载体或任何其他相容的载体中:靶向嵌合的指导rna的cftrδ508(图31b),δf508突变的修复模板(图31c)以及具有任选地一个或多个核定位信号或序列(nls)(例如,两个(2)nls)的密码子优化的cas9酶。cas9靶位点的鉴定申请人分析了人类cftr基因组座位并鉴定了cas9靶位点(图31a)。(pam可以包含一个ngg或一个nnagaaw基序)。基因修复策略申请人经由先前讨论的递送方法之一将包括cas9(或cas9切口酶)和指导rna的腺病毒/aav载体系统连同包括包含f508残基的同源性修复模板的腺病毒/aav载体系统一起引入受试者体内。crispr-cas系统由cftrδ508嵌合的指导rna指导并靶向有待切口或切割的cftr基因组座位的一个特定位点。在切割之后,将修复模板经由同源重组插入切割位点中,从而修正导致囊性纤维化或引起囊性纤维化相关症状的缺失。可以采用用来指导递送并提供crispr系统的系统性引入的此策略来靶向基因突变,以编辑或另外地操纵如那些在表b中的引起代谢、肝脏、肾和蛋白质疾病和障碍的基因。实例23:基因敲除细胞文库的产生此实例展示了如何产生其中的每个细胞都具有单基因被敲除的细胞文库:申请人制备了es细胞的文库,其中每个细胞都具有单基因被敲除,并且es细胞的整个文库将有每个单基因的敲除。此文库对于筛选细胞过程以及疾病的基因功能是有用的。为了制备此细胞文库,申请人将由诱导型启动子(例如,多西环素诱导型启动子)驱动的cas9整合到es细胞中。另外,申请人将靶向特异的基因的单个指导rna整合到es细胞中。为了制备es细胞文库,申请人简单地将es细胞与编码靶向人类基因组中的每个基因的指导rna的基因的文库混合。申请人首先将单个bxb1attb位点引入人类es细胞的aavs1座位中。然后,申请人使用bxb1整合酶来促进各个的指导rna基因整合到aavs1座位中的bxb1attb位点中。为了促进整合,每个指导rna基因都被包含在携带单个attp位点的质粒上。这样,bxb1将使基因组中的attb位点与含有指导rna的质粒上的attp位点重组。为了产生该细胞文库,申请人采用具有整合的单个指导rna的细胞的文库,并且诱导cas9表达。在诱导之后,cas9介导由该指导rna指定的位点处的双链断裂。为了验证此细胞文库的多样性,申请人进行了全外显子组测序,以保证申请人能够在每个单靶向基因中观察到突变。此细胞文库可以用于多种应用(包括基于全文库的筛选),或可以被分选进各个细胞克隆中以促进快速产生具有各个人类基因被敲除的克隆细胞系。实例24:使用cas9工程化微藻递送cas9的方法方法1:申请人使用在组成型启动子(如hsp70a-rbcs2或β2-微管蛋白)的控制之下表达cas9的载体递送cas9和指导rna。方法2:申请人使用在组成型启动子(如hsp70a-rbcs2或β2-微管蛋白)的控制之下表达cas9和t7聚合酶的载体递送cas9和t7聚合酶。将使用包含驱动指导rna的t7启动子的载体递送该指导rna。方法3:申请人将cas9mrna和体外转录的指导rna递送到藻类细胞中。rna可以在体外转录。cas9mrna将由cas9的编码区以及来自的cop1的3’utr组成,以保证cas9mrna的稳定。用于同源重组,申请人提供了一个另外的同源定向修复模板。在位于cop1的3’utr之后的β-2微管蛋白启动子的控制之下驱动cas9的表达的盒的序列。tctttcttgcgctatgacacttccagcaaaaggtagggcgggctgcgagacggcttcccggcgctgcatgcaacaccgatgatgcttcgaccccccgaagctccttcggggctgcatgggcgctccgatgccgctccagggcgagcgctgtttaaatagccaggcccccgattgcaaagacattatagcgagctaccaaagccatattcaaacacctagatcactaccacttctacacaggccactcgagcttgtgatcgcactccgctaagggggcgcctcttcctcttcgtttcagtcacaacccgcaaacatgtacccatacgatgttccagattacgcttcgccgaagaaaaagcgcaaggtcgaagcgtccgacaagaagtacagcatcggcctggacatcggcaccaactctgtgggctgggccgtgatcaccgacgagtacaaggtgcccagcaagaaattcaaggtgctgggcaacaccgaccggcacagcatcaagaagaacctgatcggagccctgctgttcgacagcggcgaaacagccgaggccacccggctgaagagaaccgccagaagaagatacaccagacggaagaaccggatctgctatctgcaagagatcttcagcaacgagatggccaaggtggacgacagcttcttccacagactggaagagtccttcctggtggaagaggataagaagcacgagcggcaccccatcttcggcaacatcgtggacgaggtggcctaccacgagaagtaccccaccatctaccacctgagaaagaaactggtggacagcaccgacaaggccgacctgcggctgatctatctggccctggcccacatgatcaagttccggggccacttcctgatcgagggcgacctgaaccccgacaacagcgacgtggacaagctgttcatccagctggtgcagacctacaaccagctgttcgaggaaaaccccatcaacgccagcggcgtggacgccaaggccatcctgtctgccagactgagcaagagcagacggctggaaaatctgatcgcccagctgcccggcgagaagaagaatggcctgttcggcaacctgattgccctgagcctgggcctgacccccaacttcaagagcaacttcgacctggccgaggatgccaaactgcagctgagcaaggacacctacgacgacgacctggacaacctgctggcccagatcggcgaccagtacgccgacctgtttctggccgccaagaacctgtccgacgccatcctgctgagcgacatcctgagagtgaacaccgagatcaccaaggcccccctgagcgcctctatgatcaagagatacgacgagcaccaccaggacctgaccctgctgaaagctctcgtgcggcagcagctgcctgagaagtacaaagagattttcttcgaccagagcaagaacggctacgccggctacattgacggcggagccagccaggaagagttctacaagttcatcaagcccatcctggaaaagatggacggcaccgaggaactgctcgtgaagctgaacagagaggacctgctgcggaagcagcggaccttcgacaacggcagcatcccccaccagatccacctgggagagctgcacgccattctgcggcggcaggaagatttttacccattcctgaaggacaaccgggaaaagatcgagaagatcctgaccttccgcatcccctactacgtgggccctctggccaggggaaacagcagattcgcctggatgaccagaaagagcgaggaaaccatcaccccctggaacttcgaggaagtggtggacaagggcgcttccgcccagagcttcatcgagcggatgaccaacttcgataagaacctgcccaacgagaaggtgctgcccaagcacagcctgctgtacgagtacttcaccgtgtataacgagctgaccaaagtgaaatacgtgaccgagggaatgagaaagcccgccttcctgagcggcgagcagaaaaaggccatcgtggacctgctgttcaagaccaaccggaaagtgaccgtgaagcagctgaaagaggactacttcaagaaaatcgagtgcttcgactccgtggaaatctccggcgtggaagatcggttcaacgcctccctgggcacataccacgatctgctgaaaattatcaaggacaaggacttcctggacaatgaggaaaacgaggacattctggaagatatcgtgctgaccctgacactgtttgaggacagagagatgatcgaggaacggctgaaaacctatgcccacctgttcgacgacaaagtgatgaagcagctgaagcggcggagatacaccggctggggcaggctgagccggaagctgatcaacggcatccgggacaagcagtccggcaagacaatcctggatttcctgaagtccgacggcttcgccaacagaaacttcatgcagctgatccacgacgacagcctgacctttaaagaggacatccagaaagcccaggtgtccggccagggcgatagcctgcacgagcacattgccaatctggccggcagccccgccattaagaagggcatcctgcagacagtgaaggtggtggacgagctcgtgaaagtgatgggccggcacaagcccgagaacatcgtgatcgaaatggccagagagaaccagaccacccagaagggacagaagaacagccgcgagagaatgaagcggatcgaagagggcatcaaagagctgggcagccagatcctgaaagaacaccccgtggaaaacacccagctgcagaacgagaagctgtacctgtactacctgcagaatgggcgggatatgtacgtggaccaggaactggacatcaaccggctgtccgactacgatgtggaccatatcgtgcctcagagctttctgaaggacgactccatcgacaacaaggtgctgaccagaagcgacaagaaccggggcaagagcgacaacgtgccctccgaagaggtcgtgaagaagatgaagaactactggcggcagctgctgaacgccaagctgattacccagagaaagttcgacaatctgaccaaggccgagagaggcggcctgagcgaactggataaggccggcttcatcaagagacagctggtggaaacccggcagatcacaaagcacgtggcacagatcctggactcccggatgaacactaagtacgacgagaatgacaagctgatccgggaagtgaaagtgatcaccctgaagtccaagctggtgtccgatttccggaaggatttccagttttacaaagtgcgcgagatcaacaactaccaccacgcccacgacgcctacctgaacgccgtcgtgggaaccgccctgatcaaaaagtaccctaagctggaaagcgagttcgtgtacggcgactacaaggtgtacgacgtgcggaagatgatcgccaagagcgagcaggaaatcggcaaggctaccgccaagtacttcttctacagcaacatcatgaactttttcaagaccgagattaccctggccaacggcgagatccggaagcggcctctgatcgagacaaacggcgaaaccggggagatcgtgtgggataagggccgggattttgccaccgtgcggaaagtgctgagcatgccccaagtgaatatcgtgaaaaagaccgaggtgcagacaggcggcttcagcaaagagtctatcctgcccaagaggaacagcgataagctgatcgccagaaagaaggactgggaccctaagaagtacggcggcttcgacagccccaccgtggcctattctgtgctggtggtggccaaagtggaaaagggcaagtccaagaaactgaagagtgtgaaagagctgctggggatcaccatcatggaaagaagcagcttcgagaagaatcccatcgactttctggaagccaagggctacaaagaagtgaaaaaggacctgatcatcaagctgcctaagtactccctgttcgagctggaaaacggccggaagagaatgctggcctctgccggcgaactgcagaagggaaacgaactggccctgccctccaaatatgtgaacttcctgtacctggccagccactatgagaagctgaagggctcccccgaggataatgagcagaaacagctgtttgtggaacagcacaagcactacctggacgagatcatcgagcagatcagcgagttctccaagagagtgatcctggccgacgctaatctggacaaagtgctgtccgcctacaacaagcaccgggataagcccatcagagagcaggccgagaatatcatccacctgtttaccctgaccaatctgggagcccctgccgccttcaagtactttgacaccaccatcgaccggaagaggtacaccagcaccaaagaggtgctggacgccaccctgatccaccagagcatcaccggcctgtacgagacacggatcgacctgtctcagctgggaggcgacagccccaagaagaagagaaaggtggaggccagctaaggatccggcaagactggccccgcttggcaacgcaacagtgagcccctccctagtgtgtttggggatgtgactatgtattcgtgtgttggccaacgggtcaacccgaacagattgatacccgccttggcatttcctgtcagaatgtaacgtcagttgatggtact在位于cop1的3’utr之后的β-2微管蛋白启动子的控制之下驱动t7聚合酶的表达的盒的序列:tctttcttgcgctatgacacttccagcaaaaggtagggcgggctgcgagacggcttcccggcgctgcatgcaacaccgatgatgcttcgaccccccgaagctccttcggggctgcatgggcgctccgatgccgctccagggcgagcgctgtttaaatagccaggcccccgattgcaaagacattatagcgagctaccaaagccatattcaaacacctagatcactaccacttctacacaggccactcgagcttgtgatcgcactccgctaagggggcgcctcttcctcttcgtttcagtcacaacccgcaaacatgcctaagaagaagaggaaggttaacacgattaacatcgctaagaacgacttctctgacatcgaactggctgctatcccgttcaacactctggctgaccattacggtgagcgtttagctcgcgaacagttggcccttgagcatgagtcttacgagatgggtgaagcacgcttccgcaagatgtttgagcgtcaacttaaagctggtgaggttgcggataacgctgccgccaagcctctcatcactaccctactccctaagatgattgcacgcatcaacgactggtttgaggaagtgaaagctaagcgcggcaagcgcccgacagccttccagttcctgcaagaaatcaagccggaagccgtagcgtacatcaccattaagaccactctggcttgcctaaccagtgctgacaatacaaccgttcaggctgtagcaagcgcaatcggtcgggccattgaggacgaggctcgcttcggtcgtatccgtgaccttgaagctaagcacttcaagaaaaacgttgaggaacaactcaacaagcgcgtagggcacgtctacaagaaagcatttatgcaagttgtcgaggctgacatgctctctaagggtctactcggtggcgaggcgtggtcttcgtggcataaggaagactctattcatgtaggagtacgctgcatcgagatgctcattgagtcaaccggaatggttagcttacaccgccaaaatgctggcgtagtaggtcaagactctgagactatcgaactcgcacctgaatacgctgaggctatcgcaacccgtgcaggtgcgctggctggcatctctccgatgttccaaccttgcgtagttcctcctaagccgtggactggcattactggtggtggctattgggctaacggtcgtcgtcctctggcgctggtgcgtactcacagtaagaaagcactgatgcgctacgaagacgtttacatgcctgaggtgtacaaagcgattaacattgcgcaaaacaccgcatggaaaatcaacaagaaagtcctagcggtcgccaacgtaatcaccaagtggaagcattgtccggtcgaggacatccctgcgattgagcgtgaagaactcccgatgaaaccggaagacatcgacatgaatcctgaggctctcaccgcgtggaaacgtgctgccgctgctgtgtaccgcaaggacaaggctcgcaagtctcgccgtatcagccttgagttcatgcttgagcaagccaataagtttgctaaccataaggccatctggttcccttacaacatggactggcgcggtcgtgtttacgctgtgtcaatgttcaacccgcaaggtaacgatatgaccaaaggactgcttacgctggcgaaaggtaaaccaatcggtaaggaaggttactactggctgaaaatccacggtgcaaactgtgcgggtgtcgacaaggttccgttccctgagcgcatcaagttcattgaggaaaaccacgagaacatcatggcttgcgctaagtctccactggagaacacttggtgggctgagcaagattctccgttctgcttccttgcgttctgctttgagtacgctggggtacagcaccacggcctgagctataactgctcccttccgctggcgtttgacgggtcttgctctggcatccagcacttctccgcgatgctccgagatgaggtaggtggtcgcgcggttaacttgcttcctagtgaaaccgttcaggacatctacgggattgttgctaagaaagtcaacgagattctacaagcagacgcaatcaatgggaccgataacgaagtagttaccgtgaccgatgagaacactggtgaaatctctgagaaagtcaagctgggcactaaggcactggctggtcaatggctggcttacggtgttactcgcagtgtgactaagcgttcagtcatgacgctggcttacgggtccaaagagttcggcttccgtcaacaagtgctggaagataccattcagccagctattgattccggcaagggtctgatgttcactcagccgaatcaggctgctggatacatggctaagctgatttgggaatctgtgagcgtgacggtggtagctgcggttgaagcaatgaactggcttaagtctgctgctaagctgctggctgctgaggtcaaagataagaagactggagagattcttcgcaagcgttgcgctgtgcattgggtaactcctgatggtttccctgtgtggcaggaatacaagaagcctattcagacgcgcttgaacctgatgttcctcggtcagttccgcttacagcctaccattaacaccaacaaagatagcgagattgatgcacacaaacaggagtctggtatcgctcctaactttgtacacagccaagacggtagccaccttcgtaagactgtagtgtgggcacacgagaagtacggaatcgaatcttttgcactgattcacgactccttcggtacgattccggctgacgctgcgaacctgttcaaagcagtgcgcgaaactatggttgacacatatgagtcttgtgatgtactggctgatttctacgaccagttcgctgaccagttgcacgagtctcaattggacaaaatgccagcacttccggctaaaggtaacttgaacctccgtgacatcttagagtcggacttcgcgttcgcgtaaggatccggcaagactggccccgcttggcaacgcaacagtgagcccctccctagtgtgtttggggatgtgactatgtattcgtgtgttggccaacgggtcaacccgaacagattgatacccgccttggcatttcctgtcagaatgtaacgtcagttgatggtact由t7启动子驱动的指导rna的序列(t7启动子,n表示靶向序列):gaaattaatacgactcactatannnnnnnnnnnnnnnnnnnngttttagagctagaaatagcaagttaaaataaggctagtccgttatcaacttgaaaaagtggcaccgagtcggtgcttttttt基因递送:来自衣藻资源中心(chlamydomonasresourcecenter)的莱茵衣藻株cc-124和cc-125将被用于电穿孔。电穿孔方案遵循来自geneartchlamydomonasengineering试剂盒的标准推荐方案。而且,申请人产生组成性地表达cas9的莱茵衣藻系。这可以通过使用pchlamy1(使用pvui线性化)并选择潮霉素抗性菌落而完成。以下是包含cas9的pchlamy1的序列。以此方式实现基因敲除,简单地需要递送指导rna的rna。对于同源重组,申请人递送了指导rna以及线性化同源重组模板。pchlamy1-cas9:tgcggtatttcacaccgcatcaggtggcacttttcggggaaatgtgcgcggaacccctatttgtttatttttctaaatacattcaaatatgtatccgctcatgagattatcaaaaaggatcttcacctagatccttttaaattaaaaatgaagttttaaatcaatctaaagtatatatgagtaaacttggtctgacagttaccaatgcttaatcagtgaggcacctatctcagcgatctgtctatttcgttcatccatagttgcctgactccccgtcgtgtagataactacgatacgggagggcttaccatctggccccagtgctgcaatgataccgcgagacccacgctcaccggctccagatttatcagcaataaaccagccagccggaagggccgagcgcagaagtggtcctgcaactttatccgcctccatccagtctattaattgttgccgggaagctagagtaagtagttcgccagttaatagtttgcgcaacgttgttgccattgctacaggcatcgtggtgtcacgctcgtcgtttggtatggcttcattcagctccggttcccaacgatcaaggcgagttacatgatcccccatgttgtgcaaaaaagcggttagctccttcggtcctccgatcgttgtcagaagtaagttggccgcagtgttatcactcatggttatggcagcactgcataattctcttactgtcatgccatccgtaagatgcttttctgtgactggtgagtactcaaccaagtcattctgagaatagtgtatgcggcgaccgagttgctcttgcccggcgtcaatacgggataataccgcgccacatagcagaactttaaaagtgctcatcattggaaaacgttcttcggggcgaaaactctcaaggatcttaccgctgttgagatccagttcgatgtaacccactcgtgcacccaactgatcttcagcatcttttactttcaccagcgtttctgggtgagcaaaaacaggaaggcaaaatgccgcaaaaaagggaataagggcgacacggaaatgttgaatactcatactcttcctttttcaatattattgaagcatttatcagggttattgtctcatgaccaaaatcccttaacgtgagttttcgttccactgagcgtcagaccccgtagaaaagatcaaaggatcttcttgagatcctttttttctgcgcgtaatctgctgcttgcaaacaaaaaaaccaccgctaccagcggtggtttgtttgccggatcaagagctaccaactctttttccgaaggtaactggcttcagcagagcgcagataccaaatactgttcttctagtgtagccgtagttaggccaccacttcaagaactctgtagcaccgcctacatacctcgctctgctaatcctgttaccagtggctgttgccagtggcgataagtcgtgtcttaccgggttggactcaagacgatagttaccggataaggcgcagcggtcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgacctacaccgaactgagatacctacagcgtgagctatgagaaagcgccacgcttcccgaagggagaaaggcggacaggtatccggtaagcggcagggtcggaacaggagagcgcacgagggagcttccagggggaaacgcctggtatctttatagtcctgtcgggtttcgccacctctgacttgagcgtcgatttttgtgatgctcgtcaggggggcggagcctatggaaaaacgccagcaacgcggcctttttacggttcctggccttttgctggccttttgctcacatgttctttcctgcgttatcccctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccgcagccgaacgaccgagcgcagcgagtcagtgagcgaggaagcggtcgctgaggcttgacatgattggtgcgtatgtttgtatgaagctacaggactgatttggcgggctatgagggcgggggaagctctggaagggccgcgatggggcgcgcggcgtccagaaggcgccatacggcccgctggcggcacccatccggtataaaagcccgcgaccccgaacggtgacctccactttcagcgacaaacgagcacttatacatacgcgactattctgccgctatacataaccactcagctagcttaagatcccatcaagcttgcatgccgggcgcgccagaaggagcgcagccaaaccaggatgatgtttgatggggtatttgagcacttgcaacccttatccggaagccccctggcccacaaaggctaggcgccaatgcaagcagttcgcatgcagcccctggagcggtgccctcctgataaaccggccagggggcctatgttctttacttttttacaagagaagtcactcaacatcttaaaatggccaggtgagtcgacgagcaagcccggcggatcaggcagcgtgcttgcagatttgacttgcaacgcccgcattgtgtcgacgaaggcttttggctcctctgtcgctgtctcaagcagcatctaaccctgcgtcgccgtttccatttgcaggagattcgaggtaccatgtacccatacgatgttccagattacgcttcgccgaagaaaaagcgcaaggtcgaagcgtccgacaagaagtacagcatcggcctggacatcggcaccaactctgtgggctgggccgtgatcaccgacgagtacaaggtgcccagcaagaaattcaaggtgctgggcaacaccgaccggcacagcatcaagaagaacctgatcggagccctgctgttcgacagcggcgaaacagccgaggccacccggctgaagagaaccgccagaagaagatacaccagacggaagaaccggatctgctatctgcaagagatcttcagcaacgagatggccaaggtggacgacagcttcttccacagactggaagagtccttcctggtggaagaggataagaagcacgagcggcaccccatcttcggcaacatcgtggacgaggtggcctaccacgagaagtaccccaccatctaccacctgagaaagaaactggtggacagcaccgacaaggccgacctgcggctgatctatctggccctggcccacatgatcaagttccggggccacttcctgatcgagggcgacctgaaccccgacaacagcgacgtggacaagctgttcatccagctggtgcagacctacaaccagctgttcgaggaaaaccccatcaacgccagcggcgtggacgccaaggccatcctgtctgccagactgagcaagagcagacggctggaaaatctgatcgcccagctgcccggcgagaagaagaatggcctgttcggcaacctgattgccctgagcctgggcctgacccccaacttcaagagcaacttcgacctggccgaggatgccaaactgcagctgagcaaggacacctacgacgacgacctggacaacctgctggcccagatcggcgaccagtacgccgacctgtttctggccgccaagaacctgtccgacgccatcctgctgagcgacatcctgagagtgaacaccgagatcaccaaggcccccctgagcgcctctatgatcaagagatacgacgagcaccaccaggacctgaccctgctgaaagctctcgtgcggcagcagctgcctgagaagtacaaagagattttcttcgaccagagcaagaacggctacgccggctacattgacggcggagccagccaggaagagttctacaagttcatcaagcccatcctggaaaagatggacggcaccgaggaactgctcgtgaagctgaacagagaggacctgctgcggaagcagcggaccttcgacaacggcagcatcccccaccagatccacctgggagagctgcacgccattctgcggcggcaggaagatttttacccattcctgaaggacaaccgggaaaagatcgagaagatcctgaccttccgcatcccctactacgtgggccctctggccaggggaaacagcagattcgcctggatgaccagaaagagcgaggaaaccatcaccccctggaacttcgaggaagtggtggacaagggcgcttccgcccagagcttcatcgagcggatgaccaacttcgataagaacctgcccaacgagaaggtgctgcccaagcacagcctgctgtacgagtacttcaccgtgtataacgagctgaccaaagtgaaatacgtgaccgagggaatgagaaagcccgccttcctgagcggcgagcagaaaaaggccatcgtggacctgctgttcaagaccaaccggaaagtgaccgtgaagcagctgaaagaggactacttcaagaaaatcgagtgcttcgactccgtggaaatctccggcgtggaagatcggttcaacgcctccctgggcacataccacgatctgctgaaaattatcaaggacaaggacttcctggacaatgaggaaaacgaggacattctggaagatatcgtgctgaccctgacactgtttgaggacagagagatgatcgaggaacggctgaaaacctatgcccacctgttcgacgacaaagtgatgaagcagctgaagcggcggagatacaccggctggggcaggctgagccggaagctgatcaacggcatccgggacaagcagtccggcaagacaatcctggatttcctgaagtccgacggcttcgccaacagaaacttcatgcagctgatccacgacgacagcctgacctttaaagaggacatccagaaagcccaggtgtccggccagggcgatagcctgcacgagcacattgccaatctggccggcagccccgccattaagaagggcatcctgcagacagtgaaggtggtggacgagctcgtgaaagtgatgggccggcacaagcccgagaacatcgtgatcgaaatggccagagagaaccagaccacccagaagggacagaagaacagccgcgagagaatgaagcggatcgaagagggcatcaaagagctgggcagccagatcctgaaagaacaccccgtggaaaacacccagctgcagaacgagaagctgtacctgtactacctgcagaatgggcgggatatgtacgtggaccaggaactggacatcaaccggctgtccgactacgatgtggaccatatcgtgcctcagagctttctgaaggacgactccatcgacaacaaggtgctgaccagaagcgacaagaaccggggcaagagcgacaacgtgccctccgaagaggtcgtgaagaagatgaagaactactggcggcagctgctgaacgccaagctgattacccagagaaagttcgacaatctgaccaaggccgagagaggcggcctgagcgaactggataaggccggcttcatcaagagacagctggtggaaacccggcagatcacaaagcacgtggcacagatcctggactcccggatgaacactaagtacgacgagaatgacaagctgatccgggaagtgaaagtgatcaccctgaagtccaagctggtgtccgatttccggaaggatttccagttttacaaagtgcgcgagatcaacaactaccaccacgcccacgacgcctacctgaacgccgtcgtgggaaccgccctgatcaaaaagtaccctaagctggaaagcgagttcgtgtacggcgactacaaggtgtacgacgtgcggaagatgatcgccaagagcgagcaggaaatcggcaaggctaccgccaagtacttcttctacagcaacatcatgaactttttcaagaccgagattaccctggccaacggcgagatccggaagcggcctctgatcgagacaaacggcgaaaccggggagatcgtgtgggataagggccgggattttgccaccgtgcggaaagtgctgagcatgccccaagtgaatatcgtgaaaaagaccgaggtgcagacaggcggcttcagcaaagagtctatcctgcccaagaggaacagcgataagctgatcgccagaaagaaggactgggaccctaagaagtacggcggcttcgacagccccaccgtggcctattctgtgctggtggtggccaaagtggaaaagggcaagtccaagaaactgaagagtgtgaaagagctgctggggatcaccatcatggaaagaagcagcttcgagaagaatcccatcgactttctggaagccaagggctacaaagaagtgaaaaaggacctgatcatcaagctgcctaagtactccctgttcgagctggaaaacggccggaagagaatgctggcctctgccggcgaactgcagaagggaaacgaactggccctgccctccaaatatgtgaacttcctgtacctggccagccactatgagaagctgaagggctcccccgaggataatgagcagaaacagctgtttgtggaacagcacaagcactacctggacgagatcatcgagcagatcagcgagttctccaagagagtgatcctggccgacgctaatctggacaaagtgctgtccgcctacaacaagcaccgggataagcccatcagagagcaggccgagaatatcatccacctgtttaccctgaccaatctgggagcccctgccgccttcaagtactttgacaccaccatcgaccggaagaggtacaccagcaccaaagaggtgctggacgccaccctgatccaccagagcatcaccggcctgtacgagacacggatcgacctgtctcagctgggaggcgacagccccaagaagaagagaaaggtggaggccagctaacatatgattcgaatgtctttcttgcgctatgacacttccagcaaaaggtagggcgggctgcgagacggcttcccggcgctgcatgcaacaccgatgatgcttcgaccccccgaagctccttcggggctgcatgggcgctccgatgccgctccagggcgagcgctgtttaaatagccaggcccccgattgcaaagacattatagcgagctaccaaagccatattcaaacacctagatcactaccacttctacacaggccactcgagcttgtgatcgcactccgctaagggggcgcctcttcctcttcgtttcagtcacaacccgcaaacatgacacaagaatccctgttacttctcgaccgtattgattcggatgattcctacgcgagcctgcggaacgaccaggaattctgggaggtgagtcgacgagcaagcccggcggatcaggcagcgtgcttgcagatttgacttgcaacgcccgcattgtgtcgacgaaggcttttggctcctctgtcgctgtctcaagcagcatctaaccctgcgtcgccgtttccatttgcagccgctggcccgccgagccctggaggagctcgggctgccggtgccgccggtgctgcgggtgcccggcgagagcaccaaccccgtactggtcggcgagcccggcccggtgatcaagctgttcggcgagcactggtgcggtccggagagcctcgcgtcggagtcggaggcgtacgcggtcctggcggacgccccggtgccggtgccccgcctcctcggccgcggcgagctgcggcccggcaccggagcctggccgtggccctacctggtgatgagccggatgaccggcaccacctggcggtccgcgatggacggcacgaccgaccggaacgcgctgctcgccctggcccgcgaactcggccgggtgctcggccggctgcacagggtgccgctgaccgggaacaccgtgctcaccccccattccgaggtcttcccggaactgctgcgggaacgccgcgcggcgaccgtcgaggaccaccgcgggtggggctacctctcgccccggctgctggaccgcctggaggactggctgccggacgtggacacgctgctggccggccgcgaaccccggttcgtccacggcgacctgcacgggaccaacatcttcgtggacctggccgcgaccgaggtcaccgggatcgtcgacttcaccgacgtctatgcgggagactcccgctacagcctggtgcaactgcatctcaacgccttccggggcgaccgcgagatcctggccgcgctgctcgacggggcgcagtggaagcggaccgaggacttcgcccgcgaactgctcgccttcaccttcctgcacgacttcgaggtgttcgaggagaccccgctggatctctccggcttcaccgatccggaggaactggcgcagttcctctgggggccgccggacaccgcccccggcgcctgataaggatccggcaagactggccccgcttggcaacgcaacagtgagcccctccctagtgtgtttggggatgtgactatgtattcgtgtgttggccaacgggtcaacccgaacagattgatacccgccttggcatttcctgtcagaatgtaacgtcagttgatggtact对于所有修饰的莱茵衣藻细胞而言,申请人使用了pcr、surveyor核酸酶测定和dna测序,以验证成功的修饰。实例25:cas9靶向多种疾病类型的用途涉及蛋白质编码序列中的突变的疾病:可以通过靶向负显性等位基因而靶向显性障碍。申请人使用cas9靶向负显性等位基因中的独特序列并经由nhej引入突变。nhej诱导的插入缺失可能能够在负显性等位基因中引入移码突变并消除负显性蛋白。如果该基因是充分单的(haplo-sufficient),这可以起作用(例如myoc突变诱导的青光眼和亨廷顿病)。可以通过修复两个等位基因中的疾病突变而靶向隐性障碍。对于分裂细胞,申请人使用cas9在突变位点附近引入双链断裂并使用外源重组模板增加同源重组率。对于分裂细胞,这可以经由携带互补突出端的外源dna片段的nhej介导的连接使用催化两个等位基因中的突变序列的替换的多元切口酶活性而实现。申请人还使用cas9引入保护性突变(例如,用于预防hiv感染的ccr5的失活、用于减少胆固醇或将a673t引入app中以减少阿尔茨海默病的可能性的pcsk9的失活)。涉及非编码序列的疾病申请人使用cas9破坏启动子区域中的非编码序列,以改变转录因子结合位点并改变增强子或阻抑子元件。例如,可以使用cas9切除造血干细胞中的klf1增强子ehs1,以减少bcl11a水平并重新激活分化的红细胞中的胎珠蛋白基因表达。申请人还使用cas9破坏5’或3’非翻译区中的功能性基序。例如,用于强直性肌营养不良的治疗,可以使用cas9除去dmpk基因中的ctg重复扩展。实例26:多元切口酶也可以使用在本申请中详细说明的cas9的优化和教导的方面产生cas9切口酶。申请人使用与指导rna对组合的cas9切口酶,以产生具有限定的突出端的dna双链断裂。当使用两对指导rna时,可能的是切除间插dna片段。如果外源dna段被这两对指导rna切割以产生可与基因组dna相容的突出端,则可以将该外源dna片段连接进该基因组dna中,以替换被切除的片段。例如,可以将其用于除去亨廷顿蛋白(huntintin)(htt)基因中的三核苷酸重复扩展,以治疗亨廷顿病。通过提供了带有较少数目的cag重复的外源dna,则可能能够产生带有相同突出端的dna片段并可以被连接进htt基因组座位中并替换被切除的片段。将外源dna片段连接进基因组中无需同源重组机器并且因此可以在有丝分裂后细胞(如神经元)中使用此方法。实例27:crispr系统的递送可以将cas9及其嵌合的指导rna或tracrrna和crrna的组合作为dna或rna而递送。递送均作为rna(正常的或包含碱基或骨架修饰)分子的cas9和指导rna可以用来减少cas9蛋白在细胞中坚持的时间量。这可以减少靶细胞中的脱靶切割活性的水平。由于递送作为mrna的cas9花费时间翻译成蛋白质,所以可能有利的是在递送cas9mrna后若干小时递送指导rna,以使可供与cas9蛋白相互作用的指导rna的水平最大化。在指导rna量有限的情况下,可以令人希望的是引入作为mrna的cas9和呈dna表达盒形式的指导rna,用驱动指导rna的表达的启动子。以此方式,可获得的指导rna的量将经由转录而放大。可以引入多种递送系统,以向宿主细胞中引入cas9(dna或rna)和指导rna(dna或rna)。这些递送系统包括使用脂质体、病毒载体、电穿孔、纳米粒子、纳米线(沙莱克(shalek)等人,《纳米快报》(nanoletters),2012)、外来体。可以使用分子特洛伊木马脂质体(巴德里智(pardridge)等人,《冷泉港草案》(coldspringharbprotoc);2010;doi:10.1101/pdb.prot5407)地递送cas9和指导rna跨过血脑屏障。实例28:三核苷酸重复障碍的治疗策略如先前在应用中所提及的,crispr复合物的靶多核苷酸可以包括多个疾病相关基因和多核苷酸并且这些疾病相关基因中的一些可以属于一套称为三核苷酸重复障碍的遗传障碍(还称为三核苷酸重复扩展障碍、三联体重复扩展障碍或密码子反复障碍)。这些疾病由以下突变引起,在这些突变中,某些基因的三核苷酸重复超过了通常在基因中可以变化的正常的稳定的阈值。更多的重复扩展障碍的发现已经允许基于基础的相似特征将这些障碍分类为多个类别。由特定基因的蛋白质编码部分中的cag重复扩展引起的亨廷顿病(hd)和脊髓小脑共济失调被包括在类别i中。具有倾向于使得它们表型相异的扩展并包括在量值上通常较小并且还发现于基因的外显子中的扩展的疾病或障碍被包括在类别ii中。类别iii包括由比类别i或ii大得多的并且通常位于蛋白质编码区外的重复扩展表征的障碍或疾病。类别iii疾病或障碍的实例包括但不限于脆性x综合征、强直性肌营养不良、两种脊髓小脑共济失调、青少年肌阵挛性癫痫以及弗里德赖希共济失调。还可以采用类似的治疗策略(像下文针对弗里德赖希共济失调提及的策略)解决其他三核苷酸重复或扩展障碍。例如,可以使用几乎相同的策略治疗的另一种三联体重复疾病是强直性肌营养不良1(dm1),其中在3'utr中存在扩展的ctg基序。在弗里德赖希共济失调中,该疾病由线粒体型共济失调蛋白(fxn)的第一个内含子中的gaa三核苷酸的扩展引起。一种使用crispr的治疗策略是从第一个内含子上切除gaa重复。认为扩展的gaa重复影响dna结构并且导致募集关闭线粒体型共济失调蛋白(frataxin)基因的异染色质的形成(图32a)。下文列出了优于其他治疗策略的竞争优势:sirna敲低在此情况下是不适用的,因为疾病归因于线粒体型共济失调蛋白的减少的表达。病毒基因疗法当前处于探索之中。使用hsv-1基的载体在动物模型中递送线粒体型共济失调蛋白基因并且已经显示出治疗效果。然而,基于病毒的线粒体型共济失调蛋白递送的长期效力受若干问题的困扰:首先,难于将线粒体型共济失调蛋白的表达调节为与健康个体中的天然水平相匹配,并且其次,线粒体型共济失调蛋白长期过量表达导致细胞死亡。可以使用核酸酶切除gaa重复,以恢复健康基因型,但是锌指核酸酶和talen策略需要递送两对高效核酸酶,这对于递送以及核酸酶工程化两者而言都是困难的(通过zfn或talen有效切除基因组dna难于实现)。与以上策略相比之下,crispr-cas系统具有清晰的优势。cas9酶更有效并且更具多元性,这意味着可以同时设置一个或多个靶标。到目前为止,在人类细胞中cas9对基因组dna的有效切除>30%并且可以高达30%,并且在未来可以得到改进。此外,相对于某些三核苷酸重复障碍(像亨廷顿病(hd)),如果在两个等位基因之间存在差异,则可以解决编码区中的三核苷酸重复。确切地,如果hd患者对于突变的htt而言是杂合的并且在野生型与突变的htt等位基因之间存在核苷酸差异(如snp),则可以使用cas9特异性靶向突变的htt等位基因。zfn或talen将不具有基于单碱基差异而区分两个等位基因的能力。在采用使用crispr-cas9酶解决弗里德赖希共济失调的策略中,申请人设计了若干侧翼于gaa扩展的指导rna靶向位点并且选择了最有效且特异的位点(图32b)。申请人递送了靶向fxn的内含子1的指导rna连同cas9的组合,以介导gaa扩展区域的切除。可以使用aav9介导将cas9有效递送进脊髓中。如果将邻近gaa扩展的alu元件认为是重要的,则对可以被靶向的位点的数目可以存在约束,但是申请人可以采用避免将其破坏的策略。替代性策略:并非使用cas9修饰基因组,申请人还可以使用基于cas9(核酸酶活性缺陷的)的dna结合结构域直接激活fxn基因,以将转录激活结构域靶向fxn基因。申请人可能不得不解决cas9介导的人工转录激活的稳健性,以保证当与其他方法相比时它足够稳健(特朗布莱(tremblay)等人,转录激活因子样效应蛋白诱导线粒体型共济失调蛋白的表达(transcriptionactivator-likeeffectorproteinsinducetheexpressionofthefrataxingene);《人类基因疗法》(humangenetherapy),2012年8月,23(8):883-890)。实例29:用于使用cas9切口酶使脱靶切割最小化的策略如先前在本申请中所提及的,可以经由一个或多个以下突变将cas9突变,以介导单链切割:d10a、e762a和h840a。为了经由nhej介导基因基因敲除,申请人使用了cas9的切口酶版本连同两个指导rna。由每个单独的指导rna产生的脱靶切口可以无需突变而首先被修复,仅当靶位点彼此相邻时才发生双链断裂(这可以经由nhej而导致突变)。由于通过双切口引入的双链断裂不是钝的,末端加工酶(如trex1)的共表达将增加nhej活性的水平。处于表格形式的以下靶标列表是针对涉及以下疾病的基因:拉福拉病-靶标gsy1或ppp1r3c(ptg)以减少神经元中的糖原。高胆固醇血症-靶标pcsk9在间隔子(0至3bp)中具有不同数目的核苷酸的靶序列成对列出(l和r)。每个间隔子都还可以独自地与野生型cas9一起使用,以在靶座位处引入双链断裂。用于改善指导rna的稳定性并增加特异性的替代性策略1.可以经由硫酯键而非磷酸酯键(像在天然rna中)连接指导rna的5’中的核苷酸。硫酯键可以防止指导rna被内源rna降解机械熟化。2.指导rna的指导序列(5’20bp)中的核苷酸可以使用桥接的核酸(bna)作为碱基,以改进结合特异性。实例30:用于快速、多元基因组编辑的crispr-cas本发明的方面涉及以下方案和方法,通过这些方案和方法,可以在靶标设计后3-4天内测试基因修饰的效率和特异性,并且可以在2-3周内得到修饰的克隆细胞系。可编程的核酸酶是用于以高精度介导基因组改变的强大技术。可以使用来自微生物crispr获得性免疫系统的rna-指导的cas9核酸酶通过简单地在其指导rna中指定一个20-nt靶向序列而在真核细胞中促进有效的基因组编辑。申请人描述了一套用于应用cas9以在哺乳动物细胞中促进有效的基因组编辑并产生用于下游功能研究的细胞系的方案。以靶标设计开始,可以在3-4天内实现有效且特异的基因修饰,并且可以在2-3内得到修饰的克隆细胞系。工程化生物系统和生物的能力跨基础科学、医药和生物技术拥有巨大的应用潜力。促进内源基因组座位的精确编辑的可编程的序列特异的内切核酸酶现在允许在广泛的物种中系统地询问遗传元件和致病性遗传变异,包括先前用基因方法不易处理的那些。近年来已经出现了多种基因组编辑技术,包括锌指核酸酶(zfn)、转录激活因子样效应核酸酶(talen)和rna-指导的crispr-cas核酸酶系统。前两种技术使用将内切核酸酶催化结构域束缚为模块化dna-结合蛋白用于在特定基因组座位处诱导靶向的dna双链断裂(dsb)的共同策略。相比之下,cas9是一种通过与靶dna进行沃森-克里克碱基配对而由小rna指导的核酸酶,呈现了一种易于设计、有效且很好地适于多种细胞类型和生物的高通量和多元基因编辑的系统。在此,申请人描述了一套用于应用最近研发的cas9核酸酶在哺乳动物细胞中促进有效的基因组编辑并产生用于下游功能研究的细胞系的方案。像zfn和talen一样,cas9通过刺激靶基因组座位处的dsb而促进基因组编辑。当被cas9切割后,靶座位经历两种主要途径之一进行dna损伤修复,即易错非同源末端连接(nhej)或高保真同源定向修复(hdr)途径。两种途径都可以用于实现希望的编辑结果。nhej:在不存在修复模板的情况下,nhej过程重新连接dsb,这可以留下一个处于插入缺失突变形式的瘢痕。可以利用此过程实现基因敲除,因为发生在编码外显子内的插入缺失可以导致移码突变并形成提前终止密码子。还可以采用多个dsb在基因组中介导较大的缺失。hdr:同源定向修复是nhej的一种主要的替换性dna修复途径。尽管hdr典型地以低于nhej的频率发生,但是可以利用它在存在外源引入的修复模板的情况下在靶座位处产生精确的限定的修饰。该修复模板可以处于类似于具有侧翼于插入序列的同源臂的常规dna靶向构建体而设计的双链dna的形式,或单链dna寡核苷酸(ssodn)的形式。后者提供了一种用于在基因组中进行小编辑的有效且简单的方法,如引入用于探测致病性遗传变异的单核苷酸突变。不同于nhej,hdr通常仅在分裂细胞中有活性并且其效率取决于细胞类型和状态而变化。crispr概述:相比之下,crispr-cas系统最低是一个由cas9核酸酶和短指导rna组成的双组分系统。将cas9重新靶向不同座位或同时编辑多个基因简单地需要克隆一个不同的20-bp寡核苷酸。尽管cas9核酸酶的特异性尚未彻底阐明,crispr-cas系统的简单的沃森-克里克碱基配对似乎比zfn或talen结构域的碱基配对更可预测。ii型crispr-cas(规律间隔成簇短回文重复)是一种使用cas9切割外源遗传元件的细菌获得性免疫系统。cas9由一对非编码rna指导,即一个可变的crrna和一个必需的辅助tracrrna。包含一个20-nt指导序列的crrna经由沃森-克里克碱基配对通过定位靶dna而确定特异性。在天然细菌系统中,共转录多种crrna,以指向针对不同靶标的cas9。在来源于化脓链球菌的crispr-cas系统中,靶dna必须紧接在一个5’-ngg/nrg原型间隔子邻近基序(pam)之前,该基序可以针对其他crispr系统而变化。crispr-cas通过异源表达人类密码子优化的cas9和必需的rna组分而在哺乳动物细胞中重构。此外,可以将crrna和tracrrna融合以产生嵌合的合成的指导rna(sgrna)。cas9因此可以通过改变sgrna内的20-nt指导序列而重新指向任何感兴趣的靶标。鉴于其易于实施和多种能力,cas9已经被用于经由nhej和hdr两者而产生携带特异的突变的工程化真核细胞。另外,直接将sgrna和编码cas9的mrna注射进胚胎中已经使得可以快速产生具有多个修饰的等位基因的转基因小鼠;这些结果拥有编辑以另外的方式可用基因方法易处理的生物的前景。在其催化结构域之一中携带破坏的突变的cas9已经被工程化为切口而非切割dna,从而允许单链断裂和优先通过hdr进行修复,从而潜在地减少来自脱靶dsb的不想要的插入缺失。另外,具有两个突变的dna切割催化残基的cas9突变体已经被适配成使得可以在大肠杆菌中进行转录调节,从而展示了功能化cas9用于相异应用的潜力。本发明的某些方面涉及用于多元编辑人类细胞的cas9的构建和应用。申请人已经提供了人类密码子优化的核定位序列侧翼的cas9,以促进真核基因编辑。申请人描述了设计20-nt指导序列的考虑因素、用于快速构建sgrna并对其进行功能验证的方案,并且最后使用cas9核酸酶在人类胚肾(hek-293ft)和人类干细胞(hues9)系中介导基于nhej和hdr的两种基因组修饰。此方案可以被同样地应用于其他细胞类型和生物。sgrna的靶标选择:在用于基因靶向的20-nt指导序列的选择中存在两个主要考虑因素:1)靶序列应该在化脓链球菌cas9的5’-nggpam之前,和2)指导序列应该被选择为使脱靶活性最小化。申请人提供了一种采用感兴趣的输入序列并鉴定适合的靶位点的在线cas9靶向设计工具。为了用实验方法评估每个sgrna的脱靶修饰,申请人还为每个预期靶标提供了计算预测的脱靶位点,这些位点是根据申请人对碱基配对错配的身份、位置和分布的作用的定量特异性分析排列的。关于计算预测的脱靶位点的详细信息如下:脱靶切割活性的考虑因素:类似于其他核酸酶,cas9可以按减少的频率切割基因组中的脱靶dna靶标。给定的指导序列展现出脱靶活性的程度取决于以下因素的组合,包括酶浓度、利用的特定指导序列的热力学以及类似序列在靶基因组中的丰度。对于cas9的常规应用,重要的是考虑使脱靶切割水平最小化并且还能够检测脱靶切割的存在的方式。最小化脱靶活性:对于在细胞系中应用,申请人推荐了以下两个步骤来减少脱靶基因组修饰的水平。首先,使用我们的在线crispr靶标选择工具可以计算评估给定的指导序列具有脱靶位点的可能性。通过在基因组中彻底检索作为与指导序列类似的序列的脱靶序列而进行这些分析。sgrna与其靶dna之间的错配碱基的作用的综合性实验研究揭示到错配耐受是1)位置依赖性的-指导序列的3’末端的8-14bp比5’碱基更不耐受错配,2)数量依赖性的-通常超过3个错配是不被容忍的,3)指导序列依赖性的-一些指导序列比其他指导序列更不耐受错配,以及4)浓度依赖性的-脱靶切割对转染dna的量高度敏感。申请人的靶位点分析网络工具(在网站enome-engineering.org/tools可获得)整合了这些标准,以为靶基因组中的可能的脱靶位点提供预测。其次,申请人推荐滴定cas9和sgrna表达质粒的量,以使脱靶活性最小化。脱靶活性的检测:使用申请人的crispr靶向网络工具可以产生最可能的脱靶位点以及进行那些位点的surveyor或测序分析的引物的列表。对于使用cas9产生的同基因克隆,申请人强烈推荐对这些候选脱靶位点进行测序,以检查任何不希望的突变。值得注意的是可能在未被包括在预测候选物列表中的位点中存在脱靶修饰并且应该进行全基因组测序以完全验证不存在脱靶位点。此外,在于同一基因组内诱导若干dsb的多元测定中,可能存在较低的转位事件率并且可以使用多种技术(如深度测序)对其进行评价。在线工具为1)制备sgrna构建体、2)测定靶标修饰效率和3)评估潜在的脱靶位点处的切割所需的所有寡核苷酸和引物提供了序列。值得注意的是因为用于表达sgrna的u6rna聚合酶iii启动子偏好鸟嘌呤(g)核苷酸作为其转录本的第一个碱基,所以在20-nt指导序列未以g开始的情况下,在sgrna的5’附加一个额外的g。sgrna构建和递送途径:取决于希望的应用,可以将sgrna作为1)包含表达盒的pcr扩增子或2)sgrna表达质粒而递送。基于pcr的sgrna递送将默认sgrna序列附加到用于扩增u6启动子模板的反向pcr引物上。可以将生成的扩增子与包含cas9的质粒(px165)共转染。此方法最适于快速筛选多个候选sgrna,因为可以在获得sgrna-编码引物后仅仅几个小时进行用于功能测试的细胞转染。因为此简单方法省却了基于质粒的克隆和序列验证的需要,所以它特别适于测试或共转染大量用于产生较大的敲除文库或其他规模敏感的应用的sgrna。注意的是,与基于质粒的sgrna递送所需的~20-bp寡核苷酸相比,sgrna-编码引物超过100-bp。sgrna的表达质粒的构建也是简单且快速的,涉及使用一对部分互补的寡核苷的单个克隆步骤。在将寡核苷酸对退火后,可以将生成的指导序列插入带有cas9和具有sgrna序列的剩余部分的不变支架两者的质粒(px330)中。还可以将转染质粒修饰为使得可以产生用于体内递送的病毒。除基于pcr和质粒的递送方法之外,还可以将cas9和sgrna两者作为rna而引入进细胞中。修复模板的设计:传统地,靶向的dna修饰具有包含侧翼于改变位点的同源臂的基于质粒的供体修复模板的所需用途。每侧的同源臂的长度可以变化,但是典型地长于500bp。可以使用此方法产生较大的修饰,包括插入报告基因(如荧光蛋白或抗生素抗性标记)。靶向质粒的设计和构建已经在别处进行了描述。最近,已经使用单链dna寡核苷酸(ssodn)代替靶向质粒,用于在限定的座位内进行短修饰而无需克隆。为了实现较高的hdr效率,ssodn在每侧包含至少40bp的与靶区域同源的侧翼序列,并且可以相对于靶座位以有义或反义方向定向。功能测试surveyor核酸酶测定:申请人通过surveyor核酸酶测定或pcr扩增子测序检测了插入缺失突变。申请人的在线crispr靶标设计工具为两个途径提供了推荐的引物。然而,也可以手动地设计surveyor或测序引物,以从基因组dna扩增感兴趣的区域并使用ncbi引物-blast避免非特异的扩增子。surveyor引物应该被设计为在cas9靶标的任一侧扩增300-400bp(对于总共600-800bp的扩增子而言),以允许通过凝胶电泳而清晰地可视化切割条带。为了防止形成过量的引物二聚体,surveyor引物应该被设计为典型地长度为25-nt之下并且解链温度为~60℃。申请人推荐在surveyor核酸酶消化过程期间针对特异的pcr扩增子以及不存在非特异的切割的情况测试每对候选引物。质粒-或ssodn-介导的hdr:可以经由修饰的区域的pcr-扩增和测序检测hdr。为此目的,pcr引物应该在由同源臂跨越的区域外退火,以避免错误地检测到残余的修复模板(hdrfwd和rev,图30)。对于ssodn介导的hdr,可以使用surveyorpcr引物。通过测序检测插入缺失或hdr:申请人通过桑格或下一代深度测序(ngs)检测了靶向的基因组修饰。对于前者,可以使用surveyor或hdr引物扩增来自修饰的区域的基因组dna。应该将扩增子亚克隆进供转化的质粒(如puc19)中;可以对单独的菌落测序,以揭示克隆基因型。申请人为较短的扩增子设计了下一代测序(ngs)引物,这些扩增子典型地在100-200bp尺寸范围内。对于检测nhej突变,重要的是设计在引发区和cas9靶位点之间具有至少10-20bp的引物,以允许检测较长的插入缺失。申请人为两步pcr方法提供了指南,以为多元深度测序附加条形码适配子。归因于illumina平台的通常较低水平的假阳性插入缺失,申请人推荐了该平台。然后可以通过读取比对程序(如clustalw、geneious或简单的序列分析脚本)进行脱靶分析(先前所述)。材料与试剂sgrna制备:超纯的无dnasernase蒸馏水(生命技术公司,目录号10977-023)herculaseii融合聚合酶(安捷伦技术公司,目录号600679)关键。标准taq聚合酶,缺少3’-5’外切核酸酶校正活性,具有较低的保真性并且可以导致扩增错误。herculaseii是一种以最小优化而产生高产率的pcr产物的高保真聚合酶(保真性与pfu相当)。可以替代其他高保真聚合酶。herculaseii反应缓冲液(5x;安捷伦技术公司,包括聚合酶)dntp混合溶液(各自25mm;enzymatics公司,目录号n205l)mgcl2(25mm;赛默飞世尔科技公司,目录号r0971)qiaquick凝胶提取试剂盒(凯杰公司,目录号28704)qiaprepspinminiprep试剂盒(凯杰公司,目录号27106)ultrapuretbe缓冲液(10x;生命技术公司,目录号15581-028)seakemle琼脂糖(龙沙公司,目录号50004)sybrsafedna染色剂(10,000x;生命技术公司,目录号s33102)1-kbplusdna梯(生命技术公司,目录号10787-018)trackitcyanorange上样缓冲液(生命技术公司,目录号10482-028)快速消化bbsi(fastdigestbpii)(费尔芒斯/赛默飞世尔科技公司,目录号fd1014)fermentastango缓冲液(费尔芒斯/赛默飞世尔科技公司,目录号by5)dl-二硫苏糖醇(dtt;费尔芒斯/赛默飞世尔科技公司,目录号r0862)t7dna连接酶(enzymatic公司,目录号l602l)关键的:不替代更常用的t4连接酶。t7连接酶在粘性末端具有比平头末端高1,000倍的活性并且具有比可商购的浓缩t4连接酶高的整体活性。t72xrapidligation缓冲液(包括t7dna连接酶,enzymatics公司,目录号l602l)t4多核苷酸激酶(新英格兰生物实验室,目录号m0201s)t4dna连接酶反应缓冲液(10x;新英格兰生物实验室,目录号b0202s)腺苷5’-三磷酸(10mm;新英格兰生物实验室,目录号p0756s)plasmidsafeatp-依赖性dnase(epicentre,目录号e3101k)oneshotstbl3化学感受态大肠杆菌(e.coli)(生命技术公司,目录号c7373-03)soc培养基(新英格兰生物实验室,目录号b9020s)lb培养基(西格玛公司,目录号l3022)lb琼脂培养基(西格玛公司,目录号l2897)氨苄西林,无菌过滤的(100mgml-1;西格玛公司,目录号a5354)哺乳动物细胞培养:hek293ft细胞(生命技术公司,目录号r700-07)杜尔贝科最低伊格尔培养基(dulbecco'sminimumeagle’smedium)(dmem,1x,高葡萄糖;生命技术公司,目录号10313-039)杜尔贝科最低伊格尔培养基(dmem,1x,高葡萄糖,无酚红;生命技术公司,目录号31053-028)杜尔贝科磷酸盐缓冲盐水(dpbs,1x;生命技术公司,目录号14190-250)胎牛血清,合格的且热灭活的(生命技术公司,目录号10438-034)opti-memi减少的血清培养基(fbs;生命技术公司,目录号11058-021)青霉素-链霉素(100x;生命技术公司,目录号15140-163)trypletmexpress(1x,无酚红;生命技术公司,目录号12604-013)lipofectamine2000转染试剂(生命技术公司,目录号11668027)amaxasfcellline4d-xkits(32rct;龙沙公司,目录号v4xc-2032)hues9细胞系(哈佛干细胞科学(harvardstemcellscience))geltrex无ldev的减少的生长因子基膜基质(生命技术公司,目录号a1413201)mtesr1培养基(干细胞技术公司(stemcelltechnologies),目录号05850)accutase细胞脱离溶液(干细胞技术公司,目录号07920)rock抑制剂(y-27632;密理博公司(millipore),目录号scm075)amaxap3primarycell4d-xkits(32rct;龙沙公司,目录号v4xp-3032)基因分型分析:quickextractdna提取溶液(epicentre,目录号qe09050)检验员、rflp分析或测序的pcr引物(参见引物表)herculaseii融合聚合酶(安捷伦技术公司,目录号600679)关键。因为surveyor测定对单碱基错配敏感,所以特别重要的是使用高保真聚合酶。可以替代其他高保真聚合酶。herculaseii反应缓冲液(5x;安捷伦技术公司,包括聚合酶)dntp混合溶液(各自25mm;enzymatics公司,目录号n205l)qiaquick凝胶提取试剂盒(凯杰公司,目录号28704)taq缓冲液(10x;金斯瑞公司(genscript),目录号b0005)用于标准凝胶电泳的surveyor突变检测试剂盒(转基因组学公司,目录号706025)ultrapuretbe缓冲液(10x;生命技术公司,目录号15581-028)seakemle琼脂糖(龙沙公司,目录号50004)4%-20%tbegels1.0mm,15孔(生命技术公司,目录号ec62255box)hi-densitytbe样品缓冲液(5x;生命技术公司,目录号lc6678)sybrgold核酸凝胶染色剂(10,000x;生命技术公司,目录号s-11494)1-kbplusdna梯(生命技术公司,目录号10787-018)trackitcyanorange上样缓冲液(生命技术公司,目录号10482-028)快速消化hindiii(fastdigesthindiii)(费尔芒斯/赛默飞世尔科技公司,目录号fd0504)设备过滤的无菌移液管(康宁公司)标准1.5ml微量离心管(艾本德公司(eppendorf),目录号0030125.150)axygen96孔pcr平板(vwr,目录号pcr-96m2-hsc)axygen8-strippcr管(飞世尔科技公司(fischerscientific),目录号14-222-250)falcon管,聚丙烯,15ml(bd福尔肯公司,目录号352097)falcon管,聚丙烯,50ml(bd福尔肯公司,目录号352070)带有细胞滤网帽的圆底管,5ml(bd福尔肯公司,目录号352235)皮氏培养皿(60mm×15mm;bd生物科学公司(bdbiosciences),目录号351007)组织培养平板(24孔;bd福尔肯公司,目录号353047)组织培养平板(96孔,平底;bd福尔肯公司,目录号353075)组织培养皿(100mm;bd福尔肯公司,353003)带有可编程的温度步进功能的96孔热循环仪(应用生物系统公司veriti(appliedbiosystemsveriti),目录号4375786)。台式微量离心机5424,5804(艾本德公司)凝胶电泳系统(powerpac基础电源,伯乐公司(bio-rad),目录号164-5050,和sub-cellgt系统凝胶托盘,伯乐公司(bio-rad),目录号170-4401)novexxcellsurelockmini-cell(生命技术公司,目录号ei0001)数字凝胶成像系统(geldocez,伯乐公司(bio-rad),目录号170-8270,和蓝色样品托盘,伯乐公司(bio-rad),目录号170-8273)蓝光透射仪和橙色过滤器护目镜(safeimager2.0;英杰公司,目录号g6600)凝胶定量软件(伯乐公司(bio-rad),imagelab,包括geldocez,或可在网站rsbweb.nih.gov/ij/获得的来自国立卫生研究院的开放源imagej)uv分光光度计(nanodrop2000c,赛默飞世尔科技公司)试剂准备三硼酸edta(tbe)电泳溶液:将tbe缓冲液稀释于蒸馏水中成1x工作溶液,用于铸造琼脂糖凝胶并用作供凝胶电泳用的缓冲液。可以将缓冲液存储在室温(18℃-22℃)下持续至少1年。·atp,10mm将10mmatp分为50-μl等分部分并存储在-20℃下,持续长达1年;避免重复的冻融循环。·dtt,10mm在蒸馏水中制备10mmdtt溶液并以20-μl等分部分存储在-70℃下,持续长达2年;用于每个反应,使用一个新的等分部分,因为dtt容易被氧化。·d10培养基用于培养hek293ft细胞,通过给dmem补充1xglutamax和10%(vol/vol)胎牛血清而制备d10培养基。如在该方案中所指示,此培养基还可以补充有1x青霉素-链霉素。可以提前制备d10培养基并存储在4℃下,持续长达1个月。·mtesr1培养基用于培养人类胚胎干细胞,通过补充5x添加物(包括mtesr1基础培养基)和100ug/mlnormocin而制备mtesr1培养基。程序靶向组分的设计以及在线工具的使用·定时1d1|输入靶基因组dna序列。申请人提供了一种在线cas9靶向设计工具,该工具采用感兴趣的输入序列,鉴定并排列适合的靶位点,并计算预测每个预期靶标的脱靶位点。可替代地,可以通过鉴定正好位于任何5’-ngg的上游的20-bp序列而手动地选择指导序列。2|订购如通过该在线工具所指定的必需的寡核苷酸和引物。如果手动地选择位点,则应该设计寡核苷酸和引物。sgrna表达构建体的制备3|为了产生sgrna表达构建体,可以使用基于pcr或质粒的方案。(a)经由pcr扩增·定时2h(i)申请人制备了稀释的u6pcr模板。申请人推荐使用px330作为pcr模板,但是可以同样地将任何含u6质粒用作pcr模板。申请人用ddh2o将模板稀释至浓度为10ng/ul。注意的是,如果将已经包含u6驱动的sgrna的质粒或盒用作模板,则需要进行凝胶提取,以保证产物仅包含预期的sgrna而不包含从模板带入的痕量sgrna。(ii)申请人制备了稀释的pcr寡核苷酸。将u6-fwd和u6-sgrna-rev引物在ddh2o中稀释至终浓度为10um(将10ul的100um引物添加至90ulddh2o中)。(iii)u6-sgrnapcr反应。申请人按照需要为每个u6-sgrna-rev引物和预混合液设置了以下反应:(iv)申请人使用以下循环条件在来自步骤(iii)的反应上进行了pcr反应:(v)反应完成后,申请人使产物在凝胶上跑胶,以验证成功的单条带扩增。用1xsybrsafe染料在1xtbe缓冲液中铸造2%(wt/vol)琼脂糖凝胶。使5ul的pcr产物在该凝胶中以15vcm-1跑胶20-30min。成功的扩增子应该产生单个的370-bp产物并且模板应该是不可见的。应该不必对pcr扩增子进行凝胶提取。(vi)申请人根据制造商的指导,使用qiaquickpcr纯化试剂盒纯化了pcr产物。将dna在35ul的缓冲液eb或水中洗脱。可以将纯化的pcr产物存储在4℃或-20℃下。(b)将sgrna克隆进含cas9的双顺反子表达载体中·定时3d(i)制备sgrna寡核苷酸插入片段。申请人将每个sgrna设计的寡核苷酸的顶链和底链再悬浮至终浓度为100um。如下使寡核苷酸磷酸化和退火:(ii)使用以下参数在热循环仪中退火:37℃,持续30m95℃,持续5m以5℃/m降至25℃(iii)申请人通过将1ul的寡核苷酸添加至199ul室温ddh2o中而以1:200稀释了磷酸化且退火的寡核苷酸。(iv)将sgrna寡核苷酸克隆进px330中。申请人为每个sgrna设置了goldengate反应。申请人还推荐设置了一种无插入物,仅px330作为阴性对照。(v)将goldengate反应孵育总共1h:循环数条件1-637℃持续5m,21℃持续5m(vi)申请人用plasmidsafe外切核酸酶处理了goldengate反应,以消化任何残余的线性化dna。此步骤是任选的但被强烈推荐。(vii)申请人将plasmidsafe反应在37℃下孵育了30min,随后在70℃下失活30min。暂停点:完成后,可以将反应冷冻并且稍后继续。环状dna应该至少1周是稳定的。(viii)转化。申请人根据与细胞一起提供的方案将plasmidsafe处理的质粒转化进感受态大肠杆菌菌株中。申请人推荐stbl3用于迅速转化。简言之,申请人将来自步骤(vii)的5ul的产物添加进20ul的冰冷化学感受态stbl3细胞中。然后将其在冰上孵育10m,在42℃下热休克30s,立即返回冰上持续,添加100ul的soc培养基,并且将其在包含100ug/ml氨苄西林的lb平板上铺板,并在37℃下孵育过夜。(ix)第2天:申请人检查了平板的菌落生长情况。典型地,在阴性对照平板上不存在菌落(仅连接了bbsi-消化的px330,没有退火的sgrna寡核苷酸),并且在px330-sgrna克隆平板上存在数十至数百个菌落。(x)申请人从每个平板中挑选了2-3个菌落,以检查sgrna的正确插入。申请人使用无菌移液管尖端将单菌落接种进3ml具有100ug/ml氨苄西林的lb培养基的培养物中。在37℃下孵育并振荡过夜。(xi)第3天:申请人根据制造商的说明书使用qiaprepspinminiprep试剂盒从过夜培养物中分离出质粒dna。(xii)序列验证crispr质粒。申请人通过使用u6-fwd引物从u6启动子测序证实了每个菌落的序列。任选的:使用以下引物表中列出的引物对cas9基因进行测序。申请人参考了px330克隆载体序列的测序结果,以检查20bp指导序列插入在u6启动子与sgrna支架的剩余部分之间。可以在网站crispr.genome-engineering.org找到处于genbank载体图谱格式的px330图谱的细节和序列(*.gb文件)。(任选的)设计ssodn模板·定时3d提前计划3|设计和订购ssodn。有义或反义ssodn可以直接从供应商购买。申请人推荐设计在任一侧上具有至少40bp和用于优化hdr效率的90bp的同源臂。在申请人的经验中,反义寡核苷酸具有稍微更高的修饰效率。4|申请人将ssodnultramer再悬浮并稀释至终浓度为10um。不将有义和反义ssodn合并或退火。存储在-20℃下。5|注意对于hdr应用,申请人推荐将sgrna克隆进px330质粒中。sgrna的功能验证:细胞培养和转染·定时3-4dcrispr-cas系统已经被用于多种哺乳动物细胞系中。每个细胞系的条件可以变化。以下方案详细说明了hek239ft细胞的转染条件。注意对于ssodn介导的hdr转染,使用amaxasfcelllinenucleofector试剂盒优化ssodn的递送。将在下节中对其进行描述。7|hek293ft维持。根据制造商的推荐维持细胞。简言之,申请人在37℃和5%co2下将细胞培养在d10培养基(补充有10%胎牛血清的glutamaxdmem)中。8|为了传代,申请人移除培养基并且通过将dpbs轻轻地添加到容器的侧面而将其冲洗一次,以便移动细胞。申请人将2ml的tryple添加至t75烧瓶中并在37℃下孵育5m。添加10ml的温d10培养基以失活并将其转移至50mlfalcon管中。申请人通过轻轻地研磨而使细胞解离,并且必要时重新接种新的烧瓶。申请人典型地使细胞以1:4或1:8的分传比每2-3d传代一次,绝不允许细胞达到大于70%的汇合。当达到传代数15时,细胞系被重新启动。9|制备供转染用的细胞。在以1.3x105个细胞/孔的接种密度和500ul的接种体积进行转染之前16-24h,申请人将良好解离的细胞在24孔平板上铺板在没有抗生素的d10培养基中。根据制造商手册按需要按比例放大或缩小。建议不要铺比推荐的密度多的细胞,因为这样做可以降低转染效率。10|在转染的当天,细胞的汇合最佳为70%-90%。根据制造商的方案,可以用lipofectamine2000或amaxasfcelllinenucleofector试剂盒转染细胞。(a)对于克隆进px330中的sgrna,申请人转染了500ng的序列已证实的crispr质粒;如果转染超过一种质粒,以等摩尔比例混合并且总共不超过500ng。(b)对于通过pcr扩增的sgrna,申请人将以下项混合:px165(仅有cas9)200ngsgrna扩增子(各自)40ngpuc19填充总dna至500ng申请人推荐在技术上一式三份地转染用于可靠地定量并包括转染对照(例如gfp质粒)以监测转染效率。另外,可以将px330克隆质粒和/或sgrna扩增子作为阴性对照而单独地转染,用于下游的功能测定。11|申请人将lipofectamine复合物轻轻地添加至细胞中,因为hek293ft细胞可以容易地从平板上脱离并导致转染效率较低。12|申请人在转染后24h通过使用荧光显微镜估计对照(例如,gfp)转染中的荧光细胞的分数而检查了细胞的效率。典型地,超过70%的细胞被转染。13|申请人给培养基补充了另外500ul的温d10培养基。将d10非常缓慢地添加至孔的侧面并且不要使用冷的培养基,因为细胞可以容易地脱离开。14|在收获用于插入缺失分析之前,将细胞在转染后孵育总共48-72h。48h后插入缺失效率未显著增加。(任选的)crispr质粒和ssodn或靶向质粒的共转染用于进行hr·定时3-4d15|线性化靶向质粒。如果可能的话,通过在同源臂之一的附近或在任一同源臂的远端在载体骨架中的限制酶切位点处切割一次而将靶向载体线性化。16|申请人使少量的线性化质粒在未切割的质粒旁边在0.8%-1%琼脂糖凝胶上跑胶,以检查成功的线性化。线性化质粒应该跑到超螺旋质粒的上方。17|申请人用qiaquickpcr纯化试剂盒纯化了线性化质粒。18|制备供转染用的细胞。申请人在t75或t225烧瓶中培养hek293ft。在转染当天之前,为重组的细胞计数订计划。对于amaxa条状比色皿格式,每个转染使用2x106个细胞。19|制备供转染用的平板。申请人将1ml的温d10培养基添加进12孔平板的每个孔中。将平板置于恒温箱中,以保持培养基是温的。20|核转染。申请人根据适于以下步骤的amaxasfcelllinenucleofector4d试剂盒制造商的说明书转染hek293ft细胞。a.用于ssodn和crispr共转染,将以下dna预混合在pcr管中:pcrispr质粒(cas9+sgrna)500ngssodn模板(10um)1ulb.用于hdr靶向质粒和crispr共转染,将以下dna预混合在pcr管中:crispr质粒(cas9+sgrna)500ng线性化靶向质粒500ng对于转染对照,参见上节。另外,申请人推荐转染单独的ssodn或靶向质粒作为阴性对照。21|解离为单细胞。申请人移除培养基并用dpbs轻轻地冲洗一次,注意不要移动细胞。将2ml的tryple添加至t75烧瓶中并在37℃下孵育5m。添加10ml的温d10培养基以失活并将其在50mlfalcon管中轻轻地研磨。推荐轻轻地研磨细胞并解离为单细胞。较大的团块将降低转染效率。申请人从悬浮液中取了一个10ul的等分部分并将其稀释于90ul的d10培养基中用于计数。申请人对细胞进行了计数并计算了转染所需的细胞数目和悬浮液体积。申请人使用amaxanucleocuvette条典型地每个条件转染2x105个细胞,并且推荐计算比所需多20%的细胞,以调节在随后的吸移步骤中的体积损失。将所需体积转移至新的falcon管中。23|申请人使新管以200xg旋降,持续5m。如由amaxa所推荐的,申请人通过将sf溶液与s1添加物混合而制备了转染溶液。对于amaxa条状比色皿,每个转染需要总共20ul的补充sf的溶液。同样地,申请人推荐计算比所需多20%的体积。25|申请人从来自步骤23的沉淀细胞中完全移除培养基并将其轻轻地再悬浮于适当体积(20ul/2x105个细胞)的补充s1的sf溶液中。不要将细胞在sf溶液中留延长的时间段。26|将20ul的再悬浮的细胞吸移进来自步骤20的每个dna预混合液中。轻轻地吸移以混合并转移至nucleocuvette条室中。针对每个转染条件将其重复。使用由amaxa推荐的nucleofector4d程序cm-130将细胞电穿孔。28|申请人轻轻地并缓慢地将100ul的温d10培养基吸移进每个nucleocuvette条室中,并将全部体积转移至来自步骤19的预加温的平板中。关键.细胞在此阶段是非常脆弱的并且粗鲁的吸移可以引起细胞死亡。孵育24h。在此时,可以从阳性转染对照中的荧光细胞的分数估计转染效率。核转染典型地产生大于70%-80%的转染效率。申请人将1ml温d10培养基缓慢地添加至每个孔中而未移动细胞。将细胞孵育总共72h。人类胚胎干细胞(hues9)培养和转染·定时3-4d维持hesc(hues9)系。申请人常规地用mtesr1培养基将hues9细胞系维持在无进料器的条件中。申请人通过添加5x包括基础培养基和100ug/mlnormocin的添加物而制备了mtesr1培养基。申请人制备了进一步补充有10umrock抑制剂的mtesr1培养基的一个10ml的等分部分。包衣组织培养平板。将冷的geltrex1:100地稀释于冷的dmem中并包衣100mm组织培养平板的整个表面。将平板在37℃下置于恒温箱中持续至少30m。在37℃下解冻一小瓶15mlfalcon管中的细胞,添加5ml的mtesr1培养基,并在200xg下沉淀5m。抽出geltrex包衣并用~1x106个细胞接种10ml的包含rock抑制剂的mtesr1培养基。转染后24h换为正常的mtesr1培养基并且每天重新给料。细胞传代。每天用新鲜的mtesr1培养基为细胞重新给料并在达到70%汇合之前传代。抽出mtesr1培养基并用dpbs将细胞洗涤一次。通过添加2mlaccutase并在37℃下孵育3-5m而使细胞解离。向脱离开的细胞中添加10mlmtesr1培养基,转移至15mlfalcon管中并轻轻地再悬浮。在具有10umrock抑制剂的mtesr1培养基中在geltrex包衣的平板上重新铺板。铺板后24h换为正常的mtesr1培养基。转染。申请人推荐在使用amaxap3primarycell4-dnucleofector试剂盒(龙沙公司)转染之前,在解冻后将细胞培养至少1周。转染之前2h,用新鲜的培养基为对数期生长细胞重新给料。用accutase解离为单细胞或不超过10个细胞的小聚簇并轻轻地再悬浮。为核转染所需的细胞数目计数并以200xg旋降,持续5m。完全地移除培养基并再悬浮于推荐体积的补充s1的p3核转染溶液中。在1xrock抑制剂的存在下,将电穿孔的细胞轻轻地铺进包衣的平板中。检查转染是否成功并且在核转染后24h开始每天用普通的mtesr1培养基重新给料。典型地,申请人用amaxa核转染观察到大于70%的转染效率。收获dna。转染后48-72h,使用accutase使细胞解离并通过添加5x体积的mtesr1而失活。将细胞以200xg旋降,持续5m。可以将沉淀的细胞直接加工,用于使用quickextract溶液提取dna。推荐不要不用accutase而机械地解离细胞。推荐不要在未灭活accutase的情况下或不按以上推荐的速度使细胞旋降;这样做可以导致细胞溶解。通过facs分离克隆细胞系。定时·2-3h亲身实践的;2-3周扩展可以在转染后24h通过facs或通过连续稀释进行克隆分离。54|制备facs缓冲液。可以在补充有1x青霉素/链霉素的普通d10培养基中分选无需使用彩色荧光分选的细胞。如果还需要彩色荧光分选,则用无酚dmem或dpbs替代正常的dmem。补充1x青霉素/链霉素并通过.22umsteriflip过滤器进行过滤。55|准备96孔平板。申请人向每个孔中添加了100ul补充有1x青霉素/链霉素的d10培养基并根据希望的克隆数目的需要准备了平板的数目。56|制备供facs用的细胞。申请人通过完全吸除培养基并向24孔平板的每个孔中添加100ultryple而使细胞解离。孵育5m并添加400ul温d10培养基。57|将再悬浮的细胞转移至15mlfalcon管中并轻轻地研磨20次。建议在显微镜下进行检查,以保证解离单细胞。58|将细胞以200xg旋降,持续5分钟。59|申请人抽出培养基,并且将细胞再悬浮于200ul的facs培养基中。60|通过35um目过滤器将细胞过滤进标记的facs管中。申请人推荐使用带有细胞滤网帽的bdfalcon12x75mm管。将细胞放在冰上直到分选。61|申请人将单细胞分选进从步骤55准备的96孔平板中。申请人推荐在每个平板上的一个单个指定的孔中,分选100个细胞作为阳性对照。注意。可以将细胞的剩余部分保存和用于以群体水平进行基因分型,以测量整体修饰效率。62|申请人将细胞返回恒温箱总并允许它们扩增2-3周。分选后5d,添加100ul的温d10培养基。必要时,每3-5d更换100ul的培养基。63|分选后1周检查菌落的“克隆”外观:从中心点辐射的圆菌落。划出空的或可能已经接种有双联体或多联体的孔。64|当超过60%的细胞汇合时,申请人准备了一套用于传代的复制平板。将100ul的d10培养基添加至复制平板中的每个孔中。申请人通过上下剧烈吸移20次而直接将细胞解离。将20%的再悬浮体积铺进准备的复制平板中,以保存克隆系。之后每2-3d更换培养基并相应地传代。65|使用剩余的80%细胞进行dna分离和基因分型。任选的:通过稀释分离克隆细胞系。定时·2-3h亲身实践的;2-3周扩展66|申请人如上所述地将细胞从24孔平板上解离。确保解离成单细胞。可以使用细胞滤网防止细胞聚集。67|在每个条件下对细胞的数目计数。将每个条件连续稀释于d10培养基中至终浓度为0.5个细胞/100ul。对于每个96孔平板,申请人推荐稀释至终计数为12ml的d10中有60个细胞。推荐将细胞数目的精确计数用于适当的克隆稀释。可以在中间的连续稀释阶段中对细胞重新计数以保证精确度。68|使用多通道移液管将100ul的稀释的细胞吸移进96孔平板的每个孔中。注意。可以将细胞的剩余部分保存并用于以群体水平进行基因分型,以测量整体修饰效率。69|铺板后~1周申请人检查了菌落的“克隆”外观:从中心点辐射的圆菌落。划出可能已经接种有双联体或多联体的孔。70|申请人将细胞返回恒温箱总并允许它们扩增2-3周。如在上节中详细说明的,根据需要为细胞重新给料。用于crispr切割效率的surveyor测定。定时·5-6h在测定转染细胞的切割效率之前,申请人推荐使用以下描述的方案在阴性(未转染的)对照样品上通过surveyor核酸酶消化步骤测试每个新的surveyor引物。偶然地,甚至单条带的干净的surveyorpcr产物可以产生非特异的surveyor核酸酶切割条带并潜在地干扰准确的插入缺失分析。71|收获细胞的dna。将细胞解离并以200xg旋降,持续5m。注意.根据需要在此阶段需要复制平板,以保存转染细胞系。72|完全地抽出上清液。73|申请人根据制造商的说明书使用quickextractdna提取溶液。申请人典型地为24孔平板的每个孔使用50ul的溶液并为96孔平板的每个孔使用10ul的溶液。74|申请人用ddh2o将提取的dna标准化至终浓度为100-200ng/ul。暂停点:可以将提取的dna存储在-20℃下,持续若干个月。75|设置surveyorpcr。使用由申请人的在线/计算机算法工具提供的surveyor引物将以下项预混合:76|申请人为每个反应添加了100-200ng的来自步骤74的标准化的基因组dna模板。77|使用以下循环条件进行pcr反应,持续不超过30个扩增循环:78|申请人使2-5ul的pcr产物在1%凝胶上跑胶,以检查单条带产物。尽管将这些pcr条件设计为与大部分surveyor引物对一起工作,但是一些引物可能需要通过调节模板浓度、mgcl2浓度和/或退火温度而进行另外的优化。79|申请人使用qiaquickpcr纯化试剂盒与标准化洗脱液纯化了pcr反应至20ng/ul。暂停点:可以将纯化的pcr产物存储在-20℃下。80|dna异源双链体形成。如下设置退火反应:81|使用以下条件使反应退火:82|surveyor核酸酶s消化。申请人制备了预混合液并将冰上的以下组分添加至来自步骤81的退火的异源双链体,总终体积为25ul:83|使孔涡旋并旋降。将反应在42℃下孵育1h。84|任选的:可以添加2ul来自surveyor试剂盒的终止溶液。暂停点.可以将消化的产物存储在-20℃下用于稍后的分析。85|可视化surveyor反应。可以在2%琼脂糖凝胶上使surveyor核酸酶消化产物可视化。用于更好地拆分,可以使产物在4%-20%梯度聚丙烯酰胺tbe凝胶上跑胶。申请人用推荐的加样缓冲液加样了10ul的产物并根据制造商的说明书在凝胶上跑胶。典型地,申请人跑胶直到溴酚蓝染料已经迁移到凝胶的底部。同一凝胶上包括dna梯和阴性对照。86|申请人用稀释于tbe中的1xsybrgold染料将凝胶染色。将凝胶轻轻地摇动15m。87|申请人使用定量成像系统使凝胶成像而未过度暴露这些条带。阴性对照应该仅具有一个对应于pcr产物的尺寸的条带,但是可以偶尔具有其他尺寸的非特异的切割条带。如果它们与靶切割条带在尺寸上不同,则这些条带将不干扰分析。由申请人的在线/计算机算法工具提供的靶切割条带尺寸的总和应该等于pcr产物的尺寸。88|估计切割强度。申请人使用imagej或其他凝胶定量软件定量了积分强度。89|对于每个泳道,申请人使用以下公式计算了切割的pcr产物的分数(f切割):f切割=(b+c)/(a+b+c),其中a是未消化的pcr产物的积分强度并且b和c是每个切割产物的积分强度。90|可以使用以下公式基于双链体形成的二项式概率分布估计切割效率:91|用于评估crispr切割效率的桑格测序。定时·3d初始步骤与surveyor测定的步骤71-79相同。注意:如果将适当的限制酶切位点附加至正向和反向引物上,则可以将surveyor引物用于桑格测序。对于克隆进推荐的puc19骨架中,可以使用ecori用于fwd引物并使用hindiii用于rev引物。92|扩增子消化。如下设置消化反应:93|puc19骨架消化。如下设置消化反应:94|申请人使用qiaquickpcr纯化试剂盒纯化了消化反应。暂停点:可以将纯化的pcr产物存储在-20℃下。95|申请人如下以1:3载体:插入片段比例将消化的puc19骨架与桑格扩增子连接:96|转化。申请人根据与细胞一起提供的方案将plasmidsafe处理的质粒转化进感受态大肠杆菌菌株中。申请人推荐stbl3用于迅速转化。简言之,将5ul来自步骤95的产物添加进20ul的冰冷的化学感受态stbl3细胞中,在冰上孵育10m,在42℃下热休克30s,立即返回冰上持续2m,添加100ul的soc培养基,并在包含100ug/ml氨苄西林的lb平板上铺板。将其在37℃下孵育过夜。97|第2天:申请人检查了平板的菌落生长情况。典型地,在阴性对照平板上不存在菌落(仅连接了ecori-hindiii消化的puc19,没有桑格扩增子插入片段),并且在puc19-桑格扩增子克隆平板上存在数十至数百个菌落。98|第3天:申请人根据制造商的说明书使用qiaprepspinminiprep试剂盒从过夜培养物中分离出质粒dna。99|桑格测序。申请人通过使用puc19-for引物从puc19骨架测序证实了每个菌落的序列。申请人参照了预期的基因组dna序列的测序结果,以检查cas9诱导的nhej突变的存在。%编辑效率=(#修饰的克隆)/(#总克隆)。重要的是挑选合理数目的克隆(>24),以产生准确的修饰效率。微小缺失的基因分型。定时·2-3d亲身实践的;2-3周扩展100|如上所述的,用一对靶向有待缺失的区域的sgrna转染细胞。101|转染后24h,如上所述的,通过facs或连续稀释分离克隆系。102|将细胞扩增2-3周。103|如上所述的,申请人使用10ulquickextract溶液从克隆系中收获了dna并用ddh2o将基因组dna标准化至终浓度为50-100ng/ul。104|pcr扩增修饰的区域。如下设置pcr反应:注意:如果缺失尺寸超过1kb,用in-fwd和in-rev引物设置一套平行的pcr反应,以筛选野生型等位基因的存在。105|为了筛选倒置,如下设置pcr反应:注意:引物作为外-fwd+内fwd或外-rev+内-rev而配对。106|申请人为每个反应添加了100-200ng的来自步骤103的标准化的基因组dna模板。107|使用以下循环条件进行pcr反应:108|申请人使2-5ul的pcr产物在1%-2%凝胶上跑胶,以检查产物。尽管将这些pcr条件设计为与大部分引物一起工作,但是一些引物可能需要通过调节模板浓度、mgcl2浓度和/或退火温度而进行另外的优化。经由hdr针对靶向修饰进行基因分型。定时·2-3d,2-3h亲身实践的109|如上所述的,申请人使用quickextract溶液收获了dna并用te将基因组dna标准化至终浓度为100-200ng/ul。110|pcr扩增修饰的区域。如下设置pcr反应:111|申请人为每个反应添加了100-200ng的来自步骤109的基因组dna模板并按以下程序跑胶。112|申请人使5ul的pcr产物在0.8%-1%凝胶上跑胶,以检查单条带产物。引物可能需要通过调节模板浓度、mgcl2浓度和/或退火温度而进行另外的优化。113|申请人使用qiaquickpcr纯化试剂盒纯化了pcr反应。114|在hdr实例中,将hindiii限制酶切位点插入emx1基因中。通过限制酶切消化pcr扩增子而对其进行检测:i.将dna在37℃下消化10m:ii.申请人使10ul具有加样染料的消化的产物在4%-20%梯度聚丙烯酰胺tbe凝胶上跑胶,直到二甲苯蓝条带已经迁移到凝胶的底部。iii.申请人用1xsybrgold染料将凝胶染色同时摇动15m。iv.如上在surveyor测定章节中所述的,使切割产物成像并对其进行定量。通过以下公式估计hdr效率:(b+c)/(a+b+c),其中a是未消化的hdrpcr产物的积分强度,并且b和c是hindiii-切割片段的积分强度。115|可替代地,可以克隆来自步骤113的纯化的pcr扩增子并使用桑格测序或ngs进行基因分型。深度测序和脱靶分析·定时1-2d在线crispr靶标设计工具针对每个鉴定的靶位点产生了候选基因组脱靶位点。可以通过surveyor核酸酶测定、桑格测序或下一代深度测序进行这些位点处的脱靶分析。鉴于这些位点中的许多处的修饰率较低或不可检测的可能性,申请人推荐用illuminamiseq平台进行深度测序,用于获得较高的灵敏度和精确度。方案将随测序平台而变化;在此,申请人简要地描述了一种用于附接测序适配子的融合pcr方法。116|设计深度测序引物。为较短的扩增子设计下一代测序(ngs)引物,这些扩增子典型地在100-200bp尺寸范围内。可以使用ncbi引物-blast手动地设计引物或用在线crispr靶标设计工具产生(网站为genome-engineering.org/tools)。117|从cas9靶向的细胞中收获基因组dna。用ddh2o将quickextract基因组dna标准化至100-200ng/ul。118|初始文库制备pcr。使用来自步骤116的ngs引物准备初始文库制备pcr119|为每个反应添加100-200ng的标准化的基因组dna模板。120|使用以下循环条件进行pcr反应,持续不超过20个扩增循环:121|使2-5ul的pcr产物在1%凝胶上跑胶,以检查单条带产物。与基因组dnapcr一样,ngs引物可能需要通过调节模板浓度、mgcl2浓度和/或退火温度而进行另外的优化。122|使用qiaquickpcr纯化试剂盒纯化pcr反应并用洗脱液标准化至20ng/ul。暂停点:可以将纯化的pcr产物存储在-20℃下。123|nexteraxtdna样品制备试剂盒。遵循制造商的方案,用独特的条形码为每个样品产生miseq测序就绪的文库。124|分析测序数据。可以通过读取比对程序(如clustalw、geneious或简单的序列分析脚本)进行脱靶分析。定时步骤1-2设计并合成sgrna寡核苷酸和ssodn:1-5d,取决于供应商而可变步骤3-5构建crispr质粒或pcr表达盒:2h至3d步骤6-53转染进细胞系中:3d(1h亲身实践时间)步骤54-70任选地衍生克隆系:1-3周,取决于细胞类型而可变步骤71-91经由surveyor对nhej进行功能验证:5-6h步骤92-124经由桑格或下一代深度测序进行基因分型:2-3d(3-4h亲身实践时间)解决在此的实例涉及的情况讨论可以容易地将crispr-cas多元化,以促进同时修饰若干基因并以较高效率介导染色体微小缺失。申请人使用了两种sgrna展示以高达68%的效率同时靶向hek293ft细胞中的人类grin2b和dyrk1a座位。同样地,可以使用一对sgrna介导微小缺失,如切除外显子,可以通过pcr在克隆水平上对微小缺失进行基因分型。注意的是外显子接合的精确位置可以变化。申请人还展示了使用ssodn和靶向载体在hek293ft和hues9细胞中用cas9的野生型和切口酶突变体两者介导hdr(图30)。注意的是申请人还不能使用cas9切口酶在hues9细胞中检测到hdr,这可能是归因于在hues9细胞中效率较低或修复活性方面的潜在差异。尽管这些值是典型的,但是给定的sgrna的切割效率仍存在一些可变性,并且在个别情况下某些sgrna可能不工作,究其原因仍是未知的。申请人推荐为每个座位设计两种sgrna,并在预期的细胞类型中测试其效率。实例31:nlscas9转录调节剂:申请人着手将cas9/grnacrispr系统变成通用的dna结合系统,在该系统中可以执行超过dna切割的功能。例如,通过将一个或多个功能结构域融合到无催化活性的cas9上,申请人已经给予了新颖的功能,如转录激活/抑制、甲基化/脱甲基化或染色质修饰。为了完成此目标,申请人通过将两个核酸酶活性必需的残基d10和h840变为丙氨酸而制备了无催化活性的cas9突变体。通过突变这两个残基,cas9的核酸酶活性被消除同时维持结合靶dna的能力。申请人决定聚焦以测试申请人的假设的功能结构域是转录激活因子vp64和转录阻遏子sid和krab。cas9核定位:申请人假设最有效的cas9转录调节剂将牢固地定位于细胞核,在细胞核中它将对转录具有最大的影响。此外,细胞质中的任何残余的cas9都可能具有不想要的作用。申请人确定野生型cas9因为不包括多个核定位信号(nls)而不定位进细胞核中(尽管crispr系统无需具有一个或多个nls,但是有利地具有至少一个或多个nls)。因为需要多个nls序列,所以推断难于将cas9进入细胞核中并且融合到cas9上的任何另外的结构域都可能破坏核定位。因此,申请人制备了四种具有不同nls序列的cas9-vp64-gfp融合构建体(pxrp02-plenti2-ef1a-nls-hspcsn1(10a,840a)-nls-vp64-egfp、pxrp04-plenti2-ef1a-nls-hspcsn1(10a,840a)-nls-vp64-2a-egfp-nls、pxrp06-plenti2-ef1a-nls-egfp-vp64-nls-hspcsn1(10a,840a)-nls、pxrp08-plenti2-ef1a-nls-vp64-nls-hspcsn1(10a,840a)-nls-vp64-egfp-nls)。将这些构建体克隆进处于人类ef1a启动子的表达之下的lenti骨架中。还添加了wpre元件,用于更稳健地表达蛋白质。使用lipofectame2000将每个构建体转染进hek293ft细胞中并在转染后24小时成像。当融合蛋白在该融合蛋白的n-末端和c-末端上都具有nls序列时获得最佳核定位。观察到的最高核定位出现在具有四个nls元件的构建体中。为了更稳健地理解nls元件对cas9的影响,申请人通过将同一α输入蛋白nls序列融合在三个串联重复的看着为零的n-末端或c-末端而制备了16个cas9-gfp融合。使用lipofectame2000将每个构建体转染进hek293ft细胞中并在转染后24小时成像。值得注意地,nls元件的数目不与核定位的范围直接相关。在c-末端上添加nls比在n-末端上添加对核定位具有更大的影响。cas9转录激活因子:申请人通过靶向sox2座位并通过rt-qpcr定量转录激活而在功能上对cas9-vp64蛋白进行了测试。选择了八个dna靶位点来跨sox2的启动子。使用lipofectame2000将每个构建体转染进hek293ft细胞中并且在转染后72小时,从细胞中提取总rna。在40ul反应中,将1ug的rna反转录成cdna(qscriptsupermix)。将2ul的反应产物添加进单个的20ultaqman测定qpcr反应中。在生物和技术上一式三份地进行每个实验。没有rt对照并且没有模板对照反应显示出无扩增。不显示出强烈的核定位的构建体pxrp02和pxrp04导致无激活。对于的确显示出较强的核定位的构建体pxrp08,观察到适度的激活。可以在指导rnasox2.4和sox2.5的情况下观察到统计学上有义意的激活。实例32:体内小鼠数据材料与试剂herculaseii融合聚合酶(安捷伦技术公司,目录号600679)10xne缓冲液4(neb,目录号b7004s)bsaihf(neb,目录号r3535s)t7dna连接酶(enzymatic公司,目录号l602l)快速消化缓冲液,10x(赛默飞世尔科技公司,目录号b64)快速消化noti(赛默飞世尔科技公司,目录号fd0594)fastap碱性磷酸酶(赛默飞世尔科技公司,目录号ef0651)lipofectamine2000(生命技术公司,目录号11668-019)胰蛋白酶(生命技术公司,目录号15400054)forceps#4(西格玛公司,目录号z168777-1ea)forceps#5(西格玛公司,目录号f6521-1ea)10x汉克氏平衡盐溶液(hank’sbalancedsaltsolution)(西格玛公司,目录号h4641-500ml)青霉素/链霉素溶液(生命技术公司,目录号p4333)neurobasal(生命技术公司,目录号21103049)b27添加物(生命技术公司,目录号17504044)l-谷氨酰胺(生命技术公司,目录号25030081)谷氨酸盐(西格玛公司,目录号res5063g-a7)β-巯基乙醇(西格玛公司,目录号m6250-100ml)ha兔抗体(细胞信号传导,目录号3724s)细胞成像试剂盒(生命技术公司,目录号r37601)30g世界精密仪器(worldprecisioninstrument)注射器(世界精密仪器(worldprecisioninstruments),目录号nanofil)立体定位仪(科夫仪器(kopfinstruments))ultramicropump3(世界精密仪器,目录号ump3-4)蔗糖(西格玛公司,目录号s7903)氯化钙(西格玛公司,目录号c1016)乙酸镁(西格玛公司,目录号m0631)tris-hcl(西格玛公司,目录号t5941)edta(西格玛公司,目录号e6758)np-40(西格玛公司,目录号np40)苯甲基磺酰氟(西格玛公司,目录号78830)氯化镁(西格玛公司,目录号m8266)氯化钾(西格玛公司,目录号p9333)β-甘油磷酸酯(西格玛公司,目录号g9422)甘油(西格玛公司,目录号g9012)dyecycletmrubystain(生命技术公司,目录号s4942)facsariaflu-act-细胞分选仪(美国剑桥mit的科赫研究所(kochinstitute)dnaeasyblood&tissue试剂盒(凯杰公司,目录号69504)程序构建在脑中体内使用的grna多元体申请人设计并pcr扩增了靶向小鼠tet和dnmt家族成员的单个的grna(如在此描述的)。在n2a细胞系中评估靶向效率(图33)。为了在体内获得若干基因的同时修饰,在aav包装的载体中对有效的grna进行多元化(图34)。为了促进系统效率的进一步分析,申请人向该系统上添加了与人类突触蛋白i启动子的控制之下的gfp-kash结构域融合蛋白一致的表达盒(图34)。此修饰允许在神经元群体中进一步分析系统效率(更详细的程序参见章节分选细胞核与体内结果)。使用以下引物使用herculaseii融合聚合酶pcr扩增该系统的所有4个部分:第一u6fw:gagggtctcgtccttgcggccgcgctagcgagggcctatttcccatgattc第一grnarv:ctcggtctcggtaaaaaagcaccgactcggtgccactttttcaagttgataacggactagccttattttaacttgctatttctagctctaaaacnnnnnnnnnnnnnnnnnnnnggtgtttcgtcctttccac第二u6fw:gagggtctctttaccggtgagggcctatttcccatgattcc第二grnarv:ctcggtctcctcaaaaaagcaccgactcggtgccactttttcaagttgataacggactagccttattttaacttgctatttctagctctaaaacnnnnnnnnnnnnnnnnnnnnggtgtttcgtcctttccac第三u6fw:gagggtctctttgagctcgagggcctatttcccatgattc第三grnarv:ctcggtctcgcgtaaaaaagcaccgactcggtgccactttttcaagttgataacggactagccttattttaacttgctatttctagctctaaaacnnnnnnnnnnnnnnnnnnnnggtgtttcgtcctttccahsyn_gfp-kashfw:gagggtctcttacgcgtgtgtctagachsyn_gfp-kashrv:ctcggtctcaaggacagggaagggagcagtggttcacgcctgtaatcccagcaatttgggaggccaaggtgggtagatcacctgagattaggagttgc(nnnnnnnnnnnnnnnnnnnn是反向互补序列靶向的基因组序列)申请人使用了goldengate策略在单步反应中组装了该系统的所有部分(1:1分子比):使用herculaseii融合聚合酶和以下引物pcr扩增goldengate反应产物:fw5’cctgtccttgcggccgcgctagcgagggccrv5’cacgcggccgcaaggacagggaagggagcag使用noti限制酶切位点将pcr产物克隆进aav骨架中在itr序列之间:pcr产物消化:aav骨架消化:在37℃下孵育20min后,使用qiaquickpcr纯化试剂盒纯化样品。如下以1:3载体:插入片段比例连接标准化的样品:用连接反应产物转化细菌后,申请人用桑格测序确认了获得的克隆。与cas9构建体共转染后,在n2a细胞中测试阳性dna克隆(图35和36)。设计用于aav递送的新的cas9构建体尽管其具有独特的功能,aav递送系统具有包装限制-为了成功地在体内递送表达盒,则它的尺寸不得不<4.7kb。为了减少spcas9表达盒的尺寸并促进递送,申请人测试了若干改变:不同启动子、较短的polya信号以及最后是较小版本的来自金黄色葡萄球菌的cas9(sacas9)(图37和38)。所有测试的启动子先前已经被测试并且公开为在神经元中有活性,包括小鼠mecp2(格雷(gray)等人,2011)、大鼠map1b和截短的大鼠map1b(刘(liu)和费舍尔(fischer),1996)。替代性合成polya序列先前也已显示具有功能(莱维特(levitt)等人,1989;格雷(gray)等人,2011)。在用lipofectamine2000转染后,在n2a细胞中表达所有克隆的构建体,并用蛋白质印迹法进行测试(图39)。在初级神经元中测试aav多元系统为了确认研发的系统在神经元中的功能性,申请人使用体外初级神经元培养物。根据先前由班克(banker)和戈斯林(goslin)(班克和戈斯林,1988)公开的方案制备小鼠皮层神经元。第16天,从胚胎中获得神经元细胞。胚胎提取自安乐死的怀孕雌鼠,并且将头部置于冰冷的hbss中。然后,用镊子(#4和#5)从头骨中提取大脑并将其转移至另一个更换的冰冷的hbss中。在立体显微镜和#5镊子的辅助下在填充有冰冷的hbss的皮氏培养皿中进行另外的步。将半球彼此分离并与脑干分离并清除脑膜。然后,非常谨慎地解剖海马并将其置于填充有冰冷的hbss的15ml锥形管中。可以使用在海马解剖后留下的皮层,在除去脑干残留物和嗅球后使用类似的方案进行另外的细胞分离。将分离的海马用10ml冰冷的hbss洗涤三次并通过在37℃下于hbss中用胰蛋白酶孵育15min而解离(4mlhbss,添加10μl2.5%胰蛋白酶/海马)。胰酶消化后,将海马非常谨慎地洗涤三次,以用预加热至37℃的hbss除去任何痕量的胰蛋白酶并在温hbss中解离。申请人通常使用1ml移液管尖端在1mlhbss中解离获得自10-12个胚胎的细胞并稀释解离的细胞直到4ml。将细胞以250个细胞/mm2的密度铺板并在37℃和5%co2下培养长达3周hbss435mlh2o50ml10x汉克氏平衡盐溶液16.5ml0.3mhepesph7.35ml青霉素-链霉素溶液过滤(0.2μm)并存储在4℃下神经元铺板培养基(100ml)97mlneurobasal2mlb27添加物1ml青霉素-链霉素溶液250μl谷氨酰胺125μl谷氨酸用来自hek293ft细胞的过滤培养基的浓缩aav1/2病毒或aav1病毒转导神经元,培养4-7天之间并且在转导后在培养物中保存至少一周,以允许递送的基因表达。aav驱动的系统的表达申请人使用蛋白质印迹法确认了aav递送后spcas9和sacas9在神经元培养物中的表达(图42)。转导后一周,用β-巯基乙醇在nupagesds加样缓冲液中收集神经元,以使蛋白质在95℃下变性5min。将样品在sdspage凝胶上分离并转移到pvdf膜上,用于进行wb蛋白质检测。用ha抗体检测cas9蛋白。用荧光显微镜确认来自grna多元aav的syn-gfp-kash的表达(图50)。毒性为了评估具有crispr系统的aav的毒性,申请人在病毒转导后一周测试了神经元的整体形态(图45)。另外,申请人用细胞成像试剂盒测试了设计的系统的潜在的毒性,该试剂盒允许区分培养物中的活细胞和死细胞。它是基于细胞内酯酶活性的存在(如通过将非荧光钙黄绿素am酶促转化为强烈的绿色荧光钙黄绿素所确定的)。另一方面,该试剂盒的红色的细胞不通透性组分仅进入具有受损膜的细胞并结合到死细胞中的产荧光dna上。两种荧光团都可以容易地用荧光显微镜在活细胞中可视化。aav驱动的cas9蛋白和多元grna构建体在初级皮层神经元中的表达耐受性良好并且无毒(图43和44),这指示设计的aav系统适于体内测试。病毒产生根据描述于麦克卢尔(mcclure)等人,2011中的方法产生浓缩的病毒。上清液病毒产生出现在hek293ft细胞中。脑部手术对于病毒载体注射,通过腹膜内注射用氯胺酮/甲苯噻嗪混合物(氯胺酮剂量为100mg/kg并且甲苯噻嗪剂量为10mg/kg)麻醉的10-15周龄的雄性c57bl/6n小鼠。将腹膜内给予buprenex用作优先购买的镇痛剂(1mg/kg)。使用耳内定位螺柱和齿条将动物固定在kopf立体定位仪中,以维持头骨不动。使用手持电钻,在前囟后面-3.0mm且在海马的ca1区域中的供注射的侧面3.5mm处钻出一个洞(1-2mm)。使用深度为2.5mm的30g世界精密仪器注射器,注射总体积为1ul的aav病毒颗粒溶液。通过流速为0.5ul/min的世界精密仪器ultramicropump3’注射泵监测注射,以防止损伤组织。当完成注射时,以0.5mm/min的速度缓慢地移除注射针。注射后,用6-0爱惜良(ethilon)缝合线将皮肤缝合。在手术后,给动物供应1ml乳酸林格氏溶液(皮下的)并放在温度受控的(37℃)环境中,直到恢复走动。术后3周,通过深度麻醉将动物处以安乐死,随后除去组织,用于细胞核分选或用4%多聚甲醛灌注用于免疫化学。分选细胞核与体内结果申请人设计了一种的方法以用gfp特异地在遗传上标记grna靶向的神经元细胞核,用以标记的细胞核的荧光激活细胞分选术(facs)以及并dna、rna和核内蛋白的下游加工。为了这个目的,诸位申请人的多元靶向载体被设计成表达在gfp与小鼠细胞核膜蛋白结构域kash(斯塔尔da(starrda),2011,《当代生物学》(currentbiology))之间的融合蛋白和用于靶向特定的感兴趣的基因座位的3个grna(图34)。在人类突触蛋白启动子的控制之下表达gfp-kash,以特异性标记神经元。融合蛋白gfp-kash的氨基酸是:mvskgeelftgvvpilveldgdvnghkfsvsgegegdatygkltlkficttgklpvpwptlvttltygvqcfsrypdhmkqhdffksampegyvqertiffkddgnyktraevkfegdtlvnrielkgidfkedgnilghkleynynshnvyimadkqkngikvnfkirhniedgsvqladhyqqntpigdgpvllpdnhylstqsalskdpnekrdhmvllefvtaagitlgmdelyksglrsreeeeetdsrmphldspgssqprrsflsrviraalplqlllllllllacllpaseddysctqannfarsfypmlrytngppptaav1/2介导的递送进入脑后一周,观察到gfp-kash的稳健表达。对于facs和标记的细胞核的下游加工,术后3周将海马解剖并加工,用于使用梯度离心步骤进行细胞核纯化。为了这个目的,使用2mldounce均质机(西格玛公司)将组织在320mm蔗糖、5mmcacl、3mmmg(ac)2、10mmtrisph7.8、0.1mmedta、0.1%np40、0.1mm苯甲基磺酰氟(pmsf)、1mmβ-巯基乙醇中均质化。根据制造商的方案,将匀浆在4℃下以3.500rpm以25%至29%梯度离心30min。将细胞核沉淀物再悬浮于340mm蔗糖、2mmmgcl2、25mmkcl、65mm甘油磷酸酯、5%甘油、0.1mmpmsf、1mmβ-巯基乙醇中并向标记的细胞核中添加dyecycletmrubystain(生命技术公司)(为dna提供近红外发射)。使用ariaflu-act-细胞分选仪和bdfacsdiva软件通过facs分选标记的和纯化的细胞核。最后,使用dnaeasyblood&tissue试剂盒(凯杰公司),将分选的gfp+和gfp-细胞核用于纯化基因组dna,用于对靶向的基因组区域进行surveyor测定分析。可以容易地使用同一途径从靶向的细胞中纯化出细胞核rna或蛋白质,用于下游加工。由于2-载体系统(图34),诸位申请人在此途径中使用有效的cas9介导的dna切割预期仅在脑中的一小部分的细胞中出现(用多元靶向载体和cas9编码载体两者共转染的细胞)。在此描述的方法使得诸位申请人可以从表达3种感兴趣的grna并且因此应该会经历cas9介导的dna切割的细胞群体中特异地纯化出dna、rna和核内蛋白。通过使用此方法,诸位申请人能够可视化仅发生在一小部分的细胞中的有效的体内dna切割。实质上,申请人在此显示的是靶向的体内切割。此外,申请人使用了一种多元途径,其中同时但是独立地靶向若干不同序列。呈现的系统可以适于研究脑部病理病症(基因敲除,例如帕金森病)并且还为进一步研发脑中的基因组编辑工具开辟了一个领域。通过将核酸酶活性替换为基因转录调节剂或表观遗传调节剂,可以回答关于脑中的基因调节和表观改变不仅在病理病症而且在生理过程(如学习和记忆形成)中的作用的整个范围的科学问题。最后,呈现的技术可以应用于更复杂的哺乳动物系统(如灵长类)中,该技术允许克服当前的技术局限。实例33:模型数据已经具体研究了若干疾病模型。这些疾病模型包括新生(denovo)自闭症风险基因chd8、katnal2和scn2a;以及综合征性自闭症(安格曼综合征(angelmansyndrome))基因ube3a。这些基因以及生成的自闭症模型当然是优选的,但是显示本发明可以被应用于任何基因并且因此任何模型都是可能的。申请人已经使用cas9核酸酶在人类胚胎干细胞(hesc)中制备了这些细胞系。通过用cbh-cas9-2a-egfp和pu6-sgrna瞬时转染hesc而建立了这些系。为最经常地靶向相同外显子的每个基因设计了两种sgrna,在这些外显子中患者无义(敲除)突变最近已经由自闭症患者的全外显子组测序研究得到描述。为此项目特异建立了cas9-2a-egfp和pu6质粒。实例34:aav产生系统或方案在此提供了为高通量筛选用途研发并且与其一起工作特别好的aav产生系统或方案,但是它在本发明中也具有较广泛的适用性。操纵内源基因表达提出了各种挑战,因为表达率取决于许多因素,包括调节元件、mrna加工和转录本稳定性。为了克服此挑战,申请人研发了一种用于供递送的基于腺相关病毒(aav)的载体。aav具有一个基于ssdna的基因组并且因此较不易受重组影响。aav1/2(血清型aav1/2,即杂交体或嵌合体aav1/aav2衣壳aav)肝素纯化的浓缩病毒方案培养基:d10+hepes500ml瓶dmem高葡萄糖+glutamax(gibco)50mlhyclonefbs(热灭活的)(赛默飞世尔)5.5mlhepes溶液(1m,gibco)细胞:低传代hek293ft(产生病毒时传代<10次,解冻新的传代2-4次的细胞用于产生病毒,生长直到3-5次传代)转染试剂:聚乙烯亚胺(pei)“max”将50mgpei“max”溶解于50ml无菌的超纯h20中将ph调节至7.1用0.22umfliptop过滤器过滤用封口膜将管和包裹物密封在-20℃下将等分部分冷冻(用于存储,也可以立即使用)细胞培养在d10+hepes中培养低传代hek293ft每天传代1:2与1:2.5之间有利地不允许达到细胞超过85%的汇合对于t75-温10mlhbss(-mg2+,-ca2+,gibco)+1mltrypleexpress(gibco)/烧瓶至37℃(水浴)完全地抽出培养基-轻轻地添加10ml温hbss(以完全洗掉培养基)-添加1mltryple/烧瓶-将烧瓶在恒温箱(37℃)中放置1min-摇动烧瓶以使细胞脱离开-添加9mld10+hepes培养基(37℃)-上下吸移5次,以产生单细胞悬浮液-以1:2-1:2.5(对于t75,是12ml培养基)比例分离(如果细胞生长更缓慢,则丢弃并解冻新的批次,它们未处于最佳生长)-当存在足够的细胞时即转移至t225中(对于易于处理大量的细胞)aav产生(5*15cm培养皿尺度/构建体):将21.5ml培养基中的1千万个细胞铺进15cm培养皿中在37℃下孵育18-22小时在80%汇合处转染是理想的每个平板预温的22ml培养基(d10+hepes)准备具有dna混合物的管(使用无内毒素大量质粒提取dna(endofreemaxiprepdna)):5.2ug感兴趣的质粒载体4.35ugaav1血清型质粒4.35ugaav2血清型质粒10.4ugpdf6质粒(腺病毒辅助基因)涡旋至混合添加434uldmem(无血清!)添加130ulpei溶液涡旋5-10秒向预温的培养基添加dna/dmem/pei混合物简单地涡旋至混合将15cm培养皿中的培养基替换为dna/dmem/pei混合物返回37℃恒温箱中收获之前孵育48h(确保培养基没有变得太酸)收获病毒:1.将培养基谨慎地从15cm培养皿中抽出(有利地不要移动细胞)2.向每个平板中添加25mlrtdpbs(英杰公司)并用细胞刮棒轻轻地移除细胞。将悬浮液收集在50ml管中。3.将细胞在800xg下沉淀10分钟。4.丢弃上清液暂停点:希望的话,将细胞沉淀物冷冻在-80c下5.将沉淀物再悬浮于150mmnacl、20mmtrisph8.0中,每个组织培养平板使用10ml。6.在dh2o中制备10%脱氧胆酸钠的新鲜溶液。向每个组织培养平板中添加1.25ml的此溶液至终浓度为0.5%。添加benzonase核酸酶,至终浓度为50个单位/ml。将管充分混合。7.在37℃下孵育1小时(水浴)。8.通过在3000xg下离心15min除去细胞碎片。转移至干净的50ml管中并且保证已经除去所有的细胞碎片,以防止堵塞肝素柱。aav1/2的肝素柱纯化:1.使用蠕动泵设置hitrap肝素柱,这样使得溶液以每分钟1ml流过该柱。重要的是保证没有将气泡引入进该肝素柱中。2.使用蠕动泵,用10ml150mmnacl、20mmtris(ph8.0)平衡该柱。3.病毒的结合:向柱上施加50ml病毒溶液并允许流过。4.洗涤步骤1:用20ml100mmnacl、20mmtris(ph8.0)洗涤柱。(使用蠕动泵)5.洗涤步骤2:使用3ml或5ml注射器继续用1ml200mmnacl、20mmtris(ph8.0)洗涤该柱,随后用1ml300mmnacl、20mmtris(ph8.0)洗涤。丢弃流过物(flow-through)。(在以上病毒溶液流过50min过程中准备具有不同缓冲液的注射器)6.洗脱使用5ml注射器和轻压(流速<1ml/min)通过施加以下项将病毒从该柱上洗脱下来:1.5ml400mmnacl,20mmtris,ph8.03.0ml450mmnacl,20mmtris,ph8.01.5ml500mmnacl,20mmtris,ph8.0将这些收集在15ml离心管中。aav1/2的浓度:1.浓缩步骤1:使用具有100,000分子量截留的amiconultra15ml离心过滤装置浓缩洗脱的病毒。将柱洗脱物加样进浓缩器中并在2000xg下离心2分钟(在室温下)。检查浓缩体积-它应该是大约500μl。必要的话,以1min间隔离心,直到达到正确体积。2.缓冲液交换:向过滤装置中添加1ml无菌dpbs,以1min间隔离心,直到达到正确体积(500ul)。3.浓缩步骤2:向amiconultra0.5ml100k过滤装置中添加500ul浓缩物。在6000g下离心2min。检查浓缩体积-它应该是大约100μl。必要的话,以1min间隔离心,直到达到正确体积。4.回收:倒置滤芯并插入新鲜的收集管中。在1000g下离心2min。等分并在-80℃下冷冻每个注射位点典型地需要1ul,因此推荐小的等分部分(例如5ul)(避免冻融病毒)。使用qpcr确定dnasei-抗性gc粒子效价(参见分离方案)材料amiconultra,0.5ml,100k;密理博公司;ufc510024amiconultra,15ml,100k;密理博公司;ufc910024benzonase核酸酶;西格玛-奥德里奇公司,e1014hitrap肝素柱体;西格玛-奥德里奇公司;54836脱氧胆酸钠;西格玛-奥德里奇公司;d5670aav1上清液产生方案培养基:d10+hepes500ml瓶dmem高葡萄糖+glutamax(英杰公司)50mlhyclonefbs(热灭活的)(赛默飞世尔)5.5mlhepes溶液(1m,gibco)细胞:低传代hek293ft(产生病毒时传代<10次)解冻新的传代2-4次的细胞用于产生病毒,生长直到2-5次传代转染试剂:聚乙烯亚胺(pei)“max”将50mgpei“max”溶解于50ml无菌的超纯h20中将ph调节至7.1用0.22umfliptop过滤器过滤用封口膜将管和包裹物密封在-20℃下将等分部分冷冻(用于存储,也可以立即使用)细胞培养在d10+hepes中培养低传代hek293ft每天传代1:2与1:2.5之间有利地一定让细胞达到超过85%的汇合对于t75-温10mlhbss(-mg2+,-ca2+,gibco)+1mltrypleexpress(gibco)/烧瓶至37℃(水浴)-完全地抽出培养基-轻轻地添加10ml温hbss(以完全洗掉培养基)-添加1mltryple/烧瓶-将烧瓶在恒温箱(37℃)中放置1min-摇动烧瓶以使细胞脱离开-添加9mld10+hepes培养基(37℃)-上下吸移5次,以产生单细胞悬浮液-以1:2-1:2.5(对于t75,是12ml培养基)比例分离(如果细胞生长更缓慢,则丢弃并解冻新的批次,它们未处于最佳生长)-当存在足够的细胞时即转移至t225中(对于易于处理大量的细胞)aav产生(单个15cm培养皿尺度)将21.5ml培养基中的1千万个细胞铺进15cm培养皿中在37℃下孵育18-22小时在每个平板80%汇合处转染是理想的预温的22ml培养基(d10+hepes)准备具有dna混合物的管(使用无内毒素大量质粒提取dna(endofreemaxiprepdna)):5.2ug感兴趣的质粒载体8.7ugaav1血清型质粒10.4ugdf6质粒(腺病毒辅助基因)涡旋至混合添加434uldmem(无血清!)添加130ulpei溶液涡旋5-10秒向预温的培养基添加dna/dmem/pei混合物简单地涡旋至混合将15cm培养皿中的培养基替换为dna/dmem/pei混合物返回37℃恒温箱中收获之前孵育48h(有利地进行监测,以保证培养基没有变得太酸)收获病毒:从15cm培养皿中除去上清液用0.45um过滤器过滤(较低的蛋白质结合)等分并在-80℃下冷冻转导(24孔格式中的原代神经元培养物,5div)将有待转导的神经元的每个孔中的完全neurobasal培养基替换为新鲜的neurobasal(通常替换每个孔中的500ul中的400ul)在37℃水浴中解冻aav上清液在恒温箱中平衡30min向每个孔中添加250ulaav上清液在37℃下孵育24h移除培养基/上清液并替换为新鲜的完全neurobasal48h后表达开始可见,感染后6-7天左右饱和具有goi的paav质粒的构建体不应该超过4.8kb(包括两个itrs)。人类密码子优化序列(即针对在人类中的表达而优化的)序列的实例:下面提供了sacas9:accggtgccaccatgtacccatacgatgttccagattacgcttcgccgaagaaaaagcgcaaggtcgaagcgtccatgaaaaggaactacattctggggctggacatcgggattacaagcgtggggtatgggattattgactatgaaacaagggacgtgatcgacgcaggcgtcagactgttcaaggaggccaacgtggaaaacaatgagggacggagaagcaagaggggagccaggcgcctgaaacgacggagaaggcacagaatccagagggtgaagaaactgctgttcgattacaacctgctgaccgaccattctgagctgagtggaattaatccttatgaagccagggtgaaaggcctgagtcagaagctgtcagaggaagagttttccgcagctctgctgcacctggctaagcgccgaggagtgcataacgtcaatgaggtggaagaggacaccggcaacgagctgtctacaaaggaacagatctcacgcaatagcaaagctctggaagagaagtatgtcgcagagctgcagctggaacggctgaagaaagatggcgaggtgagagggtcaattaataggttcaagacaagcgactacgtcaaagaagccaagcagctgctgaaagtgcagaaggcttaccaccagctggatcagagcttcatcgatacttatatcgacctgctggagactcggagaacctactatgagggaccaggagaagggagccccttcggatggaaagacatcaaggaatggtacgagatgctgatgggacattgcacctattttccagaagagctgagaagcgtcaagtacgcttataacgcagatctgtacaacgccctgaatgacctgaacaacctggtcatcaccagggatgaaaacgagaaactggaatactatgagaagttccagatcatcgaaaacgtgtttaagcagaagaaaaagcctacactgaaacagattgctaaggagatcctggtcaacgaagaggacatcaagggctaccgggtgacaagcactggaaaaccagagttcaccaatctgaaagtgtatcacgatattaaggacatcacagcacggaaagaaatcattgagaacgccgaactgctggatcagattgctaagatcctgactatctaccagagctccgaggacatccaggaagagctgactaacctgaacagcgagctgacccaggaagagatcgaacagattagtaatctgaaggggtacaccggaacacacaacctgtccctgaaagctatcaatctgattctggatgagctgtggcatacaaacgacaatcagattgcaatctttaaccggctgaagctggtcccaaaaaaggtggacctgagtcagcagaaagagatcccaaccacactggtggacgatttcattctgtcacccgtggtcaagcggagcttcatccagagcatcaaagtgatcaacgccatcatcaagaagtacggcctgcccaatgatatcattatcgagctggctagggagaagaacagcaaggacgcacagaagatgatcaatgagatgcagaaacgaaaccggcagaccaatgaacgcattgaagagattatccgaactaccgggaaagagaacgcaaagtacctgattgaaaaaatcaagctgcacgatatgcaggagggaaagtgtctgtattctctggaggccatccccctggaggacctgctgaacaatccattcaactacgaggtcgatcatattatccccagaagcgtgtccttcgacaattcctttaacaacaaggtgctggtcaagcaggaagagaactctaaaaagggcaataggactcctttccagtacctgtctagttcagattccaagatctcttacgaaacctttaaaaagcacattctgaatctggccaaaggaaagggccgcatcagcaagaccaaaaaggagtacctgctggaagagcgggacatcaacagattctccgtccagaaggattttattaaccggaatctggtggacacaagatacgctactcgcggcctgatgaatctgctgcgatcctatttccgggtgaacaatctggatgtgaaagtcaagtccatcaacggcgggttcacatcttttctgaggcgcaaatggaagtttaaaaaggagcgcaacaaagggtacaagcaccatgccgaagatgctctgattatcgcaaatgccgacttcatctttaaggagtggaaaaagctggacaaagccaagaaagtgatggagaaccagatgttcgaagagaagcaggccgaatctatgcccgaaatcgagacagaacaggagtacaaggagattttcatcactcctcaccagatcaagcatatcaaggatttcaaggactacaagtactctcaccgggtggataaaaagcccaacagagagctgatcaatgacaccctgtatagtacaagaaaagacgataaggggaataccctgattgtgaacaatctgaacggactgtacgacaaagataatgacaagctgaaaaagctgatcaacaaaagtcccgagaagctgctgatgtaccaccatgatcctcagacatatcagaaactgaagctgattatggagcagtacggcgacgagaagaacccactgtataagtactatgaagagactgggaactacctgaccaagtatagcaaaaaggataatggccccgtgatcaagaagatcaagtactatgggaacaagctgaatgcccatctggacatcacagacgattaccctaacagtcgcaacaaggtggtcaagctgtcactgaagccatacagattcgatgtctatctggacaacggcgtgtataaatttgtgactgtcaagaatctggatgtcatcaaaaaggagaactactatgaagtgaatagcaagtgctacgaagaggctaaaaagctgaaaaagattagcaaccaggcagagttcatcgcctccttttacaacaacgacctgattaagatcaatggcgaactgtatagggtcatcggggtgaacaatgatctgctgaaccgcattgaagtgaatatgattgacatcacttaccgagagtatctggaaaacatgaatgataagcgcccccctcgaattatcaaaacaattgcctctaagactcagagtatcaaaaagtactcaaccgacattctgggaaacctgtatgaggtgaagagcaaaaagcaccctcagattatcaaaaagggctaagaattc实例35:使用cas9切口酶和两种指导rna最小化脱靶切割cas9是一种可以在20bprna指导的帮助下靶向基因组中的特定位置的rna-指导的dna核酸酶。然而,该指导序列可以容忍指导序列与dna-靶序列之间的一些错配。当该指导rna将cas9靶向具有几个与该指导序列不同的碱基的脱靶序列时,归因于脱靶切割的可能性,该灵活性是不令人希望的。对于所有实验应用(基因靶向、作物工程、治疗应用等),重要的是能够改进cas9介导的基因靶向的特异性并减少cas9的脱靶修饰的可能性。申请人研发了一种使用与两种指导rna组合的cas9切口酶突变体以促进基因组中的靶向的双链断裂而无脱靶修饰的方法。可以通过使其切割活性无效而从cas9核酸酶产生cas9切口酶突变体,这样使得并非切割dna双链体的两条链,仅仅切割一条链。可以通过在cas9核酸酶的一个或多个结构域(例如ruvc1或hnh)中诱导突变而产生cas9切口酶。这些突变可以包括但不限于cas9催化结构域中的突变,例如在spcas9中,这些突变可以在位置d10或h840处。这些突变可以包括但不限于spcas9中的d10a、e762a、h840a、n854a、n863a或d986a,但是可以通过在其他crispr酶或cas9直向同源物中在对应的位置处诱导突变而产生切口酶。在本发明的一个最优选的实施例中,该cas9切口酶突变体是一种具有d10a突变的spcas9切口酶。这工作的方式是与cas9切口酶组合的每个指导rna都将诱导双螺旋dna靶标的靶向的单链断裂。由于每个指导rna切口一条链,所以最终结果是双链断裂。此方法消除脱靶突变的原因是因为非常不可能存在与两种指导序列都具有较高水平的相似性的脱靶位点(20bp+2bp(pam)=22bp针对每个指导的特异性,并且两种指导意味着任何脱靶位点将不得不具有接近于44bp的同源序列)。尽管仍可能的是单独的指导可能具有脱靶,但是那些脱靶将仅仅是带切口的,这不可能会被诱变的nhej过程修复。因此,dna双链切口的多元化提供了一种强有力的引入靶向的dna双链断裂而无脱靶诱变效应的方式。申请人进行了以下实验,这些实验涉及用编码cas9(d10a)切口酶的质粒以及一种或多种指导物的dna表达盒共转染hek293ft细胞。申请人使用lipofectamine2000转染了细胞,并且在转染后转染48或72小时收获了细胞。如在此先前所所描述的,使用surveyor核酸酶测定检测双切口诱导的nhej(图51、52和53)。申请人进一步鉴定了涉及当与两种指导rna结合时通过cas9切口酶突变体的有效切割的参数,并且这些参数包括但不限于该5’突出端的长度。针对具有至少26个碱基对的5’突出端报道了有效的切割。在本发明的一个优选实施例中,5’突出端是至少30个碱基对并且更优选至少34个碱基对。长达200个碱基对的突出端对于切割而言可以是可接受的,然而少于100个碱基对的5’突出端是优选的并且少于50个个碱基对的5’突出端是最优选的(图54和55)。实例36:行为方案高架十字迷宫。使用高架十字迷宫评估焦虑样行为,从而探索啮齿动物在开放区域中具有的先天性恐惧与它们希望探索新颖环境之间的冲突。用于高架十字迷宫测试的仪器由不锈钢制成并且由四个长35cm并且宽5cm的臂组成(两个开放的没有壁并且两个由15cm高的壁封闭)。迷宫的每个臂都附接到坚固的金属腿上,这样使得它被抬离地面40cm:将小鼠以多达每笼三只放入12hr光暗循环的随意获得食物和水的房间中。在光线明亮的房间中在上午9:00与下午6:00之间进行行为测试。在第一次试验开始前30min,将所有包含小鼠的笼转移至行为测试房间中。将一只小鼠从其笼中取出并放在开放与关闭臂的接点处,使开放臂朝向与实验者相反的方向并且让小鼠自由地探索迷宫持续5min。在该时间过程中,记录动物并追踪行为。用noldus软件自动测量在开放臂中行进的总距离、在开放臂中花费的时间、在臂之间转换的总次数以及进入开放臂的等待时间。在5-min测试结束时,将啮齿动物从十字迷宫中移出并放入运输笼中。放入到其居住笼内。在用另一只小鼠测试之前,将高架十字迷宫谨慎地清理并用纸巾干燥。恐惧条件化动物:4周龄雄鼠(bl6j/57);每组10只足底电击:2s;0.5ma方案设计三个阶段:1.暴露,允许小鼠适应并熟悉训练室。对于不成对的组:适应2min,随后呈现20-sec提示音,随后是80-sec间隔,重复六次。对于成对的组,适应周期为12min。2.训练;为小鼠提供cs和或us刺激物。适应周期-4min。以持续100sec的试验时间(包括试验间间隔)运行涉及音调(cs)和电击(us)的六个条件化试验。对于成对的组,每个试验由20-sec“基线”间隔、20-sec音调呈现、18-sec扫描间隔、2-sec电击和40-sec电击后间隔组成。对于不成对的组,试验是一样的,除省略音调除外。3.测试;观察小鼠响应每个场景以及响应音调和痕量-cs的木僵。每个阶段以24-h间隔出现。允许小鼠在训练(熟悉)和测试(改变的;具有一个格子的平地板,在壁上是bw图形;有香兰素香味)场景下自由运动3min。所有小鼠接受四个100-sec测试试验。对于所有小鼠,每个试验以20-sec间隔开始并且20-sec音调呈现之后是60-sec间隔。评分:所有评分都是基于视频而完成。贯穿每个场景测试暴露和每个100-sec试验时间以5-sec增量观察木僵%。如果动物至少木僵2s,则在每个时间纠缠(timebin)中将木僵评分为1或0。在柱状图上呈现的数据是7只动物的组的平均值,误差棒表示sem。按时间呈现出训练/测试过程和每个点的折线图上的数据是来自6个或4个试验(分别是训练和测试方案)的7只动物的平均值。误差棒表示sem。旷场。广泛地使用旷场(openfield)仪器评估探索行为并对其进行验证以用于在测量焦虑相关行为中使用。将动物放在方形舞台(40x40cm)中持续10min同时记录其行为。为运动的总距离、速度和在舞台中央花费的时间评分。新颖的物体识别。新颖的物体识别测试(nor)是一种用于研究啮齿动物的学习和记忆的流行的测试。它是基于它们与新颖的物体比熟悉的物体相互作用要多的趋势。通常,首先将动物放在仪器中并允许探索物体。规定的间隔后,将动物返回该仪器中,该仪器现在包含熟悉的物体和新颖的物体。通过花费更多的时间与新颖的物体相互作用而区分物体识别。nor任务是特别有吸引力的,因为它不需要外部动机、奖励或惩罚,但是需要一点训练或习惯,并且它可以在相对较短的时间内完成。i预训练:1.到达聚居区之后,允许这些动物适应至少3-7d。2.开始实验之前至少3天,将动物每天处理至少3min/天并暴露于运输惯例。3.熟悉测试环境-实验之前24h,将动物暴露于行为房间中的测试舞台(40x40x35cm,清晰的壁)持续10min。ii物体识别训练:1.将两个‘完全一样的’有待熟悉的(样品)物品放在该仪器的后面左侧和右侧角落中2.将动物放在与样品物品相对的壁的中点,这防止了放置动物中的任何的无意识的偏差,这样使得它更朝向具体侧/物体定向3.实验者正在使用照相机记录动物行为,呆在帘子后面,以便不为动物充当暗示或以便不向研究中引入无意识的偏差。4.计划的样品-物品暴露时间(5-10min)后,将该动物从仪器中移出并返回聚居区,持续计划的训练至测试间隔。在动物之间将该仪器用70%乙醇清理。iii延迟阶段。常用的训练至测试间隔从1h(用于稳健的物体识别)至24h而变化。iv物体识别测试:1.为了在训练至测试间隔后测试物体识别,将熟悉的样品物品之一放在该仪器的后面角落中;将新颖的物体放在另一个后面角落中。2.如在步骤ii.2中的,将动物放在该仪器中。实验者正在记录动物行为,呆在帘子后面。3.计划的物品暴露时间(3-5min)后,将动物从仪器中移出并返回聚居区。在动物之间将该仪器用70%乙醇清理。数据分析:使用记录的视频用于稍后的数据分析:a)定向接触评分(动物与物体接触的总的持续时间);b)面积内(withinarea)评分(当动物的鼻子与该物体接触或在2cm的最小距离内冲着该物体时,该动物与该物体“相互作用”)。常用的量度包括熟悉物体对新颖物体的时间、得分差值(新颖物体相互作用-熟悉物体相互作用)、判别率(新颖物体相互作用/两个物体的总的相互作用)。分别通过与新颖物体相互作用比熟悉物体多的时间,正的得分差值或判别率高于0.5来反映这些量度中的物体识别。巴恩斯迷宫。卡罗尔巴恩斯(carolbarnes)在1979年研发了一种用于空间学习和记忆的旱地迷宫测试,在该测试中,动物从灯火通明的暴露的圆形开放平台表面逃出进入位于围绕该平台的周长的18个洞之一之下的小暗凹室中。尽管最初它是针对大鼠而发明的,但是利用它们优越的发现并逃出小洞的能力,巴恩斯迷宫(bm)用于评估小鼠的空间记忆已经变得越来越流行。程序:1.适应。将小鼠放在迷宫中间的圆柱形黑色开始室中。已经过去10s之后,移除室并且与强光一起打开蜂鸣器。小鼠渐渐地被引导进逃避箱中。一旦小鼠在该箱内,则关闭蜂鸣器和光。小鼠应该在该逃避箱中呆2min。2.空间获取。将小鼠放在迷宫中间的圆柱形黑色开始室中。10s后,将该室举起并打开峰鸣器和光。允许小鼠对该迷宫探索3分钟。当小鼠进入目标通道或已经过去3min后,试验结束。在小鼠进入通道后,立即关闭峰鸣器和光并允许小鼠在该通道中呆1min。如果小鼠在3分钟内未到达目标,则实验者将它渐渐其引导进逃避箱中并将小鼠留在其中1min。小鼠呆在居住笼中,直到下次试验。在接下来的3-4天过程中,将整个试验以15分钟间隔重复4次。3.参照记忆试验。最后一次训练日后24h,执行探测试验。靶洞必须被关闭。将动物放在迷宫中间的圆柱形黑色开始室下并且10s后,将该室移除,打开蜂鸣器和光。90s后,将小鼠从迷宫中移出。完成探测试验,以便确定该动物是否记住了靶目标位于哪里。测量每个洞中的捅数(误差)以及到达实质上靶洞的等待时间和路径长度。实例37:sacas9更新图69显示了aav-sa-cas9载体、肝脏特异性aav-sa-cas9载体、以及备选的aav-sa-cas9载体。图70显示了优化的cmv-sacas9-nls-u6-sgrna载体的数据(上次提交的载体设计);新的数据比较了n'-末端对c'-末端标记的sacas9并使用c'-末端nls标记显示了增强的切割效率。在小鼠pcsk9基因的外显子4和5中选择了新的靶标(序列和位置参见下文)。外显子4-5位于pcsk9n-末端前结构域区域的下游,当蛋白质成熟时该区域被蛋白水解切割,并且此下游区域中的插入缺失预期导致蛋白质降解。pcsk9涉及ldl-受体的循环和负向调节,并且pcsk9的损失应该间接导致血浆胆固醇水平降低。将sgrna克隆进aav载体中并在单载体转染的hepa1-6小鼠肝细胞系中测试了插入缺失活性。通过lipofectamine2000将500ng的载体转染进200,000个hepa1-6细胞中并收集dna用于surveyor测定,显示出pcsk9的切割。paav-cmv-sacas9-nls-u6-sgrna(231:atctcttagataccagcatc)paav-cmv-sacas9-nls-u6-sgrna(232:tcaatctcccgatgggcacc)paav-cmv-sacas9-nls-u6-sgrna(233:gcccatcgggagattgaggg)paav-cmv-sacas9-nls-u6-sgrna(234:acttcaacagcgtgccggag)paav-cmv-sacas9-nls-u6-sgrna(235:ccgctgaccacacctgccag)paav-cmv-sacas9-nls-u6-sgrna(236:tggcaggtgtggtcagcggc)图71显示了示出通过新的pcsk9靶标产生的插入缺失的surveyor图像。图72显示了sacas9特异性:基于2个标准预测了全基因组脱靶位点(gwot):它们相对于预期sacas9靶含有4个或更少的错配碱基,并且对于sacas9具有最小的限制性pam(nngrr)。用在靶位点(emx1:tagggttaggggccccaggc)处具有它们的相应sgrna的spcas9或sacas9转染hek293ft细胞,该靶位点具有cggggt作为pam,使得它可以被spcas9(cgg)或被sacas9(cggggt)切割。从细胞中收获dna并且通过illumina测序分析在中靶和41个预测的脱靶座位处的插入缺失(遵循来自徐(hsu)等人的《自然生物技术》(naturebiotech)2013方案和由大卫·斯科特(davidscott)和乔什·温斯坦(joshweinstein)开发的数据分析流程)。图73显示sacas9在某些座位处比spcas9可具有更高水平的脱靶活性。虽然已经在此示出并描述了本发明的优选实施例,但是对本领域的普通技术人员而言应该显而易见是这样的实施例仅以举例方式提供。在不偏离本发明的情况下众多变化、改变和取代现在将被本领域的普通技术人员想到。应该理解的是,在实践本发明中可以采用在此描述的本发明的实施例的不同替代方案。参考文献班克g(bankerg)、戈斯林k(goslink).神经元细胞培养进展(developmentsinneuronalcellculture).《自然》(nature).1988年11月10日;336(6195):185-6。比德尔,v.m.(bedell,v.m.)等人使用高效率talen系统进行体内基因组编辑(invivogenomeeditingusingahigh-efficiencytalensystem).《自然》(nature)491,114-u133(2012)。布哈雅,d.(bhaya,d.)、戴维森,m.(davison,m.)&巴郎镐,r.(barrangou,r.)细菌和古细菌中的crispr-cas系统:用于获得性防御和调节的通用小rna(crispr-cassystemsinbacteriaandarchaea:versatilesmallrnasforadaptivedefenseandregulation).《遗传学年评》(annurevgenet)45,273-297(2011)。博维斯-沃佐维奇,s.(bobis-wozowicz,s.)、奥斯克,a.(osiak,a.)、拉赫曼,s.h.(rahman,s.h.)&凯思曼,t.(cathomen,t.)使用锌指核酸酶的多能干细胞中的靶向基因组编辑(targetedgenomeeditinginpluripotentstemcellsusingzinc-fingernucleases).《方法》(methods)53,339-346(2011)。博赫,j.(boch,j.)等人打破tal-iii型效应器的dna结合特异性的密码(breakingthecodeofdnabindingspecificityoftal-typeiiieffectors).《科学》(science)326,1509-1512(2009)。伯根哈根,d.f.(bogenhagen,d.f.)&布朗,d.d.(brown,d.d.)转录终止所需的非洲蟾蜍5sdna中的核苷酸序列(nucleotidesequencesinxenopus5sdnarequiredfortranscriptiontermination).《细胞》(cell)24,261-270(1981)。布尔特曼,s.(bultmann,s.)等人通过组合设计者tale和抑制表观遗传修饰剂而靶向转录激活沉默的oct4多能性基因(targetedtranscriptionalactivationofsilentoct4pluripotencygenebycombiningdesignertalesandinhibitionofepigeneticmodifiers).《核酸研究》(nucleicacidsres)40,5368-5377(2012)。卡尔松,d.f.(carlson,d.f.)等人家畜中的有效的talen介导的基因敲除(efficienttalen-mediatedgeneknockoutinlivestock).《美国国家科学院院刊》(procnatlacadsciusa)109,17382-17387(2012)。陈,f.q.(chen,f.q.)等人使用ssdna寡核苷酸用锌指核酸酶进行高效基因组编辑(high-frequencygenomeeditingusingssdnaoligonucleotideswithzinc-fingernucleases).《自然方法》(natmethods)8,753-u796(2011)。卓,s.w.(cho,s.w.),金姆,s.(kim,s.),金姆,j.m.(kim,j.m.)&金姆,j.s.(kim,j.s.)在人类细胞中用cas9rna指导的内切核酸酶进行靶向的基因组工程化(targetedgenomeengineeringinhumancellswiththecas9rna-guidedendonuclease).《自然生物技术》(natbiotechnol)31,230-232(2013)。克里斯汀,m.(christian,m.)等人用tal效应器核酸酶靶向dna双链断裂(targetingdnadouble-strandbreakswithtaleffectornucleases).《遗传学》(genetics)186,757-761(2010)。丛,l.(cong,l.)等人使用crispr-cas系统的多重基因组工程化(multiplexgenomeengineeringusingcrispr-cassystems).《科学》(science)339,819-823(2013)。德尔特科娃,e.(deltcheva,e.)等人通过反式编码的小rna和宿主因子rna酶iii熟化crisprrna(crisprrnamaturationbytrans-encodedsmallrnaandhostfactorrnaseiii).《自然》(nature)471,602-607(2011)。德沃,h.(deveau,h.)、加尔诺,j.e.(garneau,j.e.)&莫万诺,s.(moineau,s.)crispr-cas系统及其在噬菌体细菌相互作用中的作用(crispr-cassystemanditsroleinphage-bacteriainteractions).《微生物学年评》(annurevmicrobiol)64,475-493(2010)。丁,q.(ding,q.)等人一种用于产生人类干细胞基的疾病模型的talen基因组编辑系统(atalengenome-editingsystemforgeneratinghumanstemcell-baseddiseasemodels).《细胞与干细胞》(cellstemcell)12,238-251(2013)。加尔诺,j.e.(garneau,j.e.)等人crispr-cas细菌免疫系统切割噬菌体和质粒dna(thecrispr-casbacterialimmunesystemcleavesbacteriophageandplasmiddna).《自然》(nature)468,67-71(2010)。加斯诺斯,g.(gasiunas,g.)、巴郎镐,r.(barrangou,r.)、霍瓦特,p.(horvath,p.)&西克斯尼斯(siksnys,v.)cas9-crrna核糖核蛋白复合体在细菌中针对获得性免疫介导特异的dna切割(cas9-crrnaribonucleoproteincomplexmediatesspecificdnacleavageforadaptiveimmunityinbacteria).《美国国家科学院院刊》(procnatlacadsciusa)109,e2579-2586(2012)。格尤特思(geurts,a.m.)等人经由胚胎微注射锌指核酸酶敲除大鼠(knockoutratsviaembryomicroinjectionofzinc-fingernucleases).《科学》(science)325,433-433(2009)。格雷sj(graysj)、福蒂sb(fotisb)、施瓦兹jw(schwartzjw)、帕夏博纳(bachaboinal)、泰勒-布雷克b(taylor-blakeb)、科尔曼j(colemanj)、埃莱尔md(ehlersmd)、泽尔卡mj(zylkamj)、麦克考恩tj(mccowntj)、萨穆尔斯基rj(samulskirj).使用自互补载体优化外周和中枢神经系统中的重组腺相关病毒介导的基因表达的启动子(optimizingpromotersforrecombinantadeno-associatedvirus-mediatedgeneexpressionintheperipheralandcentralnervoussystemusingself-complementaryvectors).《人类基因治疗》(humgenether.)2011年9月;22(9):1143-53.doi:10.1089/hum.2010.245。格斯钦,d.y.(guschin,d.y.)等人一种用于监测内源基因修饰的快速且通用的测定(arapidandgeneralassayformonitoringendogenousgenemodification).《分子生物学方法》(methodsmolbiol)649,247-256(2010)。黑斯蒂,p.(hasty,p.)、里维拉-佩雷斯,j.(rivera-perez,j.)&布兰得利,a.(bradley,a.)胚胎干细胞中的基因靶向所需的同源性长度(thelengthofhomologyrequiredforgenetargetinginembryonicstemcells).《分子与细胞生物学》(molcellbiol)11,5586-5591(1991)。霍瓦特,p.(horvath,p.)&巴郎镐,r.(barrangou,r.)crispr-cas,细菌和古生菌的免疫系统(crispr-cas,theimmunesystemofbacteriaandarchaea).《科学》(science)327,167-170(2010)。舒,p.d.(hsu,p.d.)&张,f.(zhang,f.)使用靶向的基因组工程技术剖分神经功能(dissectingneuralfunctionusingtargetedgenomeengineeringtechnologies).《acs化学神经科学》(acschemneurosci)3,603-610(2012)。黄,w.y.(hwang,w.y.)等人使用crispr-cas系统在斑马鱼中进行有效的基因组编辑(efficientgenomeeditinginzebrafishusingacrispr-cassystem).《自然生物技术》(natbiotechnol)31,227-229(2013)。姜,w.(jiang,w.)、碧卡尔德,d.(bikard,d.)、考克斯,d.(cox,d.)、张,f.(zhang,f.)&马拉夫尼l.a.(marraffini,l.a.)使用crispr-cas系统的rna指导的细菌基因组编辑(rna-guidededitingofbacterialgenomesusingcrispr-cassystems).《自然生物技术》(natbiotechnol)31,233-239(2013)。季聂克,m.(jinek,m.)等人获得性免疫中的可编程的双rna指导的dna内切核酸酶(aprogrammabledual-rna-guideddnaendonucleaseinadaptivebacterialimmunity).《科学》(science)337,816-821(2012)。季聂克,m.(jinek,m.)等人人类细胞中的rna编程的基因组编辑(rna-programmedgenomeeditinginhumancells),elife2,e00471(2013)。卡普利特,m.g.(kaplitt,m.g.)等人,用携带腺相关病毒(aav)的gad基因对帕金森病进行基因治疗的安全性与可容许性:开放标签的i期试验(safetyandtolerabilityofgenetherapywithanadeno-associatedvirus(aav)bornegadgeneforparkinson'sdisease:anopenlabel,phaseitrial).《柳叶刀》(lancet).2007年6月23日;369(9579):2097-105。莱维特n.(levittn.)布里格斯d.(briggsd.)吉尔a.(gila.)普劳德富特n.j.(proudfootn.j.)有效的合成poly(a)位点的定义(definitionofanefficientsyntheticpoly(a)site)《基因与发育》(genesdev.)1989;3:1019-1025。刘d(liud)、费舍尔i(fischeri).两个替代性启动子指导大鼠微管相关蛋白质1b基因的神经元特异性表达(twoalternativepromotersdirectneuron-specificexpressionoftheratmicrotubule-associatedprotein1bgene).(jneurosci.)1996年8月15日;16(16):5026-36。(lopes,v.s.)等人,使用腺相关病毒用大myo7acdna进行的视网膜基因治疗(retinalgenetherapywithalargemyo7acdnausingadeno-assocaitedvirus).《基因治疗》(genether),2013年1月24日,doi:10.1038/gt2013.3.[epub优先出版]马赫福兹,m.m.(mahfouz,m.m.)等人具有新颖的dna结合特异性的从头工程化的转录激活因子样效应器(tale)杂合核酸酶产生双链断裂(denovo-engineeredtranscriptionactivator-likeeffector(tale)hybridnucleasewithnoveldnabindingspecificitycreatesdouble-strandbreaks).《美国国家科学院院刊》(procnatlacadsciusa)108,2623-2628(2011)。马卡洛夫,k.s.(makarova,k.s.)等人crispr-cas系统的进化与分类(evolutionandclassificationofthecrispr-cassystems).《自然微生物学综述》(natrevmicrobiol)9,467-477(2011)。玛丽,p.(mali,p.)等人经由cas9的rna指导的人类基因组工程(rna-guidedhumangenomeengineeringviacas9).《科学》(science)339,823-826(2013)。麦克卢尔c(mcclurec)、科尔kl(colekl)、伍尔夫p(wulffp)、克卢格曼m(klugmannm)、默里aj(murrayaj).重组腺相关病毒载体的生产与滴定(productionandtiteringofrecombinantadeno-associatedviralvectors).jvisexp.2011年11月27日;(57):e3348.doi:10.3791/3348。米凯利斯,l.m.(michaelis,l.m.),maud“diekinetikderinvertinwirkung.”biochem.z(1913)。米勒,j.c.(miller,j.c.)等人用于高度特异的基因组编辑的改进的锌指核酸酶构造(animprovedzinc-fingernucleasearchitectureforhighlyspecificgenomeediting).《自然生物技术》(natbiotechnol)25,778-785(2007)。米勒,j.c.(miller,j.c.)等人用于有效基因组编辑的tale核酸酶构造(atalenucleasearchitectureforefficientgenomeediting).《自然生物技术》(natbiotechnol)29,143-148(2011)。莫斯科,m.j.(moscou,m.j.)&保达诺夫,a.j.(bogdanove,a.j.)简单的密码通过tal效应器管理dna识别(asimpleciphergovernsdnarecognitionbytaleffectors).《科学》(science)326,1501(2009)。波蒂厄斯,m.h.(porteus,m.h.)&巴尔的摩,d.(baltimore,d.)嵌合的核酸酶刺激人类细胞中的基因靶向(chimericnucleasesstimulategenetargetinginhumancells).《科学》(science)300,763(2003)。墨索里诺,c.(mussolino,c.)等人新颖的tale核酸酶支架允许与较低的毒性组合的较高的基因组编辑活性(anoveltalenucleasescaffoldenableshighgenomeeditingactivityincombinationwithlowtoxicity).《核酸研究》(nucleicacidsresearch)39,9283-9293(2011)。纳斯瓦尼,a.c.(nathwani,a.c.)等人,腺病毒相关病毒载体介导的b型血友病的基因转移(adenovirus-associatedvirusvector-mediatedgenetransferinhemophiliab).《新英格兰医学杂志》(nengljmed.)2011年12月22日;365(25):2357-65.doi:10.1056/nejmoa1108046.epub2011年12月10日。奥利韦拉,t.y.(oliveira,t.y.)等人转位捕获测序:一种用于高通量标绘染色体重排的方法(translocationcapturesequencing:amethodforhighthroughputmappingofchromosomalrearrangements).《免疫学方法杂志》(jimmunolmethods)375,176-181(2012)。佩雷斯,e.e.(perez,e.e.)等人使用锌指核酸酶通过基因组编辑在cd4(+)t细胞中建立hiv-1抗性(establishmentofhiv-1resistanceincd4(+)tcellsbygenomeeditingusingzinc-fingernucleases).《自然生物技术》(natbiotechnol)26,808-816(2008)。齐,l.s.(qi,l.s.)等人将crispr再利用为用于基因表达的序列特异性控制的rna指导的平台(repurposingcrisprasanrna-guidedplatformforsequence-specificcontrolofgeneexpression).《细胞》(cell)152,1173-1183(2013)。雷明顿药物科学(remington'spharmaceuticalsciences)(马克出版公司(mackpub.co.),新泽西州1991)雷荣,d.(reyon,d.)等人用于高通量基因组编辑的talen的flash装配(flashassemblyoftalensforhigh-throughputgenomeediting).《自然生物技术》(natbiotechnol)30,460-465(2012)。萨利赫-德哈利,n.(saleh-gohari,n.)&荷雷德,t.(helleday,t.)保守同源重组优先修复人类细胞中的处于细胞周期的s期的dna双链断裂(conservativehomologousrecombinationpreferentiallyrepairsdnadouble-strandbreaksinthesphaseofthecellcycleinhumancells).《核酸研究》(nucleicacidsres)32,3683-3688(2004)。桑德尔,j.d.(sander,j.d.)等人通过背景依赖性装配的无选择性锌指核酸酶工程(coda)(selection-freezinc-finger-nucleaseengineeringbycontext-dependentassembly(coda)).《自然方法》(natmethods)8,67-69(2011)。萨亚纳,n.e.(sanjana,n.e.)等人用于基因组工程的转录激活因子样效应器工具箱(atranscriptionactivator-likeeffectortoolboxforgenomeengineering).《自然-实验手册》(natprotoc)7,171-192(2012)。萨普拉诺斯卡斯(sapranauskas,r.)等人嗜热链球菌crispr-cas系统在大肠杆菌中提供免疫力(thestreptococcusthermophiluscrispr-cassystemprovidesimmunityinescherichiacoli).《核酸研究》(nucleicacidsres)39,9275-9282(2011)。沈,b.(shen,b.)等人经由cas9/rna介导的基因靶向产生基因修饰的小鼠(generationofgene-modifiedmiceviacas9/rna-mediatedgenetargeting).《细胞研究》(cellres)23,720-723(2013)。斯米蒂斯,o.(smithies,o.)、格雷格,r.g.(gregg,r.g.)、博格斯,s.s.(boggs,s.s.)、科拉雷斯基,m.a.(koralewski,m.a.)&库切尔拉帕提,r.s.(kucherlapati,r.s.)提供同源重组将dna序列插入人类染色体β-珠蛋白座位中(insertionofdnasequencesintothehumanchromosomalbeta-globinlocusbyhomologousrecombination).《自然》(nature)317,230-234(1985)。索德奈尔,f.(soldner,f.)等人产生在两个早期发作的帕金森蛋白点突变处排他地相异的同基因多能干细胞(generationofisogenicpluripotentstemcellsdifferingexclusivelyattwoearlyonsetparkinsonpointmutations).《细胞》(cell)146,318-331(2011)。(takasu,y.)等人使用锌指核酸酶mrna注射靶向诱变家蚕(targetedmutagenesisinthesilkwormbombyxmoriusingzincfingernucleasemrnainjection).《昆虫生物化学与分子生物学》(insectbiochemmolec)40,759-765(2010)。腾格里s(tangris)等人,具有减少的免疫原性的合理工程化的治疗性蛋白质(rationallyengineeredtherapeuticproteinswithreducedimmunogenicity),《免疫学杂志》(jimmunol.)2005年5月15日;174(6):3187-96。托马斯,k.r.(thomas,k.r.)、福尔杰,k.r.(folger,k.r.)&卡佩基,m.r.(capecchi,m.r.)将基因高频靶向哺乳动物基因组中的特定位点(highfrequencytargetingofgenestospecificsitesinthemammaliangenome).《细胞》(cell)44,419-428(1986)。杜施,t(tuschl,t).扩展小rna干扰(expandingsmallrnainterference).《自然生物技术》(natbiotechnol)20,446-448(2002)。乌尔诺夫,f.d.(urnov,f.d.)、雷巴尔,e.j.(rebar,e.j.)、福尔摩斯,m.c.(holmes,m.c.)、张,h.s.(zhang,h.s.)&格雷戈里,p.d.(gregory,p.d.)用工程化的锌指核酸酶进行的基因组编辑(genomeeditingwithengineeredzincfingernucleases).《遗传学自然评论》(natrevgenet)11,636-646(2010)。沃尔顿,j.(valton,j.)等人克服转录激活因子样效应器(tale)dna结合结构域对胞嘧啶甲基化的敏感性(overcomingtranscriptionactivator-likeeffector(tale)dnabindingdomainsensitivitytocytosinemethylation).《生物化学杂志》(jbiolchem)287,38427-38432(2012)。王,h.(wang,h.)等人通过crispr-cas介导的基因组工程化一步产生携带多个基因突变的小鼠(one-stepgenerationofmicecarryingmutationsinmultiplegenesbycrispr-cas-mediatedgenomeengineering).《细胞》(cell)153,910-918(2013)。渡边,t.(watanabe,t.)等人使用锌指和tal效应器核酸酶在半变态昆虫中进行非转基因基因组修饰(non-transgenicgenomemodificationsinahemimetabolousinsectusingzinc-fingerandtaleffectornucleases).《自然通讯》(natcommun)3(2012)。威尔逊,e.b.(wilson,e.b.)可能的推断、继承法则与统计推断(probableinference,thelawofsuccession,andstatisticalinference).《美国统计协会杂志》(jamstatassoc)22,209-212(1927)。伍德,a.j.(wood,a.j.)等人使用zfn和talen跨物种进行靶向的基因组编辑(targetedgenomeeditingacrossspeciesusingzfnsandtalens).《科学》(science)333,307(2011)。吴,s.(wu,s.)、应,g.x.(ying,g.x.)、吴,q.(wu,q.)&卡佩基,m.r.(capecchi,m.r.)一种用于构建基因靶向载体的方案:产生钙粘素家族及以外的基因敲除小鼠(aprotocolforconstructinggenetargetingvectors:generatingknockoutmiceforthecadherinfamilyandbeyond).《自然-实验手册》(natprotoc)3,1056-1076(2008)。张,f.(zhang,f.)等人有效构建用于调控哺乳动物转录的序列特异的tal效应器(efficientconstructionofsequence-specifictaleffectorsformodulatingmammaliantranscription).《自然生物技术》(natbiotechnol)29,149-153(2011)。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1