百菌清抗独特型单域抗体库和抗独特型单域抗体及其应用的制作方法
本发明涉及基因工程和免疫工程技术领域,更具体的说是涉及一种百菌清抗独特型单域抗体库和抗独特型单域抗体及其应用。
背景技术:
百菌清是一种取代苯类杀菌剂,化学名称2,4,5,6-四氯-1,3-苯二甲腈,分子式c8cl4n2。百菌清的作用机制主要是破坏真菌细胞的三磷酸甘油醛脱氢酶活性,使其正常的新陈代谢受到破坏,被广泛的应用于蔬果、谷物及经济作物上的真菌病害防治。百菌清具有一定的急性和慢性毒性,在环境中较稳定,具有明显的蓄积毒性。由于百菌清的广泛使用,其残留问题也引起了广泛的关注。
农药小分子的检测除了采用精密仪器检测,还可以采用免疫分析方法,精密仪器检测灵敏度和准确度都很高,但是,样品前处理复杂,对设备要求高,检测成本高,对大量样品进行检测时优势不明显;免疫分析方法正好可以弥补精密仪器检测的不足之处,实现对样品快速、经济、高通量的检测。抗体是免疫分析的重要组成部分,完整的抗体有两条重链和两条轻链构成,重轻链的可变区对抗原的结合起到了关键的作用。除了完整的抗体,抗体的片段如fab、scfv、dab,也可用于免疫检测。
抗体决定簇有三种:同种型、同种异型和独特型。同种型决定了抗体型与亚型;同种异型决定了种间抗体的多样性;独特型决定了与不同抗原的结合特异性。1963年oudin等发现了一种既不同于同种型,也不同于同种异型的抗原决定簇,将其称为idiotype,意为个体基因型,现译为独特型。1974年丹麦学者jerne提出了免疫网络学说,机体受到外来抗原刺激,淋巴细胞被激活,产生抗体ab1,随之识别ab1的淋巴细胞被激活,产生抗独特型抗体ab2,还可以有ab3、ab4等抗体产生,在体内构成了复杂的id与anti-id网络。能够识别ab1独特型决定簇的ab2即为抗原的抗独特型抗体。抗独特型抗体在免疫分析方法中可以被用作抗原或标准物的替代品,建立绿色免疫分析方法,为抗原合成提供了新途径。抗独特型抗体类型有三种:多克隆抗体、单克隆抗体、基因工程抗体。噬菌体展示技术是目前比较成熟、应用相对广泛的基因抗体技术。20世纪80年代,噬菌体展示技术逐步建立并发展起来,该系统可以将抗体基因表达在重组噬菌体衣壳蛋白的表面,通过多轮亲和筛选,分离获得目的抗体。
噬菌体展示技术的优势主要体现在基因型与表型的统一,噬菌体展示技术以噬菌体或噬菌粒为载体,将外源多肽或蛋白质基因整合到噬菌体基因组中,外源基因以融合形式表达并展示在噬菌体的表面,实现了对蛋白(表型)和基因型的同步筛选。但是,目前关于百菌清抗独特型抗体库的构建研究尚属空白;因此,提供一种百菌清抗独特型单域抗体库和抗独特型单域抗体及其应用是本领域技术人员亟需解决的问题。
技术实现要素:
有鉴于此,本发明提供了一种百菌清抗独特型单域抗体库和抗独特型单域抗体及其应用,为百菌清的免疫检测提供一种百菌清抗独特型单域抗体库,利用筛选获得的抗独特型单域抗体建立百菌清的绿色免疫检测方法。
为了实现上述目的,本发明采用如下技术方案:
本发明中百菌清单域抗体是以百菌清-nh2-klh作为免疫原免疫小鼠,构建鼠源重链抗体库,以百菌清-oh-ova作为包被原筛选获得。
抗独特型抗体的筛选:采用负筛选和竞争洗脱相结合的方法扩增获得抗独特型单域抗体库,用百菌清单域抗体包被6孔板,作为阳性孔,未包被的孔作为阴性孔,利用2%mpbs封闭2h,首先将扩增的抗独特型抗体库加入阴性孔中,孵育1h,小心吸出加入阳性孔中孵育1h,未结合的噬菌体被洗涤,与百菌清单域抗体结合的噬菌体用百菌清单域抗体进行竞争洗脱,经3轮筛选即可获得高亲和性抗独特型抗体。
抗独特型抗体的可溶性表达:提取阳性克隆质粒,酶切后连接到pet26b质粒上,选取大肠杆菌bl21作为宿主菌,利用iptg进行诱导表达,表达周质经镍柱纯化即可获得可溶性的抗独特型抗体。
抗独特型单域抗体的应用:建立百菌清竞争绿色免疫检测方法,利用origin软件进行四参数拟合,获得竞争抑制曲线,建立回归方程,计算ic50。
经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种百菌清抗独特型单域抗体库和抗独特型单域抗体及其应用,由百菌清单域抗体库筛选获得百菌清单域抗体后,再次免疫小鼠,取其脾脏提取rna,利用噬菌体展示技术,以大肠杆菌tg1为宿主菌,构建百菌清抗独特型单域抗体库。本发明利用噬菌体筛选技术对该抗体库进行筛选,获得与百菌清具有竞争结合活性的抗独特型单域抗体,并且节约了抗体制备的成本,容易制备大量抗体,还方便了以后对已获得抗体的改造;为百菌清的检测提供了绿色免疫检测方法,减少检测方法对操作人员的危害,减少了有机物质的使用,具有十分广泛的应用前景。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1附图为本发明百菌清免疫原合成路线图;
图2附图为本发明百菌清免疫原紫外光谱图;
图3附图为本发明百菌清包被原合成路线图;
图4附图为本发明百菌清包被原紫外光谱图;
图5附图为本发明百菌清单域抗体制备中总rna电泳检测结果;
图6附图为本发明重链可变区基因电泳图;
其中,1-8为8个重复;ck为采用蒸馏水代替模板;
图7附图为本发明百菌清单域抗体筛选部分单克隆elisa结果;
其中,1-4为挑取的不同单克隆,深灰为阳性孔值,浅灰为阴性孔值;
图8附图为本发明百菌清单域抗体可溶性表达重组菌的pcr鉴定结果;
其中,1-4为挑取的四个单克隆;ck为采用蒸馏水代替模板;
图9附图为本发明百菌清单域抗体的纯化蛋白电泳图;
图10附图为本发明抗独特型抗体总rna电泳检测结果;
其中1-3为3个重复;
图11附图为本发明抗独特型单域抗体重链可变区基因pcr结果;
其中,1-7为扩增获得的目的条带;ck为蒸馏水替代模板;
图12附图为本发明抗独特型单域抗体筛选部分克隆elisa结果;
其中,1-4为挑取的不同单克隆,深灰为阳性孔值,浅灰为阴性孔值;
图13本发明抗独特型单域抗体可溶性表达重组菌的pcr鉴定结果;
其中,1-5为挑取的四个单克隆;ck为采用蒸馏水代替模板;
图14附图为本发明百菌清抗独特型单域抗体的纯化蛋白电泳图;
图15附图为本发明竞争抑制曲线。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
(一)百菌清单域抗体的获取
实施例1免疫原和包被原的合成
根据半抗原设计原则,对百菌清进行结构修饰,先分别引入氨基和羟基功能团,随后再分别引入klh(keyholelimpethemocyanin,血蓝蛋白)和ova(ovalbumin,鸡卵白蛋白)作为完全抗原,具体合成路线如下:
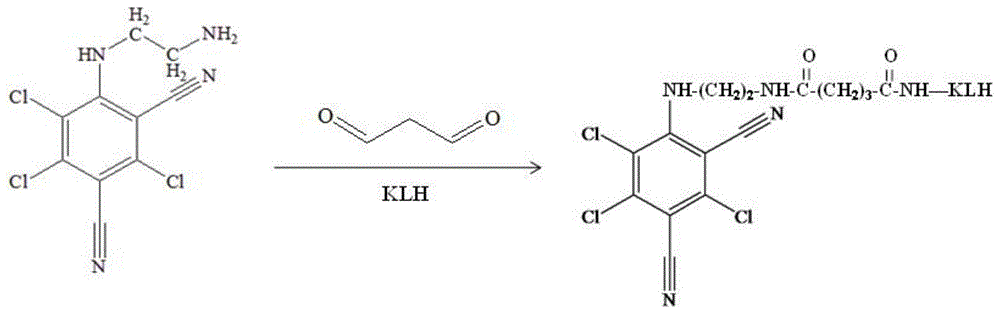
免疫原的合成路线:称取百菌清200mg溶于10ml二氯甲烷,加入10ml乙二胺和40ml水,室温搅拌24h,用水洗二氯甲烷层,之后减压蒸馏除去溶剂,得到黄绿色残留物即为ctn-nh2。利用戊二醛法合成ctn-nh2-klh(免疫原),反应路线见图1。称取50mgctn-nh2溶于4mldmf中,加入5ml9mg/mlklh的pbs溶液中,充分搅拌后滴入40μl戊二醛,4℃搅拌过夜,离心去沉淀,透析后冻干备用。紫外扫描图见图2。
包被原的合成路线:称取百菌清200mg和76mg氟化钾,溶于8ml乙二醇溶液中,90℃加热24h,冷却后加入10g冰水,分离沉淀并风干的白色固体即为ctn-oh。利用羰基咪唑法合成ctn-oh-ova(包被原),反应路线见图3。50mgctn-oh,溶于2mldmf中,加入等量1,1’-羰基咪唑,室温搅拌3h,将反应液缓慢加入ph9.51的ova碳酸盐缓冲液中,4℃磁力搅拌4h,透析后冻干备用。紫外扫描图见图4。
实施例2免疫小鼠脾细胞rna的提取和cdna的合成
6-8周龄balb/c雌性小白鼠,饲养1-2周,初次免疫前1周,进行尾部静脉采血制备阴性血清,用制备好的免疫原(ctn-nh2-klh)免疫小鼠。首先将抗原(ctn-nh2-klh)和等体积的弗氏佐剂利用注射器来回推动进行乳化,直至混合液呈均匀的乳白色。制备血清时,将采取的新鲜血液室温下静置1-2h,4℃过夜,4℃、10000g/min离心10min,收集上清液即为多抗血清。测定多抗血清效价,选择效价高的小鼠,将完整脾脏取出,去除脂肪和结缔组织,剪碎放入经depc水处理的研钵中,加入液氮研磨,加入trizol室温静置5min,上清中加入氯仿,充分混匀后静置15min,12000g离心15min,取上层水相加入异丙醇,充分混匀后静置10min,沉淀用75%乙醇悬浮,8000g离心5min,室温干燥,用rnase-freeddh2o水溶解沉淀即为rna,琼脂糖凝胶电泳检测,电泳结果如图5所示。利用反转录试剂盒(北京索莱宝科技有限公司)按照说明书操作反转录获得cdna。
实施例3百菌清单域抗体库的构建
以实施列2中获得的cdna为模板,利用重链可变区通用引物(见表1,其中hb为上游引物,hf为下游引物)扩增获得鼠源重链可变区基因。pcr反应体系:2×mixs(南京诺唯赞生物科技有限公司)25μl,上下游引物各2.5μl,模板5μl。pcr反应条件:95℃预变性5min;95℃变性30s,56℃退火1min,72℃延伸1min,反应循环35次;72℃延伸10min。pcr电泳结果如图6所示。利用pcr纯化试剂盒(北京全式金生物技术有限公司)对pcr产物进行纯化后,利用ncoⅰ和notⅰ进行双酶切,使用大连takara公司的dna连接试剂盒连接酶切后的pcr产物和pr2载体,电转化到大肠杆菌tg1(本实验室保存)中。
表1重链可变区通用引物
注:简并碱基符号:k=g/t;r=a/g;m=a/c;s=g/c;y=c/t;w=a/t。
实施例4百菌清单域抗体库的筛选
将实施例3中构建的百菌清单域抗体库,投入到2×ty-a-g(1l培养基中含16g胰蛋白胨,10g酵母提取物,5gnacl,amp终浓度为100μg/ml,kan终浓度为50μg/ml,1%的葡萄糖)中,37℃振荡培养至od600nm=0.4,加入km13辅助噬菌体(本实验室保存),37℃水浴30min,3200g离心10min,弃上清,500ml2×ty-a-k-g重悬,25℃过夜培养。过夜培养物3200g离心30min,取上清加入peg/nacl,混匀后冰浴1h;3200g离心30min,弃上清;沉淀用5mlpbs重悬,加入1mlpeg/nacl,冰浴30min;3200g离心30min,弃上清;1mlpbs重悬沉淀,3200g离心5min,用0.45μm已灭菌滤膜过滤,获得噬菌体库。4℃短时间保存,加甘油后可置于-70℃冰箱长时间保存。
用1ml的ctn-oh-ova包被6孔板,4℃包被过夜;与此同时包被ova作为阴性孔进行负筛选;用pbs缓冲液洗孔3次,再用2%的mpbs封闭过夜;封闭后用pbs洗孔3次,加1ml噬菌体库于阴性孔中,室温温和振荡孵育1h;再将噬菌体库加入阳性孔中同时加2%的mpbs,室温温和振荡孵育1h;用pbst洗液洗孔10次,洗去未结合的噬菌体,结合的噬菌体用百菌清竞争洗脱,室温条件下孵育20min。培养e.colitg1至od600nm=0.4;取1.5ml菌液,加入500μl竞争洗脱液(含50μg/ml百菌清的pbs溶液),37℃水浴侵染1h;侵染结束后3200g离心5min,用200μl2×ty(胰蛋白胨16g,酵母提取物10g和nacl5g,定容至1l,高压灭菌备用。)重悬菌体,将菌体全部涂布在tye-a-g(经高压灭菌的tye培养基冷却至60℃左右,加入终浓度为100μg/ml的amp和1%的葡萄糖,混匀后倒平板。tye:胰蛋白胨10g,酵母提取物5g,nacl8g,琼脂粉15g,定容至1l,高压灭菌备用。)平板上,37℃培养过夜。同时测定洗脱液的滴度。用2ml2×ty将上述过夜生长的菌体从tye-a-g平板上刮起,一半加入500ml2×ty-a-g(4%)中培养至od600nm=0.4,加入km13辅助噬菌体侵染,侵染后过夜培养;另一半保存于-70℃;过夜培养物的上清用peg/nacl沉淀,扩增的库用于下一轮的筛选,共进行四轮筛选,四轮筛选投入产出比见表2。
表2四轮筛选的产出投入比
实施例5阳性克隆的验证
挑取实施例4最后一轮筛选获得的单克隆,分析其elisa结果。以包被ctn-oh-ova的孔为阳性孔,包被ova的孔为阴性孔,次日pbst洗板3次后,利用ova37℃封闭2h;洗板,加入噬菌体,孵育1h;洗板,加入hrp标记的抗m13酶标二抗,孵育1h;洗板,加入tmb显色液,显色约15min,加入2mol/l硫酸终止反应;利用酶标仪测定od450nm。od阳性/od阴性>2.1的克隆视为阳性克隆。部分elisa结果见图7,其中1-4是挑取的不同单克隆,深灰为阳性孔值,浅灰为阴性孔值。经elisa鉴定为阳性的单克隆进行pcr验证,同时用e.colitg1作为阴性对照,引物见表3,反应体系见表4,pcr条件为:94℃条件下预变性3min;94℃条件下变性40s,60℃条件下退火40s,72℃条件下延伸40s,重复30个循环;72℃条件下延伸10min。结果发现,在约350bp处有明显条带,证明筛选获得的克隆,展示了完整的单域抗体片段。
表3验证引物序列
表4pcr反应体系
实施例6百菌清单域抗体的可溶性表达
将实施例5中获得的阳性克隆培养过夜,利用质粒小提试剂盒对过夜菌的质粒进行提取,再进行pcr扩增(引物及体系同表3、4,反应条件同实施例5),获得大量的目的条带。利用pcr产物纯化试剂盒对pcr产物进行纯化。对pcr纯化产物和pet26b质粒进行双酶切(ncoⅰ和notⅰ),37℃酶切过夜,80℃保温1h使酶失活。利用胶回收试剂盒对酶切质粒的大片段进行胶回收,利用pcr产物纯化试剂盒对pcr产物的酶切产物进行纯化。将胶回收后的酶切质粒和纯化后的目的片段利用t4dna连接酶16℃连接过夜。取5μl连接产物转化100μle.colibl21感受态细胞,冰上孵育30min,42℃热激60s,再次冰浴2min,加入900μl2×ty,37℃250rpm复苏1h,吸取适量培养液涂tye-k(tye-k:经高压灭菌的tye培养基冷却至60℃左右,加入终浓度为50μg/ml的kna混匀后倒平板。)的板子,培养过夜。从过夜培养的平板上挑取重组菌,液体培养后进行pcr鉴定(引物及体系同表3,4)。pcr反应条件为:94℃条件下预变性5min;94℃条件下变性1min,55℃条件下退火1min,72℃条件下延伸1min,总共进行30个循环;最后72℃条件下延伸10min。电泳结果如图8所示,其中1-4为挑取的四个单克隆。经pcr验证含有完整目的片段的菌株过夜培养,提取质粒后进行双酶切鉴定和pcr鉴定。对重组菌进行iptg诱导表达,将重组菌过夜培养后,取500μl转接到50ml2×ty-k-g的液体培养基中,37℃250rpm培养至对数后期,加入终浓度为1mmol/l的iptg30℃200rpm过夜诱导表达。10000g离心10min收集过夜培养的菌体,加入5mltes,冰浴30min,加入12ml无菌水,冰浴30min,10000g离心10min,所得上清即含有单域抗体。利用镍亲和柱对其进行纯化,获得百菌清单域抗体,纯化蛋白电泳图见图9。
(二)百菌清抗独特型抗体库的构建和百菌清抗独特型抗体的获取
实施例7免疫小鼠脾细胞rna的提取和cdna的合成
用百菌清单域抗体免疫小鼠,首先将抗原和佐剂进行乳化,得到油包水乳剂。免疫一周后进行采血,测定多抗血清效价,选择效价高的小鼠,取脾脏,去除脂肪和结缔组织,将脾脏剪碎放入盛有液氮的研钵中进行研磨,加入trizol室温静置5min,取上清加入氯仿充分混匀,静置15min,12000g离心15min,取水相加入异丙醇,充分混匀,静置10min,沉淀用75%乙醇重悬,8000g离心5min,室温干燥,沉淀用rnase-freeddh2o水溶解即为含rna的溶液,利用琼脂糖凝胶电泳进行检测,结果如图10所示。利用反转录试剂盒按照反转录试剂盒说明书进行操作,反转录获得cdna。
实施例8抗独特型抗体库的构建
以实施例7中合成的cdna为模板,利用重链可变区通用引物扩增获取重链可变区基因,重链可变区pcr反应条件:①95℃预变性,5min;②95℃变性,30s;③57℃退火,1min;④72℃延伸,1min;②-④反应循环30次;⑤72℃延伸10min。pcr扩增结果如图11所示。
利用pcr纯化试剂盒对pcr产物进行纯化,对纯化后的pcr产物利用ncoⅰ和notⅰ进行双酶切,使用takara公司的dna连接试剂盒连接酶切后的pcr产物和pr2载体,利用电转仪将构建的载体电转化到大肠杆菌tg1中,构建抗独特型抗体库。
实施例9抗独特型单域抗体的筛选
将实施例8获得的抗独特型单域抗体库菌液投入到2×ty-a-g培养基中,37℃振荡培养至od600nm=0.4,加入辅助噬菌体km13,37℃水浴30min,3200g离心10min,弃上清,沉淀用500ml2×ty-a-k-g重悬,25℃培养过夜。过夜培养物3200g离心30min,取上清加入四分之一体积的peg/nacl,混匀后冰浴1h;再次离心,弃去上清,5mlpbs重悬沉淀,加入1mlpeg/nacl操作同上,1mlpbs重悬沉淀,3200g离心5min去除残留的细胞碎片,用0.45μm无菌滤膜过滤。4℃短时间保存,加甘油后可置于-70℃冰箱长期保存。
用1ml百菌清单域抗体包被6孔板,4℃包被过夜;同时包被脱脂奶粉作为阴性孔进行负筛选;pbs缓冲液洗孔3次,2%的mpbs封闭过夜;封闭后用pbs洗孔3次,加1ml噬菌体库于阴性孔中,室温振荡孵育1h;将噬菌体库从阴性孔吸出加入阳性孔中同时加2%的mpbs,室温振荡孵育1h;用pbst洗液洗孔15次,洗去未结合的噬菌体,结合的噬菌体用百菌清单域抗体进行竞争洗脱,室温条件下孵育20min。筛选进行的同时培养新鲜的e.colitg1至od600nm=0.4;取1.5ml新鲜菌液,加入500μl竞争洗脱液,37℃水浴侵染1h;3200g离心5min收集菌体,200μl2×ty重悬菌体,将菌液涂布于tye-a-g平板上,37℃培养过夜。同时进行洗脱液滴度测定。用2ml2×ty培养基将上述过夜培养的菌体从tye-a-g平板上刮起,一半加入500ml2×ty-a-g培养基中培养至od600nm=0.4,加入辅助噬菌体km13,侵染后转入2×ty-a-k-g培养基中过夜培养;另一半保存于-70℃;过夜培养物的上清用peg/nacl沉淀,扩增的库用于下一轮的筛选,共进行四轮筛选。四轮筛选投入产出比见表5。
表5四轮筛选的产出投入比
实施例10阳性克隆的验证
实施例9最后一轮筛选获得的克隆,进行elisa验证,分析elisa结果。以包被百菌清单域抗体的孔为阳性孔,包被脱脂奶粉的孔为阴性孔,次日pbst洗板3次后,用2%脱脂奶粉37℃封闭2h;pbst洗板,加入扩增的噬菌体,孵育1h;pbst洗板,加入hrp标记的抗m13酶标二抗,孵育1h;pbst洗板,加入tmb显色液,显色15min左右,加入2m硫酸终止反应;利用酶标仪测定od450nm。od阳性/od阴性>2.1的克隆即为阳性克隆。elisa鉴定结果如图12所示。经elisa鉴定为阳性的单克隆再进行pcr验证,同时用e.colitg1作为阴性对照,验证筛选获得的克隆是否展示了完整的抗体片段。结果发现,在约350bp处有明显条带,证明筛选获得的克隆,展示了完整的抗独特型单域抗体片段。
实施例11抗独特型单域抗体的可溶性表达
将实施例10获得的阳性克隆过夜培养,利用质粒小提试剂盒提取质粒,再进行pcr扩增,获得大量的目的条带。利用pcr产物纯化试剂盒对其进行纯化。分别对pcr纯化产物和pet26b质粒进行双酶切,37℃酶切过夜,80℃1h灭酶。利用胶回收试剂盒对酶切质粒的大片段进行胶回收,再次利用pcr产物纯化试剂盒对pcr产物的酶切产物进行纯化。将胶回收后的酶切质粒和纯化后的目的片段利用t4连接酶进行连接,16℃连接过夜。取连接产物化转e.colibl21感受态细胞,37℃250rpm复苏1h,吸取适量培养液涂tye-k的板子,过夜培养。挑取重组菌,液体培养,进行菌液pcr鉴定,鉴定结果见图13。经pcr验证含有完整目的片段的菌株过夜培养,提取质粒后进行双酶切鉴定。对验证过的重组菌进行iptg诱导表达,将重组菌过夜培养后,取1ml转接到100ml2×ty-k-g的液体培养基中,37℃250rpm培养至对数后期,加入终浓度为0.6mm的iptg30℃200rpm诱导表达18h。10000g离心10min收集菌体,加入10mltes,冰浴30min,加入24ml无菌水,冰浴30min,10000g离心10min,上清即是抗独特型单域抗体的周质。利用his-trapff纯化柱对其进行纯化,获得百菌清抗独特型单域抗体,纯化蛋白电泳图见图14。
实施例12抗独特型单域抗体的应用
100μl百菌清单域抗体4℃过夜包被elisa板子,2%mpbs37℃封闭1h。50μl系列倍比稀释(0.039、0.078、0.156、0.3125、0.625、1.25、2.5、5、10μg/ml)的百菌清标准品与50μl抗独特型单域抗体混匀,一起加入elisa板子中,室温孵育1h。pbst洗板,加入100μl1:5000hrp标记的抗his酶标二抗,室温孵育1h,再次洗板,加入100μltmb显色液,显色15min,加入50μl2mol/l硫酸终止反应,用酶标仪读取od450nm。利用origin软件进行四参数拟合,获得竞争抑制曲线,建立回归方程,计算ic50。拟合曲线如图15所示,ic50为0.262μg/ml。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
序列表
<110>河南科技学院
<120>百菌清抗独特型单域抗体库和抗独特型单域抗体及其应用
<160>16
<170>siposequencelisting1.0
<210>1
<211>41
<212>dna
<213>artificialsequence
<400>1
catgccatggggctcgtgcaggtkcaggtgmagcagtcwcg41
<210>2
<211>41
<212>dna
<213>artificialsequence
<400>2
catgccatggggctcgagctggarcaggtgrwgsagtcwgg41
<210>3
<211>41
<212>dna
<213>artificialsequence
<400>3
catgccatggggcccgagtaggtcaaactgcagsggyctgg41
<210>4
<211>41
<212>dna
<213>artificialsequence
<400>4
catgccatggggctctaggaggtgmcgctggtgaartcygg41
<210>5
<211>41
<212>dna
<213>artificialsequence
<400>5
catgccatggggctcgaggargtgawgstggtggagtctgg41
<210>6
<211>41
<212>dna
<213>artificialsequence
<400>6
catgccatggggttcgaggargtgcagctkcagtagtcagg41
<210>7
<211>44
<212>dna
<213>artificialsequence
<400>7
catgccatggggctcaaggagttccaggtgcarcagtcmgkrsc44
<210>8
<211>44
<212>dna
<213>artificialsequence
<400>8
catgccatggtgcgcaaggaggttcagctkcagcagtctgkrgc44
<210>9
<211>41
<212>dna
<213>artificialsequence
<400>9
catgccatgggacgccaggargtkaarctkstmgagtctgg41
<210>10
<211>40
<212>dna
<213>artificialsequence
<400>10
ttgcggccgcgaattagtkrrsggactgtgagagtggtkc40
<210>11
<211>41
<212>dna
<213>artificialsequence
<400>11
ttgcggccgcggtcttgttgmrgaracagtgaccrkrgtcc41
<210>12
<211>41
<212>dna
<213>artificialsequence
<400>12
ttgcggccgcgcacttgttgtggagacrgtgactgwggttc41
<210>13
<211>41
<212>dna
<213>artificialsequence
<400>13
ttgcggccgcgtactagawcmagaracrgtrasrgtggtrc41
<210>14
<211>41
<212>dna
<213>artificialsequence
<400>14
ttgcggccgcgcacaagtygaggagacggtgaccrkggtsc41
<210>15
<211>24
<212>dna
<213>artificialsequence
<400>15
ctttagtggtacctttctatgcgg24
<210>16
<211>23
<212>dna
<213>artificialsequence
<400>16
cgaattcagatcctcttctgaga23
- 还没有人留言评论。精彩留言会获得点赞!