含有1,3,4噁二唑或1,3,4噻二唑片段的薯蓣皂苷元衍生物的制备方法及应用与流程
本发明涉及天然药物及药物化学技术领域,具体涉及薯蓣皂苷元f环进行修饰的衍生物。
背景技术:
近几年,全球癌症发病率和死亡率正在迅速增长,目前癌症已成为仅次于心脑血管疾病的第二大死因。根据最新的世界癌症年度报告,从2006年到2016年,肿瘤死亡人数增加了17.8%,2018年全球约有1800万新病例和960万癌症患者死亡,恶性肿瘤已成为危害人类健康的重要杀手。然而,已上市的许多抗肿瘤药物治疗效果虽好,但副作用大,极大程度限制了它们的使用,抗肿瘤药物的研发面临着严峻的挑战,为此,研发高效低毒的抗肿瘤药物成为众多科研人员的工作重点。
天然产物一直是活性先导化合物甚至是药物的重要源泉,以天然产物的药效骨架和母核开展结构改造研究从而获取结构新颖、药理活性增强及成药性改善的先导化合物或候选药物,是新药研发的重要途径之一。据统计,从1940年到2014年,已上市的抗肿瘤药物近50%直接或间接来源于天然产物。
薯蓣皂苷元(diosgenin,dg)是从薯蓣科植物盾叶薯蓣、穿龙薯蓣等根茎中分离出来的一种甾体皂苷元。薯蓣皂苷元是合成甾体激素类药物与甾体避孕药的重要原料,世界各国生产的甾体激素类药物60%以其为原料,如孕烯醇酮、孕酮、可的松等。多项药理研究结果表明薯蓣皂苷元具有抗肿瘤、抗炎、降糖以及抗动脉粥样硬化等生物活性。体内外研究结果表明,薯蓣皂苷元对乳腺癌、结肠癌、前列腺癌、肺癌和肝癌等多种肿瘤细胞表现出广谱的抗肿瘤活性。由此可见,薯蓣皂苷元无论是作为药物合成前体还是其所具备的药理活性都具有广泛的应用价值,这为研发高效低毒的抗肿瘤药物奠定了良好的基础。
技术实现要素:
本发明要解决的问题是寻找一种抗肿瘤活性好的含有噁二唑和噻二唑片段的薯蓣皂苷元衍生物,而提供含有1,3,4噁二唑或1,3,4噻二唑片段的薯蓣皂苷元衍生物的制备方法及应用。
含有1,3,4噁二唑或1,3,4噻二唑片段的薯蓣皂苷元衍生物,其结构式为
含有1,3,4噁二唑片段的薯蓣皂苷元衍生物的制备方法,按以下步骤完成:
所述
所述
薯蓣皂苷元在ch2cl2和吡啶溶剂中与乙酸酐反应,得到中间体i,中间体i在ch2cl2和冰醋酸条件下经nabh3cn还原生成中间体ii,然后经琼斯试剂、四氢呋喃和丙酮氧化合成中间体iii,随后以o-苯并三氮唑-n,n,n′,n′-四甲基脲四氟硼酸酯为偶联催化剂、n,n-二异丙基乙胺和二氯甲烷,与乙酰肼、苯甲酰肼、对甲氧基苯甲酰肼、1-萘甲酰肼或3-吡啶甲酰肼缩合,得到中间体iv;再经pocl3脱水环合,得到乙酰基衍生物,最后在氢氧化钾-甲醇溶液中水解,得到含有1,3,4噁二唑片段的薯蓣皂苷元衍生物。
含有1,3,4噻二唑片段的薯蓣皂苷元衍生物的制备方法,按以下步骤完成:
所述
薯蓣皂苷元在ch2cl2和吡啶溶剂中与乙酸酐反应,得到中间体i,中间体i在ch2cl2和冰醋酸条件下经nabh3cn还原生成中间体ii,然后经琼斯试剂、四氢呋喃和丙酮氧化合成中间体iii,随后以o-苯并三氮唑-n,n,n′,n′-四甲基脲四氟硼酸酯为偶联催化剂、n,n-二异丙基乙胺和二氯甲烷,与乙酰肼、苯甲酰肼、对甲氧基苯甲酰肼、1-萘甲酰肼或3-吡啶甲酰肼缩合,得到中间体iv;再与劳森试剂和甲苯反应,得到含有1,3,4噻二唑片段的薯蓣皂苷元衍生物;
所述
薯蓣皂苷元在ch2cl2和吡啶溶剂中与乙酸酐反应,得到中间体i,中间体i在ch2cl2和冰醋酸条件下经nabh3cn还原生成中间体ii,然后经琼斯试剂、四氢呋喃和丙酮氧化合成中间体iii,随后以o-苯并三氮唑-n,n,n′,n′-四甲基脲四氟硼酸酯为偶联催化剂、n,n-二异丙基乙胺和二氯甲烷,与乙酰肼、苯甲酰肼、对甲氧基苯甲酰肼、1-萘甲酰肼或3-吡啶甲酰肼缩合,得到中间体iv;再与劳森试剂和甲苯反应,得到乙酰基衍生物,最后在氢氧化钾-甲醇溶液中水解,得到含有1,3,4噻二唑片段的薯蓣皂苷元衍生物。
含有1,3,4噁二唑或1,3,4噻二唑片段的薯蓣皂苷元衍生物的应用,所述薯蓣皂苷元衍生物用于制备治疗肿瘤疾病的药物。
本发明的有益效果:
一、本发明采用四氮唑盐还原法(mtt),对本发明中所合成含有1,3,4噁二唑或1,3,4噻二唑片段的薯蓣皂苷元衍生物进行体外抗增殖活性测试,测试细胞为人肝癌(hep3b)细胞、人乳腺癌(bcap-37)细胞、人肺癌(h292)细胞和人结肠癌(ht29)细胞,结果显示多数衍生物ic50值<20μmol,具有显著的肿瘤抑制活性,有继续进行药理试验的潜力。
二、本发明中所合成的含有1,3,4噁二唑或1,3,4噻二唑片段的薯蓣皂苷元衍生物具有显著的抗肺癌活性,对该类衍生物进一步的生物活性研究,从天然产物的构-效关系出发,设计并开发新的抗肿瘤药物,发明成果具有潜在的研究价值和应用前景。
本发明可获得含有1,3,4噁二唑或1,3,4噻二唑片段的薯蓣皂苷元衍生物的制备方法及应用。
附图说明
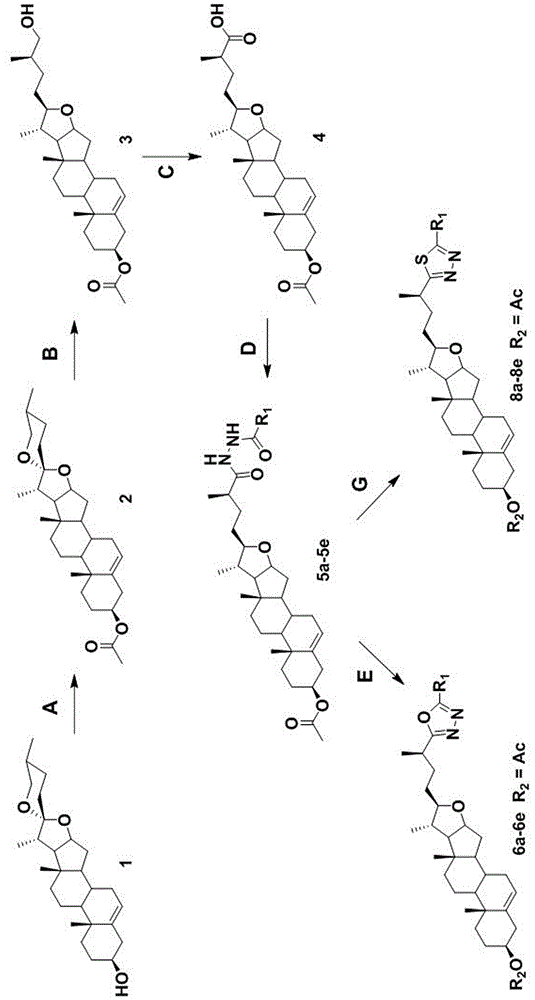
图1为本发明中乙酰基衍生物的合成步骤;
图2为本发明中含有1,3,4噁二唑或1,3,4噻二唑片段的薯蓣皂苷元衍生物的合成步骤;
图中:1为薯蓣皂苷元,2为中间体i,3为中间体ii,4为中间体iii,5a-5e为中间体iv,其中,a:r1=methyl,b:r1=phenyl,c:r1=p-methoxyphenyl,d:r1=3-pyridyl,e:r1=naphthyl;
a为乙酸酐,二氯甲烷,吡啶,室温;b为氰基硼氢化钠,冰乙酸,二氯甲烷,室温;c为琼斯试剂,四氢呋喃,丙酮,室温;d为取代酰肼,o-苯并三氮唑-n,n,n′,n′-四甲基脲四氟硼酸酯,n,n-二异丙基乙胺,二氯甲烷,室温;e为三氯氧磷,80℃;f为氢氧化钾,甲醇,室温;g为劳森试剂,甲苯,110℃;h为氢氧化钾,甲醇,室温;
具体实施方式
具体实施方式一:本实施方式含有1,3,4噁二唑或1,3,4噻二唑片段的薯蓣皂苷元衍生物,其结构式为
具体实施方式二:本实施方式与具体实施方式一不同点是:所述r1为甲基、苯基、对甲氧基苯基、1-萘基或3-吡啶基。
其他步骤与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一或二不同点是:含有1,3,4噁二唑片段的薯蓣皂苷元衍生物的制备方法,按以下步骤完成:
所述
所述
薯蓣皂苷元在ch2cl2和吡啶溶剂中与乙酸酐反应,得到中间体i,中间体i在ch2cl2和冰醋酸条件下经nabh3cn还原生成中间体ii,然后经琼斯试剂、四氢呋喃和丙酮氧化合成中间体iii,随后以o-苯并三氮唑-n,n,n′,n′-四甲基脲四氟硼酸酯为偶联催化剂、n,n-二异丙基乙胺和二氯甲烷,与乙酰肼、苯甲酰肼、对甲氧基苯甲酰肼、1-萘甲酰肼或3-吡啶甲酰肼缩合,得到中间体iv;再经pocl3脱水环合,得到乙酰基衍生物,最后在氢氧化钾-甲醇溶液中水解,得到含有1,3,4噁二唑片段的薯蓣皂苷元衍生物。
其他步骤与具体实施方式一或二相同。
具体实施方式四:本实施方式与具体实施方式一至三之一不同点是:所述
薯蓣皂苷元在ch2cl2和吡啶溶剂中,且在室温下与乙酸酐反应,得到中间体i,中间体i在ch2cl2和冰醋酸条件下,且在室温下经nabh3cn还原生成中间体ii,然后在室温下经琼斯试剂、四氢呋喃和丙酮氧化合成中间体iii,随后在室温下以o-苯并三氮唑-n,n,n′,n′-四甲基脲四氟硼酸酯为偶联催化剂、n,n-二异丙基乙胺和二氯甲烷,与乙酰肼、苯甲酰肼、对甲氧基苯甲酰肼、1-萘甲酰肼或3-吡啶甲酰肼缩合,得到中间体iv;再在80℃下经pocl3脱水环合,得到含有1,3,4噁二唑片段的薯蓣皂苷元衍生物;
所述
薯蓣皂苷元在ch2cl2和吡啶溶剂中,且在室温下与乙酸酐反应,得到中间体i,中间体i在ch2cl2和冰醋酸条件下,且在室温下经nabh3cn还原生成中间体ii,然后在室温下经琼斯试剂、四氢呋喃和丙酮氧化合成中间体iii,随后在室温下以o-苯并三氮唑-n,n,n′,n′-四甲基脲四氟硼酸酯为偶联催化剂、n,n-二异丙基乙胺和二氯甲烷,与乙酰肼、苯甲酰肼、对甲氧基苯甲酰肼、1-萘甲酰肼或3-吡啶甲酰肼缩合,得到中间体iv;再在80℃下经pocl3脱水环合,得到乙酰基衍生物,最后在室温下,且在氢氧化钾-甲醇溶液中水解,得到含有1,3,4噁二唑片段的薯蓣皂苷元衍生物。
其他步骤与具体实施方式一至三相同。
具体实施方式五:本实施方式与具体实施方式一至四之一不同点是:所述氢氧化钾-甲醇溶液中氢氧化钾的浓度为0.1mol/l。
其他步骤与具体实施方式一至四相同。
具体实施方式六:本实施方式与具体实施方式一至五之一不同点是:含有1,3,4噻二唑片段的薯蓣皂苷元衍生物的制备方法,按以下步骤完成:
所述
薯蓣皂苷元在ch2cl2和吡啶溶剂中与乙酸酐反应,得到中间体i,中间体i在ch2cl2和冰醋酸条件下经nabh3cn还原生成中间体ii,然后经琼斯试剂、四氢呋喃和丙酮氧化合成中间体iii,随后以o-苯并三氮唑-n,n,n′,n′-四甲基脲四氟硼酸酯为偶联催化剂、n,n-二异丙基乙胺和二氯甲烷,与乙酰肼、苯甲酰肼、对甲氧基苯甲酰肼、1-萘甲酰肼或3-吡啶甲酰肼缩合,得到中间体iv;再与劳森试剂和甲苯反应,得到含有1,3,4噻二唑片段的薯蓣皂苷元衍生物;
所述
薯蓣皂苷元在ch2cl2和吡啶溶剂中与乙酸酐反应,得到中间体i,中间体i在ch2cl2和冰醋酸条件下经nabh3cn还原生成中间体ii,然后经琼斯试剂、四氢呋喃和丙酮氧化合成中间体iii,随后以o-苯并三氮唑-n,n,n′,n′-四甲基脲四氟硼酸酯为偶联催化剂、n,n-二异丙基乙胺和二氯甲烷,与乙酰肼、苯甲酰肼、对甲氧基苯甲酰肼、1-萘甲酰肼或3-吡啶甲酰肼缩合,得到中间体iv;再与劳森试剂和甲苯反应,得到乙酰基衍生物,最后在氢氧化钾-甲醇溶液中水解,得到含有1,3,4噻二唑片段的薯蓣皂苷元衍生物。
其他步骤与具体实施方式一至五相同。
具体实施方式七:本实施方式与具体实施方式一至六之一不同点是:所述
薯蓣皂苷元在ch2cl2和吡啶溶剂中,且在室温下与乙酸酐反应,得到中间体i,中间体i在ch2cl2和冰醋酸条件下,且在室温下经nabh3cn还原生成中间体ii,然后在室温下经琼斯试剂、四氢呋喃和丙酮氧化合成中间体iii,随后在室温下以o-苯并三氮唑-n,n,n′,n′-四甲基脲四氟硼酸酯为偶联催化剂、n,n-二异丙基乙胺和二氯甲烷,与乙酰肼、苯甲酰肼、对甲氧基苯甲酰肼、1-萘甲酰肼或3-吡啶甲酰肼缩合,得到中间体iv;再在100℃下与劳森试剂和甲苯反应,得到含有1,3,4噻二唑片段的薯蓣皂苷元衍生物;
所述
薯蓣皂苷元在ch2cl2和吡啶溶剂中,且在室温下与乙酸酐反应,得到中间体i,中间体i在ch2cl2和冰醋酸条件下,且在室温下经nabh3cn还原生成中间体ii,然后在室温下经琼斯试剂、四氢呋喃和丙酮氧化合成中间体iii,随后在室温下以o-苯并三氮唑-n,n,n′,n′-四甲基脲四氟硼酸酯为偶联催化剂、n,n-二异丙基乙胺和二氯甲烷,与乙酰肼、苯甲酰肼、对甲氧基苯甲酰肼、1-萘甲酰肼或3-吡啶甲酰肼缩合,得到中间体iv;再在100℃下与劳森试剂和甲苯反应,得到乙酰基衍生物,最后在室温下,且在氢氧化钾-甲醇溶液中水解,得到含有1,3,4噻二唑片段的薯蓣皂苷元衍生物。
其他步骤与具体实施方式一至六相同。
具体实施方式八:本实施方式与具体实施方式一至七之一不同点是:所述氢氧化钾-甲醇溶液中氢氧化钾的浓度为0.1mol/l。
其他步骤与具体实施方式一至七相同。
具体实施方式九:本实施方式与具体实施方式一至八之一不同点是:所述薯蓣皂苷元衍生物用于制备治疗肿瘤疾病的药物。
其他步骤与具体实施方式一至八相同。
具体实施方式十:本实施方式与具体实施方式一至九之一不同点是:所述肿瘤疾病为肝癌、肺癌、乳腺癌和结肠癌。
其他步骤与具体实施方式一至九相同。
以上具体实施方式的有益效果:
一、实施方式中采用四氮唑盐还原法(mtt),对所合成含有1,3,4噁二唑或1,3,4噻二唑片段的薯蓣皂苷元衍生物进行体外抗增殖活性测试,测试细胞为人肝癌(hep3b)细胞、人乳腺癌(bcap-37)细胞、人肺癌(h292)细胞和人结肠癌(ht29)细胞,结果显示多数衍生物ic50值<20μmol,具有显著的肿瘤抑制活性,有继续进行药理试验的潜力。
二、实施方式中所合成的含有1,3,4噁二唑或1,3,4噻二唑片段的薯蓣皂苷元衍生物具有显著的抗肺癌活性,对该类衍生物进一步的生物活性研究,从天然产物的构-效关系出发,设计并开发新的抗肿瘤药物,发明成果具有潜在的研究价值和应用前景。
采用以下实施例验证本发明的有益效果:
实施例1:
于500ml圆底烧瓶中加入薯蓣皂苷元(30g,72.4mmol)和干燥的210mlch2cl2,将反应瓶置于室温搅拌,待原料完全溶解后加入吡啶(60ml)和乙酸酐(14.8g,144.9mol),搅拌反应6h,薄层色谱(石油醚∶乙酸乙酯的体积比=4∶1)监测反应,原料基本反应完全,向反应液中加入200ml水搅拌,分出有机相,用150ml水洗三次,随后将有机相分出加入饱和的nahco3调ph至碱性,水洗,用200ml饱和食盐水水洗两次,分出有机相,加入无水na2so4干燥,过滤,减压回收溶剂,将所得固体用160ml无水乙醇回流搅拌1h,抽滤干燥,得到中间体i(32.1g,产率为97.0%)。
esi-hrms:m/z457.3330[m+h]+(calcdforc29h45o4,457.3312).1hnmr(600mhz,cdcl3,δ):5.37(d,j=4.9hz,1h,h-6),4.60(m,1h,h-3),4.41(dd,j=14.8,7.2hz,1h,h-16),3.47(dd,j=10.1,4.1hz,1h,h-26),3.37(t,j=11.0hz,1h,h-26),2.03(s,3h,ac-ch3),1.03(s,3h,19-ch3),0.97(d,j=7.0hz,3h,21-ch3),0.78(s,3h,18-ch3),0.78(d,j=5.6hz,3h,27-ch3)。
实施例2:
于250l圆底烧瓶中加入中间体i(20g,43.9mmol),80mlch2cl2和20ml冰醋酸,室温搅拌,分批加入nabh3cn(5.53g,87.8mmol),加毕继续搅拌8h,薄层色谱(石油醚:乙酸乙酯的体积比=4:1)监测反应,原料基本反应完全。将反应液用150ml水洗三次以除去大部分醋酸,分出有机层,将饱和nahco3缓慢倒入有机相调ph至碱性,水洗一次,用200ml饱和食盐水水洗两次,分出有机相,加入无水na2so4干燥,过滤,浓缩,得白色固体的中间体ii(16.3g,81.0%)。
esi-hrms:m/z459.3472[m+h]+(calcdforc29h47o4,459.3469).1hnmr(600mhz,cdcl3,δ):5.36(d,j=5.0hz,1h,h-6),4.59(m,1h,h-3),4.30(m,1h,h-16),3.49(dd,j=10.6,6.0hz,1h,h-26),3.43(dd,j=10.6,6.0hz,1h,h-26),3.32(td,j=8.3,3.7hz,1h,h-22),2.02(s,3h,ac-ch3),1.03(s,3h,19-ch3),1.00(d,j=6.7hz,3h,21-ch3),0.80(s,3h,18-ch3),0.91(d,j=6.8hz,3h,27-ch3)。
实施例3:
于250ml的圆底烧瓶中加入中间体ii(10.0g,21.8mmol),50ml丙酮和50ml四氢呋喃搅拌溶解,室温下搅拌,向反应液中缓慢滴加琼斯试剂(由浓硫酸、水与三氧化铬配成的水溶液,将26.72g三氧化铬以少量水溶解,然后缓慢加入24ml浓硫酸,最后用水稀释至100ml制得),滴加过程中反应液呈现翠绿色,待反应液变为橙红色时停止滴加,继续搅拌2h,薄层色谱(石油醚∶乙酸乙酯的体积比=4∶1)监测反应,原料基本反应完全,过滤,将滤液减压蒸干,加入80mlch2cl2溶解,用100ml水洗三次,后经饱和食盐水水洗,无水na2so4干燥,过滤,浓缩,经硅胶柱色谱分离纯化得白色固体的中间体iii(7.63g,76.0%)。
esi-hrms:m/z473.3220[m+h]+(calcdforc29h45o5,473.3262).1hnmr(600mhz,cdcl3,δ):5.37(d,j=4.8hz,1h,h-6),4.60(m,1h,h-3),4.33(m,1h,h-16),3.35(td,j=8.6,2.4hz,1h,h-22),2.52(m,1h,h-25),2.03(s,3h,ac-ch3),1.18(d,j=6.9hz,3h,27-ch3),1.03(s,3h,19-ch3),1.00(d,j=6.7hz,3h,21-ch3),0.79(s,3h,18-ch3)。
实施例4:(22r,25r)-n-乙酰基-3β-乙酰氧基-5-烯-呋甾烷-26-碳酰肼(5a)的合成;
于25ml干燥的茄形瓶中加入中间体iii(306.1mg,0.65mmol)和10mlch2cl2,搅拌溶解后加入乙酰肼(101.1mg,1.35mmol)、tbtu(405.0g,1.20mmol)和dipea(1.5ml),室温搅拌4h,薄层色谱(石油醚∶丙酮的体积比=1∶1)监测反应,原料基本反应完全,向反应液中加入50ml水,用10ml二氯甲烷萃取三次,饱和食盐水洗,无水na2so4干燥、过滤、浓缩,经硅胶柱色谱分离纯化得白色固体的中间体5a,即为(22r,25r)-n-乙酰基-3β-乙酰氧基-5-烯-呋甾烷-26-碳酰肼(251.1mg,产率为74.5%)。
esi-hrms:m/z529.3650[m+h]+(calcdforc31h49n2o5,529.3636).1hnmr(600mhz,cdcl3,δ):9.24(brs,1h,nh),9.15(d,j=4.7hz,1h,nh),5.36(d,j=3.3hz,1h,h-6),4.59(m,1h,h-3),4.30(m,1h,h-16),3.28(t,j=6.4hz,1h,h-22),2.52(m,1h,h-25),2.03(s,3h,2′-ch3),2.02(s,3h,ac-ch3),1.13(d,j=6.6hz,3h,27-ch3),1.02(s,3h,19-ch3),0.96(d,j=6.1hz,3h,21-ch3),0.76(s,3h,18-ch3)。
实施例5:(22r,25r)-n-苯甲酰基-3β-乙酰氧基-5-烯-呋甾烷-26-碳酰肼(5b)的合成;
参照实施例1的合成方法。白色固体,产率为63.1%,esi-hrms:m/z591.3784[m+h]+(calcdforc36h51n2o5,591.3792).1hnmr(600mhz,cdcl3,δ):9.75(d,j=3.5hz,1h,nh),9.54(d,j=3.5hz,1h,nh),7.79(d,j=7.7hz,2h,h-2′andh-6′),7.44(t,j=7.7hz,2h,h-4′),7.33(d,j=7.7hz,2h,h-3′andh-5′),5.34(d,j=4.3hz,1h,h-6),4.57(m,1h,h-3),4.29(m,1h,h-16),3.27(t,j=7.8hz,1h,h-22),2.59(m,1h,h-25),2.00(s,3h,ac-ch3),1.12(d,j=6.6hz,3h,27-ch3),0.98(s,3h,19-ch3),0.94(d,j=6.5hz,3h,21-ch3),0.74(s,3h,18-ch3)。
实施例6:(22r,25r)-n-(对-甲氧基苯甲酰基)-3β-乙酰氧基-5-烯-呋甾烷-26-碳酰肼(5c)的合成;
参照实施例1的合成方法。白色固体,产率为48.7%,esi-hrms:m/z621.3910[m+h]+(calcdforc37h53n2o6,621.3898).1hnmr(600mhz,cdcl3,δ):9.26(brs,1h,nh),9.20(brs,1h,nh),7.77(d,j=8.6hz,2h,h-
实施例7:(22r,25r)-n-(吡啶-3-羰基)-3β-乙酰氧基-5-烯-呋甾烷-26-碳酰肼(5d)的合成;
参照实施例1的合成方法。白色固体,产率为67.8%,esi-hrms:m/z592.3769[m+h]+(calcdforc35h50n3o5,592.3745).1hnmr(600mhz,cdcl3,δ):9.81(brs,1h,nh),9.32(brs,1h,nh),9.01(s,1h,h-2′),8.69(brs,1h,h-6′),8.12(d,1h,j=7.9hz,h-4′),7.33(dd,j=7.9,4.5hz,1h,h-5′),5.34(d,j=4.0hz,1h,h-6),4.58(m,1h,h-3),4.33(m,1h,h-16),3.32(m,1h,h-22),2.64(m,1h,h-25),2.01(s,3h,ac-ch3),1.15(d,j=6.7hz,3h,27-ch3),0.98(s,3h,19-ch3),0.97(d,j=6.9hz,3h,21-ch3),0.75(s,3h,18-ch3)。
实施例8:(22r,25r)-n-(1′-萘甲酰基)-3β-乙酰氧基-5-烯-呋甾烷-26-碳酰肼(5e)的合成;
参照实施例1的合成方法。白色固体,产率为70.6%,esi-hrms:m/z641.3959[m+h]+(calcdforc40h53n2o5,641.3949).1hnmr(600mhz,cdcl3,δ):8.36(m,1h,ar-h),7.92(d,j=8.2hz,1h,ar-h),7.84(m,1h,ar-h),7.70(d,j=8.2hz,1h,ar-h),7.51(m,2h,ar-h),7.42(t,j=8.2hz,1h,ar-h),5.37(d,j=4.9hz,1h,h-6),4.59(m,1h,h-3),4.36(m,1h,h-16),3.35(t,j=8.4hz,1h,h-22),2.68(m,1h,h-25),2.02(s,3h,ac-ch3),1.19(d,j=6.7hz,3h,27-ch3),1.00(s,3h,19-ch3),0.98(d,j=6.7hz,3h,21-ch3),0.82(s,3h,18-ch3).
实施例9:(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-甲基]-1′,3′,4′-噁二唑基)-呋甾烷(6a)的合成;
于25ml的干燥茄形瓶中加入化合物5a(152.1mg,0.29mmol)和5mlpocl3,80℃搅拌反应5h,薄层色谱(石油醚∶丙酮的体积比=1∶1)监测反应,原料基本反应完全,冷却,向反应液中加入50ml水,用10ml二氯甲烷萃取三次,饱和食盐水洗,再用无水na2so4干燥、过滤、浓缩,通过硅胶柱色谱分离得白色固体6a,即为(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-甲基]-1′,3′,4′-噁二唑基)-呋甾烷(80.5mg,产率为57.14%)。
esi-hrms:m/z511.3562[m+h]+(calcdforc31h47n2o4,511.3530).1hnmr(600mhz,cdcl3,δ):5.36(d,j=4.8hz,1h,h-6),4.58(m,1h,h-3),4.28(m,1h,h-16),3.28(m,1h,h-22),3.07(dd,j=14.9,7.1hz,1h,h-25),2.49(s,3h,5′-ch3),2.02(s,3h,ac-ch3),1.34(d,j=7.1hz,3h,27-ch3),1.02(s,3h,19-ch3),0.96(d,j=7.1hz,3h,21-ch3),0.77(s,3h,18-ch3)。
实施例10:(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-苯基]-1′,3′,4′-噁二唑基)-呋甾烷(6b)的合成;
参照实施例9的合成方法。白色固体,产率为81.5%,esi-hrms:m/z573.3714[m+h]+(calcdforc36h49n2o4,573.3687).1hnmr(600mhz,cdcl3,δ):8.04(dd,j=7.9,1.3hz,2h,h-2.″andh-6″),7.50(m,3h,h-3″,h-4.″andh-5″),5.36(d,j=3.5hz,1h,h-6),4.59(m,1h,h-3),4.28(m,1h,h-16),3.30(dd,j=13.6,7.3hz,1h,h-22),3.20(m,1h,h-25),2.02(s,3h,ac-ch3),1.43(d,j=7.0hz,3h,27-ch3),1.02(s,3h,19-ch3),0.96(d,j=6.5hz,3h,21-ch3),0.77(s,3h,18-ch3).
实施例11:(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-对甲氧基苯基]-1′,3′,4′-噁二唑基)-呋甾烷(6c)的合成;
参照实施例9的合成方法。白色固体,产率为73.2%,esi-hrms:m/z603.3795[m+h]+(calcdforc37h51n2o4,603.3972).1hnmr(600mhz,cdcl3,δ):7.97(dd,j=8.7,2.9hz,2h,h-2.″andh-6″),6.98(dd,j=8.7,2.9hz,2h,h-3.″andh-5″),5.36(d,j=2.0hz,1h,h-6),4.59(m,1h,h-3),4.28(m,1h,h-16),3.86(s,3h,h-4″-och3),3.30(m,1h,h-22),3.16(m,1h,h-25),2.02(s,3h,ac-ch3),1.41(d,j=6.8hz,3h,27-ch3),1.02(s,3h,19-ch3),0.96(d,j=6.8hz,3h,21-ch3),0.76(s,3h,18-ch3).
实施例12:(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-3″-吡啶基]-1′,3′,4′-噁二唑基)-呋甾烷(6d)的合成;
参照实施例9的合成方法。白色固体,产率为82.4%,esi-hrms:m/z574.3615[m+h]+(calcdforc35h48n3o4,574.3639).1hnmr(600mhz,cdcl3,δ):9.25(s,1h,h-2″),8.76(d,j=3.5hz,1h,h-6″),8.34(d,1h,j=7.9hz,h-4″),7.46(dd,j=7.9,3.5hz,1h,h-5″),5.36(d,j=4.8hz,1h,h-6),4.58(m,1h,h-3),4.28(m,1h,h-16),3.31(dd,j=12.6,7.5hz,1h,h-22),3.22(dd,j=14.4,7.2hz,1h,h-25),2.02(s,3h,ac-ch3),1.44(d,j=6.9hz,3h,27-ch3),1.02(s,3h,19-ch3),0.96(d,j=6.9hz,3h,21-ch3),0.77(s,3h,18-ch3)。
实施例13:(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-(萘-1″-基)]-1′,3′,4′-噁二唑基)-呋甾烷(6e)的合成;
参照实施例9的合成方法。白色固体,产率为82.0%,esi-hrms:m/z623.3829[m+h]+(calcdforc40h51n2o4,623.3843).1hnmr(600mhz,cdcl3,δ):9.20(d,j=8.5hz,1h,ar-h),8.15(d,j=7.3hz,1h,ar-h),8.02(d,j=8.3hz,1h,ar-h),7.92(d,j=8.3hz,1h,ar-h),7.67(m,1h,ar-h),7.58(m,2h,ar-h),5.36(d,j=4.9hz,1h,h-6),4.59(m,1h,h-3),4.30(m,1h,h-16),3.34(m,1h,h-22),3.27(m,1h,h-25),2.03(s,3h,ac-ch3),1.49(d,j=6.9hz,3h,27-ch3),1.01(s,3h,19-ch3),0.97(d,j=6.8hz,3h,21-ch3),0.77(s,3h,18-ch3)。
实施例14:(22r,25r)-3β-羟基-5-烯-25-(2′-[5′-甲基]-1′,3′,4′-噁二唑基)-呋甾烷(7a)的合成;
于25ml的干燥茄形瓶中加入化合物6a(102.1mg,0.2mmol)和6ml甲醇,室温搅拌溶解后加入koh溶液(33.6mg,0.6mmol),搅拌反应8h,薄层色谱(石油醚∶乙酸乙酯的体积比=2∶1)监测反应,原料基本反应完全,加入20ml水,用稀盐酸酸化,将沉淀物过滤、水洗、干燥得白色固体6a,即为(22r,25r)-3β-羟基-5-烯-25-(2′-[5′-甲基]-1′,3′,4′-噁二唑基)-呋甾烷(85.2mg,产率为91.0%)。
esi-hrms:m/z469.3427[m+h]+(calcdforc29h45n2o3,469.3425).1hnmr(600mhz,cdcl3,δ):5.33(d,j=4.3hz,1h,h-6),4.28(m,1h,h-16),3.51(m,1h,h-3),3.28(dd,j=13.5,7.8hz,1h,h-22),3.06(dd,j=14.1,7.2hz,1h,h-25),2.49(s,3h,5′-ch3),1.34(d,j=6.9hz,3h,27-ch3),1.01(s,3h,19-ch3),0.96(d,j=6.9hz,3h,21-ch3),0.77(s,3h,18-ch3).
实施例15:(22r,25r)-3β-羟基-5-烯-25-(2′-[5′-苯基]-1′,3′,4′-噁二唑基)-呋甾烷(7b)的合成;
参照实施例14的合成方法。白色固体,产率为93.6%,esi-hrms:m/z531.3589[m+h]+(calcdforc34h47n2o3,531.3581).1hnmr(600mhz,cdcl3,δ):8.04(dd,j=8.0,1.3hz,2h,h-2.″andh-6″),7.50(m,3h,h-3″,h-4.″andh-5″),5.34(d,j=5.2hz,1h,h-6),4.29(m,1h,h-16),3.52(m,1h,h-3),3.31(m,1h,h-22),3.20(m,1h,h-25),1.43(d,j=7.1hz,3h,27-ch3),1.01(s,3h,19-ch3),0.96(d,j=6.9hz,3h,21-ch3),0.77(s,3h,18-ch3)。
实施例16:(22r,25r)-3β-羟基-5-烯-25-(2′-[5′-对甲氧基苯基]-1′,3′,4′-噁二唑基)-呋甾烷(7c)的合成;
参照实施例14的合成方法。白色固体,产率为92.5%,esi-hrms:m/z561.3684[m+h]+(calcdforc35h49n2o4,561.3687).1hnmr(600mhz,cdcl3,δ):7.97(dd,j=8.8,1.9hz,2h,h-2.″andh-6″),6.98(dd,j=8.8,1.9hz,2h,h-3.″andh-5″),5.34(d,j=5.0hz,1h,h-6),4.29(m,1h,h-16),3.87(s,3h,h-4″-och3),3.52(m,1h,h-3),3.31(m,1h,h-22),3.18(m,1h,h-25),1.42(d,j=7.0hz,3h,27-ch3),1.01(s,3h,19-ch3),0.96(d,j=6.7hz,3h,21-ch3),0.77(s,3h,18-ch3)。
实施例17:(22r,25r)-3β-羟基-5-烯-25-(2′-[5′-3″-吡啶基]-1′,3′,4′-噁二唑基)-呋甾烷(7d)的合成;
参照实施例14的合成方法。白色固体,产率为93.0%,esi-hrms:m/z532.3534[m+h]+(calcdforc33h46n3o3,532.3534).1hnmr(600mhz,cdcl3,δ):9.25(s,1h,h-2″),8.76(d,j=2.8hz,1h,h-6″),8.36(d,1h,j=7.9hz,h-4″),7.47(dd,j=7.9,2.8hz,1h,h-5″),5.34(d,j=4.8hz,1h,h-6),4.29(m,1h,h-16),3.50(m,1h,h-3),3.31(dd,j=13.5,7.5hz,1h,h-22),3.22(dd,j=14.3,7.1hz,1h,h-25),1.44(d,j=7.0hz,3h,27-ch3),1.01(s,3h,19-ch3),0.96(d,j=6.7hz,3h,21-ch3),0.77(s,3h,18-ch3)。
实施例18:(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-(萘-1″-基)]-1′,3′,4′-噁二唑基)-呋甾烷(7e)的合成;
参照实施例14的合成方法。白色固体,产率为91.8%,esi-hrms:m/z581.3776[m+h]+(calcdforc38h49n2o3,581.3738).1hnmr(600mhz,cdcl3,δ):9.20(d,j=8.5hz,1h,ar-h),8.15(d,j=7.3hz,1h,ar-h),8.02(d,j=8.3hz,1h,ar-h),7.92(d,j=8.3hz,1h,ar-h),7.67(m,1h,ar-h),7.58(m,2h,ar-h),5.34(d,j=4.9hz,1h,h-6),4.30(m,1h,h-16),3.52(m,1h,h-3),3.34(m,1h,h-22),3.27(m,1h,h-25),1.49(d,j=6.9hz,3h,27-ch3),1.00(s,3h,19-ch3),0.97(d,j=6.7hz,3h,21-ch3),0.78(s,3h,18-ch3)。
实施例19:(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-甲基]-1′,3′,4′-噻二唑基)-呋甾烷(8a)的合成;
于25ml的干燥茄形瓶中加入化合物5a(121.7mg,0.23mmol),劳森试剂(186mg,0.46mmol)和6ml干燥的丙酮,回流搅拌反应1h,薄层色谱(石油醚∶乙酸乙酯的体积比=1∶1)监测反应,原料基本反应完全,减压蒸干溶剂得黄色粗产物,通过硅胶柱色谱分离纯化得白色固体8a,即为(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-甲基]-1′,3′,4′-噻二唑基)-呋甾烷(91.5mg,产率为75.6%)。
esi-hrms:m/z527.3300[m+h]+(calcdforc31h47n2o3s,527.3302).1hnmr(600mhz,cdcl3,δ):5.35(d,j=3.8hz,1h,h-6),4.57(m,1h,h-3),4.27(dd,j=13.1,7.5hz,1h,h-16),3.32(m,1h,h-22),3.26(m,1h,h-25),2.72(s,3h,5′-ch3),2.01(s,3h,ac-ch3),1.37(d,j=6.9hz,3h,27-ch3),1.01(s,3h,19-ch3),0.94(d,j=7.2hz,3h,21-ch3),0.76(s,3h,18-ch3)。
实施例20:
(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-苯基]-1′,3′,4′-噻二唑基)-呋甾烷(8b)的合成;
参照实施例19的合成方法。白色固体,产率为72.0%,esi-hrms:m/z589.3434[m+h]+(calcdforc36h49n2o3s,589.3458).1hnmr(600mhz,cdcl3,δ):7.94(dd,j=5.1,1.7hz,2h,h-2.″andh-6″),7.46(m,3h,h-3″,h-4.″andh-5″),5.36(d,j=3.5hz,1h,h-6),4.60(m,1h,h-3),4.30(dd,j=13.0,7.1hz,1h,h-16),3.40(m,1h,h-22),3.30(m,1h,h-25),2.02(s,3h,ac-ch3),1.45(d,j=6.6hz,3h,27-ch3),1.02(s,3h,19-ch3),0.94(d,j=6.7hz,3h,21-ch3),0.78(s,3h,18-ch3)。
实施例21:(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-对甲氧基苯基]-1′,3′,4′-噻二唑基)-呋甾烷(8c)的合成;
参照实施例19的合成方法。白色固体,产率为74.0%,esi-hrms:m/z619.3524[m+h]+(calcdforc37h51n2o4s,619.3564).1hnmr(600mhz,cdcl3,δ):7.87(dd,j=8.7hz,2h,h-2.″andh-6″),6.96(d,j=8.7hz,2h,h-3.″andh-5″),5.36(br.s,1h,h-6),4.59(m,1h,h-3),4.29(m,1h,h-16),3.86(s,3h,h-4″-och3),3.39-3.30(m,2h,h-22,h-25),2.02(s,3h,ac-ch3),1.44(d,j=6.9hz,3h,27-ch3),1.02(s,3h,19-ch3),0.95(d,j=6.8hz,3h,21-ch3),0.77(s,3h,18-ch3)。
实施例22:(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-3″-吡啶基]-1′,3′,4′-噻二唑基)-呋甾烷(8d)的合成;
参照实施例19的合成方法。白色固体,产率为82.4%,esi-hrms:m/z590.3415[m+h]+(calcdforc35h48n3o3s,590.3411).1hnmr(600mhz,cdcl3,δ):9.11(brs,1h,h-2″),8.71(brs,1h,h-6″),8.32(d,j=7.6hz,1h,h-4″),7.44(dd,j=7.6,4.5hz,1h,h-5″),5.36(brs,1h,h-6),4.59(m,1h,h-3),4.29(dd,j=12.6,6.9hz,1h,h-16),3.45(m,1h,h-22),3.33(m,1h,h-25),2.02(s,3h,ac-ch3),1.47(d,j=6.9hz,3h,27-ch3),1.02(s,3h,19-ch3),0.95(d,j=6.5hz,3h,21-ch3),0.78(s,3h,18-ch3)。
实施例23:(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-(萘-1″-基)]1′,3′,4′-噻二唑基)-呋甾烷(8e)的合成;
参照实施例19的合成方法。白色固体,产率为75.5%,esi-hrms:m/z639.3617[m+h]+(calcdforc40h51n2o3s,639.3615).1hnmr(600mhz,cdcl3,δ):8.68(dd,j=8.3,5.0hz,1h,ar-h),7.97(d,j=8.3hz,1h,ar-h),7.91(d,j=8.3hz,1h,ar-h),7.78(d,j=8.3hz,1h,ar-h),7.55(m,3h,ar-h),5.36(d,j=4.9hz,1h,h-6),4.59(m,1h,h-3),4.31(m,1h,h-16),3.50(m,1h,h-22),3.35(m,1h,h-25),2.02(s,3h,ac-ch3),1.51(d,j=6.8hz,3h,27-ch3),1.01(s,3h,19-ch3),0.98(d,j=6.8hz,3h,21-ch3),0.78(s,3h,18-ch3)。
实施例24:(22r,25r)-3β-羟基-5-烯-25-(2′-[5′-甲基]-1′,3′,4′-噻二唑基)-呋甾烷(9a)的合成;
参照实施例14的合成方法。白色固体,产率为92.0%,esi-hrms:m/z485.3185[m+h]+(calcdforc29h45n2o2s,485.3196).1hnmr(600mhz,cdcl3,δ):5.32(d,j=3.7hz,1h,h-6),4.27(dd,j=13.1,7.4hz,1h,h-16),3.50(m,1h,h-3),3.32(m,1h,h-22),3.26(m,1h,h-25),2.72(s,3h,5′-ch3),1.37(d,j=7.0hz,3h,27-ch3),1.01(s,3h,19-ch3),0.94(d,j=7.0hz,3h,21-ch3),0.77(s,3h,18-ch3)。
实施例25:(22r,25r)-3β-羟基-5-烯-25-(2′-[5′-苯基]-1′,3′,4′-噻二唑基)-呋甾烷(9b)的合成;
参照实施例14的合成方法。白色固体,产率为93.6%,esi-hrms:m/z547.3324[m+h]+(calcdforc34h47n2o2s,547.3353).1hnmr(600mhz,cdcl3,δ):7.94(dd,j=5.1,1.6hz,2h,h-2.″andh-6″),7.47(m,3h,h-3″,h-4.″andh-5″),5.34(d,j=4.5hz,1h,h-6),4.29(m,1h,h-16),3.51(m,1h,h-3),3.42(m,1h,h-22),3.30(m,1h,h-25),1.46(d,j=6.9hz,3h,27-ch3),1.01(s,3h,19-ch3),0.95(d,j=6.5hz,3h,21-ch3),0.79(s,3h,18-ch3)。
实施例26:(22r,25r)-3β-羟基-5-烯-25-(2′-[5′-对甲氧基苯基]-1′,3′,4′-噻二唑基)-呋甾烷(9c)的合成;
参照实施例14的合成方法。白色固体,产率为92.5%,esi-hrms:m/z577.3560[m+h]+(calcdforc35h48n3o3s,577.3458).1hnmr(600mhz,cdcl3,δ):7.87(dd,j=8.7hz,2h,h-2.″andh-6″),6.97(d,j=8.7hz,2h,h-3.″andh-5″),5.34(d,j=2.0hz,1h,h-6),4.59(m,1h,h-3),4.29(m,1h,h-16),3.86(s,3h,h-4″-och3),3.51(m,1h,h-3),3.39-3.30(m,2h,h-22,h-25),1.44(d,j=6.9hz,3h,27-ch3),1.01(s,3h,19-ch3),0.96(d,j=6.8hz,3h,21-ch3),0.77(s,3h,18-ch3)。
实施例27:(22r,25r)-3β-羟基-5-烯-25-(2′-[5′-3″-吡啶基]-1′,3′,4′-噻二唑基)-呋甾烷(9d)的合成;
参照实施例14的合成方法。白色固体,产率为91.4%,esi-hrms:m/z548.3304[m+h]+(calcdforc33h46n3o2s,584.3305).1hnmr(600mhz,cdcl3,δ):9.12(brs,1h,h-2″),8.72(brs,1h,h-6″),8.33(d,j=7.7hz,1h,h-4″),7.45(m,1h,h-5″),5.33(brs,1h,h-6),4.30(m,1h,h-16),3.51(m,1h,h-3),3.45(m,1h,h-22),3.34(m,1h,h-25),1.47(d,j=6.8hz,3h,27-ch3),1.01(s,3h,19-ch3),0.96(d,j=6.7hz,3h,21-ch3),0.79(s,3h,18-ch3)。
实施例28:(22r,25r)-3β-乙酰氧基-5-烯-25-(2′-[5′-(萘-1″-基)]-1′,3′,4′-噻二唑基)-呋甾烷(9e)的合成;
参照实施例14的合成方法。白色固体,产率为92.5%,esi-hrms:m/z597.3497[m+h]+(calcdforc38h49n2o25,597.3509).1hnmr(600mhz,cdcl3,δ):8.68(dd,j=8.3,5.4hz,1h,ar-h),7.97(d,j=8.3hz,1h,ar-h),7.91(d,j=8.3hz,1h,ar-h),7.78(d,j=8.3hz,1h,ar-h),7.55(m,3h,ar-h),5.32(br.s,1h,h-6),4.30(m,1h,h-16),3.50(m,1h,h-3),3.48(m,1h,h-22),3.34(m,1h,h-25),1.50(d,j=6.9hz,3h,27-ch3),1.00(s,3h,19-ch3),0.97(d,j=6.9hz,3h,21-ch3),0.78(s,3h,18-ch3)。
实施例29:
实验方法:细胞抑制活性实验方法
取对数生长期的肿瘤细胞,经胰酶消化后以5,000个/孔细胞密度接种于96孔培养板,置于37℃、5%co2培养箱中培养12h后,每孔加入不同浓度药物100μl,对照组加等体积的空白培养基,每组设3个复孔。置于37℃、5%co2培养箱中培养48h后加mtt20μl/孔,继续培养4h,小心吸弃孔内上清液,每孔加入dmso150μl来溶解甲瓒结晶,室温振荡使结晶充分溶解。用酶标仪检测492nm处吸光度值,实验重复3次。抑制率计算方法:
药敏孔相对od值=药敏孔绝对od值-空白对照孔绝对od值
实验结果
表1为以上实施例中对4种人类癌细胞株抗增殖活性的ic5o值(μm)
表1
以下是实施例中所使用的实验设备与试剂:
仪器超净工作台(苏州艾可林净化设备有限公司)
恒温培养箱(美国thermo)
酶联免疫检测仪(美国bio-rad)
倒置相差显微镜(中国motic)
试剂细胞培养基rpmi-1640、dmem(高糖)(hyclon公司)
胎牛血清(杭州四季清有限公司)
pbs(南京凯基生物科技发展有限公司)
四甲基偶氮唑蓝(mtt)(美国sigma)
dmso(美国sigma)
细胞株人肝癌细胞hep3b、人乳腺癌细胞bcap-37、人肺癌细胞h292和人结肠癌细胞ht29。
- 还没有人留言评论。精彩留言会获得点赞!