一种捕获外周血循环肿瘤细胞的结构、芯片及其使用方法与流程
本发明涉及医疗器械领域,具体来说是一种捕获外周血循环肿瘤细胞的结构、芯片及其使用方法。
背景技术:
循环肿瘤细胞(circulatingtumorcells,ctcs)是从肿瘤原发灶或转移灶脱落,通过血管或淋巴系统进入血液的肿瘤细胞,来源于原发或转移灶的ctcs不仅能够间接体现肿瘤特征,也能够实时反映肿瘤的发展状况。ctcs在外周血中数量稀少,1亿个白细胞和红细胞中仅有数个肿瘤细胞,ctcs的分离捕获是后续分析(表型、基因型)的基础。
肿瘤细胞的物理学特征如尺寸、密度等,和白细胞、红细胞差别较大,如肿瘤细胞直径一般大于12微米,而白细胞直径大多小于15微米,利用此差异可将肿瘤细胞从血液中分离出来。常见的基于细胞尺寸的分离方法是过滤膜,滤膜的孔径通常为8微米,当血液通过滤膜时,小的白细胞和红细胞会穿过滤膜,而大的肿瘤细胞和部分白细胞会被滤膜截流。
由于滤膜的孔径是均一的,很多白细胞的直径也大于8微米,因此滤膜在过滤外周血时,经常会出现阻塞问题,局部堵塞后,会造成流体压力在滤膜上的不均匀分布,从而造成局部流速过快,外周血中的ctc无法被截流,导致部分ctc无法被捕获。
技术实现要素:
为解决上述提到的问题,本发明提供一种如下的技术方案:
本发明的目的之一在于提供一种捕获外周血循环肿瘤细胞的结构,所述的结构包括有血液入口、废血出口以及位于血液入口和废血出口之间的循环肿瘤细胞捕获区,所述的循环肿瘤细胞捕获区包括有一个以上的用于捕获循环肿瘤细胞的捕获单元和位于所述的捕获单元之间的用于防止该结构被阻塞的放行通道,所述的捕获单元在血液流动的方向成错位排列,错位排列的方式,能有效的对循环肿瘤细胞截留,如果位于第一个的捕获单元没有截住肿瘤细胞,那么随后的错位排列的其他捕获单元会有一个能截住该细胞,这样可以大大的增加肿瘤细胞被截获的概率。
进一步的,所述的捕获单元包括有相对排列的第一捕获块和第二捕获块,所述的第一捕获块和第二捕获块之间的距离小于肿瘤细胞的直径,所述的第一捕获块一个侧面、第二捕获块一个侧面以及位于第一捕获块和第二捕获块之间的距离构成一个开放式的用于容纳肿瘤细胞的容纳区,该容纳区的设置,能有效的将截留的肿瘤细胞安置在截留的位置。一般来说容纳区只能容纳一个肿瘤细胞,如果有多的细胞,会随着血液继续向前流动。
进一步的,所述的第一捕获块和第二捕获块是横截面为三角形的微柱,两个微柱上由三角形顶点构成的两条边相对设置,肿瘤细胞被截留在相对的两个微柱之间。除此之外,第一个第一捕获块和第二捕获块还可以是不规则的其他形状,一般来说构成的容纳区是内凹的即可,所以可以是成一定角度内凹的其他的曲面结构。
更进一步的,相对的第一捕获块和第二捕获块之间的距离为7-9微米,相邻的第一捕获块和第二捕获块之间的距离为15-20微米。也就是说相对的第一捕获块和第二捕获块之间的距离小于肿瘤细胞的直径,方便对肿瘤细胞进行截留;相邻的第一捕获块和第二捕获块的距离大于远大于血液中红细胞、白细胞和肿瘤细胞直径,不会造成血液阻塞,从而避免滤膜技术的阻塞问题。
进一步的,所述的捕获单元以阵列的方式沿血液流动的方向排列,其排列方向和血液流动的方向成0.1-15度夹角,该夹角的设置,使得错位的设置更适合对血液中的肿瘤细胞进行截留。
本发明的第二个目的在于提供一种捕获外周血循环肿瘤细胞的芯片,其特征在于,所述的芯片包括有上述的捕获外周血循环肿瘤细胞的结构。
进一步的,所述的芯片包括有盖片和位于盖片下方的基片,所述的捕获外周血循环肿瘤细胞的结构位于盖片的下部。
进一步的,所述的基片或盖片由玻璃、硅和聚合物中的一种或多种制成,所述聚合物为聚甲基丙烯酸甲酯、聚碳酸酯、聚苯乙烯、聚乙烯、硅树脂、聚乙酸乙烯酯、聚丙烯、聚氯乙烯、聚醚醚酮、聚对苯二甲酸乙二醇酯环烯烃聚合物和环烯烃共聚物中的一种或多种。
本发明的目的之三在于提供一种捕获外周血循环肿瘤细胞的使用方法,将处理后的血液通过捕获外周血循环肿瘤细胞的芯片后,对芯片进行冲洗,冲洗完成后,获得截获的肿瘤细胞。
本发明的有益效果在于,当外周血通过该芯片/结构时,大的循环肿瘤细胞以及部分白细胞(直径大于捕获间隔7-9微米)能够被捕获单元捕获,被捕获后,细胞卡在捕获单元中间,血液中的其它组分可以从捕获单元两侧的放行通道流过,由于捕获单元之间的间隔15-20微米远大于血液中红细胞、白细胞和肿瘤细胞直径,不会造成血液阻塞,从而避免滤膜技术的阻塞问题,实现更高效率的捕获血液中的肿瘤细胞,实现了截留和放行两不误。
附图说明
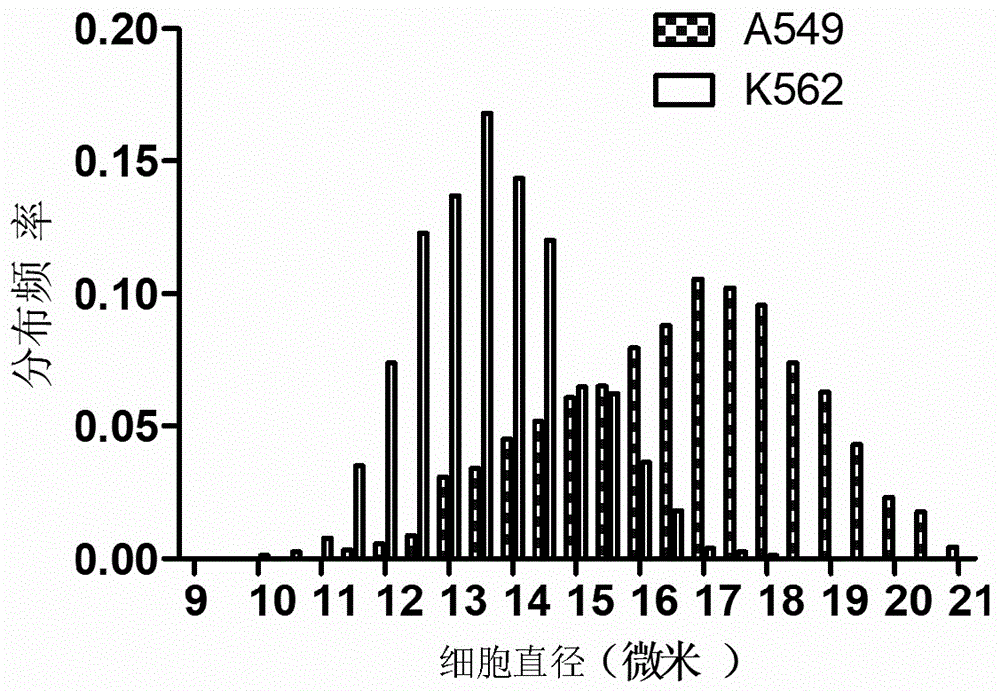
图1为肿瘤细胞a549和k562细胞直径分布范围;
图2为用于k562和a549细胞捕获的芯片尺寸示意图;
图3为用于k562和a549细胞捕获的芯片中捕获单元尺寸示意图;
图4为k562肿瘤细胞捕获效率;
图5为a549肿瘤细胞捕获效率。
具体实施方式
下面结合附图,对本发明作进一步的解释和说明。
为了验证该芯片对外周血循环肿瘤细胞的捕获效果,我们将白血病肿瘤细胞k562和肺癌肿瘤细胞a549提前染色后按一定数量加入到健康人血液中,再将血液通入芯片中,通过计算捕获在芯片中的肿瘤细胞数量以及废液中的肿瘤细胞数量,得到捕获效率。
k562和a549是两种比较典型的肿瘤细胞,如图1所示,k562细胞直径较小,分布范围在11-16微米,刚好大于捕获单元的微柱间隔7-9微米;而肺癌细胞a549直径较大,分布范围在12-20微米。
实施例1
如果图2所示,芯片长度l为47毫米,宽度d为15.5毫米,中间细胞捕获区域长度l’为36毫米。
如图3所示,构成捕获单元的第一捕获块(1)和第二捕获块(1’)均为横截面为三角形的微柱(柱子)的形状,三角形两条侧边a长12.5微米、底边b长15微米,捕获单元中相对的两个三角形微柱间隔c是8微米,捕获单元纵向间隔e和横向间隔e’都是20微米,捕获单元阵列倾斜角β为1度,也就是说捕获单元成错列排列,这样一来,在血液流过的过程中,如果第一排没有捕获,那么错列的第二排有可能会将其捕获,由于有很多排列,所以肿瘤细胞被捕获的可能性就大大的增加,芯片中所有微柱高度30微米(图中未示出),芯片中捕获单元的数量总计约35*105个。
k562细胞(001)提前用荧光染料染色,将约1000个用荧光染料标记过的k562细胞加入到2毫升健康人血液中,然后将2毫升血液用pbs(磷酸盐缓冲液)溶液稀释至10毫升,将10毫升血液通过注射泵通入到芯片入口,分别控制溶液流速为0.5,1.0,2.0,3.0,4.0,5.0毫升/分钟,当流速小于2毫升/分钟的时候,捕获率大于95%,5.0毫升/分钟以下时,捕获率大于90%。血液通入完成后,再用pbs溶液冲洗芯片约2分钟,冲洗速度控制在0.5毫升/分钟。
捕获过程中,大的k562细胞(001)以及部分白细胞被第一捕获块(1)、第二捕获块(1’)和位于两者之间的距离组成的容纳区截留在其中,血液中的其它组分(002)可以从捕获单元两侧的放行通道流过,避免血液的流动被阻塞。
冲洗完成后,将芯片放置于荧光显微镜进行观察,得到芯片中捕获到的k562细胞数量。同时收集从芯片中流出的废液和冲洗液,加入红细胞破碎液,将红细胞破碎后的细胞悬液离心,并用pbs溶液重悬,然后置于细胞培养用24孔板中进行观察,从而得到废液中肿瘤细胞数量,细胞捕获效率按下列公式计算:捕获效率=芯片中的k562细胞数量/(芯片中的k562细胞数量+废液中的k562细胞数量)。k562捕获效率与流速之间的关系如图4所示,随着流速加大,捕获效率有轻微下降趋势,但总体捕获效率大于90%。
实施例2
如果图2所示,芯片长度47毫米,宽度15.5毫米,中间细胞捕获区域长度36毫米。如图5所示,捕获单元中三角形微柱的两条边长12.5微米、一条边长15微米,捕获单元中相对的两个三角形微柱间隔是8微米,捕获单元纵向间隔和横向间隔(相邻的)都是20微米,捕获单元阵列倾斜角度1度,芯片中所有微柱高度30微米,芯片中捕获单元的数量总计约35*105个。
a549细胞提前用荧光染料染色,将约1000个用荧光染料标记过的a549细胞加入到2毫升健康人血液中,然后将2毫升血液用pbs(磷酸盐缓冲液)溶液稀释至10毫升,将10毫升血液通过注射泵通入到芯片入口,分别控制溶液流速为0.5,1.0,2.0,3.0,4.0,5.0毫升/分钟,由于a549细胞较大,其捕获率大于k562捕获率,同样的,随着血流速度的增加捕获率下降。血液通入完成后,再用pbs溶液冲洗芯片约2分钟,冲洗速度控制在0.5毫升/分钟。
冲洗完成后,将芯片放置于荧光显微镜进行观察,得到芯片中捕获到的a549细胞数量。同时收集从芯片中流出的废液和冲洗液,加入红细胞破碎液,将红细胞破碎后的细胞悬液离心,并用pbs溶液重悬,然后置于细胞培养用24孔板中进行观察,从而得到废液中肿瘤细胞数量,细胞捕获效率按下列公式计算:捕获效率=芯片中的a549细胞数量/(芯片中的a549细胞数量+废液中的a549细胞数量)。
a549捕获效率与流速之间的关系如图5所示,与k562细胞类似,随着流速加大,捕获效率有轻微下降趋势。但同样流速下,a549的捕获效率大于k562,这是由于a549细胞直径大于k562,被捕获在8微米间隔后,很难再被流体冲走。
- 还没有人留言评论。精彩留言会获得点赞!