一种同步纯化脂肪酶、酸性蛋白酶和α-淀粉酶的方法与流程
本发明属于蛋白纯化领域,特别涉及一种同步纯化酶粉中脂肪酶、酸性蛋白酶、α-淀粉酶三种蛋白的方法。
背景技术:
脂肪酶,是重要的工业酶制剂品种之一,可以催化解脂、酯交换、酯合成等反应,广泛应用于能源、油脂加工、食品、医药等行业领域。自然界中,脂肪酶普遍存在于植物种子、动物组织及微生物中,其中,工业用脂肪酶多源于微生物。因其反应所需条件温和,催化率高,立体选择性好,广泛的底物特异性以及便于提取与潜在的无限供给,所以得到广大工业领域的普遍使用。
在当今社会,由于食品工业的迅猛发展,消费者的食品安全和健康意识日益增强,对面粉及豆制品的要求越来越高。若想生产好的面粉,就要有优质的原材料,所以需要在食品处理中添加催化酶,酶的催化效率特别高,比普通催化剂高出100倍以上,它不仅能提高面包的烘焙品质,还可以延长制品的保质期。
蛋白酶是可以水解蛋白中的肽键并生成氨基酸或小肽的一类酶,是世界三大酶制剂之一,占全球酶制剂销量的60%,其主要来源于动物、植物和微生物,一般情况下不含有毒有害物质,而且水解反应完全后自身可以被灭活,因此在食品工业中有着广泛的应用。其中酸性蛋白酶是一种适合于在酸性环境下水解蛋白质的酶类,它主要用于毛皮软化和脱毛处理,也可用于羊毛低温染色和啤酒澄清工艺,以及消炎止咳,化痰和助消化。在啤酒澄清过程中需要添加蛋白酶来降解啤酒中的悬浮物,以提高啤酒的澄清度,另外还可以提高底物的利用率,降低成本。
淀粉酶是水解淀粉和糖原的酶类总称,通常可以通过淀粉酶催化水解织物上的淀粉浆料。由于淀粉酶的高效性以及专一性,酶退浆的退浆率高,污染少,且不损伤纤维。其中α-淀粉酶是目前运用最多的一种水解酶类之一,可用于食品工业、啤酒酿造、发酵、饲料、纺织、酒精工业、烘焙工业、医药等许多工业。
纯化蛋白的过程中由于各蛋白的特性不一,若想分离出一种目标蛋白,需考虑蛋白分子的带电性质,溶解度,分子大小以及配体特异性,通常会经过多步层析逐步消除杂蛋白特性的方法来纯化。现有技术中没有同步纯化脂肪酶、酸性蛋白酶、α-淀粉酶三种蛋白的方法的报道。
技术实现要素:
本发明的目的是提供一种可同步纯化脂肪酶、酸性蛋白酶、α-淀粉酶三种蛋白的方法。通过一步层析法,并结合本发明的反应条件,可同步纯化出三种目标蛋白,其操作简便,仅需一次离子层析便可高效纯化三种蛋白,最终使得脂肪酶纯化倍数提高63.24倍,酸性蛋白酶10.33倍,α-淀粉酶31.69倍。
为实现上述目的,本发明采用硫酸铵盐析以及qbeads6ff阴离子层析来进行三种蛋白的纯化。该蛋白纯化技术通过下述步骤进行:
(1)通过硫酸铵盐析的方法确定三种蛋白析出时所对应的硫酸铵饱和度;
分别将三种酶粉与各自的缓冲液按照1:10(1g酶粉:10ml缓冲液)的比例进行稀释,混匀后8,000rpm离心5min,在上清液中加入硫酸铵粉末使硫酸铵饱和度达到40%,静置30min后,8,000rpm再次离心5min,在上清液中再次加入硫酸铵粉末使硫酸铵饱和度达到50%,静置30min,8,000rpm再次离心5min,上清液补充硫酸铵至60%饱和度,梯度盐析直至硫酸铵饱和度为90%,最后收集各梯度的上清和沉淀放入透析袋中除盐。
(2)将5-10倍柱体积盐析后的酶液上样于q柱,流速为1-5ml/min,(上样前酶液需经0.45μm滤头过滤除杂。
(3)配制50-400mm的nacl溶液,按照5-10倍柱体积梯度洗脱q柱,收集各梯度的洗脱液,浓缩后进行酶活与蛋白测定。
(4)将浓缩液进行sds-page电泳,观察蛋白纯化后的效果。
其中,步骤(1)中的酶粉由江苏悠恒生物技术有限公司提供,缓冲液选择:通过优化后,纯化脂肪酶的缓冲液为磷酸盐缓冲液(ph7.5),纯化酸性蛋白酶以及α-淀粉酶的缓冲液为tris-hcl(ph7.6)。除盐的方法为将沉淀再次溶解于相应的缓冲液中放入截留分子量为3kda的透析袋,两端夹紧后放入缓冲液中4℃透析12h除盐。
步骤(3)中收集的洗脱液需用浓缩管离心进行浓缩,浓缩管浓缩5倍体积量。
附图说明
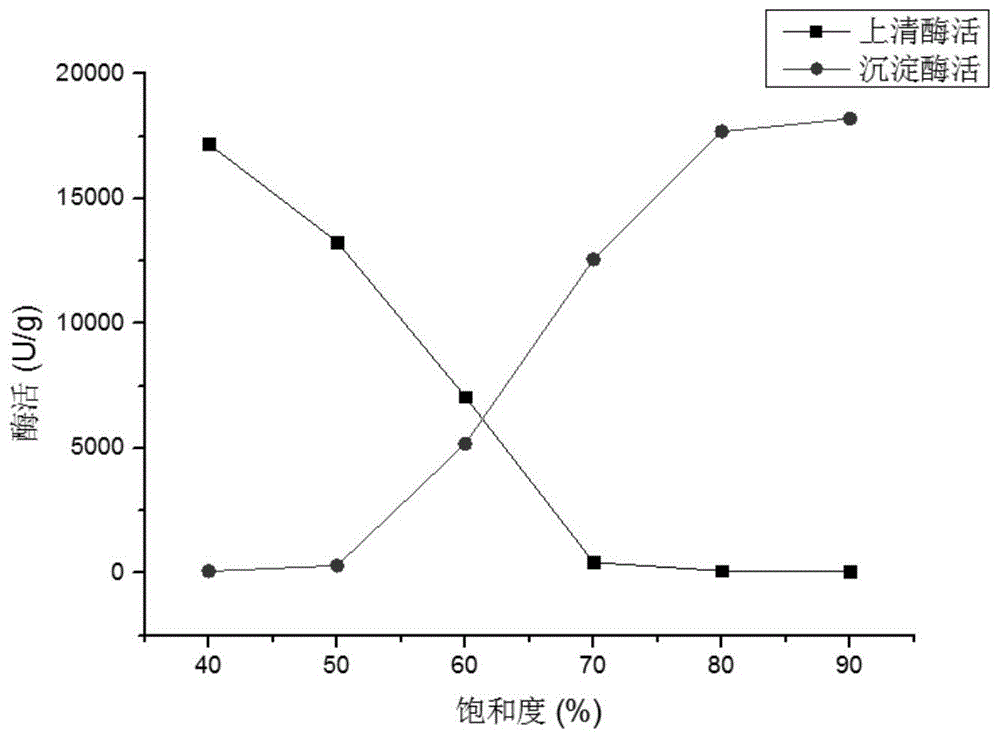
图1为硫酸铵分级盐析图;
图2为粗酶液电泳图;
图3为不同饱和度硫酸铵盐析电泳图;1孔:marker,2-7孔:30-80%硫酸铵盐析;
图4为脂肪酶、酸性蛋白酶、α-淀粉酶三种蛋白纯化后的电泳图;1孔:marker,2孔:粗酶液,3孔:低饱和度硫酸铵盐析,4孔:低饱和度硫酸铵除杂,补至高饱和度盐析,5孔:脂肪酶,6孔:酸性蛋白酶,7孔:α-淀粉酶。
图5为等电点沉淀酸性蛋白酶电泳图。
图6为流速8ml/min时的蛋白酶电泳图。
具体实施方式
本发明所述的酶粉由江苏悠恒生物技术有限公司提供,蛋白纯化过程中的离子层析填料(qbeads6ff)购自常州天地人和公司。本发明中三种酶的酶活测定均采用中华人民共和国国家标准法发布的试验方法,详见gb/t23535-2009、gb/t23527-2009、gb/t24401-2009。
实施例1
分别称取三种酶粉各1g与相应的缓冲液(纯化脂肪酶采用的缓冲液为ph7.5的磷酸盐缓冲液,纯化酸性蛋白酶以及α-淀粉酶的缓冲液为ph7.6的tris-hcl)按1:10(1g酶粉:10ml缓冲液)比例混匀后,8,000rpm离心5min,向上清中按40-90%的饱和度填加事先研磨好的硫酸铵粉末(边加边缓慢搅拌),4℃静置4h,离心收集沉淀,将沉淀再次溶解于相应的缓冲液中放入截留分子量为3kda的透析袋,两端夹紧后放入缓冲液中4℃透析12h除盐,透析结束后收集各组分酶液测定沉淀与上清的酶活,绘制硫酸铵分级盐析图。最后收集各个饱和度硫酸铵沉淀下来的酶液进行sds-page电泳确定三种目标蛋白析出时所对应的硫酸铵饱和度,结果如图1,3所示。
本实例说明,在硫酸铵饱和度达到50%时有沉淀析出,并且上清中检测到酶活力,沉淀部分的酶活力随硫酸铵饱和度的增加而增加,上清液的酶活力随硫酸铵饱和度的增加而减少。当硫酸铵饱和度达到80%时,沉淀中酶活力达到最大值而上清中几乎检测不到酶活力。因此确定80%的硫酸铵饱和度可以析出酶液中所有蛋白。
实施例2
将透析好的脂肪酶粗酶液(0.45μm滤膜过滤)上样于缓冲液平衡好的qbeads6ff离子层析柱,流速控制在1ml/min。再用5倍柱体积50mm的nacl溶液(对应的缓冲液配制)梯度洗脱,收集各个梯度的洗脱液装入透析袋中4℃静置10h透析除盐。透析结束后,装入浓缩管8,000rpm离心20min,收集浓缩液进行蛋白浓度和酶活的测定同时进行sds-page电泳观察蛋白纯化效果,结果见图4第6孔。
本实例说明,脂肪酶通过低饱和度硫酸铵盐析,低浓度盐洗脱,浓缩后纯化效果最好,纯化倍数达到63.24倍;蛋白酶通过高饱和度硫酸铵盐析,高浓度盐洗脱,浓缩后纯化效果最好,纯化倍数达到10.33倍;淀粉酶直接通过高浓度盐洗脱,浓缩后纯化效果最好,纯化倍数达到31.69倍。详细数据见下表:
表1.脂肪酶的纯化
表2.蛋白酶的纯化
表3.淀粉酶的纯化
实施例3
将透析好的蛋白酶粗酶液(0.45μm滤膜过滤)上样于缓冲液平衡好的qbeads6ff离子层析柱,流速控制在3ml/min。再用5倍柱体积250mm的nacl溶液(对应的缓冲液配制)梯度洗脱,收集各个梯度的洗脱液装入透析袋中4℃静置10h透析除盐。透析结束后,装入浓缩管8,000rpm离心20min,收集浓缩液进行蛋白浓度和酶活的测定同时进行sds-page电泳观察蛋白纯化效果,结果见图4第7孔。
实施例4
将透析好的淀粉酶粗酶液(0.45μm滤膜过滤)上样于缓冲液平衡好的qbeads6ff离子层析柱,流速控制在5ml/min。再用5倍柱体积350mm的nacl溶液(对应的缓冲液配制)梯度洗脱,收集各个梯度的洗脱液装入透析袋中4℃静置10h透析除盐。透析结束后,装入浓缩管8,000rpm离心20min,收集浓缩液进行蛋白浓度和酶活的测定同时进行sds-page电泳观察蛋白纯化效果,结果见图4第7孔。
实施例6
将纯化好的三种酶液进行sds-page电泳检测,试剂盒购自上海生工,结果如图4所示。
本实施例说明,通过sds-page电泳图我们可以发现,脂肪酶、酸性蛋白酶、α-淀粉酶三种酶纯化效果较好,条带单一明显,杂蛋白污染不严重,并且通过计算得出:脂肪酶的相对分子质量大约为36.2kda,酸性蛋白酶的相对分子质量大约为61.7kda,α-淀粉酶的相对分子质量大约为49.8kda。
对比例1
对目标蛋白进行析出的时候,采用等电点沉淀的方法,将粗酶液的ph值分别调至三种目标蛋白所对应的等电点(例酸性蛋白酶等电点pi4.0左右),冰浴静置1h,而后8,000rpm离心5min收集沉淀,沉淀便是目标蛋白,但结果我们发现由于粗酶液中杂蛋白太多,因此在该等电点析出的蛋白质中,会混有一些小分子蛋白物质造成污染,结果如图5所示,该图可清晰看出,调至酸性蛋白酶的等电点后,有很多杂条带污染,因此后续我们采用硫酸铵盐析方法沉淀目标蛋白后再进行离子层析,这样通过小分子蛋白与目标蛋白的物理特性不同便可消除小分子蛋白物质。
对比例2
由于蛋白在不同缓冲液条件下的适应力不同,因此我们通过优化其缓冲液体系来提高目标蛋白的酶活与蛋白含量,例:我们选取tis-hcl(ph7.6)、乳酸钠(ph3.0)、磷酸盐缓冲液(ph7.5)、生理盐水(ph7.0)四种缓冲液来溶解目标蛋白,所产酶活与蛋白含量如下表1,2,3:
表1.酸性蛋白酶在不同缓冲液下的酶活与蛋白含量
表2.脂肪酶在不同缓冲液下的酶活与蛋白含量
表3.淀粉酶在不同缓冲液条件下的酶活与蛋白含量
从上述表中可看出,酸性蛋白酶、淀粉酶的最适缓冲液为tis-hcl,脂肪酶的最适缓冲液为磷酸盐缓冲液。
对比例3
将透析好的蛋白酶粗酶液(0.45μm滤膜过滤)上样于缓冲液平衡好的qbeads6ff离子层析柱,流速控制在8ml/min。再用5倍柱体积250mm的nacl溶液(对应的缓冲液配制)梯度洗脱,收集各个梯度的洗脱液装入透析袋中4℃静置10h透析除盐。透析结束后,装入浓缩管8,000rpm离心20min,收集浓缩液进行蛋白浓度和酶活的测定同时进行sds-page电泳观察蛋白纯化效果,结果见图6,第四孔为8ml/min时的蛋白酶条带,可看出明显有杂蛋白干扰。
- 还没有人留言评论。精彩留言会获得点赞!