一种经修饰的腺相关病毒的制作方法
1.本发明属于生物技术领域,涉及一种经修饰的腺相关病毒。具体的,本发明涉及一种经 修饰的腺相关病毒,其可实现分泌表达含有固有免疫刺激因子和免疫检查点抑制剂和靶向肿 瘤凋亡活性肽的嵌合肽或嵌合蛋白,并在制备治疗或预防不限癌肿的肿瘤药物中的应用。
背景技术:
2.到目前为止现代抗癌药物的发展出现了三次大的革命:
[0003][0004]
第一次是1940年后出现的化疗药物,现在绝大多数临床使用的化疗药物都属于这一类。 但是化疗药物最难以解决的问题是它们并不能区分恶性细胞还是正常细胞,因此化疗药物在 杀死癌细胞的同时,也杀死人体正常细胞,对病人造成“不可逆伤害”,导致大多数患者最 终因为化药药物毒性而死亡。
[0005]
第二次是2000年后开始使用的靶向治疗,具有代表性的是2001年上市的治疗bcl-abl突变 基因慢性白血病的格列卫。这个药物让患者五年存活率从30%一跃到了89%。但是由于肿瘤的 基因组不稳定性和突变,以及肿瘤异质性,最终导致患者耐药性而靶向无效;靶向药耐药, 已经变成了一个棘手的世界难题,临床上有部分病人在用8-10月后,会出现耐药的现象。这 就好比我们用药物堵住了癌症生长的一条路,然而癌细胞也在进化,它另辟蹊径继续生长, 因此靶向药物可能将患者引入另外一个深渊。
[0006]
第三次就是免疫疗法。“免疫疗法”的靶点是正常免疫细胞,目标是激活人体自身的免 疫系统来治疗癌症。肿瘤的免疫疗法,分为靶向t细胞免疫调节物、靶向其他免疫细胞的免疫 调节物、肿瘤疫苗、细胞疗法、溶瘤病毒与靶向cd3的双特异性抗体六种。在医学应用方面, 免疫疗法中免疫检查点抑制剂pd1是行业内公认的神药,2013年,施贵宝和默沙东推出的作用 于相同靶点pd-1的两个新药物,临床效果显示在所有已有治疗方案都失效的黑色素癌晚期病 人(多数癌症已经转移)身上,这两个药物让60%以上的病人肿瘤减小乃至消失了超过2年。 但是目前免疫疗法仍然存在致命的缺陷,即有效率低,在临床中,pd-1抑制剂仅对20%的患者 有效;患者使用pd-1抗体,逐渐产生免疫原性,体内产生抗pd1抗体,药物失效;而且因其在 体内的半衰期很短,临床需要不断的重复给药,不但治疗费用巨大同时也给医疗带来巨大的 工作量。这是业内所关心的且不希望其正负面作用共存的一个问题,至今没有解决渠道。近 年溶瘤病毒相关的免疫疗法逐步引起大家的重视,仅在2018上半年就有两个大的溶瘤病毒投 资,第一个是默沙东3.96亿美元收购vialytic,第二个是强生旗下的杨森公司总投资10.4亿 美元给benevirbiopharm的t-stealth溶瘤病毒平台。其实早在2003年和2005年,cfda就批 准了两款溶瘤病毒产品上市,包括“今又生”(p53腺病毒注射液)和安柯瑞(重组人5型腺 病毒注射液)。但是上述两个产品临床反应效果不佳,疗效也未得到国际同行业的认可。
[0007]
鉴于重组腺相关病毒载体(raav)源于非致病的野生型腺相关病毒,由于其安全性
好、宿 主细胞范围广(分裂和非分裂细胞)、免疫源性低,在体内表达外源基因时间长等特点,被视 为最有前途的基因转移载体之一,在世界范围内的基因治疗和疫苗研究中得到广泛应用。因 此,利用免疫疗法的机制,开发一种新的且能够表达用于广谱肿瘤(实体瘤与非实体瘤)治 疗的腺相关病毒,解决目前现有免疫疗法产品临床效果差、有效率低、半衰期短、重复给药 等问题。
技术实现要素:
[0008]
为实现以上目的,本发明构建一种新型经修饰的腺相关病毒(aav)。
[0009]
本发明选用一种临床上常用的病毒载体(aav),其中优选aav2,通过基因工程构建,该载 体能实现分泌表达抗肿瘤细胞的嵌合肽或嵌合蛋白。
[0010]
我们经大量研究无意中发现加入编码固有免疫刺激因子gm-scf,可以定向诱导“冷”性 肿瘤向“热”肿瘤转变,转变后充满t细胞的“热”肿瘤对免疫检查点抑制剂更为敏感,而 肿瘤“是冷是热”决定了它能否响应免疫检查点抑制剂。特别地,我们经过研究发现同时表 达固有免疫刺激因子(gm-scf)和pd1、tim3、lag3中的任意一种单链抗体免疫检查点抑制 剂,尤其优选pd1scfv、tim3scfv、lag3scfv的任意一种单链抗体免疫检查点抑制剂,可解决 单独免疫检查点抑制剂临床效果差、有效率低的问题。
[0011]
另外,依近年来大量的临床经验和发表文献证实:大量实体瘤50%以上和p53突变或缺 失有关,p53基因突变,可能对免疫药物敏感(dong et,al,2017;miao et al.,2018), 这种情况下,我们可以采用p53机制的靶向肿瘤凋亡活性肽发挥抗肿瘤作用,经申请人研究 发现,p53 n端15肽、c端22肽、p53n端37肽(p73抑制肽)的抗癌效果优于p53,并且由 于正常二倍体细胞没有p53突变,p53n端15肽、c端22肽、p53n端37肽(p73抑制肽)无 法对正常组织进行杀伤,其对正常组织是无毒的,因此具有肿瘤靶向性;但是另外50%肿瘤 患者的基因和免疫组化检测p53没有异常或是临床无意义突变,这些病人的肿瘤发生和发展 可能是非依赖于p53的,这种情况下,采用非p53机制的凋亡靶向活性肽发挥抗肿瘤作用, 例如apoptin、orf4、shepherdin、par-4sac,具有特异诱导转化细胞和肿瘤细胞的凋亡和 坏死能力,不损伤正常人的二倍体细胞。
[0012]
鉴于以上研究,申请人通过本发明制备的一种经修饰的aav,可以实现分泌表达抗肿瘤 细胞的嵌合肽或嵌合蛋白包含固有免疫刺激因子和免疫检查点抑制剂和靶向肿瘤凋亡活性肽。 该组合在体内可以实现固有免疫刺激因子和免疫检查点抑制剂和靶向肿瘤凋亡活性肽同时表 达,具有更强的协同作用,既可以极大提高免疫疗法的临床有效性、有效率,还可以靶向针 对肿瘤细胞促进凋亡,并且对人体无毒无害。
[0013]
进一步的,所述的一种经修饰的aav,优选aav2。
[0014]
进一步的,所述的aav携带的蛋白衣壳与野生型aav几乎完全相同,然而衣壳内的基因 组中编码病毒蛋白的部分完全被删除,唯一被保留的部分是itrs(末端反向重复序列)。
[0015]
进一步的,所述的可实现分泌表达抗肿瘤细胞的嵌合肽或嵌合蛋白中,用于固有免疫刺 激因子是粒细胞集落刺激生物因子(gm-csf)。
[0016]
进一步的,所述的一种可实现分泌表达抗肿瘤细胞的嵌合肽或嵌合蛋白中,免疫检查点 抑制剂,选自pd1、tim3、lag3中的任意一种单链抗体;
[0017]
优选pd1 scfv、tim3 scfv、lag3 scfv中的任意一种;
[0018]
进一步优选为pd1 scfv。
[0019]
进一步的,所述的可实现分泌表达抗肿瘤细胞的嵌合肽或嵌合蛋白中,靶向肿瘤凋亡活 性肽选自p53n端15肽、p53 c端22肽、p53n端37肽(p73抑制肽)中的任意一种或apoptin、 orf4、sphervin、par-4sac中的任意一种。
[0020]
进一步的,靶向肿瘤凋亡活性肽的选择由肿瘤细胞的基因检测决定,如所述的检测结果 与p53缺陷或突变相关,则靶向肿瘤凋亡活性肽选自p53n端15肽、p53 c端22肽、p53n端 37肽(p73抑制肽)中的任意一种;如所述的检测结果与p53缺陷或突变不相关,则靶向肿 瘤凋亡活性肽选自apoptin、orf4、sphervin、par-4sac中的任意一种。
[0021]
本发明所述的一种经修饰的aav,其包含可实现分泌表达抗肿瘤细胞的嵌合肽或嵌合蛋 白的核酸序列组合。
[0022]
进一步的,所述的可实现分泌表达抗肿瘤细胞的嵌合肽或嵌合蛋白的核酸序列组合,可 以编码固有免疫刺激因子和免疫检查点抑制剂和靶向肿瘤凋亡活性肽。
[0023]
进一步的,所述的可实现分泌表达抗肿瘤细胞的嵌合肽或嵌合蛋白的核酸序列组合,包 括可以编码固有免疫刺激因子gm-csf和免疫检查点抑制剂pd1scfv或tim3 scfv或lag3 scfv 中的任意一种和靶向肿瘤凋亡活性肽p53n端15肽、p53 c端22肽、p53n端37肽(p73抑 制肽)中的任意一种或apoptin、orf4、shepherdin、par-4sac中的任意一种;
[0024]
其中,靶向肿瘤凋亡活性肽核酸序列的选择由肿瘤细胞的基因检测决定,如所述的检测 结果与p53缺陷或突变相关,则靶向肿瘤凋亡活性肽核酸序列选自p53n端15肽、p53 c端 22肽、p53n端37肽(p73抑制肽)中的任意一种;如所述的检测结果与p53缺陷或突变不 相关,则靶向肿瘤凋亡活性肽核酸序列选自apoptin、orf4、shepherdin、par-4sac中的任 意一种。
[0025]
进一步的,所述的可实现分泌表达抗肿瘤细胞的嵌合肽或嵌合蛋白的核酸序列组合含有 信号肽和穿膜肽序列。
[0026]
进一步的,所述的可实现分泌表达抗肿瘤细胞的嵌合肽或嵌合蛋白的核酸序列组合含有 内含子序列。
[0027]
申请人通过本发明制备的一种经修饰的aav,通过肌肉注射方式给药,施药剂量是 5*10
7-5*10
12
vp,通过“体内给药”方式,经修饰的aav在体内可以存活一年以上,可以保证 一次给药,一年内有效的治疗方案。解决单独免疫检查点抑制剂(如pd1抗体)或者gm-csf 和免疫检查点抑制剂组合体内半衰期短,临床上重复给药的问题。
[0028]
另外本发明提供的经修饰的aav在肿瘤治疗中通过刺激固有免疫因子提升受体自身免疫 力,通过免疫检查点抑制剂,高效识别肿瘤细胞,根据基因检测,精准识别肿瘤类别,从而 增加靶向肿瘤凋亡活性肽,进而发挥不限癌种(包括肺癌、黑色素癌、头颈部癌、肝癌、淋 巴癌、胃癌、肾癌、前列腺癌、乳腺癌、膀胱癌、结直肠癌、宫颈癌、卵巢癌、胰腺癌、胆 囊癌等)治疗的独特优势,抗肿瘤效果和肿瘤响应率显著提高,能实现本发明的预期目的和 有益效果。
[0029]
本发明还涉及所述的任一实现分泌表达抗肿瘤细胞的嵌合肽或嵌合蛋白的核酸序列和/ 或任一实现分泌表达抗肿瘤细胞的嵌合肽或嵌合蛋白和/或任一载体和/或任一病毒在制备治 疗或预防不限癌种的肿瘤药物种的应用。
附图说明
[0030]
附图1构建的经修饰的avv的表达盒结构以及对照avv的表达盒结构示意图
[0031]
附图2裸鼠中hct116肿瘤细胞的体积变化与用药时间图
[0032]
附图3裸鼠中caco-2肿瘤细胞的体积变化与用药时间图
[0033]
附图4裸鼠中siha肿瘤细胞的体积变化与用药时间图
[0034]
附图5裸鼠中mcf7肿瘤细胞的体积变化与用药时间图
具体实施方式
[0035]
实施例1:经修饰的腺相关病毒(aav)的构建
[0036]
本发明提供了一种经修饰的腺相关病毒(aav),所述的可实现分泌表达抗肿瘤细胞的 嵌合肽或嵌合蛋白包含免疫固有因子和免疫检查点抑制剂和靶向肿瘤凋亡活性肽,并构建了 能够实现三种嵌合肽和或嵌合蛋白分泌表达的重组腺相关病毒。具体构建方法表现为:在 cmv启动子和第一嵌合肽或嵌合蛋白中间添加信号肽(nt4或igg)和人工内含子进行拼接, 在第一嵌合肽/嵌合蛋白和第二嵌合肽/嵌合蛋白序列添加2a(自剪多肽序列)进行拼接,在 第二嵌合肽/嵌合蛋白和第三嵌合肽/嵌合蛋白序列添加2a(自剪多肽序列)进行拼接。
[0037]
furin-2a是2a自剪多肽元件(2a self cleavage peptide)的一种。作为拼接序列,2a肽 段中,以口蹄疫病毒(fmdv)2a(f2a)研究最为透彻,其自剪切效率高、上下两个基因表 达平衡性好且结构短小(20-22个氨基酸),是载体构建过程中很好的连接工具。2a肽的保 守序列为末位为-npgp,剪切位置在g和p之间。在f2a前面加入一个furin蛋白酶酶切位 点rakr,再加入一个-gsg-可以加强2a肽的剪切能力,还能去除2a自剪切后残留在前面 蛋白羧基端的序列。因此本发明在拼接序列的选择中优选furin-2a。
[0038]
本发明在靶向凋亡活性肽的羧基端加入了穿膜肽(cpps cell penetrating pepetides)帮助靶 向肿瘤凋亡活性肽更好的进入肿瘤细胞,包括tat穿膜肽或antp穿膜肽或一种有9个氨基 酸的环状肿瘤穿膜肽(crgdkgpdc)。
[0039]
本发明构建了7个经修饰的腺相关病毒,cmv和polya之间的即不同腺相关病毒载体的 表达盒,分别是(构成详见附图1中a,b,c,d,e,f,g):
[0040]
aav2-gm-csf-pd1scfv-p53(c22),
[0041]
aav2-gm-csf-pd1scfv-p53(n15),
[0042]
aav2-gm-csf-pd1scfv-p53(n37),
[0043]
aav2-gm-csf-pd1scfv-apoptin,
[0044]
aav2-gm-csf-pd1scfv-shepherdin,
[0045]
aav2-gm-csf-pd1scfv-orf4,
[0046]
aav2-gm-csf-pd1scfv-par4sac,
[0047]
并构建了7个对照腺相关病毒,其表达盒分别是(构成详见图1中h,i,j,k,l,m,n):
[0048]
aav2-gm-csf-pd1scfv,
[0049]
aav2
--
pd1scfv-p53(n15),
[0050]
aav2-gm-csf-p53(n15),
[0051]
aav2-gm-csf-apoptin,
[0052]
aav2-pd1scfv-apoptin,
[0053]
aav2-gm-csf,
[0054]
aav2-pd1scfv。
[0055]
以上所有的表达盒均采用全基因合成方式获得,然后插入paav-mcs载体,构成含插入目 的基因的病毒载体。
[0056]
实施例2:经修饰的腺相关病毒的鉴定
[0057]
获得将融合后的基因构建于paav-mcs后,转化至dh5α感受态细胞中,涂布到lb固体培 养平板上,置于37℃培养箱倒置培养过夜,待菌落长出后挑菌落进行菌落pcr,pcr结果为 阳性的菌落进行扩大培养,质粒小提后,序列鉴定无误。
[0058]
将正确的单克隆菌落扩大培养,并用qiagen去内毒素质粒大提试剂盒提取质粒用于后续 试验。
[0059]
实施例3:经修饰的腺相关病毒的包装和纯化
[0060]
对实施例1中所述的图1中的全部表达盒进行包装和纯化,以下仅以图1中b表达盒所 示的aav2-gm-csf-pd1scfv-p53(n15)重组腺相关病毒的包装和纯化为例,说明本发明中涉及 到的重组腺相关病毒的包装和纯化。
[0061]
(1)aav293细胞培养
[0062]
细胞采用含10%fbs的dmem高糖培养基在37摄氏度、5%co2培养箱中培养,采用75cm2的 细胞培养瓶。细胞生长至90%汇合时进行,传代弃去培养基,加入1ml0.25%胰蛋白酶,在37℃ 消化3min左右,注意在显微镜下观察细胞,当细胞皱缩,变圆时,加入9ml含10%fbs的dmem 培养基,吹打成单细胞悬液进行细胞计数,按1:3的比例进行传代。
[0063]
(2)病毒包装
[0064]
将aav293细胞进行细胞传代,然后在37℃,5%co2培养箱中培养,当细胞生长至60%-70% 汇合时,进行转染。采用三质粒转染系统,将paav-mcs-gm-csf-pd1scfv-p53(n15)和paav-rc 和phelper一同转染至aav-293细胞,具体为将paav-mcs-gm-csf-pd1scfv-p53(n15)和 paav-rc和phelper,按摩尔质量比1:1:1,总质粒量400ug每瓶进行转染。
[0065]
将400ug质粒和超纯水及2.5mol/l cacl2在15ml离心管中混匀,然后逐滴加入2xbbs (50mmol/l bes,280mol/l nacl,1.5mmol/l na2hpo4,ph6.95),边加入边尽力吹打以形成 较小的钙磷颗粒。加完后在室温下孵育20min。
[0066]
取出细胞,吸去培养基,用pbs清洗一次,然后将磷酸钙-dna溶液均匀加入细胞生长至 60%-70%汇合的aav-293细胞中,并在37℃,5%co2培养箱中继续培养,18h后,更换成dmem 培养基,继续培养。72h后将培养基转移至15ml离心管中,用pbs清洗一次细胞,再加入少 量pbs,用细胞刮板刮取瓶中的293细胞。如不立刻使用,将此细胞悬液转移至冻存管中, 在-80℃保存。
[0067]
(3)收获
[0068]
将感染了病毒的avv293细胞连同培养基一同收集到一个15ml的离心管中,1500g/min, 离心3分钟,分离细胞和上清,将上清另外存放,细胞用1ml pbs重悬。将细胞悬浮液在液 氮和37℃水浴中反复转移,冻融四次,每次凝固和解冻约10min。每次融解后振荡混匀。
[0069]
(4)病毒浓缩
[0070]
将反复冻融的细胞然后在4℃,8000g离心15min,取上清至新的15ml离心管中。将之前 的培养基上清也进行4℃,8000g离心15min,将两次离心的上清转移到同一个离心管中,混 匀。用0.45um滤器过滤除杂质。加入1/2体积的1m nacl,10%peg8000溶液,混合均匀, 4度过夜。
[0071]
将过夜的上清溶液进行离心,12,000rpm,4℃,2h。然后弃上清,病毒沉淀用适量的pbs 溶液溶解,待完全溶解后用0.22um滤器过滤除菌。加入核酸酶消化去除残留的质粒dna(终 浓度为50u/ml)。合上管盖,颠倒几次以充分混合。在37℃孵育30分钟。用0.22um过滤 头过滤,取滤出液,得到浓缩的aav病毒。
[0072]
(5)病毒滴度的测定(q-pcr法)
[0073]
取20ul浓缩病毒液,加入1ul rnase-free dnase,混匀,37℃水浴反应30min。然后4℃, 12000rpm/min,离心10min,取10ul上清到1.5ml ep管中。加入90ul dilution buffer (1mm tris-hcl,ph 8.0,0.1mm edta,150mm nacl),混匀,37℃水浴30min。将ep 管自然冷却至室温,加入1ul蛋白酶k,65℃水浴反应1h,去除病毒的蛋白质外壳。然后100℃ 沸水浴10min,自然冷却至室温。然后进行q-pcr检测滴度。
[0074]
获得共表达人gm-csf、pd1svfc、p53(n15)的重组腺相关病毒 aav2-gm-csf-pd1scfv-p53(n15),滴度达10x109pfu/l.
[0075]
实施例4:修饰的腺相关病毒以对不同类型肿瘤细胞杀伤活性的检测
[0076]
分别将hela299(宫颈癌细胞),eca-109(食管癌细胞),a549(肺癌细胞),mcf7(乳 腺癌细胞),gbc-sd(胆囊癌细胞),caco-2(结肠腺癌细胞),u251(胶质癌细胞),pc-3 (前列腺癌细胞),hct 116(结肠癌细胞),siha(子宫颈癌细胞),mg-63(骨肉瘤细胞), a3t(淋巴细胞白血病细胞)细胞按5x103/孔接种至96孔培养皿中,接种24h后,将 aav2-gm-csf-pd1scfv-p53(n15)进行稀释,以1倍moi(mulitiplicityofinfection病毒数量 与细胞数量之比)感染上述肿瘤细胞,7天后弃去病毒残液,通过mtt法检测aav2-gm-csf-pd1scfv-p53(n15)对各种细胞的杀伤作用。在酶标仪中读取od570,参考波长 630nm。做8个复孔,独立重复三次。
[0077]
杀伤率=1-[(测试孔平均od值-试剂空白组平均od值)/(阴性孔平均od值-试剂空白组平 均od值)],计算ic
50
值(moi ic
50
)。
[0078]
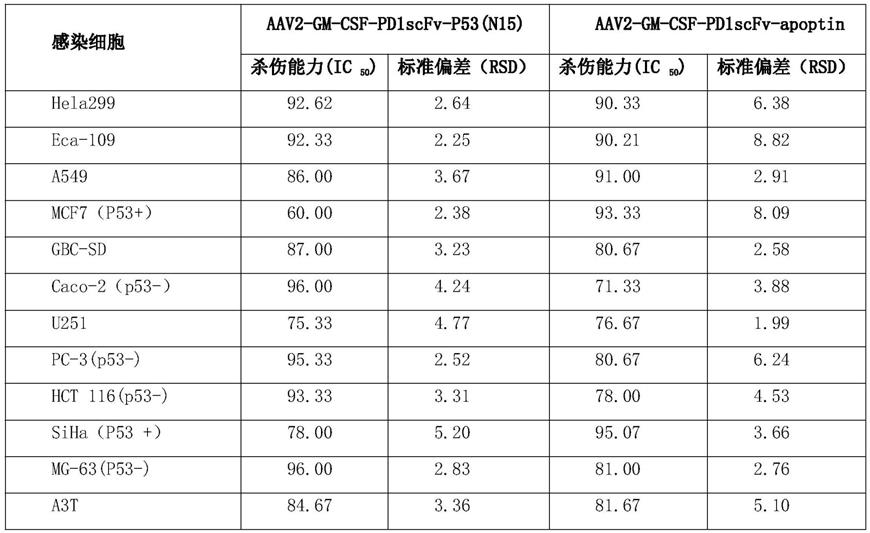
使用同样的方法检测aav2-gm-csf-pd1scfv-apoptin对上述肿瘤细胞的杀伤活力,结果 见下表:
[0079]
注:因前期细胞实验结果显示,aav2-gm-csf-pd1scfv-p53(n15)、 aav2-gm-csf-pd1scfv-p53(c22)、aav2-gm-csf-pd1scfv-p53(n37)结果相当,无显著差异, 因此以aav2-gm-csf-pd1scfv-p53(n15)作为p53靶向肿瘤凋亡活性肽的代表; aav2-gm-csf-pd1scfv-apoptin、aav2-gm-csf-pd1scfv-shepherdin、 aav2-gm-csf-pd1scfv-orf4、aav2-gm-csf-pd1scfv-par4sac结果相当,无显著差异,因此 以aav2-gm-csf-pd1scfv-apoptin作为非p53靶向肿瘤凋亡活性肽的代表。
[0080][0081]
小结:aav2-gm-csf-pd1scfv-p53(n15)对以上感染的肿瘤细胞均具有明显的杀伤能力, 尤其对hela299、eca-109、caco-2、pc-3、hct 116、mg-63具有很强的杀伤能力,其中对不 表达p53或表达失去活性的突变型的p53或p53片段的肿瘤细胞(标记为p53-)caco-2、pc-3、 hct 116、mg-63有更高的杀伤力,且aav2-gm-csf-pd1scfv-p53(n15)对于caco-2、pc-3、 hct 116、mg-63肿瘤细胞的杀伤力明显优于aav2-gm-csf-pd1scfv-apoptin;
[0082]
aav2-gm-csf-pd1scfv-apoptin对以上感染的肿瘤细胞均具有明显的杀伤能力,尤其对hela299、eca-109、a549、mcf7(p53+)、siha(p53+)具有很强的杀伤力,其中对表达 p53或p53片段的肿瘤细胞(标记为p53+)mcf7、siha具有更高的杀伤力,且 aav2-gm-csf-pd1scfv-apoptin对于mcf7、siha肿瘤细胞的杀伤力明显优于 aav2-gm-csf-pd1scfv-p53(n15);
[0083]
实施例5:修饰的腺相关病毒裸鼠体内实验:
[0084]
分别将处于对数期的siha(子宫颈癌细胞),caco-2(结肠腺癌细胞),mcf7(乳腺癌 细胞),hct 116(结肠癌细胞),接种至balb/c裸鼠内,检测本发明中构建的aav病毒对 移植瘤生长的抑制作用,结果见附图2-附图5。以对乳腺癌细胞(mcf7)的抑制作用为例, 其具体操作如下:
[0085]
取对数生长期的mcf7细胞用生理盐水稀释至1x108/ml,100ul/只注射于裸鼠侧腹部近腋 下部位的皮下。持续观察裸鼠的情况,约5周后,接种区域的皮下出现米粒大小的硬结。将 裸鼠随机分成9组(aav2-gm-csf-pd1scfv-p53(n15),aav2-gm-csf-pd1scfv-apoptin, aav2-gm-csf-pd1scfv,aav2-pd1scfv-p53(n15),aav2-gm-csf-p53(n15), aav2-gm-csf-apoptin,aav2-pd1scfv-apoptin,aav2-gm-csf,aav2-pd1scfv),每组5只。 用含2x108pfu病毒量的100ul重组腺相关病毒液在瘤内多点注射,隔日一次,共5次;空白 对照组以生理盐水代替重组病毒注射,100ulx5次。在注射前以及注射后第3、7、14、21、 28、35、42、49d测量瘤体生长情况,游标卡尺测量瘤体大小,以“axb2x0.5”公式计算瘤 体体积(a:最大径,b:最小径)。
[0086]
附图2-附图5显示这九种修饰的腺相关病毒均能减小肿瘤的体积, aav2-gm-csf-pd1scfv-p53(n15)和aav2-gm-csf-pd1scfv-apoptin减少肿瘤体积的效果最好, aav2-gm-csf-pd1scfv,aav2-pd1scfv-p53(n15),aav2-gm-csf-p53(n15), aav2-gm-csf-apoptin,aav2-pd1scfv-apoptin的效果次之,aav2-gm-csf,aav2-pd1scv的 效果更弱一些。
[0087]
其中aav2-gm-csf-pd1scfv-apoptin对p53+的siha、mcf7移植瘤的效果比 aav2-gm-csf-pd1scfv-p53(n15)好,aav2-gm-csf-apoptin和aav2-pd1scfv-apoptin对p53+ 的siha、mcf7移植瘤的效果也比aav2-gm-csf-p53(n15)和aav2-pd1scfv-p53(n15)要好。
[0088]
其中aav2-gm-csf-pd1scfv-p53(n15)对p53-的hct 116、caco-2移植瘤的效果比 aav2-gm-csf-pd1scfv-apoptin更好,并且aav2-gm-csf-p53(n15)和aav2-pd1scfv-p53(n15) 对p53-的hct 116、caco-2移植瘤的效果比aav2-gm-csf-apoptin和aav2-pd1scfv-apoptin 也要更好些。
[0089]
实施例6:修饰的腺相关病毒腹水瘤模型体内试验
[0090]
将处于对数期的hela299(宫颈癌细胞)用胰酶进行消化,制成浓度为2.0*106/ml的细 胞悬液,采用腹腔注射的方式接种至3-5周鼠龄的balb/c裸鼠体内,注射体积为200μl。小 鼠注射mcf7细胞21天后出现腹水瘤,成瘤率为90%,成瘤后病情发展较为缓慢,腹水瘤形 成后的生存时间为28~35天。
[0091]
将3-5周鼠龄的balb/c裸鼠随机分为3组,每组20只,分别是对照组,治疗组1 (aav2-gm-csf-pd1scfv-p53(n15))治疗组2(aav2-gm-csf-pd1scfv-apoptin)。在裸鼠接 种hela299(宫颈癌细胞)出现腹水瘤后,腹腔内注射病毒,注射量为4*105pfu/只;对照 组中20支小鼠从第4周开始陆续死亡,第6周已经全部死亡。治疗组1中的20支小鼠7-10 天后腹水消失,20支小鼠中有19只存活,生存期超过12周且无腹水瘤复发。治疗组2中的 20支小鼠7-10天后腹水消失,20支小鼠中有18只存活,生存期超过12周且无腹水瘤复发。 显示aav2-gm-csf-pd1scfv-apoptin和aav2-gm-csf-pd1scfv-p53(n15)都有很有效的治疗效 果。
[0092]
实施例7:修饰的腺相关病毒临床实施例
[0093]
患者信息:女,64岁,临床诊断为胆囊中-低分化腺癌,pd-l1免疫组化监测pd-l1 tps 表达阴性,tps<1%,pd-l1 cps表达阳性,cps≥1。临床使用pd1单抗治疗无效,化疗无效, 生存周期低于三个月。基因检测为p53无突变。
[0094]
治疗方案:施用aav-gm-scf-pd1scfv-apoptin,臀部肌肉注射1*10
10
vp。
[0095]
效果:一周后,腹水较少,胸水吸收,肺部阴影较少,症状缓解,疼痛缓解,检查甲胚 蛋白、癌胚抗原、c125测定等肿瘤抗原,显著降低,目前患者继续状态极佳,生存周期>1 年以上。
[0096]
实施例8:修饰的腺相关病毒临床实施例
[0097]
患者信息:男,69岁,右下肺癌双肺转移纵膈淋巴结转移腰椎转移癌tnm分期:t4n2m1b 基因诊断为p53突变。
[0098]
治疗方案:施用aav-gm-scf-pd1scfv-p53(n15),臀部肌肉注射1*10
10
vp。
[0099]
效果:一周后,腹癌胚抗原及糖链抗原125明显下降,癌胚抗原下降40%。糖链抗原125 下降32%,病人自觉症状及生存状态明显好转。
[0100]
实施例9:修饰的腺相关病毒临床实施例
[0101]
患者信息:男,75岁,右下肺癌双肺转移纵膈淋巴结转移腰椎转移癌tnm分期:t4n2m1b 基因诊断为p53突变。
[0102]
治疗方案:施用aav-gm-scf-pd1scfv-p53(c22),臀部肌肉注射1*10
10
vp。
[0103]
效果:一周后,腹癌胚抗原及糖链抗原125明显下降,癌胚抗原下降37%。糖链抗原125 下降30%,病人自觉症状及生存状态明显好转。
[0104]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员 来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所做的任何修改,简 并序列等的等同替换改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1