一株弗氏志贺氏菌微小噬菌体SGF3及其应用
一株弗氏志贺氏菌微小噬菌体sgf3及其应用
技术领域
1.本发明涉及生物技术领域,更具体的说是涉及一株弗氏志贺氏菌微小噬菌体sgf3及其应用。
背景技术:
2.志贺氏菌作为革兰氏阴性菌的一种,也是细菌性痢疾最为常见的病原体,主要通过食物和饮水等途径进行传播,具有强烈的致病性和致死性;因此,志贺氏菌防控已成为全球关注的公共健康问题。其中,弗氏志贺氏菌作为痢疾性疾病的主要病原体,对其的防控措施研究迫在眉睫。
3.众所周知,抗生素被广泛用于治疗细菌感染,但随着抗生素的滥用,多耐药和抗药的超级细菌层出不穷。由于超级细菌感染发生迅速并且可用的抗生素非常有限,使得抗生素治疗陷入瓶颈,研究者们开始寻找更加安全有效的抑菌方法。噬菌体作为细菌病毒,能够特异性识别裂解细菌,具有高度的宿主专一性,对病原菌的去除具有很好的效果,因此利用噬菌体防控病原菌污染逐渐成为学者们关注的焦点。但考虑到噬菌体和宿主菌之间抗性机制的存在,在病原菌感染较为严重时,直接使用一种噬菌体所达到的抑菌效果不佳,选择将多种噬菌体或者噬菌体与抗生素联合应用无疑具有重要的现实意义。这样做不仅可以避免或者减弱抗性现象的产生,而且可以扩大宿主谱,有助于提高病原菌的去除效率。但是,现阶段,噬菌体的种类和数量是限制噬菌体治疗进一步发展的一个重要因素;基于此,分离和鉴定噬菌体来丰富噬菌体种库是十分必要的。
4.因此,提供一株弗氏志贺氏菌微小噬菌体sgf3及其应用是本领域技术人员亟需解决的问题。
技术实现要素:
5.有鉴于此,本发明提供了一株弗氏志贺氏菌微小噬菌体sgf3及其应用,用于丰富噬菌体种库,并进一步发展一种新型的生物防治手段。
6.为了实现上述目的,本发明采用如下技术方案:
7.一株弗氏志贺氏菌微小噬菌体sgf3,保藏编号为cgmcc no.20294,已保藏于中国微生物菌种保藏管理委员会普通微生物中心,简称cgmcc,地址北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏日期为2020年09月03日,分类命名为弗氏志贺氏菌微小噬菌体。
8.进一步,弗氏志贺氏菌微小噬菌体sgf3在裂解志贺氏菌中的应用。
9.进一步,弗氏志贺氏菌微小噬菌体sgf3在污水处理系统中防治和去除志贺氏菌中的应用。
10.经由上述的技术方案可知,与现有技术相比,本发明公开提供了一株弗氏志贺氏菌微小噬菌体sgf3及其应用,为噬菌体治疗和病原菌的防控提供一种可选择的基础材料,以此来丰富噬菌体种库,并进一步发展一种新型的生物防治手段;通过对噬菌体sgf3的分
离鉴定,生物学特性研究和全基因组测序,进一步深入挖掘其功能基因和蛋白,为噬菌体治疗和生物防治提供一种或多种对病原菌具有裂解作用的酶类等,以此扩大宿主谱,提高噬菌体应用的广泛性和有效性;噬菌体sgf3对弗氏志贺氏菌1.10599具有强裂解效用,为工业化生产噬菌体及用于污水排放和污水回用中志贺氏菌的防治提供了噬菌体来源。
附图说明
11.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
12.图1附图为本发明噬菌体sgf3的双层平板噬菌斑形态;
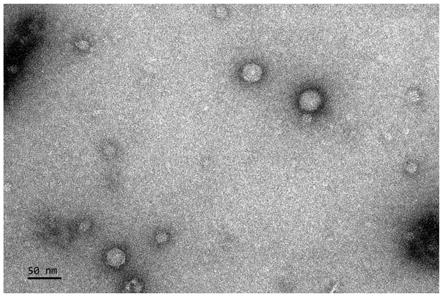
13.图2附图为本发明噬菌体sgf3透射电镜形态;
14.图3附图为本发明噬菌体sgf3一步生长曲线;
15.图4附图为本发明噬菌体sgf3基因组圈图;
16.图5附图为本发明噬菌体sgf3基于全基因组的系统进化树。
具体实施方式
17.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
18.噬菌体宿主菌弗氏志贺氏菌1.10599由中国普通微生物菌种保藏管理中心提供,并由本实验室保存。
19.nb培养液、培养基和peg8000购自amresco公司;dnase、rnasea购自sigma公司;蛋白酶k购自amresco公司;0.22μm微孔滤膜购自上海市新亚净化器件厂;氯仿、平衡饱和酚购自北京鼎国生物技术有限公司。
20.实施例1噬菌体的分离纯化
21.本发明试验用污水样品于2019年11月采集于北京市中国科学院大学雁栖湖校区西区,以此作为分离噬菌体的水样。
22.污水样本离心15min,取用0.22μm微孔滤膜过滤除菌的污水25ml,加入cacl2母液至终浓度为1mmol/l,静置,加入20ml nb液体培养基,再加入对数期宿主菌悬液2.0ml,于50ml离心管中,混匀,静置15min后,37℃振荡过夜(10h)。次日,加2ml氯仿,4℃,8000g离心30min,上清即为含有此宿主菌噬菌体的原液。采用spot
‑
test方法鉴定原液中是否含有噬菌体,取适量上述原液点滴到涂布了宿主菌的nb固体培养基上,37℃培养6
‑
8h,观察有无噬菌斑长出。若平板上出现清晰透亮的噬菌斑,则说明原液中存在噬菌体,反之,则表明未分离出噬菌体,需重新采样分离。
23.分离出的噬菌体未必为单一噬菌体,应采用双层平板法进一步纯化。挑取平板上的噬菌斑,浸置于含有1ml sm液的无菌管中,室温放置1h后,取0.1ml上述溶液经梯度稀释。取0.1ml稀释后的溶液与0.1ml宿主菌悬液加入5ml管内,紧接着加入4ml nb半固体培养基,
而后迅速倒入nb固体培养基中,使之涂布于整个双层平板。37℃培养6
‑
8h,观察噬菌斑生长情况。而后挑取单一噬菌斑,重复此步骤3
‑
4次,直至双层平板中各噬菌斑的大小和形态基本一致,将其命名为sgf3,见图1。
24.实施例2噬菌体的形态观察
25.取噬菌体悬液20μl滴于铜网上,待其自然沉淀10min后,用干燥滤纸从侧面吸干,晾置约1min后在铜网上加1滴1%醋酸双氧铀,染色2min,然后小心使用干燥滤纸从侧面将多余染剂吸干,避光自然晾置30min后,用透射电子显微镜(jem
‑
1400)观察。
26.透射电镜结果见图2,结果显示,噬菌体sgf3为多面体结构,直径为28
±
4nm,根据国际病毒分类学组织(ictv)病毒分类第八次报告,可初步将该株噬菌体sgf3归类为微小噬菌体科。
27.实施例3噬菌体sgf3宿主谱测定
28.利用本课题组实验室的14株菌株进行sgf3宿主谱的测定,包括志贺氏菌,大肠杆菌,金黄色葡萄球菌和沙门氏菌。通过双层平板法检测sgf3对各菌株的感染情况,每个实验重复3次,每次两个平行样。噬菌体对菌株的侵染情况见表1。
29.表1
[0030][0031]
特征:噬菌体侵染菌株后,(+)有噬菌斑,(
‑
)没有噬菌斑。
[0032]
cdc为中国疾病预防控制中心;cgmcc为中国普通微生物菌种保藏管理中心。
[0033]
由表1可以看出,sgf3只特异性裂解宿主菌1.10599,对其他菌株均无裂解性。
[0034]
实施例4噬菌体sgf3的一步生长曲线测定
[0035]
以感染复数(moi)为0.05的比例,将噬菌体悬液加入到对数期宿主菌悬液中,吸附10min后12000g离心3min,倒掉上清液,用nb培养基将沉淀洗涤两次。而后将沉淀用等体积
的nb培养基重悬,放入150rpm,37℃的摇床中。每10min取一次样用双层平板法测定噬菌体效价,一共取120min。上述实验重复三次,每次3个平行样,将数据取平均值,绘制一步生长曲线图,结果见图3。
[0036]
图3结果显示,sgf3的潜伏期约为20min,裂解期约为70min,而后为平稳期。裂解量是每个受感染细胞所产生的子代噬菌体的平均数目,计算可知,sgf3的裂解量约为7.1。
[0037]
实施例5噬菌体基因组分析鉴定
[0038]
噬菌体全基因组测序及分析:采用illuminanextseq500进行pe 2
×
150对样品的dna进行测序。随后利用spades v.3.11.1拼接软件对优化序列进行拼接,得到最优的组装结果。利用生物软件phaster对基因组的开放阅读框进行预测分析,并使用ncbi blastp完成功能基因的初步注释,使用trnascan
‑
se在线预测trna,利用cgview server软件完成全基因组圈图的绘制,基于大亚基的基因组数据利用mega x软件构件系统进化树。
[0039]
全基因组分析结果见图4,结果显示,噬菌体sgf3的基因组为环状结构,全长为5386bp,预测有7个cds,编码7个蛋白序列;其中有2个预测为假定蛋白,5个为功能蛋白,并进行了功能基因注释。经同源性比对和基因组系统进化树分析(图5)显示,噬菌体sgf3与噬菌体wa4的亲缘关系最近,但其分离自不同的宿主菌,因此说明噬菌体sgf3为新型噬菌体;并归类为微小噬菌体科。
[0040]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1