一种具有食品防腐保鲜作用的乳酸菌zy-B及其应用的制作方法
本发明属于食品保鲜技术领域,具体涉及一种具有食品防腐保鲜作用的乳酸菌zy-b及其应用。
背景技术:
食品在加工和保藏过程中,极易受到微生物污染而导致腐败变质,采用食品防腐剂抑制有害微生物,延缓腐败变质是当今食品保鲜的重要技术之一。然而,食品中使用最多的化学防腐剂,影响人体健康,应用越来越受到众多国家的限制。天然生物防腐剂具有安全、无毒、适用性广、性能稳定等优点,因此,开发天然食品生物防腐剂,尤其是有益微生物型天然食品防腐剂,以替代目前广泛使用的化学防腐剂已成为现代食品工业的重要任务。
乳酸菌(lacticacidbacteria,lab),是一类能利用碳水化合物产生大量乳酸的革兰氏阳性细菌的通称,广泛存在于自然界中,被公认为是安全的食品级微生物。乳酸菌在代谢过程中可以产生许多种有抗菌活性的代谢产物,主要分为:(1)乳酸菌在代谢过程中可以产生乳酸、乙酸、二氧化碳、乙醇等其他副产物。乳酸的产生导致周围环境ph的降低,而微生物生长的又与ph十分相关,因此不能耐受生长环境较低的ph的食品腐败菌或致病菌的生长就会受到抑制。(2)过氧化氢的抑菌作用:乳酸菌的生长环境如果有氧气存在,那么乳酸菌进行有氧发酵,其中的黄素蛋白氧化酶活性使其产生h2o2,而且乳酸菌又因不含有过氧化氢酶而造成h2o2的不断积蓄,导致对其它微生物(如副溶血性弧菌和沙门氏菌等)的生长抑制作用。(3)乳酸菌素的抑制作用:乳酸菌细菌素是由乳酸菌在代谢过程中由核糖体合成的一类具有抑菌活性的多肽或前体多肽。其中大部分的乳酸菌细菌素可以耐受高温,乳酸菌的种类不同其代谢的所产生的乳酸细菌素种类也不同,并且不同乳酸细菌素的抑菌谱也各不相同。其中,产iia类细菌素的乳酸菌是对单增李斯特菌具有强烈抑制作用的一类广谱抑菌性乳酸菌,是最有前景的食品天然防腐剂之一。
因此,挖掘具有天然食品防腐剂功能的乳酸菌成为当前的研究热点。
技术实现要素:
为了克服上述现有技术的不足,本发明提出了一种具有食品防腐保鲜作用的乳酸菌zy-b及其应用,该菌株为iia类细菌素产生菌,具有抑菌活性强,且抗菌谱广的优点,可以应用于食品保鲜领域。
为了实现上述目的,本发明所采用的技术方案是:
本发明提供一种具有食品防腐保鲜作用的乳酸菌zy-b,所述乳酸菌zy-b为iia类细菌素产生菌,所述乳酸菌zy-b于2019年8月19日保藏于广东省微生物菌种保藏中心,保藏编号为gdmccno:60743。
优选的,所述乳酸菌zy-b的16srrna具有如seqidno:1所示的核苷酸序列,经16srrna分子生物学鉴定表明,该菌与乳酸菌(戊糖片球菌)pediococcuspentosaceusdsm20336t(jqbf01000022)高度相似,相似度为99.53%。
优选的,所述乳酸菌zy-b分离自高贵海扇蛤肠道。
进一步的,上述的乳酸菌zy-b在可以应用于食品防腐保鲜中。
为筛选可能应用于食品保鲜领域的潜在乳酸菌,针对常见的引起食品腐败变质的腐败菌,选取单增李斯特菌(listeriamonocytogenes)、金黄色葡萄球菌(staphylococcusaureus)、枯草芽孢杆菌(bacillussubtilis)、大肠杆菌(escherichiacoli)、副溶性血弧菌(vibrioparahemolyticus)为指示菌。采用双层牛津杯法对乳酸菌zy-b进行抗菌活性测定,以此为依据筛选潜在的具有天然食品防腐剂功能的乳酸菌,结果表明,乳酸菌zy-b对这5种指示菌均检测到较好的抗菌活性。
经过pcr鉴定、排除酸性物质干扰实验、排除过氧化氢干扰实验以及蛋白酶敏感实验发现,乳酸菌zy-b是一种iia类细菌素产生菌。
为此,采用乙酸乙酯萃取、sephadexlh-20柱层析系统纯化、离子交换色谱纯化和半制备型反相液相色谱纯化四步法从乳酸菌zy-b中分离、纯化得到一种细菌素pe-zyb1,对细菌素pe-zyb1进行抗菌谱测定实验,测定结果表明,细菌素pe-zyb1具有广泛的抗菌谱,不仅对单增李斯特菌、金黄色葡萄球菌等革兰氏阳性细菌有较强的抑制作用,同时对革兰氏阴性菌如副溶血性弧菌、大肠杆菌、产气肠杆菌、铜绿假单胞菌、变形杆菌、溶血性链球菌也有抑制作用,而且对枯草芽孢杆菌、蜡状芽孢杆菌也有抑制作用。
优选的,将所述乳酸菌zy-b进行发酵,取上清液制备成抑菌剂,所述乳酸菌zy-b以乳酸菌发酵上清液的形式直接喷涂于固体食品的表面,或混合于液体食品中,用于抑制食品中的单增李斯特菌、金黄色葡萄球菌、副溶血性弧菌、大肠杆菌、产气肠杆菌、铜绿假单胞菌、变形杆菌、溶血性链球菌、枯草芽孢杆菌和蜡状芽孢杆菌。所述固体食品包括肉类食品(如鸡脚、鸡翅、猪蹄、猪皮、猪耳朵等)或蔬菜类食品(如竹笋、萝卜等),所述液体食品包括饮料(如果汁等)和酒类(如啤酒等)。
更优选的,将所述乳酸菌zy-b接种于mrs液体培养基中于28℃下培养36-48h,得到乳酸菌发酵上清液。具体为:将乳酸菌zy-b接种于mrs液体培养基中,置于恒温摇床于28℃、150r/min下培养,活化2代后按照3%的接种量接种于1lmrs液体培养基中,28℃培养48h,收集发酵液于12,000rpm、4℃下离心10min,保留发酵上清液,发酵上清液使用0.22μm滤膜进行过滤,得到乳酸菌发酵上清液。
与现有技术相比,本发明的有益效果是:
本发明从采集自湛江东风市场的高贵海扇蛤(mimachlamysnobilis)肠道中分离得到一种乳酸菌,经16srrna分子生物学鉴定表明,该乳酸菌与pediococcuspentosaceus(戊糖片球菌)dsm20336t(jqbf01000022)高度相似,相似度为99.53%,命名为乳酸菌zy-b;经抑菌活性筛选发现,乳酸菌zy-b是一种潜在的具有天然食品防腐剂功能的乳酸菌;经pcr鉴定、排除酸性物质干扰实验、排除过氧化氢干扰实验以及蛋白酶敏感实验表明,乳酸菌zy-b为iia类细菌素产生菌;采用乙酸乙酯萃取、sephadexlh-20柱层析系统纯化、离子交换色谱纯化和半制备型反相液相色谱纯化四步法从乳酸菌zy-b中分离、纯化得到得到一种细菌素pe-zyb1,对细菌素pe-zyb1进行抗菌谱测定实验,测定结果表明,细菌素pe-zyb1具有广泛的抗菌谱,不仅对单增李斯特菌、金黄色葡萄球菌等革兰氏阳性细菌有较强的抑制作用,同时对革兰氏阴性菌如副溶血性弧菌、大肠杆菌、产气肠杆菌、铜绿假单胞菌、变形杆菌、溶血性链球菌也有抑制作用,而且对枯草芽孢杆菌、蜡状芽孢杆菌也有抑制作用。可见,乳酸菌zy-b是一种抑菌活性强,且抗菌谱广的乳酸菌,可以应用于食品保鲜领域。
附图说明
图1为pcr鉴定的特异引物pcr扩增电泳结果;
图2为菌株zy-b发酵上清液和乙酸乙酯萃取后的细菌素粗提物对单增李斯特菌的抑制效果(图中,1:菌株zy-b发酵上清液;2:乙酸乙酯萃取后细菌素;3:乙酸乙酯;ck:空白对照);
图3为25-32管组分对单增李斯特菌的抑制效果;
图4离子交换色谱纯化细菌素的洗脱曲线;
图5为半制备型反相色谱纯化细菌素洗脱曲线;
图6为h5组分纯度的rp-hplc色谱鉴定图;
图7为细菌素pe-zyb1的ms/ms图。
具体实施方式
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
下述实验例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实验材料:含有0.3%caco3的分离培养基、mrs液体培养基的配方具体参考文献:delves-broughtonj.nisinanditsapplicationasafoodpreservative[j].internationaljournalofdairytechnology,2010,43(3):73-76.
mightyampdna聚合酶、2×mightyampbuffer,购于宝生物工程(大连)有限公司。
胰酪胨大豆酵母浸膏琼脂(tsa-ye培养基)、营养琼脂培养基、含3%氯化钠的营养琼脂培养基、琼脂糖,购于北京陆桥技术有限责任公司。
乳酸、过氧化氢酶、胰蛋白酶、胃蛋白酶,购于上海生工生物有限公司;木瓜蛋白酶购于美国sigma公司。
各指示菌均为市售,详细情况见表1:
表1指示菌种
实施例1菌株的分离
将采集自湛江东风市场的高贵海扇蛤(mimachlamysnobilis)样品,用无菌生理盐水反复冲洗干净,置于超净工作台上无菌操作取出样品的肠道,用无菌剪刀剪碎。称取25g转移至225ml的无菌生理盐水均质袋中,置于均质机中反复拍打1-2min使之彻底均质,即得10-1的样品菌悬液。按照梯度稀释法,使用1ml移液枪从10-1样品菌悬液中吸取1ml转移至有9ml无菌生理盐水的试管中,反复吹打使之充分混匀,即得10-2样品菌悬液,按照同样方法依次稀释成10-3、10-4、10-5样品菌悬液,备用。
从梯度稀释之后的样品液各吸取0.1ml分别均匀涂布于4种含有0.3%caco3的分离培养基上,28℃培养48h。每个稀释度4个平板,其中2个平板再在已经涂布好的上层倾倒一层温度在50℃左右的相同的培养基,置于28℃培养。
根据溶钙圈与分离培养基中菌落形态初步确定,从样品中共分离出4株疑似乳酸菌菌株。
实施例2菌株的16srrna分子生物学鉴定
pcr扩增以27f和1492r为引物(由上海生工生物技术有限公司合成),27f和1492r的核苷酸序列分别如seqidno:2和seqidno:3所示,使用mightyampdna聚合酶对菌株进行菌落pcr。pcr反应条件为:以无菌牙签挑取培养24h的单菌落作为模板,2×mightyampbuffer15μl,mightyampdna聚合酶0.75μl,27f(10μmol/μl)0.75μl,1492r(10μmol/μl)0.75μl,ddh2o12.75μl。反应条件:98℃预变性2min;98℃变性10s,55℃退火15s,68℃延伸1.5min,40个循环;10℃保存10min。将pcr产物寄送生工生物工程(上海)股份有限公司进行测序。将测序结果在ncbi(genbank)和ezbiocloud(eztaxon)数据库中进行同源性检索。
如表2所示的结果表明,这4株菌株均属于乳酸菌,其中,菌株zy-6属于乳杆菌属(lactobacillus),菌株zy-12、zy-14属于肠球菌属(enterococcus),菌株zy-b属于片球菌属(pediococcus)。
表24个菌株与其系统发育关系最密切的典型菌株间的系统发育关系
实施例3通过抑菌活性测定进行菌株的筛选
为筛选可能应用于食品保鲜领域的潜在乳酸菌,针对常见的引起食品腐败变质的腐败菌,选取单增李斯特菌(listeriamonocytogenes)、金黄色葡萄球菌(staphylococcusaureus)、枯草芽孢杆菌(bacillussubtilis)、大肠杆菌(escherichiacoli)、副溶性血弧菌(vibrioparahemolyticus)为指示菌,见表1。采用双层牛津杯法对乳酸菌zy-b进行抗菌活性测定。
将上述4株乳酸菌接种于mrs液体培养基中,置于恒温摇床于28℃、150r/min下培养,活化2代后按照3%的接种量接种于1lmrs液体培养基中,28℃培养48h,收集发酵液于12,000rpm、4℃下离心10min,除去菌体保留发酵上清液,发酵上清液使用0.22μm滤膜进行过滤,得到乳酸菌发酵上清液,备用。
牛津杯法的具体操作方法参照“焦冬冬,任文彬,赵鸭美,etal.南海海域动物肠道中抗菌活性乳酸菌的分离及多样性分析[j].食品科学,2017(08):82-87.”。将listeriamonocytogenes接种于tsa-ye培养基,将escherichiacoli、staphylococcusaureus、bacillussubtilis接种于营养琼脂培养基,vibrioparahemolyticus采用含3%氯化钠的营养琼脂培养基,37℃培养24h。在无菌培养皿中加入薄薄一层灭菌的只含2%琼脂液,待其凝固后,将灭菌牛津杯均匀置于凝固琼脂上,再将培养24h的指示菌用无菌生理盐水调整od600为0.3~0.5的菌悬液,取2ml指示菌菌悬液加到100ml冷却至50℃灭菌的相应培养基中摇匀,立即倒入已凝固的只含有2%琼脂的培养皿中,凝固后,用无菌镊子将牛津杯轻轻拔起。并向牛津杯孔中加入200μl乳酸菌发酵上清液,4℃静置扩散4h后,移至37℃培养24h,观察是否出现抑菌圈并测量直径大小。
如表3所示的结果表明,只有菌株zy-b同时对5种指示菌具有抗菌活性,同时具有抑菌活性强,且抗菌谱广的优点。
为此,对菌株zy-b进行了保藏。
菌株zy-b的保藏信息如下:
保藏时间:2019年8月19日;
保藏单位名称:广东省微生物菌种保藏中心;
保藏编号:gdmccno:60743;
保藏单位地址:广州市先烈中路100号大院59号楼5楼;
分类命名:pediococcuspentosaceuszy-b。
表34株乳酸菌对不同指示菌的抑菌作用
注:牛津杯内径7.8mm,外径8.0mm;+++:抑菌圈直径﹥20mm;++:抑菌圈直径:14~20mm;+:抑菌圈直径:﹤14mm;-:无抑菌活性
实施例4鉴定菌株zy-b是否为iia类细菌素产生菌
(1)pcr鉴定:参照陈章庭的方法(陈章庭.乳酸菌iia类抗菌肽pcr筛选方法初步研究[d].哈尔滨工业大学,2012))根据iia类细菌素特有的保守序列设计特异性引物进行菌落pcr。
引物f和引物r的核苷酸序列分别如seqidno:4和seqidno:5所示(由上海生工生物技术有限公司合成),pcr反应条件为:以无菌牙签挑取培养24h的单菌落作为模板,2×mightyampbuffer5μl,mightyampdna聚合酶0.25μl,引物f(10pmol/μl)0.25μl,引物r(10pmol/μl)0.25μl,ddh2o5.25μl。反应条件:98℃预变性3min;98℃变性10s,53℃退火15s,72℃延伸10s,35个循环;10℃保存10min。
pcr产物于2%琼脂糖凝胶进行电泳,电泳结束后在geldocxr+凝胶成像系统(美国伯乐bio-rad)观察电泳结果并拍照。
如图1所示的结果表明,扩增出了一条150bp左右的目的条带,条带明亮且特异性较好,初步确定菌株zy-b为ⅱa类细菌素产生菌,并对其抗菌物质性质是否为细菌素进一步确认。
(2)有机酸排除实验:由于乳酸菌所产生的抑菌效果可能是由于自身所代谢产生的有机酸等物质所导致,为了排除有机酸的干扰,用乳酸分别调无菌mrs液体培养基(121℃高压蒸汽灭菌15min)的ph值至3.0、4.0、4.5、5.0、6.0、7.0进行抑菌实验,选择对5种指示菌都没有抑菌效果的最大ph值为对照。把待测乳酸菌发酵液上清液用1.0mol/lhcl和1.0mol/lnaoh调至已确定的对照ph值,用双层牛津杯法进行排酸实验。观察记录排除酸作用后仍有抑菌圈的菌株。
如表4所示,ph在6.0时对5种指示菌都没有抑制效果,因此选择ph6.0作为酸排除的对照ph。
将菌株zy-b接种于50mlmrs液体培养基中,置于恒温摇床中于28℃、150r/min下培养16h,得到菌株zy-b发酵液,将菌株zy-b发酵液的ph值调为6.0,没有调节ph的发酵液作对照,用双层牛津杯法进行抑菌实验,结果如表5所示,菌株zy-b发酵液ph调至为6.0时,仍具有抑菌活性,说明菌株zy-b对指示菌的抑制作用不仅仅是由酸引起的,还可能是乳酸菌存在代谢中产生的过氧化氢等其他物质作用。
表4不同ph对指示菌的抑制作用
表5排除有机酸后的抑菌效果
(3)过氧化氢作用的排除实验:吸取5ml排除有机酸干扰后对指示菌仍具有抑菌效果的菌株发酵液,加入50mg的过氧化氢酶至完全溶解,并将ph调为7.0,置于37℃水浴锅中水浴2h,再将ph调为排除有机酸干扰作用时的ph(6.0),以未使用过氧化氢酶处理的排除酸干扰发酵液作为对照,用双层牛津杯法进行抑菌实验。
由于乳酸菌经过代谢会产生过氧化氢,一定浓度的过氧化氢具有杀菌作用。在排除酸性物质干扰后的菌株进行进一步的过氧化氢酶解的试验来消除干扰。在菌株zy-b的发酵上清液中加入过氧化氢酶使其水浴反应后,再对反应后的发酵液利用双层牛津杯测定其抗菌效果,抗菌活性结果如表6所示,发现菌株zy-b发酵上清液经过氧化氢酶处理后,处理后相比处理前的抑菌圈直径略有变小,但变化程度不大,因此,可以说明菌株zy-b的发酵上清液当中的抑菌物质不只是过氧化氢。
综上,除了有机酸、过氧化氢的存在外,菌株zy-b的发酵上清液中还有其它有抑菌作用的物质存在。
表6排除过氧化氢后的抑菌效果
(3)蛋白酶敏感实验:取3份2.0ml在经过酸的排除与过氧化氢酶处理后仍对指示菌有抑菌活性的菌株发酵液,按胃蛋白酶、木瓜蛋白酶和胰蛋白酶的ph值分别为2.0、6.0和7.4,并使各蛋白酶的终浓度均为1.0mg/ml的标准分别加入胃蛋白酶、木瓜蛋白酶和胰蛋白酶,37℃下水浴4h后调回原始ph值(6.0),测定酶处理前后的抑菌活性。
通过排除酸性物质的干扰与过氧化氢的干扰后发现菌株zy-b仍然有抑菌活性,为了最终确定其抑菌性的物质的性质是否为蛋白质或肽类,对经过排酸、排过氧化氢试验的菌株zy-b的发酵液进行酶解试验。试验分别用木瓜蛋白酶、胰蛋白酶、胃蛋白酶对菌株发酵上清液进行处理后,测定处理前后的抑菌圈直径(以单增李斯特菌为指示菌)的变化。结果如表7所示,发现菌株zy-b的发酵液上清液经胃蛋白酶处理、木瓜蛋白酶处理处理后,活性分别保留了64.7%、77.1%;而经过胰蛋白酶处理后,活性仅仅保留了8.9%,可见菌株zy-b发酵液中的抑菌物质对胰蛋白酶的处理较为敏感,因此,可判定菌株zy-b能够产生蛋白质或肽类性质的抑菌物质。
结合pcr鉴定、排除酸性物质干扰实验、排除过氧化氢干扰实验以及蛋白酶敏感实验后可得出,菌株zy-b为iia类细菌素产生菌。
表73种蛋白酶处理后的的抑菌效果
实施例5菌株zy-b的抑菌谱测定
以表1中的菌株为指示菌,采用双层牛津杯法对菌株zy-b进行抑菌谱测定,测抑菌圈直径。将菌株zy-b接种于mrs液体培养基中,置于恒温摇床于28℃、150r/min下培养,活化2代后按照3%的接种量接种于1lmrs液体培养基中,28℃培养48h,收集发酵液于12,000rpm、4℃下离心10min,除去菌体保留发酵上清液,发酵上清液使用0.22μm滤膜进行过滤,得到乳酸菌发酵上清液,备用。
牛津杯法的具体操作方法参照“焦冬冬,任文彬,赵鸭美,etal.南海海域动物肠道中抗菌活性乳酸菌的分离及多样性分析[j].食品科学,2017(08):82-87.”。其中,listeriamonocytogenes接种于tsa-ye培养基,staphylococcusaureus、escherichiacoli、bacillussubtilis、bacilluscereus、enterobacteraerogenes、pseudomonasaeruginosa、streptococcushemolytics、proteusbacillus接种于营养琼脂培养基,vibrioparahemolyticus接种于含3%氯化钠的营养琼脂培养基,37℃培养24h。
由表8的测定结果可见,菌株zy-b不仅对单增李斯特菌、金黄色葡萄球菌等革兰氏阳性细菌有较强的抑制作用,同时对革兰阴性菌如副溶血性弧菌、大肠杆菌、产气肠杆菌、铜绿假单胞菌、变形杆菌、溶血性链球菌也有抑制作用,而且对枯草芽孢杆菌、蜡状芽孢杆菌也有抑制作用。表明菌株zy-b具有较广泛的抗菌谱,可以作为潜在的天然抗菌药物或生物保鲜剂应用于食品工业。
表8菌株zy-b的抑菌谱测定结果
注:抑菌圈直径(mm):+++:>20;++:14-20;+:<14.
实施例6细菌素pe-zyb1的分离、纯化
(1)乳酸菌zy-b发酵上清液制备和细菌素效价的测定方法
将斜面保存的乳酸菌zy-b转接于mrs液体培养基中,置于恒温摇床于28℃、150r/min下培养,活化2代后按照3%的接种量接种于1lmrs液体培养基中,28℃培养48h,收集发酵液于12,000rpm、4℃下离心10min,除去菌体保留发酵上清液,发酵上清液使用0.22μm滤膜进行过滤,将发酵上清液以单增李斯特菌为指示菌进行抑菌活性测定,4℃保存备用。其中,抑菌活性的测定采用双层琼脂牛津杯法,牛津杯法的具体操作方法参照“焦冬冬,任文彬,赵鸭美,etal.南海海域动物肠道中抗菌活性乳酸菌的分离及多样性分析[j].食品科学,2017(08):82-87.”。
采用连续双倍稀释法测定细菌素效价,以定量测定细菌素活性。细菌素液用无菌去离子水连续稀释两倍,在牛津杯中加入100μl的稀释液测定抗菌活性(以单增李斯特菌为指示菌)。其抗菌效价(au)的计算公式为2n×1000μl/100μl,其中n是明显有抑制圈的稀释度(具体操作方法参照“
(2)细菌素粗提取物的抽提(乙酸乙酯萃取法)
取1l上述发酵上清液与乙酸乙酯按1:1的比例混合,置于摇床以120r/min的转速放置过夜。收集上部有机相,下层发酵上清液再使用等体积乙酸乙酯提取两次。将有机相混合后使用旋转蒸发器在40℃的真空下进行蒸发、浓缩,收集含有残留物的馏分,得到细菌素粗提取物。细菌素粗提取物使用25mlpbs(磷酸缓冲盐溶液)重新复溶,利用双层琼脂牛津杯法对单增李斯特菌进行抑菌活性测定和效价测定。
图2的抑菌活性测定实验结果表明,乳酸菌zy-b的发酵上清液经过乙酸乙酯萃取后仍具有较好的抑菌效果,通过效价测定经初步纯化的细菌素粗提物的效价为6553.6au/ml。表明可以使用乙酸乙酯从发酵上清液中萃取细菌素,进行下一步的纯化。
(3)采用sephadexlh-20柱层析系统纯化细菌素
sephadexlh-20柱层析系统是使用有分子筛功能的葡聚糖凝胶,利用不同物质分子大小不同来进行组分的分离纯化。具体方法参照:赵圣明,赵岩岩,马汉军.植物乳杆菌jla-9产细菌素的分离纯化[j].食品与发酵工业,2017,43(6):60-65.
将经乙酸乙酯萃取得到的细菌素粗提取物利用pbs溶解,将样品浓缩至尽量小的体积,0.22μm滤膜过滤除去杂质后,采用湿法上样,先用纯甲醇将凝胶柱洗脱一个柱体积,除去之前残存的杂质,再利用80%甲醇-水的洗脱体系洗脱一个柱体积,平衡凝胶柱。然后将样品直接加入sephadexlh-20凝胶层析柱,利用80%甲醇-水进行洗脱,流速设置为1ml/5min,5ml/管,利用全自动收集器进行样品收集,最后用纯甲醇洗脱,收集每一管洗脱样品进行抑菌测定。
将25ml乙酸乙酯纯化的细菌素粗提物样品上样于lh-20凝胶柱,利用甲醇:水(8:2)的洗脱体系洗脱,电脑自动收集器共收集到40管洗脱样品,测定每管样品的抑制单增李斯特菌活性,结果见图3,通过测定每管的抑菌活性后发现第25、26、27、28、29、30、31和32号管具有不同的抑菌效果,合并冻干复溶后测定其效价为8192au/ml,进行下一步阳离子交换纯化。
(4)采用离子交换色谱纯化细菌素
当ph<pi时大部分细菌素带正电,所以可以选用在合适的ph下的细菌素溶液使用离子交换色谱进一步纯化细菌素,通过调节ph、上样量、洗脱流速与nacl的浓度得到合适的洗脱体系来进行细菌素的分离,具体方法参照“任丽.新型双歧杆菌细菌素bifidocina的提纯、特性及分子结构研究[d].2015.”。
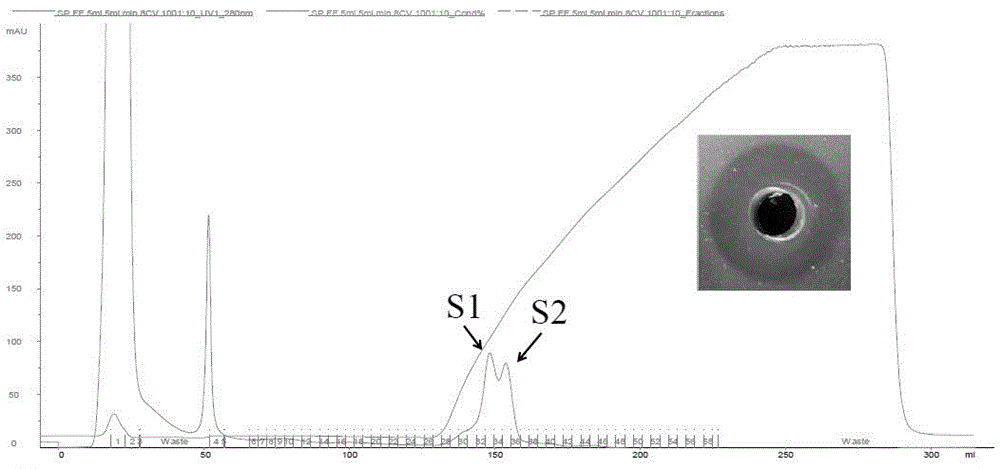
取10ml经lh-20凝胶柱纯化得到的细菌素上样于akta系统中,与spff阳离子柱结合后,先用20nmol/l的柠檬酸缓冲液(ph6.0)冲洗未结合的杂质蛋白,洗至基线平衡;再使用1mol/l的nacl溶液梯度洗脱目标蛋白,同时在280nm处检测吸收峰,自动收集器收集样品,分别检测每管的抗菌活性。
280nm处检测收集组分,洗脱曲线如图4所示,经检测出现两个吸收峰s1和s2,通过抗菌活性测定发现s2具有抑菌活性,效价为4096au/ml。
(5)采用半制备型反相液相色谱纯化细菌素:
利用hpplus50d全自动中高压制备液相色谱仪对经过阳离子交换色谱收集的组分进一步分离纯化,c18反相柱填料:sinochromods-ap15μm;尺寸:20.0mm*250mm;柱号:2617138;流动相为甲醇-水,使用前样品均需经0.22μm滤膜过滤,并且超声脱气;上述s2样品经过0.22μm滤膜阳离子交换层析,通过进样环上样,0~4min,10%的甲醇-水等度洗脱;4~13min,10%甲醇-水~25%的甲醇-水梯度洗脱;13~21min,25%~30%的甲醇-水梯度洗脱21~22min,30%~40%甲醇梯度洗脱;22~32min利用100%甲醇等度洗脱,收集对单增李斯特菌具有抑制活性的组分。
洗脱曲线如图5所示,0~4min,10%的甲醇-水等度洗脱,得到组分h1;4~13min,10%甲醇-水25%的甲醇-水梯度洗脱,得到组分h2;13~21min,25%~30%的甲醇-水,得到组分h3和组分h4;21~22min,30%~40%甲醇没有组分;22~32min利用100%甲醇等度洗脱,得到组分h5。经抗菌活性检测发现只有峰h5具有抑菌活性,效价为5120au/ml。
用rp-hplc分析色谱对h5峰的纯度进行鉴定,如图6所示,结果发现只在t=1.859min时出现一个峰,表明纯化的细菌素已达到单一组分。至此得到纯化的细菌素pe-zyb1。
实施例7细菌素pe-zyb1的分子质量测定与氨基酸分析
将纯化得到的细菌素pe-zyb1寄送于北京百泰派克生物技术有限公司,用lc-ms/ms系统(岛津lc-20adnanoflow-lc与thermofisherscientificqexactivemassspectrometer)对多肽片段进行分析。一级质谱扫描范围为350-1800(m/z),分辨率为70000,二级ms/ms分辨率为17500。通过maxquant分析软件将得到的氨基酸序列与通用蛋白数据库(uniprot)、blast(http:/www.uniprot.org/blast/)和抗肽数据库(apd)保存的序列进行比较(http:/aps.unmc.edu/ap/main.html)。
lc-ms/ms分析发现,细菌素pe-zyb1的分子量为2019.22da;并且具有如seqidno:6所示的氨基酸序列(图7)。与通用蛋白数据库(uniprot)进行比较发现细菌素pe-zyb1与数据库中一种未鉴定的蛋白质相似,并且与其他文献报道的抗菌肽无同源性。在抗菌肽数据库(apd)中搜索,发现与抗菌肽andersonin-x1(登录号:ap01874)相似,最高相似性为38.09%。表明细菌素pe-zyb1可能为潜在的新型细菌素。
实施例8细菌素pe-zyb1的抑菌谱测定
将细菌素pe-zyb1溶液(用pbs稀释成50μg/ml)采用双层琼脂牛津杯法,以表8中的指示菌,进行指示菌抑菌谱实验,测抑菌圈直径。牛津杯法的具体操作方法参照“焦冬冬,任文彬,赵鸭美,etal.南海海域动物肠道中抗菌活性乳酸菌的分离及多样性分析[j].食品科学,2017(08):82-87.”。其中,listeriamonocytogenes接种于tsa-ye培养基,staphylococcusaureus、escherichiacoli、bacillussubtilis、bacilluscereus、enterobacteraerogenes、pseudomonasaeruginosa、streptococcushemolytics、proteusbacillus接种于营养琼脂培养基,vibrioparahemolyticus接种于含3%氯化钠的营养琼脂培养基,37℃培养24h。
采用牛津杯法对10种指示菌进行细菌素pe-zyb1抗菌谱测定(表9),结果发现它不仅对单增李斯特菌、金黄色葡萄球菌等革兰氏阳性细菌有较强的抑制作用,同时对革兰阴性菌如副溶血性弧菌、大肠杆菌、产气肠杆菌、铜绿假单胞菌、变形杆菌、溶血性链球菌也有抑制作用,而且对枯草芽孢杆菌、蜡状芽孢杆菌也有抑制作用。结果表明细菌素pe-zyb1具有较广泛的抗菌谱。因此细菌pe-zyb1可以作为潜在的天然抗菌药物或生物保鲜剂应用于食品工业。细菌素具有广泛的抗菌活性,在食品工业中是有用和有价值的。
表9细菌素pe-zyb1的抗菌谱
注:抑菌直径(mm):+++:>20;++:14-20;+:<14mm.(牛津杯直径为8mm);/:无抑菌效果。
以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
序列表
<110>广东海洋大学
<120>一种具有食品防腐保鲜作用的乳酸菌zy-b及其应用
<141>2019-10-17
<160>6
<170>siposequencelisting1.0
<210>1
<211>1480
<212>dna
<213>乳酸菌zy-b(pediococcuspentosaceuszy-b)
<400>1
gggcgttgcggggtgctaatactgcagtcgacgaacttccgttaattgattatgacgtac60
ttgtactgattgagattttaacacgaagtgagtggcgaacgggtgagtaacacgtgggta120
acctgcccagaagtaggggataacacctggaaacagatgctaataccgtataacagagaa180
aaccgcatggttttcttttaaaagatggctctgctatcacttctggatggacccgcggcg240
tattagctagttggtgaggtaaaggctcaccaaggcagtgatacgtagccgacctgagag300
ggtaatcggccacattgggactgagacacggcccagactcctacgggaggcagcagtagg360
gaatcttccacaatggacgcaagtctgatggagcaacgccgcgtgagtgaagaagggttt420
cggctcgtaaagctctgttgttaaagaagaacgtgggtaagagtaactgtttacccagtg480
acggtatttaaccagaaagccacggctaactacgtgccagcagccgcggtaatacgtagg540
tggcaagcgttatccggatttattgggcgtaaagcgagcgcaggcggtcttttaagtcta600
atgtgaaagccttcggctcaaccgaagaagtgcattggaaactgggagacttgagtgcag660
aagaggacagtggaactccatgtgtagcggtgaaatgcgtagatatatggaagaacacca720
gtggcgaaggcggctgtctggtctgcaactgacgctgaggctcgaaagcatgggtagcga780
acaggattagataccctggtagtccatgccgtaaacgatgattactaagtgttggagggt840
ttccgcccttcagtgctgcagctaacgcattaagtaatccgcctggggagtacgaccgca900
aggttgaaactcaaaagaattgacgggggcccgcacaagcggtggagcatgtggtttaat960
tcgaagctacgcgaagaaccttaccaggtcttgacatcttctgacagtctaagagattag1020
aggttcccttcggggacagaatgacaggtggtgcatggttgtcgtcagctcgtgtcgtga1080
gatgttgggttaagtcccgcaacgagcgcaacccttattactagttgccagcattaagtt1140
gggcactctagtgagactgccggtgacaaaccggaggaaggtggggacgacgtcaaatca1200
tcatgccccttatgacctgggctacacacgtgctacaatggatggtacaacgagtcgcga1260
gaccgcgaggttaagctaatctcttaaaaccattctcagttcggactgtaggctgcaact1320
cgcctacacgaagtcggaatcgctagtaatcgcggatcagcatgccgcggtgaatacgtt1380
cccgggccttgtacacaccgcccgtcacaccatgagagtttgtaacacccaaagccggtg1440
gggtaacctttaggagctagccgtctaagtgacagaatga1480
<210>2
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggttaccttgttacgactt19
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
agagtttgatcctggctcag20
<210>4
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>4
atgaaaaagaaaktakt17
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
ccaatatacccaacattttt20
<210>6
<211>17
<212>prt
<213>人工序列(artificialsequence)
<400>6
alaleuproalaleuproalaalasermetglythrglyalaglyval
151015
gly
- 还没有人留言评论。精彩留言会获得点赞!