一种制备异喹啉酮类化合物的方法与流程
1.本申请涉及药物化学领域,尤其涉及一种制备异喹啉酮类化合物的方法。
背景技术:
2.罗沙司他,化学名(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸,分子式为:c19h16n2o5,分子量为:352.11,cas号为:808118-40-3,化学结构式为:
[0003][0004]
罗沙司他是由珐博进(fibrogen)公司开发的一种治疗肾性贫血的疾病,于2017年11月在国内申请上市。该药是全球首个开发的小分子低氧诱导因子脯氨酰羟化酶抑制剂(hif-phi)类治疗肾性贫血的药物。低氧诱导因子(hif) 的生理作用不仅使红细胞生成素表达增加,也能使红细胞生成素受体以及促进铁吸收和循环的蛋白表达增加。罗沙司他通过模拟脯氨酰羟化酶(ph)的底物之一酮戊二酸来抑制ph酶,影响ph酶在维持hif生成和降解速率平衡方面的作用,从而达到纠正贫血的目的。罗沙司他为由慢性肾脏病引起的贫血患者提供了新的治疗手段。
[0005]
然而,在的现有罗沙司他的制备技术中,反应路线往往需要在低温、高温、密闭加压、条件下反应,反应条件苛刻,对工艺对设备要求较高,且反应路线长,副反应多,导致后续纯化困难,使得合成的罗沙司他的产率和纯度低,从而不利于工业化生产。
[0006]
因此,需要开发一种具有路线合理、方便易行、适合工业化生产的异喹啉酮类化合物合成方法。
技术实现要素:
[0007]
本发明的目的在于提供一种具有路线合理、方便易行、产率和纯度高且适合工业化生产的式3结构的异喹啉酮类化合物的制备方法。
[0008]
本发明的第一方面,提供一种制备式3化合物的方法,所述方法包括步骤 a)或步骤b):
[0009]
步骤a):
[0010]
式1化合物与甘氨酸反应,得到式2化合物,式2化合物与醇和酰氯反应得到式3化合物;
[0011][0012]
或步骤b):
[0013]
式1化合物与甘氨酸酯反应,得到式3化合物;
[0014][0015]
其中,所述酰氯的为rc(o)cl,所述的甘氨酸酯为nh
2-ch
2-c(o)-o-r;
[0016]
r为c1-c10烷基、c6-c10芳基、c6-c10芳基-c1-c4烷基-、或-r1or2,其中r1和r2各自独立地为c1-c10烷基。
[0017]
在另一优选例中,r为c1-c6烷基、c6-c10芳基、c6-c10芳基-c1-c4烷基-。
[0018]
在另一优选例中,所述步骤a)包括以下步骤:
[0019]
a1)式1化合物在第一惰性溶剂中,在第一碱试剂的作用下与甘氨酸反应生成所述式2化合物;
[0020]
a2)式2化合物与醇和酰氯反应生成所述式3化合物。
[0021]
在另一优选例中,所述步骤b)包括以下步骤:
[0022]
式1化合物在第二惰性溶剂中,在第二碱试剂的作用下和甘氨酸酯反应得到式3化合物。
[0023]
在另一优选例中,r为甲基、甲氧甲基、乙基、乙氧乙基、丙基、异丙基、正丁基、异丁基、叔丁基、苄基或苯基。
[0024]
在另一优选例中,所述步骤a1)中,所述第一惰性溶剂选自下组:乙二醇甲醚、甲醇、乙醇、异丙醇、正丁醇、n,n-二甲基甲酰胺(dmf)、n-甲基吡咯烷酮(nmp)、二甲基亚砜(dmso)、乙腈、四氢呋喃、1,4-二氧六环、乙酸乙酯、乙酸异丙酯、二氯甲烷中,或其组合。
[0025]
在另一优选例中,所述步骤a1)中,所述第一碱试剂选自下组:三乙胺 (tea)、1,8-二氮杂二环十一碳-7-烯(dbu)、n,n-二异丙基乙胺(diea)、n-甲基吗啉、吡啶,或其组合。
[0026]
在另一优选例中,所述步骤a1)中,所述甘氨酸与所述式1化合物的摩尔比为1-4:1。
[0027]
在另一优选例中,所述步骤a1)中,反应的温度为50-100℃。
[0028]
在另一优选例中,所述步骤a1)中,反应的时间为2-12h,较佳地4-8h。
[0029]
在另一优选例中,所述步骤a2)中,所述醇选自下组:甲醇、乙醇、异丙醇、正丁醇,或其组合。
[0030]
在另一优选例中,所述步骤a2)中,所述酰氯选自下组:氯化亚砜、乙酰氯、苯甲酰氯、草酰氯,或其组合。
[0031]
在另一优选例中,所述步骤a2)中,所述醇与式2化合物的体积比为 1:1-30:1。
[0032]
在另一优选例中,所述步骤a2)中,所述酰氯与式2化合物的摩尔比为 1-10:1,较佳地1-6:1。
[0033]
在另一优选例中,所述步骤a2)中,所有的反应的温度使得反应在回流条件下进行。
[0034]
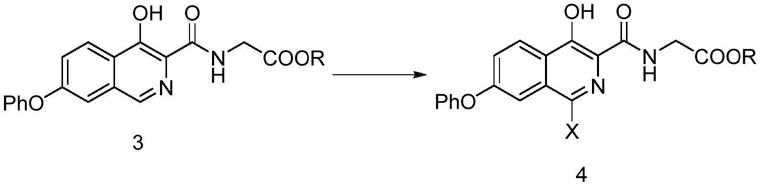
在另一优选例中,所述步骤a2)中,所有的反应的时间为2-8h,较佳地2-5h。
[0035]
在另一优选例中,所述步骤b)中,所述第二惰性溶剂选自下组:乙二醇甲醚、甲醇、乙醇、异丙醇、正丁醇、n,n-二甲基甲酰胺(dmf)、n-甲基吡咯烷酮(nmp)、二甲基亚砜
(dmso)、乙腈、四氢呋喃、1,4-二氧六环、乙酸乙酯、乙酸异丙酯、二氯甲烷,或其组合。
[0036]
在另一优选例中,所述步骤b)中,所述第二碱试剂选自下组:三乙胺 (tea)、1,8-二氮杂二环十一碳-7-烯(dbu)、n,n-二异丙基乙胺(diea)、n-甲基吗啉、吡啶,或其组合。
[0037]
在另一优选例中,所述步骤b)中,所述甘氨酸酯选自下组:甘氨酸甲酯、甘氨酸乙酯、甘氨酸苄酯、甘氨酸甲氧基甲酯,或其组合。
[0038]
在另一优选例中,所述步骤b)中,所述甘氨酸酯与所述式1化合物的摩尔比为1-4:1。
[0039]
在另一优选例中,所述步骤b)中,反应的温度为50-100℃,较佳地55-75℃。
[0040]
在另一优选例中,所述步骤b)中,反应的时间为2-12h,较佳地4-8h。
[0041]
在另一优选例中,在另一优选例中,所述步骤a1)中,反应时间为5-8h。
[0042]
在另一优选例中,所述步骤a1)中,所述第一碱试剂与所述式1化合物的摩尔比为1-6:1,较佳地1-4,更佳地1.5-4,最佳地1.5-2.5。
[0043]
在另一优选例中,所述步骤a1)包括:式1化合物、第一碱试剂、甘氨酸和第一惰性溶剂混合反应后,过滤,滤液调节ph至酸性,析晶,过滤得到式2 化合物。
[0044]
在另一优选例中,所述步骤a2)包括:式2化合物与醇混合后,降温至 5-15℃,加入酰氯,升温至回流反应,得到式3化合物。
[0045]
在另一优选例中,所述步骤a2)包括:式2化合物与醇混合后,降温至 5-15℃,加入酰氯,升温至回流反应,反应结束,反应液浓缩至干,加二氯甲烷萃取,水洗涤,干燥过滤,浓缩溶解后加入石油醚析晶,过滤得到式3化合物。
[0046]
在另一优选例中,所述步骤b)中,所述第二碱试剂与所述式1化合物的摩尔比为1-6:1,较佳地2-4:1。
[0047]
在另一优选例中,所述步骤b)包括:式1化合物、第二碱试剂、甘氨酸酯和第二惰性溶剂中混合后,反应毕,加水和乙酸乙酯萃取,得到式3化合物。
[0048]
在另一优选例中,所述步骤a2)中,所有的反应在回流条件下进行。
[0049]
在另一优选例中,所述的反应在常压下进行。
[0050]
在另一优选例中,所述步骤a1)中,反应在常压下进行反应。
[0051]
在另一优选例中,所述步骤a2)中,反应在常压下进行反应。
[0052]
在另一优选例中,所述步骤b)中,反应在常压下进行反应。
[0053]
在另一优选例中,所述步骤a1)中,所述第一惰性溶剂为乙腈。
[0054]
在另一优选例中,所述步骤a1)中,所述步骤a1)中,所述第一碱试剂为 1,8-二氮杂二环十一碳-7-烯(dbu)。
[0055]
在另一优选例中,所述步骤a1)中,所述甘氨酸与所述式1化合物的摩尔比为1.3-2.5:1,较佳地1-2:1。
[0056]
在另一优选例中,所述步骤a1)中,反应的温度为65-90℃。
[0057]
在另一优选例中,所述步骤a2)中,所述醇为甲醇。
[0058]
在另一优选例中,所述步骤a2)中,所述酰氯为草酰氯。
[0059]
在另一优选例中,所述步骤a2)中,所述醇与式2化合物的体积比为 1:1-20:1。
[0060]
在另一优选例中,所述步骤a2)中,酰氯与式2化合物的摩尔比为1-4:1,较佳地2-4:1。
[0061]
在另一优选例中,所述步骤b)中,所述甘氨酸酯与所述式1化合物的摩尔比为1.3-2.5。
[0062]
在另一优选例中,所述步骤b)中,所述步骤b)的反应的温度为50-75℃。
[0063]
本发明的第二方面,提供一种制备式5化合物的方法,所述的方法包括以下步骤:
[0064]
1)式3化合物与卤代试剂反应得到式4化合物;
[0065][0066]
2)式4化合物与甲基化试剂反应得到式5化合物;
[0067][0068]
r为c1-c10烷基、c6-c10芳基、c6-c10芳基-c1-c4烷基-、或
ꢀ-
r1or2,其中r1和r2各自独立地选自c1-c10烷基,x为cl、br或i。
[0069]
在另一优选例中,r为c1-c6烷基、c6-c10芳基、c6-c10芳基-c1-c4烷基-。
[0070]
在另一优选例中,r为甲基、甲氧甲基、乙基、乙氧乙基、丙基、异丙基、正丁基、异丁基、叔丁基、苄基或苯基。
[0071]
在另一优选例中,所述的式3化合物如本发明的第一方面所述的方法制备。
[0072]
在另一优选例中,所述的卤代试剂含有卤素x。
[0073]
在另一优选例中,所述步骤1)中,式3化合物在第三惰性溶剂中与卤代试剂进行卤代反应生成式4化合物。
[0074]
在另一优选例中,所述步骤2)中,式4化合物在第四惰性溶剂中,在第三碱试剂和钯催化剂的存在下与甲基化试剂反应得到式5化合物。
[0075]
在另一优选例中,所述式3化合物中,r为甲基、甲氧甲基、乙基、乙氧乙基、丙基、异丙基、正丁基、异丁基、叔丁基、苄基或苯基。
[0076]
在另一优选例中,所述步骤1)中,所述第三惰性溶剂选自下组:甲醇、乙醇、异丙醇、二氯甲烷、乙腈、四氢呋喃,或其组合。
[0077]
在另一优选例中,所述步骤1)中,所述卤代试剂选自下组:ncs、二氯海因、nbs、二溴海因、溴素、四丁基三溴化铵、三溴吡啶嗡盐、单质碘、nis、二碘海因,或其组合。
[0078]
在另一优选例中,所述步骤1)中,所述第三惰性溶剂与所述式3化合物的体积比为1:1-30:1。
[0079]
在另一优选例中,所述步骤1)中,所述卤代试剂与所述式3化合物的摩尔比为1.0-10:1。
[0080]
在另一优选例中,所述步骤1)中,所述的反应的时间为1-8h,较佳地1-5h,更佳地
2-4h。
[0081]
在另一优选例中,所述步骤1)中,所述的反应的温度为0-30℃,较佳地20-30 ℃。
[0082]
在另一优选例中,所述步骤2)中,所述第四惰性溶剂选自下组:水、n,n
-ꢀ
二甲基甲酰胺、甲醇、乙醇、异丙醇、正丁醇、乙二醇、乙二醇甲醚、乙二醇二甲醚、1,4-二氧六环、四氢呋喃,或其组合。
[0083]
在另一优选例中,所述步骤2)中,所述第三碱试剂选自下组:碳酸钠、碳酸钾、乙酸钾、磷酸钠、磷酸钾,或其组合。
[0084]
在另一优选例中,所述步骤2)中,所述的钯催化剂选自下组:双(三苯基磷) 二氯化钯、乙酸钯、三苯基膦醋酸钯、四(三苯基膦)钯、乙酰丙酮钯、[1,1
’-
双(二苯基膦)二茂铁]二氯化钯、[1,1
’-
双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物,或其组合。
[0085]
在另一优选例中,所述步骤2)中,所述的甲基化试剂选自下组:三甲基硼、甲基硼酸、甲基硼酸异丙酯、甲基三氟硼酸钾,或其组合。
[0086]
在另一优选例中,所述步骤2)中,所述第四惰性溶剂与所述式4化合物的体积比为1:1-30:1,较佳地20-30:1。
[0087]
在另一优选例中,所述步骤2)中,所述第三碱试剂与所述式4化合物的摩尔比为1-10:1,较佳地2-6:1。
[0088]
在另一优选例中,所述步骤2)中,所述甲基化试剂与所述式4化合物的摩尔比为1-10。1,较佳地2-6:1,更佳地2-3.5:1。
[0089]
在另一优选例中,所述步骤2)中,反应温度为50℃-120℃,较佳地100-120 ℃。
[0090]
在另一优选例中,所述步骤2)中,所述的反应的时间为1-10h,较佳地1-7h,更佳地3-5h。
[0091]
在另一优选例中,所述步骤2)中,所述的反应的温度为80-140℃,较佳地 90-130℃,更佳地100-120℃。
[0092]
在另一优选例中,所述步骤1)包括:式3化合物与第三惰性溶剂混合后,降温至0~10℃,加入卤代试剂,反应生成式4化合物。
[0093]
在另一优选例中,所述步骤2)中,所述第四惰性溶剂为水和选自下组溶剂形成的混合液:乙醇乙二醇甲醚,或其组合。
[0094]
在另一优选例中,所述步骤2)中,所述第四惰性溶剂为乙醇水溶液、乙二醇甲醚水溶液、乙醇+乙二醇甲醚水溶液。
[0095]
在另一优选例中,所述步骤2)中,所述第四惰性溶剂为乙醇水溶液,乙醇和水的体积比为20-40:4-12。
[0096]
在另一优选例中,所述步骤2)中,所述第四惰性溶剂为乙醇+乙二醇甲醚水溶液,乙醇、乙二醇甲醚和水的体积比25-35:15-25:4-12。
[0097]
在另一优选例中,所述步骤2)中,所述第四惰性溶剂为乙二醇甲醚水溶液,乙二醇甲醚与水的体积比为1-10:1,较佳地2-8:1。
[0098]
在另一优选例中,所述步骤2)中,所述第三碱试剂与所述式4化合物的摩尔比为1-3:1。
[0099]
在另一优选例中,所述步骤2)中,所述第四惰性溶剂与所述式4化合物的体积比为1:1-10:1。
[0100]
在另一优选例中,所述步骤2)中,所述甲基化试剂与所述式4化合物的摩尔比为1-3。1。
[0101]
在另一优选例中,所述步骤2)中,式4化合物、第三碱试剂、钯催化剂、甲基化试剂和第四惰性溶剂混合后,反应,反应结束后,反应液过滤,加水,调 ph=3~4析晶,过滤,得到式5化合物。
[0102]
在另一优选例中,反应在常压下进行反应。
[0103]
在另一优选例中,所述步骤1)中,反应在常压下进行反应。
[0104]
在另一优选例中,所述步骤2)中,反应在常压下进行反应。
[0105]
在另一优选例中,所述的二氯甲烷和乙腈的体积比为0.8-1.2:0.8-1:2。
[0106]
在另一优选例中,所述步骤1)中,所述步骤1)中,所述第三惰性溶剂选自下组:乙腈、二氯甲烷,或其组合。
[0107]
在另一优选例中,所述步骤1)中,所述卤代试剂选自下组:nbs、ncs、二溴海因,或其组合。
[0108]
在另一优选例中,所述步骤1)中,所述第三惰性溶剂与所述式3化合物的体积比为1:1-30:1。
[0109]
在另一优选例中,所述步骤1)中,所述卤代试剂与所述式3化合物的摩尔比为1-6:1,较佳地1-4:1,更佳地1-3:1。
[0110]
在另一优选例中,所述步骤2)中,所述第四惰性溶剂选自下组:乙二醇甲醚、乙醇,或其组合。
[0111]
在另一优选例中,所述步骤2)中,所述第三碱试剂为磷酸钾。
[0112]
在另一优选例中,所述步骤2)中,所述钯催化剂为双(三苯基磷)二氯化钯。
[0113]
在另一优选例中,所述步骤2)中,所述甲基化试剂为甲基硼酸。
[0114]
在另一优选例中,所述的反应无需密闭环境条件下反应。
[0115]
在另一优选例中,所述的反应在密闭和开放条件下反应。
[0116]
本发明的第三方面,提供一种异喹啉酮类化合物中间体,所述异喹啉酮类化合物中间体的结构如式3或式4所示:
[0117][0118]
其中,r选自c1-c10烷基、c6-c10芳基、-r1or2,其中r1和r2各自独立地选自c1-c10烷基,x为cl、br或i。
[0119]
在另一优选例中,r为c1-c6烷基、c6-c10芳基、c6-c10芳基-c1-c4烷基-。
[0120]
在另一优选例中,r为甲基、甲氧甲基、乙基、乙氧乙基、丙基、异丙基、正丁基、异丁基、叔丁基、苄基或苯基。
[0121]
在另一优选例中,所述异喹啉酮类化合物中间体为:
[0122][0123]
在另一优选例中,r为甲基、甲氧甲基、乙基、乙氧乙基、丙基、异丙基、正丁基、异丁基、叔丁基、苄基或苯基,x为br。
[0124]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例) 中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
具体实施方式
[0125]
本发明经过广泛而又深入的研究,意外地发现一种制备式3结构化合物的方法。本发明所述的式3结构化合物的制备方法具有路线合理、方便易行、制备的产率和纯度高、适合工业化生产等优势。在此基础上,发明人完成了本发明。
[0126]
术语
[0127]
如本文所用,术语“包含”、“包括”、“含有”可互换使用,不仅包括封闭式定义,还包括半封闭、和开放式的定义。换言之,所述术语包括了“由
……
构成”、“基本上由
……
构成”。
[0128]
如本文所用,术语“烷基”指只含碳原子的直链(即,无支链)或支链饱和烃基,或直链和支链组合的基团。当烷基前具有碳原子数限定(如c1-c10烷基) 指所述的烷基含有1-10个碳原子,代表性实例包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、或类似基团。
[0129]
术语“芳基”是指芳香环状烃类化合物基团,例如具有1、或2个环,尤其指单环和双环基团,如苯基、联苯基或萘基。凡含有两个或两个以上芳香环(双环等),芳基基团的芳香环可由单键联接(如联苯),或稠合(如萘、蒽等等)。当芳基前有碳原子数限定时,指的是芳基的环碳原子个数,例如c6-c10芳基指的是具有6-10个环碳原子的芳基,代表性实例包括但不限于苯基、联苯基或萘基。
[0130]
在本发明中,除非另有说明书,所有的取代基为未取代的取代基。
[0131]
如本文所用,如本文所用与结构可互换使用。
[0132]
本发明中使用的缩写形式及其含义如下表所述:
[0133]
缩写含义dmfn,n-二甲基甲酰胺nmpn-甲基吡咯烷酮dmso二甲基亚砜tea三乙胺dbu1,8-二氮杂二环十一碳-7-烯diean,n-二异丙基乙胺dmfn,n-二甲基甲酰胺tlc薄层色谱ncsn-氯代丁二酰亚胺nbsn-溴代丁二酰亚胺nisn-碘代丁二酰亚胺
[0134]
如本文所使用“惰性溶剂”是指不与反应中的其它物质(如原料、催化剂等) 发生反应的溶剂。
[0135]
制备方法
[0136]
式3结构的异喹啉酮类化合物的制备方法
[0137]
本发明提供一种式3结构化合物的制备方法,具体地,本发明提供一种制备式3结构化合物的方法,所述方法包括步骤a)或步骤b):
[0138]
步骤a):
[0139]
式1化合物与甘氨酸反应,得到式2化合物,式2化合物与醇和酰氯反应得到式3化合物:
[0140][0141]
或步骤b):
[0142]
式1化合物与甘氨酸酯反应,得到式3化合物:
[0143][0144]
其中,所述酰氯的为rc(o)cl,所述的甘氨酸酯为nh
2-ch
2-c(o)-o-r;
[0145]
r为c1-c10烷基、c6-c10芳基、c6-c10芳基-c1-c4烷基-、或-r1or2,其中r1和r2各自独立地为c1-c10烷基。
[0146]
在另一优选例中,r为甲基、甲氧甲基、乙基、乙氧乙基、丙基、异丙基、正丁基、异丁基、叔丁基、苄基或苯基。
[0147]
在本发明的一个优选例中,所述步骤a)包括以下步骤:
[0148]
a1)式1化合物在第一惰性溶剂中,在第一碱试剂的作用下与甘氨酸反应生成所述式2化合物;
[0149]
a2)式2化合物与醇和酰氯反应生成所述式3化合物。
[0150]
在本发明的另一优选例中,所述步骤b)包括以下步骤:
[0151]
式1化合物在第二惰性溶剂中,在第二碱试剂的作用下和甘氨酸酯反应得到式3化合物。
[0152]
在一个优选例中,所述步骤a1)中,所述第一惰性溶剂包括(但不限于):乙二醇甲醚、甲醇、乙醇、异丙醇、正丁醇、n,n-二甲基甲酰胺(dmf)、n
-ꢀ
甲基吡咯烷酮(nmp)、二甲基亚砜(dmso)、乙腈、四氢呋喃、1,4-二氧六环、乙酸乙酯、乙酸异丙酯、二氯甲烷中,或其组合。
[0153]
在另一优选例中,所述步骤a1)中,所述第一碱试剂包括(但不限于):三乙胺(tea)、1,8-二氮杂二环十一碳-7-烯(dbu)、n,n-二异丙基乙胺(diea)、 n-甲基吗啉、吡啶,或其组合。
[0154]
在另一优选例中,所述步骤a1)中,所述甘氨酸与所述式1化合物的摩尔比为1-4:1。
[0155]
在另一优选例中,所述步骤a1)中,反应的温度为50-100℃。
[0156]
在另一优选例中,所述步骤a2)中,所述醇包括(但不限于):甲醇、乙醇、异丙醇、正丁醇,或其组合。
[0157]
在另一优选例中,所述步骤a2)中,所述酰氯包括(但不限于):氯化亚砜、乙酰氯、苯甲酰氯、草酰氯,或其组合。
[0158]
在另一优选例中,所述步骤a2)中,所述酰氯与式2化合物的摩尔比为1-10:1,较佳地1-6:1。
[0159]
在另一优选例中,所述步骤a2)中,所有的反应的温度使得反应在回流条件下进行。
[0160]
在另一优选例中,所述步骤b)中,所述第二惰性溶剂包括(但不限于):乙二醇甲醚、甲醇、乙醇、异丙醇、正丁醇、n,n-二甲基甲酰胺(dmf)、n
-ꢀ
甲基吡咯烷酮(nmp)、二甲基亚砜(dmso)、乙腈、四氢呋喃、1,4-二氧六环、乙酸乙酯、乙酸异丙酯、二氯甲烷,或其组合。
[0161]
在另一优选例中,所述步骤b)中,所述第二碱试剂包括(但不限于):三乙胺(tea)、1,8-二氮杂二环十一碳-7-烯(dbu)、n,n-二异丙基乙胺(diea)、 n-甲基吗啉、吡啶,或其组合。
[0162]
在另一优选例中,所述步骤b)中,所述甘氨酸酯包括(但不限于):甘氨酸甲酯、甘氨酸乙酯、甘氨酸苄酯、甘氨酸甲氧基甲酯,或其组合。
[0163]
在另一优选例中,所述步骤b)中,所述甘氨酸酯与所述式1化合物的摩尔比为1-4:1。
[0164]
在另一优选例中,所述步骤b)中,反应的温度为50-100℃,较佳地55-75℃。
[0165]
在另一优选例中,所述步骤a1)中,所述第一碱试剂与所述式1化合物的摩尔比为
1-6:1,较佳地1-4,更佳地1.5-4,最佳地1.5-2.5。
[0166]
在另一优选例中,所述的反应在常压下进行。
[0167]
式5结构的异喹啉酮类化合物的制备方法
[0168]
本发明提供一种式5化合物的制备方法,具体地,所述的方法包括以下步骤:
[0169]
1)式3化合物与卤代试剂反应得到式4化合物;
[0170][0171]
2)式4化合物与甲基化试剂反应得到式5化合物。
[0172][0173]
r为c1-c10烷基、c6-c10芳基、c6-c10芳基-c1-c4烷基-、或-r1or2,其中r1和r2各自独立地选自c1-c10烷基,x为cl、br或i。
[0174]
在一个优选例中,所述的式3化合物如上所述的方法制备。
[0175]
在另一优选例中,所述步骤1)中,式3化合物在第三惰性溶剂中与卤代试剂进行卤代反应生成式4化合物。
[0176]
在另一优选例中,所述步骤2)中,式4化合物在第四惰性溶剂中,在第三碱试剂和钯催化剂的存在下与甲基化试剂反应得到式5化合物。
[0177]
在另一优选例中,所述步骤1)中,所述第三惰性溶剂选自下组:甲醇、乙醇、异丙醇、二氯甲烷、乙腈、四氢呋喃,或其组合。
[0178]
在另一优选例中,所述步骤1)中,所述卤代试剂选自下组:ncs、二氯海因、nbs、二溴海因、溴素、四丁基三溴化铵、三溴吡啶嗡盐、单质碘、nis、二碘海因,或其组合。
[0179]
在另一优选例中,所述步骤1)中,所述卤代试剂与所述式3化合物的摩尔比为1.0-10:1。
[0180]
在另一优选例中,所述步骤1)中,所述的反应的温度为0-30℃,较佳地20-30 ℃。
[0181]
在另一优选例中,所述步骤2)中,所述第四惰性溶剂包括(但不限于):水、n,n-二甲基甲酰胺、甲醇、乙醇、异丙醇、正丁醇、乙二醇、乙二醇甲醚、乙二醇二甲醚、1,4-二氧六环、四氢呋喃,或其组合。
[0182]
在另一优选例中,所述步骤2)中,所述第三碱试剂包括(但不限于):碳酸钠、碳酸钾、乙酸钾、磷酸钠、磷酸钾,或其组合。
[0183]
在另一优选例中,所述步骤2)中,所述的钯催化剂包括(但不限于):双 (三苯基磷)二氯化钯、乙酸钯、三苯基膦醋酸钯、四(三苯基膦)钯、乙酰丙酮钯、 [1,1
’-
双(二苯基膦)二茂铁]二氯化钯、[1,1
’-
双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物,或其组合。
[0184]
在另一优选例中,所述步骤2)中,所述的甲基化试剂包括(但不限于):三甲基硼、甲基硼酸、甲基硼酸异丙酯、甲基三氟硼酸钾,或其组合。
[0185]
在另一优选例中,所述步骤2)中,所述第四惰性溶剂与所述式4化合物的体积比为1:1-30:1,较佳地20-30:1。
[0186]
在另一优选例中,所述步骤2)中,所述甲基化试剂与所述式4化合物的摩尔比为1-10;1,较佳地2-6:1,更佳地2-3.5:1。
[0187]
在另一优选例中,所述步骤2)中,反应温度为50℃-120℃,较佳地100-120 ℃。
[0188]
在另一优选例中,所述步骤2)中,所述的反应的温度为80-140℃,较佳地 90-130℃,更佳地100-120℃。
[0189]
在另一优选例中,所述步骤1)中,反应在常压下进行反应。
[0190]
在另一优选例中,所述步骤2)中,反应在常压下进行反应。
[0191]
中间体
[0192]
本发明还提供一种异喹啉酮类化合物中间体,所述异喹啉酮类化合物中间体的结构如式3或式4所示:
[0193][0194]
其中,r选自c1-c10烷基、c6-c10芳基、-r1or2,其中r1和r2各自独立地选自c1-c10烷基,x为cl、br或i。
[0195]
r为甲基、甲氧甲基、乙基、乙氧乙基、丙基、异丙基、正丁基、异丁基、叔丁基、苄基或苯基。
[0196]
在另一优选例中,x为br。
[0197]
在另一优选例中,所述异喹啉酮类化合物中间体为:
[0198][0199]
本发明的主要优点包括:
[0200]
1)在本发明中,将式1化合物先与甘氨酸氨解反应,优先在异喹啉母核上引入甘氨酸基团,该步骤仅需在常压下加热即可完成,无需使用封管等密闭环境,降低了制备工艺对设备的要求,简化了操作步骤,降低了安全隐患。
[0201]
2)本发明由式3化合物制备式3异喹啉酮类化合物的过程中,卤代反应及 suzuki偶联反应速度快。
[0202]
3)本发明的异喹啉酮类化合物的制备工艺相较于现有技术,制备过程简单,反应时间短,产率高,副产物少,放大生产的结果良好,具有较好的工业化前景。
[0203]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0204]
实施例
[0205]
在实施例1-7中,所有的反应均在常压(标准大气压)条件下进行,室温指的是25
±
5℃。
[0206]
实施例1
[0207][0208]
将4-羟基-7-苯氧基异喹啉-3-甲酸甲酯(20g,68mmol)加入乙腈中,缓慢滴加dbu(136mmol),然后加入甘氨酸(7.66g,102mmol),升温至65℃反应6h,tlc 板检测反应完成,冷却至室温,并过滤。滤液调节ph至弱酸性,搅拌析晶,过滤烘料得到(4-羟基-7-苯氧基异喹啉-3-甲酰胺基)乙酸22g,收率96%,hplc 测定纯度为98.1%。
[0209]
将(4-羟基-7-苯氧基异喹啉-3-甲酰胺基)乙酸(8g,24mmol)和120ml甲醇混合,降
温至10℃,缓慢加入草酰氯(91.5mmol),滴加完升温至回流反应3h,tlc 检测反应完成,浓缩至干,加二氯甲烷萃取,水洗涤,干燥过滤,浓缩至少量滴加石油醚析晶,过滤烘干得8.2g(4-羟基-7-苯氧基异喹啉-3-甲酰胺基)乙酸甲酯,收率98%,hplc测定纯度为97.7%。1h nmr(400mhz,cdcl3):δ12.85 (s,1h),8.48
–
8.37(m,2h),8.34(d,j=9.0hz,1h),7.52
–
7.37(m,3h),7.23(d, j=7.4hz,1h),7.15
–
7.08(m,2h),4.28(d,j=5.8hz,2h),3.81(s,3h).
[0210]
实施例2
[0211][0212]
将4-羟基-7-苯氧基异喹啉-3-甲酸甲酯(20g,68mmol)加入nmp中,缓慢滴加diea(252mmol),然后加入甘氨酸(15.3g,204mmol),滴毕后升温至100℃反应6h,tlc板检测反应完成,冷却至室温,并过滤。滤液调节ph至弱酸性,搅拌析晶,过滤烘料得到(4-羟基-7-苯氧基异喹啉-3-甲酰胺基)乙酸21g,收率 91%,hplc测定纯度为98.3%。
[0213]
将(4-羟基-7-苯氧基异喹啉-3-甲酰胺基)乙酸(8g,24mmol)和120ml乙醇混合,降温至0℃,缓慢加入氯化亚砜(72mmol),滴加完升温至回流反应3h,tlc 检测反应完成,浓缩至干,加二氯甲烷萃取,水洗涤,干燥过滤,浓缩至少量滴加石油醚析晶,过滤烘干得8.4g(4-羟基-7-苯氧基异喹啉-3-甲酰胺基)乙酸乙酯,收率97%,hplc测定纯度为96.4%。
[0214]
实施例3
[0215][0216]
将4-羟基-7-苯氧基异喹啉-3-甲酸甲酯(10g,33.9mmol)和四氢呋喃混合,缓慢滴加diea(136mmol),然后加入甘氨酸苄酯(136mmol),滴毕后升温至 65℃反应6h,tlc板检测反应完成,冷却至室温,加水和乙酸乙酯萃取,浓缩有机相得到15g(4-羟基-7-苯氧基异喹啉-3-甲酰胺基)乙酸苄酯,收率83.8%, hplc测定纯度为97.3%。
[0217]
实施例4
[0218][0219]
将4-羟基-7-苯氧基异喹啉-3-甲酸甲酯(10g,33.9mmol)和乙腈混合,缓慢滴加dbu(10.3g,67.7mmol),然后加入甘氨酸甲氧基甲酯(68mmol),滴毕后升温至65℃反应6h,tlc板检测反应完成,冷却至室温,加水和乙酸乙酯萃取,浓缩有机相得到10g(4-羟基-7-苯氧基异喹啉-3-甲酰胺基)乙酸甲氧基甲酯,收率83.8%,hplc测定纯度为98.0%。
[0220]
实施例5
[0221][0222]
室温下将(4-羟基-7-苯氧基异喹啉-3-甲酰胺基)乙酸甲酯(26g,73.8mmol)和二
氯甲烷混合,降温到0~10℃滴加nbs(88.5mmol),滴完升温至室温反应3 小时,tlc检测反应完成,加亚硫酸氢钠溶液洗涤,干燥,浓缩,得到(4-羟基
ꢀ-
1-溴-7-苯氧基异喹啉-3-甲酰胺基)乙酸甲酯26g,收率81%,hplc测定纯度 96.5%。1h nmr(400mhz,cdcl3)δ12.83(s,1h),8.34(d,j=9.0hz,1h),8.15 (t,j=5.5hz,1h),7.64(d,j=2.3hz,1h),7.52
–
7.40(m,3h),7.24(d,j=7.5hz, 1h),7.17
–
7.09(m,2h),4.27(d,j=5.9hz,2h),3.82(s,3h).
[0223]
室温下将(4-羟基-1-溴-7-苯氧基异喹啉-3-甲酰胺基)乙酸甲酯(20g, 46.4mmol),甲基硼酸(7.5g,125.2mmol),磷酸钾(27.6g,130mmol),双(三苯基磷) 二氯化钯(2.6g,3.7mmol)和乙二醇甲醚400ml混合,加水80ml,升温到110℃反应4小时,tlc检测反应完成,降温到室温过滤,加水400ml,调ph=3~4 析晶,过滤,烘干滤饼得到[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸15.0g,收率91%,hplc测定纯度为97.7%。1h nmr(400mhz,dmso):δ13.07(d,j=196.2hz,2h),9.10(t,j=5.9hz,1h),8.30(d,j=9.0hz,1h),7.62 (d,j=2.3hz,1h),7.51(ddd,j=15.9,8.6,5.0hz,3h),7.26(t,j=7.4hz,1h), 7.19(d,j=7.7hz,2h),4.06(d,j=6.1hz,2h),2.71(s,3h)。
[0224]
实施例6
[0225][0226]
室温下将(4-羟基-7-苯氧基异喹啉-3-甲酰胺基)乙酸乙酯(27g,73.8mmol)和二氯甲烷混合,降温到0~10℃滴加ncs(160mmol),滴完升温至室温反应3 小时,tlc检测反应完成,加亚硫酸氢钠溶液洗涤,干燥,浓缩,得到(4-羟基
ꢀ-
1-氯-7-苯氧基异喹啉-3-甲酰胺基)乙酸甲酯25g,收率87%,hplc测定纯度为96.8%。
[0227]
室温下将(4-羟基-1-氯-7-苯氧基异喹啉-3-甲酰胺基)乙酸乙酯(17g, 46.4mmol),三甲基硼(192mmol),碳酸钾(130mmol),四(三苯基膦)钯(3.7mmol) 和乙醇300ml混合,加水80ml,升温到110℃反应4小时,tlc检测反应完成,降温到室温过滤,加水400ml,调ph=3~4析晶,过滤,烘干滤饼得到[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸14.2g,收率86%,hplc测定纯度为96.3%。
[0228]
实施例7
[0229][0230]
室温下将(4-羟基-7-苯氧基异喹啉-3-甲酰胺基)乙酸苄酯(31.5g,73.8mmol) 和315ml二氯甲烷,315ml乙腈混合,降温到0~10℃滴加二溴海因(300mmol),滴完升温至室温反应3小时,tlc检测反应完成,加亚硫酸氢钠溶液洗涤,干燥,浓缩,得到(4-羟基-1-溴-7-苯氧基异喹啉-3-甲酰胺基)乙酸苄酯25g,收率 81%,hplc测定纯度为96.8%。
[0231]
室温下将(4-羟基-1-溴-7-苯氧基异喹啉-3-甲酰胺基)乙酸苄酯(23.4g, 46.4mmol),甲基硼酸异丙酯(150mmol),乙酸钾(185.6mmol),三苯基膦醋酸钯 (3.7mmol)和乙二醇甲醚200ml、乙醇300ml混合,加水80ml,升温到110℃反应4小时,tlc检测反应完
成,降温到室温过滤,加水400ml,调ph=3~4析晶,过滤,烘干滤饼得到[(4-羟基-1-甲基-7-苯氧基-异喹啉-3-羰基)-氨基]-乙酸 15g,收率92%,hplc测定纯度为96.9%。
[0232]
对比例
[0233]
按照专利cn107954931中公开了一种罗沙司他的合成方法,具体路线如下:
[0234][0235]
该路线的产率为49.3%。
[0236]
与对比例相比,本发明实施例的方法由于先对原料进行了胺解,不仅在后续的suzuki偶联过程中,可以加快反应速率,而且避免了甲基化后胺解的过程中使用高压反应条件或复杂偶联剂,提高了工业生产效率,降低了成本。
[0237]
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1