一种麦芽糖生产用重组异淀粉酶高效表达及应用的制作方法
本发明涉及一种麦芽糖生产用重组异淀粉酶高效表达及应用,属于基因工程和酶工程领域。
背景技术:
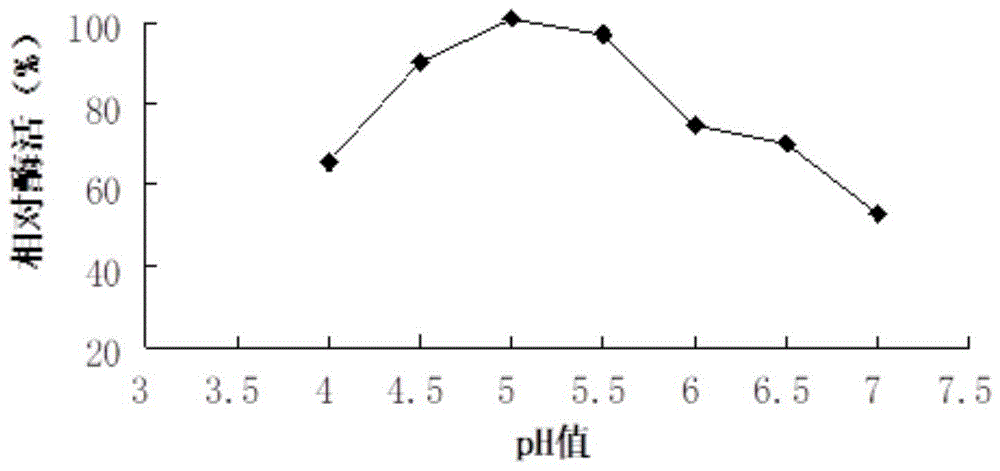
:异淀粉酶(e.c.3.2.1.33,isoamylase)是一种内切型淀粉酶,仅专一性作用于支链淀粉分支点的α-1,6-糖苷键,使其形成直链淀粉,而对直链淀粉分子中的α-1,6-糖苷键不起作用,这种特性最早在淀粉结构的理论研究中应用。到七十年代,异淀粉酶的应用越来越广泛,逐步从实验室研究向工业化应用发展,已扩展到淀粉糖浆,啤酒和酒精生产等多个淀粉深加工领域。主要原因是在淀粉加工过程中,异淀粉酶和糖化酶的协同作用可以加速糖化过程,并提高糖化率,和β-淀粉酶配合使用能极大提高麦芽糖得率。由于异淀粉酶可以将最小单位的支链分解,最大限度地利用淀粉原料,因此是一种需求量很大的支链淀粉酶。目前除了较成功地应用于高葡萄糖浆,高麦芽糖浆,低聚寡糖和啤酒生产,在医药领域亦有应用。自然界中,异淀粉酶来源广泛。目前已在大米、甜玉米、马铃薯、蚕豆等许多植物中发现有异淀粉酶。高等动物的肝脏、肌肉中也有类似于异淀粉酶水解α-1,6-糖苷键的酶存在,但将这些来源的异淀粉酶应用于高速发展的工业上是远远不够的。微生物来源的异淀粉酶数量庞大,而且根据菌的生长特性可以分离出耐高温、耐低温、嗜酸性、嗜碱性等适合于不同工业需求的异淀粉酶,因此近年来,人们越来越多的关注微生物来源的异淀粉酶。1940年日本学者首次从酵母细胞提取液中发现异淀粉酶,但能满足工业化生产的菌种还是比较难得。1993年王武等对短杆菌异淀粉酶产生菌进行诱变,选育,从初始酶活为7u/ml的出发菌,获得了摇瓶发酵液中酶活单位最高可达20u/ml的突变菌株,是至今国内较为优良的产异淀粉酶菌种,但一直未见其后续研究及工业化生产的相关报道。2003年王弋等诱变中温地衣芽孢杆菌,其出发菌株的异淀粉酶活性达到3.35u/ml,诱变后酶活提高到7.37u/ml。2005年夏静等从云南梁河温泉水样中分离筛选到1株产异淀粉酶的栖热菌(thermus),其产酶的初始酶活达4.14u/ml。关于如何获得高产量、高稳定性微生物来源的异淀粉酶方面的报道在国内并不多见。2016年,冉红艳将嗜热放线菌的异淀粉酶基因克隆到大肠杆菌里,获得成功表达,酶活力是18.8u/ml。国外,1988年amemura首先使用鸟枪克隆法克隆并测序了p.amyloderamosa的异淀粉酶编码基因。1989年togoni等完成了来源于一株假单胞菌的异淀粉酶编码基因的克隆和测序。1999年abej将flavobacteriumodoratumku异淀粉酶基因成功表达在大肠杆菌中,酶活力达到85.9u/ml。2007年cho等克隆并鉴定了来自pectobacteriumcarotovrum亚种carotovorum(pcc)ly34的异淀粉酶基因,并将其表达在大肠杆菌dh5α中,酶活力为35.5u/ml。因此,细菌异淀粉酶普遍分泌量较低,常规方法如优化发酵产酶条件、紫外诱变等无法从根本上提高酶活,细菌异淀粉酶基因重组表达是解决这一难题的主要策略之一。技术实现要素:本发明提供一种产异淀粉酶重组工程菌,该工程菌进行异源重组表达得到目标重组酶,分析重组酶的酶学性质和应用特性,并与天然酶的结果进行比较,鉴定性能优良的麦芽糖生产用高效胞外异淀粉酶的编码基因。本发明的第一个目的是提供一种编码异淀粉酶的基因,其核苷酸序列如seqidno.1所示。本发明的第二个目的是提供一种异淀粉酶,其氨基酸序列如seqidno.2所示。本发明的第三个目的是提供携带所述基因或表达所述异淀粉酶的载体或细胞系。在一种实施方式中,所述细胞为微生物细胞。在一种实施方式中,所述微生物为大肠杆菌,包括但不限于:e.colibl21、e.colibl21(de3)、e.colijm109、e.colidh5α或e.colitop10。本发明的第四个目的是提供一种基因工程菌,其特征在于,以pmd18t-simple为载体,以e.colibl21(de3),表达seqidno.1所示的异淀粉酶基因。本发明的第五个目的是提供所述异淀粉酶在食品领域的应用。在一种实施方式中,所述应用是生产高葡萄糖浆,高麦芽糖浆,低聚寡糖或啤酒。有益效果:本发明从富含淀粉的土壤中分离筛选目的菌株,通过菌株细胞破碎技术获取产异淀粉酶基因,设计引物,目的基因pcr扩增,选择合适质粒结合以大肠杆菌为受体细胞,建立细菌异淀粉酶基因的重组表达系统,获得高产量、高稳定性的异淀粉酶,摇瓶发酵产量可达113.7u/ml,将其用于麦芽糖生产,可使麦芽糖浆中的麦芽糖含量达95.13%,弥补工业上的需求。附图说明图1为不同温度下酶的相对活力;图2为不同ph下酶的相对活力。具体实施方式异淀粉酶的酶活测定方法:采用3,5-二硝基水杨酸法测定酶活力(以麦芽糖做标准曲线),测定实验菌株在od520nm的光密度值。酶活力单位定义:在40℃、ph6.0条件下,每分钟从1%的支链淀粉中释放出1mmol麦芽糖的酶量定义为1个酶活力单位(u)式中:k为标准曲线斜率;f为样品溶液反应前的总量,100ml;s为样品测试量,s=0.5;t为时间,t=10min;a为实验组吸光度;a0为对照组吸光度。取15ml具塞试管8支,编号,分别加入粗酶液和1%的支链淀粉溶液各0.5ml,以蒸馏水代替粗酶液的试管做对照。再加入3,5-二硝基水杨酸1.5ml,摇匀,沸水浴5min,取出冷却,用蒸馏水稀释至10ml,摇匀后用分光光度计于520nm波长下比色,记录吸光值,根据标准曲线进行结果计算,每个样平行做3份,求平均值。实施例1野生产异淀粉酶菌种的筛选(1)培养基的准备分离培养基(按g/100ml培养基计):蛋白胨0.5,na2hpo40.015,kh2po40.01,mgso4·7h2o0.05,nacl0.05,支链淀粉0.2,琼脂1.8,ph7.0-7.2,8磅30min灭菌。lb斜面培养基(按g/100ml培养基计):可溶性淀粉1,蛋白胨0.6,酵母膏0.15,mgso4·7h2o0.1,k2hpo4.0.05,ph7.0-7.2,15磅25min灭菌。tb发酵培养基(按g/100ml培养基计):可溶性淀粉1.2,蛋白胨0.6,酵母膏0.3,mgso4·7h2o0.05,k2hpo4.0.1,ph7.0-7.2,15磅25min灭菌。(2)菌种的筛选及分离纯化分别从含有淀粉的土壤、堆肥、温泉等自然环境中采集样品土壤,将样品土壤用无菌水适当稀释,均匀涂布于分离培养基上,32℃培养。待长出菌落后,挑取透明圈和菌落直径比较大的50株菌接入斜面,进一步纯化分离,将纯化好的菌种接入含有tb发酵培养基的摇瓶中,以32℃180r/min培养48h测酶活(接种量4ml),表1为筛选获得的3株酶活最高的菌株。表1不同菌株产酶能力实施例2产异淀粉酶工程菌的制备及表达(1)目的基因组的提取从斜面培养基上挑取适量的纯化好的目标菌体l3,接种于液体培养基中,在50℃,200rpm振荡培养20h,取1.5ml菌体悬浮液离心,用于提取基因组dna。l3基因组dna采用生工生物工程(上海)有限公司生产的ezup柱式细菌基因组dna抽提试剂盒进行提取,详细操作步骤见试剂盒使用说明书。最后将吸附柱上的基因组dna用无菌超纯水进行洗脱,样品在-20℃下保存备用。(2)目的基因的鉴定及pcr扩增将菌株l3的基因组进行全基因组测序,对相关基因进行初步确定。根据基因组序列设计引物:tfu_f:5–catatgatggtggaagtctggcctgg–3’含有ndeⅰ酶切位点tfu_r:5–aagcttgagcaccaggaacgaccgg–3’含有hindⅲ酶切位点pcr反应体系如下所示:pcr扩增程序设定为:94℃预变性4min后进入30个循环;98℃变性10s,58℃退火5s,72℃延伸2.5min;最后72℃延伸10min,4℃保温。pcr产物用1%琼脂凝胶电泳进行检测。(3)pcr产物的纯化使用生物工程(上海)有限公司生产的sanprep柱式pcr产物纯化试剂盒进行纯化,具体操作间试剂盒说明书。最后将吸附在柱上的pcr产物用无菌超纯水进行洗脱,样品直接使用或保存在-20℃下备用。(4)质粒的构建ta克隆载体为takara公司的pmd18t-simplevector,连接体系如下:pca产物5μlpmd18t-simple2μlsolution4μl将上述连接反应混合物轻轻混匀并离心,于16℃连接过夜,然后转化克隆宿主jm109。限制性内切酶采用ndeⅰ和hindⅲ,用质粒小量提取试剂盒来提取质粒,进行小量双酶切验证。将酶切验证正确的质粒送上海生工测序,然后将测序正确的表达载体pmd18t-simple/pula转化表达宿主e.colibl21(de3),挑取阳性转化子接入lb培养基中培养过夜,并保存甘油管备用,构建得到重组菌株bl21(de3)(pt7-7/tfu_iso)。(5)重组菌的摇瓶发酵种子培养:取适量甘油管保藏的菌液接入lb种子培养基,37℃,200rpm摇瓶振荡培养8-9h。培养基使用前添加100μg/ml氨苄青霉素。摇瓶发酵培养:以5%(v/v)的接种量将种子接入tb发酵培养基中,装液量50ml(250ml三角瓶),200rpm,37℃培养至od600为1.0时,加入0.05mmol/liptg诱导,继续培养30h。培养基使用前添加100μg·ml-1氨苄青霉素,异淀粉酶活力为38.4u/ml,是出发菌株的2.07倍。(6)诱导条件的优化保持诱导浓度为0.05mmo/l,分别将诱导温度降低至30℃和25℃,结果显示,酶活分别可达45.8u/ml和35.1u/ml。将诱导温度控制为30℃,分别调至iptg浓度为0.05、0.10和0.15mmo/l,比较诱导30h后的细胞生长情况和产酶情况,结果如表2所示。以37℃培养至od600为1.0时,加入0.1mmol/liptg诱导,于30℃继续培养30h作为最优的诱导条件。表2不同诱导条件下的细胞生长及产酶情况iptg浓度(mmo/l)细胞干重(g/l)酶活力(u/ml)0.058.645.80.107.2113.70.157.065.1(7)重组酶的分离纯化发酵液于4℃、10000rpm离心20min收集得到菌体,菌体用50mmol·l-1ph5.5na2hpo4柠檬酸缓冲悬浮液悬浮,用超声波破碎仪破碎,破碎条件:工作3s,间歇3s,功率15%,总时间6min,实际工作时间是3min。菌体破碎后12000rpm,离心3min,上清液即为酶液。采用20%的(nh4)2so4进行盐析,离心收集沉淀。沉淀复溶后,在ph7.0,20mmol/l磷酸缓冲液中透析过夜。样品经过0.4μm膜过滤后制成上样样品;deae阴离子交换色谱柱进行纯化,260nm紫外在线监测收集目的组分,分部收集含异淀粉酶酶活的洗脱液。表3重组酶的纯化过程参数实施例3重组酶的酶学性质分析配制不同ph值(ph4.0-7.0)的缓冲液代替异淀粉酶活力测定方法中的缓冲液,在45℃下测定异淀粉酶活力,考察酶的最适作用ph。以支链淀粉为底物,用50mmol·l-1ph5.0磷酸缓冲液,在不同温度下(30℃-70℃)测定异淀粉酶酶活以确定最适反应温度。结果如图1~2所示,重组酶在ph5.0,温度45℃时活性最强,在温度为40~45℃,ph4.5~5.5时,相对酶活可达90%以上。实施例4重组酶在生产麦芽糖中的应用向200g/l淀粉糊精中按照2u/gds(干物质)的量添加异淀粉酶酶液,于ph5.0,45℃反应4h,再加富15u/gds的β-淀粉酶,继续反应20h,测得麦芽糖浆中的麦芽糖含量达95.13%;以普鲁兰酶作为对照,在相同条件下进行反应,结果显示,麦芽糖含量仅78.22%。可见,本申请的异淀粉酶能够显著提高β-淀粉酶转化生成麦芽糖的效率,由于最适温度较低,更适于工业化应用。虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。sequencelisting<110>湖南汇升生物科技有限公司<120>一种麦芽糖生产用重组异淀粉酶高效表达及应用<160>4<170>patentinversion3.3<210>1<211>2088<212>dna<213>人工序列<400>1atggtcgaggtctggcccggcaccccctaccccctcggcgccacctacgacggctccggc60accaacttctccctcttctccgaggtcgccaccggcgtcgagctctgcctcttcgacgac120gacggcgccgagacccgcatcgagctcaccgagcgcgacggccacgtctggcacctctac180ctccccggcgtcggccccggccagcgctacggctaccgcgtccacggcccccacgacccc240acccgcggcctccgctgcaaccccaacaagctcctcgtcgacccctacgccaaggccatc300gacggccgcatcgagtggcacgagtccctcttcgactaccacttcgacgacccctcccgc360gtcaacaaccacgactccgccccctacgtccccacctgcgtcgtcgtctcccccttcttc420gactggggcgccgagcagcaccccaacatcccctaccacgagaccgtcatctacgaggcc480cacgtccgcggcatgaccatccgccaccccgacgtccccccccccctccgcggcacctac540gccggcatggcccaccccgccgtcgtcgaccacctccgcgccctcggcgtcaccgccgtc600gagctcatgcccgtccaccacttcctccccgagcacgccctcgtcgcccgcggcctcacc660aactactggggctacaacaccctcgccttcctcgcccccgactccggctacgccgccacc720ggcacccgcggcgagcaggtccaggagttcaaggccatggtcaaggccctccacgaggcc780ggcatcgaggtcatcctcgacgtcgtctacaaccacaccgccgagggcgaccacatgggc840cccaccctctccctccgcggcatcgacaacctcgcctactaccgcgtccgcgaggacgac900cgccgctactacctcgactacaccggctgcggcaactccctcaacatgcgccacccccac960tccctccagctcatcatggactccctccgctactgggtcctcgagatgcacgtcgacggc1020ttccgcttcgacctcgcctccgccctcgcccgcgagttccacgacgtcgaccgcctctcc1080accttcttcgacatcgtccagcaggaccccgtcatcgagcaggtcaagctcatcgccgag1140ccctgggacgtcggccccggcggctaccaggtcggcaacttcccccccctctggtccgag1200tggaacggcctctaccgcgacaccgtccgcgacttctggcgcggctaccccgtcctcccc1260gagctcgcctcccgcctctccggctcctccgacctctaccaggccgacggccgccgcccc1320gtcgcctccgtcaacttcgtcacctgccacgacggcttcaccctcgccgacctcgtctcc1380tacgaccgcaagcacaacgaggccaacggcgaggacaaccgcgacggcaccaacgacaac1440cgctcctggaaccacggcaccgagggccccaccaccgaccccgccatcgccaccctccgc1500cgccgccagatgcgcaacatgctcaccaccctcatgctctcccagggcgtccccatgctc1560tcccacggcgacgagatcggccgcacccagcacggcaacaacaacgcctactgccaggac1620aacgagatcgcctggatggactgggagctcggcgaggagcaggaggagctcctcgagttc1680gtccgccgcctctcccgcctccgccgcggccaccccgtcttccgccgccgccgcttcttc1740cagggcgacctctccggccagggccgccagcgcgacatcgcctggctccgccccgacggc1800ggcctcatggccaactccgactggggccgcggcggccgcgccctcggcgtcttcctcaac1860ggcgacgccatcaccgagcccgaccgcctcggccgccgcgtccgcgacgactccttcctc1920ctcctcgccaacgccgaggtcggctccgtccgcttcaccctccccgaccgctcctacggc1980tccgcctgggagaccgtcgtcgacaccgccgagcccggcgtcaccggccgccccctcctc2040ctcgccggcggcggcgtcaccgtcgtcgaccgcgccttcctcgtcctc2088<210>2<211>696<212>prt<213>人工序列<400>2metvalgluvaltrpproglythrprotyrproleuglyalathrtyr151015aspglyserglythrasnpheserleuphesergluvalalathrgly202530valgluleucysleupheaspaspaspglyalagluthrargileglu354045leuthrgluargaspglyhisvaltrphisleutyrleuproglyval505560glyproglyglnargtyrglytyrargvalhisglyprohisasppro65707580thrargglyleuargcysasnproasnlysleuleuvalaspprotyr859095alalysalaileaspglyargileglutrphisgluserleupheasp100105110tyrhispheaspaspproserargvalasnasnhisaspseralapro115120125tyrvalprothrcysvalvalvalserprophepheasptrpglyala130135140gluglnhisproasnileprotyrhisgluthrvaliletyrgluala145150155160hisvalargglymetthrilearghisproaspvalproproproleu165170175argglythrtyralaglymetalahisproalavalvalasphisleu180185190argalaleuglyvalthralavalgluleumetprovalhishisphe195200205leuprogluhisalaleuvalalaargglyleuthrasntyrtrpgly210215220tyrasnthrleualapheleualaproaspserglytyralaalathr225230235240glythrargglygluglnvalglngluphelysalametvallysala245250255leuhisglualaglyilegluvalileleuaspvalvaltyrasnhis260265270thralagluglyasphismetglyprothrleuserleuargglyile275280285aspasnleualatyrtyrargvalarggluaspaspargargtyrtyr290295300leuasptyrthrglycysglyasnserleuasnmetarghisprohis305310315320serleuglnleuilemetaspserleuargtyrtrpvalleuglumet325330335hisvalaspglypheargpheaspleualaseralaleualaargglu340345350phehisaspvalaspargleuserthrphepheaspilevalglngln355360365aspprovalilegluglnvallysleuilealagluprotrpaspval370375380glyproglyglytyrglnvalglyasnpheproproleutrpserglu385390395400trpasnglyleutyrargaspthrvalargaspphetrpargglytyr405410415provalleuprogluleualaserargleuserglyserseraspleu420425430tyrglnalaaspglyargargprovalalaservalasnphevalthr435440445cyshisaspglyphethrleualaaspleuvalsertyrasparglys450455460hisasnglualaasnglygluaspasnargaspglythrasnaspasn465470475480argsertrpasnhisglythrgluglyprothrthraspproalaile485490495alathrleuargargargglnmetargasnmetleuthrthrleumet500505510leuserglnglyvalprometleuserhisglyaspgluileglyarg515520525thrglnhisglyasnasnasnalatyrcysglnaspasngluileala530535540trpmetasptrpgluleuglyglugluglnglugluleuleugluphe545550555560valargargleuserargleuargargglyhisprovalpheargarg565570575argargphepheglnglyaspleuserglyglnglyargglnargasp580585590ilealatrpleuargproaspglyglyleumetalaasnserasptrp595600605glyargglyglyargalaleuglyvalpheleuasnglyaspalaile610615620thrgluproaspargleuglyargargvalargaspaspserpheleu625630635640leuleualaasnalagluvalglyservalargphethrleuproasp645650655argsertyrglyseralatrpgluthrvalvalaspthralaglupro660665670glyvalthrglyargproleuleuleualaglyglyglyvalthrval675680685valaspargalapheleuvalleu690695<210>3<211>26<212>dna<213>人工序列<400>3catatgatggtggaagtctggcctgg26<210>4<211>25<212>dna<213>人工序列<400>4aagcttgagcaccaggaacgaccgg25当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1