一种快速获得大量纯化的疟原虫子孢子的方法与流程
本发明属于疟疾研究技术领域,涉及一种快速获得大量纯化的疟原虫子孢子的方法。
背景技术:
疟疾是严重危害公共卫生健康的三大传染病之一,每年全球死亡人数约有40万。按蚊是疟疾的传播媒介,其在叮咬人体吸血时,唾液腺中的子孢子随即一同进入人体内开启疟疾感染。由于子孢子是感染源头,因此围绕子孢子开展的各类研究均是疟疾领域的热点和重点,如子孢子在人体内的迁移途径,子孢子对肝细胞的专性寄生以及减毒子孢子疫苗等。但是,无论何种研究,首先需要分离得到子孢子。目前常用的纤维素柱分离方法存在耗时长,得率低,子孢子活力低等缺点,本发明旨在建立一种快速获得大量纯化的疟原虫子孢子的方法。
技术实现要素:
有鉴于此,本发明的目的在于提供一种快速获得大量纯化的疟原虫子孢子的方法,所得疟原虫子孢子可用于后续下游实验。
为达到上述目的,本发明提供如下技术方案:
一种快速获得大量纯化的疟原虫子孢子的方法,先收集感染疟疾的按蚊,麻醉浸洗后于显微镜下解剖剥离蚊唾液腺,通过机械性挤压释放出唾液腺内的疟原虫子孢子并收集,然后利用无菌滤膜进行纯化处理即得纯化的疟原虫子孢子。优选的,所述疟原虫子孢子为恶性疟原虫、间日疟原虫、三日疟原虫、卵形疟原虫、伯氏疟原虫、夏氏疟原虫或约氏疟原虫的子孢子。
优选的,麻醉方法为乙醚麻醉,浸洗方法包括体积百分数75%乙醇水溶液浸泡消毒、然后用pbs浸泡并洗涤,显微镜为解剖专用显微镜,用于解剖剥离唾液腺的工具为医用无菌一次性1ml注射器。
进一步优选的,麻醉时间为2~3分钟,浸洗的具体方法为:先利用乙醇水溶液浸泡1分钟,弃去液体,然后加入pbs浸泡3分钟,pbs重复洗涤3次后,将按蚊置于冰上待解剖。
优选的,解剖的具体方法为:
(1)分离按蚊头部和胸部;
(2)轻轻挤压按蚊胸部,使其缓慢释放出唾液腺;
(3)分离出完整唾液腺并转移至无菌载玻片上,滴加液体培养基以防唾液腺干燥并保持活力;
(4)用无菌盖玻片覆盖无菌载玻片上的材料,通过挤压无菌盖玻片以破碎唾液腺使其释放出疟原虫子孢子,收集即可。
进一步优选的,步骤(1)的具体方法为:双手同时持握无菌注射器,用其中一只注射器针头固定按蚊胸部,然后用另一注射器针头刀锋面切去按蚊头部,使其从胸部上脱离下来,注意此过程动作尽量轻柔,不能破坏按蚊胸部,且切去过程要迅速果断,不能牵连出按蚊胸腹部脏器。
进一步优选的,步骤(2)的具体方法为:用一注射器针头固定按蚊腹部,另一注射器针头与按蚊胸部呈约45度角,轻轻挤压按蚊胸部,使其缓慢释放出唾液腺,注意挤压时力道不宜过重,否则将破坏按蚊胸部而无法获得唾液腺。
进一步优选的,步骤(3)的具体方法为:释放出的唾液腺常粘附有其他组织,用注射器针头小心分离出完整唾液腺,注意此时不能刺破唾液腺,否则子孢子将溢漏,小心挑取至一无菌洁净载玻片中央,同时滴上200μl冰预冷的1640培养基以防唾液腺干燥并保持活力。
进一步优选的,步骤(4)的具体方法为:用一无菌盖玻片,以45°角接触载玻片上液体边缘后迅速放下并盖上,然后用无菌眼科镊挤压盖玻片以破碎唾液腺使其释放出子孢子,小心吸取液体至一无菌ep管中,然后用1640培养基清洗载玻片3次,收集液体至ep管中并置于冰上保持活力。
优选的,所述无菌滤膜的孔径为75μm(200目),市售品,采用高压蒸汽灭菌或紫外照射消毒。
进一步优选的,所述无菌滤膜为尼龙微孔滤膜。
优选的,纯化处理的具体方法如下:
(a)准备12张无菌滤膜;
(b)向收集子孢子的ep管中加入500μl1640培养基,用1ml移液枪反复吹打30次,再次充分破裂唾液腺,释放出更多的子孢子;
(c)准备7个洁净1.5mlep管,置于冰上预冷5分钟;先在其中一个ep管管口处放置一张滤膜,双手紧握两侧将其绷紧,移液器小心吸取含子孢子液体使其通过滤膜,结束后再重复该步骤2次;然后在另一洁净ep管口重叠放置两张200目滤膜,方法同上过滤3次;最后在另一洁净ep管口重叠放置三张200目滤膜,方法同上过滤1次即可。
进一步优选的,步骤(c)全程需在冰上操作,以保持子孢子活力。
本发明的有益效果在于:
本发明先收集感染疟疾的按蚊,经麻醉消毒后,用精细的解剖分离方法取代传统的匀浆处理方法,以获得唾液腺子孢子,然后利用无菌滤膜替代传统的纤维素柱进行纯化处理,即得纯化的疟原虫子孢子。操作简便可逆,与传统方法相比,具有分离时间短、子孢子得率高、活力高等优点。具体分析如下:
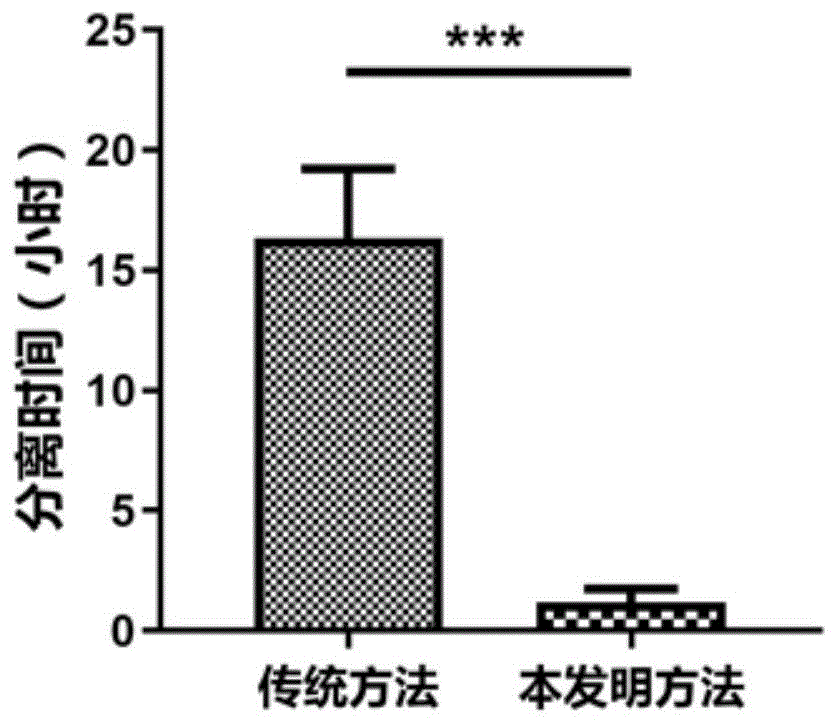
1、时间短:传统的纤维素柱分离方法,从准备分离柱(纤维素de52需预先溶胀,通常需要浸泡过夜)到分离结束,至少需要13小时,如果分离柱配置不理想,子孢子过柱时间还将大大增加,步骤繁琐费时费力,本发明方法无需特殊材料,整个分离过程可在1小时左右完成,极大缩短了实验时间,提升了效率。
2、得率高:传统的纤维素柱分离方法,子孢子得率较低且不稳定(14%~50%),步骤多致使干扰实验因素较多,子孢子在分离过程中损失很多,如果实验需求量大将无法满足,而本发明方法子孢子得率稳定在80%以上,一次分离可获得大量纯化子孢子。
3、活力高:传统的纤维素柱分离方法获得的子孢子,由于分离时间过长,加入到肝细胞中后,与本发明方法获得的子孢子相比,入侵肝细胞的能力显著下降,说明其活力受到严重影响,而本发明方法由于时间短,对子孢子活力影响较小,入侵肝细胞的能力没有受到影响。
4、操作可逆:传统的纤维素柱分离方法,步骤繁琐,如果子孢子加入到配制错误的纤维素中,将导致无法获得子孢子,操作不可逆。而本发明方法操作简便可逆,即便尼龙膜放置错误也不会导致子孢子无法挽回。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
图1为两种方法子孢子分离时间对比图。
图2a为两种方法子孢子得率对比图;图2b为两种方法子孢子得率光镜对比图。
图3为两种方法子孢子活力对比图。
图4为两种方法子孢子纯度对比图。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。
本发明涉及的pbs,其ph=7.4。
本发明以分离约氏疟原虫by265-gfp虫株的子孢子(带有gfp绿色荧光)为例说明本发明的方法,需要指出的是,本发明并不局限于这一种子孢子。
实施例:
(1)疟原虫子孢子的分离;
第一步:收集感染性按蚊(斯氏按蚊(anophelesstephensi),为中国人民解放军陆军军医大学基础医学院病原生物学教研室长期繁殖、饲养的hor株)约100只,快速短时麻醉2-3分钟后,转移至50mlep管中;
第二步:向ep管内加入体积百分数75%消毒酒精30ml,浸泡感染性按蚊1分钟,弃去液体,加入pbs浸泡3分钟,重复洗涤3次;
第三步:准备一洁净载玻片,在其中央滴加约200μl1640培养基,将此载玻片置于冰上备用;
第四步:解剖镜下显微解剖感染性按蚊,分离过程全程需在解剖显微镜下进行。第一步,分离按蚊头部和胸部,方法为:双手同时持握无菌注射器,用其中一只注射器针头固定按蚊胸部,然后用另一注射器针头刀锋面切去按蚊头部,使其从胸部上脱离下来,注意此过程动作尽量轻柔,不能破坏按蚊胸部,且切去过程要迅速果断,不能牵连出按蚊胸腹部脏器;第二步,用一注射器针头固定按蚊腹部,另一注射器针头与按蚊胸部呈约45度角,轻轻挤压按蚊胸部,使其缓慢释放出唾液腺,注意挤压时力道不宜过重,否则将破坏按蚊胸部而无法获得唾液腺;第三步,释放出的唾液腺常粘附有其他组织,用注射器针头小心分离出完整唾液腺,注意此时不能刺破唾液腺,否则子孢子将溢漏,小心挑取至一无菌洁净载玻片中央,同时滴上200μl冰预冷的1640培养基以防唾液腺干燥并保持活力。第四步,全部解剖完成后,用一无菌盖玻片,以45度角接触载玻片上液体边缘后迅速放下并盖上,然后用无菌眼科镊挤压盖玻片以破碎唾液腺使其释放出子孢子,小心吸取液体至一无菌ep管中,然后用1640培养基清洗载玻片3次,收集液体至ep管中并置于冰上保持活力。
(2)疟原虫子孢子的纯化;
第一步:准备12张无菌200目(75μm)滤膜;
第二步:向上步中收集子孢子的ep管中加入适量1640培养基,用1ml移液枪反复吹打30次,再次充分破裂唾液腺,释放出更多的子孢子;
第三步:准备7个洁净1.5mlep管,在其中一个管口处放置一张200目滤膜,双手紧握两侧将其绷紧,移液器小心吸取含子孢子液体使其通过尼龙膜,重复该步骤2次。然后在另一洁净ep管口重叠放置两张200目滤膜,方法同上过滤3次;最后在另一洁净ep管口重叠放置三张200目滤膜,方法同上过滤1次,完毕后将ep管置于冰上等待计数。
(3)疟原虫子孢子的计数;
第一步:将步骤(2)获得的子孢子轻柔颠倒混匀,吸取10μl原液稀释100倍后,加入至细胞计数板;
第二步:将细胞计数板置于显微镜下计数,方法为,统计计数板四角的四个大格子里面的子孢子的总数,除以4后乘以稀释倍数后再乘以104即得原液中子孢子密度,最后乘以原液体积可得子孢子总量。
(4)疟原虫子孢子活力鉴定;
第一步:复苏液氮冻存的肝细胞hepa1-6,pbs清洗3遍后种于细胞培养瓶中,加入含10%(体积比)胎牛血清的1640培养基5ml,第二天更换培养基,待细胞融合度达90%左右时进行传代分瓶培养;
第二步:将步骤(2)获得的子孢子与肝细胞hepa1-6以数量比1:2的比例进行混合培养,37℃co2培养箱内放置42小时;
第三步:收集培养细胞,定量pcr检测入侵肝细胞的子孢子,此法为检测子孢子活力的金标准,方法为,用trizol提取细胞总rna;dnasei处理后,采用primescripttmrtreagentkitwithgdnaeraser(takara)将rna逆转录成cdna作为模板,构建taqmanrt-pcr反应体系,20μl体系中,cdna1μl,上下游引物各1μl(上游序列:5′-ggttttataattggaatgatgggaat-3′;下游序列:5′-acgctattggagctggaattacc-3′),探针0.5μl(fam-aaccttcccaaaaat–mg),premixextaq(2×)10μl,h2o6.5μl。扩增条件:95℃2min;95℃15s、60℃20s,40个循环;根据18srrna/gapdh比值确定各样本18srna相对含量。
(5)疟原虫子孢子纯度鉴定
第一步:复苏液氮冻存的肝细胞hepa1-6(购于美国典型培养物保藏中心atcc,货号atcccrl-1830),pbs清洗3次后种于细胞培养瓶中,加入含10%(体积比)胎牛血清的1640培养基5ml,第二天更换培养基,待细胞融合度达90%左右时进行传代分瓶培养;
第二步:将步骤(2)获得的子孢子与肝细胞hepa1-6以数量比1:2的比例混合,置于37℃co2培养箱内,通过观察细胞培养过程中细菌出现的时间来衡量子孢子的纯度。
将本发明与传统方法(纤维素柱de52)进行子孢子分离时间比较(表1、图1)、子孢子得率对比(图2a、图2b)、子孢子活力对比(图3)、子孢子纯度对比(图4)。从结果可以看出,通过本发明方法获得的子孢子,其纯度与传统方法相当,但本发明方法大大缩短了分离时间,在提高子孢子得率的同时还能保持子孢子活力,且操作步骤可逆。
表1.子孢子分离时间比较
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!