一株cspA基因加倍的须糖多孢菌工程菌株及其应用的制作方法
本发明涉及一株须糖多孢菌基因过表达工程菌株及其应用,尤其是涉及一株cspa基因加倍的须糖多孢菌工程菌株及其应用。
背景技术:
农业是国民经济的基础,而农作物虫害是我国现代农业可持续发展的主要障碍。使用化学农药增强了人类控制病虫危害的能力,为挽回农作物产量损失作出了重大的贡献。但是,长期依赖和大量使用化学农药,已经产生了严重的污染环境、破坏生态平衡和影响食品安全等一系列问题。而生物农药因其选择性强、不伤害天敌、无污染和不易产生抗性等优点,以及人们的生态环境和食品安全意识的提高,使其在当前的农药市场中越来越受到关注和青睐。
丁烯基多杀菌素(butenyl-spinosyn),是由须糖多孢菌(saccharopolysporapogona)经好氧发酵产生的具有触杀及摄食毒素的新型微生物源杀虫剂,具有比多杀菌素更为广泛的杀虫谱,对水果类害虫的控制更为明显,是当今世界上最具发展前景的新型生物农药之一。虽然,丁烯基多杀菌素杀虫效果显著,合成途径也早已得到清晰的阐述,但野生型菌株丁烯基多杀菌素产量低且不稳定,发酵周期长等,严重制约着丁烯基多杀菌素的生产和应用。因此,如何提高丁烯基多杀菌素产量以及缩短发酵周期成为科学研究的热点问题。2018年,li等人在《applmicrobiolbiotechnol》发表的“impactonstraingrowthandbutenyl-spinosynbiosynthesisbyoverexpressionofpolynucleotidephosphorylasegeneinsaccharopolysporapogona.(2018,102(18):8011-8021)”中公开了首次通过基因工程技术完成对须糖多孢菌聚核苷酸磷酸激酶基因(pnp)研究,并获得高产突变株,使得利用基因工程技术对须糖多孢菌基因组进行定向遗传修饰成为提高丁烯基多杀菌素产量的有效方法。但尚欠理想。
冷激蛋白csps(coldshockproteins)是一类普遍存在于微生物中的、分子量为7kda左右的蛋白质,在低温条件下能瞬间诱导表达。一般来说,冷激蛋白的生物学功能是作为rna的分子伴侣结合单链核苷酸,阻止后者复杂的二级结构形成,从而使得翻译能够顺利进行,起到调节表达的作用。目前,在大肠杆菌中已发现了9类冷激蛋白(cspa-cspi),其中以cspa在大肠杆菌中研究最早、作用机制最为清楚。除了消除mrna的二级结构、促进蛋白质翻译外,cspa还存在另一种增强自身翻译的机制,这种机制使得cspa的mrna在缺少冷诱导的特异的核糖体因子(csda和rbfa)的情况下也能完成翻译,从而更好的发挥自身功能。前期研究,qiyang等在《microbialcellfactories》中发表的“differentialproteomicprofilingrevealsregulatoryproteinsandnovellinksbetweenprimarymetabolismandspinosadproductioninsaccharopolysporaspinosa”文中提到多杀菌素生物合成主要存在于生长稳定期,而此阶段由于胞内外环境的改变已开始对细胞的生长产生不利影响,其生物合成与丁烯基多杀菌素生物合成非常相似。因此,在须糖多孢菌中对cspa进行过表达,有可能增强菌株在生长稳定期或衰退期对胞内外不利环境的抵抗,使得某些代谢活动得以继续进行,如菌株生长和丁烯基多杀菌素生物合成。
目前,在糖多孢菌中有关cspa的研究还未见有报道,而且采用结合转移的方法将外源基因转入须糖多孢菌中存在很大的困难。
技术实现要素:
本发明所要解决的技术问题是,克服现有技术存在的上述缺陷,提供一株须糖多孢菌cspa基因加倍的工程菌株,旨在进一步促进丁烯基多杀菌素的生物合成,提高丁烯基多杀菌素的产量,降低丁烯基多杀菌素的生产成本。
本发明解决其技术问题所采用的技术方案如下:一株cspa基因加倍的须糖多孢菌工程菌株,将冷激蛋白基因cspa整合至须糖多孢菌的染色体组中产生。
本发明之须糖多孢菌冷激蛋白合成基因加倍工程菌株,即须糖多孢菌s.pogona::cspa,于2019年3月20日保藏于中国典型培养物保藏中心(简称cctcc,地址:中国武汉武汉大学),菌种保藏号为cctccno:m2019181。
进一步,所述的冷激蛋白基因cspa,克隆自须糖多孢菌,其序列如序列表seqid№1所示:
atggcacagggaaccgtgaagtggttcaacgcggaaaagggcttcggctttatcgccccc60
gacgacggtggcccggacgtattcgtgcacttctcggccatcgaggcctcgggcttccgt120
gagctgtccgaggaccagcacgtgacctacgaggtcacccagggccctaagggcccgcag180
gccgccagcgtgcgcgtctga201
本发明之须糖多孢菌cspa加倍的工程菌株,构建方法如下:
(1)提取须糖多孢菌nrrl30141基因组,扩增cspa基因;
(2)将cspa基因与质粒pkccas9进行酶连,获得重组质粒pkccas9-cspa;
(3)原生质体转化构建工程菌株s.pogona::cspa及其pcr鉴定;
(4)对获得的工程菌株进行生理特性分析。
本发明在构建好重组质粒pkccas9-cspa的基础上,利用原生质体转化的方法将外源重组质粒转入须糖多孢菌中,获得了cspa基因加倍的工程菌株s.pogona::cspa。pcr鉴定结果表明,外源质粒已成功导入须糖多孢菌中;实时荧光定量pcr结果显示,工程菌s.pogona::cspa中cspa的转录水平比原始菌株提高了约4.5倍;hplc检测结果表明,工程菌s.pogona::cspa中丁烯基多杀菌素产量比原始菌株提高了4倍;生长曲线测定结果显示,工程菌s.pogona::cspa在培养6天后其细胞密度开始大于原始菌株,培养至第10天后,工程菌s.pogona::cspa菌体密度是原始菌株1.6倍;扫描电镜观察结果发现,工程菌s.pogona::cspa在合成发酵培养基培养至第4天后菌丝体形态逐渐由分枝丝状变为短杆状且少分支。
表1本发明所用菌株、质粒和引物
实践证明,本发明cspa基因加倍的须糖多孢菌工程菌株s.pogona::cspa应用于丁烯基多杀菌素的生物合成,与利用原始菌株s.pogona进行丁烯基多杀菌素的生物合成相比,丁烯基多杀菌素的产量提高4倍,可以大幅降低生产成本。
微生物保藏情况说明
本发明之须糖多孢菌cspa加倍工程菌株,即s.pogona::cspa,saccharopolysporapogona::cspa,于2019年3月20日保藏于国典型培养物保藏中心(简称cctcc,地址:中国武汉武汉大学),菌种保藏号为cctccno:m2019181。
附图说明
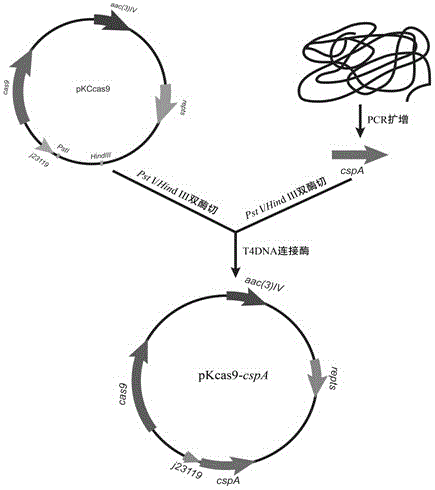
图1为重组质粒pkccas9-cspa的构建流程图;
图2为本发明工程菌株s.pogona::cspapcr鉴定图;
图3为本发明cspa基因的qrt-pcr分析;
图4为本发明工程菌株s.pogona::cspa生长曲线测定及葡萄糖消耗分析;
图5为本发明工程菌株s.pogona::cspa菌丝形态观察;
图6为本发明工程菌株s.pogona::cspa丁烯基多杀菌素产量分析及质谱鉴定。
具体实施方式
下面结合实施例和附图对本发明作进一步详细说明。
实施例
本实施例之cspa基因加倍的须糖多孢菌工程菌株,通过将冷激蛋白基因cspa整合至须糖多孢菌的染色体组中产生。
本发明之须糖多孢菌冷激蛋白合成基因加倍工程菌株,即须糖多孢菌s.pogona::cspa,于2019年3月20日在中国典型培养物保藏中心(简称cctcc,地址:中国武汉武汉大学)保藏,菌种保藏号为cctccno:m2019181。
进一步,所述的冷激蛋白基因cspa,克隆自须糖多孢菌,其序列如下:
atggcacagggaaccgtgaagtggttcaacgcggaaaagggcttcggctttatcgccccc60
gacgacggtggcccggacgtattcgtgcacttctcggccatcgaggcctcgggcttccgt120
gagctgtccgaggaccagcacgtgacctacgaggtcacccagggccctaagggcccgcag180
gccgccagcgtgcgcgtctga201
(一)具体培养基配方和培养条件
(1)s.pogona种子活化培养基csm(completesyntheticmedium):trypticsoybroth4.5g/l,glucose0.9g/l,yeastextract0.3g/l,mgso4.7h2o0.22g/l。接种单克隆或2%菌种保藏液加入装有20mlcsm的150ml摇瓶中,30°c,280r/min培养48h;
(2)s.pogona合成发酵培养基sfm(syntheticfermentationmedium):glucose20.0g/l,yeastextract4.0g/l,tryptone4.0g/l,kno31.0g/l,k2hpo4•3h2o0.5g/l,mgso4•7h2o0.5g/l,feso4•7h2o0.01g/l。接种2%的菌种活化液加入装有50mlsfm的300ml摇瓶中,30°c,280r/min培养12d。
(3)原生质体转化采用r5培养基:蔗糖103g/l,葡萄糖10g/l,酪蛋白氨基酸0.1g/l,yeastextract5g/l,k2so40.25g/l,mgcl2•6h2o10.12g/l,tes5.73g/l,微量元素溶液2ml(zncl240mg/l,fecl3•6h2o200mg/l,cucl2•2h2o10mg/l,mncl2•4h2o10mg/l,na2b4o7•10h2o10mg/l,(nh4)6mo7o4•4h2o10mg/l),琼脂粉15-20g/l,使用之前在培养基中分别加入已过滤除菌的kh2po3(0.5%)2.5ml/l,l-脯氨酸(20%)3.75ml/l和cacl2•2h2o(5m)1ml/l。
(4)e.colidh5α液体培养基lb(luria-bertani):tryptone1g/l,yeastextract0.5g/l和nacl1g/l。在上述液体中加入15-20g/l的琼脂粉可配制成lb固体培养基。
(二)重组质粒pkccas9-cspa构建
以s.pogona基因组为模板,设计一对引物fcspa/rcspa扩增冷激蛋白cspa完整开放阅读框,引物序列见表1。同时引物对fcspa/rcspa5’分别带有psti和hindiii酶切位点,用于与质粒pkccas9进行连接。cspa扩增的pcr反应体系如下:
表2cspa扩增的pcr反应体系
pcr反应程序设置为:95℃预变性,随后按95℃变性30s、56℃退火30s和72℃延伸90s循环30次,最后再72℃维持10min,20℃终止反应。
将上述pcr产物进行回收、纯化,并利用psti和hindiii对其进行双酶切,同时,对质粒pkccas9也进行相同的双酶切用于构建重组质粒。回收、纯化后产物在t4dna连接酶的作用下进行cspa与线性化质粒pkccas9进行酶连。将连接产物热转入e.colidh5α感受态细胞中,并在lb抗性平板(阿泊拉霉素)上进行转化子筛选和验证,获得重组质粒pkccas9-cspa(参照图1)。
(三)重组菌株s.pogona::cspa的构建
使用原生质体转化的方式将外源重组质粒pkccas9-cspa转入s.pogona原生质体中,转化步骤为:从-80℃冰箱中取出制备好的s.pogona原生质体置于冰上融化;所述原生质体制备流程可参考罗玉双,丁学知,夏立秋,王海龙,黄璠,唐滢在《生物工程学报》上发表的文章“多杀菌素生产菌原生质体的制备条件及其再生菌株生理特性(2009年第25卷第3期360-367页)”;在含有原生质体的ep管中分别加入适量线性片段(50-200ng)以及促融剂peg2000(40%),混匀,在冰上静置1h;将混合物涂布于不含抗生素的r5平板上,30℃恒温培养箱倒置培养16-20h;进行阿泊拉霉素(50μg/ml)覆盖,继续放置于30℃培养箱倒置培养3-7天,直至白色转化子出现;从r5平板上挑取6-8个白色转化子划线于含阿泊拉霉素(50μg/ml)的tsb平板上进行复筛,30℃恒温培养箱倒置培养3-5天,直至在平板划线区域形成菌苔,重复2-3次。
在tsb平板上挑取部分菌苔于tsb液体培养基中,30℃摇床培养48h,收集1ml菌液并提取基因组作为模板,使用引物对fapr/rapr进行阿泊拉霉素抗性基因扩增,并以野生型s.pogona基因组为阴性对照,质粒pkccas9-cspa为阳性对照。pcr鉴定正确的转化子(重组菌株),命名为s.pogona::cspa。结果显示(参照图2),重组菌株s.pogona::cspa在以引物对fapr/rapr进行pcr扩增时有约为1.5kb的条带出现,而野生型s.pogona无对应条带出现,说明携带有apr基因的质粒成功导入须糖多孢菌中,最终完成重组菌株s.pogona::cspa的构建。
(四)实时荧光定量pcr检测
为了在转录水平上验证工程菌株s.pogona::cspa中冷激蛋白cspa基因表达量是否提高,采用qrt-pcr方法对该菌株进行了检测分析。首先,分别将在csm活化培养基中活化好的工程菌株s.pogona::cspa和原始菌株等量转接至合成发酵培养基中,30℃,280r/min培养4天,分别取1ml菌液用于总rna提取,rna提取方法采用trizol试剂盒法(sangon),并严格参照说明书步骤进行。为排除基因组dna对实验结果造成的影响,
以16srrna为内参,使用引物对fcspart/rcspart对工程菌株s.pogona::cspa与原始菌株中的csp基因的mrna表达水平进行比较分析,设定原始菌株cspa基因mrna与其内参mrna的比值为1,每个样品设4个重复。结果显示(参照图3),与原始菌株相比,工程菌株中cspa基因的mrna水平明显上调,其转录水平提高约4.5倍,该结果从测面说明csp基因加倍的工程菌株构建成功。
(五)cspa基因加倍对s.pogona生长发育的影响
(1)对菌株生长曲线的影响
分别将活化好的工程菌株s.pogona::cspa和原始菌株等量转入合成发酵培养基中,每12h取样进行菌体od600值测定(测定值在0.2~08之间,以保证测定结果的准确性,否则对样品进行稀释),取样周期为12d。实验结果如图4所示,工程菌株s.pogona::cspa与原始菌株相比,生长曲线有显著变化,表现为对数期延长,且培养至第6天后工程菌株菌体od600值开始高于原始菌株,培养至第10天时,菌体od600值是原始菌株的1.6倍。
(2)对合成发酵培养基中葡萄糖消耗的影响
分别将活化好的工程菌株s.pogona::cspa和原始菌株等量转入合成发酵培养基中,每12h取样进行发酵液上清中葡萄糖含量测定。结果显示(参照图4),工程菌株s.pogona::cspa在合成发酵培养基中葡萄糖消耗与原始菌株有着明显差异,后者培养至第6天时培养基中葡萄糖消耗量达99.9%以上,但是工程菌株s.pogona::cspa仅消耗培养基中葡萄糖不到40%,说明冷激蛋白cspa基因加倍后极大影响菌株对发酵培养基中葡萄糖的利用。
(3)对菌丝体形态的影响
分别将活化好的工程菌株s.pogona::cspa和原始菌株等量转入合成发酵培养基中,并取第2天,第4天,第6天和第8天的菌液进行扫描电镜观察。样品经2.5%的戊二醛固定以及不同浓度梯度乙醇(30%、50%、70%、90%、95%和100%)脱水处理后,可使用冷场发射扫描电子显微镜su8010进行工程菌株s.pogona::cspa与原始菌株菌丝体形态观察。结果显示(参照图5),工程菌株s.pogona::cspa培养至第4天时,菌丝体形态已由分枝丝状转变为短杆状且少分支,与原始菌株相比,菌丝体形态有着较为明显的变化。
(4)对丁烯基多杀菌素生物合成的影响
分别将活化好的工程菌株s.pogona::cspa和原始菌株等量转入合成发酵培养基中,取培养至第10天的发酵液进行丁烯基多杀菌素产量检测。具体操作步骤为,取500µl培养至第10天的发酵液于1.5ml的ep管中,并加入等体积的丙酮进行混匀,30℃浸提48h;12000r/min离心10min,取上清液(含有丁烯基多杀菌素);经0.22µm微孔滤膜过滤后即可使用agilent1290超高效液相色谱系统测定上清液中丁烯基多杀菌素含量。hplc1290仪器参数设置为:色谱柱型号(zorbaxsb-c18),柱温:室温,流动相:a相为ddh2o,b相为甲醇与乙腈等比例混合液,流速:1.0ml/min,上样体积:20µl,检测波长:250nm。通过仪器自带的分析软件计算丁烯基多杀菌素峰面积,并使用lc-ms/ms对该峰进行质谱鉴定,以确定其是否为丁烯基多杀菌素。
hplc1290检测结果显示(参照图6),在5.4min左右存在峰面积明显变化的色谱峰且最大吸收波长为250nm,质谱鉴定结果进一步证实该色谱峰为丁烯基多杀菌素。经软件分析后,工程菌株s.pogona::cspa在5.4min的平均峰面积为3882.57±116.88,而原始菌株在此外的平均峰面积为764.73±52.26,最终工程菌株s.pogona::cspa丁烯基多杀菌素产量相比原始菌株提高了4倍。
序列表
<110>湖南师范大学
<120>一株cspa基因加倍的须糖多孢菌工程菌株
<160>1
<170>siposequencelisting1.0
<210>1
<211>201
<212>dna
<213>须糖多孢菌工程菌(saccharopolysporapogona)
<400>1
atggcacagggaaccgtgaagtggttcaacgcggaaaagggcttcggctttatcgccccc60
gacgacggtggcccggacgtattcgtgcacttctcggccatcgaggcctcgggcttccgt120
gagctgtccgaggaccagcacgtgacctacgaggtcacccagggccctaagggcccgcag180
gccgccagcgtgcgcgtctga201
序列表
<110>湖南师范大学
<120>一株cspa基因加倍的须糖多孢菌工程菌株
<160>1
<170>siposequencelisting1.0
<210>1
<211>201
<212>dna
<213>须糖多孢菌工程菌(saccharopolysporapogona)
<400>1
atggcacagggaaccgtgaagtggttcaacgcggaaaagggcttcggctttatcgccccc60
gacgacggtggcccggacgtattcgtgcacttctcggccatcgaggcctcgggcttccgt120
gagctgtccgaggaccagcacgtgacctacgaggtcacccagggccctaagggcccgcag180
gccgccagcgtgcgcgtctga201
- 还没有人留言评论。精彩留言会获得点赞!