用于鉴定病毒污染物的系统和方法与流程
本发明整体涉及对细胞培养物中存在的核酸,尤其是病毒核酸序列进行测序的方法。
背景技术:
下一代测序(ngs)平台和其他高通量测序(hts)平台具有重新定义生物制药行业中的病毒安全性测试的潜力。尽管基于聚合酶链反应(pcr)的方法灵敏、便宜且快速,但基于ngs的方法允许对特定临床或生产样品中存在的所有病毒基因组进行广泛测试。一直以来,借助此技术作为生产过程中对潜在污染物进行系统性监视的工具受到外来物质的宏基因组检测所需的工作流程的阻碍。具体而言,采用ngs技术进行常规病毒筛选措施需要优化样品制备策略、流线化和自动化的文库制备以及时间敏感性的数据分析工作流程。
病毒基因组复杂而多样,其中rna病毒使从头hts工作流程中的适足文库制备尤其复杂。与可相对容易检测的微生物和支原体污染相比,病毒污染带来了严重威胁,因为某些病毒难以检测,还有受感染的细胞培养物缺乏有效的处理方法。
因此,需要用于检测和鉴定细胞培养物中的病毒污染的新方法。
技术实现要素:
一个实施方案提供了一种流线化的样品制备方法,即vera(通过减少干扰物(artifact)富集病毒),以使总基因组材料向病毒基因组倾斜。可在样品采集后8小时内完成这种宿主基因组材料的减少。使用快速文库制备方案(约15分钟)和实时纳米孔测序,可以在样品采集后不到一个工作日内鉴定出潜在的病毒污染。
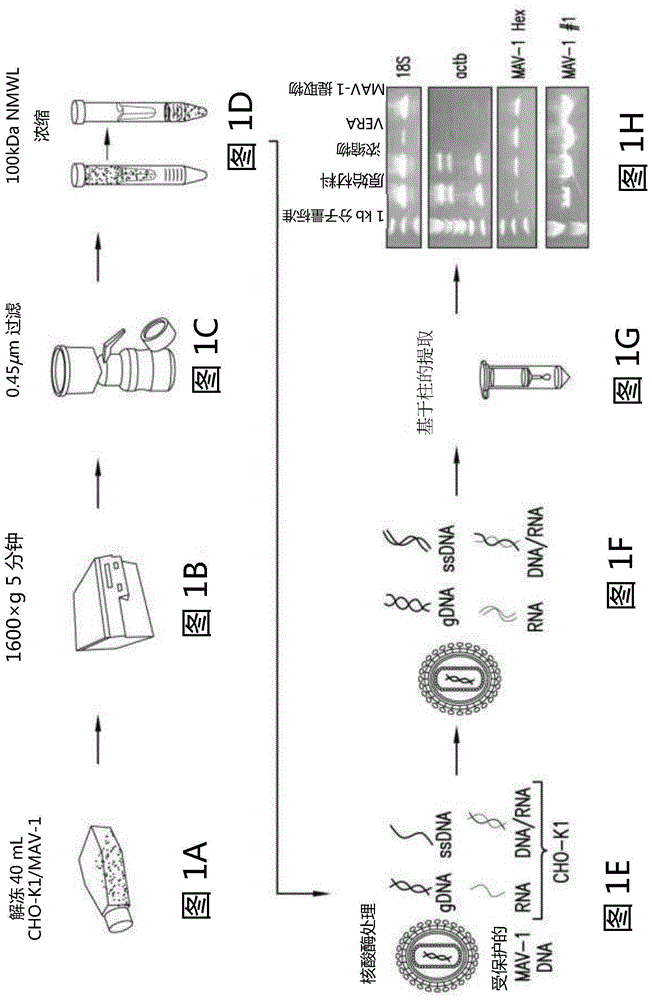
图1是用于检测和鉴定细胞培养物样品中的病毒核酸的示例性方法的示意图。用于鉴定细胞培养物样品中的病毒核酸的方法包括裂解细胞培养物的样品中的真核细胞。可以使用机械裂解技术,诸如超声处理或均化来进行细胞裂解。裂解细胞的优选方法是常规的冻融技术。细胞培养物中的细胞一经裂解,即从样品中移除细胞碎片。可以使用常规技术移除细胞碎片,包括但不限于离心、大小过滤或它们的组合。样品中的大多数细胞碎片一经移除,即浓缩样品以产生渗余物。然后用核酸酶处理渗余物以消化真核生物核酸。因为病毒颗粒保护病毒核酸,所以核酸酶处理不会消化病毒核酸。在一个实施方案中,用
在所公开的方法的另一个实施方案中,病毒读段为从测序获得的总读段的至少51%,或为从测序获得的总读段的50%至99%,或为从测序获得的总读段的至少80%、85%或90%。
一般而言,细胞培养物中的细胞是真核细胞,例如中国仓鼠卵巢细胞。在一些实施方案中,细胞分泌蛋白质药物产物。蛋白质药物产物可以是抗体或其抗原结合片段、融合蛋白或重组蛋白。
在某些实施方案中,病毒是rna病毒、dna病毒或它们的组合。病毒可以是单链的或双链的。可以检测的示例性病毒包括但不限于小鼠细小病毒(minutevirusofmice,mvm)、msv1、p12/emc、小鼠脑脊髓炎病毒(mouseencephalomyelitisvirus)、小鼠腺病毒(mouseadenovirus)、乳酸脱氢酶病毒(ldv)、多瘤病毒、小鼠肝炎病毒(mhv)、仙台病毒、淋巴细胞性脉络丛脑膜炎病毒(lcm)、呼肠孤病毒3型、克氏大鼠病毒(kilhamratvirus)和toolan氏h-1病毒(toolan’sh-1virus)。
附图说明
图1a-1h是用于检测细胞培养物中的病毒核酸的方法的一个实施方案的示意图。
图2是单独样品中,使用随机引物pcr的vera和使用靶向引物pcr的vera的平均病毒读段数目的柱状图。
图3a是示出了从渗余物中获取时95%的读段是真核生物(对应于宿主)而2%是病毒的示意图。图3b是示出了用核酸酶处理样品时97%的读段是真核生物而2%是病毒的示意图。
图4是溴化乙锭凝胶,其显示利用vera大部分真核dna被移除。
图5a是示出了用
具体实施方式
i.定义
在描述当前要求权利保护的本发明的上下文中(特别是在权利要求的上下文中)使用术语“一个”、“一种”、“该(所述)”和类似的指代物应被解释为涵盖单数和复数,除非本文另有说明或明确与上下文相矛盾。
除非本文另有说明,否则本文中对数值范围的描述仅旨在用作单独提及落入该范围内的每个单独值的简写方法,并且将每个单独的值并入本说明书中,就如同其在本文中单独引用一样。
术语“约”的使用旨在描述高于或低于所述值大约+/-10%的范围内的值;在其它实施方案中,值的数值范围可以是高于或低于所述值大约+/-5%的范围;在其它实施方案中,值的数值范围可以是高于或低于所述值大约+/-2%的范围;在其它实施方案中,值的数值范围可以是高于或低于所述值大约+/-1%的范围。前面的范围旨在通过上下文解释清楚,并且不暗示进一步的限制。除非本文另有说明或上下文明显矛盾,否则本文所述的所有方法均可以任何合适的顺序进行。除非另有说明,否则本文提供的任何和所有实例或示例性语言(例如,“诸如”)的使用仅旨在更好地说明本发明,而不是对本发明的范围进行限制。说明书中的任何语言都不应被解释为表明任何未要求权利保护的要素对于本发明的实施是必不可少的。
关于测序的术语“读段”是指一组核苷酸的核酸序列,其在测序过程结束后获得,并且最终是完整核酸序列的一段的序列。“读段”是源自原始信号的一串核苷酸的碱基读出值。
“蛋白质”是指包含两个或更多个通过肽键彼此结合的氨基酸残基的分子。蛋白质包括多肽和肽,并且可还包括修饰,诸如糖基化、脂质附接、硫酸化、谷氨酸残基的γ羧化、烷基化、羟基化和adp-核糖基化。蛋白质可能具有科学或商业意义,包括基于蛋白质的药物,并且蛋白质尤其包括酶、配体、受体、抗体和嵌合蛋白或融合蛋白。蛋白质是使用众所周知的细胞培养方法通过各种类型的重组细胞产生的,并且通常通过基因工程技术(例如,诸如编码嵌合蛋白的序列,或者密码子优化的序列、无内含子序列等)引入细胞中,其中其可以作为附加体存在或整合到细胞基因组中。
“抗体”是指由通过二硫键相互连接的四条多肽链(两条重(h)链和两条轻(l)链)组成的免疫球蛋白分子。每条重链具有重链可变区(hcvr或vh)和重链恒定区。重链恒定区含有三个结构域即ch1、ch2和ch3。每条轻链具有轻链可变区和轻链恒定区。轻链恒定区由一个结构域(cl)组成。vh区和vl区可以进一步细分为高变区,称为互补决定区(cdr),并散布有更保守的称为框架区(fr)的区域。每个vh和vl由三个cdr和四个fr构成,从氨基末端到羧基末端按照以下顺序排列:fr1、cdr1、fr2、cdr2、fr3、cdr3和fr4。术语“抗体”包括指任何同种型或亚型的糖基化和非糖基化的免疫球蛋白。术语“抗体”包括通过重组手段制备、表达、产生或分离的抗体分子,诸如从经转染以表达抗体的宿主细胞中分离的抗体。术语抗体还包括双特异性抗体,该双特异性抗体包括可以与不止一个不同表位结合的异四聚体免疫球蛋白。双特异性抗体在美国专利申请公开号2010/0331527中进行了一般性描述,将其以引用方式并入本申请。
“细胞培养”是指细胞在诸如烧瓶或生物反应器之类的容器中繁殖或增殖,并且包括但不限于补料分批培养、连续培养、灌流培养等。
omnicleavetm是指omnicleavetm核酸内切酶,其为一种来自重组大肠杆菌菌株的高度纯化的酶,可将单链和双链dna和rna降解为二核苷酸、三核苷酸和四核苷酸。omnicleave核酸内切酶(omnicleaveendonuclease)具有与
riboshreddertm是指专有的非哺乳动物rna酶共混物,其可在dna和蛋白质纯化程序中完全降解不需要的rna。riboshreddertm可从epicentre公司商购获得。
如本文所用,“扩增”是指产生dna或rna片段的多个拷贝。扩增通常由聚合酶链反应引起。
如本文所用,“pcr”是指聚合酶链反应,其为用于扩增dna或rna片段的单个拷贝从而产生特定dna或rna序列的成千至上百万个拷贝的一种分子生物学技术。pcr通常用于扩增要克隆的dna或rna片段的拷贝数,或用于其他分析程序。
术语“实时纳米孔测序”是指测序分析,而测序是由于核酸分子通过纳米孔而扰乱电流来进行。
ii.检测细胞培养物中的病毒的方法
对细胞培养物中存在的病毒进行鉴定和测序的代表性方法包括以下步骤:裂解正在培养的细胞,移除细胞碎片,浓缩样品以富集病毒核酸,酶消化存在于经富集样品中的从细胞释放的核酸,从经消化的样品提取病毒核酸,并对病毒核酸进行测序以鉴定病毒。
a.裂解细胞
处理细胞培养物样品以破坏或裂解正在培养的细胞。通常,细胞是真核细胞,诸如中国仓鼠卵巢细胞。下面提供了可用于细胞培养的其他细胞和细胞系的实例。
裂解细胞的技术是本领域众所周知的。在优选的实施方案中,使用冻融技术裂解细胞。例如,通常将细胞瓶冷冻过夜,然后在使用前解冻。
在一个实施方案中,使用机械装置裂解细胞,包括但不限于瓦氏高速捣碎器(waringblender)和polytron。旋转的刀片研磨并分散细胞和组织。
在另一个实施方案中,使细胞经受液体均化(liquidhomogenization),例如使用杜恩斯匀浆器(douncehomogenizer)、波-伊匀浆器(potter-elvehjemhomogenizer)或弗氏压碎器(frenchpress)。通过迫使细胞或组织悬浮液通过狭小的空间来对其进行剪切。
在另一个实施方案中,通过使用超声波仪进行超声处理来裂解细胞。高频声波可剪切细胞。
b.移除细胞碎片
裂解细胞会产生细胞碎片。可以使用常规技术诸如离心、大小过滤或它们的组合来移除细胞碎片。
1.离心
在一个实施方案中,利用低速离心移除细胞碎片。通常,通过将样品以1,600×g离心5分钟来澄清样品。然后移除上清液。
2.过滤
在一个实施方案中,通过过滤样品移除细胞碎片。例如,可以使用具有0.2μm至0.45μm直径的孔的过滤器过滤样品。合适的过滤器可商购获得。在某些实施方案中,首先将样品离心,然后过滤上清液以移除额外的细胞碎片,包括但不限于细胞器诸如细胞核。在另一个实施方案中,使用0.8μm的过滤器过滤样品。
然后浓缩所得的滤液。
c.浓缩样品
浓缩滤液,例如通过使用
d.核酸酶处理
然后用核酸酶处理浓缩的样品,以消化来自细胞培养物中的细胞的核酸。由于病毒衣壳的保护性质,感染病毒对此步骤的核酸酶处理免疫。
在一个实施方案中,用
在一个实施方案中,将两个病毒滤液体积独立地分布在具有100kda可通过的过滤器的amicon15微量浓缩器上。如有必要,可以使用磷酸盐缓冲盐水溶液来平衡管,在allegra6离心机上以最大速度将管离心15分钟。检查渗余物体积。如有必要,将管以最大速度再离心15分钟。每个微量浓缩器中的渗余物体积应大约为200μl。小心地从每个微量浓缩器移出渗余物,并将渗余物汇集在新管中。从每个样品移出50μl的总渗余物,并标为样品dp和样品dr。
将1×dna酶缓冲液添加至这两个独立的汇集渗余物中以使体积增加至4ml。如步骤4.4中所做的在amicon4中浓缩,但使体积降至50μl到200μl。
向每个经缓冲液交换的渗余物的体积中,添加2倍体积的omnicleave、2倍体积的benzonase、2倍体积的rna酶混合物(rnasecocktailenzymemix),并添加足量的10×dna酶缓冲液,使得最终为1×dna酶缓冲液。将管在恒温混匀仪中于37℃以1000转/分钟温育2小时。
可使用的其他核酸酶包括但不限于dna酶ⅰ、dna酶ⅱ、核酸酶s1、rna酶a、rna酶b、rna酶ⅰ、rna酶t1、rna酶t2、rna酶h、核酸外切酶ⅰ、核酸外切酶ⅱ、核酸外切酶ⅲ、核酸外切酶ⅳ、核酸外切酶ⅴ、λ核酸外切酶、核酸内切酶ⅰ、核酸内切酶ⅱ、核酸内切酶ⅲ、核酸内切酶ⅳ、核酸内切酶ⅴ、核酸内切酶vi、核酸内切酶vii、核酸内切酶viii和位点特异性核酸内切酶,包括但不限于aatii、acc、acci、acli、aatii、acc65i、acci、acli、afei、aflii、agei、apai、apali、apoi、asci、asei、asisi、avrii、bamhi、bcli、bglii、bmel580i、bmti、bsahi、bsiei、bsiwi、bspei、bsphi、bsrgi、bsshii、bstbi、bstzl7i、btgi、clai、drai、eaei、eagi、ecori、ecorv、fsei、fspi、haeii、hincii、hindiii、hpal、kasi、kpni、mfei、mlui、msci、mspali、mfei、mlui、msci、naei、nari、ncoi、ndei、ngomiv、nhei、noti、nrui、nsii、nspi、paci、pcii、pmei、pmli、psii、pspomi、psti、pvui、pvuii、saci、sacii、sali、sbfi、scai、sfci、sfoi、sgrai、smai、smli、snabi、spei、sphi、sspi、stui、swai、xbai、xhoi和xmai。
在一个实施方案中,将样品在37℃下于摇床(即恒温混匀仪)上用一种或多种核酸酶处理以消化2小时。2×核酸酶:渗余物是足够的(2×omnicleave、2×benzonase、2×rna酶混合物)。另外,添加10×dna酶缓冲液至终浓度为1×。因此,可以通过容易地放大或缩小酶与渗余物的比例来处理不同的样品量。
e.病毒核酸的提取
用核酸酶混合物消化后,从样品中提取病毒核酸。在一个实施方案中,在提取之前将0.5medta添加至管中至终浓度为3mmedta。可以使用来自赛默飞世尔公司(thermofisher)的purelinktm病毒rna/dna小试剂盒(purelinktmviralrna/dnaminikit)提取病毒核酸。
为了制备洗涤缓冲液(washbuffer),将60ml96-100%乙醇添加至15ml该试剂盒所包括的洗涤缓冲液(wii)。在洗涤缓冲液标签上划勾以表明已添加乙醇,并且处于室温。
每份样品(对于<500μl的样品)使用5.6μgcarrierrna来制备carrierrna。可以每份样品使用较少的carrierrna,但应验证每种样品类型和下游应用所需的carrierrna量。
制备carrierrna(5.6μg/样品):
1.将310μl无rna酶水(rnase-freewater)(包括在试剂盒中)添加至在随试剂盒一起的管中提供的310μg冻干carrierrna,以获得1μg/μlcarrierrna储液。
2.充分混合并将溶液等分成小份。将等分试样在20℃下存储。
避免反复冻融。
3.使用以下公式计算同时处理所需数量的样品所需的裂解缓冲液(lysisbuffer)/carrierrna混合物的体积:
n×0.21ml(裂解缓冲液体积/反应)=aml
aml×28μl/ml=bμl
其中
n=样品数
a=裂解缓冲的体积计算值(l22)
b=要添加至裂解缓冲液(l22)的1μg/μlcarrierrna储液的体积计算值
4.解冻所需量的1μg/μlcarrierrna储液。
5.在无菌管中,将所述体积的carrierrna储液(b,如上所述计算)添加至所述体积的裂解缓冲液(a,如上所述计算)。通过上下吸液轻轻混合。避免涡旋,因为涡旋会产生泡沫。
6.在4℃下储存直至使用。1小时内使用缓冲液。
制备溶胞产物
下文描述了用于200μl起始原料的溶胞产物制备方案。如果您希望处理>200μl(≤500μl)样品体积,请相应地放大试剂体积。
1.将25μl蛋白酶k加入无菌微量离心管中。
2.向该微量离心管添加200μl无细胞样品。
注意:如果您在处理<200μl的样品,请使用pbs(磷酸盐缓冲盐水)或0.9%nacl将样品的最终体积调整至200μl。
3.添加200μl裂解缓冲液(含有5.6μgcarrierrna)。盖上管封盖并涡旋混合15秒钟。
4.在56℃下温育15分钟。
5.将250μl96-100%乙醇添加至该管,盖上封盖,并涡旋混合15秒钟。
6.在室温下将溶胞产物温育5分钟。
纯化
1.将上述溶胞产物添加至收集管中的病毒离心柱(viralspincolumn)中。
2.以6800×g将柱离心1分钟。丢弃收集管。将该离心柱置于新的洗涤管(washtube)中。
3.用500μl含有乙醇的洗涤缓冲液(wii)洗涤该柱。以6800×g离心1分钟。丢弃流过液流。
4.重复洗涤步骤3,每次使用500μl洗涤缓冲液(wii)。
5.丢弃收集管,并将离心柱置于另一个干净的洗涤管中。
6.以最大速度将离心柱离心1分钟,以移除任何残留的洗涤缓冲液(wii)。
7.将离心柱置于干净的1.7ml回收管(recoverytube)中。
8.用试剂盒随附的10-50μl无菌无rna酶水(e3)洗脱(将水加至料筒的中央)。
9.在室温下温育1分钟。将离心柱以最大速度离心1分钟以洗脱核酸。回收管容纳有纯化的病毒核酸。丢弃离心柱。
10.将纯化的病毒rna/dna在-80℃下储存或将rna/dna用于所需的下游应用。
f.测序
病毒核酸一经提取,就可以开始进行文库制备以供测序。重要的是,在测序之前病毒核酸未经扩增。在一个实施方案中,按照制造商的说明,用sqk-lsk308(1d2)或sqk-rad004(rapid)ont文库制备试剂盒进行文库制备。sqk-rad004是一种15分钟快速文库制备试剂盒,而sqk-lsk308是一种较慢(约3小时)的更稳健的文库制备。
在一个优选的实施方案中,使用来自牛津纳米孔技术公司(oxfordnanoporetechnologies)的第三代测序仪(miniontm)对病毒核酸进行测序。miniontm是一款小型便携式测序仪,可实时生成测序数据,从而大大减少了从样品接收到污染物鉴定的时间。外来物质核酸的原生测序还消除了耗时的(靶向或从头)扩增步骤的需要。使用ont的wimp软件分析数据,该平台可将读段的数据与来自refseq的病毒、细菌和真菌数据库进行比对,并定期进行更新。对应的“真核”或“细菌”对齐(alignment)代表假阳性,该假阳性最有可能源自cho(宿主)读段与真菌(真核)数据库的部分对齐或来自试剂的污染物。
在一个优选的实施方案中,通过rt-pcr对病毒核酸进行测序。如本文所用,“rt-pcr”是指逆转录聚合酶链反应,rt-pcr是传统pcr的变形形式。rt-pcr是一种分子生物学技术,用于通过从rna产生互补的dna(cdna)转录本来定量检测基因表达。在rt-pcr期间,rna分子通过逆转录酶转换为它们的cdna序列。用于cdna合成的引物可以是非序列特异性引物(诸如随机六聚体引物或寡聚dt引物的混合物),也可以是序列特异性引物。随机六聚体是六核苷酸序列的所有可能组合的混合物,这些序列可以随机附接到整个rna库。寡聚dt引物与mrna分子的多聚a尾互补,可用于合成仅来自mrna分子的cdna。传统上,使用标准pcr程序扩增从mrna合成的cdna。
可以使用所公开的方法检测和测序的病毒包括但不限于汉坦病毒、淋巴细胞脉络丛脑膜炎病毒、大鼠轮状病毒、呼肠孤病毒3型、仙台病毒、小鼠脱脚病病毒、k病毒、克氏大鼠病毒、p12、emc、mav1、乳酸脱氢酶病毒、小鼠微小病毒、泰累尔氏病毒(theiler’svirus)、小鼠肝炎病毒、小鼠轮状病毒、多瘤病毒、大鼠冠状病毒逆转录病毒、涎泪腺炎病毒、胸腺病毒、hi病毒、鼠白血病病毒和牛病毒性腹泻病毒。
感染细胞培养物的人病毒病原体包括但不限于腺病毒、细胞巨化病毒、肠病毒、单纯疱疹病毒、流感病毒、副流感病毒、鼻病毒、呼吸道合胞病毒和水痘带状疱疹病毒。
iii.所关注的蛋白质
本文所公开的细胞培养物中的细胞通常表达或分泌所关注的蛋白质。适合在原核或真核细胞中表达的任何所关注的蛋白质都可用于所提供的工程宿主细胞系统中。例如,所关注的蛋白质包括但不限于抗体或其抗原结合片段、嵌合抗体或其抗原结合片段、scfv或其片段、fc融合蛋白或其片段、生长因子或其片段、细胞因子或其片段、或细胞表面受体的胞外结构域或其片段。所关注的蛋白质可以是由单个亚基组成的简单多肽,或者是包含两个或更多个亚基的复杂多亚基蛋白质。所关注的蛋白质可以是生物制药产品、食品添加剂或防腐剂,或者受纯化和质量标准约束的蛋白质产品。
在一些实施方案中,蛋白质产物(所关注的蛋白质)是抗体、人抗体、人源化抗体、嵌合抗体、单克隆抗体、多特异性抗体、双特异性抗体、抗原结合抗体片段、单链抗体、双抗体、三抗体或四抗体、fab片段或f(ab')2片段、igd抗体、ige抗体、igm抗体、igg抗体、igg1抗体、igg2抗体、igg3抗体或igg4抗体。在一个实施方案中,该抗体是igg1抗体。在一个实施方案中,该抗体是igg2抗体。在一个实施方案中,该抗体是igg4抗体。在一个实施方案中,该抗体是嵌合igg2/igg4抗体。在一个实施方案中,该抗体是嵌合igg2/igg1抗体。在一个实施方案中,该抗体是嵌合igg2/igg1/igg4抗体。
在一些实施方案中,该抗体选自由下列所组成的群组:抗程序性细胞死亡1抗体(例如,如美国专利申请公开号us2015/0203579a1中所述的抗pd1抗体)、抗程序性细胞死亡配体1(例如,如美国专利申请公开号us2015/0203580a1中所述的抗pd-l1抗体)、抗dll4抗体、抗血管生成素2抗体(例如,如美国专利号9,402,898中所述的抗ang2抗体)、抗血管生成素样3抗体(例,如美国专利号9,018,356中所述的抗angptl3抗体)、抗血小板衍生生长因子受体抗体(例如,如美国专利号9,265,827中所述的抗pdgfr抗体)、抗erb3抗体、抗催乳素受体抗体(例如,如美国专利号9,302,015中所述的抗prlr抗体)、抗补体5抗体(例如,如美国专利申请公开号us2015/0313194a1中所述的抗c5抗体)、抗tnf抗体、抗表皮生长因子受体抗体(例如,如美国专利号9,132,192中所述的抗egfr抗体或如美国专利申请公开号us2015/0259423a1中所述的抗egfrviii抗体)、抗前蛋白转化酶枯草溶菌素9抗体(例如,如美国专利号8,062,640或美国专利申请公开号us2014/0044730a1中所述的抗pcsk9抗体)、抗生长和分化因子8抗体(例如,抗gdf8抗体,也称为抗肌生长抑制素抗体,如美国专利号8,871,209或9,260,515中所述)、抗胰高血糖素受体(例如,如美国专利申请公开号us2015/0337045a1或us2016/0075778a1中所述的抗gcgr抗体)、抗vegf抗体、抗il1r抗体、白介素4受体抗体(例如,如美国专利申请公开号us2014/0271681a1或美国专利号8,735,095或8,945,559中所述的抗il4r抗体)、抗白介素6受体抗体(例如,如美国专利号7,582,298、8,043,617或9,173,880中所述的抗il6r抗体)、抗il1抗体、抗il2抗体、抗il3抗体、抗il4抗体、抗il5抗体、抗il6抗体、抗il7抗体、抗白介素33(例如,如美国专利申请公开号us2014/0271658a1或us2014/0271642a1中所述的抗il33抗体)、抗呼吸道合胞病毒抗体(例如,如美国专利申请公开号us2014/0271653a1中所述的抗rsv抗体)、抗分化簇3(例如,如在美国专利申请公开号us2014/0088295a1和us20150266966a1以及在美国申请号62/222,605中所述的抗cd3抗体)、抗分化簇20(例如,如美国专利申请公开号us2014/0088295a1和us20150266966a1以及在美国专利号7,879,984中所述的抗cd20抗体)、抗cd19抗体、抗cd28抗体、抗分化簇48(例如,如美国专利号9,228,014中所述的抗cd48抗体)、抗feld1抗体(例如,如美国专利号9,079,948中所述的)、抗中东呼吸综合征病毒(例如,如美国专利申请公开号us2015/0337029a1中所述抗mers抗体)、抗埃博拉病毒抗体(例如,如美国专利申请公开号us2016/0215040中所述的)、抗塞卡病毒抗体、抗淋巴细胞活化基因3抗体(例如,抗lag3抗体或抗cd223抗体)、抗神经生长因子抗体(例如,如美国专利申请公开号us2016/0017029以及美国专利号8,309,088和9,353,176中所述的抗ngf抗体)和抗激活素a抗体。在一些实施方案中,双特异性抗体选自由下列所组成的群组:抗cd3×抗cd20双特异性抗体(如美国专利申请公开号us2014/0088295a1和us20150266966a1中所述的)、抗cd3×抗粘蛋白16双特异性抗体(例如,抗cd3×抗muc16双特异性抗体)和抗cd3×抗前列腺特异性膜抗原双特异性抗体(例如,抗cd3×抗psma双特异性抗体)。在一些实施方案中,所关注的蛋白质选自由下列所组成的群组:阿昔单抗(abciximab)、阿达木单抗(adalimumab)、阿达木单抗-atto(adalimumab-atto)、ado-曲妥珠单抗(ado-trastuzumab)、阿仑单抗(alemtuzumab)、阿利库单抗(alirocumab)、阿特珠单抗(atezolizumab)、阿维鲁单抗(avelumab)、巴利昔单抗(basiliximab)、贝利木单抗(belimumab)、贝那利珠单抗(benralizumab)、贝伐珠单抗(bevacizumab)、贝洛托单抗(bezlotoxumab)、博纳吐单抗(blinatumomab)、本妥昔单抗(brentuximabvedotin)、布罗达单抗(brodalumab)、康纳单抗(canakinumab)、卡罗单抗喷地肽(capromabpendetide)、peg化塞妥珠单抗(certolizumabpegol)、西米普利单抗(cemiplimab)、西妥昔单抗(cetuximab)、地诺单抗(denosumab)、地努妥昔单抗(dinutuximab)、度匹鲁单抗(dupilumab)、得瓦鲁单抗(durvalumab)、依库珠单抗(eculizumab)、埃罗妥珠单抗(elotuzumab)、艾米希组单抗(emicizumab-kxwh)、厄塔毒素-阿利珠单抗偶联物(emtansinealirocumab)、依维库人单抗(evinacumab)、依洛尤单抗(evolocumab)、fasinumab、戈利木单抗(golimumab)、塞库单抗(guselkumab)、替伊莫单抗(ibritumomabtiuxetan)、依达赛珠单抗(idarucizumab)、英夫利昔单抗(infliximab)、英夫利昔单抗-abda(infliximab-abda)、英夫利昔单抗-dyyb(infliximab-dyyb)、伊匹单抗(ipilimumab)、伊西贝单抗(ixekizumab)、美泊利单抗(mepolizumab)、耐昔妥珠单抗(necitumumab)、雷珠单抗(nesvacumab)、纳武单抗(nivolumab)、奥必托昔单抗(obiltoxaximab)、奥滨尤妥珠单抗(obinutuzumab)、奥瑞珠单抗(ocrelizumab)、奥法木单抗(ofatumumab)、奥拉单抗(olaratumab)、奥马珠单抗(omalizumab)、帕尼单抗(panitumumab)、派姆单抗(pembrolizumab)、帕妥珠单抗(pertuzumab)、雷莫芦单抗(ramucirumab)、兰尼单抗(ranibizumab)、瑞西巴库单抗(raxibacumab)、瑞利珠单抗(reslizumab)、利努单抗(rinucumab)、利妥昔单抗(rituximab)、沙利鲁单抗(sarilumab)、塞库单抗(secukinumab)、西妥昔单抗(siltuximab)、塔西单抗(tocilizumab)、塔西单抗(tocilizumab)、曲妥珠单抗(trastuzumab)、特伐单抗(trevogrumab)、乌司他单抗(ustekinumab)和维多珠单抗(vedolizumab)。
在一些实施方案中,所关注的蛋白质是含有fc部分和另一个结构域的重组蛋白质(例如fc融合蛋白)。在一些实施方案中,fc融合蛋白是受体fc融合蛋白,其包含与fc部分偶联的受体的一个或多个胞外结构域。在一些实施方案中,fc部分包含igg的铰链区、随后的ch2和ch3结构域。在一些实施方案中,受体fc融合蛋白含有可结合至单个配体或多个配体的两个或更多个独特的受体链。例如,fc融合蛋白是trap蛋白,诸如例如il-1陷阱(例如,rilonacept,其含有与融合至higg1的fc的il-1r1胞外区融合的il-1racp配体结合区;参见美国专利号6,927,004,该专利全文以引用的方式并入本文)或yegf陷阱(例如,aflibercept或ziv-aflibercept,其包含与融合至higg1的fc的vegf受体flk1的ig结构域3融合的vegf受体flk1的ig结构域2;参见美国专利号7,087,411和7,279,159)。在其他实施方案中,fc融合蛋白是scfv-fc融合蛋白,其含有与fc部分偶联的抗体的一个或多个抗原结合结构域(诸如可变重链片段和可变轻链片段)中的一者或多者。
iv.细胞培养
本文所述的细胞培养可以是“补料分批细胞培养”或“补料分批培养物”,其是指分批培养,其中在最初将细胞和培养基供应至培养容器,并且在培养期间将另外的培养营养物以不连续的增量缓慢地供料至培养物,在终止培养之前进行或不进行定期的细胞和/或产物收获。补料分批培养包括“半连续补料分批培养”,其中定期移出整个培养物(可能包括细胞和培养基)并用新鲜培养基代替。补料分批培养不同于简单的“分批培养”,而在分批培养中用于细胞培养的所有组分(包括动物细胞和所有培养营养物)都在培养过程的开始就提供至培养容器。补料分批培养在以下方面可与“灌流培养”不同:在标准补料分批过程中未从培养容器中移出上清液,而在灌流培养中,通过例如过滤将细胞限制在培养物中,并连续或间歇地将培养基引入培养容器并从培养容器移出。但是,设想了在补料分批细胞培养过程中移出样品以用于测试目的。补料分批过程持续进行直至确定达到最大工作体积和/或蛋白质产量,随后收获蛋白质。
细胞培养可以是“连续细胞培养”,其为一种用于连续培养细胞(通常是处于特定生长期)的技术。例如,如果需要持续供应细胞,或者需要生产所关注的特定蛋白质,则细胞培养物可能需要维持在特定的生长期。因此,必须连续地监测并相应地调节条件,以将细胞维持在该特定生长期。
细胞在细胞培养基中培养。术语“细胞培养基”和“培养基”是指用于培养哺乳动物细胞的营养液,其通常提供必要的营养以增强细胞的生长,诸如碳水化合物能源、必需氨基酸(如苯丙氨酸、缬氨酸、苏氨酸、色氨酸、甲硫氨酸、亮氨酸、异亮氨酸、赖氨酸和组氨酸)和非必需氨基酸(如丙氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、脯氨酸、丝氨酸和酪氨酸)、痕量元素、能源、脂质、维生素等。细胞培养基可含有提取物,如血清或蛋白胨(水解产物),其可提供支持细胞生长的原料。培养基可含有源自酵母的提取物或大豆提取物,而不是源自动物的提取物。化学限定培养基是指其中所有化学组分均已知(即具有已知化学结构)的细胞培养基。化学限定培养基完全不含源于动物的组分,诸如源于血清或源于动物的蛋白胨。在一个实施方案中,培养基是化学限定培养基。
该溶液还可以含有增强生长和/或存活率高于最低速率/比率的组分,包括激素和生长因子。可以将溶液配制成对于所培养的特定细胞的存活和增殖而言最佳的ph和盐浓度。
“细胞系”是指通过细胞的连续传代或传代培养而衍生自特定谱系的一个或多个细胞。术语“细胞”可与“细胞群体”互换使用。
术语“细胞”包括适合于表达重组核酸序列的任何细胞。细胞包括原核生物和真核生物的细胞,诸如细菌细胞、哺乳动物细胞、人细胞、非人动物细胞、禽细胞、昆虫细胞、酵母细胞或细胞融合物,诸如例如杂交瘤或四重杂交瘤。在某些实施方案中,细胞是人、猴、猿、仓鼠、大鼠或小鼠细胞。在其他实施方案中,细胞选自以下细胞:中国仓鼠卵巢(cho)(例如chok1、dxb-11cho、veggie-cho)、cos(例如cos-7)、视网膜细胞、vero、cv1、肾细胞(例如,hek293、293ebna、msr293、mdck、hak、bhk21)、hela、hepg2、wi38、mrc5、colo25、hb8065、hl-60、淋巴细胞例如jurkat(t淋巴细胞)或daudi(b淋巴细胞)、a431(表皮细胞)、u937、3t3、l细胞、c127细胞、sp2/0、ns-0、mmt细胞、干细胞、肿瘤细胞和源自上述细胞的细胞系。在一些实施方案中,细胞包含一种或多种病毒基因,例如表达病毒基因的视网膜细胞(例如,per.
实施例
实施例1:在无需扩增的情况下鉴定病毒
材料和方法
将鼠腺病毒1(mav1)(一种约30,000bp的双链dna病毒)在cho-k1指标细胞上培养7天。将细胞瓶冷冻过夜,然后在用于vera优化研究之前解冻。按照制造商的说明,用sqk-lsk308(1d2)或sqk-rad004(rapid)ont文库制备试剂盒进行文库制备。sqk-rad004是一种15分钟快速文库制备试剂盒,而sqk-lsk308是一种较慢(约3小时)的更稳健的文库制备试剂盒。使用ont的wimp软件分析数据,该平台可将读段的数据与来自refseq的病毒、细菌和真菌数据库进行比对,并定期进行更新。对应的“真核”或“细菌”对齐代表假阳性,该假阳性最有可能源自cho(宿主)读段与真菌(真核)数据库的部分对齐。
结果
最初的工作集中于并入随机pcr技术以从储备病毒滴度扩增剩余的少量病毒核酸。这带来可用于测序的大量总读段,但也扩增了任何残余的宿主核酸,从而使测序后的数据分析变得复杂。不进行扩增则难以对大量的原生病毒读段进行测序。vera加随机引物可增加病毒读段对齐,但不如使用靶向pcr引物有效(图2)。
在另一个实验中,将两种dna病毒(mvm和mav1)在cho-k1细胞上培养7天。对所述细胞进行上述方法。以q>7(约80%的准确度)过滤测序读段,所有可通过的读段均进行实时分析。大多数读段对应于掺标的病毒(>总读段的98%)。如表2中可见,vera方案可有效移除宿主细胞背景以对原生病毒读段进行测序,并可以在5分钟内鉴定出污染物。
实施例2:样品的过滤
将0.22μm过滤器用于更好地捕获宿主细胞碎片(即细胞核)。从该初始vera程序制备两份样品(测试#1a和测试#1b)。测试#1a尝试对未经历任何核酸酶处理的来自vera的剩余渗余物进行测序(图1,步骤d)。测试#1b在核酸酶混合物处理(omnicleave+riboshredder)后对样品进行测序,以测试在核酸酶处理以消化宿主核酸(图1,步骤e)后是否有更多的病毒测序读段增加。两种制备物都没有产生任何病毒鉴定。为了挽救任何未鉴定的残余读段,使用图2中的随机pcr技术并正确鉴定了mav1读段。然而,两种制备物之间mav1测序度量没有变化,总病毒读段仅占总对齐读段的2%(图3a和3b)。
在另一个实验中,将0.22μm过滤器替换为较大的0.45μm过滤器。对来自vera程序的独立核酸酶处理物的等分试样进行测序,即仅rna酶i(测试#2a)或商购的omnicleave核酸酶混合物(测试#2b)。这些个别的处理物均能够鉴定mav1,但仅从有限数目的读段。大多数读段映射至真核生物,从而表明两种核酸酶处理均不足以完全移除宿主核酸,这可能与文库制备问题有关,因为少于1%的映射读段来自mav1。未像测试#1中那样尝试随机pcr策略。
实施例3:核酸酶处理
在另一个实验中,保留0.45μm过滤器,并用(i)
实施例4:自动提取
将dna病毒(mvm、pi2、reo2和/或mav-1)掺入cho-k1细胞中。在掺有病毒的cho-k1细胞经受超速离心后,对所述细胞进行苯酚/氯仿提取。在掺有病毒的cho-k1细胞经受vera方案后,对所述细胞进行dna的自动提取。
使用用于ipreptm纯化仪(ipreptmpurificationinstrument)的ipreptmpurelinktm病毒试剂盒(ipreptmpurelinktmviruskit)进行自动提取,该纯化仪已根据纯化方案进行了预编程,该纯化方案可指导所用试剂的体积和温育时间。如表3中可见,自动提取减少了病毒富集。
但是,超离心后,仍保留高比例的宿主读段。
尽管在前面的说明书中已关于本发明的某些实施方案描述了本发明,并且出于说明的目的已经提出了许多细节,但是对于本领域技术人员来说显而易见的是,本发明容易受其他实施方案的影响,并且在不脱离本发明的基本原理的情况下,本文所述的某些细节可以进行相当大的改变。
本文引用的所有参考文献均以引用的方式全文并入本文。在不脱离本发明的精神或本质属性的情况下,本发明可以以其他特定形式来体现,并且因此,应参考所附权利要求,而不是前述说明书,来指示本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!