用于在连续有氧发酵中控制溶解氧浓度的方法与流程
优先权要求
本申请要求2018年3月30日提交的美国临时专利申请号62/650,575的权益,该临时专利申请以引用方式并入本文以用于所有目的。
本公开整体涉及有氧生物合成中溶解氧浓度的控制。具体地,本公开涉及在特定范围内的溶解氧的控制,并且涉及发酵罐顶部空间中气态氧浓度的控制。
背景技术:
在气体发酵中,富含碳的气体诸如二氧化碳、一氧化碳和甲烷被微生物转化为多种产物,诸如燃料、蛋白质和化学化合物,例如醇和有机酸。这些产物可用于化学、石化、制药、动物饲料、环境和农业领域的行业。气体发酵工艺可利用多种原料,包括来源于家庭、工业或农业废物的原料,从而减少对化石碳源的依赖并降低温室气体的排放。与高温高压化学催化反应相比,气体发酵通常在较低的反应温度和压力下进行。
微生物在发酵罐内的各种工程条件和物理条件下生长,诸如搅拌、混合、曝气、压力、剪切、温度和ph。一些微生物在厌氧条件下生长,而其他微生物则在有氧条件下生长。对于有氧反应,通常将空气用作氧气源,但也可以使用富氧空气或纯氧。通常优选在尽可能高的氧浓度下操作,以使氧传质最大化,并因而优化生产率。这是因为对于大多数有氧微生物生物合成反应来说,从气相到液相的氧传质速率是已知的限速步骤。
另外,对于发酵罐外部的任何潜在易燃气体混合物,例如分散在发酵液(即,液相)中的气体,诸如发酵罐顶部空间的气体混合物,期望在低于使气态组合物易燃性的下限氧浓度(loc)的气态氧浓度下安全地操作。顶部空间中的溶解氧和气态氧浓度难以控制,尤其是当压力增加到高于大气压时以及当氧溶解度增加时。
因此,需要在达到可接受的生产率、安全性、资本成本(资本效率)和操作成本的同时,在对于微生物而言可接受的范围内改进对溶解氧浓度的控制和维持。
技术实现要素:
在一些方面,本公开涉及一种用于在连续有氧气体发酵工艺中控制溶解氧浓度的方法,该方法包括:a)将微生物提供给发酵罐;b)将至少两种进料流引入发酵罐,其中至少一种进料流包含气态氧,并且其中至少一种进料流包含易燃气体和任选地氧浓度低于极限氧浓度(loc)的氧气;c)测量发酵罐中至少一个位置的溶解氧浓度;d)测量顶部空间中的气态氧浓度;以及e)控制发酵罐中的溶解氧浓度,使其大于微生物起作用所需的最小溶解氧浓度,并且小于顶部空间中的气态氧浓度超过极限氧浓度(loc)时的溶解氧浓度。如果微生物具有至少1mmol氧/(g干细胞重量)/小时的比摄氧率,则认为该微生物起作用。在某些方面,所述至少一种包含易燃气体和氧气的进料流不包括所述至少一种包含气态氧的进料流,例如,所述至少一种包含易燃气体的进料流不包含氧气。在一些实施方案中,溶解氧浓度通过调节以下项中的至少一项而调节氧传质速率来控制:i.所述至少一种包含氧气的气态流的流量;ii所述至少一种包含氧气的气态流中的氧浓度;iii.所述发酵罐内作为气泡的气体滞留量;iv.所述发酵罐内的所述气泡的大小;以及v.所述发酵液的影响氧传质速率的一种或多种物理特性。所述物理特性可选自由表面张力、粘度、密度和温度组成的组。在一些实施方案中,易燃气体包含氢气。在一些实施方案中,所述至少两种进料流中的至少一种进料流包含二氧化碳。可通过调整所述至少一种气态流的总流量和/或通过调整所述至少一种包含氧气的气态流中的氧浓度来调节所述至少一种包含氧气的气态流的流量。发酵罐可选自由以下项组成的组:单个发酵罐、串联的多个发酵罐、膜发酵罐、固定床发酵罐、流化床发酵罐、单个高压釜、串联的多个高压釜、活塞流发酵罐、气动搅拌发酵罐、带有具有强制循环的外部回路的气升式发酵罐、鼓泡塔发酵罐、固定(填充)床塔式发酵罐、带有多个隔室的卧式单个发酵罐和多级塔式发酵罐。发酵罐可为非搅拌式发酵罐。在一些实施方案中,不对发酵罐进行机械搅拌。微生物可依赖于化能自养代谢/rubisco。微生物可为含rubisco的微生物。微生物可选自罗尔斯通菌属(ralstonia)、沃特氏菌属(wausteria)、贪铜菌属(cupriavidus)、产碱杆菌属(alcaligenes)、伯克氏菌属(burkholderia)或潘多拉菌属(pandoraea)的非致病性成员。在一些方面,微生物为钩虫贪铜菌(c.necator)或耐金属贪铜菌(c.metalliduruns)。发酵罐可在高于大气压的压力下操作。所述方法还可包括:f.测量发酵罐的顶部空间中的气态氧浓度;以及g.将气态氧浓度控制为小于发酵罐顶部空间中气态混合物的极限氧浓度(loc)的75%。发酵罐可包括至少两个氧添加入口。所述至少一种包含气态氧的进料流可为空气进料流、富氧空气流或纯氧流。溶解氧浓度可被控制为低于过渡溶解氧浓度的值。
在一些方面,本公开涉及一种用于有氧气体发酵工艺的发酵罐系统,该系统包括:a.发酵罐,该发酵罐包括至少两个氧添加点;b.发酵罐中的微生物;以及c.至少两个控制回路,其中至少一个控制回路测量和控制发酵罐中发酵液的溶解氧含量,并且其中至少一个控制回路测量和控制发酵罐的顶部空间中的气态氧浓度。在一些方面,该系统包括串联的至少两个发酵罐。在其他方面,该系统包括并联的至少两个发酵罐。发酵罐可选自由以下项组成的组:单个发酵罐、串联的多个发酵罐、膜发酵罐、固定床发酵罐、流化床发酵罐、单个高压釜、串联的多个高压釜、活塞流发酵罐、气动搅拌发酵罐、带有具有强制循环的外部回路的气升式发酵罐、鼓泡塔发酵罐、固定(填充)床塔式发酵罐、带有多个隔室的卧式单个发酵罐和多级塔式发酵罐。发酵罐可在高于大气压的压力下操作。
附图说明
根据所附非限制性附图,将更好地理解本公开,其中:
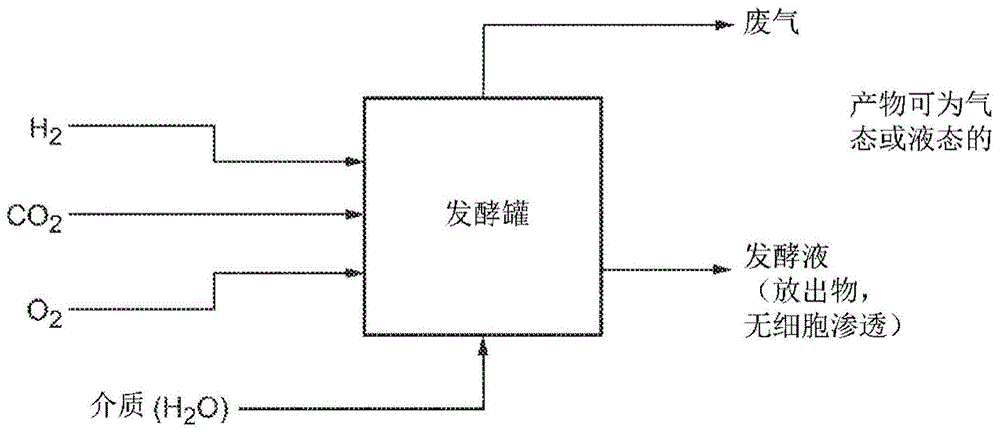
图1示出了根据本公开的实施方案的具有三种气体进料的气体发酵工艺的框图。
图2a和图2b示出了根据本公开的实施方案的在不同压力下的比摄氧率(our)与溶解氧(do)浓度的动力学模型。
图3a和图3b示出了根据本公开的实施方案的并联构造和串联构造的发酵罐。
图4示出了根据本公开的实施方案的用于do浓度和顶部空间中的氧浓度的控制方法。
图5示出了根据本公开的实施方案的h16野生型钩虫贪铜菌的比our与do浓度的动力学模型。
具体实施方式
本公开涉及用于管理有氧生物合成的材料和方法,包括控制氧浓度的方法。某些生物体诸如钩虫贪铜菌在低于最小溶解氧(do)浓度的条件下停止起作用或以非常低的速率起作用,因为它们不再能够以最小的速率代谢氧,从而无法生长和生成产物。此外,当do高于一定浓度时,这些生物体会显示出生长抑制和降低的摄氧率(our)。因此,将do浓度控制在特定范围内对于确保生物体的改善或最佳的生长和生产率而言很重要。do浓度还与发生有氧生物合成的发酵罐的气态顶部空间中的氧浓度平衡并与之均衡。当顶部空间保持为非易燃组合物时,气态顶部空间中氧浓度的控制上限对应于该组合物的易燃性极限氧浓度(loc)。最小do浓度是发酵罐的控制下限。
在一些方面,被控制的氧浓度是溶解氧浓度。用于控制溶解氧浓度的方法包括:a.将微生物提供给生物反应器例如发酵罐,并且将至少两种进料流引入反应器。所述进料流中的至少一种进料流包含气态氧,并且所述进料流中的至少一种进料流包含易燃气体(例如,氢气),并且任选地包含浓度低于易燃性极限氧浓度(loc)的氧气。该方法还包括测量发酵罐中至少一个位置的溶解氧浓度,并且控制发酵罐中的溶解氧浓度。将溶解氧浓度控制为至少等于微生物起作用的最小值,并且小于导致顶部空间中的气态氧浓度达到或高于气态混合物在顶部空气中的易燃性loc的值。该方法还可包括测量发酵罐的顶部空间中的气态氧浓度,并且将溶解氧浓度控制为小于顶部空间中的气态氧浓度超过loc时的量。
在其他方面,本公开还涉及测量和控制在其中发生有氧生物合成的发酵罐的顶部空间中的气态氧浓度。将顶部空间中的该气态氧浓度控制为小于气态混合物在顶部空间中的易燃性极限氧浓度(loc),例如小于loc的85%。
在另外的实施方案中,本公开涉及一种用于有氧气体发酵工艺的发酵罐系统。该系统包括发酵罐,该发酵罐包括至少两个气体添加点,例如氧添加点。在发酵罐中提供微生物。该系统还包括至少两个控制回路,其中至少一个控制回路测量和控制发酵罐中发酵液的溶解氧含量,并且至少一个控制回路测量和控制发酵罐的顶部空间中的气态氧浓度。
通常,在搅拌式发酵罐诸如cstr中,在大气压下控制do浓度和loc,其中由于cstr中的返混,do浓度在整个发酵液中趋于更均匀。至少部分地由于难以在loc以下安全操作的同时维持均匀的do,因此未实现在高于大气压的压力下和/或在没有或几乎没有机械搅拌的情况下(例如,在具有很少反混的非搅拌式生物反应器中)的连续有氧工艺的操作。
本发明人发现,为了在易燃性极限氧浓度(loc)以下操作,但不让氧含量下降过多,可以调节氧的传质速率。本发明人已发现,为了在资本有效的发酵罐中维持do浓度并优化摄氧率(our),他们可通过使用以下项中的一项或多项来控制氧浓度:1.多个氧气注入点,2.多个串联流反应器,3.微泡生成,4.维持相对高的气体滞留率,以及5.一个或多个do浓度测量点和用于将do浓度和气态氧浓度维持在限制范围内并优化our的控制方法,例如将do浓度控制在our与do浓度曲线的左侧、右侧或这两侧,如本文中进一步论述。
下文描述了用于在生物合成过程中控制氧浓度的方法以及发酵罐本身。
微生物
将微生物提供给本文所述的发酵罐,以便发生有氧生物合成。对于有氧反应,通常将空气用作氧气源,但也可以使用富氧空气或纯氧。通常优选在发酵罐内的分散气相中以尽可能高的氧浓度操作,以使氧传质最大化,从而优化生产率。这是因为对于大多数有氧微生物生物合成反应来说,从气相到液相的氧传质速率是已知的限速步骤。高氧浓度(诸如,富含氢气的流中分散的气相中的氧>6体积%)的结果是,当存在易燃气体(例如氢气)、易燃的挥发性有机产物或中间产物时,发酵罐顶部空间和排出气体流中任何未反应的氧都可能导致形成不安全的易燃混合物。
在一些方面,微生物依赖于化能自养代谢/rubisco。在其他方面,微生物为含rubisco的微生物。作为非限制性示例,微生物可为钩虫贪铜菌或具有与其相似的特性的生物体。钩虫贪铜菌(先前被称为真养氢单胞菌(hydrogenomonaseutrophus)、真养产碱杆菌(alcaligeneseutropha)、富养罗尔斯通氏菌(ralstoniaeutropha)和富养沃特氏菌(wautersiaeutropha))是β-变形菌类的革兰氏阴性鞭毛土壤细菌。这种氢氧化细菌能够在无氧环境和有氧环境的界面处生长,并且容易在异养生活方式和自养生活方式之间适应。该细菌的能量来源包括有机化合物和氢两者。钩虫贪铜菌的另外的特性包括微需氧性、抗铜性(makar和casida;1987年)、细菌捕食(byrd等人,1985年;sillman和casida,1986年;zeph和casida,1986年)和聚羟基丁酸酯(phb)合成。此外,已报道这些细胞能够进行有氧生长和硝酸盐依赖型厌氧生长。可用于本公开的钩虫贪铜菌生物体的非限制性示例是钩虫贪铜菌h16菌株。在一个非限制性实施方案中,使用钩虫贪铜菌h16菌株的宿主,其中phac1ab1基因座的至少一部分被敲除(δphacab),如美国专利申请序列号15/717,216中所述,该美国专利申请的教导内容以引用方式并入本文。生物体可选自罗尔斯通菌属(ralstonia)、沃特氏菌属(wausteria)、贪铜菌属(cupriavidus)、产碱杆菌属(alcaligenes)、伯克氏菌属(burkholderia)或潘多拉菌属(pandoraea)的非致病性成员。在一些实施方案中,微生物是钩虫贪铜菌、耐金属贪铜菌、草酸盐贪铜菌(cupriavidusoxalaticus)、嗜碱贪铜菌(cupriavidusalkaliphilus)、巴塞尔贪铜菌(cupriavidusbasilensis)、皮纳图博火山贪铜菌(cupriaviduspinatubonensis)、台湾贪铜菌(cupriavidustaiwanensis)、cupriaviduspampae、罕见贪铜菌(cupriaviduspauculus)、皮氏罗尔斯通菌(ralstoniapickettii)、罗尔斯通菌属db3或罗尔斯通菌属pba。
在某些方面,微生物为钩虫贪铜菌,这是一种在升高的do浓度下表现出氧抑制的微生物。据他人报道,这种氧抑制仅影响聚羟基丁酸酯(phb)的产生,而不影响生物体的生长。然而,本发明人发现,钩虫贪铜菌的氧抑制还会影响生物体的生长,如下所述。
与大多数其他物种不同,当do高于一定浓度时,诸如钩虫贪铜菌的生物体显示出生长抑制。这是通过对h16野生型钩虫贪铜菌进行的动力学研究发现的,该研究显示出在大于约1mg/l的溶解氧浓度下对生长速率的氧抑制。当do浓度增大时,观察到生长损失和比摄氧率(our)降低。当在高压下操作时随着氧气的溶解度和所产生的do浓度增大,和/或在很少进行机械搅拌或不进行机械搅拌的情况下在连续反应器中操作时(do在整个发酵罐中都可能发生变化),这种现象甚至变得更加重要。准确的溶解氧测量结果对于确定相对于氧浓度极限何时进行气体发酵工艺以及理解工艺控制动作的影响来说很重要。即使在高于大气压的压力下,也希望将do浓度保持在足以维持最佳生长和our的水平。
进料流
如上所述,需要氧气来进行有氧生物合成,并且通过进料流将氧气引入发酵罐。为了以安全的方式将气态进料流引入发酵罐,使用了至少两种不同的连续进料流。至少一种连续流包含易燃气体(例如,氢气),并且至少一种进料流包含气态氧。所述至少一种包含易燃气体的进料流可任选地包含浓度低于易燃性极限氧浓度(loc)的氧气,并且可任选地包含cch气体进料的全部或一部分。所述至少一种包含氧气的连续流可包含至少15重量%的氧气,并且可为空气进料流、富氧空气流或纯氧流。此类进料流将不含有氢气,或者将含有浓度低于氢气的易燃性下限的氢气,但是可任选地包含co2气体进料的全部或一部分。通过本文别处描述的方式,将每种气体进料流引入发酵罐。通过将氢气和大部分氧气分离成单独的进料流,无法在进料系统中形成易燃气体混合物,并且含有氢气和氧气的气体混合物仅存在于发酵液和顶部空间内的小体积气泡中和排出气体流中。在一些方面,与主体气相例如顶部空间中的气态氧浓度相比,发酵液中分散的气相气泡中的气态氧浓度可处于增加的值。在某些方面,发酵液中分散的气相气泡中的气态氧浓度高于loc。
发酵罐
如本文所述,发酵罐的温度和压力参数可例如在低于大气压至高于大气压的压力下以及在20℃至50℃的温度下变化。可基于期望的操作温度和压力以及附加因素来选择要使用的发酵罐的类型。附加因素的示例包括是否需要机械搅拌或搅动、微生物是否将固定化以及需要多少氧添加点。发酵罐诸如气体发酵罐的类型的示例包括单个发酵罐、串联的多个发酵罐、膜发酵罐、固定床发酵罐、流化床发酵罐、单个高压釜、串联的多个高压釜、活塞流发酵罐、气动搅拌发酵罐、带有具有强制循环的外部回路的气升式发酵罐、鼓泡塔发酵罐、固定(填充)床塔式发酵罐、带有多个隔室的卧式单个发酵罐和多级塔式发酵罐。
发酵罐可包括一个或多个传感器,所述传感器被配置为测量发酵罐内的环境和/或培养物的一个或多个参数。传感器可以例如包括一个或多个温度传感器、ph传感器、压力传感器、溶解氧传感器、发泡传感器、光密度传感器以及其他酶促、近红外或中红外传感器。发酵罐的操作条件可以根据需要进行测量和控制以在发酵罐内进行处理,并且在一些方面,所述测量和控制涉及来自一个或多个传感器的测量。
如本文所述,发酵罐可与至少一个控制回路相互作用,以测量和控制溶解氧浓度。发酵罐可与附加控制回路相互作用,以测量和控制发酵罐的顶部空间中的气态氧浓度。控制回路可使用前馈控制、反馈控制以及它们的组合。
在一些方面,使用多于一个发酵罐。发酵罐可平行布置,如图3a所示,或者串联布置,如图3b所示。当串联布置时,在各个位置(高度)处测量和控制溶解氧浓度的控制回路(未示出)调节紧接在溶解氧浓度测量位置之前的包含氧气的气态进料流的流量。
在一些实施方案中,将发酵罐的表压保持在期望的范围内以影响诸如发酵罐内的气体溶解度的因素。发酵罐内的表压可为例如1巴至10巴,例如1.1巴至6.4巴、1.9巴至7.3巴、2.8巴至8.2巴、3.7巴至9.1巴或4.6巴至10巴。就上限而言,发酵罐表压可以小于10巴,例如小于9.1巴、小于8.2巴、小于7.3巴、小于6.4巴、小于5.5巴、小于4.6巴、小于3.7巴、小于2.8巴或小于1.9巴。就下限而言,发酵罐表压可以大于1巴,例如大于1.9巴、大于2.8巴、大于3.7巴、大于4.6巴、大于5.5巴、大于6.4巴、大于7.3巴、大于8.2巴或大于9.1巴。还可以想到较高的表压,例如大于10巴。以巴为单位测得的表压也可称为巴(g)。
氧浓度的控制参数
如本文所述,将发酵罐中的氧浓度控制在指定范围内。将溶解氧浓度控制为至少微生物起作用所需的最小值。如果微生物的比摄氧率为至少1mmol氧/(g干细胞重量)/小时,例如至少2mmol氧/(g干细胞重量)/小时、至少3mmol氧/(g干细胞重量)/小时、至少4mmol氧/(g干细胞重量)/小时、至少5mmol氧/(g干细胞重量)/小时、至少6mmol氧/(g干电池重量)/小时、至少7mmol氧/(g干电池重量)/小时、至少8mmol氧/(g干电池重量)/小时、至少9mmol氧/(g干电池重量)/小时或至少10mmol氧/(g干细胞重量)/小时,则认为该微生物起作用。需要最小值是因为微生物是好氧的并且需要一定量的氧气,低于该量,氧气微生物将无法生长或生成产物,并且该过程将是不经济的。
发酵罐的顶部空间中气态氧的浓度还被控制为使其在loc以下安全操作。为了提供针对工艺异常的安全措施,顶部空间中的气态氧浓度可被测量和控制为小于loc,例如小于loc以下的期望安全界限。在一些方面,顶部空间中的气态氧浓度可小于loc的85%,例如小于80%、小于75%或小于70%。在一些方面,将顶部空间中的气态氧浓度控制在loc的65%至85%之内。在一些方面,在发酵液外部的气态混合物中,loc为约5.9体积%的氧,但它也可在5体积%至6体积%之间变化,具体取决于气态混合物。
除了在所需do浓度和loc值下操作之外,还期望最大化考虑了生产率、资本成本和操作成本的经济价值。从工艺工程的角度来看,存在一些需要管理的自然冲突。理想的是,氧浓度将会为实现传质而最大化,但为了工艺安全性应最小化。
溶解氧浓度
测量溶解氧,然后将其控制为大于微生物起作用所需的最小do浓度,例如至少1mmol氧/(g干细胞重量)/小时。溶解氧浓度通过调节向发酵罐的氧传质速率来控制。由于氧气在水中的相对低的水溶性,氧传质速率是发酵罐中细胞生长和生产的限速因素。
可通过合适的装置将所述至少一种包含气态氧的进料流引入发酵罐,以产生微泡并增强气相与主体液体之间的气-液界面。进料点的位置可变化,但假设是立式发酵罐时,通常可靠近发酵罐的底部。附加的氧添加点可进一步沿着发酵罐或在发酵罐上方(假设是立式发酵罐),但在发酵液表面下方。在一些方面,附加的氧添加点可与第一氧添加点和发酵液表面等距。用于测量溶解氧的溶解氧控制器可位于第一氧添加点(第一溶解氧控制器)附近,以允许在该第一点处调节氧添加速率。附加的溶解氧控制器例如第二溶解氧控制器可在附加的氧添加点附近,以允许在该附加点处调节氧添加。第二溶解氧控制器还可与第一溶解氧控制器相互作用以在第一氧添加点处调整氧添加速率,特别是在第二溶解氧控制器不能将do浓度维持在附加的氧添加点处时。随着包含的氧添加点越多,则可包含的溶解氧控制器越多,它们可彼此相互作用并且与第一溶解氧控制器和第二溶解氧控制器相互作用。
另外,气液传质取决于反应器构造。存在七个将气体传质到反应位点的一般步骤。
1.通过气泡内的主体气体扩散到气-液界面。
2.跨气液界面运动。
3.溶质气体通过邻近气泡的相对未混合的液体区域(膜)扩散到充分混合的主体液体中。
4.溶质气体通过主体液体运输到细胞周围的停滞膜。
5.通过与细胞相关的第二未混合液膜运输。
6.跨细胞膜运输。
7.通过细胞运输到反应位点。
在有氧生物合成期间,微生物需要氧气来起作用,例如生长和/或生成产物。例如,钩虫贪铜菌是好氧的并且在低溶解氧浓度下会关闭,因为细胞内反应需要氧气。可溶性氢化酶(sh)是催化分子氢氧化为质子和电子的酶,通常呈烟酰胺腺嘌呤二核苷酸(nadh)的形式。即,sh产生能量并减少当量以支持钩虫贪铜菌的生长。sh对氧浓度敏感。如果氧浓度过高,它们的辅因子钼就会被氧化,并且如果氧浓度过低,sh不能再足够快地再生nadh或atp,生物体就会关闭。
sh生成的nadh是经由calvin-bensonbassham循环驱动碳固定所必需的,该循环是钩虫贪铜菌在co2/h2下生长时进行碳固定的主要途径。二氧化碳和氧气竞争同一个活性位点,并因此竞争进入rubisco。rubisco对二氧化碳的亲和力远高于对氧气的亲和力。因此,即使大气中的二氧化碳水平为约0.035体积%co2,而大气中的氧气浓度为约21体积%o2,二氧化碳的固定通常也会超过氧气的固定。因此,随着氧浓度的降低,二氧化碳固定的能量效率提高。
可溶性氢化酶和rubisco的最佳活性发生在不同浓度的溶解氧下,需要仔细选择最小氧浓度。
然而,对h16野生型钩虫贪铜菌的动力学研究显示出在大于约1mg/l的溶解氧浓度下对生长速率的氧抑制。当溶解氧浓度增大时,观察到生长损失和比摄氧率(our)降低。最大比our发生在本文中称为过渡溶解氧浓度的溶解氧浓度处。准确的溶解氧测量结果对于了解相对于氧极限、尤其是相对于过渡溶解氧浓度何时进行气体发酵工艺很重要。
顶部空间中的气态氧浓度
出于安全考虑,发酵罐的顶部空间中气态氧浓度的上限是受限的。通常,文献引用了比率为7∶1∶1或8∶1∶1的初始气体混合物h2/co2/o2(氢气/二氧化碳/氧气)为钩虫贪铜菌的气体发酵提供最佳生长/生产条件(ishizaki等人,2001年),但该比率可根据调整和反应需要而变化。然而,通常,这意味着氢气/氧气比率在氢气和氧气浓度的易燃范围内。当与作为稀释剂的氢气和二氧化碳混合时,临界氧浓度为5.9体积%(jones和kenny,1935年)。因此,5.9体积%的极限氧浓度(loc)在此被定义为易燃气态混合物可与根据本公开的气体发酵工艺混合物形成的最小氧浓度。这些气体发酵工艺混合物是在发酵罐的顶部空间中产生氧气、氮气、氢气、二氧化碳和水蒸气混合物的混合物。发酵罐中的温度和压力条件也可影响顶部空间中的组分的相对浓度。因此,该发酵罐在低于5.9体积%氧气的loc的条件下操作。为了维持安全界限,发酵罐可在loc的70%至80%内或者甚至不到70%的范围内操作。在一些方面,将顶部空间中的气态氧浓度控制为3.5体积%至4.5体积%的氧气,例如3.75体积%至4.25体积%、3.85体积%至4.15体积%、3.95体积%至4.05体积%、或大约4体积%的氧气。发酵罐排出气体也具有相同的loc。
氧浓度的控制
1.多个氧添加点
为了将do和loc保持在期望的范围内,可存在两个或更多个氧添加点,例如三个或更多个、四个或更多个、五个或更多个或者六个或更多个。当发酵罐中包含的氧添加点越多时,整个发酵液中的do浓度可越恒定。例如,在立式塔发酵罐气升式发酵罐中,do浓度可在竖直方向上保持。然而,随着添加更多的氧添加点,反应器设计的复杂性和成本增加。
发酵罐的氧添加点不需要线性间隔开,并且可在发酵罐的多于一个侧面上间隔开。包含氧气的进料流可通过延伸穿过发酵罐壁并终止于如本文所述的一些类型的气体分配装置例如喷头的管道来输送。这允许进料流跨发酵罐直径分配。
假设是立式发酵罐,则可在发酵罐的底部添加包含氧气的进料流。在一些方面,进料流是空气、富氧空气或纯氧。因此,发酵罐底部的氧浓度可能高于发酵罐顶部的氧浓度。在包含氧气的初始进料流上方的氧添加点允许将整个发酵液中的do浓度控制得更均匀。在一些实施方案中,可将不含气态氧的进料流在发酵罐的底部处引入,并且可在该点上方添加包含氧气的进料流。与添加不含气态氧的进料流相结合,塔上方的更多的氧添加会使发酵液中的溶解氧更均匀。不含氧气的进料流包括易燃组分,例如氢气或者二氧化碳和氢气的组合。传质速率可沿着塔(立式或卧式)的长度分级,并且可相应地选择氧添加点。
可沿着发酵罐的长度沿着多个微泡生成模块逐渐添加氧气。这种设置允许逐步添加氧气,从而提高在低于loc的条件下操作的能力,但与氧传质速率保持平衡。可基于对do浓度的测量来单独地控制每个模块的氧添加。
2.串联反应器
当使用多于一个发酵罐时,这些发酵罐可串联或并联放置。串联反应器比并联反应器更有利地可配置,从而实现操作灵活性。当串联时,反应器为两个(或更多个)物理容纳的容器。在连续工艺中,串联反应器允许模块化条件的设计。串联反应器的使用允许发生不同的条件/阶段,例如不同的温度、盐控制或不同比例的氧进料。串联反应器允许每个容器具有不同的条件,使得与并联反应器相比,在串联反应器中可以更好地管理条件。使用串联反应器提供更多控制点以及在系统管理方面的更多灵活性,例如在管理气体循环速率、压力操作、盐控制、不同温度、不同氧气进料比率方面的更多灵活性。串联反应器可以比并联反应器更有利地配置。
如果对于具有实际最大直径的单个发酵罐而言流体速度过高(例如,压降过高),则可使用并联发酵罐。如果高流体速度不是问题,则可以使用串联发酵罐,并且需要更长的反应路径和更多的气体注入/分散区,并且该路径比单个发酵罐的实际高度长。
串联和/或并联的反应器数量受到成本考虑的限制。一般来讲,可使用串联或并联的两个至三个反应器。
3.气体滞留率
气-液分散体中气相的体积分数称为气体滞留率,它决定了气体在液相中的停留时间,并影响可用于传质的气-液界面面积。气体滞留率取决于气体表观气体流速(ug),并且也是反应器几何形状的函数。液体循环速度通过气体滞留率和表观气体速度来控制。气体速度还取决于气泡大小、液体粘度和操作压力。
气体滞留率本身是通过气泡大小和生成方法来控制的。例如,气泡的运动速度起着一定作用,重要的是要防止气泡运动过快,否则气泡可能会过快凝结。另外,发酵液的特性需要有利于小气泡或微泡的形成和稳定性。对于本质上不发泡的含有h16野生型钩虫贪铜菌的发酵液,可添加表面活性剂,诸如
可控制气体滞留量(即,以分散的气泡形式保留在液相中的气体量),因为如果液相中的气体过多,则会过多地气泡,并且如果液相中的气体过少,则氧传质不足。例如,可通过增大操作压力和/或通过减小气泡大小(因为这会增加接触面积)来实现气体的传质。
为了减小气泡大小,应通过合适的装置将气体混合物引入发酵罐,以形成微泡或其他小气泡,并增强气相与主体液体之间的气-液界面。
在气体发酵罐中,诸如氧气的气体进入液相(发酵液)的传输速率通过液相传质系数(kl)、传质可用的总界面表面积(a)、与气相中的气体浓度处于平衡状态的气-液界面处的溶解气体浓度(c*)以及液体主体中的溶解气体浓度(c)来控制。传质系数(kl)和气-液界面面积(a)的单独确定很难评估,有时甚至无法评估。通常报告体积传质系数kla的组合项,而不仅仅是传质系数(kl)。对于氧气,氧传质速率(otr)表示为□
i)otr=kla*(do*-do)
其中do*为气-液界面处的溶解氧浓度,与气相(即,气泡)中的氧浓度处于平衡状态,并且do为液体(发酵液)主体中的溶解氧浓度。在稳态操作下,系统的氧传质速率(otr)必须等于摄氧率(our)。
体积传质系数(kla)是每单位驱动力的跨气-液界面的气体传递速率。体积传质系数受到会改变比表面积(a)的气泡大小影响,并且还取决于传质系数kl。气泡大小的减小将增加比界面面积,并因此增大体积传质系数。气泡的大小可通过使用合适的曝气装置来减小。kla是气泡直径、液体粘度、介质的表面张力、混合和雷诺数的函数。
在有氧生物工艺应用中,氧传递是放大研究中的重要参数之一。气体滞留率也是一个重要参数,因为它直接影响体积传质速率(kla)。气体分子从主体气体向细胞内的内容物运输的主要限制步骤是气-液膜处的界面。传质速率与有效面积和传递过程的驱动力成正比。
氧传质速率可通过各种方式调节。在一些方面,通过所述至少一种包含氧气的进料流的总流量或通过所述至少一种包含氧气的进料流中的氧浓度来调整流向发酵罐的氧气流量。在其他方面,可调整气体滞留率,例如发酵液内的氧气量。在其他方面,可调整气泡大小,例如,可相对于氧气体积调整用于氧传质的气-液界面表面积。在其他方面,可调整影响氧传质速率的发酵液物理特性。影响氧传质速率的物理特性包括例如表面张力、粘度、密度和温度。
4.微泡生成
为了改善kua,可操作工艺以产生具有尽可能小的大小(例如直径)的气泡,从而增大比表面积并增加气体向液相的传质。有若干种微泡发生器可用,例如膜、空泡泵、文丘里喷嘴和烧结块。
在错流膜微泡发生器中,经由膜将压缩气体引入腔室,并且在膜表面上形成的气泡被错流入口和液体切断。这种装置(例如,得自d&btech,spain)产生非常细小的气泡,并且适用于小规模的系统。该系统的优点包括:生成直径小于100微米的微泡,易于组装,可选择用蒸汽对膜进行灭菌以及调整气体和液体流量的能力。然而,也存在缺点,包括膜随时间推移的积垢/阻塞、潜在的低气体流量以及需要用于水错流的外部泵。
在离心泵/微泡发生器中,泵将发酵液中的空气/气体抽到泵的吸入口中,来自泵叶轮的高速旋转和剪切力会破坏气泡并提供非常细小的气泡或微泡射流。然而,如果整个发酵液都再循环,则高剪切力可能会破坏微生物细胞。即使在再循环之前经由膜分离对细胞进行了过滤,泵的活动部件、封垫、润滑剂和密封液也可能会影响发酵罐的无菌性。该系统的优点包括产生高度精细和致密的微泡(100微米-200微米),缺点包括具有可能影响无菌性的运动部件,进入系统的空气量极少(空气与液体流量之比为1∶10)以及由于高速度和高压力而在泵内产生高剪切力。
在文丘里微泡发生器中,文丘里喷嘴利用与喷嘴喉部处的压力和速度差有关的文丘里效应进行操作。文丘里喷嘴的内表面被设计成形成通过螺旋路径的高涡流,从而生成非常细小的微泡。文丘里系统适用于大规模连续气体发酵。液体通过具有运动部件的泵被泵送。气体的抽吸取决于动力液体形成的真空。该系统的优点包括:生成微泡(直径小于200微米),文丘里管本身没有运动部件,但该系统需要泵。缺点包括需要高速度和高流量的液体(例如发酵液)以生成微泡,文丘里管喉部的速度和压力的变化可能会导致微生物细胞产生剪切,并且需要若干个文丘里管装置将所需总体积流量的气体注入发酵罐中。
在烧结块中,多孔喷头由烧结玻璃、陶瓷或金属制成。这种类型的气泡发生器主要以实验室规模用于非搅拌式容器中。通常,由于喷头上的压降,气体的吞吐量较低。该系统的优点包括产生细小微泡的射流,缺点包括需要气体压缩器产生非常高压的气体以生成微泡,由于积垢而可能导致喷头堵塞,以及需要繁琐而费时的清洁过程。
多种溶解氧浓度测量点和控制方法
如本文所述,do浓度可在发芽液体中变化,特别是在高于大气压的压力下和/或在具有很少机械搅拌或没有机械搅拌的发酵罐中。使用一种或多种do浓度测量点和控制方法将do浓度和气态氧浓度保持在本文所述的极限内,同时保持our。
测量可基本上连续地进行,并被用于将来的调整。在一些方面,以定时间隔进行测量。将控制回路包括在内,以允许调整测量结果,并且允许整个发酵液中更均匀的氧气分布以及发酵罐顶部空间中的气态氧浓度。溶解氧浓度的测量可使用连续测量的溶解氧探头进行。顶部空间中气态氧的测量可通过任何具有足够短的测量周期时间的基本上连续的测量装置诸如气态氧探头或氧气分析仪(例如,拉曼激光气体分析仪、气相色谱分析仪、微型gc分析仪)来进行,以允许将顶部空间氧浓度连续控制在loc以下。
无论所述至少一种包含氧气的气态进料流是否有多个添加点,当使用非搅拌式生物反应器例如发酵罐时,诸如气升式外部回路发酵罐,测量发酵罐内多于一个位置(高度)的溶解氧浓度是有利的。溶解氧浓度通常在包含氧气的气态进料流的添加点附近最高,然后随着氧气和其他气态进料(例如co2、h2)反应而降低。每个溶解氧浓度都应保持在控制下限之上,该控制下限是钩虫贪铜菌关闭时的最小溶解氧浓度,并且应保持在氧抑制会限制生长并降低our的溶解氧浓度之下。此外,顶部空间气态混合物中的气态氧浓度必须保持在控制上限之下,该控制上限是低于易燃性极限氧浓度(loc)的安全系数。将每个测得的do浓度保持在尽可能接近最大比our(即,发酵罐中每单位质量生物质的最大摄氧率)也是有利的。
实施例
对于理解本公开有用的非限制性示例如下。
实施例1
制备h16野生型钩虫贪铜菌的比摄氧率(our)与溶解氧(do)浓度的动力学模型,并且示于图2a-b中。在大气操作压力下(图2a),最大比our出现在对应于约5%饱和度的do浓度下(基于0巴(g)和30℃下的空气)。在3.5巴(g)的高操作压力下(图2b),最大比our出现在对应于约1%饱和度的do浓度下(基于0巴(g)和30℃下的空气),而5%饱和度对应于高得多的do浓度以及最大our右侧的氧抑制区域中的显著降低的比our。
实施例2
图4示出了当至少一种包含氧气的气态进料流是空气进料流时用于顶部空间氧浓度和do浓度的一种控制方法。流向发酵罐的空气进料流量通过流量计(空气ft)测量,并通过调节空气流控制阀(空气fv)而由空气流控制器(空气fc)诸如比例-积分反馈控制器来控制。do浓度通过发酵液中的do探头测量。发酵罐的顶部空间内的氧气探头测量气态顶部空间中的氧浓度。do浓度控制器(doxc)和顶部空间氧浓度控制器(o2xc)竞争控制空气流量控制器设定值。控制空气流量设定值的控制器是具有最低输出的控制器,如通过低选器测得。所选的(最低)空气流量设定值作为反重置反馈信号被反馈到do浓度控制器和顶部空间氧浓度控制器,因此,两个控制器中任何一个不受控制的积分动作都不会导致控制器输出“终结”(饱和),从而使该控制器能够在其误差乘以比例增益使其输出成为较低输出信号时重新获得控制。顶部空间氧浓度控制器的设定值被设置为4体积%o2或以下(loc的-70%)。将do浓度控制器设定值设置为等于或低于过渡do浓度(在该值处出现最大比our)的值,以确保在比our与do浓度曲线的左侧进行操作。
实施例3
图5示出了h16野生型钩虫贪铜菌的比摄氧率(our)与溶解氧(do)浓度的动力学模型。它示出了在低于过渡do浓度下操作时,必须增大do浓度来提高比our;而在高于过渡do浓度下操作时,必须减小do浓度来提高比our。该模型说明,对于曲线左侧的操作,在出现最大比our的过渡do浓度之下,增大do浓度将提高比our,并且导致较低的残余氧浓度(较低的顶部空间氧浓度)。相反,对于曲线右侧的操作,在过渡do浓度之上,增大do浓度将降低比our,并且导致较高的残余氧浓度(较高的顶部空间氧浓度)。通过实时计算比our,可将比our的时间导数除以do浓度的时间导数,以确定比our相对于do浓度变化的变化是为正(曲线左侧,正斜率)还是为负(曲线右侧,负斜率)。由于工艺信号可能有噪声,因此应对时间导数进行滤波,使得仅计算比our和do浓度的真实偏移。然后,可通过在计算出的斜率为正时缓慢增大do浓度设定值并且在计算出的斜率为负时缓慢减小do浓度设定值,从而采用算法来最大化比our。
实施方案
设想以下实施方案。设想特征和实施方案的所有组合。
实施方案1:一种用于在连续有氧气体发酵工艺中控制溶解氧浓度的方法,所述方法包括:将微生物提供给发酵罐;将至少两种进料流引入发酵罐,其中至少一种进料流包含气态氧,并且其中至少一种进料流包含易燃气体和任选地氧浓度低于极限氧浓度(loc)的氧气;测量所述发酵罐中至少一个位置的溶解氧浓度;测量顶部空间中的气态氧浓度;以及控制所述发酵罐中的溶解氧浓度,使其大于所述微生物起作用所需的最小溶解氧浓度,并且小于所述顶部空间中的气态氧浓度超过极限氧浓度(loc)时的溶解氧浓度,其中如果所述微生物具有至少1mmol氧/(g干细胞重量)/小时的比摄氧率,则认为所述微生物起作用。
实施方案2:根据实施方案1所述的实施方案,其中溶解氧浓度通过调节以下项中的至少一项而调节氧传质速率来控制:i.所述至少一种包含气态氧的进料流的流量;ii所述至少一种包含气态氧的进料流中的氧浓度;iii.所述发酵罐内作为气泡的气体滞留量;iv.所述发酵罐内的所述气泡的大小;以及v.所述发酵液的影响氧传质速率的一种或多种物理特性。
实施方案3:根据实施方案2所述的实施方案,其中通过调整所述至少一种包含气态氧的进料流的总流量和/或通过调整所述至少一种包含气态氧的进料流中的氧浓度来调节所述至少一种包含气态氧的进料流的流量。
实施方案4:根据实施方案1至3中任一实施方案所述的实施方案,其中所述易燃气体包含氢气。
实施方案5:根据实施方案1至4中任一实施方案所述的实施方案,其中所述至少两种进料流中的至少一种进料流还包含二氧化碳。
实施方案6:根据实施方案1至5中任一实施方案所述的实施方案,其中所述发酵罐选自由以下项组成的组:单个发酵罐、串联的多个发酵罐、膜发酵罐、固定床发酵罐、流化床发酵罐、单个高压釜、串联的多个高压釜、活塞流发酵罐、气动搅拌发酵罐、带有具有强制循环的外部回路的气升式发酵罐、鼓泡塔发酵罐、固定(填充)床塔式发酵罐、带多个隔室的卧式单个发酵罐和多级塔式发酵罐。
实施方案7:根据实施方案1至6中任一实施方案所述的实施方案,其中所述发酵罐不是搅拌式发酵罐。
实施方案8:根据实施方案1至7中任一实施方案所述的实施方案,其中不对所述发酵罐进行机械搅拌。
实施方案9:根据实施方案1至8中任一实施方案所述的实施方案,其中所述微生物依赖于化能自养代谢/rubisco。
实施方案10:根据实施方案1至9中任一实施方案所述的实施方案,其中所述微生物为含rubisco的微生物。
实施方案11:根据实施方案1至10中任一实施方案所述的实施方案,其中所述微生物选自罗尔斯通菌属(ralstonia)、沃特氏菌属(wausteria)、贪铜菌属(cupriavidus)、产碱杆菌属(alcaligenes)、伯克氏菌属(burkholderia)或潘多拉菌属(pandoraea)的非致病性成员。
实施方案12:根据实施方案1至11中任一实施方案所述的实施方案,其中所述微生物为钩虫贪铜菌(c.necator)或耐金属贪铜菌(c.metalliduruns)。
实施方案13:根据实施方案1至12中任一实施方案所述的实施方案,其中所述发酵罐在高于大气压的压力下操作。
实施方案14:根据实施方案1至13中任一实施方案所述的实施方案,其中所述方法还包括:测量所述发酵罐的顶部空间中的气态氧浓度;以及将所述顶部空间中的气态氧浓度控制为小于所述发酵罐的所述顶部空间中的所述气态混合物的极限氧浓度(loc)的75%。
实施方案15:根据实施方案1至14中任一实施方案所述的实施方案,其中所述发酵罐包括至少两个氧添加入口。
实施方案16:根据实施方案1至15中任一实施方案所述的实施方案,其中所述至少一种包含气态氧的进料流为空气进料流、富氧空气流或纯氧流。
实施方案17:一种用于有氧气体发酵工艺的发酵罐系统,所述系统包括:发酵罐,所述发酵罐包括至少两个氧添加点;所述发酵罐中的微生物;以及至少两个控制回路,其中至少一个控制回路测量和控制所述发酵罐中的发酵液中的溶解氧含量,使其大于所述微生物起作用所需的最小溶解氧浓度,并且其中至少一个控制回路测量和控制所述发酵罐的顶部空间中的气态氧浓度,使其不超过loc,其中如果所述微生物具有至少1mmol氧/(g干细胞重量)/小时的比摄氧率,则认为所述微生物起作用。
实施方案18:根据实施方案17所述的实施方案,其中所述系统包括串联的至少两个发酵罐。
实施方案19:根据实施方案17或18所述的实施方案,其中所述系统包括并联的至少两个发酵罐。
实施方案20:根据实施方案17至19中任一实施方案所述的实施方案,其中所述发酵罐选自由以下项组成的组:单个发酵罐、串联的多个发酵罐、膜发酵罐、固定床发酵罐、流化床发酵罐、单个高压釜、串联的多个高压釜、活塞流发酵罐、气动搅拌发酵罐、带有具有强制循环的外部回路的气升式发酵罐、鼓泡塔发酵罐、固定(填充)床塔式发酵罐、带有多个隔室的卧式单个发酵罐和多级塔式发酵罐。
实施方案21:根据实施方案17至20中任一实施方案所述的实施方案,其中所述发酵罐在高于大气压的压力下操作。
实施方案22:根据实施方案1至16中任一实施方案所述的实施方案,其中将溶解氧浓度控制为低于过渡溶解氧浓度的值。
虽然已经详细描述了本公开,但在本公开的实质和范围内的修改对于本领域的技术人员将是显而易见的。应当理解,本公开的各方面以及上文和/或所附权利要求中陈述的各种实施方案和各种特征的部分可整体或部分地组合或互换。在各种实施方案的前述描述中,如本领域的普通技术人员将理解的那样,可将参考另一实施方案的那些实施方案与其他实施方案适当地组合。此外,本领域的普通技术人员将理解,前述说明仅以举例的方式,并不旨在限制本公开。本文引用的所有美国专利和出版物均全文以引用方式并入。本文引用的参考文献的完整详细信息如下:
k.t.klasson、m.d.ackerson、e.c.clausen和j.l.gaddy,“fermenterdesignforsyntheticgasfermentations”,fuel(1991),70,605-614。
ishizakia、tanakak、tagan(2001)microbialproductionofpoly-d-3-hydroxybutyratefromco2.applmicrobiolbiotechnol57:6-12。
k.tanaka1994productionofpoly-d-3-hydroxybutyricacidfromcarbondioxidebyatwostageculturemethodemployingalcaligeneseutrophusatcc17697
maddipatip1、atiyehhk、bellmerdd、huhnkerl。ethanolproductionfromsyngasbyclostridiumstrainp11usingcomsteepliquorasanutrientreplacementtoyeastextract.bioresouretechnol.2011年六月;102(11):6494-501。
jugderb-e、chenz、pingdtt、lebharh、welchj、marquiscp。ananalysisofthechangesinsolublehydrogenaseandglobalgeneexpressionincupriavidusnecator(ralstoniaeutropha)h16growninheterotrophicdiauxicbatchculture.microbialcellfactories.2015;14:42.doi:10.1186/s12934-015-0226-4。
cjbrigham、csgai、jlu、drspeth、rmworden、ajsinskey。engineeringralstoniaeutrophaforproductionofisobutanolfromco2,h2ando2.advancedbiofuelsandbioproducts(2013)第39章,springerscienceandbusiness,newyork
phillips,j.r.;huhnke,r.l.;atiyeh,h.k。syngasfermentation:amicrobialconversionprocessofgaseoussubstratestovariousproducts.fermentation2017,3,28。
gwjones、rekenny的preventionofgasexplosionsbycontrollingoxygenconcentration.industrialandengineeringchemistry1935,27,1344-1346。
- 还没有人留言评论。精彩留言会获得点赞!