个体化检测癌症复发或转移和/或评估治疗反应的方法与流程
相关申请的交叉引用
本申请要求于2019年3月18日提交的美国非临时专利申请系列号16/356,693的优先权,其要求于2018年3月16日提交的美国临时专利申请系列号62/643,827的优先权,这些专利申请的全部内容通过引用并入本文。
本公开总体上提供了用于个体化检测癌症复发或转移(特别是在其早期阶段)的方法和材料。本公开还提供了用于评估抗癌疗法的功效的方法和材料。
背景技术:
对于正在接受癌症治疗的受试者和那些处于缓解的受试者而言,复发和转移是主要关注的问题。实际上,在治疗后的前两年内受试者通常处于最高的复发风险。在http://www.cancer.net/blog/2017-05/understanding-risk-late-recurrence-breast-cancer,可获取understandingtheriskoflaterecurrenceofbreastcancer,cancer.net,其公开于2017年5月25日,于2017年10月24日访问。不幸的是,大量的受试者将经历复发或转移。
研究表明,对于实体癌,癌症的转移扩散导致超过90%的癌症相关死亡。此外,研究表明,多种常见癌症的许多受试者都发生了复发。例如,一项研究表明,在初始治疗后缓解的结直肠癌受试者中约有30%会复发。同样,患有前列腺癌的受试者在接受局部癌症的前列腺切除术后,终生复发的机会为10%-30%。对于非小细胞肺癌,约50%的受试者会复发。被诊断为患有卵巢癌的受试者的复发率甚至更高,约为70%。
此外,微小残留疾病(mrd)是指在治疗期间或治疗后(甚至当受试者处于缓解时)残留在受试者中的少量癌细胞,其是血液系统癌症或恶性肿瘤复发或转移的重要原因。mrd的检测对于血液系统癌症或恶性肿瘤的管理至关重要。检测mrd极为困难,需要使用能够检测组织样本中微量水平癌症(例如癌细胞)的高灵敏度检测方法。由于与mrd检测相关的困难,经常不监测患有血液系统癌症的受试者的mrd,也不检测复发或转移,直到受试者表现出与其原始的血液系统癌症或恶性肿瘤相关的症状。此外,患有mrd的那些受试者通常不进行常规筛选,以确定他们的mrd是稳定的还是正在进行的。因此,这些受试者在知道他们的mrd可能导致复发时,只能等待,观察症状是否复发。
通常,直到癌症已经发展到可通过影像学扫描(例如ct扫描)检测到的大小,才能检测到癌症的复发或转移。等到通过影像学可检测到癌症,可能使治疗复杂化、减少受试者的治疗选择、并增加需要侵入性治疗的可能性。此外,诊断复发或转移的延迟会导致受试者的预后较差。这会增加受试者的治疗后焦虑,甚至缓解后的焦虑。因此,需要一种比传统方法能够更快地检测复发或转移、并且对于受试者而言不麻烦和较少侵入性的方法。
技术实现要素:
本公开涉及用于检测癌症的复发或转移的方法和材料。
本公开提供了用于检测受试者中癌症的复发的方法,所述受试者包括,例如他或她的癌症已经被诊断为缓解的受试者。所述方法可以包括在施用抗癌疗法之前,从受试者获得生物样本(例如,来自癌症的一个或多个细胞);检测生物样本中的一个或多个基因突变,包括,例如,产生受试者的基因谱;在对受试者施用抗癌疗法后,从受试者获得液体活检物;以及检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于生物样本中(例如,包括从生物样本产生的基因谱)时,癌症已经复发。或者,当在液体活检物中没有检测到基因谱中的一个或多个突变时,则癌症没有复发。在优选的实施方案中,液体活检物是在受试者被诊断为无癌症(例如,处于缓解中)之后从受试者获得的。以这种方式,本文公开的方法可以用于监测受试者先前已经进入缓解的癌症的复发。另外,该方法通过确定在用抗癌疗法治疗之后癌症是否已经复发,可用于监测癌症疗法的有效性(例如,治疗效果)。
在每个或任何上文或下文提到的实施方案的一些实施方案中,当液体活检物中存在基因谱中的一个突变时,确定癌症已经复发。在其他实施方案中,当液体活检物中存在基因谱中的两个、三个、四个、五个、六个、七个、八个、九个、十个或更多个突变时,确定癌症已经复发。在其他实施方案中,当液体活检物中检测到基因谱中的所有突变时,确定癌症已经复发。
在每个或任何上文或下文提到的实施方案的一些实施方案中,生物样本来自癌症。在一些实施方案中,生物样本是新鲜的组织样本。在其他实施方案中,组织样本来自肿瘤活检物。在又一个实施方案中,组织样本是福尔马林固定的石蜡包埋的(ffpe)组织样本。
在每个或任何上文或下文提到的实施方案的一些实施方案中,生物样本包含具有不同病理形态的一个或多个区域。在一些实施方案中,生物样本从具有最高侵袭性的病理形态的一个或多个区域获得。
在每个或任何上文或下文提到的实施方案的一些实施方案中,使用下一代测序在生物样本中检测一个或多个突变。在一些实施方案中,使用下一代测序在生物样本中检测到的一个或多个突变用于产生受试者的基因谱。
在每个或任何上文或下文提到的实施方案的一些实施方案中,液体活检物是抽吸物、血液、血浆、血清、痰、尿液或唾液。在一个优选的实施方案中,液体活检物是血液样本。在一些实施方案中,在向受试者施用抗癌疗法之后,包括,例如,在向受试者施用抗癌疗法之后的预定时间段,例如在受试者的癌症已经被诊断为处于缓解中之后,从受试者获得液体活检物。可以每一个月、两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、十二个月、十三个月、十四个月、十五个月、十六个月、十七个月、十八个月、十九个月、二十个月、二十一个月、二十二个月、二十三个月、二十四个月或更多个月从受试者获得液体活检物。在其他实施方案中,每一年、两年、三年、四年、五年、六年、七年、八年、九年、十年或更多年从受试者获得液体活检物。在其他实施方案中,在一个或多个预定时间段,包括,例如,由医生设置的一个或多个预定时间段,从受试者获得液体活检物。在一些实施方案中,每三个月(例如,每季度)一次从受试者获得液体活检物。在其他实施方案中,大约每三个月一次从受试者获得液体活检物,持续连续两年的期间。
在每个或任何上文或下文提到的实施方案的一些实施方案中,使用微滴式数字pcr或下一代测序进行生物样本中的一个或多个基因突变的检测步骤。
在每个或任何上文或下文提到的实施方案的一些实施方案中,液体活检物中一个或多个基因突变的检测用于产生受试者的基因谱。
在每个或任何上文或下文提到的实施方案的一些实施方案中,通过确定生物样本中的一个或多个基因突变的频率、并选择一个或多个基因突变包括在基因谱中,来产生基因谱,其中一个或多个基因突变的频率高于阈值量。在一些实施方案中,通过确定一个或多个基因突变在染色体上的位置、并选择一个或多个基因突变包括在基因谱中,来产生基因谱,其中一个或多个基因突变位于不同的染色体上。
在每个或任何上文或下文提到的实施方案的一些实施方案中,癌症选自胃肠癌、前列腺癌、卵巢癌、乳腺癌、头颈癌、肺癌、非小细胞肺癌、神经系统癌、肾癌、视网膜癌、皮肤癌、肝癌、胰腺癌、泌尿生殖器癌、结直肠癌、肾癌、血液系统癌症、血液系统疾病、血液系统恶性肿瘤、微小残留疾病和膀胱癌。
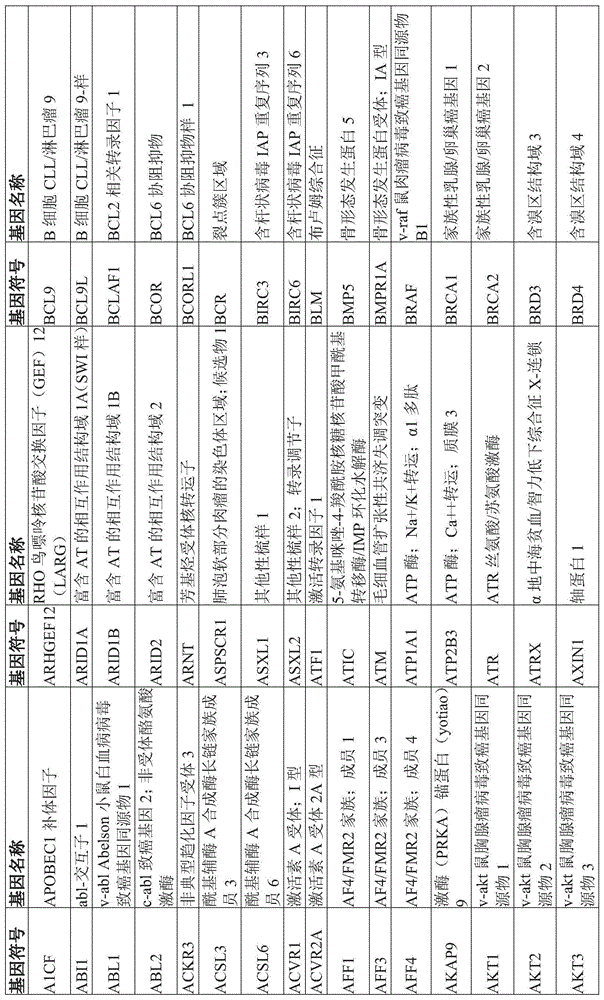
在每个或任何上文或下文提到的实施方案的一些实施方案中,一个或多个突变选自图1中列出的那些突变。
本公开提供了用于检测受试者中癌症的复发的方法,所述受试者包括,例如他或她的癌症进入缓解中的受试者。所述方法可以包括在施用抗癌疗法之前,从受试者获得生物样本(例如,来自癌症的一个或多个细胞);检测生物样本中的一个或多个基因突变,以产生受试者的基因谱;在对受试者施用抗癌疗法后,从受试者获得液体活检物;以及检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于基因谱中时,癌症已经复发。或者,当在液体活检物中没有检测到基因谱中的一个或多个突变时,则癌症没有复发。在优选的实施方案中,液体活检物是在受试者被诊断为无癌症(例如,处于缓解中)之后从受试者获得的。
本公开还提供了用于检测受试者中癌症的复发的方法,所述受试者包括,例如他或她的癌症进入缓解中的受试者。所述方法可以包括在施用抗癌疗法之前,从受试者获得生物样本(例如,来自癌症的一个或多个细胞);检测生物样本中的一个或多个基因突变,以产生受试者的基因谱;在对受试者施用抗癌疗法后,每三个月从受试者获得液体活检物,持续连续的两年;以及检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于基因谱中时,癌症已经复发。或者,当在液体活检物中没有检测到基因谱中的一个或多个突变时,则癌症没有复发。在优选的实施方案中,液体活检物是在受试者被诊断为无癌症(例如,处于缓解中)之后从受试者获得的。
本公开还提供了用于检测受试者中癌症的复发的方法,所述受试者包括,例如他或她的癌症进入缓解中的受试者。所述方法可以包括在施用抗癌疗法之前,从受试者获得生物样本(例如,来自癌症的一个或多个细胞);检测生物样本中的一个或多个基因突变,以产生受试者的基因谱;在对受试者施用抗癌疗法后,每三个月从受试者获得液体活检物,持续连续的两年;以及检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于基因谱中时,癌症已经复发。或者,当在液体活检物中没有检测到基因谱中的一个或多个突变时,则癌症没有复发。在优选的实施方案中,液体活检物是在受试者被诊断为无癌症(例如,处于缓解中)之后从受试者获得的。
本公开提供了用于检测受试者中的转移的方法和材料。所述方法可以包括(例如,在施用抗癌疗法之前),从受试者获得生物样本(例如,来自癌症的一个或多个细胞);检测生物样本中的一个或多个基因突变,以产生受试者的基因谱;(例如,在对受试者施用抗癌疗法后),从受试者获得液体活检物;以及检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于基因谱中时,转移已经发生。或者,当在液体活检物中没有检测到基因谱中的一个或多个突变时,则转移没有发生。在优选的实施方案中,液体活检物是在受试者被诊断为无癌症(例如,处于缓解中)之后从受试者获得的。以这种方式,本文公开的方法可以用于监测受试者的转移。另外,该方法通过确定在用抗癌疗法治疗之后转移是否已经形成,可用于监测癌症疗法的有效性(例如,治疗效果)。
本公开提供了用于检测受试者中的微小残留疾病的方法和材料。所述方法可以包括(例如,在施用抗癌疗法之前),从受试者获得生物样本(例如,来自癌症的一个或多个细胞);检测生物样本中的一个或多个基因突变,以产生受试者的基因谱;(例如,在对受试者施用抗癌疗法后),从受试者获得液体活检物;以及检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于基因谱中时,微小残留疾病已经发生。或者,当在液体活检物中没有检测到基因谱中的一个或多个突变时,则微小残留疾病没有发生。在优选的实施方案中,液体活检物是在受试者被诊断为无癌症(例如,处于缓解中)之后从受试者获得的。以这种方式,本文公开的方法可以用于监测受试者的微小残留疾病。另外,该方法通过确定在用抗癌疗法治疗之后微小残留疾病是否已经形成,可用于监测癌症疗法的有效性(例如,治疗效果)。
本公开提供了用于监测具有微小残留疾病的受试者的方法和材料。所述方法可以包括:从受试者获得第一液体活检物、从第一液体活检物产生一个或多个基因的第一基因谱、在预定时间段(例如一个月、两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、十二个月、两年、三年、四年、五年、六年、七年、八年、九年、十年、十一年、十二年、十三年、十四年、十五年、十六年、十七年、十八年、十九年、二十年)之后从受试者获得第二液体活检物、以及从第二液体活检物产生一个或多个基因的第二基因谱,其中当在第二基因谱中检测到第一基因谱中未检测到的一个或多个突变时,受试者已经复发(例如,受试者过去曾接接受治疗的癌症已经复发)。备选地,当在第二基因谱中没有检测到第一基因谱中未检测到的突变时,受试者没有复发。在优选的实施方案中,液体活检物是在受试者被诊断为无癌症(例如,处于缓解中)之后从受试者获得的。另外,该方法通过确定在用抗癌疗法治疗之后微小残留疾病是否已经形成,可用于监测癌症疗法的有效性(例如,治疗效果)。
在每个或任何上文或下文提到的实施方案的一些实施方案中,所述方法进一步包括确定来自第一液体活检物的一个或多个基因中的一个或多个突变的数目的步骤,以生成检测到的一个或多个突变的基线。在一些实施方案中,所述方法进一步包括确定来自第二液体活检物的一个或多个基因中的一个或多个突变的数目,以与基线进行比较,其中如果来自第二液体活检物的一个或多个基因中的一个或多个突变的数目已经超过基线,则受试者已经复发。在其他实施方案中,受试者患有血液系统恶性肿瘤。
本公开还提供了治疗受试者的癌症的方法。这样的方法可以包括在向受试者施用第一抗癌疗法之前,从受试者获得癌症的生物样本;在向受试者施用第一抗癌疗法之前,检测生物样本中的一个或多个基因突变以产生受试者的基因谱;向受试者施用第一抗癌疗法;在向受试者施用第一抗癌疗法之后,从受试者获得液体活检物;检测液体活检物中的一个或多个基因突变,其中在液体活检物中检测到基因谱中的一个或多个突变时,癌症已经复发;以及当癌症已经复发时,向受试者施用第二抗癌疗法。
在每个或任何上文或下文提到的实施方案的一些实施方案中,第一抗癌疗法与第二抗癌疗法相同。在每个或任何上文或下文提到的实施方案的一些实施方案中,第一抗癌疗法与第二抗癌疗法不同。
在每个或任何上文或下文提到的实施方案的一些实施方案中,生物样本是癌症。在一些实施方案中,生物样本是新鲜的组织样本。在其他实施方案中,组织样本来自肿瘤活检物。在又一个实施方案中,组织样本是福尔马林固定的石蜡包埋的组织样本。
在每个或任何上文或下文提到的实施方案的一些实施方案中,使用下一代测序在生物样本中检测一个或多个突变。在一些实施方案中,使用下一代测序在生物样本中检测到的一个或多个突变用于产生受试者的基因谱。
在每个或任何上文或下文提到的实施方案的一些实施方案中,液体活检物是抽吸物、血液、血浆、血清、痰、尿液或唾液。在一些实施方案中,液体活检物是血液样本。在一些实施方案中,在向受试者施用抗癌疗法之后,包括,例如,在向受试者施用抗癌疗法之后的预定时间段,例如在受试者的癌症已经进入缓解中之后,从受试者获得液体活检物。在其他实施方案中,可以每一个月、两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、十二个月、十三个月、十四个月、十五个月、十六个月、十七个月、十八个月、十九个月、二十个月、二十一个月、二十二个月、二十三个月、二十四个月或更多个月从受试者获得液体活检物。在其他实施方案中,每一年、两年、三年、四年、五年、六年、七年、八年、九年、十年或更多年从受试者获得液体活检物。在其他实施方案中,在一个或多个预定时间段,包括,例如,由医生设置的一个或多个预定时间段,从受试者获得液体活检物。在一些实施方案中,每三个月一次(例如每季度一次)从受试者获得液体活检物。在其他实施方案中,大约每三个月一次从受试者获得液体活检物,持续两年的期间。
在每个或任何上文或下文提到的实施方案的一些实施方案中,使用微滴式数字pcr或下一代测序进行生物样本中的一个或多个基因突变的检测步骤。
在每个或任何上文或下文提到的实施方案的一些实施方案中,液体活检物中一个或多个基因突变的检测用于产生受试者的基因谱。
在每个或任何上文或下文提到的实施方案的一些实施方案中,癌症选自胃肠癌、前列腺癌、卵巢癌、乳腺癌、头颈癌、肺癌、非小细胞肺癌、神经系统癌、肾癌、视网膜癌、皮肤癌、肝癌、胰腺癌、泌尿生殖器癌、结直肠癌、肾癌和膀胱癌。
在每个或任何上文或下文提到的实施方案的一些实施方案中,一个或多个突变选自图1中列出的那些突变。
本公开进一步提供了向患有癌症的受试者施用抗癌疗法的方法。这样的方法可以包括:在向受试者施用第一抗癌疗法后(例如,在受试者的癌症进入缓解中后),从受试者获得液体活检物;检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于从抗癌疗法治疗之前的受试者获得的基因谱中时,癌症已经发生复发;以及一旦检测到癌症复发,则向受试者施用第二抗癌疗法。
在每个或任何上文或下文提到的实施方案的一些实施方案中,第一抗癌疗法与第二抗癌疗法相同。在每个或任何上文或下文提到的实施方案的一些实施方案中,第一抗癌疗法与第二抗癌疗法不同。
在每个或任何上文或下文提到的实施方案的一些实施方案中,生物样本是癌症。在一些实施方案中,生物样本是新鲜的组织样本。在其他实施方案中,组织样本来自肿瘤活检物。在又一个实施方案中,组织样本是福尔马林固定的石蜡包埋的组织样本。
在每个或任何以上或以下提到的实施方案的一些实施方案中,液体活检物是抽吸物、血液、血浆、血清、痰、尿液或唾液。在一些实施方案中,液体活检物是血液样本。在一些实施方案中,在向受试者施用抗癌疗法之后,包括,例如,在向受试者施用抗癌疗法之后的预定时间段,从受试者获得液体活检物。在其他实施方案中,可以每一个月、两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、十二个月、十三个月、十四个月、十五个月、十六个月、十七个月、十八个月、十九个月、二十个月、二十一个月、二十二个月、二十三个月、二十四个月或更多个月从受试者获得液体活检物。在其他实施方案中,每一年、两年、三年、四年、五年、六年、七年、八年、九年、十年或更多年从受试者获得液体活检物。在其他实施方案中,在一个或多个预定时间段,包括,例如,由医生设置的一个或多个预定时间段,从受试者获得液体活检物。在一些实施方案中,每三个月(例如,每季度)一次从受试者获得液体活检物。在其他实施方案中,大约每三个月一次从受试者获得液体活检物,持续两年的期间。
在每个或任何上文或下文提到的实施方案的一些实施方案中,使用微滴式数字pcr或下一代测序进行生物样本中的一个或多个基因突变的检测步骤。
在每个或任何上文或下文提到的实施方案的一些实施方案中,液体活检物中一个或多个基因突变的检测用于产生受试者的基因谱。
在每个或任何上文或下文提到的实施方案的一些实施方案中,癌症选自胃肠癌、前列腺癌、卵巢癌、乳腺癌、头颈癌、肺癌、非小细胞肺癌、神经系统癌、肾癌、视网膜癌、皮肤癌、肝癌、胰腺癌、泌尿生殖器癌、结直肠癌、肾癌、血液系统癌症、血液系统疾病、血液系统恶性肿瘤、微小残留疾病和膀胱癌。
在每个或任何上文或下文提到的实施方案的一些实施方案中,一个或多个突变选自图1中列出的那些突变。
本公开还提供了用于评估抗癌疗法的功效的方法。所述方法可以包括在向受试者施用抗癌疗法之前,从受试者获得癌症的生物样本;检测生物样本中的一个或多个基因突变以产生受试者的基因谱;向受试者施用第一抗癌疗法;在向受试者施用抗癌疗法之后,从受试者获得液体活检物;以及检测液体活检物中的一个或多个基因突变,其中在液体活检物中检测到基因谱中的一个或多个突变时,抗癌疗法无效。
附图说明
图1是可以在生物样本或液体活检物中检测到的突变的示例性列表。
具体实施方式
检测癌症的复发或转移对于确保及时有效的癌症治疗至关重要。早期检测还可以减少此类治疗的侵入性、最大程度地减少应对复发或转移所需的治疗次数、降低总体治疗成本、并减轻患者对复发或转移可能性的焦虑。当前用于检测癌症的复发或转移的方法在很大程度上依赖于影像学扫描。结果,复发或转移性癌症必须已经发展到可以在这种扫描上被看到的时期,以被检测。通常,这意味着肿瘤一定已经发展并生长到足以明确诊断的大小。在此时间点,治疗的选择可能会更复杂、时间更长且更昂贵。更糟糕的是,某些治疗选项可能不再可行,并且受试者的预后可能比最初的诊断差。另外,决定使用何种癌症疗法可以取决于对肿瘤组织样本或标本中基因突变的检测。但是,许多受试者患有的癌症无法手术或不允许以其他方式收集组织样本,例如晚期癌症或患有复发性肿瘤的受试者的情况。这妨碍了这些受试者接受针对其癌症的靶向治疗。因此,需要能够在传统影像学扫描上可以看到肿瘤的发展或其他生长的早期和之前,用于检测癌症的复发或转移的方法。期望这样的方法是侵入性最小的,并且可以用于常规地监测受试者。此外,期望这样的方法能够检测液体样本中的基因突变,以用于确定应使用哪一种或哪几种癌症疗法,以及用于确定抗癌疗法的功效。
本文提供了用于检测癌症包括癌症复发的方法。这样的方法可以检测生物标本中的基因突变(例如,与癌症相关的突变),所述生物标本包括,例如基于液体的标本,例如血液、血浆和尿液等。因此,这些方法可以克服基于组织的技术的临床限制。另外,用本文提供的方法检测的突变可以为患有癌症的受试者提供信息并选择合适的治疗方案(例如靶向疗法)。
本公开提供了用于检测受试者中癌症的复发的方法和材料。所述方法可以包括:在施用抗癌疗法之前,从受试者获得生物样本(例如,ffpe组织样本);检测生物样本中的一个或多个基因突变,以产生受试者的基因谱;在对受试者施用抗癌疗法后(例如,每三个月一次),从受试者获得液体活检物(例如,血液样本);以及检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于基因谱中时,已经发生癌症的复发。这样的方法尤其可以用于监测患者的癌症复发、或用于评估抗癌疗法的有效性(例如,疗法有效性或反应性)。
本公开提供了用于检测受试者中的转移的方法和材料。所述方法可以包括:在施用抗癌疗法之前,从受试者获得生物样本(例如,ffpe组织样本);检测生物样本中的一个或多个基因突变,以产生受试者的基因谱;在对受试者施用抗癌疗法后(例如,每三个月一次),从受试者获得液体活检物(例如,血液样本);以及检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于基因谱中时,已经发生转移。这样的方法尤其可以用于监测患者的转移、或用于评估抗癌疗法的有效性(例如,疗法有效性或反应性)。
本公开提供了用于监测具有微小残留疾病(mrd)的受试者的方法和材料。所述方法可以包括:从受试者获得第一液体活检物、从第一液体活检物产生一个或多个基因的第一基因谱、在预定时间段(例如一个月、两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、十二个月、两年、三年、四年、五年、六年、七年、八年、九年、十年、十一年、十二年、十三年、十四年、十五年、十六年、十七年、十八年、十九年、二十年)之后从受试者获得第二液体活检物、以及从第二液体活检物产生一个或多个基因的第二基因谱,其中当在第二基因谱中检测到第一基因谱中未检测到的一个或多个突变时,受试者已经复发。备选地,当在第二基因谱中没有检测到第一基因谱中未检测到的突变时,受试者没有复发。在优选的实施方案中,液体活检物是在受试者被诊断为无癌症(例如,处于缓解中)之后从受试者获得的。另外,该方法通过确定在用抗癌疗法治疗之后微小残留疾病是否已经形成,可用于监测癌症疗法的有效性(例如,治疗效果)。
在每个或任何上文或下文提到的实施方案的一些实施方案中,所述方法进一步包括确定来自第一液体活检物的一个或多个基因中的一个或多个突变的数目,以生成检测到的一个或多个突变的基线(例如,突变的参考数目)。在一些实施方案中,所述方法进一步包括确定来自第二液体活检物的一个或多个基因中的一个或多个突变的数目,以与基线进行比较,其中如果来自第二液体活检物的一个或多个基因中的一个或多个突变的数目已经增加超过基线(例如,第二液体活检物中的突变数目大于第一液体活检物中的突变数目),则受试者已经复发(例如,其癌症已经重新发展)。在其他实施方案中,受试者患有血液系统恶性肿瘤。
本公开还提供了用于治疗受试者的癌症的方法。这样的方法可以包括在向受试者施用抗癌疗法之前,从受试者获得癌症的生物样本;在向受试者施用抗癌疗法之前,检测生物样本中的一个或多个基因突变以产生受试者的基因谱;向受试者施用抗癌疗法;在向受试者施用抗癌疗法之后,从受试者获得液体活检物;检测液体活检物中的一个或多个基因突变,其中在液体活检物中检测到一个或多个突变时,癌症已经复发;以及当癌症已经复发时,向受试者施用抗癌疗法。在一些实施方案中,检测到癌症复发后施用的抗癌疗法与在癌症复发之前向受试者施用的抗癌疗法不同。
本公开进一步提供了向患有癌症的受试者施用抗癌疗法的方法。这样的方法可以包括:在向受试者施用抗癌疗法之后从受试者获得液体活检物;检测液体活检物中的一个或多个基因突变,其中当液体活检物中检测到的一个或多个突变存在于由施用抗癌疗法之前的癌症产生的基因谱中时(例如,一个或多个基因突变存在于基因谱中),癌症已经复发;以及当检测到癌症复发时,向受试者施用抗癌疗法。在一些实施方案中,检测到癌症复发之后施用的抗癌治疗与先前向受试者施用的任何抗癌疗法不同。
本公开还提供了用于评估抗癌疗法的功效的方法。所述方法可以包括在向受试者施用抗癌疗法之前,从受试者获得癌症的生物样本;检测生物样本中的一个或多个基因突变以产生受试者的基因谱;向受试者施用第一抗癌疗法;在向受试者施用抗癌疗法之后,从受试者获得液体活检物;以及检测液体活检物中的一个或多个基因突变,其中在液体活检物中检测到基因谱中的一个或多个突变时,抗癌疗法无效。
检测癌症的复发或转移
发明人发现癌症与独特的基因标识(geneticsignature,例如,独特的基因谱)相关,该基因标识可用于确定癌症的复发和/或监测抗癌疗法的有效性或反应性。出人意料的是,复发的癌症通常与基因标识相关,这种基因标识与最初用抗癌剂治疗的癌症的基因标识相似,如果不相同的话。因此,从抗癌剂治疗之前的受试者获得的生物样本(例如ffpe组织样本,例如,ffpe癌组织样本)中鉴定的基因突变的模式可用于产生对受试者癌症特异的基因谱。基因谱随后可用于通过检测从抗癌剂治疗后的受试者(包括,例如受试者已经进入缓解之后)获得的血液样本中的基因突变(包括基因突变的相同模式)来确定癌症是否复发。以这种方式,本文公开的方法提供了确定受试者中癌症是否已经复发的个体化方法,并且任选地使用该信息策划医学治疗或干预。
本公开还提供了用于检测受试者中癌症的复发的方法和材料。所述方法可以包括:在施用抗癌疗法之前,从受试者获得生物样本(例如,ffpe组织样本);检测生物样本中的一个或多个基因突变(包括,例如体细胞突变),以产生受试者的基因谱;在对受试者施用抗癌疗法后(包括,例如,受试者已经进入缓解后),从受试者获得液体活检物(例如,血液样本);以及检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于基因谱中时,癌症已经复发。
本公开还提供了用于检测受试者中的转移的方法和材料。所述方法可以包括在施用抗癌疗法之前,从受试者获得生物样本;检测生物样本中的一个或多个基因突变(包括,例如体细胞突变),以产生受试者的基因谱;从受试者(包括,例如在对受试者施用抗癌疗法后)获得液体活检物;以及检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于基因谱中时,转移已经发生。
在一些实施方案中,在生物样本或液体活检物中对一个或多个基因突变的检测用于产生受试者的基因谱。基因谱可以包含关于检测到的基因突变的身份、拷贝数和/或表达水平的信息。
可以在向受试者施用抗癌疗法之前产生受试者的基因谱,以在癌症暴露于抗癌疗法之前确定导致癌症的基因突变,所述抗癌疗法可能影响其基因组成和基因表达。受试者的基因谱中包含的信息对于受试者和受试者的癌症都是独特的,并且可以对受试者的复发或转移进行高度敏感的个体化监控。
本文还提供了用于本公开的方法中的基因谱以及制备此类谱的方法。在这样的方法中,可以基于若干标准选择包含在基因谱中的突变,所述标准包括但不限于生物样本中的突变频率、由突变代表的染色体、和/或由突变代表的病理形态。
可以基于其在生物样本中的发生频率来选择包含在基因谱中的突变,因为并非生物样本中的每个细胞都可以包含突变。相反,突变可能仅出现在生物样本的一部分中(例如,出现在生物样本中的一些细胞中)。因此,可以选择突变以包括在基因谱中,其中其在生物样本中的频率高于阈值量,包括例如基于包含突变的那些细胞相对于生物样本中细胞总数(或估计总数)的百分比。例如,可以选择突变以包括在基因谱中,其中突变的频率为生物样本中细胞总数(例如,估计的细胞总数)的至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。
另外,突变可以包括在基因谱中,其中它代表未被该基因谱中的其他突变所代表(或未被充分代表)的染色体。以这种方式,优选地为基因谱选择突变,以提供若干染色体的代表,包括,例如2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22或23条染色体。
此外,可以选择基因谱中包括的一个或多个突变以代表特定的病理形态。生物样本可以在样本内的不同位置包含不同的病理形态。一些区域可能具有指示癌症或恶性肿瘤的侵袭性形式的病理形态。其他区域可能表现出较弱侵袭性的病理形态。在一些实施方案中,选择代表生物样本中最具侵袭性的病理形态的突变。在其他实施方案中,选择代表不同(例如,包括所有)病理形态的突变。
选择包括在基因谱中的一个或多个突变的方法可以包括以下一步或多步:获得生物样本、检测生物样本中的一个或多个基因突变、确定一个或多个基因突变的频率、确定一个或多个基因突变所代表的染色体(例如,鉴定包含基因突变的染色体)、以及确定突变所来自的生物样本或生物样本的部分的病理形态。在以下情况下可以选择包括在基因谱中的突变:其频率为生物样本中细胞总数(例如,估计的细胞总数)的至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%;突变所代表的染色体没有被生物样本中的其他突变代表(或未被充分代表),和/或突变存在于与特定病理形态相关的生物样本的一部分中(例如,突变存在于来自生物样本中最具侵袭性部分的细胞)。
在向受试者施用抗癌治疗后,也可以生成该受试者的基因谱。该基因谱可以基于在液体活检物中检测到的任何突变。如果基于液体活检物中突变检测的结果生成了基因谱,则可以将其与从生物样本中突变检测生成的基因谱进行比较。检测到的突变以及这些突变的表达水平的变化可用于确定是否发生了癌症复发或转移。
基于受试者他或她的基因谱创建高度敏感的定制化测定法。开发了定制化的测定法,以检测使用液体活检物分析在生物样本中检测到的特定基因突变。使用众所周知的技术,例如上面关于基因突变检测和定量所讨论的技术,开发了定制化的测定法。
可以使用任何已知方法来设定适当的阈值水平,在该阈值水平之上的突变被确定为在生物样本中存在,而在该阈值水平之下的突变被确定为在生物样本中不存在。例如,可以将阈值设定为某一突变的拷贝数。可替代地,可以将阈值设定为检测突变的某一读数,包括来自下一代测序的读数(例如10个或更多个读数)。阈值也可以设定为突变的表达水平。
可将阈值设定为高于对照样本(例如,不含突变的样本)中存在的突变的拷贝数。阈值还可以设定为不包含基因突变的对照样本中存在的表达水平。在一些实施方案中,基因突变的表达水平必须是高于对照样本的至少10%、20%、30%、40%、50%、60%、70%、80%、90%、100%或更高,以确定基因突变存在于生物样本或液体活检物中。
在一些实施方案中,在液体活检物中检测到的一个或多个突变被用于产生基因谱。可以通过本领域中已知的任何方式,比较从液体活检物获得的基因谱与从用抗癌剂治疗之前的受试者获得的生物样本产生的基因谱。
在一些实施方案中,当在液体活检物中鉴定的1、2、3、4、5、6、7、8、9、10或更多个突变存在于从生物样本产生的基因谱中时,确定癌症已经复发。在其他实施方案中,当在液体活检物的基因谱中鉴定的所有突变均存在于从生物样本产生的基因谱中时,确定癌症已经复发。
生物样本可以是从包括人受试者的受试者获得的任何生物组织或液体。优选地,生物样本是癌症。生物样本也可以来自肿瘤活检。另外,生物样本可以是新鲜收集的样本。生物样本也可以是福尔马林固定的石蜡包埋的组织样本。生物样本可以包括组织、细胞、生物液体及其分离物,包括但不限于从身体样本中分离的细胞或肿瘤细胞,例如但不限于涂片、痰、活检物、分泌物、唾液、脑脊液、胆汁、血液、血浆、血清、淋巴液、尿液和粪便,或已从器官(例如,乳腺、肺、肠、皮肤、子宫颈、前列腺和胃)中取出的组织。
生物样本可以包括一个或多个具有不同病理形态的区域。生物样本可以在样本内的不同位置包含不同的病理形态。一些区域可能具有指示癌症或恶性肿瘤的侵袭性形式的病理形态。其他区域可能表现出较弱侵袭性的病理形态。可以从一个或多个具有最大侵袭性的病理形态的区域获得生物样本。可以从一个或多个具有最小侵袭性的病理形态的区域获得生物样本。靶向病理形态的选择允许对生物样本进行靶向分析。备选地,生物样本可以包括从一个或多个不同病理形态获得的若干样本。实际上,生物样本中可包含样本中存在的每种不同病理形态的样本,这将确保对所有可能的突变来源进行完整的分析。
可以使用已知方法获得生物样本,包括但不限于针头活检、精细需求抽吸、芯活检、图像引导活检、ct引导活检、超声引导活检、mri引导活检、抽吸活检、手术活检、切除活检、切开活检、穿刺活检、真空辅助活检、骨活检、肝活检、肾活检、前列腺活检、皮肤活检、内窥镜活检、腹腔镜活检、胸腔镜活检、纵隔镜活检、剖腹手术、胸廓切开术、或前哨淋巴结定位和活检。
一旦获得了生物样本,就可以使用已知方法将其保存以进行进一步分析。例如,可以将生物样本包埋在福尔马林固定的石蜡中以产生组织块。生物样本也可以冷冻或固定在载玻片上。
可以使用多种方法来检测生物样本中基因突变的存在和/或定量那些突变的表达。基因突变可以包括特定基因的已知突变,包括但不限于表1中列出的基因,以及存在或不存在某些基因的扩增。基因突变的检测可以在蛋白质水平和/或核酸水平上进行。本领域技术人员将理解,下面指出的方法代表一些优选的方式,其中可以检测和/或定量基因突变的存在,包括那些基因突变的表达水平,并且决不限制可以采用的方法的范围。本领域技术人员还能够通过采用常规实验来确定每次测量的操作和最佳测定条件。此类方法可包括但不限于原位杂交(ish)、蛋白质印迹、elisa、免疫沉淀、免疫荧光、流式细胞仪、northern印迹、聚合酶链反应(pcr)、定量实时pcr(qpcr)、微滴式数字pcr、免疫细胞化学(ihc)和下一代测序。
可以在蛋白质水平或核酸水平测定检测到的基因突变的表达水平。可以使用众所周知的基于核酸的技术评估表达,包括但不限于,测定生物样本中含有突变的基因的mrna水平,该方法可以使用分离的rna。可以使用任何不选择分离mrna的rna分离技术。也可以使用众所周知的分离rna的技术。从生物样本中分离的mrna可用于杂交或扩增测定法,包括但不限于southern或northern分析、pcr分析和探针测定法。
测定生物样本或液体活检物中感兴趣基因的mrna水平的另一种方法涉及核酸扩增过程,例如通过rt-pcr(mullis,1987,美国专利号4,683,202中指出的实验实施方案)、或数字pcr、连接酶链反应(barany(1991)proc.natl.acad.sci.usa88;189-193)、natl.acad.sci.自我持续序列复制(guatelli等人(1990)proc.natl.acad.sci.usa87;1874-1878)、转录扩增系统(kwoh等人(1989)proc.natl.acad.sci.usa86;1173-1177)、q-beta复制酶(lizardi等人(1988)bio/technology6;1197)、滚环复制(lizardi等人,美国专利号5,854,033)、或任何其他核酸扩增方法,然后使用本领域技术人员熟知的技术检测扩增的分子。上述检测方法可用于检测以极低数量存在的核酸分子。如本文所用,扩增引物被定义为一对核酸分子,其可以与基因的5'或3'区域(分别为正和负链,反之亦然)退火,并包含期间的短区域。通常,扩增引物的长度为约10至30个核苷酸,并且侧接长度为约50至200个核苷酸区域。在合适的条件和合适的试剂下,此类引物允许扩增包含侧接引物的核苷酸序列的核酸分子。
另外,微阵列可用于检测感兴趣基因的表达。特别地,dna微阵列允许同时测量大量基因的表达水平。每个阵列由附着在固体支持物上的捕获探针的可再现模式组成。标记的rna或dna可以与阵列上的互补探针杂交,然后通过激光扫描进行检测。测定阵列上每种探针的杂交强度并将其转化为代表相对基因表达水平的定量值(参见,例如,美国专利号6,040,138、5,800,992、6,020,135、6,033,860、和6,344,316)。高密度寡核苷酸阵列对于测定样本中大量rna的基因表达谱特别有用。
基于扩增的测定法可用于测量感兴趣基因的拷贝数。在这样的基于扩增的测定法中,感兴趣基因的相应核酸序列在扩增反应(例如pcr)中作为模板。在定量扩增中,扩增产物的量将与原始样本中模板的量成比例。与适当对照的比较提供了对应于所使用的特异性探针的感兴趣基因的拷贝数的测量。与对照相比,存在更高水平的扩增产物指示扩增的感兴趣基因。
“定量”扩增的方法是本领域技术人员众所周知的。例如,定量pcr涉及使用相同的引物同时共扩增已知量的对照序列。这提供了可用于校准pcr反应的内部标准。定量pcr的详细方案提供于,例如innis等人(1990)pcrprotocols,aguidetomethodsandapplications,academicpress,inc.n.y.中。
实时pcr(rt-pcr)是另一种扩增技术,可用于测定感兴趣基因的基因拷贝水平或mrna表达的水平。(参见,例如,gibson等人,genomeresearch6;995-1001,1996;heid等人,genomeresearch6;986-994,1996)。实时pcr评估扩增期间pcr产物的积累水平。这项技术可以定量评估多个样本中的mrna水平。对于基因拷贝水平,从样本中分离总基因组dna。对于mrna水平,从肿瘤和正常组织中提取mrna,并使用标准技术制备cdna。实时pcr可以,例如,使用perkinelmer/appliedbiosystems(fostercity,calif.)7700prism仪器进行。可以使用,例如,由perkinelmer/appliedbiosystems(fostercity,calif.)提供的引物表达程序,为感兴趣基因设计匹配的引物和荧光探针。引物和探针的最佳浓度最初可以由本领域普通技术人员确定,对照(例如,β-肌动蛋白)引物和探针可以从,例如perkinelmer/appliedbiosystems(fostercity,calif.)商购获得。为了定量样本中特定的感兴趣核酸的量,使用对照生成标准曲线。可以使用实时pcr中测定的ct值生成标准曲线,该值与测定法中使用的感兴趣核酸的初始浓度相关。通常,范围为10-106拷贝的感兴趣基因的标准稀释液就足够了。另外,生成对照序列的标准曲线。这允许将组织样本中感兴趣核酸的初始含量相对于用于比较目的的对照的量进行标准化。
微滴式数字pcr是另一种扩增技术,可用于测定感兴趣基因的基因拷贝水平或mrna表达的水平。该技术是一种数字pcr方法,其利用了水-油乳剂液滴系统。水-油乳剂用于形成数千个纳升大小的液滴,这些液滴将模板dna分子分开。pcr扩增在每个独立的液滴内进行。这允许在单一样本中测量数千个单独的扩增,还降低了所需的样本大小。微滴式数字pcr使用的试剂和工作流程与大多数基于taqman探针的测定法所用的试剂和工作流程相似,下面将对此进行讨论。pcr之后,分析或读取每个液滴,以确定原始样本中包含pcr产物的液滴的数量。使用泊松统计(poissonstatistics)分析该信息,以确定原始样本中的靶标模板浓度。
使用taqman探针的实时定量pcr和数字液滴pcr的方法是本领域众所周知的。对于rna的实时定量pcr的详细方案在,例如,在gibson等人,1996,anovelmethodforrealtimequantitativert-pcr.genomeres.,10;995-1001中提供了;对于dna的实时定量pcr的详细方案在heid等人,1996,realtimequantitativepcr.genomeres.,10;986-994中提供了。
基于taqman的测定法也可以用于定量特定的基因组区域。基于taqman的测定法使用了包含5'荧光染料和3'淬灭剂的荧光寡核苷酸探针。该探针与pcr产物杂交,但由于3'端的封闭剂,其本身无法延伸。当在随后的循环中扩增pcr产物时,聚合酶(例如amplitaq)的5'核酸酶活性会导致taqman探针的裂解。这种裂解将5'荧光染料和3'淬灭剂分开,从而导致荧光作为扩增函数而增加。
其他合适的扩增方法包括但不限于,连接酶链反应(lcr)(参见wu和wallace(1989)genomics4:560,landegren等人(1988)science241;1077和barringer等人(1990)gene89;117)、转录扩增(kwoh等人(1989)proc.natl.acad.sci.usa86;1173)、自我维持的序列复制(guatelli等人(1990)proc.nat.acad.sci.usa87;1874)、斑点pcr、和接头适配体pcr等。
荧光原位杂交(fish)也可用于测定样本中感兴趣基因的拷贝数。fish是本领域技术人员已知的(参见,angerer,1987meth.enzymol.,152;649)。通常,原位杂交包括以下主要步骤:(1)固定待分析的组织或生物结构;(2)对生物结构进行预杂交处理,以增加靶dna的可及性,并降低非特异性结合;(3)使核酸混合物与生物结构或组织中的核酸杂交;(4)杂交后洗涤以除去在杂交中未结合的核酸片段;和(5)检测杂交的核酸片段。
在典型的原位杂交测定法中,将细胞或组织切片固定至固体支持物,通常为玻璃载玻片。如果要探测核酸,通常用热或碱使细胞变性。然后使细胞与杂交溶液在中等温度下接触,以允许对编码蛋白质的核酸序列具有特异性的标记探针进行退火。然后通常以预定的严谨度或递增的严谨度洗涤靶标(例如细胞),直到获得合适的信噪比。
通常使用例如放射性同位素或荧光报告子标记在此类应用中使用的探针。优选的探针足够长,例如约50、100或200个核苷酸至约1000或更多个核苷酸,以使得能够在严格条件下与一个或多个靶核酸特异性杂交。
在一些应用中,需要阻断重复序列的杂交能力。因此,在一些实施方案中,使用trna、人基因组dna或cot-1dna阻断非特异性杂交。因此,在本发明的一个实施方案中,通过fish测定ras扩增存在或不存在。
可以通过获得液体活检物来监测受试者癌症的复发或转移。可以在向受试者施用抗癌疗法之后的预定时间段获得液体活检物。该预定时间段可以是任何期望长度的时间,例如一天或多天或几个月或几年。在其他实施方案中,可以每一个月、两个月、三个月、四个月、五个月、六个月、七个月、八个月、九个月、十个月、十一个月、十二个月、十三个月、十四个月、十五个月、十六个月、十七个月、十八个月、十九个月、二十个月、二十一个月、二十二个月、二十三个月或二十四个月从受试者获得液体活检物。在其他实施方案中,每一年、两年、三年、四年、五年、六年、七年、八年、九年或十年从受试者获得液体活检物。在其他实施方案中,在预定时间段从受试者获得液体活检物,所述预定时间段包括任何期望数目的月或年。在一些实施方案中,每三个月(例如,每季度)一次从受试者获得液体活检物。在其他实施方案中,每三个月一次从受试者获得液体活检物,持续两年的期间。在一个实施方案中,在受试者已经进入缓解后,获得液体活检物。在另一个实施方案中,在受试者完成他或她的抗癌疗法治疗后,获得液体活检物。
液体活检物可以是抽吸物、血液、血浆血清、痰、尿液或唾液。优选地,液体活检物是血液样本。液体活检物可以使用已知的方法获得,包括但不限于使用已知的放血技术、程序和方法。在一个实施方案中,液体活检物是在edta管中收集的10ml血液样本。
对液体活检物进行分析,以确定是否存在受试者基因谱中包含的基因突变。从受试者的基因谱开发的定制化测定法用于检测基因突变的存在。如果检测到受试者基因谱中的基因突变,则已经发生癌症复发或转移。如果没有检测到受试者基因谱中的基因突变,则没有发生癌症复发或转移。在一个实施方案中,基于液体活检物中基因突变的检测产生第二基因谱。该基因谱可以任选地包括关于包含感兴趣突变的基因的表达水平的信息。可以将基于液体活检物的基因谱与基于生物样本的基因谱进行比较,以确定检测到的基因突变的任何差异或变化,并且任选地可以确定与基因突变相关的基因的表达水平中的任何差异。该信息可以为是否发生复发或转移提供更多见解,并且如果发生的话,可以提供有关其是否与初始癌症具有相同特征的信息。
在一个实施方案中,所述癌症可以选自口腔癌、前列腺癌、直肠癌、非小细胞肺癌、唇和口腔癌、肝癌、肺癌、肛门癌、肾癌、外阴癌、乳腺癌、口咽癌、鼻腔和鼻旁鼻窦癌、鼻咽癌、尿道癌、小肠癌、胆管癌、膀胱癌、卵巢癌、喉癌、下咽癌、胆囊癌、结肠癌、结直肠癌、头颈癌、神经胶质瘤、甲状旁腺癌、阴茎癌、阴道癌、甲状腺癌、胰腺癌、食道癌、霍奇金淋巴瘤、与白血病相关的疾患、蕈样真菌病、血液系统癌症、血液系统疾病、血液系统恶性肿瘤、微小残留疾病和骨髓增生异常综合症。
在另一个实施方案中,癌症选自胃肠癌、前列腺癌、卵巢癌、乳腺癌、头颈癌、肺癌、非小细胞肺癌、神经系统癌、肾癌、视网膜癌、皮肤癌、肝癌、胰腺癌、泌尿生殖器癌、结直肠癌、肾癌和膀胱癌。
在另一个实施方案中,癌症可以是非小细胞肺癌、胰腺癌、乳腺癌、卵巢癌、结直肠癌或头颈癌。在又一个实施方案中,癌症可以是癌、肿瘤、赘生物、淋巴瘤、黑色素瘤、神经胶质瘤、肉瘤或母细胞瘤。
在一个实施方案中,所述癌可以选自癌、腺癌、腺样囊性癌、腺鳞癌、肾上腺皮质癌、分化良好的癌、鳞状细胞癌、浆液性癌、小细胞癌、浸润性鳞状细胞癌、大细胞癌、胰岛细胞癌、燕麦细胞癌、鳞癌、未分化癌、疣状癌、肾细胞癌、乳头状浆液性腺癌、默克尔细胞癌、肝细胞癌、软组织癌、支气管腺癌、毛细血管癌、巴索林腺癌、基底细胞癌、癌肉瘤、乳头状瘤/癌、透明细胞癌、子宫内膜样腺癌、间皮癌、转移癌、粘液表皮样癌、胆管癌、光化性角化病、囊腺瘤和肝腺瘤病。
在另一个实施方案中,所述肿瘤可以选自星形细胞肿瘤、恶性间皮瘤、卵巢生殖细胞肿瘤、幕上原始神经外胚层肿瘤、wilms肿瘤、垂体肿瘤、性腺外生殖细胞肿瘤、胃泌素瘤、生殖细胞肿瘤、妊娠滋养细胞肿瘤、脑瘤、松果体和幕上原始神经外胚层肿瘤、垂体瘤、生长抑素分泌肿瘤、真皮内窦瘤、类癌、中枢性脑星形细胞瘤、胰高血糖素瘤、肝腺瘤、胰岛瘤、髓质上皮瘤、浆细胞瘤、舒血管肠肽瘤(vipoma)和嗜铬细胞瘤
在另一个实施方案中,所述赘生物可以选自上皮内赘生物、多发性骨髓瘤/浆细胞赘生物、浆细胞赘生物、上皮间鳞状细胞赘生物、子宫内膜增生、局灶性结节性增生、血管内皮瘤和恶性胸腺瘤。在另一个实施方案中,淋巴瘤可以选自神经系统淋巴瘤、aids相关淋巴瘤、皮肤t细胞淋巴瘤、非霍奇金淋巴瘤、淋巴瘤和waldenstrom巨球蛋白血症。在另一个实施方案中,黑色素瘤可以选自:肢端雀斑样黑色素瘤、浅表扩散黑色素瘤、葡萄膜黑色素瘤、扁桃状恶性黑色素瘤、黑色素瘤、眼内黑色素瘤、腺癌结节性黑色素瘤和血管瘤。在又一个实施方案中,肉瘤可以选自腺瘤、腺肉瘤、软骨肉瘤、子宫内膜间质肉瘤、尤因氏肉瘤、卡波济肉瘤、平滑肌肉瘤、横纹肌肉瘤、肉瘤、子宫肉瘤、骨肉瘤和假性肉瘤。在一个实施方案中,神经胶质瘤可以选自神经胶质瘤、脑干神经胶质瘤以及下丘脑和视觉通路神经胶质瘤。在另一个实施方案中,母细胞瘤可以选自肺母细胞瘤、胸膜肺母细胞瘤、视网膜母细胞瘤、神经母细胞瘤、髓母细胞瘤、胶质母细胞瘤和血管母细胞瘤。
治疗方法
本公开还提供了治疗受试者的癌症的方法。这样的方法可以包括在向受试者施用第一抗癌疗法之前,从受试者获得癌症的生物样本(例如,ffpe组织样本);在向受试者施用第一抗癌疗法之前,检测生物样本中的一个或多个基因突变以产生受试者的基因谱;向受试者施用第一抗癌疗法;在向受试者施用第一抗癌疗法之后,从受试者获得液体活检物;检测液体活检物中的一个或多个基因突变,其中在液体活检物中检测到的突变存在于基因谱中时,癌症已经复发;以及癌症复发后,向受试者施用第二抗癌疗法。
在一些实施方案中,疾病、病患或病症的“治疗(treating)”或“治疗(treatment)”至少部分地包括(1)预防疾病、病患或病症,即,使得疾病、病患或病症的临床症状不在哺乳动物中显露,所述哺乳动物暴露于或易患该疾病、病患或病症,但尚未经历或显现该疾病、病患或病症的症状;(2)抑制疾病、病患或病症,即,阻止或降低疾病、病患或病症或其临床症状的发展;或(3)减轻疾病、病患或病症,即使疾病、病患或病症或其临床症状消退。疾病或疾患的治疗或治疗可以包括癌症的治疗或治疗。
术语“治疗癌症”是指向患有癌性病症的哺乳动物的施用,并且是指通过杀死癌细胞来减轻癌性病症的作用,还指导致癌症生长和/或转移抑制的作用。
在一些实施方案中,第二抗癌疗法与第一抗癌疗法不同。
抗癌疗法可以包括任何已知的治疗癌症的疗法,包括但不限于手术切除癌症、化学疗法的施用、放射线的施用、抗体疗法的施用以及抗癌药物的施用。
术语“化学疗法”是指使用对恶性细胞和组织、病毒、细菌或其他微生物具有选择性毒性和破坏性的特定化学试剂、药物或放射性试剂来治疗癌症或由病毒、细菌、其他微生物引起的疾病或病患、或不适当的免疫应答。化学治疗剂或化学治疗药物,例如抗叶酸(例如甲氨蝶呤)或可用于治疗癌症、炎性疾病或自身免疫性疾病的任何其他试剂或药物,是优选的。合适的化学治疗剂和化学治疗药物包括但不限于放线菌素d、阿霉素、六甲蜜胺、硫唑嘌呤、博来霉素、白消安、卡培他滨、卡铂、卡莫司汀、苯丁酸氮芥、顺铂、克拉屈滨、crisantaspase、环磷酰胺、阿糖胞苷、达卡巴嗪、柔红霉素、多柔比星、表柔比星、依托泊苷、氟达拉滨、氟尿嘧啶、吉西他滨、羟基脲、伊达比星、异环磷酰胺、伊立替康、脂质体多柔比星、洛莫司汀、美法仑、巯基嘌呤、甲氨蝶呤、丝裂霉素、米托蒽醌、奥沙利铂、紫杉醇(paclitaxel)、喷司他丁、丙卡巴肼、雷替曲塞、类固醇、链脲佐菌素、紫杉醇(taxol)、多西紫杉醇(taxotere)、替莫唑胺(temozolomide)、巯鸟嘌呤、噻替派、雷替曲塞(tomudex)、拓扑替康、苏消安、uft(尿嘧啶-喃氟啶)、长春花碱、长春新碱、长春地辛和长春瑞滨。
本公开进一步提供了向患有癌症的受试者施用抗癌疗法的方法。这样的方法可以包括:在向受试者施用第一抗癌疗法后(例如,在受试者的癌症进入缓解中后),在预定的时间段后从受试者获得液体活检物;检测液体活检物中的一个或多个基因突变,其中当在液体活检物中检测到的一个或多个突变存在于从第一抗癌疗法治疗之前的受试者获得的信息产生的基因谱中时,已经发生癌症复发;以及在检测到癌症复发后,向受试者施用第二抗癌疗法。
通过以下实施例进一步说明本公开,提供这些实施例以促进所公开方法的实践。这些实施例不旨在以任何方式限制本公开的范围。
实施例
实施例1:卵巢癌复发的检测
从42岁女性受试者的卵巢肿瘤中获取ffpe组织样本。如本文所述,通过限定的下一代测序组(panel)分析了ffpe组织样本的基因突变,并用于创建受试者的基因谱。检测到tp53、brca1和brca2基因中的突变。这些突变和/或这些基因的表达水平的检测被用于产生在向受试者施用抗癌治疗之前的受试者的基因谱。然后对该受试者施用抗癌疗法,所述抗癌疗法包括铂化合物(例如顺铂或卡铂)和紫杉烷(例如紫杉醇
除非另有说明,否则在说明书和权利要求书中使用的所有表示成分数量、性质(例如分子量、反应条件等)的数字在任何情况下均应理解为由术语“约”修饰。因此,除非有相反的说明,否则说明书和所附权利要求书中列出的数字参数是近似值,其可以根据本公开寻求获得的期望特性而变化。至少,并且不试图将等同原则的应用限制于权利要求的范围,每个数字参数应至少根据所报告的有效数字的数目并通过应用普通的舍入技术来解释。
尽管阐述本公开的广泛范围的数值范围和参数是近似值,但是在具体实施例中阐述的数值被尽可能精确地报告。但是,任何数值都固有地包含某些误差,这些误差必定是由它们各自的测试测量中的标准偏差引起的。
除非本文另外指出或者与上下文明显矛盾,否则在描述本公开内容的上下文中使用的术语“一(a)”,“一种(an)”,“该(the)”和类似指代(特别是在以下权利要求的上下文中)应解释为涵盖单数和复数两者。本文中数值范围的描述仅旨在用作单独指代落入该范围内的每个单独数值的简写方法。除非本文另外指出,否则每个单独的值都被并入说明书中,就如同其在本文中被单独引述一样。除非本文另外指出或与上下文明显矛盾,否则本文描述的所有方法可以以任何合适的顺序进行。本文提供的任何和所有实施例或示例性语言(例如,“例如”)的使用仅旨在更好地阐明本公开,并且不对以其他方式要求保护的本公开的范围构成限制。说明书中的任何语言都不应被解释为表示任何未要求保护的对本公开的实施必不可少的要素。
本文公开的公开内容的替代元件或实施方案的分组不应被解释为限制。每个组成员可以单独引用,也可以与该组的其他成员或本文存在的其他要素组合引用。出于方便和/或可专利性的原因,预期组中的一个或多个成员可以包含在组中或从组中删除。当发生任何这样的包含或删除时,说明书被认为包含经修改的组,从而满足所附权利要求中使用的所有马库什组的书面描述。
本文描述了本公开的某些实施方案,包括发明人已知的用于执行本公开的最佳模式。当然,在阅读了前面的描述之后,对这些描述的实施方案的变型对于本领域普通技术人员将变得显而易见。发明人预期熟练的技术人员将适当地采用这样的变型,并且发明人希望以不同于本文具体描述的方式来实践本公开。因此,本公开包括适用法律所允许的所附权利要求书中记载的主题的所有修改和等同物。此外,除非本文另外指出或与上下文明显矛盾,否则本公开内容涵盖上述要素在其所有可能的变化中的任何组合。
可以使用“由……组成”或“基本上由……组成”语言在权利要求书中进一步限制本文公开的特定实施方案。当在权利要求书中使用时,无论是在提交时使用还是根据修改增加,过渡术语“由……组成”均不包括权利要求书中未指定的任何要素、步骤或成分。过渡术语“基本上由...组成”将权利要求的范围限制为指定的材料或步骤以及那些不实质性影响基本和新颖特征的材料或步骤。如此要求保护的本公开的实施方案在本文中被固有地或明确地描述和实施。
要理解的是,本文公开的本公开的实施方案说明了本公开的原理。可以采用的其他修改在本公开的范围内。因此,通过示例而非限制的方式,可以根据本文的教导来利用本公开的替代配置。因此,本公开不限于精确地所示出和描述的那些。
尽管本文已经通过参考各种特定的材料、步骤和实施例描述和说明了本公开,但是应当理解,本公开不限于为此目的选择的材料和步骤的特定组合。如本领域技术人员将理解的,可以隐含这种细节的许多变化。说明书和实施例旨在仅被认为是示例性的,本公开的真实范围和精神由所附权利要求表明。本申请中引用的所有参考文献、专利和专利申请均通过引用整体并入本文。
- 还没有人留言评论。精彩留言会获得点赞!