生产重组蛋白的方法与流程
本发明总体上涉及利用非灌注策略在n-1培养阶段期间增加活细胞密度的方法,所述非灌注策略用于以高种子密度接种n生产生物反应器以用于细胞培养物制造。
发明背景
蛋白质和多肽作为治疗剂变得越来越重要。在大多数情况下,治疗性蛋白质和多肽是在细胞培养物中由已被工程化和/或选择以产生异常高水平的目的多肽的细胞产生的。细胞培养条件的控制和优化对于成功商业性生产蛋白质和多肽至关重要。
细胞培养时产生的许多蛋白质和多肽是在补料分批过程中制备的,其中将细胞培养一段时间,并且然后终止培养并分离产生的蛋白质或多肽。产生的蛋白质或多肽的最终的量和质量可能受到n-1种子培养和n生产时种子密度的显著影响。虽然已努力改进补料分批培养过程中蛋白质和多肽的生产,但仍需要另外的改进。
灌注细胞培养可以实现比常规补料分批细胞培养系统高得多的活细胞密度。灌注细胞培养在培养系统中提供新鲜培养基的持续供应,同时去除废弃产物,这为细胞生长提供了丰富的环境。与采用低种子密度的常规补料分批生产培养相比,用n-1灌注种子接种的高种子密度补料分批生产培养可以在短持续时间内实现更高的最终效价。然而,当用于大规模培养系统(例如,大于200l生物反应器)时,灌注细胞培养变得昂贵,因为消耗了大量的细胞培养基。另外,灌注细胞培养可能具有来自细胞保留系统的并发症,这阻止了细胞从细胞培养系统中移出,特别是对于大规模制造而言。
特别需要开发改进的系统,用于使用非灌注系统以高种子细胞密度通过大规模细胞培养来生产蛋白质和多肽。
技术实现要素:
本公开文本涉及增加n-1大规模生物反应器细胞培养物的活细胞密度的方法,所述方法包括在基于非灌注的培养系统中培养表达目的重组多肽的宿主细胞,并且其中所述活细胞密度增加到至少5×106个细胞/ml。在一些实施方案中,所述基于非灌注的培养系统是分批或补料分批生物反应器。在一些实施方案中,n-1阶段的活细胞密度为至少5×106、至少10×106、至少15×106、至少20×106、至少25×106或至少30×106个活细胞/ml。在一些实施方案中,所述细胞活力在所述n-1阶段的最后一天为至少80%、在所述n-1阶段的最后一天为至少85%、或者在所述n-1阶段的最后一天为至少90%。
在本发明的一些实施方案中,将所述宿主细胞在用于n-1分批培养的富集培养基中培养。在一些实施方案中,将所述宿主细胞在添加了用于n-1补料分批培养的补料培养基的种子培养基中培养。
在本发明的一些实施方案中,将所述培养基通过补料培养基相对于非富集培养基富集至少5%、相对于非富集培养基富集至少10%、相对于非富集培养基富集至少15%、或相对于非富集培养基富集至少20%。在一些实施方案中,所述富集培养基或补料培养基包含增加的量的碳源。在一些实施方案中,所述碳源是葡萄糖。在一些实施方案中,所述富集培养基或补料培养基包含增加的量的营养物。在一些实施方案中,所述营养物选自氨基酸、脂质、维生素、矿物质和多胺。在一些实施方案中,所述富集培养基包含增加的量的碳源和营养物。在一些实施方案中,所述碳源是葡萄糖,并且所述营养物选自氨基酸、脂质、维生素、矿物质和多胺。
在本发明的一些实施方案中,所述宿主细胞是哺乳动物细胞。在一些实施方案中,所述哺乳动物细胞选自cho、vero、bhk、hek、hela、cos、mdck和杂交瘤细胞。在一些实施方案中,所述宿主细胞是cho细胞。
在本发明的一些实施方案中,所述目的多肽是治疗性多肽。在一些实施方案中,所述目的多肽是抗体或抗原结合片段。在一些实施方案中,所述抗体或抗原结合片段结合选自pd-1、pd-l1、lag-3、tigit、gitr、cxcr4、cd73her2、vegf、cd20、cd40、cd11a、组织因子(tf)、psca、il-8、egfr、her3和her4的抗原。
在本发明的一些实施方案中,所述生物反应器为至少50l、至少500l、至少1,000l、至少5,000l或至少10,000l。
在本发明的一些实施方案中,所述方法还包括在富集分批培养物或补料分批培养物中在所述n-1阶段中培养至少5×106个活细胞/ml,所述富集分批培养物或补料分批培养物用于接种所述n生产阶段以产生所述目的重组多肽。在一些实施方案中,所述方法还包括从所述生产培养系统分离所述目的多肽的步骤。
本公开文本还涉及大规模生产目的重组多肽的方法,所述方法包括:(1)在基于非灌注的培养系统中在n-1阶段中培养表达目的重组多肽的宿主细胞,其中所述活细胞密度增加到至少5×106个细胞/ml;和(2)在至少1.5×106个细胞/ml的高种子密度的基础培养基或富集基础培养基中培养n补料分批生产细胞,其中所述n补料分批生产细胞是从所述基于非灌注的培养系统中的所述n-1阶段接种的。在一些实施方案中,所述n生产培养系统是补料分批生物反应器。
在本发明的一些实施方案中,相对于非富集培养基,将所述富集基础培养基通过补料培养基富集至少5%、至少10%、至少15%、至少20%。在一些实施方案中,所述富集培养基包含增加的量的碳源。在一些实施方案中,所述碳源是葡萄糖。在一些实施方案中,所述富集培养基包含增加的量的营养物。在一些实施方案中,所述营养物选自氨基酸、脂质、维生素、矿物质和多胺。在一些实施方案中,所述富集培养基包含增加的量的碳源和营养物。在一些实施方案中,所述碳源是葡萄糖,并且所述营养物选自氨基酸、脂质、维生素、矿物质和多胺。
在本发明的一些实施方案中,所述生物反应器为至少50l、至少500l、至少1,000l、至少5,000l、至少10,000l、至少15,000l、或至少20,000l。
在本发明的一些实施方案中,所述宿主细胞是哺乳动物细胞。在一些实施方案中,所述宿主细胞是cho细胞。
在本发明的一些实施方案中,所述目的多肽的效价为至少100mg/l、至少1g/l、至少3g/l、至少5g/l、或至少10g/l。
在本发明的一些实施方案中,将所述宿主细胞在用于n补料分批生产生物反应器的基础培养基或富集基础培养基中培养,以获得至少1.5×106、至少5×106或至少10×106个活细胞/ml的活细胞密度。
在本发明的一些实施方案中,所述方法还包括分离所述目的多肽的步骤。在一些实施方案中,所述目的多肽是治疗性多肽。在一些实施方案中,所述目的多肽是抗体或抗原结合片段。
附图说明
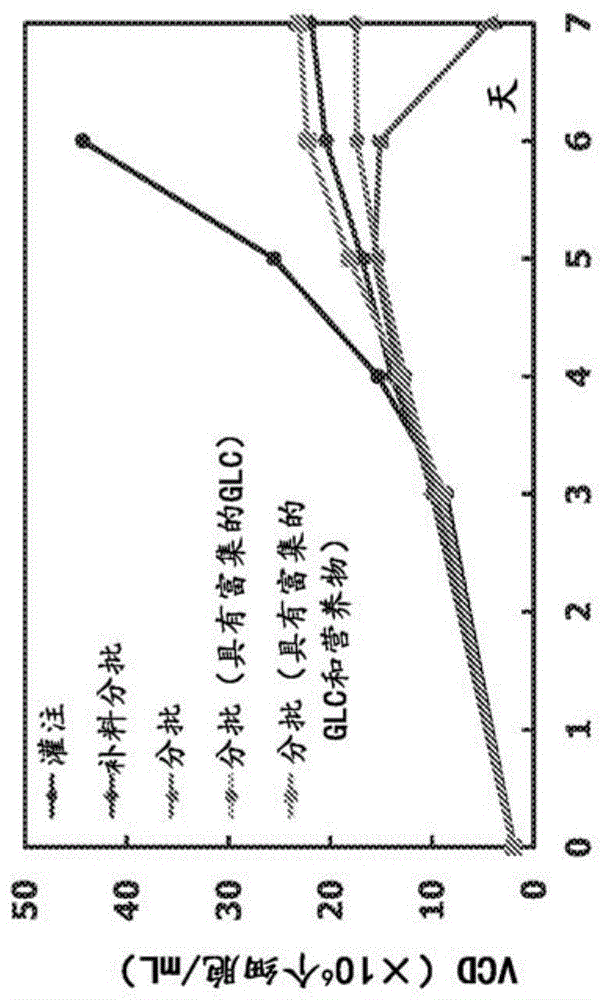
图1a和图1b.图1a示出了在以下用于cho细胞系a的细胞培养系统中生长的n-1细胞培养物的活细胞密度(“vcd”):灌注、补料分批、分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批细胞培养系统。图1b示出了在以下用于细胞系a的细胞培养系统中生长的n-1细胞培养物的细胞活力(%):灌注、补料分批、分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批。
图2a-图2c.图2a示出了使用来自以下n-1细胞培养系统的种子培养物通过细胞系a产生多肽-1的n生产培养物的活细胞密度:灌注、补料分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批。图2b示出了在使用来自以下n-1细胞培养系统的种子培养物在生产培养物中生长的目的多肽的效价:灌注、补料分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批。图2c示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系a产生多肽-1的生产培养物中生长的目的多肽的成像毛细管等电聚焦(“icief”)、尺寸排阻色谱法(“sec”)和n-聚糖分析:灌注、补料分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批。
图3a和图3b.图3a示出了在以下用于cho细胞系b的细胞培养系统中生长的n-1细胞培养物的vcd:灌注、补料分批、分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批细胞培养系统。图3b示出了在以下用于cho细胞系b的细胞培养系统中生长的n-1细胞培养物的细胞活力(%):灌注、补料分批、分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批。
图4a-图4c.图4a示出了使用来自以下n-1细胞培养系统的种子培养物,通过cho细胞系b产生多肽-2的n生产培养物的活细胞密度:灌注、补料分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批。图4b示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系b产生多肽-2的n生产培养物中生长的目的多肽的效价:灌注、补料分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批。图4c示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系b产生多肽-2的n生产培养物中生长的目的多肽的icief、sec和n-聚糖分析:灌注、补料分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批。
图5a和图5b.图5a示出了在以下用于cho细胞系c的细胞培养系统中生长的n-1细胞培养物的vcd:灌注、补料分批、分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批细胞培养系统。图5b示出了在以下细胞培养系统中生长的n-1细胞培养物的细胞活力(%):灌注、补料分批、分批、具有富集的葡萄糖的分批以及具有富集的葡萄糖和营养物的分批。
图6a-图6c.图6a示出了使用来自以下n-1细胞培养系统的种子培养物通过cho细胞系c产生多肽-3的n生产培养物的活细胞密度:补料分批以及具有富集的葡萄糖和营养物的分批。图6b示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系c产生多肽-3的生产培养物中生长的目的多肽的效价:补料分批以及具有富集的葡萄糖和营养物的分批。图6c示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系c产生多肽-3的n生产培养物中生长的目的多肽的icief、sec和n-聚糖分析:补料分批以及具有富集的葡萄糖和营养物的分批。
图7a-图7c.图7a示出了使用来自以下n-1细胞培养系统的种子培养物通过cho细胞系c产生多肽-3的n生产培养物的活细胞密度:灌注和补料分批。图7b示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系c产生多肽-3的生产培养物中生长的目的多肽的效价:灌注和补料分批。图7c示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系c产生多肽-3的n生产培养物中生长的目的多肽的icief、sec和n-聚糖分析:灌注和补料分批。
图8a-图8c.图8a示出了使用来自以下n-1细胞培养系统的种子培养物通过cho细胞系a产生多肽-1的1000l规模(n=3)和5l卫星(n=2)的n生产培养物的活细胞密度:具有富集的葡萄糖和营养物的分批。图8b示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系a产生多肽-1的1000l规模(n=3)和5l卫星(n=2)的生产培养物中生长的目的多肽的效价:具有富集的葡萄糖和营养物的分批。图8c示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系a产生多肽-1的1000l规模(n=3)和5l卫星(n=2)的n生产培养物中生长的目的多肽的icief、sec和n-聚糖分析:具有富集的葡萄糖和营养物的分批。
图9a-图9c.图9a示出了使用来自以下n-1细胞培养系统的种子培养物通过cho细胞系b产生多肽-2的500l规模(n=1)和5l卫星(n=2)的n生产培养物的活细胞密度:具有富集的葡萄糖和营养物的分批。图9b示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系b产生多肽-2的500l规模(n=1)和5l卫星(n=2)的生产培养物中生长的目的多肽的效价:具有富集的葡萄糖和营养物的分批。图9c示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系b产生多肽-2的500l规模(n=1)和5l卫星(n=2)的n生产培养物中生长的目的多肽的icief、sec和n-聚糖分析:具有富集的葡萄糖和营养物的分批。
图10a-图10c.图10a示出了使用来自以下n-1细胞培养系统的种子培养物通过cho细胞系c产生多肽-3的500l规模(n=1)和5l卫星(n=2)的n生产培养物的活细胞密度:补料分批。图10b示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系c产生多肽-3的500l规模(n=1)和5l卫星(n=2)的生产培养物中生长的目的多肽的效价:补料分批。图10c示出了使用来自以下n-1细胞培养系统的种子培养物在通过cho细胞系c产生多肽-3的500l规模(n=1)和5l卫星(n=2)的n生产培养物中生长的目的多肽的icief、sec和n-聚糖分析:补料分批。
具体实施方式
在某些实施方案中,本公开文本提供了增加n-1大规模生物反应器细胞培养物的活细胞密度的新方法,所述新方法包括在基于非灌注的培养系统中培养表达目的重组多肽的宿主细胞,并且其中所述活细胞密度增加到至少5×106个细胞/ml。在某些实施方案中,本公开文本提供了大规模生产目的重组多肽的新方法,所述新方法包括:(1)在基于非灌注的培养系统中在n-1阶段中培养表达目的重组多肽的宿主细胞,其中所述活细胞密度增加到至少5×106个细胞/ml;和(2)在至少1.5×106个/ml的高种子密度的富集培养基中在n生产阶段中培养所述细胞,所述细胞是从非灌注培养系统中的n-1细胞培养物接种的。
定义
不定冠词“一个/种”(“a”或“an”)应当理解为是指任何所述或列举的组分中的“一个/种或多个/种”。
如本文所用的术语“约”是在本领域普通技术人员确定的特定值或组成的可接受误差范围内的值或组成,其部分取决于如何测量或确定值或组成,即测量系统的局限性。例如,根据本领域的实践,“约”可以意指在1个或超过1个标准偏差内。可替代地,“约”可以意指高达20%的范围。此外,特别是关于生物系统或过程,所述术语可以意指高达值的一个数量级或高达值的5倍。当在本申请和权利要求中提供特定值或组成时,除非另有说明,否则应当假定“约”的含义在所述特定值或组成的可接受的误差范围内。
在本文中使用的情况下,将术语“和/或”视为对两个指定特征或组分中的每一个与或不与另一个的具体公开。因此,如在本文中以短语如“a和/或b”使用的术语“和/或”旨在包括“a和b”、“a或b”、“a”(单独)和“b”(单独)。同样地,在诸如“a、b和/或c”的短语中使用的术语“和/或”旨在涵盖以下方面中的每一个:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);以及c(单独)。替代方案(例如,“或”)的使用应当理解为意指替代方案之一、两者或其任何组合。
如本文所用,术语“氨基酸”在其广义上是指可以掺入多肽链中的任何化合物和/或物质。在一些实施方案中,氨基酸具有一般结构h2n--c(h)(r)--cooh。在一些实施方案中,氨基酸是天然存在的氨基酸。在一些实施方案中,氨基酸是合成氨基酸;在一些实施方案中,氨基酸是d-氨基酸;在一些实施方案中,氨基酸是l-氨基酸。氨基酸(包括肽中的羧基和/或氨基末端氨基酸)可以通过甲基化、酰胺化、乙酰化、保护基团和/或被其他化学基团取代进行修饰,所述其他化学基团可以改变肽的循环半衰期而不会对其活性产生不利影响。氨基酸可以参与二硫键。氨基酸可以包含一种或多种翻译后修饰,如与一种或多种化学实体(例如,甲基基团、乙酸酯基团、乙酰基团、磷酸基团、甲酰基部分、类异戊二烯基、硫酸基团、聚乙二醇部分、脂质部分、碳水化合物部分、生物素部分等)的缔合。在一些实施方案中,本发明的氨基酸可以提供于或用于细胞培养物的补充培养基中。在一些实施方案中,提供于或用于补充细胞培养基的氨基酸可以作为盐或以水合物形式提供。
如本文所用的术语“抗体”是指免疫球蛋白分子,其通过所述免疫球蛋白分子的可变区内的至少一个抗原识别位点识别并特异性地结合靶标,如蛋白质、多肽、肽、碳水化合物、多核苷酸、脂质或上述物质的组合。如本文所用,所述术语涵盖完整的多克隆抗体、完整的单克隆抗体、抗体片段(如fab、fab’、f(ab’)2和fv片段)、单链fv(scfv)抗体、由至少两种完整抗体生成的多特异性抗体(如双特异性抗体)、单特异性抗体、单价抗体、嵌合抗体、人源化抗体、人抗体、包含抗体的抗原决定部分的融合蛋白、以及包含抗原识别位点的任何其他经修饰的免疫球蛋白分子,只要所述抗体展现出所期望的生物活性即可。抗体可以是五大类免疫球蛋白中的任何一类:iga、igd、ige、igg和igm,或其亚类(同种型)(例如,igg1、igg2、igg3、igg4、iga1和iga2),这基于它们的重链恒定结构域(分别称为α、δ、ε、γ和μ)的身份。不同种类的免疫球蛋白具有不同且熟知的亚基结构和三维构型。抗体可以是裸露的或与其他分子缀合,所述其他分子包括但不限于毒素和放射性同位素。
如本文所用的术语抗体的“抗原结合部分”或“抗原结合片段”是指保留与抗原特异性地结合的能力的抗体的一个或多个片段。已经显示抗体的抗原结合功能可以由全长抗体的片段执行。涵盖在术语“抗原结合片段”内的结合片段的例子例如(i)由vl、vh、lc和ch1结构域组成的fab片段(来自木瓜蛋白酶切割的片段)或类似的单价片段;(ii)包含由铰链区的二硫键连接的两个fab片段的f(ab')2片段(来自胃蛋白酶切割的片段)或类似的二价片段;(iii)由vh和ch1结构域组成的fd片段;(iv)由抗体单臂的vl和vh结构域组成的fv片段;(v)dab片段(ward等人,(1989)nature341:544-546),其由vh结构域组成;(vi)分离的互补决定区(cdr)和(vii)两个或更多个分离的cdr的组合,所述两个或更多个分离的cdr可以任选地通过合成接头来连接。此外,尽管fv片段的两个结构域vl和vh由单独的基因编码,但它们可以使用重组方法通过合成接头进行连接,从而将它们制成单个蛋白质链,在所述单个蛋白质链中vl和vh区域配对形成单价分子(称为单链fv(scfv);参见例如,bird等人(1988)science242:423-426;和huston等人(1988)proc.natl.acad.sci.usa85:5879-5883)。此类单链抗体也旨在包含在抗体的“抗原结合部分”术语内。这些抗体片段是使用本领域技术人员已知的常规技术获得的,并且以与完整抗体相同的方式针对效用筛选所述片段。抗原结合部分可以通过重组dna技术或通过完整的免疫球蛋白的酶促或化学切割来产生。
如本文所用的术语“分批培养”是指培养细胞的方法,其中在培养过程开始时提供最终将用于培养细胞的所有组分,包括培养基(参见下文“培养基”的定义)以及细胞本身。通常在某一点停止分批培养,并且收获并任选地纯化培养基中的细胞和/或组分。术语“补料分批培养”意指向初始细胞培养物中增量式或连续添加第二液体培养基,而不从细胞培养物中大量或显著去除第一液体培养基。在一些情况下,所述第二液体培养基与所述第一液体培养基相同。在其他情况下,所述第二液体培养基是所述第一液体培养基的浓缩形式和/或作为干粉添加。
如本文所用的术语“生物反应器”是指用于哺乳动物细胞培养物生长的任何容器。所述生物反应器可以具有任何大小,只要它可用于培养哺乳动物细胞。通常,所述生物反应器将为至少1升,并且可以为10、100、250、500、1000、2500、5000、8000、10,000、12,000、15,000、20,000升或更多,或者其间的任何体积。通常在培养期内控制所述生物反应器的内部条件,包括但不限于ph和温度。所述生物反应器可以由适合于在本发明的培养条件下保持悬浮在培养基中的哺乳动物细胞培养物的任何材料构成,所述材料包括玻璃、塑料或金属。如本文所用的术语“生产生物反应器”是指用于生产目的多肽或蛋白质的最终生物反应器。大规模细胞培养生产生物反应器的体积通常为至少500升,并且可以为1000、2500、5000、8000、10,000、12,000、15,000、20,000升或更多,或者其间的任何体积。本领域普通技术人员将知道并且将能够选择用于实践本发明的合适生物反应器。
如本文所用的术语“活细胞密度”是指在给定体积的培养基中存在的活(活的)细胞的数量。术语“靶细胞密度”意指每体积培养基中用于在培养物中产生重组蛋白的特定细胞的浓度。靶细胞密度可以根据培养的特定哺乳动物细胞而变化。
如本文所用的术语“细胞活力”是指在培养物中的细胞在给定的一组培养条件或实验变化下存活的能力。如本文所用的术语也指在特定时间存活的细胞相对于在所述时间在培养物中的活细胞和死细胞的总数的部分。
如本文所用的术语“培养物”、“细胞培养物”和“哺乳动物细胞培养物”是指在适合于细胞群体存活和/或生长的条件下悬浮于培养基中的哺乳动物细胞群体。如本领域普通技术人员将清楚的是,如本文所用的这些术语可以指包含哺乳动物细胞群体和所述群体悬浮于其中的培养基的组合。
术语“培养”或“细胞培养”意指在受控制的一组物理条件下,哺乳动物细胞在液体培养基中的维持或生长。
如本文所用的术语“培养基”、“细胞培养基”、“培养基”是指含有滋养生长中的哺乳动物细胞的营养物的溶液。通常,这些溶液提供细胞最小生长和/或存活所需的必需和非必需氨基酸、维生素、能源、脂质和微量元素。所述溶液还可以含有增强高于最小速率的生长和/或存活的组分,包括激素和生长因子。优选地将所述溶液配制成对细胞存活和增殖最佳的ph和盐浓度。培养基还可以是“化学限定培养基”—不含蛋白质、水解产物或未知组成的组分的无血清培养基。限定培养基不含动物来源的组分,并且所有组分均具有已知的化学结构。术语“富集培养基(medium)”、“富集培养基(media)”或“富集化学限定培养基”是相对于标准培养基包含另外或增加的量的碳源和/或营养物的培养基。
如本文所用的术语“n-1阶段”是指恰好在生产接种之前的最后的种子扩增阶段。n-1阶段是接种生产生物反应器用于多肽生产之前的最终细胞生长步骤。如本文所用的术语“n-2阶段”和“n-3阶段”是指细胞生长和扩增期间以及通常在接种n生产阶段之前的时间段。n-3阶段是用于增加待在n-2阶段中使用的存活细胞密度的细胞生长阶段。n-2阶段是用于增加待在n-1阶段中使用的存活细胞密度的细胞生长阶段。
如本文所用的术语“灌注”或“灌注过程”是指培养细胞的方法,其中在将细胞保留在反应器中的同时,从生物反应器同时添加和去除等体积的培养基(含有营养补充剂)。通常在连续或半连续的基础上去除对应于补充培养基的一定体积的细胞和培养基,并任选地进行纯化。通常,将涉及灌注过程的细胞培养过程称为“灌注培养”。在一些实施方案中,新鲜培养基可以与细胞培养过程中使用的基础培养基相同或相似。在一些实施方案中,新鲜培养基可以不同于基础培养基,但含有所期望的营养补充剂。在一些实施方案中,新鲜培养基是化学限定培养基。
如本文所用的术语“多核苷酸”或“核苷酸”旨在涵盖单个核酸以及多个核酸,并且是指分离的核酸分子或构建体,例如,信使rna(mrna)、互补dna(cdna)或质粒dna(pdna)。在某些方面,多核苷酸包含常规磷酸二酯键或非常规键(例如酰胺键,如见于肽核酸(pna)中)。
如本文所用的术语“多肽”是指由通过酰胺键(也称为肽键)线性连接的单体(氨基酸)构成的分子。术语“多肽”是指两个或更多个氨基酸的任何单个链或多个链,而不是指特定长度的产物。如本文所用的术语“蛋白质”旨在涵盖由一个或多个多肽构成的分子,所述一个或多个多肽在一些情况下可以通过除酰胺键之外的键缔合。另一方面,蛋白质也可以是单个多肽链。在后一种情况下,所述单个多肽链在一些情况下可以包含两个或更多个融合在一起以形成蛋白质的多肽亚基。术语“多肽”和“蛋白质”还指表达后修饰的产物,所述表达后修饰包括但不限于糖基化、乙酰化、磷酸化、酰胺化、通过已知保护/阻断基团的衍生化、蛋白水解切割或通过非天然存在的氨基酸进行的修饰。多肽或蛋白质可以源自天然生物来源或由重组技术产生,但不一定从指定的核酸序列翻译。它可以以任何方式产生,包括化学合成。
如本文所用的术语“目的多肽”以其最广泛的含义使用,以包括存在于混合物中期望纯化的任何蛋白质(天然或重组的)。此类目的多肽包括但不限于酶、激素、生长因子、细胞因子、免疫球蛋白(例如抗体)和/或任何融合蛋白。
细胞培养的术语“生产阶段”是指细胞培养的最后阶段。在所述生产阶段,细胞将首先生长,并且然后是多肽生产。所述生产阶段通常称为细胞培养物制造的“n”或最后阶段。
如在本文中可互换使用的术语“纯化”、“分开”、“分离”或“回收”是指将重组蛋白从细胞培养基(例如,哺乳动物细胞或培养基蛋白质)中存在的一种或多种其他组分或者哺乳动物细胞裂解物中存在的一种或多种其他组分(例如,dna、rna或其他蛋白质)至少部分地纯化或分离(例如,按重量计至少或约5%,例如,至少或约10%、15%、20%、25%、30%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%或至少或约95%纯)。通常,通过从组合物去除(完全或部分)至少一种杂质来提高目的蛋白质的纯度。
如本文所用的术语“重组表达的多肽”和“重组多肽”是指从哺乳动物宿主细胞表达的多肽,所述哺乳动物宿主细胞已被基因工程化以表达所述多肽。所述重组表达的多肽可以与所述哺乳动物宿主细胞中正常表达的多肽相同或相似。所述重组表达的多肽也可以对于所述宿主细胞是外来的,即与在哺乳动物宿主细胞中正常表达的肽异源。可替代地,所述重组表达的多肽可以是嵌合的,因为所述多肽的部分含有与哺乳动物宿主细胞中正常表达的多肽相同或相似的氨基酸序列,而其他部分对于所述宿主细胞是外来的。
如本文所用的术语“接种”是指向生物反应器或另一容器提供细胞培养物的过程。所述细胞可能先前已在另一个生物反应器或容器中繁殖。可替代地,所述细胞可以一直是冷冻的并在提供给所述生物反应器或容器之前即时解冻。所述术语是指任何数量的细胞,包括单个细胞。
术语“摇瓶”意指可以容纳一定体积的液体培养基的容器(例如,无菌容器),其具有至少一个渗透表面。例如,摇瓶可以是细胞培养瓶,如t形瓶、锥形瓶或者其任何本领域公认的改进形式。
如本文所用的术语“效价”是指由哺乳动物细胞培养物生产的重组表达的多肽或蛋白质的总量除以给定量的培养基体积。效价通常以每毫升培养基中多肽或蛋白质的毫克数为单位来表示。
在以下小节中进一步详细描述了本公开文本的各个方面。
本发明的方法
在某些实施方案中,本公开文本提供了增加n-1大规模生物反应器细胞培养物的活细胞密度的新方法,其包括在基于非灌注的培养系统中培养表达目的重组多肽的宿主细胞,并且其中活细胞密度增加到至少5×106个细胞/ml。
在某些实施方案中,本公开文本提供了大规模生产目的重组多肽的新方法,所述新方法包括:(1)在基于非灌注的培养系统中在n-1阶段中培养表达目的重组多肽的宿主细胞,其中所述活细胞密度增加到至少5×106个细胞/ml;和(2)在至少1.5×106个/ml的高种子密度的富集培养基中在n生产阶段中培养所述细胞,所述细胞是从非灌注培养系统中的n-1细胞培养物接种的。
宿主细胞
根据本发明,可以利用对细胞培养和对多肽表达敏感的任何哺乳动物细胞或细胞类型。可以根据本发明使用的哺乳动物细胞的非限制性例子包括balb/c小鼠骨髓瘤细胞系(nso/1,ecaccno:85110503);人成视网膜细胞(per.c6(crucell,莱顿,荷兰));由sv40转化的猴肾cv1系(cos-7,atcccrl1651);人胚肾细胞系(亚克隆以在悬浮培养物中生长的293或293细胞,graham等人,j.genvirol.,36:59(1977));婴儿仓鼠肾细胞(bhk,atccccl10);中国仓鼠卵巢细胞±dhfr(cho,urlaub和chasin,proc.natl.acad.sci.usa,77:4216(1980));小鼠塞托利细胞(tm4,mather,biol.reprod.,23:243-251(1980));猴肾细胞(cv1atccccl70);非洲绿猴肾细胞(vero-76,atcccrl-1587);人宫颈癌细胞(hela,atccccl2);犬肾细胞(mdck,atccccl34);buffalo大鼠肝细胞(brl3a,atcccrl1442);人肺细胞(w138,atccccl75);人肝细胞(hepg2,hb8065);小鼠乳腺肿瘤(mmt060562,atccccl51);tri细胞(mather等人,annalsn.y.acad.sci.,383:44-68(1982));mrc5细胞;fs4细胞;以及人肝癌细胞系(hepg2)。在一个实施方案中,本发明被用于培养cho细胞系和从cho细胞系表达多肽和蛋白质。
另外,根据本发明,可以利用任何数量的表达多肽或蛋白质的可商购和非可商购杂交瘤细胞系。本领域技术人员将理解,杂交瘤细胞系可能具有不同的营养需求和/或可能需要不同的培养条件以实现最佳生长以及多肽或蛋白质表达,并且将能够根据需要改变条件。
如上所述,在许多情形中,细胞将被选择或工程化以生产高水平的蛋白质或多肽。通常,例如通过引入编码目的蛋白质或多肽的基因和/或通过引入调节编码所述目的多肽的基因(无论是内源的还是被引入的)的表达的控制元件,将细胞基因工程化以生产高水平的蛋白质。
某些多肽可能对细胞生长、细胞活力或最终以某种方式限制目的多肽或蛋白的生产的一些其他细胞特征具有不利影响。即使在被工程化以表达特定多肽的一种特定类型的细胞群体中,细胞群体内也存在变异性,使得某些单独细胞将生长得更好和/或生产更多的目的多肽。在本发明的某些实施方案中,从业人员根据经验选择细胞系以在选择用于培养细胞的特定条件下稳健生长。在其他实施方案中,基于细胞生长、最终细胞密度、细胞活力百分比、所表达多肽的效价或这些的任何组合或被从业人员认为重要的任何其他条件,选择被工程化以表达特定多肽的单独细胞进行大规模生产。
补料分批细胞培养生产
用于生产目的多肽的典型程序包括用于种子扩增的分批培养和补料分批培养生产阶段。分批种子培养过程传统上包括用特定细胞密度的种子培养物接种大规模生产培养物,在有利于细胞生长和活力的条件下培养所述细胞,并且当所述细胞到达指定细胞密度时将所述种子培养物转移至下一阶段。补料分批培养程序包括用所述细胞生长期间消耗的营养物和其他组分补充所述分批培养物的一个或多个另外的步骤。本领域普通技术人员将认识到,本发明可以用于培养细胞的任何系统中,包括但不限于分批、补料分批和灌注系统。在本发明的某些优选实施方案中,所述细胞在分批或补料分批系统中生长。
富集培养基
本发明提供了富集的化学限定培养基配制品,当按照本文所述的其他培养步骤使用时,相对于在非富集培养基中培养的宿主细胞,所述富集的化学限定培养基配制品增加n-1培养物中宿主细胞的活细胞密度和/或在具有高种子密度的生产培养物中提供更多的营养物。已经显示出对细胞生长或目的多肽的生产具有有益作用的本发明的富集培养基配制品包含相对于标准培养基i)增加的量的碳源和/或ii)增加的营养物。此外,所述碳源可以是:酪蛋白、乳酸盐、右旋糖、果糖、果聚糖、葡萄糖、蔗糖、乳糖、麦芽糖、乙酸盐、甘油、山梨醇、甘露醇、蔗糖、木糖、糖蜜、岩藻糖、葡萄糖胺、葡聚糖、脂肪、油、甘油、乙酸钠、阿拉伯糖、大豆蛋白、可溶性蛋白、棉子糖、直链淀粉、淀粉、胰蛋白胨、酵母提取物及其组合,并且所述营养物可以是氨基酸。相对于非富集培养基,关于碳源和/或营养物,将所述富集培养基用补料培养基富集5%、至少10%、至少15%或至少20%。本领域普通技术人员将理解,本发明的培养基配制品涵盖限定和非限定培养基两者。
如实施例1-3所示,使用富集培养基的出乎意料的结果是,相对于用非富集培养基以分批法培养的宿主细胞,在n-1培养阶段期间用富集培养基以分批法培养的宿主细胞显示出增加的活细胞密度。另外,用富集培养基以分批法培养的宿主细胞显示出与不使用富集培养基以补料分批法培养的宿主细胞相似的活细胞密度和/或细胞活力。因此,用富集培养基以分批法培养的宿主细胞可以实现与用非富集培养基以灌注或补料分批系统培养的宿主细胞相似的结果。
如实施例1-3所示,使用富集培养基的另一个出乎意料的结果是,从在含有富集培养基的分批培养物中生长的细胞接种的生产培养物与用来自不含富集培养基的灌注或补料分批方法的细胞接种的生产培养物具有相似的目的多肽效价。以上列出的条件可以单独使用,也可以相互组合使用。
本发明中公开的这些培养基配制品中的任一种可以任选地根据需要补充激素和/或其他生长因子、特定离子(如钠、氯、钙、镁和磷酸盐)、缓冲液、维生素、核苷或核苷酸、微量元素(通常以极低的最终浓度存在的无机化合物)、氨基酸、脂质、蛋白质水解产物或葡萄糖或其他能源。在本发明的某些实施方案中,用化学诱导剂如六亚甲基-双(乙酰胺)(“hmba”)和丁酸钠(“nab”)补充培养基可能是有益的。为了补充耗尽的营养物或出于其他原因,这些任选的补充剂可以在培养开始时添加,或者可以在稍后的时间点添加。本领域普通技术人员将意识到可以包含在所公开的培养基配制品中的任何期望的或必要的补充剂。
提供哺乳动物细胞培养物
一旦鉴定出表达目的多肽或蛋白的细胞,就将所述细胞通过本领域普通技术人员熟知的多种方法中的任何一种在培养物中繁殖。表达目的多肽或蛋白的细胞通常通过在有助于细胞存活、生长和活力的温度下和培养基中使所述细胞生长来繁殖。初始培养体积可以是任何大小,但通常小于最终生产目的多肽或蛋白所使用的生产生物反应器的培养体积,并且通常在接种生产生物反应器之前将细胞在体积渐增的生物反应器中传代培养数次。一旦细胞达到特定的活细胞密度,则使细胞在生物反应器中生长以进一步增加活细胞的数量。这些生物反应器称为n-1、n-2、n-3等。“n”是指主要生产培养生物反应器,而“n-1”意指主要生产培养之前的生物反应器,以此类推。
可以搅动或摇动细胞培养物,以增加培养基氧合和营养素向细胞分散。可替代地或另外地,可以使用本领域熟知的特殊鼓泡装置来增加和控制培养物的氧合。根据本发明,本领域普通技术人员将理解,控制或调节生物反应器的某些内部条件(包括但不限于ph、温度、氧合等)可能是有益的。
n-3生物反应器中的起始细胞密度可以由本领域普通技术人员选择。根据本发明,所述生产生物反应器中的起始细胞密度可以低至2x104个活细胞/ml。在本发明的某些实施方案中,n-3生物反应器中的起始细胞密度可以在以下范围内:2x104、2x105、2x106、5x106、10x106个活细胞/ml和更高。用富集培养基培养n-3宿主细胞可以导致至少5x106个活细胞/ml至5x106、10x106、15x106、20x106、25x106或30x106个活细胞/ml和更高的活细胞密度。
n-2生物反应器中的起始细胞密度可以由本领域普通技术人员选择。根据本发明,所述生产生物反应器中的起始细胞密度可以低至2x104个活细胞/ml。在本发明的某些实施方案中,n-2生物反应器中的起始细胞密度可以在以下范围内:约2x104个活细胞/ml至约2x105、2x106、5x106、10x106个活细胞/ml和更高。用富集培养基培养n-2宿主细胞可以导致至少5x106个活细胞/ml至10x106、15x106、20x106、25x106或30x106个活细胞/ml和更高的活细胞密度。
n-1生物反应器中的起始细胞密度可以由本领域普通技术人员选择。根据本发明,所述生产生物反应器中的起始细胞密度可以低至每培养体积单个细胞。在本发明的某些实施方案中,所述生产生物反应器中的起始细胞密度可以在以下范围内:2x104个活细胞/ml至约2x105、2x106、5x106、10x106个活细胞/ml和更高。用富集培养基培养n-1宿主细胞可以导致至少5x106个活细胞/ml至约5x106、10x106、15x106、20x106、25x106或30x106个活细胞/ml和更高的活细胞密度。
n生产生物反应器中的起始细胞密度可以由本领域普通技术人员选择。根据本发明,n生产生物反应器中的起始细胞密度可以低至1x106个细胞/ml。在本发明的某些实施方案中,所述生产生物反应器中的起始细胞密度可以在以下范围内:约1x106个活细胞/ml至约2x106、5x106、10x106个活细胞/ml和更高。用富集培养基培养所述宿主细胞可以导致至少1x106个活细胞/ml至约2x106、5x106、10x106、15x106、20x106、25x106或30x106个活细胞/ml和更高的活细胞密度。
通常,在接种下一生产生物反应器之前,可以使n-1的细胞培养物生长到所期望的密度。尽管不需要完全或接近完全活力,但是优选的是大多数细胞在接种之前保持存活的。在本发明的一个实施方案中,可以例如通过低速离心从上清液去除细胞。还可能需要在接种下一个生物反应器之前用培养基洗涤所取出的细胞,以去除任何不需要的代谢废物或培养基组分。所述培养基可以是细胞先前在其中生长的培养基,或者其可以是由本发明的从业人员选择的不同培养基或洗涤溶液。
然后可以将n-1的细胞稀释至适当的密度以接种生产生物反应器。在本发明的某些实施方案中,将细胞稀释到将用于生产生物反应器中的相同培养基中。可替代地,可以将细胞稀释到另一种培养基或溶液中,这取决于本发明的从业人员的需要和期望,或者以适应细胞自身的特定要求,例如,如果在接种生产生物反应器之前要将它们储存一段短的时间。
根据本发明,所述生产生物反应器可以是适合于大规模生产多肽或蛋白质的任何体积。在某些实施方案中,所述生产生物反应器的体积为至少500升。在其他实施方案中,所述生产生物反应器的体积为1,000、2,500、5,000、8000、10,000、15,000或20,000升或更多,或介于其间的任何体积。本领域普通技术人员将知道并且将能够选择用于实践本发明的合适生物反应器。所述生产生物反应器可以由有助于细胞生长和活力的任何材料构成,所述材料不干扰所生产的多肽或蛋白质的表达或稳定性。
在本发明的某些实施方案中,所述生产阶段包括如相对于非富集培养基的富集培养基。例如,相对于非富集培养基,将所述培养基通过补料培养基富集至少5%、至少10%、至少15%、或至少20%。在某些实施方案中,所述富集培养基包含增加的量的碳源(例如,葡萄糖)。在某些实施方案中,所述富集培养基包含增加的量的营养物(例如,氨基酸)。在某些实施方案中,所述富集培养基包含增加的量的碳源和营养物。
所述细胞培养物在n-1阶段或所述生产阶段的温度将主要基于细胞培养物保持存活的温度范围来选择。通常,大多数哺乳动物细胞在约25℃至42℃的范围内生长良好。优选地,哺乳动物细胞在约35℃至40℃的范围内生长良好。本领域普通技术人员将能够根据细胞的需要和从业人员的生产要求选择使细胞生长的一个或多个适当温度。任选地,将所述温度保持在单一的恒定温度下。任选地,将所述温度保持在一定的温度范围内。例如,所述温度可以稳定地升高或降低。可替代地,所述温度可以在不同时间以不连续的量升高或降低。本领域普通技术人员将能够确定应当使用单个温度还是多个温度,以及应当稳定地调节温度还是以不连续的量调节温度。
取决于从业人员的需要和细胞本身的要求,处于n-1阶段或所述生产阶段的细胞可以生长更长或更短的时间量。在一个实施方案中,使细胞生长足以实现活细胞密度的时间段,所述活细胞密度是如果允许其不受干扰地生长,细胞最终将达到的最大活细胞密度的给定百分比。允许所述细胞生长确定的时间段。例如,取决于细胞培养物的起始浓度、细胞生长的温度和细胞的固有生长速率,可以使细胞生长0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20天或更多天。本发明的从业人员将能够根据多肽生产要求和细胞本身的需要来选择生长的持续时间。
监测培养条件
在本发明的某些实施方案中,监测使细胞培养物生长的特定条件。监测细胞培养条件允许确定细胞培养物是否正在以次优水平生产重组多肽或蛋白,或者培养物是否即将进入次优生产阶段。
作为非限制性例子,监测温度、ph、细胞密度、细胞活力、整合的活细胞密度、乳酸盐水平、铵水平、渗透压或表达的多肽或蛋白质的效价可能是有益的或必要的。许多技术是本领域熟知的,这将允许本领域普通技术人员测量这些条件。例如,可以使用血细胞计数器、coulter计数器(vi-cell)或细胞密度检查(cedex)来测量细胞密度。可以通过用台盼蓝染色培养样品来确定活细胞密度。由于仅死细胞吸收台盼蓝,因此可以通过计数细胞总数、将吸收染料的细胞数除以细胞总数并求倒数来确定活细胞密度。hplc可以用于确定乳酸、铵或所表达多肽或蛋白质的水平。可替代地,可以通过标准分子生物技术(如sds-page凝胶的考马斯染色、蛋白质印迹、bradford测定、lowry测定、biuret测定和uv吸光度来确定所表达多肽或蛋白质的水平。监测所表达多肽或蛋白质的翻译后修饰(包括磷酸化和糖基化)也可能是有益或必要的。
表达的多肽的分离
一般来讲,通常将期望分离和/或纯化根据本发明表达的蛋白质或多肽。在一个实施方案中,所述表达的多肽或蛋白质被分泌到培养基中,并因此可以去除细胞和其他固体,如通过离心或过滤(例如作为纯化过程中的第一步)进行。当根据本发明使用时此实施方案特别有用,因为本文所述的方法和组合物导致增加的细胞活力。作为结果,更少的细胞在培养过程期间死亡,并且更少的蛋白水解酶被释放到培养基中,这可能潜在地降低表达的多肽或蛋白质的产量。
重组多肽
本发明的方法可以用于大规模生产任何目的重组多肽,包括治疗性抗体。可以通过本文提供的方法生产的重组多肽的非限制性例子包括抗体(包括完整的免疫球蛋白或抗体片段)、酶(例如,半乳糖苷酶)、蛋白质(例如,人促红细胞生成素、肿瘤坏死因子(tnf)或干扰素α或β)、细胞受体(例如,egfr)或免疫原性或抗原性蛋白质或蛋白质片段(例如,用于疫苗的蛋白质)。本发明范围内的抗体包括但不限于:抗her2抗体,包括曲妥珠单抗
先前的描述应理解为仅是代表性的,并且不旨在进行限制。用于实施本发明的替代方法和材料以及另外的应用对于本领域技术人员将是清楚的,并且旨在包括在所附权利要求中。
实施例
细胞系和培养基
在这些实验中使用了产生三种不同单克隆抗体或多肽的三种不同cho细胞系。所使用的种子、基础和补料培养基是化学限定的。
n-1种子培养
对于分批和补料分批n-1培养物,使细胞在初始体积为80-100ml的250ml摇瓶中或初始体积为1000ml的2l摇瓶中生长。在25mm投掷距离的定轨摇床上使用150rpm的摇动速度。将培养箱设置为36.5℃的恒定温度,并将co2控制为5%。对于分批n-1培养物,种子培养基或者没有进行富集,或者进行了葡萄糖富集,或者进行了葡萄糖和营养物富集。未向分批n-1培养物中添加补料。对于补料分批n-1培养物,从第3天起每天向种子培养基补料。
灌注n-1培养涉及在初始体积为5l的10l细胞袋中使细胞生长。摇摆速度控制在28rpm,并且摇摆角度设定为7°。在第0天与第1天之间将co2控制为4%,然后关闭。将辅助atf-2(repligen)连接到细胞袋以灌注培养物。连续添加新鲜培养基(1倍浓缩),同时根据以下时间表以相同速率连续去除旧培养基:0.5vvdd2-4,增加到1.0vvdd4-5,并且最后增加到2.0vvdd5-6。
生产培养基
在5lsartorius生物反应器中进行补料分批生产生物反应器,其中初始工作体积为3.3l。
分析
使用vi-cell自动细胞计数器(beckmancoulter)离线测量活细胞密度(vcd)和细胞活力。还使用cedexbioht(roche)离线分析培养物样品,以监测葡萄糖、谷氨酰胺、谷氨酸盐、乳酸盐和铵。对于生物反应器培养,还使用bioprofilephox(novabiomedical)离线测量了ph、pco2、po2。将蛋白auplc方法用于测量蛋白质效价,将其报告为归一化值。
使用7.8x30cm,5um的tosohtskg3000swxl柱进行高分子量(hmw)的尺寸排阻色谱法(sec),其中在配备有温控自动进样器和waters2996pda检测器的watersalliancehplc系统(米尔福德,马萨诸塞州)上在280nm处监测等度梯度。
通过成像毛细管等电聚焦(icief)测定电荷变体,这在具有alcott720nv自动进样器(圣何塞,加利福尼亚州)的proteinsimpleice3仪器上进行。将样品与适当的pi标记、两性电解质和尿素混合,并注入涂有碳氟化合物的毛细管中。施加高电压,并且带电的变体迁移到其各自的pi。uv照相机在280nm处捕获图像。鉴定出主峰,并对迁移到酸性范围和碱性范围内的峰进行求和、定量,并报告为相对百分比面积。
使用可商购的试剂盒进行n-聚糖分析,所述试剂盒来自prozyme,具有2-ab(海沃德,加利福尼亚州)的
实施例1
细胞系a:n-1种子培养
对于细胞系a,以分批、具有葡萄糖富集的分批、具有葡萄糖和营养物富集的分批、补料分批或灌注模式使n-1培养物生长。所述分批n-1培养物达到仅15×106个细胞/ml的峰值vcd,并且在接近培养期结束时未能保持高细胞活力(图1a)。相比之下,具有葡萄糖富集的分批n-1培养物达到17×106个细胞/ml的vcd,并保持>99%细胞活力(图1a)。类似地,在第6天,补料分批n-1和具有葡萄糖和营养物富集的分批n-1两者均生长至>20×106个细胞/ml,并且活力保持在>99%(图1a和图1b)。在第6天,灌注n-1培养物中的细胞生长至44×106个细胞/ml,并且活力>99%(图1a和图1b)。
用于生产多肽-1的细胞系a:高密度补料分批生产培养
对于细胞系a,使用在具有富集的葡萄糖的分批、具有富集的葡萄糖和营养物的分批、补料分批或灌注培养物中生长的种子开始高密度补料分批生产培养。
以5×106个细胞/ml的高种子密度接种n生产培养物,持续14天。在第2天以培养体积的3.5%的补料体积开始每日补料。溶解氧(do)保持在40%,并且ph控制在6.8与7.6之间。温度最初保持在36.5℃,并在第4天转变为34℃。
图2a表明,在整个培养期内,所有生产培养物均保持>90%细胞活力。与补料分批种子培养物和具有富集的葡萄糖或者富集的葡萄糖和营养物的分批种子培养物的17×106个细胞/ml相比,灌注种子培养物的最大活细胞密度为22×106个细胞/ml(图2a)。来自灌注种子培养物的多肽-1的效价为大约9.3g/l,而补料分批种子培养物的效价为大约9g/l(图2b)。来自富集了葡萄糖或葡萄糖和营养物的分批种子的目的多肽的效价分别为大约8.5g/l和9g/l。图2c显示在所有n生产条件下,质量属性(如icief、sec和n-聚糖)均相似,而与不同的n-1种子无关。
实施例2
细胞系b:n-1种子培养
对于细胞系b,以分批、具有葡萄糖富集的分批、具有葡萄糖和营养物富集的分批、补料分批或灌注模式使n-1培养物生长。所述分批n-1培养物达到仅24.5×106个细胞/ml的峰值vcd,并且未能保持高活力(图3a和图3b)。相比之下,单独富集了葡萄糖或富集了葡萄糖和营养物两者的分批n-1培养物达到≥25.5×106个活细胞/ml,并保持≥99%细胞活力(图3a和图3b)。类似地,在第5天,补料分批n-1培养物生长到≥30×106个活细胞/ml,并且活力保持在≥99%(图3a和图3b)。在第5天,灌注n-1培养物中的细胞生长到41×106个细胞/ml,并且活力≥99%(图3a和图3b)。
用于生产多肽-2的细胞系b:高密度补料分批生产培养
对于细胞系b,使用在分批、具有富集的葡萄糖和营养物的分批、补料分批或灌注培养物中生长的种子开始高密度补料分批生产培养。
以3×106个细胞/ml的高种子密度接种生产培养物,持续14天。在第2天以培养体积的3.1%的补料体积开始每日补料。溶解氧(do)保持在40%,并且ph控制在6.7与7.6之间。温度保持在36.5℃。
图4a表明,在整个培养期内,所有生产培养物均保持>90%细胞活力。与补料分批和具有富集的葡萄糖或者富集的葡萄糖和营养物的分批种子培养物的仅大约24×106个细胞/ml相比,灌注种子培养物的最大活细胞密度为大约26×106个细胞/ml(图4a)。来自灌注和分批种子(具有富集的葡萄糖和营养物)培养物的目的多肽的效价为大约3.2g/l,而分批和补料分批种子培养物的效价为大约3g/l(图4b)。图4c显示在所有n生产条件下,质量属性(如icief、sec和n-聚糖)均相似,而与不同的n-1种子无关。
实施例3
细胞系c:n-1种子培养
对于细胞系c,以分批、具有葡萄糖富集的分批、具有葡萄糖和营养物富集的分批、补料分批或灌注模式使n-1培养物生长。所述分批n-1培养物达到仅26×106个细胞/ml的峰值vcd,并且未能保持高活力(图5a和图5b)。相比之下,单独富集了葡萄糖或富集了葡萄糖和营养物两者的分批n-1培养物达到≥30×106个活细胞/ml,并保持≥99%细胞活力(图5a和图5b)。类似地,在第5天,补料分批n-1培养物生长到≥33×106个活细胞/ml,并且活力保持在≥99%(图5a和图5b)。在第5天,灌注n-1培养物中的细胞生长到62×106个细胞/ml,并且活力≥99%(图5a和图5b)。
用于生产多肽-3的细胞系c(实验1):使用补料分批或具有富集的葡萄糖和营养物种子的分批的高密度补料分批生产培养
对于细胞系c,使用在补料分批或具有富集的葡萄糖和营养物培养物的分批中生长的种子开始高密度补料分批生产培养。
以6×106个细胞/ml的高种子密度开始生产培养,持续14天。在第2天以培养体积的5%的补料体积开始每日补料(d2-10),然后是初始培养体积的3.3%(d11-13)。以指示量的一半每天进行两次补料。溶解氧(do)保持在40%,并且ph控制在6.8与7.3之间。温度最初保持在36.5℃,并在第6天转变为33℃。
图6a表明,在整个培养期内,所有生产培养物均保持>80%细胞活力。补料分批种子和分批(具有富集的葡萄糖和营养物)种子培养物的最大活细胞密度为大约27×106个细胞/ml(图6a)。来自补料分批和分批(具有富集的葡萄糖和营养物)种子培养物的目的多肽的效价为大约4.3g/l(图6b)。图6c显示在所有n生产条件下,质量属性(如icief、sec和n-聚糖)均相似,而与不同的n-1种子无关。
用于生产多肽-3的细胞系c(实验2):使用补料分批或灌注种子的高密度补料分批生产培养
对于细胞系c,使用在补料分批或灌注培养物中生长的种子开始高密度补料分批生产培养。
以6×106个细胞/ml的高种子密度开始生产培养,持续14天。在第1天以培养体积的3.7%的补料体积开始每日补料。溶解氧(do)保持在40%,并且ph控制在6.8与7.3之间。温度最初保持在36.5℃,并在第6天转变为33℃。
图7a表明,在整个培养期内,所有生产培养物均保持>80%细胞活力。灌注种子培养物的最大活细胞密度为大约33×106个细胞/ml,而补料分批种子培养物的最大活细胞密度为大约30×106个细胞/ml(图7a)。来自灌注和补料分批种子培养物的目的多肽的效价为大约7g/l(图7b)。图7c显示在所有n生产条件下,质量属性(如icief、sec和n-聚糖)均相似,而与不同的n-1种子无关。
实施例4
这三种分子的大规模制造过程是以1000l规模(对于细胞系a)在bristol-myerssquibb的gmp设施中或以500l规模(对于细胞系b和c)在按比例放大设施中进行的。用于细胞系a和b的n-1种子培养物利用富集了葡萄糖和营养物的分批培养物,而将用于细胞系c的n-1种子以补料分批模式培育。所有这三个过程均被显示为稳健的,并且可扩展至1000l或500l。细胞密度、效价和产品质量概况与实验室规模的生物反应器中的卫星培养物的那些一致(图8-图10)。对于细胞系a,由于异常高的效价超过了下游纯化的容量,因此在第10天收获生产培养物。细胞系a的培养持续时间缩短使得能够每周接种新的生产培养物(使用两个生产容器),从而显著提高了生产量。
- 还没有人留言评论。精彩留言会获得点赞!