重组猪细小病毒抗原蛋白及其用途的制作方法
1.本发明是在韩国农林畜牧食品部支援下通过课题号1545016316来实现的,上述课题的研究主管机构为韩国农林畜牧检疫总部,研究项目名称为“农林畜牧检疫检查技术开发(r&d)”,研究课题名称为“利用植物基因临时表达系统的新型猪细小病毒疫苗的开发”,主管机构为韩国农林畜牧检疫总部,研究期间为2018年01月01日~2018年12月31日。
2.本技术要求于2018年12月5日向韩国知识产权局提交的韩国专利申请第10
‑
2018
‑
0155084号的优先权,并且该专利申请的公开内容通过引用并入本说明书中。
3.本发明涉及重组猪细小病毒抗原蛋白及其用途。
背景技术:
4.猪细小病毒(porcine parvovirus,ppv)是一种无包膜(non
‑
enveloped)、单链(single
‑
stranded)、具有约5kb大小的小脱氧核糖核酸(dna)的病毒,是引起猪繁殖障碍的病原体之一。自1965年在德国初次分离后,直到现在仍在包括欧洲、亚洲在内的世界各地流行。猪细小病毒血清型1型主要与繁殖障碍相关,代表性的临床症状有称为smedi综合征的死产(stillbirth)、胎儿干尸化(mummification)、胚胎死亡(embryonic death)以及不孕(infertility)。并且,除繁殖障碍外,还引起皮肤疾病、腹泻以及呼吸器官障碍,因此给养猪产业造成很多经济损失。
5.猪细小病毒感染症会导致母猪繁殖障碍,因此尽管在全世界范围内引发很多问题,但仍未根除。由此,为了最小化养猪农家的生产损失并提高怀孕母猪的分娩率,需要开发具有优秀功效且改善有效性的新型疫苗。
6.当前使用的猪细小病毒感染症诊断法有病毒中和试验(virus neutralization test,vnt)、酶联免疫吸附测定(enzyme linked immunosorbent assay,elisa)、红细胞凝集抑制反应法(hi)等。当前为尝试家畜防疫事业的家畜血清检查及病情鉴定而提供的诊断液有红细胞凝集抑制(hi,hemagglutination inhibition)诊断液。红细胞凝集抑制诊断法必须利用动物(豚鼠(guinea pig))的血细胞,使用起来麻烦,具有为了采取血细胞而要长期饲养动物的困难。中和试验法存在需要在净化工作台(clean bench)培养猪细小病毒,需要3日~4日才能得到结果的问题。
技术实现要素:
7.技术问题
8.本发明人进行了深入的研究和努力,以开发作为抗原蛋白具有优秀的抗原性及免疫原性的重组猪细小病毒抗原蛋白。其结果,优化(optimization)并合成猪细小病毒vp2基因的密码子(codon),查明从由包含其的重组表达载体转化的重组植物体或重组昆虫细胞中获取的猪细小病毒vp2抗原蛋白具有很高的稳定性及免疫原性。
9.因此,本发明的目的在于,提供重组猪细小病毒vp2蛋白表达载体。
10.本发明的再一目的在于,提供表达重组猪细小病毒vp2蛋白的重组植物体或重组
昆虫细胞。
11.本发明的另一目的在于,提供用于猪细小病毒疫苗的组合物。
12.本发明的还有一目的在于,提供用于猪细小病毒诊断的组合物。
13.本发明的又一目的在于,提供用于猪细小病毒诊断的试剂盒。
14.本发明的又一目的在于,提供猪细小病毒诊断方法。
15.解决问题的手段
16.根据本发明的一方面,本发明提供一种重组表达载体,其包含编码猪细小病毒的vp2蛋白的基因。
17.本发明人进行了深入的研究和努力,以开发作为抗原蛋白具有优秀的抗原性及免疫原性的重组猪细小病毒抗原蛋白。其结果,优化(optimization)并合成猪细小病毒vp2基因的密码子(codon),查明从由包含其的重组表达载体转化的重组植物体或重组昆虫细胞中获取的猪细小病毒vp2抗原蛋白具有很高的稳定性及免疫原性。
18.编码上述猪细小病毒vp2蛋白的基因可以由序列3或序列4的碱基序列表示,或者可以具有与其在功能上等同的碱基序列。
19.上述序列3的碱基序列是为了植物体表达而使猪细小病毒82vp2基因的密码子优化的序列。
20.上述序列3的碱基序列是为了植物体表达而使猪细小病毒07vp2基因的密码子优化的序列。
21.上述“功能上等同”是指碱基的附加、取代或缺失的结果,仍与序列3或序列4的碱基序列具有70%以上、优选80%以上、更优选90%以上、进一步优选95%以上的序列同源性,并且可以编码表现出与由序列3或序列4表示的碱基序列编码的蛋白质实质上相同的生理活性的碱基序列。例如,可以包括虽然一部分碱基序列通过缺失(deletion)、取代(substitution)或者插入(insertion)而变形,但仍然能够在功能上起到与编码猪细小病毒vp2蛋白的核酸分子相同作用的变异体(variants)。
22.根据本发明的再一方面,本发明提供一种表达由本发明的上述重组表达载体转化的猪细小病毒vp2蛋白的重组植物体。
23.上述植物体可以为烟草(nicotiana)属植物。
24.上述烟草属植物可以为渐尖叶烟草(nicotiana acuminata)、非洲烟草(nicotiana africana)、花烟草(nicotiana alata)、渐狭叶烟草(nicotiana attenuata)、本塞姆氏烟草(nicotiana benthamiana)、克利夫兰氏烟草(nicotiana clevelandii)、稀少烟草(nicotiana exigua)、粉蓝烟草(nicotiana glauca)、粘烟草(nicotiana glutinosa l.)、蓝格斯多夫烟草(nicotiana langsdorffii)、长花烟草(nicotiana longiflora)、西方烟草(nicotiana occidentalis)、欧布特斯烟草(nicotiana obtusifolia)、耳状烟草(nicotiana otophora)、蓝茉莉叶烟草(nicotiana plumbaginifolia)、夸德瑞伍氏烟草(nicotiana quadrivalvis)、黄花烟草(nicotiana rustica l.)、香甜烟草(nicotiana suaveolens lehm.)、林烟草(nicotiana sylvestris)、普通烟草(nicotiana tabacum l.)或者绒毛状烟草(nicotiana tomentosiformis goodsp.),例如,可以为本塞姆氏烟草。
25.本发明的由包含编码猪细小病毒vp2蛋白的基因的重组表达载体转化的植物体可
以表达猪细小病毒vp2蛋白。在利用上述转化的植物体的情况下,可以在能够栽培植物体的普通实验室中简单制备大量蛋白,并且所获得的猪细小病毒vp2蛋白具有诸如针对豚鼠红细胞的红细胞凝集能力之类的猪细小病毒抗原蛋白固有的生物学功能,不存在因活病毒的处理而产生污染的可能性,因此很安全,并且相比于现有的抗原制备过程,能够非常迅速且准确地大量生产抗原。
26.根据本发明的一实例,从上述重组植物体获得的猪细小病毒vp2抗原蛋白能够有效用于猪细小病毒的诊断。
27.根据本发明的再一方面,本发明提供一种表达由本发明的上述重组表达载体转化的猪细小病毒vp2蛋白的重组昆虫细胞。
28.上述昆虫细胞可以为源自斜纹夜蛾种的草地贪夜蛾(spodoptera frugiperda)的sf
‑
9细胞,但不限于此。
29.根据本发明的一实例,包含于上述重组表达载体的猪细小病毒vp2基因虽由针对植物体表达而优化的序列组成,但在由上述重组表达载体转化的重组昆虫细胞中也有效地表达猪细小病毒vp2蛋白。
30.根据本发明的一实例,从上述重组昆虫细胞获得的猪细小病毒vp2抗原蛋白能够有效用于猪细小病毒的诊断。
31.根据本发明的另一方面,本发明提供包含由上述重组植物体或重组昆虫细胞表达的猪细小病毒vp2蛋白的用于猪细小病毒诊断的组合物及诊断试剂盒。
32.在本发明中,“诊断”是指对病理状态的存在或特征进行确认。从本发明的目的而言,诊断是确认猪细小病毒的发病与否或是否有发病的可能性。
33.上述诊断试剂盒可以使用本技术领域中通常使用的方法来制备。该诊断试剂盒不仅包含猪细小病毒vp2抗原蛋白,还包含本技术领域中通常使用的工具、试剂等。这些工具/试剂包含适当的载体、能够生成可检测信号的标记物质、溶解剂、洗涤剂、缓冲剂、稳定剂等,但不限于此。在标记物质为酶的情况下,还可以包含能够测定酶活性的基质及反应终止剂。适当的载体可以为可溶性载体,例如本技术领域中公知的生理学上可接受的缓冲液,比如磷酸盐缓冲溶液(pbs),不溶性载体,例如聚苯乙烯、聚乙烯、聚丙烯、聚酯纤维、聚丙烯腈、氟树脂、交联右旋糖酐、多糖类、在乳胶上镀层金属的具有磁性的微粒子之类的高分子、其他纸、玻璃、金属、琼脂糖及它们的组合,但不限于此。
34.并且,本发明提供如下猪细小病毒的诊断方法:将由上述重组植物体或重组昆虫细胞表达的猪细小病毒vp2蛋白用作抗原,在试样中通过抗原
‑
抗体反应检测针对猪细小病毒vp2蛋白的抗体。
35.上述抗原
‑
抗体反应可以利用本技术领域中通常使用的所有方法,例如,可以利用选自由组织免疫染色、放射免疫分析法(ria)、酶联免疫吸附测定(elisa)、免疫印迹法(western blotting)、免疫沉淀分析法(immunoprecipitation assay)、免疫扩散分析法(immunodiffusion assay)、补体结合分析法(complement fixation assay)、荧光激活细胞分选术(facs,fluorescence
‑
activated cell sorter)以及蛋白质芯片(protein chip)分析法组成的组中的一种以上的方法。
36.上述试样包括预计被猪细小病毒感染或已被感染的细胞、血液、尿液、唾液、组织等,但不限于此。
37.根据本发明的还有一方面,本发明提供一种针对猪细小病毒的疫苗组合物,其包含猪细小病毒vp2蛋白,上述猪细小病毒vp2蛋白由重组植物体或重组昆虫细胞表达,上述重组植物体或重组昆虫细胞由重组表达载体转化,上述重组表达载体包含编码由序列3的碱基序列或序列4的碱基序列表示的猪细小病毒vp2蛋白的基因。
38.在本说明书中,术语“疫苗组合物”是指给对象(subject)的免疫反应产生积极影响的组合物。上述疫苗组合物向对象提供细胞性免疫反应,例如由细胞毒性t淋巴细胞(ctl,cytotoxic t lymphocyte)或者体液性免疫反应如抗体引起的增强的全身或局部免疫反应。
39.上述疫苗组合物还可以包含药剂学上可接受的载体。本发明的组合物中可包含的药剂学上可接受的载体为制剂时通常使用的载体,包括乳糖、葡萄糖、蔗糖、山梨糖醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、海藻酸盐、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石粉、硬脂酸镁及矿物油等,但不限于此。
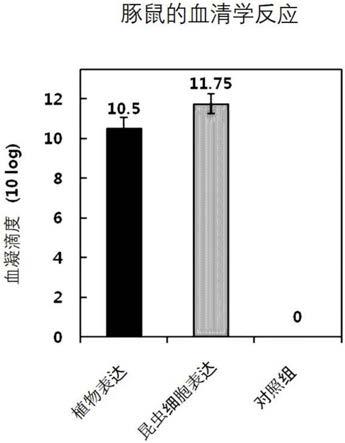
40.除上述成分外,本发明的组合物还可以包含润滑剂、湿润剂、甜味剂、香味剂、乳化剂、悬浮剂、保存剂等。适当的药剂学上可接受的载体及制剂详细记录在remington's pharmaceutical sciences(19th ed.,1995)中。
41.本发明的疫苗组合物可以包含其他组分,例如稳定剂、赋形剂、其他药学上可接受的化合物或任何其他抗原或其一部分。疫苗能够以冻干制剂或悬浮液的形式存在,这些在疫苗生成领域都很普遍。
42.本发明的疫苗组合物的给药形式可以为使用肠溶衣的单位体形式、腹腔内、肌肉内或皮下给药用接种、喷雾剂喷雾、口服或鼻腔内的用途。也能够以饮用水或口服药丸的方式给药。
43.本发明的疫苗组合物也可以通过在同一重组体中表达诸如双重抗原及细胞因子之类的免疫调节分子来将其作为单一疫苗传递,并且可以与免疫增强剂一同给药。在本说明书中,术语“免疫增强剂(adjuvant)”是指通常增加针对抗原的体液或细胞免疫反应的任何物质(例如明矾(alum)、弗氏完全佐剂、弗氏不完全佐剂、脂多糖(lps)、聚肌胞(poly ic)、poly au等)。
44.发明的效果
45.本发明的特征及优点概括如下:
46.(a)本发明提供包含编码猪细小病毒vp2蛋白的基因的重组表达载体、由上述载体转化的重组植物体或重组昆虫细胞、包含从上述重组植物体或重组昆虫细胞获得的猪细小病毒vp2蛋白的针对猪细小病毒的疫苗组合物及用于猪细小病毒诊断的组合物。
47.(b)在利用本发明的重组植物体或重组昆虫细胞的情况下,可以高效地生产猪细小病毒抗原蛋白,利用上述重组植物体或重组昆虫细胞的猪细小病毒抗原蛋白生产方法比其他抗原生产方法表现出更优秀的安全性及稳定性。
48.(c)由于本发明的用于猪细小病毒诊断的组合物利用重组抗原蛋白,因而不存在因活病毒的处理而产生污染的可能性,因此很安全,并且可以在大量的试样中迅速诊断是否感染猪细小病毒。
附图说明
49.图1示出不同菌株(strain)的猪细小病毒的vp2蛋白的序列。
50.图2a为包含编码猪细小病毒82
‑
opt vp2蛋白的基因的重组表达载体的结构的示意图。
51.图2b为包含编码猪细小病毒07
‑
opt vp2蛋白的基因的重组表达载体的结构的示意图。
52.图3a为示出通过免疫印迹法确认在植物体中表达的重组猪细小病毒82
‑
opt vp2蛋白的表达结果的图。
53.其中,rbc:6his:vp2是对由以一系列顺序包含核酮糖
‑
1,5
‑
二磷酸羧化酶(rubisco)转运肽、6xhis以及密码子被优化的猪细小病毒vp2的表达载体转化的植物体中的猪细小病毒vp2的表达的确认,rbc:vp2:6his是对由以一系列顺序包含核酮糖
‑
1,5
‑
二磷酸羧化酶转运肽、密码子被优化的猪细小病毒vp2以及6xhis的表达载体转化的植物体中的猪细小病毒vp2的表达的确认。
54.图3b为示出通过免疫印迹法确认在植物体中表达的重组猪细小病毒07
‑
opt vp2蛋白的表达结果的图。
55.图3c为示出通过免疫印迹法确认由包含密码子未被优化的猪细小病毒vp2的表达载体转化植物体中的猪细小病毒vp2的表达结果的图。
56.其中,6his:vp2是对由包含6xhis及密码子未被优化的猪细小病毒vp2的表达载体转化的植物体中的猪细小病毒vp2的表达的确认,vp2:6his是对由包含密码子未被优化的猪细小病毒vp2及6xhis的表达载体转化的植物体中的猪细小病毒vp2的表达进行确认的结果。
57.图4为示出通过免疫印迹法确认在昆虫细胞中表达的重组猪细小病毒07
‑
opt vp2蛋白的表达结果的图。
58.图5a为示出在猪身上评价在植物体中表达的重组猪细小病毒82
‑
opt vp2蛋白的免疫原性的结果的图。
59.图5b为示出用于评价在植物体中表达的重组猪细小病毒82
‑
opt vp2蛋白的免疫原性的96孔培养板的图。
60.图6a为示出在豚鼠的身上评价在植物体及昆虫细胞中表达的重组猪细小病毒07
‑
opt vp2蛋白的免疫原性的结果的图。
61.图6b为示出用于评价在植物体及昆虫细胞中表达的重组猪细小病毒07
‑
opt vp2蛋白的免疫原性的96孔培养板的图。
62.图7a为示出对在植物体中表达的重组猪细小病毒82
‑
opt vp2蛋白的豚鼠红细胞凝集能力进行确认的结果的图。
63.图7b为示出对在植物体中表达的重组猪细小病毒07
‑
opt vp2蛋白的豚鼠红细胞凝集能力进行确认的结果的图。
具体实施方式
64.以下,通过实施例更为详细地说明本发明。但这些实施例仅用于更为具体地说明本发明,根据本发明的要旨,本发明的范围不受这些实施例的限制,这对本发明所属技术领
域的普通技术人员来说是显而易见的。.
65.实施例
66.实施例1.重组猪细小病毒(ppv)vp2(猪细小病毒82
‑
opt、猪细小病毒07
‑
opt)抗原植物表达载体的制备
67.为了靶向抗原性最高的vp2,使用从猪的流产、死产胎儿的试样中获得的猪细小病毒vp2脱氧核糖核酸序列,通过金斯瑞公司(genescript)的密码子优化程序,以适合本塞姆氏烟草的方式进行优化,并委托bioneer公司合成。被优化的猪细小病毒82
‑
opt vp2核苷酸序列由1740bp组成,猪细小病毒07
‑
opt vp2由1737bp组成。
[0068]1‑
1.重组猪细小病毒82
‑
opt vp2表达载体
[0069]
为了猪细小病毒vp2抗原的植物表达,在pcambia1300载体的camv 35s启动子基因与nos终止子(terminator)之间依次连接编码核酮糖
‑
1,5
‑
二磷酸羧化酶转运肽(transit peptide)的多核苷酸(序列1)、编码6个连续的组氨酸(histidin)的多核苷酸(序列2)以及编码猪细小病毒82vp2蛋白的(序列3)来制备重组猪细小病毒82
‑
opt vp2植物表达载体(图2a)。
[0070]1‑
2.重组猪细小病毒07
‑
opt vp2表达载体
[0071]
为了猪细小病毒vp2抗原植物表达,在pcambia1300载体的camv 35s启动子基因与nos终止子之间依次连接编码核酮糖
‑
1,5
‑
二磷酸羧化酶转运肽的多核苷酸(序列1)、编码6个连续的组氨酸的多核苷酸(序列2)以及编码猪细小病毒07vp2蛋白的(序列3)来制备重组猪细小病毒猪细小病毒07vp2植物表达载体(图2b)。
[0072]
实施例2.在植物体中的重组猪细小病毒vp2(猪细小病毒82
‑
opt、猪细小病毒07
‑
opt)蛋白的表达
[0073]
为了在植物中表达重组猪细小病毒82
‑
opt vp2蛋白或猪细小病毒07
‑
opt vp2,根据制造公司的指示使用gene pulser xcell(bio
‑
rad公司,美国)对上述实施例1中准备的重组表达载体进行电穿孔来将其转化为农杆菌菌株gv3101。使转化的gv3101在含有适当的抗生素的yep培养基(10g的酵母提取物、10g的胨、5g的氯化钠(nacl)、50mg/l的卡那霉素、25mg/l的利福平)中生长直至达到稳定期(stationary phase)。离心分离培养物,在浸润培养基(10mm的mes、10mm的氯化镁(mgcl2)、100mm的乙酰丁香酮)中使用0.5的od 600使沉淀物重悬后,在室温下培养1小时。在25℃的条件下,使用农杆菌悬浮液通过注射器或真空渗透的方法在生长至4周龄~6周龄的本塞姆氏烟草叶中执行农杆菌渗入法(agro
‑
infiltration)。
[0074]
实施例3.确认植物体中重组猪细小病毒vp2(猪细小病毒82
‑
opt,猪细小病毒07
‑
opt)蛋白的表达
[0075]
使用100μl的粉碎缓冲液(20mm的三羟甲基氨基甲烷盐酸盐(tris
‑
hcl)(ph7.5)、150mm的氯化钠(nacl)、1mm的乙二胺四乙酸(edta)、1%的聚乙二醇辛基苯基醚(triton x
‑
100)、0.1%的十二烷基硫酸钠(sds)、5mm的二硫苏糖醇(dtt)以及植物蛋白酶抑制剂混合物(sigma
‑
aldrich公司))粉碎约3cm2的叶组织,在4℃的温度下以20000x g的转速离心分离不溶性残渣10分钟。在12%的十二烷基硫酸钠
‑
聚丙烯酰胺凝胶(sds
‑
page)中分离样品后,移到聚偏氟乙烯(pvdf)膜(millipore merck kgaa of darmstadt公司,德国)上。然后使其与单克隆his抗体(1∶1000稀释(dilution),invitrogen公司)反应后,使用化学发光基
质(chemiluminescent substrate)进行检测。
[0076]
在利用依次连接对编码核酮糖
‑
1,5
‑
二磷酸羧化酶转运肽的多核苷酸
‑
6个连续的组氨酸进行编码的多核苷酸与编码猪细小病毒vp2蛋白(猪细小病毒82
‑
opt vp2蛋白或猪细小病毒07
‑
opt vp2蛋白)的多核苷酸来制备的植物表达载体的情况下,如图(左侧图案)及图3b中所确认,表达表现良好,但在利用通过将组氨酸附着于猪细小病毒vp2蛋白后面来制备的植物表达载体的情况下,未形成蛋白的表达(图3a右侧图案)。
[0077]
并且,在由包含密码子未被优化的猪细小病毒vp2的表达载体转化的植物体中,猪细小病毒vp2没有表达(图3c)。
[0078]
实施例4.重组猪细小病毒07
‑
opt vp2抗原的昆虫细胞表达载体的制备
[0079]
扩增猪细小病毒07
‑
opt vp2序列,将其克隆到pdrive载体(vector)后分析碱基序列。为了杆状病毒(baculovirus)的重组表达,利用pfastbactm ht b vector(invitrogen公司)进行克隆。
[0080]
实施例5.在昆虫细胞中的重组猪细小病毒07
‑
opt vp2蛋白的表达及确认
[0081]
为了在昆虫中表达重组猪细小病毒07
‑
opt vp2蛋白,根据制造公司的指示,通过42℃热休克(heat shock)将重组表达载体转化为dh10bac。使用s.o.c培养基在37℃的温度下培养转化的dh10bac4小时。稀释为1/10后,向lb培养基添加庆大霉素(gentamycin)(7μg/ml)抗生素后,在37℃的温度下培养48小时。将10个菌株(colony)移到10个培养板(plate)后,使用puc/m13引物(primer)通过聚合酶链式反应(pcr)确认重组猪细小病毒07
‑
opt vp2序列。使用cellfectin ii reagent(invitrogen公司)向sf
‑
9细胞转染(transfection)。
[0082]
在27℃的温度下转染,5天后收获细胞,在4℃的温度下提取蛋白质30分钟。为了提纯重组猪细小病毒vp2蛋白的n
‑
末端结合有组氨酸的vp2蛋白,使用ni
‑
nta树脂来分离蛋白质。
[0083]
将使用聚偏氟乙烯膜提纯的蛋白质转移后,使用5%的牛血清白蛋白(bsa)阻塞膜。使用第一抗体mouse
‑
his(1∶1000)在常温下反应1小时后使用tbst缓冲液洗涤5次,然后使用第二抗体mouse
‑
hrp(1∶5000)在常温下反应1小时后使用tbst缓冲液洗涤5次,然后与增强化学发光剂(ecl,enhanced chemiluminescence)反应来确认蛋白质的表达(图4)。
[0084]
实施例6.重组猪细小病毒vp2蛋白的免疫原性评价
[0085]6‑
1.重组猪细小病毒82
‑
opt vp2蛋白免疫原性评价
[0086]
以1∶1的比例混合在植物体表达的重组猪细小病毒82
‑
opt vp2蛋白与氢氧化铝凝胶佐剂(aluminium hydroxide gel adjuvant)后,以25000ha unit的量对100日龄~110日龄的猪进行第一次接种,2周后进行第二次接种,2周后进行采血来测定血凝滴度(hi titer)。其结果,确认平均27的抗体滴度(图5a及图5b)。
[0087]6‑
2.重组猪细小病毒07
‑
opt vp2蛋白的免疫原性评价
[0088]
分别使用500ha unit的在昆虫细胞中表达的重组猪细小病毒07
‑
opt vp2蛋白与利用植物表达系统表达的重组猪细小病毒07
‑
opt vp2蛋白对豚鼠进行第一次接种,2周后进行第二次接种,2周后进行采血来测定血凝滴度(hi titer)。其结果,在植物体中表达的重组猪细小病毒07
‑
opt vp2蛋白表现出2
10
的平均抗体滴度,在昆虫细胞中表达的重组猪细小病毒07
‑
opt vp2蛋白表现出2
11
的平均抗体滴度(图6a及图6b)。
[0089]
实施例7.红细胞凝集反应(ha)
[0090]7‑
1.重组猪细小病毒82
‑
opt vp2蛋白的红细胞凝集能力
[0091]
猪细小病毒表现出凝集豚鼠红细胞的特征,参考senda et al.(1986)的论文进行红细胞凝集反应。在96孔u型培养板中将在本塞姆氏烟草中表达的猪细小病毒82
‑
opt vp2蛋白稀释2倍后,与0.6%的豚鼠红细胞混合后在37℃的温度下反应1小时后,对结果进行解析。
[0092]
重组猪细小病毒82
‑
opt vp2蛋白表现出2
11
ha unit(8g/植物)的豚鼠红细胞凝集能力,由此确认在植物中表达的重组猪细小病毒82
‑
opt vp2蛋白的抗原性(表1、图7a)。
[0093]
表1
[0094][0095]7‑
2.重组猪细小病毒07
‑
opt vp2蛋白的红细胞凝集能力
[0096]
猪细小病毒表现出凝集豚鼠红细胞的特征,参考senda et al.(1986)的论文进行红细胞凝集反应。在96孔u型培养板中将在本塞姆氏烟草中表达的猪细小病毒07
‑
opt vp2蛋白稀释2倍后,与0.6%的豚鼠红细胞混合后在37℃的温度下反应1小时后,对结果进行解析。
[0097]
重组猪细小病毒07
‑
opt vp2蛋白表现出25ha unit(8g/植物)的豚鼠红细胞凝集能力,由此确认在植物中表达的重组猪细小病毒07
‑
opt vp2蛋白的抗原性(表2、图7b)。
[0098]
表2
[0099]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1