衔接分子、该衔接分子与生物分子结合的生物分子-衔接分子复合体、生物分子分析装置及生物分子分析方法与流程
1.本发明涉及核酸等生物分子的分析所使用的衔接分子、结合有该衔接分子的生物分子、生物分子分析装置以及生物分子分析方法。
背景技术:
2.蛋白质、核酸分子等生物分子分别具有连接了氨基酸、核苷酸这样的单体的结构。关于这些生物分子的蛋白质,使用将埃德曼法自动化的装置(被称为肽测序仪或蛋白质测序仪)来确定单体序列。作为确定核酸分子的单体序列(碱基序列)的装置,已知应用了sanger法、maxam-gilbert法的第1代测序仪,使用了组合有焦磷酸测序法、桥式pcr法和边合成边测序(sequence-by-synthesis,sbs)技术的方法的第2代测序仪。
3.此外,与这些各种测序仪不同,不进行伸长反应、荧光标记,直接电计测生物分子的单体序列的方法在下一代测序仪的领域受到关注。具体而言,使具有上述单体序列结构的生物分子通过纳米尺寸的孔,检测此时产生的电信号,基于电信号的变化确定单体序列的方法。现在,更具体而言,对于核酸分子,纳米孔dna测序方式的研究开发正在积极进行,被实用化。
4.在该纳米孔dna测序方式中,利用计测dna链通过形成于薄膜的细孔(以下称为“纳米孔”。)而产生的封闭电流,从而计测碱基序列。即,根据dna链所包含的各个碱基种类的不同而封闭电流发生变化,从而利用计测封闭电流量,由此能够依次鉴定碱基种类。在该方式中,与上述各种测序仪不同,不需要施加将dna链作为模板的酶的扩增反应、荧光体等标记物。因此,纳米孔dna测序方式与以往的各种测序仪相比,能够高吞吐量且低运行成本,且能够长碱基的dna解读。
5.该纳米孔dna测序方式一般而言,通过具备充满电解质溶液的第1和第2液槽;将该第1和第2液槽隔开且具有纳米孔的薄膜;以及设置于第1和第2液槽的第1和第2电极的生物分子分析用器件来实现。生物分子分析用器件也能够作为阵列器件来构成。阵列器件是指具备多个通过薄膜隔开的液室的组的器件。例如,能够使第1液槽为共同槽,使第2液槽为多个单独槽。在该情况下,共同槽和单独槽各自配置电极。
6.在该构成中,对于第1液槽与第2液槽之间施加电压,且纳米孔中流动与纳米孔径相应的离子电流。此外,纳米孔中,形成有与施加的电压相应的电位梯度。如果将生物分子导入第1液槽,则与扩散现象和该产生的电位梯度相应,生物分子介由纳米孔而输送至第2液槽。离子电流的大小以一次近似计与纳米孔的截面积成比例。如果dna通过纳米孔,则dna封闭纳米孔,有效截面积减少,因此离子电流减少。将该电流称为封闭电流。以封闭电流的大小为基础,判别dna的单链与双链的差异、碱基的种类。
7.此外,还已知如下方式:通过在纳米孔的内侧面等对置地设置探针电极对,对于电极间施加电压,从而测定通过纳米孔时的dna与探针电极间的隧穿电流,由隧穿电流的大小判别碱基的种类。
8.作为纳米孔dna测序方式的课题之一,可举出通过纳米孔的dna的运输控制。在利用封闭电流量计测dna链所包含的各个碱基种类的差异时,认为由计测时的电流噪声和dna分子的摇动的时间常数,需要使dna的纳米孔通过速度在1个碱基附近为100μs以上。然而,dna的纳米孔通过速度通常在1个碱基附近快达1μs以下,难以充分地计测来源于各碱基的封闭电流。
9.作为运输控制法之一,有如下方法:在dna聚合酶进行互补链合成反应时、解旋酶解开双链dna时,利用对成为模板的单链dna进行输送控制的力(例如,参照非专利文献1)。dna聚合酶与成为模板的dna进行结合,从与模板dna互补结合的引物的端部进行互补链合成反应。在第1液槽中,dna聚合酶在纳米孔附近进行互补链合成反应,从而介由纳米孔将模板dna运输至第2液槽。将该dna聚合酶、解旋酶称为分子发动机。
10.此外,如专利文献1所记载的那样,通过使解析对象的单链dna介由纳米孔在第1液槽与第2液槽之间往复运动,从而能够提高计测精度。即,使解析对象的单链dna在第1液槽与第2液槽之间往复运动,进行多次计测,从而能够校正单次测定中产生的错误。此时,如专利文献1所记载那样,通过在解析对象的单链dna中的一方端部结合第一阻断分子(与纳米孔径相比大),从而从该单链dna的另一方端部介由纳米孔,使单链dna移动至第2液槽,在第2液槽内相对于单链dna的另一方端部结合第二阻断分子(与纳米孔径相比大)。由此,能够使单链dna的一方端部保留于第1液槽内,另一方端部保留于第2液槽内,能够防止进行往复运动时,单链dna从纳米孔脱落。
11.现有技术文献
12.非专利文献
13.非专利文献1:gerald m cherf et al.,nat.biotechnol.30,no.4,p.349-353,2012
14.专利文献
15.专利文献1:日本专利第5372570号
技术实现要素:
16.发明所要解决的课题
17.可是,在专利文献1所公开的纳米孔dna测序方式中,在使解析对象的双链dna变性为单链dna的状态下通过纳米孔。即,以往,在纳米孔dna测序方式中,需要将解析对象的双链dna变性为单链dna的处理。因此,在纳米孔dna测序方式中,存在该处理需要时间、成本,复杂这样的问题。
18.此外,即使在非专利文献1等所公开的方式中,解析对象的核酸为单链dna,在将双链dna作为解析对象的情况下,需要变性处理,具有与专利文献1所公开的纳米孔dna测序方式同样的问题。
19.因此,本发明鉴于上述实际情况,其目的在于提供能够避免将解析对象的双链dna进行变性处理这样的复杂性的衔接分子、该衔接分子与生物分子结合的生物分子-衔接分子复合体、生物分子分析装置以及生物分子分析方法。
20.用于解决课题的方法
21.为了达成上述目的,本发明人等进行了深入研究,结果发现,通过设计具有能够通
过纳米孔的单链区域的衔接分子,将该衔接分子与解析对象的生物分子进行连接,从而不需要该双链dna的变性处理,由此完成本发明。
22.本发明包含以下。
23.(1)一种衔接分子,其具备:
24.双链核酸区域,其具有与解析对象的生物分子直接或间接地结合的一方端部,且由彼此互补的碱基序列形成,
25.一对单链核酸区域,其连接于上述双链核酸区域中与上述一方端部不同的另一方端部,且由彼此不互补的碱基序列形成,以及
26.嵌段分子,其配置于上述一对单链核酸区域中一方的单链核酸区域,且直径大于上述生物分子的解析装置中的纳米孔的直径。
27.(2)根据(1)所述的衔接分子,其特征在于,上述嵌段分子配置于上述一对单链核酸区域中端部为3’末端的单链核酸区域。
28.(3)根据(1)所述的衔接分子,其特征在于,上述嵌段分子为能够与上述单链核酸区域结合的分子或由上述单链核酸区域内的互补区域所形成的发夹结构。
29.(4)根据(1)所述的衔接分子,其特征在于,上述一对单链核酸区域中,端部为3’末端的单链核酸区域具备能够与分子发动机结合的分子发动机结合部。
30.(5)根据(4)所述的衔接分子,其特征在于,具备上述分子发动机结合部的单链核酸区域在与该分子发动机结合部相比靠3’末端侧具备能够与引物杂交的引物结合部。
31.(6)根据(5)所述的衔接分子,其特征在于,在上述分子发动机结合部与上述引物结合部之间,具有上述分子发动机不能结合的间隔区。
32.(7)根据(1)所述的衔接分子,其特征在于,上述一对单链核酸区域中,端部为5’末端的单链核酸区域中,从5’末端直至至少第2位的碱基由胸腺嘧啶形成。
33.(8)根据(1)所述的衔接分子,其特征在于,上述双链核酸区域具有标记序列。
34.(9)一种生物体-衔接分子复合体,其包含解析对象的生物分子以及与该生物分子的两末端直接或间接地结合的上述(1)~(8)中任一项所述的衔接分子。
35.(10)根据(9)所述的生物体-衔接分子复合体,其特征在于,上述解析对象的生物分子为双链核酸。
36.(11)一种生物体分析装置,其具备:
37.具有纳米孔的薄膜,
38.隔着上述薄膜对置的第1液槽和第2液槽,
39.以在上述第1液槽中填充有包含(9)或(10)所述的生物体-衔接分子复合体的电解质溶液、并且在上述第2液槽中填充有电解质溶液的状态,对于第1液槽与第2液槽之间施加电压的电压源,以及
40.以在上述第1液槽与上述第2液槽之间形成所期望的电位梯度的方式控制上述电压源的控制装置。
41.(12)一种生物分子的分析方法,其特征在于,具备下述工序:
42.以在隔着具有纳米孔的薄膜对置的第1液槽和第2液槽中,在第1液槽内填充有包含上述(9)或(10)所述的生物体-衔接分子复合体的电解质溶液,且在第2液槽内填充有电解质溶液的状态,对于第1液槽与第2液槽之间施加电压,形成使第1液槽侧为负或接地电
位、使第2液槽为正电位的电位梯度的工序;以及
43.测定上述生物体-衔接分子复合体从上述第2液槽朝向上述第1液槽通过上述纳米孔时产生的信号的工序,
44.在形成上述电位梯度的工序中,生物体-衔接分子复合体中的单链核酸区域介由上述纳米孔导入至上述第2液槽内,通过电位梯度,上述生物体-衔接分子复合体从上述第1液槽朝向上述第2液槽进行移动。
45.(13)根据(12)所述的生物分子的分析方法,其特征在于,上述生物体-衔接分子复合体中,在端部为3’末端的单链核酸区域配置有上述嵌段分子,端部为5’末端的单链核酸区域介由上述纳米孔导入至上述第2液槽内,上述生物体-衔接分子复合体通过电位梯度从上述第1液槽朝向上述第2液槽移动,通过配置于端部为3’末端的单链核酸区域的嵌段分子与纳米孔进行接触,从而上述生物体-衔接分子复合体从上述第1液槽朝向上述第2液槽的移动停止。
46.(14)根据(12)所述的生物分子的分析方法,其特征在于,上述生物体-衔接分子复合体在端部为3’末端的单链核酸区域具有分子发动机结合部,
47.填充于上述第1液槽的电解质溶液包含能够与上述分子发动机结合部结合的分子发动机,
48.该分子发动机与上述分子发动机结合部结合,通过该分子发动机,使上述生物体-衔接分子复合体从上述第2液槽朝向上述第1液槽进行移动。
49.(15)根据(12)所述的生物分子的分析方法,其特征在于,上述生物体-衔接分子复合体在端部为3’末端的单链核酸区域具有分子发动机结合部,在与该分子发动机结合部相比靠3’末端侧具有引物结合部,
50.填充于上述第1液槽的电解质溶液包含能够与上述分子发动机结合部结合的分子发动机以及能够与上述引物结合部杂交的引物,
51.上述分子发动机通过由与引物结合部杂交的引物合成互补链,从而使上述生物体-衔接分子复合体从上述第2液槽朝向上述第1液槽进行移动。
52.(16)根据(12)所述的生物分子的分析方法,其特征在于,上述生物体-衔接分子复合体在端部为3’末端的单链核酸区域具有分子发动机结合部;在与该分子发动机结合部相比靠3’末端侧具有引物结合部;在该分子发动机结合部与该引物结合部之间具有上述分子发动机不能结合的间隔区,
53.填充于上述第1液槽的电解质溶液包含能够与上述分子发动机结合部结合的分子发动机以及能够与上述引物结合部杂交的引物,
54.在上述分子发动机与上述纳米孔接触的状态下,上述分子发动机通过由与引物结合部杂交的引物合成互补链,从而使上述生物体-衔接分子复合体从上述第2液槽朝向上述第1液槽进行移动。
55.(17)根据(12)所述的生物分子的分析方法,其特征在于,在测定上述信号的工序中,在测定来自上述衔接分子中的特定的区域的信号的阶段,将施加于第1液槽与第2液槽之间的电压进行反转,形成使第1液槽侧为正电位、使第2液槽为负或接地电位的电位梯度。
56.(18)根据(12)所述的生物分子的分析方法,其特征在于,填充于上述第2液槽的电解质溶液包含能够与上述生物体-衔接分子复合体中的单链核酸区域的5’末端侧结合的分
子,
57.上述分子结合于介由上述纳米孔导入至上述第2液槽内的单链核酸区域的5’末端。
58.(19)根据(12)所述的生物分子的分析方法,其特征在于,通过控制施加于上述第1液槽与上述第2液槽之间的电压,从而使上述生物体-衔接分子复合体在上述第1液槽与上述第2液槽之间往复移动,重复进行测定上述信号的工序。
59.发明的效果
60.本发明涉及的衔接分子以直接或间接地结合于解析对象的生物分子的状态,在端部具有由彼此不互补的碱基序列形成的一对单链核酸区域。该单链核酸区域通过导入至纳米孔内,从而能够将解析对象的生物分子容易地诱导至纳米孔。此外,在解析对象的生物分子为双链的核酸的情况下,从该单链核酸区域通过纳米孔,从而能够将双链的核酸容易地解开(unzip)为单链的核酸。
61.本发明涉及的生物体-衔接分子复合体为上述衔接分子直接或间接地结合于解析对象的生物分子的生物体-衔接分子复合体,在端部具有由彼此不互补的碱基序列形成的一对单链核酸区域。该单链核酸区域能够导入至纳米孔内。此外,在解析对象的生物分子为双链的核酸的情况下,从该单链核酸区域通过纳米孔,从而能够将双链的核酸容易地解开(unzip)为单链的核酸。
62.本发明涉及的生物分子的分析方法能够通过第1液槽与第2液槽之间的电位梯度,将上述生物体-衔接分子复合体的单链核酸区域导入至纳米孔内,能够使上述生物体-衔接分子复合体从上述第1液槽朝向上述第2液槽进行移动。在解析对象的生物分子为双链的核酸的情况下,从该单链核酸区域通过纳米孔,从而能够将双链的核酸容易地解开(unzip)为单链的核酸。
附图说明
63.图1为概略地显示应用了本发明的生物分子分析装置的构成图。
64.图2为示意性示出第1实施方式涉及的衔接分子的构成图。
65.图3为示意性示出使用第1实施方式涉及的衔接分子来分析生物分子的工序的构成图。
66.图4为图3所示的工序的继续,示意性示出使用第1实施方式涉及的衔接分子来分析生物分子的工序的构成图。
67.图5为图4所示的工序的继续,示意性示出使用第1实施方式涉及的衔接分子来分析生物分子的工序的构成图。
68.图6a为图5所示的工序的继续,示意性示出使用第1实施方式涉及的衔接分子来分析生物分子的工序的构成图。
69.图6b为图5所示的工序的继续,示意性示出使用第1实施方式涉及的衔接分子来分析生物分子的工序的构成图。
70.图7为示意性示出第2实施方式涉及的衔接分子的构成图。
71.图8a为示意性示出使用第2实施方式涉及的衔接分子来分析生物分子的工序的构成图。
72.图8b为图8a所示的工序的继续,示意性示出使用第2实施方式涉及的衔接分子来分析生物分子的工序的构成图。
73.图9a为示意性示出使用第2实施方式涉及的衔接分子来分析生物分子的工序中的重要部分的构成图。
74.图9b为图9a所示的工序的继续,示意性示出使用第2实施方式涉及的衔接分子来分析生物分子的工序中的重要部分的构成图。
75.图9c为图9b所示的工序的继续,示意性示出使用第2实施方式涉及的衔接分子来分析生物分子的工序中的重要部分的构成图。
76.图9d为图9c所示的工序的继续,示意性示出使用第2实施方式涉及的衔接分子来分析生物分子的工序中的重要部分的构成图。
77.图9e为图9d所示的工序的继续,示意性示出使用第2实施方式涉及的衔接分子来分析生物分子的工序中的重要部分的构成图。
78.图9f为图9e所示的工序的继续,示意性示出使用第2实施方式涉及的衔接分子来分析生物分子的工序中的重要部分的构成图。
79.图9g为图9f所示的工序的继续,示意性示出使用第2实施方式涉及的衔接分子来分析生物分子的工序中的重要部分的构成图。
80.图10为表示本实施例中进行的各种反应的反应液组成和反应条件的图。
81.图11为示意性示出本实施例中设计的衔接分子的碱基序列及其二次结构的图。
82.图12为表示将本实施例所测定的封闭电流值进行了标准化的结果的特性图。
具体实施方式
83.以下,参照附图详细地说明本发明涉及的衔接分子、生物体-衔接分子复合体、生物分子的分析方法。然而,这些附图表示按照本发明的原理的具体的实施方式,它们是为了理解本发明而设置的,绝不是用于限定性地解释本发明。
84.[第1实施方式]
[0085]
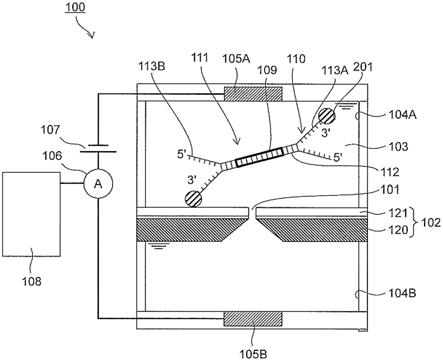
图1表示分析衔接分子与解析对象的生物分子直接或间接地连接而成的生物体-衔接分子复合体的生物分子分析装置的一构成例。图1所示的生物分子分析装置为以封闭电流方式测定离子电流的生物分子分析用器件,其具备:形成有纳米孔101的基板102;以夹持基板102并与基板102相接的方式配置,在其内部充满有电解质溶液103的一对液槽104(第1液槽104a和第2液槽104b);以及与第1液槽104a和第2液槽104b的各自相接的一对电极105(第1电极105a和第2电极105b)。测定时,对于一对电极105之间从电压源107施加预定的电压,在一对电极105之间流动电流。电极105之间流动的电流的大小通过电流计106进行计测,其计测值通过计算机108进行分析。
[0086]
电解质溶液103使用例如kcl、nacl、licl、cscl。电解质溶液103在第1液槽104a和第2液槽104b中可以为相同组成,也可以为不同的组成。另外,第1液槽104a中,填充有包含将详细情况进行后述的生物体-衔接分子复合体等的电解质溶液103。第2液槽104b中的电解质溶液103中,为了抑制生物分子的自身互补链形成,也能够混合存在4m以上的尿素、dmso、dmf、naoh。此外,为了生物分子的稳定化,也能够使缓冲剂混合存在。作为缓冲剂,使用tris、edta、pbs等。第1电极105a和第2电极105b例如能够由ag、agcl、pt这样的具有导电
性的材料来制作。
[0087]
填充于第1液槽104a内的电解质溶液103包含含有解析对象的生物分子109(双链dna等)和衔接分子110的生物体-衔接分子复合体111。衔接分子110如图2所示那样,具备:与生物分子109直接结合的双链核酸区域112;双链核酸区域112中与生物分子109所结合的端部不同的端部相连接,由彼此不互补的碱基序列形成的一对单链核酸区域113a和113b;以及单链核酸区域113a和113b中的任一方的末端所配置的嵌段分子201。另外,单链核酸区域113a具有3’末端,单链核酸区域113b具有5’末端。图2所示的例子中,嵌段分子201配置于具有3’末端的单链核酸区域113a的端部。嵌段分子201可以不配置于单链核酸区域113a的端部,而配置于具有5’末端的单链核酸区域113b的端部。
[0088]
另外,可以在填充于第1液槽104a内的电解质溶液103中添加生物分子109、衔接分子110和dna连接酶,在填充于第1液槽104a内的电解质溶液103内形成生物体-衔接分子复合体111。
[0089]
此外,虽然没有图示,但是衔接分子110与生物分子109可以间接地连接。所谓间接地连接,是指包含介由预定的碱基长度的核酸片段将衔接分子110与生物分子109进行连接;以及介由根据生物分子109的种类而导入的官能团将衔接分子110与生物分子109进行连接的含义。
[0090]
进一步,衔接分子110优选双链核酸区域112中的与生物分子109连接的端部成为3’突出末端(例如,dt突出末端)。通过使该端部成为3’da突出末端,从而能够防止在将衔接分子110与生物分子109进行连接时,形成衔接分子110的二聚体。
[0091]
进一步,在衔接分子110中,双链核酸区域112的长度和碱基序列没有特别限定,能够设为任意的长度和任意的碱基序列。例如,作为双链核酸区域112的长度,能够设为5~100个碱基长度,能够设为10~80个碱基长度,能够设为15~60个碱基长度,能够设为20~40个碱基长度。
[0092]
进一步,在衔接分子110中,单链核酸区域113a和113b的长度和碱基序列没有特别限定,能够设为任意的长度和任意的碱基序列。另外,单链核酸区域113a和113b可以为彼此相同的长度,也可以为不同的长度。单链核酸区域113a和113b可以具有彼此共同的碱基序列,如果彼此不互补,则可以具有完全不同的碱基序列。所谓不互补,是指单链核酸区域113a和113b的碱基序列整体中互补的序列的比例为30%以下,优选为20%以下,更优选为10%以下,进一步优选为5%以下,最优选为3%以下。
[0093]
作为单链核酸区域113a和113b的长度,例如,能够设为10~200个碱基长度,能够设为20~150个碱基长度,能够设为30~100个碱基长度,能够设为50~80个碱基长度。作为一例,特别是具有5’末端的单链核酸区域113b中从5’末端直至至少第2位的碱基序列、优选从5’末端直至第5位的碱基序列、更优选从5’末端直至第7位的碱基序列为由胸腺嘧啶形成的序列。此外可以是,具有5’末端的单链核酸区域113b中90%以上为由胸腺嘧啶形成的碱基序列、优选100%为由胸腺嘧啶形成的碱基序列。通过使具有5’末端的单链核酸区域113b的端部中直至第2位的碱基序列,优选直至第5位的碱基序列,更优选直至第7位的碱基序列成为胸腺嘧啶,或者具有5’末端的单链核酸区域113b中的胸腺嘧啶的比例处于该范围,从而能够防止高级结构的形成,能够维持易于导入至纳米孔101的形状。
[0094]
这里,所谓嵌段分子201,是指具有防止第1液槽104a中存在的被解开为单链的生
物体-衔接分子复合体202介由纳米孔101脱落至第2液槽104b的功能的构成。因此,作为嵌段分子201,可以为与单链核酸区域113a结合的分子,也可以成为单链核酸区域113b的末端附近所形成的高级结构。作为能够用作嵌段分子201的分子,可以使用例如抗生物素蛋白、链亲和素、对于地高辛(digoxigein)(dig)的抗dig抗体与珠(beads)的复合体等。此外,作为能够用作嵌段分子201的高级结构,可举出单链核酸区域113a的3’末端部所形成的分子内发夹结构、三链dna结构。
[0095]
此外,嵌段分子201优选形成与纳米孔101的大小(直径)相比充分大的大小。例如,作为相对于纳米孔101的直径的嵌段分子201的大小,只要是能够阻止生物分子109的行进的大小即可,例如期望为1.2~50倍左右。更详细地说,在作为生物分子109测定单链dna的情况下,其直径为大约1.5nm,因此如果作为纳米孔101的直径为1.5nm~2.5nm左右,则能够使用链亲和素(直径为大约5nm)作为嵌段分子201。另外,在使链亲和素结合于单链核酸区域113a的末端时,使生物素结合于该末端。末端的生物素化能够使用市售的试剂盒。此外,作为链亲和素,没有特别限定,例如,可以为使与生物素的结合部位成为1个地方的方式导入有突变的突变型链亲和素。
[0096]
另一方面,基板102由基材120以及形成于基材120的一主面的薄膜121来构成。纳米孔101形成于薄膜121。此外,虽然没有图示,但基板203可以具有绝缘层。基材120可以由电绝缘体的材料,例如无机材料和有机材料(包含高分子材料)来形成。作为构成基材120的电绝缘体材料的例子,可举出硅(silicone)、硅化合物、玻璃、石英、聚二甲基硅氧烷(pdms)、聚四氟乙烯(ptfe)、聚苯乙烯、聚丙烯等。作为硅化合物,可举出氮化硅、氧化硅、碳化硅等、氮氧化硅。特别是基材120可以由这些任意的材料来制作,例如可以为硅或硅化合物。
[0097]
基板102的尺寸和厚度只要能够设置纳米孔101,就不受特别限定。基板102可以由本技术领域所公知的方法来制作,或也可以作为市售品来获得。例如,基板102可以使用光刻或电子射线光刻、以及蚀刻、激光消融、注射成型、铸造、分子束外延、化学蒸镀(cvd)、介电击穿、电子射线或聚焦离子束等技术来制作。另外,基板102为了避免对于表面的目标外的分子的吸附,可以进行涂布。
[0098]
基板102具有至少1个纳米孔101。纳米孔101具体而言,设置于薄膜121,但是根据情况,可以设置于薄膜121和基材120。这里,所谓“纳米孔”和“孔”,为具有纳米(nm)尺寸(即,具有1nm以上且小于1μm)的直径的贯通孔,为贯通基板102而将第1液槽104a与第2液槽104b进行连通的孔。
[0099]
基板102优选具有用于设置纳米孔101的薄膜121。即,通过将适于形成纳米尺寸的孔的材料和厚度的薄膜121形成于基板120上,从而能够将纳米孔101简便并且有效地设置于基板102。从纳米孔101形成的容易性考虑,薄膜121的材料优选为例如氧化硅(sio2)、氮化硅(sin)、氮氧化硅(sion)、金属氧化物、金属硅酸盐等。此外,薄膜121(和根据情况为基板102整体)可以实质上为透明的。这里所谓“实质上透明”,是指能够透过外部光大约50%以上,优选为80%以上。此外薄膜可以为单层,也可以为多层。
[0100]
薄膜121的厚度为1nm~200nm,优选为1nm~50nm,更优选为1nm~20nm。薄膜121可以通过本技术领域中公知的技术,例如减压化学气相生长(lpcvd),形成于基材120上。
[0101]
另外,优选在薄膜121上也设置绝缘层。绝缘层的厚度优选为5nm~50nm。绝缘层能
够使用任意绝缘体材料,例如优选使用硅或硅化合物(氮化硅、氧化硅等)。
[0102]
纳米孔101的尺寸可以根据分析对象的生物体高分子的种类选择适当的尺寸。纳米孔可以具有均匀的直径,但是可以根据部位具有不同的直径。基板102的薄膜121所设置的纳米孔的最小直径部,即纳米孔101所具有的最小直径为直径100nm以下,例如1nm~100nm,优选为1nm~50nm,例如1nm~10nm,具体而言,优选为1nm以上5nm以下,3nm以上5nm以下等。另外,纳米孔101可以与形成于基材120的具有1μm以上的直径的孔进行连接。
[0103]
此外,在解析对象的生物分子为单链的核酸(dna)的情况下,由于单链dna的直径为大约1.5nm,因此作为纳米孔101的直径,优选为1.5nm~10nm左右,更优选为1.5nm~2.5nm左右。在解析对象的生物分子为双链的核酸(dna)的情况下,由于双链dna的直径为大约2.6nm,因此作为纳米孔101的直径,优选为3nm~10nm左右,更优选为3nm~5nm左右。进一步,纳米孔101的直径可以根据解析对象的生物体高分子(例如蛋白质、多肽、糖链等)的外径尺寸,进行适当设定。
[0104]
纳米孔101的深度(长度)可以通过调整薄膜121或基板102整体的厚度来调整。纳米孔101的深度优选与构成解析对象的生物分子的单体单元的长度一致。例如,在作为解析对象的生物分子选择核酸的情况下,纳米孔101的深度优选为碱基1个以下的大小,例如约0.3nm以下。纳米孔101的形状基本上为圆形,但是也可以为椭圆形、多边形。
[0105]
进一步,纳米孔101可以在基板102上设置至少1个,在设置多个纳米孔101的情况下,可以规则地排列也可以无规地配置。纳米孔101可以通过本技术领域中公知的方法,例如通过照射透射型电子显微镜(tem)的电子束,使用纳米光刻技术或离子束光刻技术等来形成。
[0106]
另外,图1所例示的装置在一对液槽104a与104b之间具有1个纳米孔101,但是其严格地说为一例,还可以采用在一对液槽104a与104b之间具有多个纳米孔101的构成。此外,作为其它例,还可以采用在基板102上形成多个纳米孔101,将多个纳米孔101的各自的区域以间壁来分离并构成的阵列器件。在该阵列器件中,可以使第1液槽104a为共同槽、使第2液槽104b为多个单独槽。在该情况下,可以在共同槽和单独槽的各自中配置电极。
[0107]
另一方面,作为第1电极105a和第2电极105b,没有特别限定,例如可以由铂、钯、铑、钌等铂族、金、银、铜、铝、镍等;石墨、例如石墨烯(单层或多层的任一者都可以)、钨、钽等来制作。
[0108]
如以上那样构成的生物分子分析装置中,如果以在第1液槽104a内填充有包含生物体-衔接分子复合体111的电解质溶液103的状态,对于第1电极105a和第2电极105b之间施加电压,形成使第1液槽104a侧为负电位或接地电位、使第2液槽104b为正电位的电位梯度,则如图3所示那样,不具有嵌段分子201的单链核酸区域113b介由(通过)纳米孔101而向第2液槽104b的方向移动。而且,如图4所示那样,通过第1液槽104a与第2液槽104b之间的电位梯度,生物体-衔接分子复合体111介由(通过)纳米孔101而向第2液槽104b移动。在由该图3的状态向图4的状态转变时,生物体-衔接分子复合体111中的双链的核酸(衔接分子110中的双链核酸区域112与生物分子109)被解开(unziped)。
[0109]
另外,所谓第1液槽104a和第2液槽104b之间所形成的电压梯度,为了使带负电的核酸分子进行移动,只要使任一方为正电位即可,另一方为负电位或接地电位即可。在以下说明中,在记载为使第1液槽104a和第2液槽104b的任一方为正电位,另一方为负电位的情
况下,作为负电位的一侧作为接地电位也可以是理所当然的。
[0110]
此外,如图3~4所示那样,在不具有嵌段分子201的单链核酸区域113b通过纳米孔101而沿第2液槽104b的方向移动的状态下,通过在第2液槽104内填充具有嵌段分子203的电解质溶液103,从而如图5所示那样,该嵌段分子203结合于单链核酸区域113b的末端。由此,能够在成为单链的生物体-衔接分子复合体111的两末端配置嵌段分子201和203。
[0111]
本实施方式中,嵌段分子201和203可以采用相同的物质,也可以采用不同的物质。此外,可以使嵌段分子201为单链核酸区域113a端部附近的高级结构,可以使嵌段分子203为单链核酸区域113a的端部所结合的物质。
[0112]
作为嵌段分子201和203使用了不同的物质的例子,能够使单链核酸区域113a的端部所结合的嵌段分子201为链亲和素,使单链核酸区域113b的端部所结合的嵌段分子203为介由dig-抗dig抗体结合的珠。在该情况下,在单链核酸区域113b,事先标记地高辛(dig)。而且,如图4所示那样,使末端被dig标记的单链核酸区域113b从第1液槽104a向第2溶槽104b泳动。dig本身的大小与纳米孔101的直径1nm相比充分小,因此由单链核酸区域113b的末端导入至纳米孔101。在通过由链亲和素形成的嵌段分子201而成为单链的生物体-衔接分子复合体202的移动停止的状态下,向第2溶槽104b中导入直径比1nm大的珠被标记的抗dig抗体,使其与单链核酸区域113b的末端被标记的dig相结合。由此,使由链亲和素形成的嵌段分子201以及由通过dig-抗dig抗体结合的珠形成的嵌段分子203分别与成为单链的生物体-衔接分子复合体111相结合。另外,作为嵌段分子201和203,除了生物素/链亲和素和dig/抗dig结合珠以外,可以使用将末端硫醇化以结合金粒子的方法、将末端进行氨基修饰而与羧基修饰的珠通过脱水反应来结合的方法等。此外,作为嵌段分子201和203,可以为使具有互补的序列的寡核苷酸与包含末端的附近区域杂交,然后,使用光交联或溴化乙锭酰胺单叠氮、补骨脂素衍生物等交联剂,牢固地结合于所形成的双链核酸区域的嵌段分子201和203。
[0113]
另外,在上述例子中,说明了使嵌段分子201结合于单链核酸区域113a的端部,然后,使嵌段分子203结合于单链核酸区域113b的端部的方法,但是其顺序可以颠倒。即,可以使嵌段分子203结合于单链核酸区域113b的端部之后,使嵌段分子201结合于单链核酸区域113a的端部。
[0114]
在从图3的状态转变为图4的状态时,通过使用衔接分子110,从而能够相对于作为双链的核酸的生物分子109不进行复杂的变性处理(例如热处理),制成能够通过纳米孔101的单链的核酸。即,通过使用衔接分子110,从而能够容易地解开双链的核酸。
[0115]
此外,生物分子分析装置如图4所示那样,使成为单链的生物体-衔接分子复合体111介由纳米孔101从第1液槽104a移动至第2液槽104b,但是通过使电压梯度颠倒,从而能够使成为单链的生物体-衔接分子复合体111介由纳米孔101从第2液槽104b移动至第1液槽104a。即,如图6a所示那样,通过使第1液槽104a为负电位、使第2液槽104b为正电位而形成的电压梯度,可以使成为单链的生物体-衔接分子复合体111沿图中箭头[a]所示的方向进行移动。相反地,如图6b所示那样,通过使第2液槽104b为负电位、使第1液槽104a为正电位而形成的电压梯度,可以使成为单链的生物体-衔接分子复合体111沿图中箭头[b]所示的方向进行移动。这样,生物分子分析装置能够使成为单链的生物体-衔接分子复合体111在第1液槽104a与第2液槽104b之间往复运动。
[0116]
此外,图1的生物分子分析装置能够利用测定部106测定一对电极105a和105b之间所流动的离子电流(封闭信号),计算机108基于被测定的离子电流(封闭信号)的值来取得生物体-衔接分子复合体111的序列信息。另外,图1中虽然没有显示,但是通过在纳米孔101内设置电极,从而能够取得隧穿电流,基于隧穿电流以取得序列信息,或者通过检测晶体管特性变化,从而也能够获得生物分子109的序列信息。
[0117]
这里,更详细地说明碱基序列信息的确定方法。碱基具有atgc的4种,但如果这些碱基通过纳米孔101,则每个种类,观测到固有的离子电流(封闭电流)的值。因此,事先,使用已知的序列,计测纳米孔101通过时的离子电流,使该已知的序列相对应的电流值存储于计算机108中的存储器。而且,构成解析对象的生物体-衔接分子复合体111的碱基依次介由将通过纳米孔101时测定的电流值与存储于存储器的已知的序列相对应的电流值进行比较,从而能够依次确定构成解析对象的生物体-衔接分子复合体111的碱基的种类。
[0118]
此外,作为生物分子109的碱基序列确定方法,可以对于生物分子109标记荧光体,使其在纳米孔101附近进行激发,检测该发光荧光。进一步,还能够应用参考文献1(nano letters(2005),vol.5,pp.421-424)所记载的、确定基于杂交的生物分子109的碱基序列的方法。
[0119]
通过上述碱基序列信息的确定方法,从而如图3和图4所示那样,能够在使成为单链的生物体-衔接分子复合体111介由纳米孔101从第1液槽104a移动至第2液槽104b时,取得生物分子109的碱基序列信息。此外,如图6a和6b所示那样,能够在使成为单链的生物体-衔接分子复合体111介由纳米孔101在第1液槽104a与第2液槽104b之间进行往复运动时,取得生物分子109的碱基序列信息。此时,在图6a和6b中示意性示出,但是能够防止因嵌段分子201和203而成为单链的生物体-衔接分子复合体111整体通过纳米孔101。
[0120]
另外,在使成为单链的生物体-衔接分子复合体111进行往复运动时,可以仅沿图6a的箭头[a]方向移动时取得生物分子109的碱基序列信息,也可以仅沿图6b的箭头[b]方向移动时取得生物分子109的碱基序列信息,也可以在图6a的箭头[a]方向和图6b的箭头[b]方向这两方向取得生物分子109的碱基序列信息。在沿图6a的箭头[a]方向移动时,从生物分子109的5’末端朝向3’末端确定碱基序列信息,在沿图6b的箭头[b]方向移动时,从生物分子109的3’末端朝向5’末端确定碱基序列信息。在任一情况下,对于生物分子109都能够取得多个组(set)的碱基序列信息,能够提高碱基序列信息的准确性。换句话说,通过使成为单链的生物体-衔接分子复合体111进行往复运动,从而能够多次读取生物分子109的碱基序列,能够提高读取精度。
[0121]
此外,上述往复运动中的施加电压的切换,可举出例如,以一定时间自动地切换的方法。在该情况下,可以通过计算机108计划电压切换的时机,按照该程序,控制电压源107,从而在该时机切换施加电压,进行上述那样的往复运动。
[0122]
或者,还可以在进行上述往复运动时使用读取的碱基序列信息进行施加电压的切换。可举出例如,在衔接分子110中插入特征性序列、产生与碱基(agct)不同的封闭电流的区域,在读取该特征性序列、该区域的信号的阶段切换电压的方法。所谓产生与碱基不同的封闭电流的区域,可举出例如,包含肽核酸、人工核酸等疑似核酸的区域。通过读取上述特征性序列、产生与碱基不同的封闭电流的区域的信号,从而对于生物分子109的碱基序列的读取结束,能够识别为生物体-衔接分子复合体111的端部接近纳米孔101。由此,通过在该
时机切换施加电压,从而能够在生物体-衔接分子复合体111从纳米孔101脱落之前,使生物体-衔接分子复合体111沿相反方向移动。进一步,在本实施方式中,能够采用通过检测嵌段分子201和203从而切换上述往复运动中的施加电压的切换的方法。即,嵌段分子201或203如果接近纳米孔101,则能够计测封闭电流的减少,因此能够在检测封闭电流减少的阶段成为切换施加电压的时机。
[0123]
如以上那样,通过使用衔接分子110,从而不需要将双链核酸变性为单链核酸的处理。即,即使在解析对象的生物分子109为双链核酸的情况下,通过第1液槽104a与第2液槽104b之间所形成的电压梯度,从而可以成为能够确定碱基序列的单链核酸。而且,此后,如上述那样,能够按照规定方法进行序列确定解析。
[0124]
另外,在上述例子中,作为生物分子109例示了双链核酸(dna、rna),但是作为生物分子109即使为蛋白质(肽链)、糖链,也能够通过同样的原理而作为分析对象。
[0125]
[第2实施方式]
[0126]
本实施方式中,对于与图1等所示的衔接分子110不同的构成的衔接分子300进行说明。另外,在图7所例示地表示的衔接分子300中,通过对于图1等所示的衔接分子110相同的构成,附上相同的符号,从而在本项中省略详细的说明。
[0127]
图7所示的衔接分子300具备:与生物分子109结合的双链核酸区域112;双链核酸区域112中与生物分子109所结合的端部不同的端部相连接,由彼此不互补的碱基序列形成的一对单链核酸区域301a和301b;以及单链核酸区域301a和301b中的任一方的末端所配置的嵌段分子201。另外,单链核酸区域301a具有3’末端,单链核酸区域301b具有5’末端。图7所示的例子中,嵌段分子201配置于具有3’末端的单链核酸区域301a的端部。嵌段分子201可以不配置于单链核酸区域113a的端部,而配置于具有5’末端的单链核酸区域301b的端部。
[0128]
图7所示的衔接分子300中的单链核酸区域301a具有能够与分子发动机结合的分子发动机结合部302。这里所谓分子发动机,是指能够将衔接分子300和生物分子109进行移动的蛋白质分子。作为具有这样的功能的分子发动机,没有特别限定,可举出dna聚合酶、rna聚合酶、核糖体和解旋酶。特别是在本实施方式中,作为分子发动机,优选使用将单链dna作为模板将互补链从5’末端沿3’末端方向进行合成的dna聚合酶。分子发动机结合部302并不限定于特定的碱基序列,能够设为任意的碱基序列,作为单链核酸而存在。
[0129]
此外,图7所示的衔接分子300中的单链核酸区域301a中,在分子发动机结合部302的3’末端侧具有能够与引物杂交的引物结合部303。引物结合部303只要具有与所使用的引物的碱基序列互补的序列即可,具体的碱基序列不受限定。这里,所谓引物,没有特别限定,可以为例如10~40个碱基长度,优选为15~35个碱基长度,更优选为18~25个碱基长度的单链核苷酸。因此,引物结合部303可以为10~40个碱基长度,优选为15~35个碱基长度,更优选为18~25个碱基长度的区域,由与引物的碱基序列互补的碱基序列形成的区域。
[0130]
进一步,图7所示的衔接分子300中的单链核酸区域301a在分子发动机结合部302与引物结合部303之间具有间隔区304。这里所谓间隔区304,是指分子发动机不能结合的区域,即不含由agct形成的碱基的区域。作为间隔区304,没有特别限定,可以为不含碱基的直链状连接体。特别是间隔区304的长度优选为至少2个碱基相当的长度,即约0.6
×
2nm以上。换句话说,可以通过间隔区304,使分子发动机结合部302与引物结合部303之间分开2个碱
基以上(约0.6
×
2nm以上)。作为构成间隔区304的材料,可举出integrated dna technologies公司所提供的c3 spcer,pc spacer,spacer9,spacer18和dspacer等dna链中能够配置的材料。此外,作为间隔区304,能够使用直链状碳链、直链状氨基酸、直链脂肪酸及直链状糖链等。
[0131]
进一步,图7所示的衔接分子300中,能够使双链核酸区域112中的规定的区域为标记序列(未图示)。所谓标记序列,也被称为条形码序列、索引序列,是指衔接分子300中固有的碱基序列。例如,通过准备仅标记序列不同的多个衔接分子300,从而能够基于标记序列特定所使用的衔接分子300的种类。
[0132]
使用图8a和b以及图9a~g来说明使用了如以上那样构成的衔接分子300的生物分子109的分析方法。
[0133]
首先,准备在生物分子109的两端部分别结合有衔接分子300的生物体-衔接分子复合体305。在第1液槽104a内,填充包含该生物体-衔接分子复合体305、分子发动机306、引物307和封闭(blocking)核酸308的电解质溶液。由此,如图8a所示那样,在衔接分子300中的分子发动机结合部302结合分子发动机306,引物307与引物结合部303杂交,封闭核酸308与单链核酸区域103b的规定的位置杂交。另外,封闭核酸308为由与单链核酸区域103b的规定的区域互补的序列形成的单链核苷酸。封闭核酸308杂交的区域能够形成将单链核酸区域103b中的5’末端区域(例如,包含5’末端的2~10个碱基,优选为5~10个碱基)除外的区域。封闭核酸308通过与该区域杂交,从而能够防止分子发动机306结合于单链核酸区域301b。因此,提高分子发动机306对于分子发动机结合部302的结合效率。即,即使为少量的分子发动机306,也能够效率良好地与分子发动机结合部302进行结合。然而,即使分子发动机306结合于单链核酸区域301b,对于生物分子109的分析结果也没有影响。因此,可以不使用封闭核酸308。
[0134]
接下来,对于第1电极105a和第2电极105b之间施加电压,形成使第1液槽104a侧为负电位(或接地电位。以下同样。)、使第2液槽104b为正电位的电位梯度。由此,单链核酸区域113b沿纳米孔101方向移动,封闭核酸308没有杂交的5’末端区域导入至纳米孔101内。而且,如图8b所示那样,通过第1液槽104a与第2液槽104b之间的电位梯度,从而生物体-衔接分子复合体305介由(通过)纳米孔101移动至第2液槽104b。此时,生物体-衔接分子复合体305中的双链的核酸(衔接分子300中的双链核酸区域112与生物分子109、封闭核酸308与单链核酸区域301b)被解开(unziped)。
[0135]
这样,即使在使用了衔接分子300的情况下,也能够对于作为双链的核酸的生物分子109不进行复杂的变性处理(例如热处理),来形成能够通过纳米孔101的单链的核酸。即,即使使用了衔接分子300的情况下,也能够将双链的核酸容易地解开。另外,在图8a和b所示的状态下,引物307与分子发动机306分开间隔区304的长度,因此将引物307的3’末端作为起点的、利用分子发动机306进行的互补链合成反应不会开始。另外,虽然没有图示,但是与第1实施方式同样地操作,能够在第2液槽104b内,在生物体-衔接分子复合体305中的单链核酸区域103b结合嵌段分子201。
[0136]
而且,通过第1液槽104a与第2液槽104b之间的电位梯度,从而如图9a所示那样,成为单链的生物体-衔接分子复合体305通过纳米孔101,然后,分子发动机306到达纳米孔101。这里分子发动机306的尺寸dm比纳米孔101的直径dn大(dm>dn),因此如果分子发动机
306到达纳米孔101的入口(第1液槽104a侧),则不能通过纳米孔101而行进至出口侧(第2液槽104b侧),止于纳米孔101的入口。另一方面,成为单链的生物体-衔接分子复合体305由于带有负电荷,因此进一步向下游方向行进,以间隔区304为中心发生形状变化。如果这样,则分子发动机306与引物307的3’末端接触,并结合(图9b)。由此,分子发动机306将引物307的3’末端作为起点,从5’末端沿3’末端的方向开始互补链合成反应。另外,图9a~h中,白底的箭头是指从负极朝向正极的电位梯度。
[0137]
而且,如图9c所示那样,如果利用分子发动机306的互补链合成反应进行,则与成为单链的生物体-衔接分子复合体305通过电位梯度移动至第2液槽104b侧的力相比,成为单链的生物体-衔接分子复合体305通过分子发动机306被提升的力强,因此成为单链的生物体-衔接分子复合体305与电位梯度相反地沿第1液槽104a方向(图9c中箭头m的方向)被运输。此时,能够取得通过纳米孔101的生物体-衔接分子复合体305的碱基序列信息。
[0138]
而且,如图9d所示那样,如果生物体-衔接分子复合体305的单链核酸区域103b所结合的嵌段分子203到达纳米孔101,则利用分子发动机306进行的运输动作和测序停止。在利用分子发动机306进行的运输动作和测序停止的阶段,使第2液槽104b内成为更强的正电位。其结果如图9e所示那样,生物体-衔接分子复合体305通过电位梯度移动至第2液槽104b侧(图9e中箭头m的方向)。此时,通过分子发动机306合成的生物体-衔接分子复合体305的互补链307从生物体-衔接分子复合体305被解开(unziped),并且分子发动机306与生物体-衔接分子复合体305分离。
[0139]
另外,使第2液槽104b内成为更强的正电位的时机也可以采用以一定时间自动地切换的方法、使用读取的碱基序列信息进行切换的方法。或者如果嵌段分子203接近纳米孔101,则能够计测封闭电流的减少,因此可以在检测封闭电流减少的阶段,使第2液槽104b内成为更强的正电位。即使在这些任一方法中,通过使嵌段分子203结合于单链核酸区域103b,从而能够防止成为单链的生物体-衔接分子复合体305整体通过纳米孔101。
[0140]
而且,接下来,如图9f所示那样,将对于第1电极105a和第2电极105b施加的电压进行反转,形成使第1液槽104a为正电位、使第2液槽104b为负电位的电位梯度。由此,能够使成为单链的生物体-衔接分子复合体305介由纳米孔101从第2液槽104b沿第1液槽104a方向进行移动。
[0141]
然后,如图9g所示那样,向第1液槽104a所填充的电解质溶液103中添加分子发动机306和引物307,使引物307与引物结合部303杂交,使分子发动机306结合于分子发动机结合部302。然后,将对于第1电极105a和第2电极105b施加的电压再次反转,形成使第1液槽104a为负电位、使第2液槽104b为正电位的电位梯度。由此,引物307进行杂交,分子发动机306使所结合的生物体-衔接分子复合体305沿第2液槽104b方向移动。而且,如图9b所示那样,产生以间隔区304为中心的形状变化,在分子发动机306中形成与引物307的3’末端接触的状态。即,通过反复进行图9a~g,从而每个利用分子发动机306进行的运输动作能够进行测序。
[0142]
另外,根据参考文献(nat nanotechnol.2010.november;5(11):798-806),暗示在使用了分子发动机306的计测(纳米孔101的直径1.4nm)中,一边施加至少80mv以上的电压一边进行计测。在该情况下,根据参考文献(nature physics,5,347-351,2009.),暗示施加大约24pn的力。因此,本实施方式中,嵌段分子201和203优选以80mv的电压进行测定的情况
下,以24pn以上的结合力结合于单链核酸区域103a和103b。
[0143]
实施例
[0144]
以下,使用实施例进一步详细地说明本发明,但是本发明的技术范围并不限定于以下实施例。
[0145]
〔实施例1〕
[0146]
将本实施例所使用的试剂种类示于表1中。在本实施例中,作为间隔区304制作具有脱碱基序列部(ispc3)的衔接分子300。此外,在本实施例中,作为分子发动机306,使用作为高盐耐性dna聚合酶的bst3.0polymerase。进一步,确认了将1个碱基单元信号进行明确化,使用特殊碱基(amp、gmp、ump-pnp)和dttp作为bst3.0polymerase反应的基质。
[0147]
[表1]
[0148][0149]
在本实施例中,在图8和9所示的方案中,制作出用于解析双链dna(生物分子109)的碱基序列的测序仪用文库(library)。在本实施例中,设计了图7所示的衔接分子300。利用本实施例设计的衔接分子300如图8所示那样,为解析对象的双链dna的两末端所结合的对称结构的同型衔接。设计的衔接分子300通过连接反应与解析对象的双链dna结合,成为两末端具有左右对称的y型结构的生物体-衔接分子复合体305。在本实施例中,在制作生物体-衔接分子复合体305之后,使序列用的引物307与引物结合部303杂交。接下来,如果将生物体-衔接分子复合体305与聚合酶一起投入至第1液槽104a,则通过电泳,文库中仅1个地方成为单链状态的单链核酸区域301b被引入至纳米孔101。通过纳米孔101,从而双链dna进行解离(unzip)。如果分子发动机结合部302所结合的dna聚合酶(分子发动机306)到达纳米孔101,则夹持间隔区304并分开的引物307的端部与dna聚合酶进行接触,从5’末端沿3’末端的方向开始互补链合成反应。
[0150]
在本实施例中,使来源于λ噬菌体的规定的区域成为解析对象的双链dna(生物分子109)(序列号1)。由序列号1所示的碱基序列形成的双链dna可以通过将λ噬菌体的基因组
作为模板,且使用了由序列号1中的第1~21位的碱基序列形成的正向引物以及由序列号1中的第394~415位的碱基序列的反链序列形成的反向引物的pcr来取得。
[0151]
此外,在本实施例中,作为衔接分子300,合成同型衔接分子(homoadaptor)-模板(序列号2)和同型衔接分子-引物(序列号3),互补区域彼此进行杂交从而制作。另外,从序列号2中的5’末端的第1~30位为构成双链核酸区域112的一方的链,第61~64位的nnnn相当于间隔区304,第65~91位相当于引物结合部303。进一步,从序列号3中的5’末端起的第62~92位为构成双链核酸区域112的另一方的链。进一步,在本实施例中,作为与引物结合部303杂交的引物307,设计了测序引物(序列号4)。
[0152]
另外,该衔接分子300中的同型衔接分子-模板的5’末端磷酸部和同型衔接分子-引物的3’末端所突出的dt部与附加有da的pcr产物杂交,通过实施连接所需要的磷酸化从而被结合(t/a连接)。此时,通过衔接分子300中的突出碱基的存在,以不生成衔接二聚体的方式进行设计。
[0153]
此外,具体而言,以下述工序制作库(参照图10和11)。
[0154]
(1)将同型衔接分子-模板和同型衔接分子-引物在等温缓冲液ii内,以80℃且10分钟(解离)
→
以30℃且30分钟(杂交)进行杂交,制作出衔接分子300。
[0155]
(2)将pcr扩增的dna样品使用nebnext ultraii末端修复/加da尾模块,通过以20℃且30分钟(酶反应)
→
以65℃且30分钟(酶失活),进行末端修复和da附加处理,通过ampurexp来纯化。
[0156]
(3)将由(1)准备的衔接分子和由(2)准备的da附加后的dna样品进行混合,使用平末端/ta连接酶预混液(blunt/ta ligase master mix),在室温(25℃)进行30分钟t/a连接,在冰上进行静置后,通过ampure xp进行了纯化(衔接分子:样品的摩尔比调整为3:1)。
[0157]
(4)对于由(3)所连接的样品,将测序引物在等温缓冲液ii内,在30℃杂交30分钟,最终制作出文库。
[0158]
另外,将上述(1)~(4)所使用的反应液的组成等示于图10中。图11中,示意性示出由本实施例设计的衔接分子的碱基序列及其二次结构。
[0159]
获得的文库利用电泳装置(安捷伦科技公司,tapestation4200)进行电泳,进行了谱带解析。在本实施例中,将测定的封闭电流值进行标准化(图12),获取与预计的封闭电流值的相关,结果相关系数r2=0.807。由该结果显示,通过使用由本实施例制作的衔接分子300,从而能够通过不含将双链dna热变性为单链dna这样的工序的上述规程(protocol)而测序。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1