用于产生低聚异麦芽糖的改进的方法与流程
1.本发明的方法用于从麦芽糖糊精产生改进的低聚异麦芽糖(imo)。该改进的方法涉及用选定的α-淀粉酶完全或部分替代如常规方法中使用的β-淀粉酶。与使用常规方法产生的imo相比,所得imo具有更长的链长度和减少的残余葡萄糖含量。
背景技术:
2.低聚异麦芽糖(imo)是部分可消化的糖基食物成分,其为人类和其他动物提供了健康益处。imo的代谢程度低于更广泛使用的糖(如葡萄糖、果糖和蔗糖),因此与可代谢糖相比,imo以更少的卡路里为代价提供口感和甜味益处。imo还可以为肠道细菌群提供影响所希望的细菌亚群增殖的碳源。imo似乎能刺激肠内短链脂肪酸的产生,从而降低腔内ph并抑制肠道病原体的生长和活性。imo具有低血糖指数,使其适合糖尿病患者食用,并且imo不会被大多数口腔细菌代谢,因此是避免蛀牙的理想选择。
3.从化学上讲,imo是从麦芽糖糊精产生的不同低聚糖和葡萄糖的混合物。该混合物由线性低聚糖(低聚麦芽糖)和支化低聚糖(低聚异麦芽糖)组成。imo常规上通过β-淀粉酶和转葡糖苷酶的顺序或同时作用从麦芽糖糊精产生。β-淀粉酶从麦芽糖糊精产生麦芽糖,该麦芽糖是转葡糖苷酶的底物。麦芽糖是转糖基反应(transglycolysation reaction)中的供体分子,该反应将麦芽糖水解,从而释放一个游离葡萄糖分子并将另一个葡萄糖分子转移到受体。
4.该受体可以是另一个麦芽糖分子,从而形成三糖。形成的量最多的三糖是潘糖。还可以将葡萄糖转移到高级糖中,从而形成更长链的低聚异麦芽糖;转移到葡萄糖中,从而形成异麦芽糖;或转移到水中,使其以另一个游离葡萄糖分子的形式释放。不同低聚糖形成的速度取决于不同受体的浓度。在反应初期,麦芽糖浓度很高,主要使潘糖形成。在反应后期,当麦芽糖浓度降低,而潘糖浓度增加时,更可能的反应产物将是形成四糖(glc(α-1,6)glc(α-1,6)glc(α-1,4)glc)。
5.遗憾的是,每次葡萄糖分子转移到受体时,供体麦芽糖分子就会释放游离葡萄糖分子。这会产生具有相对高的葡萄糖含量的imo糖浆。虽然可以通过色谱法从imo糖浆中去除葡萄糖,但这一过程成本高昂。对于减少由淀粉底物制成的imo糖浆中存在的葡萄糖量并提高imo的整体质量的方法存在需求。
技术实现要素:
6.描述了一种用于制备低聚异麦芽糖(imo)的改进的方法,该方法可以导致更长链的imo和/或减少量的葡萄糖。这些组合物和方法的方面和实施例描述于以下独立编号的段落中。
7.1.在第一个方面,提供了一种用于从麦芽糖糊精产生低聚异麦芽糖(imo)的改进的方法,所述方法包括以下步骤:(i)使麦芽糖糊精与α-淀粉酶接触以产生低聚麦芽糖,以及(ii)使所述低聚麦芽糖与转葡糖苷酶接触以产生imo,其中与在步骤(i)中使用β-淀粉酶
来从麦芽糖糊精产生imo的方法相比,所述方法产生了更长链的imo和/或减少量的葡萄糖。
8.2.在如段落1所述的方法的一些实施例中,步骤(i)在不超过660糖化力(dp
°
)单位β-淀粉酶/kg干重麦芽糖糊精的存在下进行。
9.3.在如段落1所述的方法的一些实施例中,步骤(i)在不超过264糖化力(dp
°
)单位/kg干重低聚麦芽糖的存在下进行。
10.4.在如段落1所述的方法的一些实施例中,步骤(i)在不超过132糖化力(dp
°
)单位/kg干重低聚麦芽糖的存在下进行。
11.5.在如段落1所述的方法的一些实施例中,步骤(i)在不超过66糖化力(dp
°
)单位/kg干重低聚麦芽糖的存在下进行。
12.6.在如段落1所述的方法的一些实施例中,步骤(i)在不存在β-淀粉酶的情况下进行。
13.7.在如段落1-6中任一项所述的方法的一些实施例中,步骤(i)使用产生包含至少15%dp3的低聚麦芽糖的α-淀粉酶进行。
14.8.在如段落1-7中任一项所述的方法的一些实施例中,步骤(i)使用产生包含至少10%dp4的低聚麦芽糖的α-淀粉酶进行。
15.9.在如段落1-8中任一项所述的方法的一些实施例中,步骤(i)使用产生包含至少5%dp5的低聚麦芽糖的α-淀粉酶进行。
16.10.在如段落1-9中任一项所述的方法的一些实施例中,步骤(i)使用产生包含不超过40%dp2的低聚麦芽糖的α-淀粉酶进行。
17.11.在如段落1-10中任一项所述的方法的一些实施例中,步骤(i)在存在支链淀粉酶的情况下进行。
18.12.在如段落1-11中任一项所述的方法的一些实施例中,步骤(i)和步骤(ii)按顺序进行。
19.13.在如段落1-11中任一项所述的方法的一些实施例中,步骤(i)和步骤(ii)同时进行。
20.14.在如段落1-13中任一项所述的方法的一些实施例中,所述麦芽糖糊精是使用液化α-淀粉酶从含淀粉底物制备的。
21.15.在如段落14所述的方法的一些实施例中,所述液化α-淀粉酶和步骤(i)中使用的α-淀粉酶是相同的。
22.16.在另一个方面,提供了一种用于产生低聚异麦芽糖(imo)的改进的方法,所述方法包括以下步骤:(i)使含淀粉底物与液化α-淀粉酶接触以产生麦芽糖糊精;(ii)使所述麦芽糖糊精与产生dp3+的α-淀粉酶接触以产生低聚麦芽糖以及(iii)使所述低聚麦芽糖与转葡糖苷酶接触以产生imo,所述imo与使用β-淀粉酶替代步骤(ii)中产生dp3+的α-淀粉酶产生的imo相比具有更长的链。
23.17.在如段落16所述的方法的一些实施例中,所述产生dp3+的α-淀粉酶产生包含至少15%dp3、至少10%dp4、至少5%dp5、和/或不超过40%dp2的低聚麦芽糖。
24.18.在如段落16或17所述的方法的一些实施例中,步骤(i)和步骤(ii)、和/或步骤(ii)和步骤(iii)是按顺序的、重叠的或同时的。
25.19.在如段落16-18中任一项所述的方法的一些实施例中,步骤(ii)在不超过660、
不超过264、不超过132、或不超过66糖化力(dp
°
)单位β-淀粉酶/kg干重麦芽糖糊精的存在下进行。
26.20.在如段落16-19中任一项所述的方法的一些实施例中,步骤(ii)在不存在β-淀粉酶的情况下进行。
27.21.在如段落16-20中任一项所述的方法的一些实施例中,步骤(ii)在存在支链淀粉酶的情况下进行。
28.22.在如段落16-21中任一项所述的方法的一些实施例中,所述液化α-淀粉酶和步骤(ii)中使用的产生dp3+的α-淀粉酶是相同的。
29.23.在另一个方面,提供了通过如段落1-22中任一项所述的方法产生的imo。
30.从说明书和附图中,本发明的组合物和方法的这些及其他方面和实施例将是清楚的。
附图说明
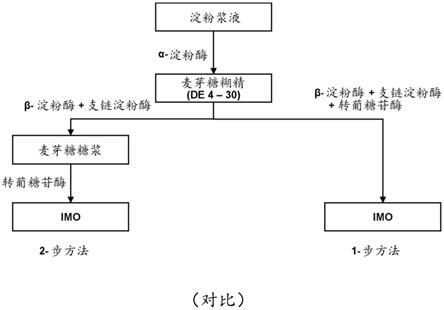
31.图1是对用于制备imo的常规方法中涉及的步骤和酶进行说明的流程图。
32.图2是对本发明的用于制备imo的改进的方法中涉及的步骤和酶进行说明的流程图。
33.图3是对用于制备imo的常规方法中发生的转葡糖苷酶反应进行说明的图。
34.图4是对为了产生低聚异麦芽糖而进行的转葡糖苷酶-葡萄糖复合物和低聚麦芽糖受体分子之间的反应进行说明的图。
35.图5是对为了产生可以与低聚麦芽糖受体分子反应以产生低聚异麦芽糖的转葡糖苷酶-葡萄糖复合物而进行的低聚麦芽糖供体分子和转葡糖苷酶之间的反应进行说明的图。
具体实施方式
36.i.定义
37.在详细地描述本发明的方法和组合物之前,为了清楚起见定义以下术语。未定义的术语应当符合相关领域中所使用的常规含义。
38.如本文所使用的,术语“淀粉”是指由植物的复合多糖碳水化合物组成的任何材料,该复合多糖碳水化合物由具有式(c6h
10
o5)
x
(其中x可以是任何数目)的直链淀粉和/或支链淀粉构成。特别地,该术语是指任何基于植物的材料,包括但不限于谷物、草、块茎、和根,并且更具体地是小麦、大麦、玉米、黑麦、水稻、高粱、豆类、木薯、粟、马铃薯、甘薯、和树薯。在复合多糖碳水化合物从其他植物组分纯化后,称其为“精制淀粉”。
39.术语“颗粒淀粉”是指未经糊化的未烹调过的(生的)淀粉。
40.如本文所使用的,“麦芽糖糊精”是指通常通过部分化学水解或酶水解从淀粉产生的低聚糖。多糖的尺寸通常在dp3至dp20的范围内,但可以更长。
41.如本文所使用的,“低聚麦芽糖”是指经由α-d-1,4键连接的葡萄糖的低聚糖。示例性低聚麦芽糖及其简洁iupac名称(指iub-iupac生化命名联合委员会(jcbn,joint committee on biochemical nomenclature)推荐的iupac术语(1982)j.biol.chem.[生物化学杂志]257:3347-51)包括但不限于麦芽糖(glc(α-1,4)glc)、麦芽三糖(glc(α-1,4)glc
(α-1,4)glc)、和麦芽四糖(glc(α-1,4)glc(α-1,4)glc(α-1,4)glc)。
[0042]
如本文所使用的,“低聚异麦芽糖(imo)”通常是指包括α-d-1,6键的葡萄糖的低聚糖。示例性低聚异麦芽糖及其简洁iupac名称(id.)包括但不限于异麦芽糖(glc(α-1,6)glc)、异麦芽三糖(glc(α-1,6)glc(α-1,6)glc)、和异麦芽四糖(glc(α-1,6)glc(α-1,6)glc(α-1,6)glc)。通常将具有α-d-1,4键和α-d-1,6键两者的支化的低聚糖,例如潘糖(glc(α-1,6)glc(α-1,4)glc)也视为imo。如本文所使用的,imo可以包括一些α-d-1,4键。
[0043]
如本文所使用的,短语“聚合度”(dp)是指给定的糖类中脱水吡喃葡萄糖单元的数目(n)。dp1的实例是单糖葡萄糖。dp2的实例是二糖麦芽糖和异麦芽糖。
[0044]
如本文所使用的,“α-淀粉酶”是内切作用酶,其具有系统名称α-d-(1
→
4)-葡聚糖葡聚糖水解酶和酶学委员会(enzyme commission)命名ec 3.2.1.1。
[0045]
如本文所使用的,“淀粉加工酶”是使淀粉底物(包括麦芽糖糊精)解聚的酶。示例性淀粉加工酶是α-淀粉酶、葡糖淀粉酶、β-淀粉酶、支链淀粉酶、和α-葡糖苷酶。
[0046]
如本文所使用的,“生麦芽糖酶”是主要产生麦芽糖作为产物的酶。此类酶包括分类ec 3.2.1.2的外切作用酶,一些主要的内切作用酶如生麦芽糖α-淀粉酶(ec 3.2.1.133)也产生大量的麦芽糖并且出于本发明的目的将其认为是“生麦芽糖酶”。
[0047]
如本文所使用的,“产生低聚麦芽糖的酶”是主要产生聚合度长于2的低聚麦芽糖的酶。此类酶包括但不限于ec 3.2.1.1、ec 3.2.1.116、ec 3.2.1.60和3.2.1.98。
[0048]
如本文所使用的,“转葡糖苷酶”是术语α-葡糖苷酶和系统名称α-d-葡糖苷葡糖水解酶的同义词,其具有酶学委员会命名ec 3.2.1.20。
[0049]
如本文所使用的,“支链淀粉酶”是系统名称α-糊精内切-1,6-α-葡糖苷酶的同义词,其具有cazy酶数据库命名ec 3.2.1.41。出于本发明的目的,认为其他对支化的麦芽糖糊精具有活性的脱支酶如异淀粉酶(ec 3.2.1.68)是“支链淀粉酶”。
[0050]
如本文所使用的,使酶与底物“接触”是指将酶和底物一起置于普通水性环境中,典型地伴随混合以实现均匀分布。术语“接触的”与“处理的”可互换使用。
[0051]
如本文所使用的,“产生”是指作为酶方法的结果而产生反应产物。
[0052]
如本文所使用的,单数冠词“一个/一种(a/an)”以及“该/所述”涵盖复数个指示物,除非上下文中另外明确指明。本文引用的所有参考文献均通过引用以其全文特此并入。除非另外说明,否则以下缩写/首字母缩略词具有以下含义:
[0053]
℃
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
摄氏度
[0054]
bba
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
大麦β-淀粉酶
[0055]
de
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
右旋糖当量
[0056]
dp
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
聚合度
[0057]
dp
°ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
糖化力度数(β-淀粉酶活性的单位)
[0058]
dp3+
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
dp3或更长
[0059]
dpn
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
值未知的dp
[0060]
ds
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
干固体
[0061]
g或gm
ꢀꢀꢀꢀꢀꢀꢀꢀ
克
[0062]
hpae
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高效阴离子交换色谱法
[0063]
hplc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
高效液相色谱法
[0064]
hr
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
小时
[0065]
im2
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异麦芽糖
[0066]
im3
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异麦芽三糖
[0067]
im4
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异麦芽四糖
[0068]
im5
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异麦芽五糖
[0069]
im6
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异麦芽六糖
[0070]
im7
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异麦芽七糖
[0071]
imo
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
低聚异麦芽糖
[0072]
iupac
ꢀꢀꢀꢀꢀꢀꢀꢀ
国际纯粹与应用化学联合会(international union of pure and applied chemistry)
[0073]
kg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
千克
[0074]mꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
摩尔
[0075]
mg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫克
[0076]
min
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
分钟
[0077]
ml和ml
ꢀꢀꢀꢀꢀꢀ
毫升
[0078]
mm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫米
[0079]
mm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
毫摩尔
[0080]
mt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
公吨
[0081]
naac
ꢀꢀꢀꢀꢀꢀꢀꢀ
乙酸钠
[0082]
naoh
ꢀꢀꢀꢀꢀꢀꢀꢀ
氢氧化钠
[0083]
pad
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
脉冲安培检测
[0084]
pu
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
支链淀粉酶
[0085]
ri
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
折射率
[0086]
rpm或rpm
ꢀꢀꢀꢀ
转数/分钟
[0087]
tg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
转葡糖苷酶
[0088]
u或u
ꢀꢀꢀꢀꢀꢀꢀꢀ
单位
[0089]
w/v
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
重量/体积
[0090]
μg
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
微克
[0091]
μl和μl
ꢀꢀꢀꢀꢀꢀ
微升
[0092]
μm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
微米
[0093]
μm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
微摩尔
[0094]
ii.用于制造改进的imo的酶方法
[0095]
描述了用于使用转葡糖苷酶从麦芽糖糊精产生低聚异麦芽糖(imo)的改进的酶方法,该方法利用α-淀粉酶替代β-淀粉酶。与常规方法相比,该改进的方法产生具有减少量的葡萄糖的更长链的imo,这使更经济地产生高imo、低葡萄糖的特制糖浆成为可能。
[0096]
该改进的方法在附图的帮助下可以是直观的。如图1中的流程图所示,imo常规上从麦芽糖糊精通过β-淀粉酶和转葡糖苷酶的按顺序或同时作用产生。在常规的两步方法(流程图左侧)中,在液化过程中将淀粉浆液转化为麦芽糖糊精,并且将该麦芽糖糊精用β-淀粉酶和支链淀粉酶处理以产生麦芽糖糖浆,然后将麦芽糖糖浆用转葡糖苷酶处理以产生
imo。在常规的一步方法(流程图右侧)中,在液化过程中将淀粉浆液转化为麦芽糖糊精,并且将该麦芽糖糊精同时用β-淀粉酶、支链淀粉酶和转葡糖苷酶处理以产生imo,无需将麦芽糖糖浆分离或分开。
[0097]
如图2中的流程图所示,该改进的方法可以继续以在液化过程中将淀粉浆液转化为麦芽糖糊精开始。然而,此时,麦芽糖糊精是用能够产生长于dp2(即,麦芽糖)的低聚麦芽糖的酶处理的。相反,在两步方法(流程图左侧)中使用了产生dp3(或更长的低聚麦芽糖)的酶和支链淀粉酶以产生富含麦芽三糖(或更长的低聚糖)的糖浆,然后将该糖浆用转葡糖苷酶处理以产生改进的imo。可替代地,在一步方法(流程图右侧)中将麦芽糖糊精同时用产生dp3(或更长的低聚麦芽糖)的酶、支链淀粉酶和转葡糖苷酶处理以产生改进的imo,无需将富含麦芽三糖(或更长的低聚麦芽糖)的糖浆分离或分开。
[0098]
在对转葡糖苷酶反应的最终产物进行检验后,该改进的方法的优点将显而易见。在图3-图5中,将葡萄糖分子用圆表示,并且将糖苷键用连接圆的线表示。将具有还原端的葡萄糖分子用纯黑色填充,将供体葡萄糖分子用格子图案填充,将葡萄糖受体葡萄糖分子用纯白色填满,并且将非反应性葡萄糖分子用灰色示出。将具有还原端、但还充当受体葡萄糖分子的游离葡萄糖分子用一半白色和一半黑色填充。
[0099]
在常规方法中,特别是在转糖基化反应阶段的初期,通过β-淀粉酶从淀粉水解产物产生的麦芽糖量很多,并且既充当转葡糖苷酶的主要供体分子又充当受体分子(图3a)。这导致三糖的产生,量最多的是潘糖,还有游离葡萄糖。在反应后期,当麦芽糖耗尽时,更长的受体分子相对而言量更大,从而产生更长的imo,还有游离葡萄糖(图3b)。游离葡萄糖自身还可以充当转葡糖苷酶的受体(图3c),在此情况中产生了短的imo,但还是仅伴有不同游离葡萄糖的释放。
[0100]
图5说明了该改进的方法的优点。与先前一致,当麦芽糖是如在常规imo产生方法中的供体低聚麦芽糖时,每个转葡糖苷酶反应都形成游离葡萄糖(图5a)。相反,当使用更长的供体低聚麦芽糖(如麦芽三糖(图5b)、麦芽四糖(图5c)、或更高)时,转葡糖苷酶反应在反应的第一部分期间不产生游离葡萄糖,而是形成转葡糖苷酶-葡萄糖复合物。如图4b和图4c中形成的转葡糖苷酶-葡萄糖复合物可以与各种长度的受体低聚糖相互作用以产生imo。在反应的这一部分不产生游离葡萄糖(图5)。
[0101]
iii.酶组合物
[0102]
a.产生dp3+的α-淀粉酶
[0103]
适于产生用于该改进的方法的低聚麦芽糖的产生(generating)dp3+(也称为产生(producing)dp3+)的α-淀粉酶是从麦芽糖糊精产生长于dp2(即,麦芽糖)的低聚麦芽糖的那些。此类酶产生dp3、dp4、dp5、或更长的低聚麦芽糖。产生大量的dp3的酶包括但不限于源自曲霉属(aspergilus),例如,白曲霉(a.kawachi)、棒曲霉(a clavatus)和米曲霉(a.oryzae)的α-淀粉酶。已经于灰色链霉菌(streptomyces griseus)、枯草芽孢杆菌(bacillus subtilis)、蛾微杆菌(microbacterium imperiaie)和橙色绿屈挠菌(chloroflexus aurantiacus)中鉴定出产生麦芽三糖的淀粉酶。产生大量的dp4的酶包括但不限于源自嗜糖假单胞菌(pseudomonas saccharophila)的淀粉酶。产生大量的dp5的酶包括但不限于源自几种芽孢杆菌属物种(bacillus spp.)(包括嗜热脂肪芽孢杆菌(b.stearothermophilus)和地衣芽孢杆菌(b.licheniformis))的α-淀粉酶以及源自嗜纤
维菌属物种(cytophaga spp.)的酶。
[0104]
通常,适合用于根据本发明的方法使用的产生dp3+的α-淀粉酶是产生(当将反应进行足够时间时)具有最少15%dp3、最少10%dp4或最少5%dp5,还有最多40%、最多30%、最多20%、最多10%或甚至最多5%dp2的糖谱的任何α-淀粉酶。可以使用多于一种产生dp3+的α-淀粉酶,在此情况中产生dp3+的α-淀粉酶的组合产生所述的低聚麦芽糖谱。
[0105]
b.转葡糖苷酶
[0106]
对用于从低聚麦芽糖产生改进的低聚异麦芽糖(imo)的方法而言至关重要的第二种酶是转葡糖苷酶,也称为α-葡糖苷酶和α-d-葡糖苷葡糖水解酶。将这些分子分类为cazy家族gh31中的ec 3.2.1.20酶并且已经鉴定于多种生物中。genbank包括了超过400个条目的转葡糖苷酶。
[0107]
本文示例的酶源自黑曲霉(aspergillis niger)并且在里氏木霉(trichoderma reesei)中表达。该酶高度表达但在其他方面认为其与研究的其他转葡糖苷酶相比不具有独特性质。因此,据信衍生自很多生物的大量转葡糖苷酶适合用于从麦芽糖糊精产生低聚异麦芽糖(imo)。
[0108]
示例性酶是可商购的,如transglucosidase (杜邦营养生物科技公司(dupont nutrition&biosciences)),其具有1700转葡糖苷酶单位(tgu)/g的活性。一个tgu定义为在测定条件下每分钟产生一微摩尔潘糖所需的酶量。需要最少0.1kg/mt的transglucosidase /mt的ds。在本文所述的所有操作中,使用1kg/mt ds。
[0109]
c.液化α-淀粉酶
[0110]
用于将粗原料(如源自谷物和其他植物材料的淀粉)转化为麦芽糖糊精的液化α-淀粉酶是本领域熟知的,并且包括衍生自多种微生物的酶。示例性酶是可商购的,例如,fuelzyme
tm
(巴斯夫酶有限公司(basf enzymes llc),加利福尼亚州圣地亚哥(san diego,ca))、diego,ca))、和产品(诺维信公司(novozymes))以及产品(杜邦公司(dupont))。可以使用多于一种液化α-淀粉酶。
[0111]
在一些实施例中,液化α-淀粉酶可以另外用作产生dp3+的酶在该改进的方法中使用,这取决于所产生的麦芽糖低聚物的谱。因此,该一种或多种液化α-淀粉酶可以是,或可以包括一种或多种产生dp3+的酶。
[0112]
产生这种糖谱所需的酶浓度取决于其产生的反应产物的类型、反应条件和反应时间。训练有素的人员可以确定最佳的量。作为实例,在12de液化物上剂量为0.2kg/mt ds的alpha pf可以在约7小时内产生具有超过20%dp5的糖浆。
[0113]
淀粉液化可以在高于、处于或低于淀粉底物的糊化温度下进行。可以存在其他酶,例如蛋白酶。
[0114]
d.用于进行该改进的方法的酶共混物
[0115]
适合的酶共混物是在不存在转葡糖苷酶的情况下从12de淀粉液化物产生具有高含量的dp3-dp5低聚麦芽糖的糖浆的那些。在这种背景下,高含量意指总低聚麦芽糖的最少15%、25%、30%、35%、40%、45%、50%、55%、60%是dp3、dp4和/或dp5。定义高含量糖浆的另一种方法是按照单独的糖组分来定义,其中dp3最少是15%,dp4最少是10%,dp5最少是5%和/或dp2最多是40%、30%、20%、10%或甚至5%。
[0116]
适合的酶共混物另外地或可替代地是在存在转葡糖苷酶的情况下从12de淀粉液化物产生以总糖的百分比计含量为多于4%异麦芽五糖、多于2%异麦芽六糖和/或多于1%异麦芽七糖(如实例中所述的测量的)的糖浆的那些。
[0117]
e.对β-淀粉酶活性无要求
[0118]
该改进的方法和酶组合物的关键特征是它们基本上是在不存在生麦芽糖活性的情况下进行的,旨在将作为转葡糖苷酶供体的麦芽糖的使用最小化,从而减少游离葡萄糖的产生。基本上在不存在β-淀粉酶活性的情况下意指不必须或不需要分类为β-淀粉酶或生麦芽糖淀粉酶的酶、和/或具有β-淀粉酶活性的酶组合物(如共混物)以产生本文所述的改进的imo。因此,不需要将β-淀粉酶和/或β-淀粉酶活性应用于麦芽糖糊精来达到产生所述的改进的imo的目的。
[0119]
β-淀粉酶活性典型地以糖化力度数(dp
°
)表示。一单位的淀粉酶制剂(diastase)活性(以dp度数(dp
°
)表示)定义为0.1ml的5%样品酶制剂溶液中含有的如下酶量,当在20℃将该样品与100ml的底物一起孵育1小时时,该酶量将产生足够的还原糖以还原5ml的费林溶液(fehling's solution)。在滴定分析程序中使用碱性铁氰化物来测量在反应过程中产生的还原糖基团。该酶测定测量了给定样品中存在的α-淀粉酶和β-淀粉酶两者的活性。
[0120]
在本发明的改进的方法中可以耐受的、从而使得仍然可实现imo质量上的优点的β-淀粉酶活性的量是最多约660dp
°
单位β-淀粉酶/kg ds淀粉水解产物、最多约264dp
°
单位β-淀粉酶/kg ds淀粉水解产物、最多约132dp
°
单位β-淀粉酶/kg ds淀粉水解产物、和最多约66dp
°
单位β-淀粉酶/kg ds淀粉水解产物。如所述,不需要存在可测量的量的β-淀粉酶。
[0121]
f.粗淀粉水解酶
[0122]
很多淀粉降解酶对粗淀粉有活性,如在例如美国专利号7037704、7205138、7303899、7378256和其中含有的参考文献中所述。通常将这些酶称为粗淀粉水解酶或颗粒淀粉水解酶(gshe)。如所述,释放dp3或更长的糖的gshe是适用的。gshe可以用在两步反应中,其中将粗淀粉用gshe处理,用或不用支链淀粉酶处理,以产生低聚麦芽糖,然后使低聚麦芽糖与转葡糖苷酶反应。gshe还可以用在一步反应中,其中将粗淀粉用gshe处理,用或不用支链淀粉酶处理,并且同时与转葡糖苷酶反应。可以从粗淀粉释放低聚糖的酶的实例包括但不限于alpha pf、xtra、白曲霉α-淀粉酶、和4g。
[0123]
iv.改进的imo的特征和用途
[0124]
改进的方法和酶组合物允许从麦芽糖糊精产生低聚异麦芽糖(imo)用于任何数量的用途。与用常规方法产生的imo相比,该imo更长,并且糖浆中的葡萄糖含量更低。可以使用与对常规糖浆使用的那些方法类似的方法将糖浆物理分离为具有希望的dp范围的级分。更具体地,使用本发明的组合物和方法产生的imo比使用常规方法产生的imo更长,并且较长的imo分子相比于较短的分子的含量比率(总糖的%)增加了。更长的imo可能代谢更差,这为消费者提供了更大的健康益处并为食物生产商提供了更多食物成分选择。
[0125]
鉴于本说明书,本发明的方法和从其所得的组合物的这些和其他方面以及实施例对于技术人员将是清楚的。以下实例旨在进一步说明但不限制这些组合物和方法。
[0126]
实例
[0127]
实例1.使用麦芽糖和麦芽三糖的转糖基反应
[0128]
使用在水中30%ds的试剂等级麦芽糖和试剂等级麦芽三糖(两者均购自西格玛奥德里奇公司(sigma aldrich))来进行转糖基反应。制备30%ds的麦芽糖或麦芽三糖溶液并调节至ph 4.2。将大约2g的麦芽糖或麦芽三糖溶液称重加入埃彭道夫(eppendorf)管。向每个埃彭道夫管添加转葡糖苷酶(l-2000;杜邦公司),添加剂量为1kg产品/mt的底物ds。将这些管在60℃下以750rpm的摇动速度在恒温混合器(加热块(thermoblock))中孵育48h。
[0129]
在适当的时间将样品取出用于进行hplc分析。从反应介质取出100μl部分,用蒸馏水稀释10倍并煮沸。过滤之后,将20μl注入配备有bio-rad aminex hpx-42a柱(#1250096,300mm x 7.8mm)的hplc设备。流动相是hplc级的蒸馏水,以0.6ml/min运行22.5min。柱的温度是85℃并且使用池温为40℃的ri检测器进行检测。
[0130]
如表1中总结的,麦芽糖和麦芽三糖的多数在48h后已经消耗。这些结果进一步示出了,48h后,与用麦芽糖进行的反应相比,用麦芽三糖进行的反应释放了大约一半的葡萄糖(dp1)。当将麦芽糖用转葡糖苷酶处理时,起初形成了支化的麦芽三糖(dp3),随后形成了更高聚合度的支化的低聚糖(dpn),这些更高聚合度的支化的低聚糖可能形成自dp3。当将麦芽三糖用转葡糖苷酶处理时,更快地形成了更高度支化的低聚糖(dpn),该更高度支化的低聚糖起初可能是dp4。表1中的结果示出了,当反应以更高聚合度的低聚麦芽糖起始时,通过转葡糖苷酶形成了更高聚合度的支化的imo。这还使葡萄糖的形成减少。
[0131]
表1.从麦芽糖和麦芽三糖进行的糖(%)的产生
[0132][0133]
实例2.使用dp2和dp4糖浆进行的转糖基反应
[0134]
由于用纯的低聚麦芽糖进行转糖基反应不具有商业吸引力,因此使用富含dp4的淀粉水解产物重复实例1中的实验。该淀粉水解产物是使用产生dp4的酶制备的,并且将该淀粉水解产物与使用β-淀粉酶制备的富含麦芽糖的淀粉水解产物进行比较。两种淀粉水解产物均是从32.5%ds的de为11.28的玉米液化物制备的。为产生富含dp4的水解产物,将液化物与0.9kg/mt ds的产生dp4的α-淀粉酶(4g;杜邦公司)加上0.4kg/mt ds的支链淀粉酶(l-1000;杜邦公司)在ph 5.0和60℃下一起孵育48h。为产生富含麦芽糖的水解产物,将相同的液化物用0.9kg/mt ds的β-淀粉酶(bba;杜邦公司)加上0.4kg/mt ds的支链淀粉酶处理。
[0135]
在适当的时间点,将样品取出用于进行hplc分析。从反应介质取出100μl部分,用蒸馏水稀释10倍并煮沸。过滤之后,将20μl注入配备有bio-rad aminex hpx-42a柱(#1250096,300mm x 7.8mm)的hplc设备。流动相是hplc级的蒸馏水,以0.6ml/min运行22.5分钟。柱的温度是85℃并且在池温为40℃的ri检测器中完成检测。在表2中总结了48h的反应时间之后所得糖浆的糖组合物。
[0136]
表2.从玉米液化物产生的麦芽糖和麦芽四糖糖浆的糖组合物
[0137]
糖dp2糖浆dp4糖浆dp12.035.1dp260.26.1dp312.615.0dp42.643.9dp5+22.629.9
[0138]
使这些糖浆进一步与转葡糖苷酶反应以产生imo。将以上富含dp2或dp4的糖浆调节至ph 4.2和30%ds。将2g富含dp4或富含dp2的糖浆样品在60℃用1kg/mt ds的转葡糖苷酶处理24h。24h之后,将样品取出用于进行hplc分析。如上,从反应介质取出100μl部分,用蒸馏水稀释10倍,煮沸,离心并过滤,随后将20μl注入配备有相同的bio-rad aminex hpx-42a柱的hplc设备,使用相同的流动相、流速和温度。表3示出了起始的dp2糖浆和dp4糖浆的糖谱以及24h之后从转葡糖苷酶反应获得的糖谱。
[0139]
表3.tg处理前后的dp2糖浆和dp4糖浆的糖组合物
[0140][0141]
与使用富含dp2的水解产物制备的糖浆相比,使用富含dp4的水解产物制备的imo糖浆在组成上明显不同。与使用富含dp2的糖浆(28%)相比,使用富含dp4的糖浆(17%)的tg反应之后的dp1水平低得多。使用富含dp4的糖浆的tg反应之后的dp2也更低,并且更长的低聚糖(包括dp5、dp6、dp7、d8和dp9)的量更多。
[0142]
实例3.用于产生dp2-dp5糖浆的酶的选择
[0143]
通过将更多样的酶组应用至麦芽糖糊精来重复实例2中所述的实验以从麦芽糖糊精制备富含dp2、dp3、dp4和dp5的糖浆。
[0144]
用于产生富含dp2的糖浆的酶是0.9kg/mt ds的β-淀粉酶(bba,如上)加上0.4kg/mt ds的支链淀粉酶(l1000,如上),或是0.5kg/mt ds的生麦芽糖淀粉酶(2g),用或不用0.4kg/mt ds的支链淀粉酶。用于产生富含dp3的糖浆的酶是源自白曲霉(gc626;杜邦公司)的0.5kg/mt ds的产生dp3的α-淀粉酶,用或不用0.4kg/mt ds的支链淀粉酶。用于产生富含dp4的糖浆的酶是0.9kg/mt ds的产生dp4的α-淀粉酶(4g,如上),用和不用0.4kg/mt ds的支链淀粉酶。用于富含dp5的糖浆的酶是6μg纯化蛋白/g ds的嗜纤维菌属物种基的α-淀粉酶,或是0.2kg/mt ds的嗜热脂肪芽孢杆菌基的α-淀粉酶(alpha pf),用或不用0.4kg/mt ds的支链淀粉酶。
[0145]
在该实例和所有进一步的实例中,将前述淀粉酶分别称为bba、2g、626、4g、cspamy和pf。除非另外说明,否则在所有进一步的实例中使用的支链淀粉酶是l1000并且转葡糖苷酶是transglucosidase
[0146]
对于所有反应,将10g的玉米液化物与以上确定的酶以指示的剂量和ph在60℃一起孵育48h。如上,从反应介质取出100μl部分并用于进行hplc分析。
[0147]
在所有情况下,很清楚的是需要在反应中添加支链淀粉酶以增加希望的糖类的水平并且减少高级糖(dpn)的量。因此,将只讨论用支链淀粉酶的结果。用产生dp3的α-淀粉酶(gc626)获得了具有大约32.5%dp3和39%dp2的糖浆。用产生dp4的α-淀粉酶(4g)获得了具有大约44%dp4的糖浆。用产生dp5的α-淀粉酶(cspamy或alpha pf)获得了分别具有大约29%和21%dp5的糖浆。表4中示出了所有这些反应的糖组成(总量的%)。通过以上说明书,表中使用的酶的缩写是很清楚的。
[0148]
表4.tg处理前的糖浆的糖组成
[0149]
[0150][0151]
在第二步骤中,将以上糖浆调节至ph 4.2和30%ds并且使2g的每种糖浆进一步与1kg/mt ds的转葡糖苷酶在60℃反应24小时。如上,从反应介质取出100μl部分并用于进行hplc分析。制备第二样品用于使用脉冲安培检测(hpae-pad)通过高效阴离子交换色谱法进行分析。在其他方法基于尺寸(单体、二聚体等)分离糖类的情况下,hpae-pad能够将如麦芽三糖、潘糖和异麦芽三糖的异构体分离。具体地,取出100μl样品,稀释1,000倍并煮沸10min。过滤之后,以0.5ml/min的流速和30℃的温度将10μl样品注入配备有保护柱的carbopac pa200柱(3mm x 250mm)。在25℃的池温时进行pad。在色谱运行的60min期间,使用以下条件:(i)注入样品之前,将柱用10%1m naoh和10%500mm naoac以及80%milliq水平衡10分钟。通过用恒定10%1m氢氧化钠和90%milliq水洗脱5分钟来完成糖的分离。在接下来的5分钟期间开始500mm naoac的梯度,其中流动相中的naoac%从0%增加至8%,并且milliq水的%从90%减少至82%。在接下来的50分钟内改变梯度,并且流动相中的milliq%从82%减少至0%,并且naoac%从8%增加至90%。表5示出了梯度。
[0152]
表5.色谱梯度
[0153][0154][0155]
为计算imo含量,需要两个分析。用常规hplc方法(上述),通过测量色谱图上dp1、dp2、dp3、dp4、dp5、dp6、dp7、dp8、dp9、dp10和dpn峰的面积来计算不同糖类的含量(%)。为了清楚起见,10%dp2意指存在于最终糖组成中的10%重量的糖是dp2(等等)。出于表5的目的,dpn是指≥dp11。如所述,该分析不提供关于存在的异构体的信息。然而,例如,存在于dp2峰的异构体可以通过hpae-pad分析区分开来。来自该hpae-pad分析的色谱图揭示了不同异构体的峰,可以基于对组分已知的标准样品进行分离分析来鉴定这些异构体。由于标
准混合物中每个组分的浓度是已知的,因此可以计算出样品中该特定组分的含量。例如,基于hpae-pad分析,如果样品含有1.4%(w/v)麦芽糖、7.4%(w/v)异麦芽糖、2.4%(w/v)曲二糖和1.6%(w/v)黑曲霉糖(w/v),这意指总dp2含有11%麦芽糖、58%异麦芽糖、19%曲二糖和12%黑曲霉糖。例如,如果糖浆中的dp2含量是10%(通过常规hplc测量),这意指总糖浆中异构体的含量是:1.1%麦芽糖、5.8%异麦芽糖、1.9%曲二糖和1.2%黑曲霉糖。以这种方式,可以将dp1、dp2和dp3异构体区分开来。
[0156]
在dp1、dp2和dp3糖的情况下,可以将可能形成的大多数异构体明确地区分开来,这是由于纯的组分可以购自化学供应公司并用作标准品。对于更长的低聚糖(例如dp4和更高),不是所有异构体都能使用易得的标准品区分开来。因此,在dp4和更高的异构体的情况下,只将至多dp10的线性低聚麦芽糖区分开来,即,麦芽四糖、麦芽五糖、麦芽六糖、麦芽七糖、麦芽八糖、麦芽九糖和麦芽十糖。此外,将至多dp7的线性低聚异麦芽糖区分开来,即,鉴定了异麦芽四糖、异麦芽五糖、异麦芽六糖和异麦芽七糖。其他更复杂的支化的低聚糖在色谱图中作为未鉴定的峰示出。随着低聚物变得更长,色谱图上峰重叠的可能性也越大,这导致量化出现问题。缺少用于将更长的异构体分离的可商购标准品和方法是可以理解的,这是因为只有本发明的改进的方法能够实际产生这些imo。
[0157]
为鉴定作为异麦芽四糖的dp4的百分比,假设其仅含有麦芽四糖和异麦芽四糖。在计算imo含量时不考虑其他未鉴定的支化的四聚物。由于支化的低聚糖常被认为是imo,该计算导致略微低估了总imo含量。这对于更长的低聚麦芽糖同样如此。对于dp8-dp11的异构体,假设它们都是线性低聚麦芽糖。这再次导致略微低估了总imo含量。
[0158]
表6中总结的结果示出了转葡糖苷酶处理的糖浆的糖组成,其以总糖的%表示,通过hplc测量并且是指dp数目。表7中总结的结果示出了转葡糖苷酶处理的糖浆中的imo含量,其以总糖的%表示,通过hpae-pad测量。在该表中,im2代表异麦芽糖,im3代表异麦芽三糖等。
[0159]
表6.转葡糖苷酶处理之后dp2-dp5糖浆的糖组成
[0160][0161]
表7.通过hpae-pad测量的以上糖浆的imo含量
[0162][0163]
对表4、表6和表7中总结的最终imo糖浆进行比较,清楚的是转葡糖苷酶反应中供体分子越长,处理之后dp1(游离葡萄糖)的增加越少。此外,随着供体分子的长度增加,总dp1含量减少。
[0164]
在涉及首先产生富含低聚麦芽糖的糖浆、随后用转葡糖苷酶处理的两步反应中,dpn水平降低很少或不降低。这可能是因为支链淀粉酶是在第一反应中而不是tg反应期间添加的。
[0165]
转葡糖苷酶处理之后,当从富含dp4或富含dp5的糖浆起始时,存在更少的dp2,并且将富含低聚麦芽糖的糖浆中的任一种用转葡糖苷酶处理后,存在的dp3和dp4的量几乎没有差异。用转葡糖苷酶处理后,dp6-dp10的量随着供体分子长度的增加而增加。使用富含更长的糖的糖浆的转葡糖苷酶反应使异麦芽糖的量减少并使异麦芽六糖和异麦芽七糖的量增加。
[0166]
与从富含dp2的糖浆起始相比,当从富含dp3的糖浆起始时,imo含量(即,异麦芽糖、异麦芽三糖、潘糖、异麦芽四糖、异麦芽五糖、异麦芽六糖和异麦芽七糖的总和)更高。对于富含dp4和富含dp5的糖浆而言情况则并非如此,而是具有更高含量的dpn,这可能是由于在转糖基化反应期间缺少脱支活性。如果在tg处理的时候通过添加支链淀粉酶来获得这些不可获得的、可能支化的低聚麦芽糖,那么使用更长的供体分子的转葡糖苷酶处理之后的imo含量可能更高。
[0167]
实例4.同时进行的低聚麦芽糖产生和转糖苷
[0168]
在常规产生imo中,在一步反应中使麦芽糖糊精与β-淀粉酶和转葡糖苷酶同时接触以产生imo是不常用的。在该实例中,重复实例3中所述的实验,但并非首先产生富含低聚麦芽糖的糖浆,而是产生低聚麦芽糖和转糖苷同时进行。在该一步反应中,使用与实例3中相同的液化物、酶和酶剂量。温度和ph与实例3的第一步骤中相同。
[0169]
在一步反应期间于适当的时间取样品用于进行如上所述的hplc和hpae-pad分析。表9中示出了最终imo糖浆的糖组合物。表8示出了如通过hpae-pad测量并且使用如实例3中所述的相同的计算的低聚异麦芽糖的组成(总量的%)。将潘糖在表9和随后的表中分开列示。
[0170]
表8.一步反应之后imo糖浆的糖谱
[0171]
[0172]
表9.如通过hpae-pad分析测量的以上糖浆的imo含量。
[0173][0174]
对表8和表9中总结的最终imo糖浆(在一步反应结束时)进行比较,清楚的是在tg反应期间有活性的支链淀粉酶将所有反应中的dpn量减少至与两步反应中相比低得多的水平。高级糖的降解明显可以在一步反应期间持续,这使得更好地利用可获得的低聚糖。
[0175]
如上,dp1含量随着供体分子长度的增加而减少。总而言之,与两步方法相比,一步方法中形成了更多的dp1。即使在用更长的供体分子转糖基期间,最终还是会释放葡萄糖。dp2-dp5含量与用产生dp3+的酶的反应中相似,并且略微低于使用产生麦芽糖的酶的反应。在一步反应中,dp6-dp10含量也以如下顺序随着供体分子长度的增加而增加:pf》cspamy2》4g,626》bba/2g。
[0176]
更短的imo的量通常似乎随着供体分子长度的增加而减少。异麦芽三糖、异麦芽四糖和异麦芽五糖的水平似乎保持大约相同,而异麦芽六糖和异麦芽七糖的水平明显随着供体分子长度的增加而增加。
[0177]
对一步反应和两步反应进行比较,清楚的是(a)在一步反应中产生了更多的imo,(b)在一步反应中产生了更少的潘糖,(c)在一步反应中产生了更多的异麦芽糖并且(d)在一步反应中产生了更多的im5、im6和im7。
[0178]
实例5.β-淀粉酶活性的希望的量
[0179]
在以上实例中,不使用β-淀粉酶来产生imo,并且将其与传统的使用β-淀粉酶产生imo进行比较。在该实验中,研究了在不抵消改进的imo产生方法的益处的情况下,该改进的方法中可以存在多少β-淀粉酶活性。重复如实例4中所述的用4g(不用β-淀粉酶)的一步反应,但有一定剂量范围的β-淀粉酶存在。
[0180]
将5g的玉米液化物(de 12.1,ds 33.1%)在60℃、ph 5.0下与0.9kg/mt ds的产生dp4的α-淀粉酶(4g)和0.16kg/mt ds的支链淀粉酶(l2500)以及1.0kg/mt的转葡糖苷酶一起孵育48h。用如表10中指示的增加量的β-淀粉酶(bba)进行相同的反应。作为对照,在ph 5.0和60℃下用0.9kg/mt的β-淀粉酶(
bba)、0.16kg/mt的支链淀粉酶(l2500)和1.0kg/mt的转葡糖苷酶进行传统的一步骤糖化。
[0181]
在糖化期间于适当的时间取样品用于进行如前述实例中所述的hplc和hpae-pad分析。表11中示出了最终imo糖浆的糖组成。表12示出了如通过hpae-pad测量并且使用如实例3中所述的相同的计算的低聚异麦芽糖的组成(总量的%)。
[0182]
表10.用于确定β-淀粉酶的希望的量的酶剂量
[0183][0184]
表11.48小时糖化之后反应的糖谱(%)
[0185][0186]
表12.如通过hpae-pad分析测量的以上糖浆的imo含量(%)。
[0187][0188]
从表11中清楚的是,如前述实例中所见,用4g的反应产生了具有比传统地用bba的反应低得多的dp1的糖浆。还示出了用4g的反应期间可以存在少量的β-淀粉酶,而不明显地影响结果。具体地,当存在至多0.05kg/mt bba时,dp1与不存在bba时一样低。只有当存在0.1kg/mt bba时,dp1开始增加,并且根据β-淀粉酶的量以剂量依赖性方式进一步增加。在0.5kg/mt的剂量时,dp1水平非常接近于仅用β-淀粉酶进行的常规反应的dp1水平。
[0189]
除dp11+以外,产生的其他糖的量遵循相同的趋势。在至多0.05bba的剂量下,与不用bba的反应相比,糖谱几乎无变化。当剂量进一步增加时,该改进的方法和常规方法之间的差异随剂量增加而变得更小。对于其中使用4g和bba两者的反应,与传统的仅用bba的反应相比,dp11+的量更低。清楚的是,当存在两种酶时,淀粉片段越长,越易于水解。
[0190]
如表12中所示,与用bba的反应相比,在用4g的反应中更长的imo(参见,例如im6和im7)的量更大。此外,在该实例中,测量到更少的im2和更多的潘糖。总而言之,该实验中制备的imo的总量比前述实验中更高,这可能是由于使用了不同的液化物。
[0191]
当在用4g的反应中存在少量的β-淀粉酶(bba)时,im2比不存在β-淀粉酶时更高。在至多0.05kg/mt的β-淀粉酶剂量的情况下,im2的量不随剂量而改变。在更高剂量的bba的情况下,im2含量增加至与仅用bba的常规反应相同的水平。对其他糖可见相似效应。
[0192]
一个令人惊奇的观察结果是,在4g反应中存在0.01kg/mt的bba时,总imo含量增加。鉴于少量的β-淀粉酶不增加dp1的形成,其可能实际上对该改进的方法有益。然而,更大量的β-淀粉酶显然与本发明的改进的方法不相称。
[0193]
实例6.将β-淀粉酶剂量转化为β-淀粉酶活性单位
[0194]
在前述实例中,酶剂量以kg酶/mt底物表示,这对于商业产品是方便的,并且是行业中的常见做法。出于定义该改进的方法的目的,β-淀粉酶的剂量应该以反应中存在的活性单位表示。
[0195]
bba具有1320dp
°
/g产品的平均β-淀粉酶活性,其中dp
°
是指糖化力。dp
°
的确定基于在ph 4.6和20℃下淀粉底物的30分钟水解。在滴定分析程序中使用碱性铁氰化物来测量水解后产生的还原糖基团。一单位的淀粉酶制剂活性(以dp度数(
°
dp)表示)定义为0.1ml的5%样品酶制剂溶液中含有的如下酶量,当在20℃将该样品与100ml的底物一起孵育1小时时,该酶量将产生足够的还原糖以还原5ml的费林溶液。作为实例,0.05kg/mt剂量的bba相当于50g/mt,其相当于50x 1320dp
°
单位/mt、或66,000dp
°
单位/mt。该量相当于淀粉水解产物中66dp
°
单位/kg、或66dp
°
单位/kg的干固体。
[0196]
实例5中所述的结果指示,本发明的改进的方法不受淀粉水解产物中存在的至多66dp
°
单位的β-淀粉酶活性/kg干固体的负面影响。在存在至多66dp
°
单位的情况下,dp1与不存在β-淀粉酶时一样低,具有相同的、或甚至更高的imo含量。据估算,存在少至13.2dp
°
/kg可能甚至是有益的。然而,当存在增加量的β-淀粉酶活性时,该改进的方法的这些益处以剂量依赖性方式被削弱,直到imo谱与通过常规方法获得的类似。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1