一种非动物源低分子量肝素及其制备方法与应用与流程
本发明涉及一种非动物源低分子量肝素及其制备方法与应用,属于生物医药技术领域。
背景技术:
肝素是一种高度硫酸化的、结构不均一的糖胺聚糖,是由葡萄糖胺(glcn)与艾杜糖醛酸(idoa)或葡萄糖醛酸(glca)以1,4-糖苷键连接而成的一种天然抗凝物质,其重均分子量在5000da~25000da之间。肝素作为抗凝药物应用于临床已经超过80年,至今发挥着无可替代的重要作用。
目前商品化肝素主要包括普通肝素、低分子量肝素,其中普通肝素又称未分级肝素(unfractionatedheparin,ufh),主要从猪小肠黏膜、牛肺等动物脏器中提取得到;ufh经物理、化学或酶法部分解聚可得到重均分子量小于8000da的产物即低分子量肝素(low-molecular-weightheparin,lmwh)。英国药典规定:lmwh的重均分子量一般不得大于8000da,且其中重均分子量小于8000da的物质至少应超过60%。lmwh具有体内半衰期长、生物利用度高,副作用小及使用安全等优点,近年逐渐替代ufh成为首选临床抗凝药物。但应用最广泛的化学法解聚反应条件剧烈,极易使肝素分子中的某些功能基团(如硫酸基团)丢失或被破坏,从而可能造成lmwh抗凝活性下降。
动物脏器来源的ufh及lmwh具有原料来源丰富、价格相对低廉、生产工艺成熟等优点。但是,此类结构复杂的动物源肝素质量控制难度大且存在被污染的可能,临床应用中存在较大的安全隐患,如疯牛病、非洲猪瘟的出现使人们对使用动物来源的肝素产生了担忧,特别是自2007年以来发生的多次肝素污染事件更加剧了人们对动物源肝素的恐惧。考虑到肝素在临床应用中的重要价值,寻求新的非动物源肝素受到广泛关注。其中,化学法合成发展迅速并成功实现了结构确定的、特异性抑制xa活性的磺达肝素(fondaparinux)的上市,但因其合成步数多,总产率低(通常小于0.3%),导致成本极高,在市场上几无竞争力。近期jianliu的团队(science,2011,334(6055):498–501)通过模拟肝素的体内生物合成途径,发展了一种全新的化学酶法合成策略,以大约10步即可得到具有特异抗xa活性的肝素寡糖,但面临制备规模小、成本偏高等挑战。
大肠杆菌k5(e.colik5)等微生物能产生一种特殊的胞外多糖(k5cps),是由β-d-葡萄糖醛酸(glca)和α-d-n-乙酰葡萄糖胺(glcnac)二糖重复单元[-glca-β(1,4)-glcnac-α(1,4)-]n组成的糖胺聚糖,被认为是未经修饰、重均分子量不同的肝素前体多糖。故而以k5cps为原料被认为有望制备得到非动物来源的肝素及衍生物(中国现代应用药学,2019,36:114-119)。
国内外学者曾尝试以胞外多糖k5cps为原料,采用多种策略进行修饰以制备具有抗凝活性的衍生物。研究证实,单纯的化学修饰方法反应条件剧烈、选择性差,且无法使糖链的glca残基转变为肝素所必需的2-o-硫酸化艾杜糖醛酸(idoa2s)。相比之下,酶法修饰是较为可行的策略,例如robertj.linhardt课题组(carbohydrpolym,2015,122:399-407)采用化学酶法修饰k5cps,得到了抗xa与抗iia活性相当的衍生物,但该方法效率低、工艺稳定性差,难以真正实现规模化制备,而且所得产物的精细结构、重均分子量与肝素差别较大。迄今为止,以k5cps为原料尚无法实现具有肝素/低分子量肝素的典型结构、抗凝活性强的非动物源产物的高效制备。
技术实现要素:
针对现有技术的不足,本发明提供了一种非动物源低分子量肝素及其制备方法与应用。本发明以胞外多糖k5cps为原料,将肝素酶iii的部分解聚作用与化学酶法修饰胞外多糖k5cps的技术合理组合,建立了具有肝素典型结构特征、并具备显著抗凝活性的低分子量产物的半合成新方法,采用本发明的制备方法可以高效制备结构均一性好、抗凝活性强的非动物源低分子量肝素(non-animal-sourcedlmwh,简称nalmwh)。
术语说明:
paps:3'-磷酸腺苷-5'-磷酸硫酸。
胞外多糖k5cps:是由β-d-葡萄糖醛酸(glca)和α-d-n-乙酰葡萄糖胺(glcnac)二糖重复单元[-glca-β(1,4)-glcnac-α(1,4)-]n组成的糖胺聚糖。
本发明的技术方案如下:
一种非动物源低分子量肝素,其结构式如下:
其中,x,y为0~9之间的整数,且x+y为2~9之间的整数。
上述一种非动物源低分子量肝素的制备方法,包括步骤如下:
(1)以胞外多糖k5cps为底物,将胞外多糖k5cps的n-乙酰葡糖胺(glcnac)残基经化学法n-脱乙酰化/n-硫酸化修饰成为n-硫酸化葡糖胺(glcns),得到中间产物1;
(2)将中间产物1经肝素酶ⅲ部分解聚得到低分子量的中间产物2;
(3)通过肝素c-5差向异构化酶(c5-epi)和肝素2-o-硫酸基转移酶(2ost)共同催化修饰,使中间产物2的葡糖醛酸(glca)残基一步转变为2-o-硫酸化艾杜糖醛酸(idoa2s),得到中间产物3;
(4)由肝素6-o-硫酸基转移酶(6ost)催化,使中间产物3的葡糖胺(glcns)残基发生6-o-硫酸化修饰(glcns6s),得到中间产物4;
(5)由肝素3-o-硫酸基转移酶(3ost)催化,使中间产物4的葡糖胺发生3-o-硫酸化修饰(glcns6s3s),得到具有抗fxa和fiia活性的非动物源低分子量肝素(nalmwh)。
根据本发明优选的,步骤(1)中所述胞外多糖k5cps来源于天然微生物大肠杆菌k5、多杀性巴氏杆菌、副鸡禽杆菌、或者代谢产生胞外多糖k5cps的基因工程菌株;所述胞外多糖k5cps的重均分子量>10000da。
本发明一个优选的技术方案中,所述胞外多糖k5cps是将大肠杆菌k5发酵液上清浓缩、醇沉得到多糖粗品,再通过强阴离子交换柱层析纯化得到。
根据本发明优选的,步骤(1)中所述化学法n-脱乙酰化/n-硫酸化的具体方法为:
将胞外多糖k5cps溶解于碱性溶液中,水浴加热处理以实现胞外多糖k5cps的n-乙酰葡糖胺(glcnac)残基的n-脱乙酰化,然后调节ph至7.0~8.0,以三氧化硫-三甲胺混合物为硫酸基供体对葡糖胺残基进行n-硫酸化定点修饰,制得中间产物1。
进一步优选的,所述碱性溶液为2m氢氧化钠溶液。
进一步优选的,所述水浴加热处理为55~65℃下反应5~10h。
进一步优选的,所述三氧化硫-三甲胺混合物的加入量与k5cps的质量比不低于3∶1。
进一步优选的,所述n-硫酸化定点修饰的反应条件为45~50℃下反应20~30h。
根据本发明优选的,步骤(2)中所述肝素酶ⅲ部分解聚的具体方法为:
将中间产物1与肝素酶iii在缓冲溶液中混合,恒温水浴反应使中间产物1部分解聚,反应液分离纯化后得到低分子量的中间产物2。
进一步优选的,所述缓冲溶液的组分为50mmtris-hcl,10mmcacl2,溶剂为水,ph为7.0。
进一步优选的,所述中间产物1在缓冲溶液中的浓度为0.5~5.0mg/ml;优选为2mg/ml。
进一步优选的,所述肝素酶iii在缓冲溶液中的浓度为1.0~10.0miu/ml;优选为7.0~8.1miu/ml。
进一步优选的,所述恒温水浴反应的条件为20~37℃反应30~60min;优选为37℃反应30min。
进一步优选的,所述中间产物2的重均分子量为2000da~5000da。
根据本发明优选的,步骤(3)中所述肝素c-5差向异构化酶(c5-epi)和肝素2-o-硫酸基转移酶(2ost)共同催化修饰的具体方法为:
将中间产物2与肝素c-5差向异构酶(c5-epi)先在缓冲溶液中进行异构化反应,再加入肝素2-o-硫酸基转移酶(2ost)和硫酸基供体paps进行硫酸化修饰,反应液经强阴离子柱层析或超滤纯化,得到中间产物3。
进一步优选的,所述缓冲溶液的组分为:50mmmes,2mmcacl2,溶剂为水,ph为7.0~7.4。
进一步优选的,所述异构化反应的条件为20~37℃反应0.5h~1.5h。
进一步优选的,所述硫酸基供体paps的加入量为中间产物2所含葡萄糖醛酸残基(glca)摩尔质量的1.1~1.5倍。
进一步优选的,所述硫酸化修饰的反应温度为20~37℃。
进一步优选的,所述共同催化修饰的反应终点为中间产物3中双糖idoa2s-glcns的摩尔百分比为30%~90%,优选为45%~85%。
根据本发明优选的,步骤(4)中所述肝素6-o-硫酸基转移酶(6ost)催化的具体方法为:
将中间产物3与6-o-硫酸基转移酶1(6ost1)和6-o-硫酸基转移酶3(6ost3)、硫酸基供体paps在缓冲溶液中混合进行硫酸化修饰,反应液经强阴离子交换柱层析或超滤纯化,得到中间产物4。
进一步优选的,所述缓冲溶液的组分为:50mmmes,2mmcacl2,溶剂为水,ph为7.0~7.4。
进一步优选的,所述硫酸基供体paps的加入量为中间产物3所含葡糖胺残基(glcn)摩尔质量的1.1~1.5倍。
进一步优选的,所述硫酸化修饰的反应温度为20~37℃。
进一步优选的,所述硫酸化修饰的反应终点为中间产物4中双糖idoa2s-glcns6s的摩尔百分比为45%~90%。
根据本发明优选的,步骤(5)中所述肝素3-o-硫酸基转移酶(3ost)催化的具体方法为:
将中间产物4与3-o-硫酸基转移酶1(3ost1)、硫酸基供体paps在缓冲溶液中混合进行硫酸化修饰,反应液经强阴离子交换柱层析或超滤纯化,得到非动物源低分子量肝素(nalmwh)。
本发明中,经生色底物法测定上述非动物源低分子量肝素具有抗fxa和fiia活性。
进一步优选的,所述缓冲溶液的组分为:50mmmes,2mmcacl2,溶剂为水,ph为7.0~7.4。
进一步优选的,所述硫酸基供体paps的加入量为中间产物4所含葡糖胺残基(glcn)摩尔质量的1.1~1.5倍。
进一步优选的,所述硫酸化修饰的反应温度为20~37℃。
进一步优选的,所述非动物源低分子量肝素的重均分子量为3000da~8000da,优选为4000da~8000da;其抗fxa活性>50iu/mg,抗fxa和fiia活性比>2。
上述非动物源低分子量肝素(nalmwh)在制备治疗血栓性疾病的药物中的应用。
有益效果:
本发明提供了一种化学酶法半合成非动物源低分子量肝素的新方法,包括一步化学法与多种酶催化法有序进行的步骤:提取胞外多糖k5cps,将其化学法n-脱乙酰化/n-硫酸化修饰后,再经肝素酶ⅲ在缓冲溶液中部分解聚;所得到的低分子量产物依次进行酶法c-5差向异构化/2-o-硫酸化修饰、6-o-硫酸化修饰、3-o-硫酸化修饰,得到具有抗fxa和fiia活性的产物。本发明提供了制备具有肝素典型结构特征和显著抗凝活性的低分子量产物的新方法,该方法的原料非动物来源、质量可控、污染风险低,采用的反应条件温和、高效,所得产物易分离,能够实现结构均一性好、抗凝活性强的非动物源低分子量肝素的规模化制备,制备得到的非动物源低分子量肝素可以替代动物源低分子量肝素作为临床抗凝药物,或用于制备治疗血栓性疾病的药物,具有重大产业化和临床应用前景。
附图说明
图1是非动物源低分子量肝素nalmwh的合成路线图;
图2是胞外多糖k5cps双糖分析的高效液相色谱图;图中,横坐标为保留时间,纵坐标为232nm处的吸光值;
图3是胞外多糖k5cps的多角度激光光散射分析图;图中,a为定义峰图,横坐标为时间,纵坐标为响应信号值;b为分布曲线图,横坐标为摩尔质量,纵坐标为累积质量分数;
图4是中间产物1双糖分析的高效液相色谱图;图中,横坐标为保留时间,纵坐标为232nm处的吸光值;
图5是中间产物1的多角度激光光散射分析图;图中,a为定义峰图,横坐标为时间,纵坐标为响应信号值;b为分布曲线图,横坐标为摩尔质量,纵坐标为累积质量分数;
图6是中间产物2的多角度激光光散射分析图;图中,a为定义峰图,横坐标为时间,纵坐标为响应信号值;b为分布曲线图,横坐标为摩尔质量,纵坐标为累积质量分数;
图7是中间产物3双糖分析的高效液相色谱图;图中,横坐标为保留时间,纵坐标为232nm处的吸光值;
图8是中间产物4双糖分析的高效液相色谱图;图中,横坐标为保留时间,纵坐标为232nm处的吸光值;
图9是肝素双糖分析的高效液相色谱图;图中,a为非动物源低分子量肝素nalmwh,b为依诺肝素;横坐标为保留时间,纵坐标为232nm处的吸光值;
图10是非动物源低分子量肝素nalmwh的多角度激光光散射分析图;图中,a为定义峰图,横坐标为时间,纵坐标为响应信号值;b为分布曲线图,横坐标为摩尔质量,纵坐标为累积质量分数;
图11是依诺肝素的多角度激光光散射分析图;图中,a为定义峰图,横坐标为时间,纵坐标为响应信号值;b为分布曲线图,横坐标为摩尔质量,纵坐标为累积质量分数;
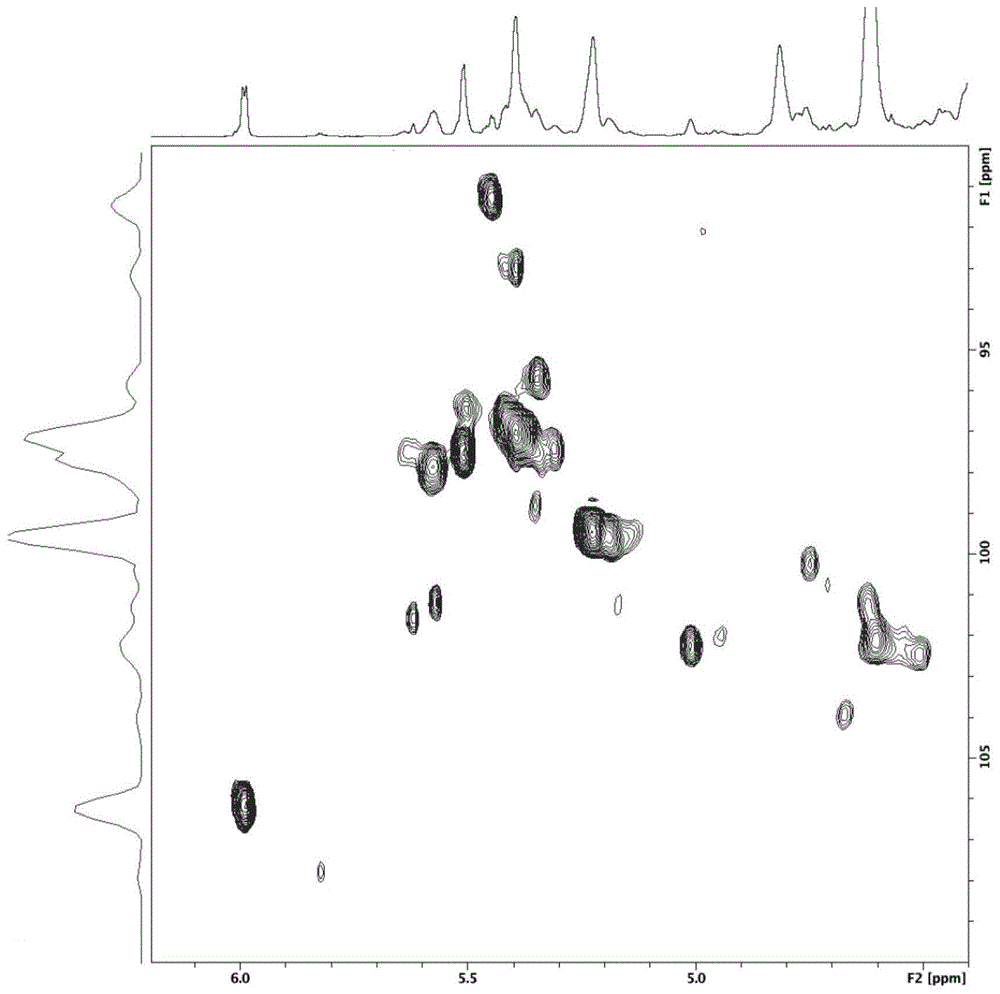
图12是非动物源低分子量肝素nalmwh的hsqc核磁共振波低场区谱图;
图13是依诺肝素的hsqc核磁共振波低场区谱图。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。实施例中涉及的药品及试剂,若无特殊说明,均为普通市售产品。
实施例中所述的室温具有本技术领域公知的含义,一般是指25±2℃。
本发明中,非动物源低分子量肝素nalmwh的合成路线如图1所示,胞外多糖k5cps经化学法n-脱乙酰化/n-硫酸化修饰后得到中间产物1,中间产物1经肝素酶ⅲ部分解聚后得到中间产物2,中间产物2经c-5差向异构化/2-o-硫酸化修饰后得到中间产物3,中间产物3经6-o-硫酸化修饰后得到中间产物4,中间产物4经3-o-硫酸化修饰后即得非动物源低分子量肝素nalmwh。
实施例1:大肠杆菌k5胞外多糖k5cps的制备
大肠杆菌k5采用发酵罐培养,培养基为葡萄糖培养基,其成分为:20g/l葡萄糖、10~300mg/l维生素b1、13.5g/lkh2po4、4.0g/l(nh4)2hpo4、1.4g/lmgso4·7h2o、1.7g/l柠檬酸、10.0ml/l微量元素,ph为7.0。其中,微量元素配制如下:将10.0gfeso4·7h2o、2.0gcacl2、2.2gznso4·7h2o、0.5gmnso4·4h2o、1.0gcuso4·h2o、0.1g(nh4)6mo7o24·4h2o和0.02gna2b4o7·10h2o溶于1l2m的hcl中。补料培养基为:300~600g/l葡萄糖、20g/lmgso4·7h2o、0.15~0.25g/l维生素b1。
发酵条件为:接种量为4%,30%氨水调节ph,温度37℃,转速500rpm,培养36h。
发酵完成后,发酵液以8000rpm离心15min,收集的上清用截留分子量(mwco)5000da的超滤膜超滤浓缩,后加入3倍体积无水乙醇沉淀,于4℃过夜醇沉,醇沉液以8000rpm离心15min,收集沉淀得到多糖粗品。
多糖粗品采用q-sepharose柱层析纯化,收集目标组分、浓缩,然后用截留分子量为1000da的透析袋透析,于旋转蒸发仪浓缩、冷冻干燥机冻干即得胞外多糖k5cps纯品。
所得胞外多糖k5cps用肝素酶i、ii、iii充分切割后采用高效液相色谱仪进行双糖分析,结果如图2所示,表明胞外多糖k5cps的水解产物仅含不饱和双糖δu-glcnac,证实胞外多糖k5cps由glca-glcnac聚合而成。胞外多糖k5cps的多角度激光光散射仪的分析结果如图3所示,测得其重均分子量为118.1kda,多分散指数(pdi)为1.298。
实施例2:胞外多糖k5cps的化学法n-脱乙酰化/n-硫酸化修饰
将100mg实施例1制备得到的胞外多糖k5cps纯品溶解于25ml2m氢氧化钠溶液中,在60℃水浴条件下反应7h,结束后冷却至室温,用2m盐酸调ph为7.0~8.0,然后加入0.3g碳酸钠和0.3g三氧化硫-三甲胺混合物,于47℃反应12h,再加入等量的碳酸钠和三氧化硫-三甲胺混合物,于47℃继续反应12h。反应结束后冷却至室温,盐酸调ph至7.0,用截留分子量为3500da的透析袋透析除盐,透析液冻干后即得n-脱乙酰化/n-硫酸化的胞外多糖k5cps衍生物即中间产物1的纯品。
所得中间产物1用肝素酶i、ii、iii充分切割后采用高效液相色谱仪进行双糖分析,结果如图4所示,水解产物中不饱和双糖δu-glcnac、δu-glcns的摩尔百分比分别为5%、95%,表明中间产物1的glcn残基的n-硫酸化修饰率为95%。中间产物1的多角度激光光散射仪的分析结果如图5所示,测得其重均分子量(mw)为29.84kda,多分散指数(pdi)为1.553。
实施例3:中间产物1的肝素酶iii部分解聚
表达肝素酶iii的大肠杆菌参照文献构建(carbohydrpolym,2017,173:276-285)。工程化菌株采用lb培养基培养,抗性为50μg/ml氨苄青霉素,37℃培养至od600为0.6~0.8,0.2mmiptg在22℃下诱导18~20h。培养结束后,8000rpm离心15min,收集菌体,冰上破碎离心过滤后采用nisepharose6b亲和柱层析进行纯化,所得重组肝素酶iii纯度大于80%。
称取100mg实施例2制得的中间产物1溶解于50ml缓冲溶液(50mmtris-hcl,10mmcacl2,溶剂为水,ph为7.0)中,加入36μl总活力为371miu的肝素酶iii溶液,于37℃恒温水浴中解聚反应30min,沸水浴5min,使酶失活,冷却至室温,反应液过滤后用截留分子量为2000da的透析袋透析,透析液用冷冻干燥机冻干即得中间产物2。
中间产物2经双糖分析证实,其双糖类型和比例与中间产物1相同(图略)。中间产物2的多角度激光光散射仪的分析结果如图6所示,测得其重均分子量为3.276kda,多分散指数(pdi)为1.178。
实施例4:中间产物2的酶法c-5差向异构化和2-o-硫酸化修饰
表达肝素c-5差向异构化酶(c5-epi)和肝素2-o-硫酸基转移酶(2ost)的大肠杆菌工程菌株参照文献构建(science.2011,334(6055):498–501)。两种酶的提取纯化方法与实施例3中肝素酶iii的方法类似,不同之处为肝素c-5差向异构化酶(c5-epi)的抗性为15μg/ml卡那霉素、50μg/ml羧苄青霉素、12.5μg/ml四环素和50μg/ml氯霉素,诱导时需先加入终浓度为1mg/ml的l-阿拉伯糖,5min后再加入0.2mmiptg在22℃下诱导18~20h;肝素2-o-硫酸基转移酶(2ost)表达菌株的抗性为50μg/ml卡那霉素、50μg/ml羧苄青霉素、12.5μg/ml四环素,诱导方法同肝素酶iii。肝素c-5差向异构化酶(c5-epi)和肝素2-o-硫酸基转移酶(2ost)采用mbpsepharose亲和柱层析进行纯化,所得酶纯度大于80%。
称取50mg实施例3制备得到的中间产物2溶解于50ml缓冲溶液(50mmmes、2mmcacl2,溶剂为水,ph为7.0)中,加入5mg肝素c-5差向异构化酶(c5-epi),于37℃下反应1h后加入70mg硫酸基供体paps,5mg肝素c-5差向异构化酶(c5-epi),10mg肝素2-o-硫酸基转移酶(2ost),于30℃继续反应,可根据反应进程补加适量酶与硫酸基供体paps至反应终点;反应液用醋酸调节ph至4.0以终止反应,离心过滤后用q-sepharose柱层析纯化,收集样品溶液,用截留分子量为1000da的透析袋透析,透析液用冷冻干燥机冻干即得中间产物3。
所得中间产物3用肝素酶i、ii、iii充分切割后采用高效液相色谱仪进行双糖分析,结果如图7所示,水解产物中不饱和双糖δu2s-glcns的摩尔百分比为65%,表明中间产物3的c-5差向异构化/2-o-硫酸化修饰率为65%。
实施例5:中间产物3的酶法6-o-硫酸化修饰:
表达6-o-硫酸基转移酶1(6ost1)和6-o-硫酸基转移酶3(6ost3)的大肠杆菌工程菌株参照文献构建(science.2011,334(6055):498–501)。酶的提取方法与实施例3中肝素酶iii的提取方法类似,但其抗性为50μg/ml卡那霉素、50μg/ml羧苄青霉素、12.5μg/ml四环素。诱导时6-o-硫酸基转移酶3(6ost3)先加入终浓度为1mg/ml的l-阿拉伯糖,5min后再加入0.2mmiptg在22℃下诱导18~20h,6-o-硫酸基转移酶1(6ost1)直接加入0.2mmiptg在22℃下诱导18~20h。6-o-硫酸基转移酶1(6ost1)和6-o-硫酸基转移酶3(6ost3)均采用mbpsepharose亲和柱层析进行纯化,所得酶纯度大于80%。
称取50mg实施例4制备得到的中间产物3溶解于50ml缓冲溶液(50mmmes、2mmcacl2,溶剂为水,ph为7.0)中,再加入70mg硫酸基供体paps、5mg6-o-硫酸基转移酶1(6ost1)和5mg6-o-硫酸基转移酶3(6ost3),于30℃下反应12h,可根据反应进程补加适量酶与硫酸基供体paps至反应终点;反应液用醋酸调节ph至4.0以终止反应,离心过滤后用q-sepharose柱层析纯化,收集样品溶液,用截留分子量为1000da的透析袋透析,透析液用冷冻干燥机冻干即得中间产物4。
所得中间产物4用肝素酶i、ii、iii充分切割后采用高效液相色谱仪进行双糖分析,结果如图8所示,水解产物中δu-glcns6s的摩尔百分比为23%,δu2s-glcns6s的摩尔百分比为54%,表明中间产物4的6-o-硫酸化修饰率为77%。
实施例6:中间产物4的酶法3-o-硫酸化修饰
表达3-o-硫酸基转移酶1(3ost1)的大肠杆菌工程菌株参照文献构建(science.2011,334(6055):498–501)。3-o-硫酸基转移酶1(3ost1)的提取纯化方法与实施例3所述肝素酶iii的方法类似,其抗性为50μg/ml卡那霉素。
称取50mg实施例5制备得到的中间产物4溶于50ml缓冲溶液(50mmmes、2mmcacl2,溶剂为水,ph为7.0)中,再加入70mg硫酸基供体paps、5mg3-o-硫酸基转移酶1(3ost1),于30℃下充分反应;反应液用醋酸调节ph至4.0终止反应,离心过滤后用q-sepharose层析柱纯化,收集样品溶液,用截留分子量为1000da的透析袋透析,透析液用冷冻干燥机冻干即得非动物源低分子量肝素(nalmwh)纯品。
所得非动物源低分子量肝素(nalmwh)用肝素酶i、ii、iii切割后采用高效液相色谱仪进行双糖分析,结果如图9a所示,其水解产物的不饱和双糖主要包括δu-glcnac、δu-glcns、δu-glcns6s、δu2s-glcns、δu2s-glcns6s,摩尔百分比分别为1%、18%、21%、8%、52%;动物源低分子量肝素依诺肝素(图9b)水解产物的不饱和双糖主要包括δu-glcnac、δu-glcns、δu-glcns6s、δu2s-glcns、δu2s-glcns6s,摩尔百分比分别为10%、5%、15%、5%、65%,由此可知本发明所得产物非动物源低分子量肝素(nalmwh)的双糖种类与动物源低分子量肝素相同,且主要双糖为δu2s-glcns6s。
多角度激光光散射仪测定的分析结果如图10所示,非动物源低分子量肝素(nalmwh)的重均分子量(mw)和多分散系数(pdi)分别为:4.021kda、1.076,其中mw<8000da的比例为98.9%;同样条件下测得依诺肝素(图11)的重均分子量(mw)、多分散系数(pdi)及mw<8000da的比例分别为:5.261kda、1.073、95.3%,表明本发明制备得到的非动物源低分子量肝素(nalmwh)的重均分子量(mw)与一般规定的低分子量肝素(lmwh)相符。
采用2dnmr分析所得非动物源低分子量肝素(nalmwh),其hsqc谱图的低场区信号如图12所示,可以清楚观察到glcns6x-(idoa2s)、glcns6x3s、idoa2s-(glcns6x3x)、glca-(glcns6x3s)等动物源肝素表现抗xa活性必需的典型结构信息,并观察到非还原末端δu和还原末端的glcns6x的异头信号。相比之下,依诺肝素(图13)除了肝素的典型结构外,还可观察到较多非必需结构信号,因此本发明制备得到的非动物源低分子量肝素(nalmwh)具有动物源肝素的典型结构特征,且其精细结构更均一。
实施例7:非动物源低分子量肝素(nalmwh)的体外活性测定
采用生色底物法测得本发明制备得到的非动物源低分子量肝素(nalmwh)的抗fxa、fiia因子的活性分别为90.8iu/mg、13.6iu/mg,抗fxa/fiia活性之比为6.68。同样条件下测得依诺肝素抗fxa、fiia因子的活性分别为91.1iu/mg、18.3iu/mg,抗fxa/fiia活性之比为4.97。因此本发明所得非动物源低分子量肝素(nalmwh)的抗fxa、fiia因子活性与依诺肝素相当。
- 还没有人留言评论。精彩留言会获得点赞!