大豆GmTST2.1基因在大豆育种中的应用的制作方法
本发明涉及一种大豆gmtst2.1基因在大豆育种中的应用,属于植物生物技术领域。
背景技术:
大豆是全世界广泛种植的重要食用蛋白质和油料作物,其研究的主要任务是培育优质高产的新品种大豆。种子作为大豆的重要经济产物,在它的发育过程中需要很多的光合产物运输到库。光合产物向库运输的形式主要为蔗糖。因此,大豆产量和品质的形成与高效蔗糖运输密切相关。作物光合作用合成的大多数蔗糖通过韧皮部的运输最终卸载到库组织,在其运输途中糖转运蛋白发挥了关键作用。液泡膜糖转运蛋白tst(tonoplastsugartransporter)在糖转运过程中起重要作用,可把“源”中的碳水化合物转运到“库”中,从而增强库势,促进作物产量形成。
技术实现要素:
为了大豆高产、抗逆新品种的培育,本发明提供了一种大豆gmtst2.1基因在制备转基因大豆植株中的应用,步骤如下:
1)克隆大豆gmtst2.1基因;所述gmtst2.1基因核苷酸序列如seqidno.1所示;
2)将gmtst2.1基因构建到表达载体中,获得重组载体;
3)将重组载体导入大豆中,获得转基因植株。
进一步地限定,步骤2)所述的表达载体为pcambia3300。
进一步地限定,步骤3)所述大豆品种为黑河43。
进一步地限定,步骤3)所述重组载体通过农杆菌介导法转化大豆。
进一步地限定,所述农杆菌为eha105。
本发明还提供了大豆gmtst2.1基因在富含可溶性糖大豆品种育种中的应用,所述gmtst2.1基因核苷酸序列如seqidno.1所示。
本发明还提供了大豆gmtst2.1基因在大豆抗旱品种育种中的应用,所述gmtst2.1基因核苷酸序列如seqidno.1所示。
有益效果
本发明克隆了gmtst2.1,并证明该基因能够参与到大豆产量的相关进程中,过表达该基因可显著提高大豆的株高、百粒重和可溶性糖含量,生物学产量以及经济产量,与野生型相比,过表达gmtst2.1基因大豆株高增加14%,百粒重增加8.2%,蛋白质和脂肪含量变化不显著而可溶性糖含量明显升高,且为野生型的1.83倍,生物学产量增加87%,且该基因具有明显的抵抗干旱的功能,将得到的转基因材料通过之后的继代繁殖及鉴定,可以成为稳定的高产遗传材料。本发明为大豆高产抗逆新品种的培育提供优良基因资源和新材料。
附图说明
图1rna和pcr产物电泳结果,左图中1-2为williams82rna,右图中3为gmtst2.1目的条带,m为标准分子量2000,从上至下,大小依次为2000bp,1000bp,750bp,500bp,250bp,100bp;
图2gmtst2.1基因表达载体的构建,m:dl15000;a:双酶切鉴定,其中1:阳性重组质粒,2:双酶切产物;b:转化农杆菌菌液pcr鉴定,其中1:阳性重组质粒,2:阴性质粒对照,3:水对照,4-7:pcr产物;
图3t1代转基因大豆的pcr检测,m:dl2000;a:bar引物的pcr鉴定;b:特异性引物的pcr鉴定;1均为阳性对照,2均为阴性对照,3均为水;4-14分别为pcr产物;
图4t1代转gmtst2.1基因大豆植株的qrt-pcr检测,1-10为转基因植株;ck为野生型植株;
图5t1代转gmtst2.1大豆植株半定量rt-pcr检测,其中ck1为空白对照;ck2为阴性对照;1-7为pcr产物;
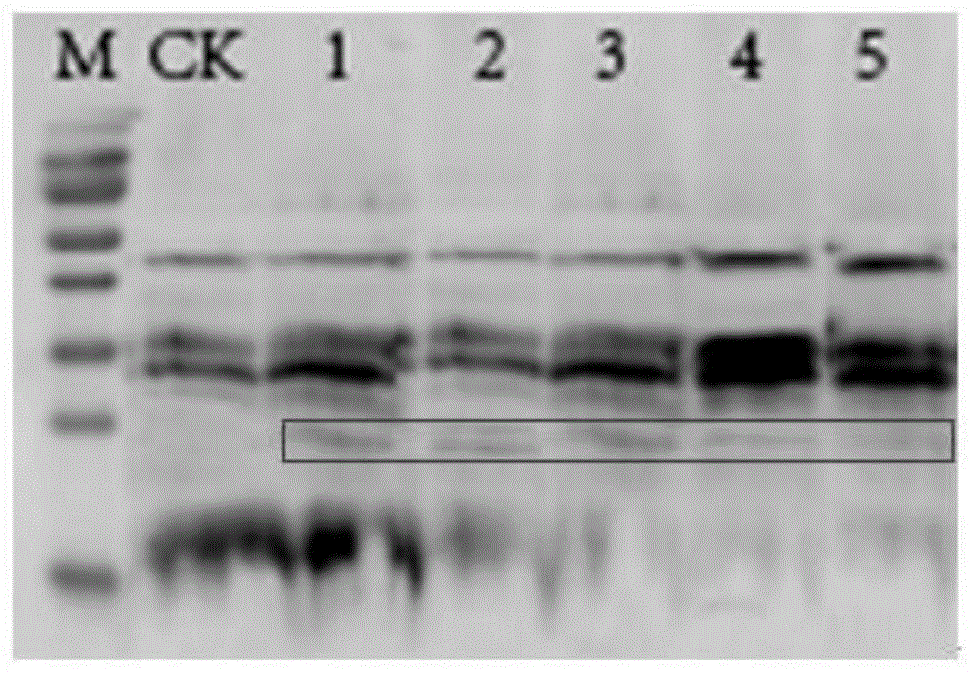
图6转gmtst2.1大豆植株免疫印迹检测,其中ck为野生型;1-5为转gmtst2.1基因植株;
图7t1代转gmtst2.1基因大豆植株株高变化,1-3:转基因植株;ck:野生型植株;
图8转基因植株与野生型植株在干旱胁迫7d的生理指标测定,oe1-oe3代表3个t1代转基因株系,wt代表野生型黑河43;“*”和“**”分别代表在0.05和0.01水平差异显著;
图9自然干旱条件下gmtst2.1基因过表达植株与野生型长势对比。
具体实施方式
提取植物rna和dna纯化回收实验用品由omega公司提供;反转录实验用品由上海捷瑞公司提供。taqdna聚合酶、dnamarker、trizolreagent、t4dna连接酶、pgem-teasyvector克隆试剂盒、限制性内切酶均由thermofisherscientific公司提供。
其余实验试剂以及仪器设备如无特殊说明,均可通过商业化途径购买获得。
所述大豆品种williams82、黑河43均为本领域公知的大豆品种,可通过商业化途径购买。
实施例1.转gmtst2.1基因大豆植株的构建。
1、gmtst2.1基因的克隆
1)总rna提取(trizol法)
①用剪子剪取williams82的嫩叶放入1.5ml的离心管中,迅速放入液氮盒冷冻研磨,向离心管中加入1mltrisol提取液,颠倒混匀,静止5min;
②加入200ul氯仿,颠倒混匀,静置3-5min后4℃12000r/min离心15min;
③抽取上清放至新离心管,加入等体积的异丙醇,均匀振荡2-3min,4℃静止20-30min;
④4℃12000r/min离心10min;
⑤去上清,加入1ml75%乙醇(将无水乙醇用depc水进行稀释),振荡后4℃12000r/min离心10min;
⑥重复第⑤步一次;
⑦去上清,空离2min,用移液器吸除残留上清,置于冰上干燥;
⑧待干燥之后加入20uldepc水溶解及凝胶电泳检验质量。
2)总rna反转录
表1反转录反应体系及程序如下
根据定量结果选出主拷贝基因序列,设计一对包括有起始密码和终止密码的5’端及3’端引物,并且引入合适酶切位点。gmtst2.1基因克隆的引物:
gmtst2.1-fcatgggattacgaaactaactgaaacg
gmtst2.1-rggttaccgaatttatcatgtccttggg
克隆pcr反应体系参考试剂盒说明书。pcr反应条件为:94℃预变性10min,94℃变性30s,58℃复性30s,72℃延伸30s,扩增适当次数;72℃延伸10min,得到该基因全长cds2205bp序列(图1),将目的基因经回收、转化,取阳性克隆进行测序,测序结果与phytozme数据库中目的序列进行比对,结果与参考序列完全一致。置于4℃保存。
2、gmtst2.1基因的载体构建
将带有目的基因的pcr产物回收,参照试剂盒说明书将回收产物与pgem-teasy载体连接过夜,连接体系10μl:1μlpgem-teasyvector,1μlt4dnaligase,1μl10xt4dnaligasebuffer,5μlpcr产物,水。连接产物转化大肠杆菌trans-t1,然后在lb固体培养基上筛选,lb固体培养基含卡纳抗性。选取阳性菌株进行基因测序。将测序正确的菌株进行下步的酶切反应。用spei/saci酶切载体载体pcambia3300,目的菌株质粒及载体37℃酶切2-4h后通过凝胶电泳分离,回收目的片段,与线性化的pcambia3300载体片段进行连接。连接体系参考相关说明书。连接产物转化trans-t1,鉴定阳性菌株测序正确后提取质粒进行双酶切验证获得pgm-gmtst2.1。将pcambia3300质粒和pgm-gmtst2.1质粒分别进行spei和saci双酶切,将目的片段进行胶回收纯化后将两者进行连接、转化,用pcr进行鉴定,选取pcr为阳性的质粒再次用spei和saci进行双酶切鉴定(图2中a),得到的酶切产物为2260bp,表明成功构建pcambia3300-gmtst2.1表达载体。提取重组质粒,转化农杆菌eha105,进行菌液pcr鉴定,选取阳性菌株,结果表明重组质粒pcambia3300-gmtst2.1已成功转入到农杆菌中(图2中b)。所述农杆菌转化时所用的感受态细胞以及转化方法如下:
1)电击农杆菌感受态细胞的制备:
①吸取5μl稀释64000倍eha105菌液涂于lb固体培养基上,在28℃下孵育1-3天(培养基平板带含链霉素和利福平抗生素);
②待平板上出现单菌落后,选取一个克隆加入到20mllb液体培养基中28℃过夜悬浮培养;
③向1000mllb液体培养基中接种9ml上述农杆菌菌液,此次无需加抗生素,28℃,200rpm,培养20h,农杆菌培养浓度至od600nm为0.5-1;
④菌液培养完成后冰浴15-30min;
⑤把冰浴后的菌液转移至灭菌离心管中,4℃下5000rpm离心15min;
⑥尽量将上清液移除,用200ml预冷的灭菌去离子水重悬菌体,4℃下5000rpm离心15min;
⑦尽量将上清液移除,用100ml预冷的灭菌去离子水重悬菌体,4℃下5000rpm离心15min;
⑧尽量将上清液移除,用10ml预冷的10%甘油重悬菌体,4℃下5000rpm离心15min;
⑨尽量把上清液移除,用2-3ml预冷的10%甘油重悬菌体,细胞浓度应在1×1010-3×1010细胞/ml;
⑩将做好的感受态细胞分装入1.5ml离心管中,每管50μl,封口于-80℃下保存,6个月内可安全使用。
2)电击农杆菌转化
①将质粒稀释至浓度为15ng/μl(如果盐浓度过高,细胞会在电转化过程中死亡);
②将2μl上述稀释的质粒加入装有50μl农杆菌的1.5mlep管中并轻轻混匀;
③将混合液转入-20℃预冷20min的电转化杯中,将电转化杯调整至正确方向,放在电转化仪槽中;
④电转化仪电压设置为2v(其他参数为默认设置),按住加压按钮直到哔哔警报响起(大概几秒钟)时间常量应读数应为4.7;
⑤向电转化杯中加入1mllb,并用移液器混匀,吸取1.5ml转入离心管中;
⑥在涂板前将混合液于28℃,200rpm,孵育2-3h,取70μl均匀涂抹于lb固体培养基平板(平板抗生素为农杆菌抗性+质粒抗性);
⑦涂板后平板封口,固体石蜡封口膜周围可做微小孔隙,28℃培养,直到单菌落出现;
⑧挑选单菌落摇菌和pcr验证;
⑨pcr验证成功后存菌。
3、gmtst2.1基因的遗传转化
1)菌液制备
挑取带有目的基因的eha105单菌落接种在带有利福平25mg/l、链霉素50mg/l及卡那霉素50mg/l的3mlyep液体培养基上,28℃200rpm培养过夜,然后将菌液转移到100ml新鲜的上述yep液体培养基中摇至a600=0.6-0.8,置于5000rpm,离心10min后用100mlccm共培养液体培养基重悬菌液并填加24.5ul乙酰丁香酮和200ul6-ba待用。
2)农杆菌介导大豆茎尖遗传转化方法
①种子灭菌
取外表光滑且没有病斑的大豆黑河43成熟种子,装在培养皿中,置于通风厨内的干燥器里,培养皿盖半开,量取96mlnaclo置于100ml三角瓶中,将三角瓶放在平皿中间,一切准备就绪后,将4ml浓盐酸(hcl)加入naclo中,屏住呼吸,快速将干燥器盖盖上,灭菌16-18h后,取出,置于超净台中吹走残留的氯气,备用。
②种子萌发和转化受体制备
超净台下,用镊子将消毒的种子播种于ms固体培养基中,待种子萌发至子叶即将冲破种皮时,利用镊子和手术刀等工具去掉种皮,将两半子叶中的一半切掉,并用手术刀轻轻刮掉子叶和生长点之间的腋芽,并在子叶节处轻轻划3-5道伤口,剩余部分作为外植体用于侵染。
③侵染
将外植体和重悬液放入无菌的组培瓶中密封后,放入抽真空设备中进行侵染,抽真空条件2-3pa,10min。
④共培养
侵染后的外植体用灭菌蒸馏水清洗一次,置于ms培养基中共培养约2-3天,共培养采取暗培养方式,观察复活情况,根据外植体返青的情况确定移栽时间。
⑤转化苗的培养和筛选
移栽后,新芽长出,在第3-4轮3出复叶时期进行整株喷施或单片涂抹ppt(草铵膦)处理,浓度为125mg/l。
4、gmtst2.1转基因大豆的检测
1)转基因植株的pcr(聚合酶链式反应)分析
按照通用方法提取转基因和野生型大豆黑河43叶的dna,用dna做模板,根据基因与载体序列设计的特异性检测引物和通用bar引物进行pcr鉴定,引物序列和反应体系如下:
转gmtst2.1植株鉴定引物:
3300-tst2.1-nos804-f5’-acgcacaatcccactatccttc-3’
3300-tst2.1-nos804-r5’-ccaagaccctcaaccagtaaagc-3’
3300-bar-nos402-f5’-gcggtaccggcaggctgaag-3’
3300-bar-nos402-r5’-ccgcaggaaccgcaggagtg-3’
表2pcr反应体系
反应条件:bar引物反应程序:94℃5min;38个循环:94℃30s,54℃30s,72℃30s;72℃7min,4℃保存。3300-tst2.1-nos804引物反应程序:94℃10min;38个循环:94℃30s,58℃30s,72℃45s;72℃7min,4℃保存。反应后用6μlpcr产物做1%琼脂糖凝胶电泳进行检测。
经pcr检测,获得298株t0代转基因植株,t0代阳性植株经温室扩繁获得306株t1代植株,3300-tst2.1-nos804引物和3300-bar-nos402引物pcr检测出804bp和402bp大小的目的条带的植株有79株(图3中a、图3中b所示为部分植株的检测结果),说明gmtst2.1基因已整合至大豆基因组中,并可以遗传到子代。
2)转基因植株目的基因转录水平分析
①转gmtst2.1基因大豆的荧光定量pcr
a.总rna提取,总rna反转录,把反转录产物稀释调整浓度一致后用作定量pcr模板。
b.实时荧光定量pcr
以转gmtst2.1基因植株叶片组织dna为模板,做实时荧光定量pcr扩增,检测大豆中gmtst2.1基因的表达情况,并用内参基因actin的表达量的平均值作为参考(目的基因和内参基因的每种处理均需设置3个重复)。
actin引物序列系:2xsybrgreenrealtimepcrmastermix8ul;ddh2o10.8ul;上游引物(10umol/l)0.1ul;下游引物(10umol/l)0.1ul;cdna模板1ul。pcr程序包括:预变性95℃15min;95℃10s,60℃20s,72℃20s,40个循环。相对定量δδct方法中ct值为三次试验重复取平均数,相对拷贝数计算公式2-δδct(δδct=ct目的基因—ct内参actin基因)。
本发明用79株t1代pcr筛选为阳性植株的cdna做qrt-pcr检测。结果表明,转基因大豆gmtst2.1表达量普遍高于野生型大豆,以转基因植株gmtst2.1表达量超过野生型植株3倍为阈值再次筛选,最终获得gmtst2.1基因高表达的转基因植株32株,其中转基因株系gmtst2.1基因表达量最高是野生型大豆的17倍如图4所示。
②转gmtst2.1基因大豆的半定量pcr
随机取7株t1代pcr检测阳性植株嫩叶,以转gmtst2.1基因和正常栽培植株的叶片组织的cdna为模板,进行半定量pcr扩增,用1%琼脂糖凝胶电泳检验扩增结果,并用内参基因actin的表达量的平均值作为参考。引物序列、体系及反应程序如上述荧光定量pcr。
3)转基因植株的western-blot检测
①蛋白的提取:取鲜嫩叶片0.3-0.5g用液氮研磨至粉碎。加入400ul蛋白提取液混匀、涡旋、冰浴10min,4℃13000rpm离心15min,吸取上清液于1.5ml的去蛋白酶离心管中,取80ul上述上清液加入20ul蛋白上样buffer,混匀,沸水浴10min,12000rpm离心30s后吸取上清20ul用于点样;
②制备凝胶:将干净的玻璃板正对齐安置在制胶架上,把配好的分离胶灌入玻璃板缝隙至绿线边缘,快速沿上边缘加蒸馏水,静止凝胶10min左右,倒掉蒸馏水加入浓缩胶至溢出,插入梳子,约凝胶15min;
③点样:在电泳槽中加入1×runningbuffer,快速垂直拔下梳子,贴壁垂直点样;
④跑胶:浓缩胶用80v电压,待样品跑入分离胶后,观察marker是否跑开以调整电压,分离胶用120v电压,根据蛋白大小选择电泳时间;
⑤取胶及转膜:小心撬起小玻璃板,切除留在大玻璃板上的浓缩胶,准备滤2块厚滤纸和pvdf膜1块,裁制与胶大小相同,将pvdf膜放置在甲醇里,滤纸和海绵放置在转膜液中湿润;
⑥转膜按照从负极到正极放置顺序依次为:海绵,滤纸,胶,pvdf膜,滤纸,海绵,每一层都需用玻璃棒赶走气泡,选用80v电压转膜,大约1h即可;
⑦封闭:转膜后,将pvdf膜拿出,放置在加有封闭液的平皿,室温下60rpm晃动1h或4℃过夜;
⑧一抗反应:将稀释后的一抗和pvdf膜放入平皿,室温下60rpm摇晃1h;
⑨洗膜:倒去平皿中的一抗,重新加入20mltbst,室温下60rpm摇晃10min洗膜,重复上一步,倒掉tbst加入20mltbs再次洗膜10min;
⑩二抗反应:将稀释后的二抗和pvdf膜放入平皿,室温下60rpm摇晃1h;
由rt-pcr产物凝胶电泳可知,在内参扩增一致的条件下,水对照(ck1)未检测到内源gmtst2.1基因的表达,野生型植株(ck2)和样品1-7均有内源gmtst2.1基因的表达,转基因植株的表达均强于野生型植株(图5),这一结果与相对定量pcr一致,说明转基因植株中gmtst2.1基因成功过量表达。对定量pcr检测为阳性的32株转gmtst2.1基因大豆植株做bar基因的western-blot检测,28株检测到条带(图6为部分检测结果)。说明标记基因bar在转基因植株中成功编码蛋白质产物。
实施例2.gmtst2.1转基因大豆产量及品质性状鉴定
1)收获t1代转gmtst2.1基因大豆植株种子,大豆籽粒烘干后,将其磨成粉末。取适量,经80%乙醇溶液抽提,离心过滤除去不溶性糖类等一些其他成分后,加蒽酮试剂(95%的浓硫酸和蒽酮)进行抽提,因此用蒽酮法测出的糖类是所有可溶性糖类的总量。
配制标准溶液:根据大豆籽粒中可溶性糖的大致含量,把葡萄糖配置成0、10ug/ml、20ug/ml、30ug/ml、40ug/ml、50ug/ml和60ug/ml七种不同浓度的标准液,如表3。
表3葡萄糖标准溶液的配置
硫酸-蒽酮试剂的配制。称取200mg蒽酮,加入100ml95%的浓硫酸试剂中,混合均匀后备用。
大豆籽粒中可溶性糖的提取:将干净的豆子磨成细细的粉末后置于烘箱中烘干2小时。烘干后分别称取0.05g豆粉加入10ml离心管,加入4ml80%乙醇振荡摇匀后放在80℃水浴锅中水浴40min,期间不断搅拌。水浴后待冷却,放于离心机4000转离心10min,收集上清放入新管,再次向沉淀中加4ml80%乙醇振荡摇匀后水浴10min,冷却后放入离心机4000转离心10min,再次收集上清,重复上述步骤一次。将收集的上清均放入25ml的容量瓶中并用80%乙醇定容,混匀。吸取上述乙醇提取液1ml放入新的10ml管中,水浴20min,主要是蒸发乙醇。水浴后加水定容至10ml,玻璃棒搅拌溶液、离心后,取上清2ml至新试管中。在冰水浴中向上述新试管溶液加入硫酸-蒽酮溶液5ml,加完后马上摇匀,沸水浴10min后,流水冷却,分别取已配置好浓度的葡萄糖标准溶液1ml,重复这一步骤,用于绘制标准曲线。
绘制标准曲线和计算可溶性糖含量:取经上述处理后的标准溶液2.5ml置于比色皿中,用于绘制标准曲线。取冷却后的样品溶液2.5ml测定其可溶性糖含量。测定后根据标准曲线算得溶液浓度。测得的标准曲线方程为:计算公式:y=ax+b;a=0.0142,b=0.0055,r2=0.9986,其中x为葡萄糖浓度,y为吸光度。
2)转基因植株后代的农艺性状
调查转gmtst2.1基因的t1代的生育期、株型变化。待植株成熟后对转基因阳性植株进行考种(主要有株高、节数、分支数、荚数、粒数、粒重、植株鲜重及干重)分析其生物学产量与百粒重;利用近红外光谱分析仪检测对转基因与野生型黑河43种子的蛋白质和油分含量。
从表4可以看出,转gmtst2.1基因和野生型黑河43单株的粒数、粒重、荚数和百粒重均比野生型植株高。
表4转基因与野生型大豆粒重、粒数及荚数的差异显著性分析
注:表中数据为26个单株的均值,*和**表示在0.05和0.01水平上显著
从表5和6可以看出,转gmtst2.1基因植株与野生型黑河43籽粒粒型测定及比较结果发现,野生型植株的粒长和粒宽比转基因植株的大,但其差异并不显著。用近红外光谱分析仪检测转gmtst2.1基因和野生型黑河43籽粒的品质,转基因与野生型籽粒蛋白、脂肪含量差异并不显著。可溶性糖含量在野生型大豆籽粒中平均值为0.04g,在转基因大豆籽粒中最高可达0.073g且显著高于野生型,是野生型的1.83倍。实验结果证明gmtst2.1基因的表达可提高大豆籽粒中可溶性糖的含量。
表5转基因与野生型大豆粒型的差异显著性分析
注:表中数据为26个单株的均值
表6转基因与野生型大豆籽粒品质差异显著性分析
注:表中数据为17个单株的均值,*表示在0.05水平上显著
从表7和表8可以看出,通过田间考种数据的调查比较转基因与野生型植株在株高上的变化,发现与野生型相比较,转gmtst2.1基因植株株高升高,且较野生型增加了14%(图7)。分别称量转gmtst2.1基因和野生型黑河43的秸秆(包括荚皮)的重量和烘干3天的秸秆重量,结果表明转基因植株比野生型植株的生物学产量高且鲜重、干重、生物学产量分别增加了17%、42%、87%。综合转基因大豆的粒重结果,说明gmtst2.1基因具有调控产量的作用。
表7转基因与野生型大豆株高的差异显著性分析
注:表中数据为26个单株的均值,*表示在0.05水平上显著
表8转基因与野生型大豆的生物学产量的差异显著性分析
注:表中数据为26个单株的均值,*和**表示在0.05和0.01水平上显著。
实施例3.过表达gmtst2.1基因对大豆抗旱能力提高的研究。
为了比较转gmtst2.1基因与野生型大豆的抗旱性差异,将3个转gmtst2.1基因大豆株系和野生型对照品种黑河43以盆栽方式种植,待植株长到两个三出复叶时期停止浇水,开始干旱处理,取处理7d时叶片,测定叶片相对含水量、叶片持水力、电导率以及叶绿素含量。
叶片相对含水量检测:迅速剪取植物材料,装入自封袋,用分析天平称取鲜重(fw)。将称过鲜重的植株叶片全部浸入水中,1小时后拿出,用吸水纸吸干叶片表面的水分,立即称重;将称重后叶片再一次放入水中,浸泡一段时间后将叶片取出,然后用吸水纸再次吸干叶片表面水分,称鲜重,直到两次称量结果一致,最后称重的数值为饱和鲜重(sfw)。然后在室温条件下自然干燥12h后称重(ew)。待烘箱温度上升至100~105℃时。把植物叶片放入烘箱内杀青10min,然后把烘箱温度调至70~80℃左右,使叶片烘至恒重。将取出的叶片放在实验台上冷却至室温,称干重(dw)。按公式计算叶片相对含水量以及持水力。
相对含水量rw%=(fw-dw)/(sfw-dw)×100%
持水力=(ew-dw)/(sfw-dw)×100%
叶片电导率的测定:选取同等节位叶片1g,用去离子水冲洗干净后放入50ml离心管中,加入10ml去离子水,使叶片完全浸没。放入真空浓缩仪中,抽真空使叶片完全下沉,15-20min后拿出,放在室温下培育1h,用电导仪率(dds-307a)测其电导率,记录为s1。将样品置于沸水浴中加热15min,杀死细胞组织,使细胞质膜完全破坏,室温自然冷却,再平衡10min,测其电导率,记录为s2。以各株系未经胁迫处理的叶片为各自的对照。
l=s1/s2
伤害度/%=(lt-lck)×(1-lck)-1×%
式中:l为相对电导率
lt为处理叶片的相对电导率
lck为对照叶片的相对电导率
叶绿素含量检测:使用的仪器为spad-502plus型叶绿素含量测定仪对大豆叶片的叶绿素进行检测。该仪器通过测量叶片在两波长光学浓度差方式650nm和940nm来确定与叶片当前叶绿素的相对数量。
结果表明,转基因株系在干旱胁迫后的叶绿素含量、叶片相对含水量、叶片持水能力显著高于野生型植株,在叶片伤害度上极显著低于野生型植株,说明转gmtst2.1基因能够提高植株对干旱的抵抗能力。
将转gmtst2.1基因大豆和野生型对照品种黑河43在自然干旱地块,在第一轮三出复叶期开始,自然干旱15d后观察到过表达gmtst2.1植株长势显著优于野生型黑河43(图9)。说明转gmtst2.1基因大豆提高了大豆的抗旱性。
- 还没有人留言评论。精彩留言会获得点赞!