一种糖醇体外肠道微生物评价方法与流程
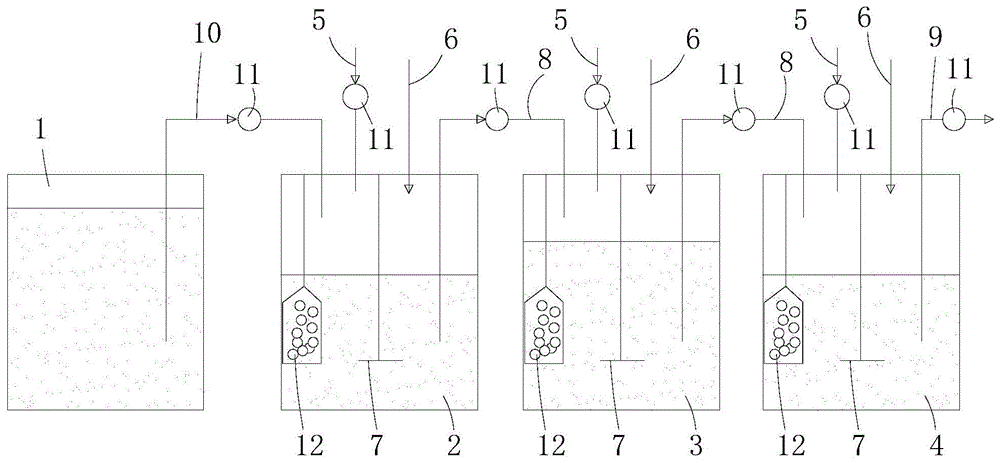
本发明属于糖醇体外肠道微生物评价
技术领域:
,特别一种糖醇体外肠道微生物评价方法。
背景技术:
:现有对微生物利用糖醇的研究方向及技术路线主要涉及的是乳酸菌和双歧杆菌等单菌研究,即糖醇如何影响这些单菌的代谢活动及代谢产物的产生。但是在人体消化及自然界中,糖醇相应的转化和利用是在复杂的微生态中进行。比如糖醇在被肠道中的微生物利用情况原比单菌利用复杂的多,究其原因是因为肠道微生物在利用糖醇等其他益生元存在一种共生滋养的作用。同时相应代谢产生的物质如短链脂肪酸对人体的健康有极大的影响。因此糖醇在复杂微生物体系中利用的研究相对于单菌研究更为重要。现有的动物实验因为其肠道微生物组成与人体的肠道微生物有差异性,因此实验结果不能很好的反应人体的代谢情况和菌群数据。人体实验虽然能够了解人体的代谢情况,但是结果只反应了直肠的信息,并不能获取结肠部分的菌群及其代谢产物的数据,且很难得到动态的数据变化。技术实现要素:本发明所要解决的技术问题在于,提供一种糖醇体外肠道微生物评价方法,利用人体粪便进行体外模拟,因此相较于动物实验,获得的菌群数据更接近人体真实情况。并且此方法能够动态直接的获取结肠中群菌和代谢产物的相关数据从而去了解糖醇对于肠道微生物丰度和种类的影响,进一步去评估糖醇对于肠道微生物的影响,弥补了人体实验的不足。本发明是这样实现的,提供一种糖醇体外肠道微生物评价方法,包括如下步骤:采用体外混菌评价装置,向体外混菌评价装置中通过串联管路依次连通的补料罐、前发酵罐、中间发酵罐和后发酵罐内分别加入预先配制的培养液,将预先提取的粪便微生物菌液和事先制备的粘膜小球分别加入到前发酵罐、中间发酵罐和后发酵罐中,每日通过补料罐和串联管路向前发酵罐、中间发酵罐和后发酵罐补充部分培养液,并从后发酵罐排出等量的废液,直至各个发酵罐内的微生物趋于稳定;再向补料罐中加入要评价的糖醇的溶液,重复补充部分培养液和排出等量的废液的过程连续七天后停止;对每天收集的各个发酵罐中的发酵液和被替换的黏膜小球样品中肠道微生物的组成及分布进行测定,检测样品中短链脂肪酸浓度以及各个发酵罐的发酵气体的成分分布,对获得的检测数据进行分析,找出与要评价的糖醇代谢密切相关的多种主要菌群;对多种主要菌群的菌液进行菌落数评价实验。进一步地,所述糖醇体外肠道微生物评价方法,包括如下步骤:步骤一、准备体外混菌评价装置:设置至少三个发酵罐和一个补料罐,其中发酵罐包括至少一个前发酵罐、至少一个中间发酵罐和至少一个后发酵罐,在每个发酵罐上分别设有输入酸液或碱液的输液管、输入惰性气体的输气管和搅拌装置,前发酵罐、中间发酵罐和后发酵罐依次通过连接管路串联,在后发酵罐上设有输出管路,在补料罐上设有补料管与前发酵罐连通;步骤二、收集粪便微生物菌液:称取新鲜粪便用ph6.8缓冲液进行搅拌溶解,纱布过滤掉固体颗粒,所得滤液即为含粪便微生物的菌液;步骤三、制备粘膜小球:将琼脂加入蒸馏水中加热溶解,再混入黏液素,调节混合液的ph为6.8,灭菌,将混合溶液转移到球形磨具中制备黏膜小球;步骤四、配制培养液:将玉米淀粉、蛋白胨、酵母提取物、胰蛋白胨、黏液素、l-半胱氨酸盐酸盐、3号胆盐、血红素、氯化钠、吐温、氯化钾、磷酸二氢钾、六水氯化镁、六水氯化钙和微量元素储备液的各组分进行混合以配制培养液,其中,微量元素储备液包含七水硫酸镁、七水硫酸亚铁、二水氯化钙、四水氯化锰、七水硫酸钴、五水硫酸铜、七水硫酸锌、六水氯化镍的组分;步骤五、建立体外模拟发酵系统cdmn:(1)将步骤四制备的培养液分别加入到步骤一的补料罐、前发酵罐、中间发酵罐和后发酵罐中并通过输液管调节各个发酵罐的ph值;(2)将步骤二制备的粪便微生物菌液分别接入到各个发酵罐中,向每个发酵罐中加入步骤三制备的黏膜小球,启动每个发酵罐上的搅拌装置对发酵液进行搅拌;(3)接种培养24h之后,每日由补料罐通过补料管向前发酵罐补给部分培养液,并通过中间发酵罐、连接管路和输出管路从后发酵罐排出等量废液,以维持各个发酵罐内培养液体积不变,每日用新的黏膜小球分别替换各个发酵罐中的部分黏膜小球,每日早、中、晚对每个发酵罐通过输气管通入氮气以排尽发酵罐内的空气,直至各个发酵罐内的微生物趋于稳定;(4)向补料罐中加入要评价的糖醇的溶液,重复步骤(3)连续7天后停止发酵,分别采集0~7天各个发酵罐中的发酵液和被替换的黏膜小球,收集各个发酵罐的发酵气体;步骤六、进行体外肠道微生物评价:(5)找出多种主要菌群:测定步骤(4)得到的各发酵液和粘膜小球样品中肠道微生物的组成及分布,检测各样品中短链脂肪酸浓度以及各个发酵罐的发酵气体的成分分布,对获得的检测数据进行分析,找出与要评价的糖醇代谢密切相关的多种主要菌群;和/或,(6)进行单菌菌落数评价实验:各取多种主要菌群中的某一单菌菌液分别接入葡萄糖gam培养基、要评价的糖醇gam培养基、混糖(含有葡萄糖和要评价的糖醇)gam培养基、无糖(或称无碳源)gam培养基中,分别混匀后各取1.8ml样品作为0h初始样品,然后将样品放置于培养箱里培养,每隔2h~4h取一次样,测算并记录样品中菌群的菌落数,直到60h。与现有技术相比,本发明的糖醇体外肠道微生物评价方法具有以下特点:1.通过特有的体外混菌评价装置,利用物理调控(温度、搅拌速度、物料流速等),以及ph(模拟结肠不同部位的环境)和od(使得菌密度达到特定数量)双反馈系统以及利用粘膜小球去模拟人体的黏液层,从而能够模拟更加真实的结肠环境,且微生物的数量种类组成于人体结肠有高度的相似性。2.独有的单双三菌(即包括单菌、双菌和三菌)培养去实现代谢估算模型,通过体外模拟发酵系统cdmn模型获得的数据进行相关性分析和随机数森林方法选择出在糖醇代谢中更为重要的多种菌群进行单双三菌培养,而不是单纯的选择乳酸菌或双歧杆菌进行实验。这样的方法能够获得更真实且有效的数据。而且在双三菌培养中能够探究获得肠道微生物菌群之间利用糖醇共生滋养的数据,弥补了单菌实验的不足,这更有助于实现更真实的代谢估算模型。附图说明图1为本发明的体外混菌评价装置一较佳实施例的平面示意图;图2为本发明的实施例1的肠道微生物相关性分析示意图;图3a为本发明的实施例1的单菌实验中的大肠杆菌在不同碳源下生长曲线示意图;图3b为本发明的实施例1的单菌实验中的青春双歧杆菌在不同碳源下生长曲线示意图;图3c为本发明的实施例1的单菌实验中的脆弱拟杆菌在不同碳源下生长曲线示意图;图3d为本发明的实施例1的单菌实验中的罗伊氏乳杆菌在不同碳源下生长曲线示意图;图3e为本发明的实施例1的单菌实验中的酿酒酵母在不同碳源下生长曲线示意图;图4a为本发明的实施例1的双菌实验中的两种肠道微生物在葡萄糖碳源下共培养生长曲线示意图;图4b为本发明的实施例1的双菌实验中的两种肠道微生物在木糖醇碳源下共培养生长曲线示意图;图5a为本发明的实施例1的三菌实验中的三种肠道微生物在葡萄糖碳源下共培养生长曲线示意图;图5b为本发明的实施例1的三菌实验中的三种肠道微生物在木糖醇碳源下共培养生长曲线示意图。具体实施方式为了使本发明所要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。本发明的糖醇体外肠道微生物评价方法,包括如下步骤:采用体外混菌评价装置,向体外混菌评价装置中通过串联管路依次连通的补料罐、前发酵罐、中间发酵罐和后发酵罐内分别加入预先配制的培养液,将预先提取的粪便微生物菌液和事先制备的粘膜小球分别加入到前发酵罐、中间发酵罐和后发酵罐中,每日通过补料罐和串联管路向前发酵罐、中间发酵罐和后发酵罐补充部分培养液,并从后发酵罐排出等量的废液,直至各个发酵罐内的微生物趋于稳定;再向补料罐中加入要评价的糖醇的溶液,重复补充部分培养液和排出等量的废液的过程连续七天后停止;对每天收集的各个发酵罐中的发酵液和被替换的黏膜小球样品中肠道微生物的组成及分布进行测定,检测样品中短链脂肪酸浓度以及各个发酵罐的发酵气体的成分分布,对获得的检测数据进行分析,找出与要评价的糖醇代谢密切相关的多种主要菌群;对多种主要菌群的菌液进行菌落数评价实验。具体地,所述糖醇体外肠道微生物评价方法,包括如下步骤:步骤一、准备体外混菌评价装置:请参照图1所示,评价装置中溶液和气体等物料的流动方向如图中箭头所示,该评价装置包括至少三个发酵罐和一个补料罐1,其中发酵罐包括至少一个前发酵罐2、至少一个中间发酵罐3和至少一个后发酵罐4。在每个发酵罐和补料罐1中分别盛有培养液,补料罐1中还含有要评价的糖醇的溶液。在每个发酵罐上分别设有便于稳定培养液ph值的输入酸液或碱液的输液管5,在每个发酵罐上还分别设置有输入惰性气体的输气管6和搅拌罐内培养液的搅拌装置7。前发酵罐2、中间发酵罐3和后发酵罐4依次通过连接管路8串联,前发酵罐2内的发酵液通过连接管路8流入中间发酵罐3,中间发酵罐3内的发酵液通过另一连接管路8流入后发酵罐4中。在后发酵罐4上设有发酵后废液的输出管路9。在补料罐1上设有补料管10与前发酵罐2连通给前发酵罐2补充培养液。具体地,在输液管5、输出管路9、连接管路8和补料管10上分别设置了蠕动泵11。在补料罐1和每个发酵罐上设有调节培养液温度的调温装置(图中未示出)。为了实验需要,个别发酵罐处于厌氧环境中。所述要评价的糖醇包括木糖醇或山梨糖醇或l-阿拉伯糖。步骤二、收集粪便微生物菌液:称取新鲜粪便用ph6.8缓冲液进行搅拌溶解,纱布过滤掉固体颗粒,所得滤液即为含粪便微生物的菌液,厌氧环境下保存备用。步骤三、制备粘膜小球12:将琼脂加入蒸馏水中加热溶解,再混入黏液素,调节混合液的ph为6.8,灭菌,将混合溶液转移到球形磨具中制备黏膜小球12。步骤四、配制培养液:将玉米淀粉、蛋白胨、酵母提取物、胰蛋白胨、黏液素、l-半胱氨酸盐酸盐、3号胆盐、血红素、氯化钠、吐温、氯化钾、磷酸二氢钾、六水氯化镁、六水氯化钙和微量元素储备液的各组分进行混合以配制培养液,其中,微量元素储备液包含七水硫酸镁、七水硫酸亚铁、二水氯化钙、四水氯化锰、七水硫酸钴、五水硫酸铜、七水硫酸锌、六水氯化镍的组分。步骤五、建立体外模拟发酵系统cdmn:(1)将步骤四制备的培养液分别加入到步骤一的补料罐1、前发酵罐2、中间发酵罐3和后发酵罐4中并通过输液管5调节各个发酵罐的ph值。(2)将步骤二制备的粪便微生物菌液分别接入到各个发酵罐中,向每个发酵罐中加入步骤三制备的黏膜小球12,启动每个发酵罐上的搅拌装置7对发酵液进行搅拌。(3)接种培养24h之后,为维持发酵罐内微生物的正常生长,每日由补料罐1通过补料管10向前发酵罐2补给部分培养液,并通过中间发酵罐3、连接管路8和输出管路9从后发酵罐4排出等量废液,以维持各个发酵罐内培养液体积不变,每日用新的黏膜小球12分别替换各个发酵罐中的部分黏膜小球,每日早、中、晚对每个发酵罐通过输气管通入氮气以排尽发酵罐内的空气,直至各个发酵罐内的微生物趋于稳定。(4)向补料罐1中加入要评价的糖醇的溶液,重复步骤(3)连续7天后停止发酵,分别采集0~7天各个发酵罐中的发酵液和被替换的黏膜小球12,低温保存样品备用,收集各个发酵罐的发酵气体。步骤六、进行体外肠道微生物评价:(5)找出多种主要菌群:测定步骤(4)得到的各发酵液和粘膜小球12样品中肠道微生物的组成及分布,检测各样品中短链脂肪酸浓度以及各个发酵罐的发酵气体的成分分布,对获得的检测数据进行分析,找出与要评价的糖醇代谢密切相关的多种主要菌群。和/或,(6)进行单菌菌落数评价实验:各取多种主要菌群中的某一单菌菌液分别接入葡萄糖gam培养基、要评价的糖醇gam培养基、混糖(含有葡萄糖和要评价的糖醇)gam培养基、无糖(或称无碳源)gam培养基中,分别混匀后各取1.8ml样品作为0h初始样品,然后将样品放置于培养箱里培养,每隔2h~4h取一次样,测算并记录样品中菌群的菌落数,直到60h。和/或,(7)对多种主要菌群中的任意两种分别采用与步骤(6)相同的评价实验方法进行双菌菌落数评价实验。和/或,(8)对多种主要菌群中的任意三种分别采用与步骤(6)相同的评价实验方法进行三菌菌落数评价实验。和/或,(9)对多种主要菌群中的任意三种以上分别采用与步骤(6)相同的评价实验方法进行多菌菌落数评价实验。下面结合具体实施例来进一步说明本发明的糖醇体外肠道微生物评价方法。实施例1本发明的第一种糖醇体外肠道微生物评价方法的实施例,包括如下步骤:步骤1、准备体外混菌评价装置。体外混菌评价装置的结构如前所述,不再赘述。步骤2、称取10g新鲜粪便用80ml、ph6.8的pbs缓冲液充分搅拌悬浮后,用无菌三层纱布过滤掉固体颗粒,所得滤液即为含粪便微生物的菌液,厌氧环境下保存备用。其中,新鲜粪便采用如下方法收集,收集无炎症性肠炎、肠易激综合征等肠道疾病,且半年内没有使用过抗生素的三位健康青年(20~25岁)粪便作为肠道微生物来源。捐献者使用一次性无菌采样器收集好粪便后,立即转入在厌氧操作箱,以防厌氧菌接触空气死亡。混匀三位捐献者粪便,以消除个体带来的差异。根据实验目的的不同,可以收集特定人群的粪便样品进行体外实验,达到评价糖醇对特定人群的作用。步骤3、称取2g琼脂于100ml蒸馏水中加热溶解,待琼脂溶液澄清透明后,冷却至60±5℃,称取0.5g黏液素趁热溶解,调节ph为6.8,紫外灭菌30min后,将混合溶液转移到球形磨具中制备直径为7mm~8mm黏膜小球。步骤4、将玉米淀粉8.0g/l、蛋白胨3.0g/l、酵母提取物4.5g/l、胰蛋白胨3.0g/l、黏液素0.5g/l、l-半胱氨酸盐酸盐0.8g/l、3号胆盐0.4g/l、血红素0.05g/l、氯化钠4.5g/l、吐温801.0ml、氯化钾2.5g/l、磷酸二氢钾0.4g/l、六水氯化镁4.5g/l、六水氯化钙0.2g/l、微量元素储备液2ml的组分进行混合以配制培养液;其中,微量元素储备液包含七水硫酸镁3.0g/l、七水硫酸亚铁0.1g/l、二水氯化钙0.1g/l、四水氯化锰0.32g/l、七水硫酸钴0.18g/l、五水硫酸铜0.01g/l、七水硫酸锌0.18g/l、六水氯化镍0.092g/l的组分。培养液的成分可根据实验目的以及特定人群的饮食习惯进行修改。步骤5、建立体外模拟发酵系统cdmn:(11)将步骤4制备的培养液分别加入到步骤1的补料罐1、前发酵罐2、中间发酵罐3和后发酵罐4中并通过输液管5调节各个发酵罐的ph值,其中,前发酵罐2的培养液体积300ml,ph5.8,中间发酵罐3的培养液体积400ml,ph56.2,后发酵罐4的培养液体积300ml,ph6.8。在本实施例中,前发酵罐2相当于人体的升结肠段,中间发酵罐3相当于人体的横结肠段,后发酵罐4相当于人体的降结肠段。ph自动控制系统通过输液管5补充0.5mol/l的naoh溶液或0.5mol/l的hcl来调节发酵液的ph值。稳定前发酵罐2、中间发酵罐3和后发酵罐4的温度恒定在37℃。(12)将步骤2制备的粪便微生物菌液以10%的接种量分别接入到各个发酵罐中,向每个发酵罐中加入步骤3制备的15颗黏膜小球12,启动每个发酵罐上的搅拌装置7对发酵液进行搅拌,设定前发酵罐2上搅拌装置7的转速为120rpm,中间发酵罐3上搅拌装置7的转速为150rpm,后发酵罐4上搅拌装置7的转速为110rpm。前发酵罐2、中间发酵罐3和后发酵罐4的设定参数如下表所示。参数项目前发酵罐(升结肠)中间发酵罐(横结肠)后发酵罐(降结肠)培养液体积(ml)300400300温度(℃)373737转速(rpm)120150110培养液ph5.86.26.8(13)接种培养24h之后,为维持发酵罐内微生物的正常生长,每日由补料罐1通过补料管5向前发酵罐2补给培养液,并通过中间发酵罐3、连接管路8和输出管路9从后发酵罐4排出等体积废液300ml,以维持各个发酵罐内培养液体积不变,每日用3颗新的黏膜小球12分别替换各个发酵罐中等数量的黏膜小球12,以模拟人体黏膜的再生。为控制发酵严格的厌氧环境,每日早、中、晚对每个发酵罐通过输气管6通入氮气以排尽发酵罐内的空气。(14)向补料罐1中加入要评价的3%的木糖醇溶液,重复步骤(13)连续7天后停止发酵,分别采集0~7天各个发酵罐中的发酵液和被替换的3颗黏膜小球12,低温保存样品备用,收集各个发酵罐的发酵气体。步骤6、进行体外肠道微生物评价:(15)测定步骤(4)得到的各发酵液及3颗被替换出来的粘膜小球12样品中肠道微生物的组成及分布,检测各样品中短链脂肪酸浓度以及各个发酵罐的发酵气体的成分分布;采用相关性分析和随机数森林方法对获得的检测数据进行分析,找出与要评价的糖醇代谢密切相关的多种主要菌群。其中,发酵气体利用电子鼻进行测定,短链脂肪酸利用hplc测定,细菌用16srrna测序分析,真菌用its测定。经过对测试数据进行对比分析得出如下结论:肠腔中升结肠和横结肠的菌群结构最不稳定,各个属的菌的相对丰度变化较大。木糖醇减少升结肠的普氏杆菌属(prevotella9)、埃希氏菌属(escherichia)相对丰度(p<0.05),大幅增加了巨单胞菌属(megamonas)相对丰度(p<0.05)。木糖醇减少了横结肠的拟杆菌属(bacteroides)、埃希氏菌属(escherichia)细菌,增加了巨单胞菌属(megamonas)、对拟杆菌属(parabacteroides)细菌(p<0.05)。降结肠的菌群结构则相对最为稳定,木糖醇减少了降结肠的拟杆菌属(bacteroides)、埃希氏菌属(escherichia)、肠球菌属(enterococcus)细菌(p<0.05),增加了巨单胞菌属(megamonas)、柠檬杆菌属(citrobacter)、普氏杆菌属(prevotella9)、考拉杆菌属(cloacibacillus)、对拟杆菌(parabacteroides)细菌(p<0.05)。横结肠和降结肠黏膜上微生物最不稳定,说明木糖醇对横结肠和降结肠影响最大。木糖醇增加了升结肠黏膜上的双歧杆菌属(bifidobacterium)、anaerofustis、enterococcus、sutterella、parabacteroides、bacteroidaless24-7group_norank、柠檬酸杆菌属(citrobacter),减少了埃希氏菌属(escherichia-shigella)。在横结肠中,木糖醇增加了横结肠毛螺菌科(lachnospiraceae)、anaerofustis、lachnoclostridium、bacteroidaless24-7group_norank,减少了双歧杆菌属(bifidobacterium)、埃希氏菌属(escherichia-shigella)。在降结肠中,木糖醇增加了降结肠的双歧杆菌属(bifidobacterium)、毛螺菌科(lachnospiraceae)、anaerofustis、lachnoclostridium细菌,减少了拟杆菌属(bacteroides)、埃希氏菌属(escherichia-shigella)、acinetobacter、sutterella、cloacibacillus、对拟杆菌属(parabacteroides)、citrobacter细菌;在三段结肠中,乳杆菌(lactobacillus)的变化均没有显著性差异。总的来说,木糖醇在各个肠段增加了毛螺菌科(lachnospiraceae),减少了埃希氏菌属(escherichia-shigella)细菌。对上述肠道微生物进行相关性分析,得到如图2的肠道微生物spearman相关性分析图,因此,得到在木糖醇消化中重要的细菌菌属是青春双歧杆菌、罗伊氏乳杆菌、脆弱拟杆菌、酿酒酵母和大肠杆菌。选择这五种菌群先进行下面的单菌实验。(16)各取100μl驯化并稀释后的多种主要菌群——青春双歧杆菌、罗伊氏乳杆菌、脆弱拟杆菌、酿酒酵母和大肠杆菌中的某一单菌菌液分别接入100ml的葡萄糖gam培养基、100ml的要评价的木糖醇gam培养基、100ml的混糖(含有葡萄糖和要评价的糖醇)gam培养基、100ml的无糖(或称无碳源)gam培养基中,分别混匀后各取1.8ml样品作为0h初始样品,然后将样品放置于37℃培养箱里培养,每隔2h~4h取一次样,稀释至合适浓度涂平板测算并记录样品中菌群的菌落数,直到60h。分别得到如图3a~图3e所示的单菌实验的五种肠道微生物在不同碳源下生长曲线示意图。由图3a可知大肠杆菌能够利用木糖醇,因此在混糖的情况下没有出现快速衰退,一直维持着生物量的平衡。由图3b可知青春双歧杆菌能利用木糖醇和葡萄糖。由图3c可知脆弱拟杆菌在以木糖醇为碳源的环境里可以生长,但生长情况还没有葡萄糖碳源、混糖碳源和无碳源的生长环境好。由图3d可知罗伊氏乳杆菌在木糖醇为碳源的条件下无法生长,对其他碳源的利用也受到限制。由图3e可知酿酒酵母在木糖醇环境下可以微弱地生长,在葡萄糖碳源环境下可以生长,在无碳源环境下无法生长。选择其中的大肠杆菌和罗伊氏乳杆菌在木糖醇和葡萄糖中共培养进行双菌菌落数评价实验。(17)对多种主要菌群中的任意两种分别采用与步骤(16)相同的评价方法进行双菌菌落数评价实验。具体实验方法是:取100μl驯化并稀释好的大肠杆菌菌液、罗伊氏乳杆菌菌液,分别接入100ml的葡萄糖gam培养基、100ml的木糖醇gam培养基,混匀后各取1.8ml样品作为0h初始样品,然后都放置于37℃培养箱里厌氧培养每隔2h~4h取一次样,稀释至合适浓度涂平板测菌落数,直到60h。稀释后的大肠杆菌、罗伊氏乳杆菌涂布于麦康凯培养基(桃红色菌落)、mc培养基(粉红色菌落,有溶钙环)中计算菌落数。分别得到如图4a和图4b所示的双菌实验的两种肠道微生物在不同碳源下共培养生长曲线示意图。由图4a可知,大肠杆菌在葡萄糖为碳源的培养环境下,罗伊氏乳杆菌抑制大肠杆菌的生长。由图4b可知,在以木糖醇为碳源的培养环境下,本不能利用木糖醇的罗伊氏乳杆菌,在大肠杆菌存在的情况下能够生长,绝对数量也比大肠杆菌高。说明罗伊氏乳杆菌的对木糖醇的利用需要大肠杆菌的支持,同时不会过多产酸抑制大肠杆菌。在上述双菌实验的基础上加入脆弱拟杆菌进行下面三菌实验。(18)对多种主要菌群中的任意三种分别采用与步骤(16)相同的评价方法进行三菌菌落数评价实验。具体实验方法是:取100μl驯化并稀释好的大肠杆菌菌液、罗伊氏乳杆菌菌液和脆弱拟杆菌菌液,分别接入100ml的葡萄糖gam培养基、100ml的木糖醇gam培养基,混匀后各取1.8ml样品作为0h初始样品,然后都放置于37℃培养箱里厌氧培养每隔2h~4h取一次样,稀释至合适浓度涂平板测菌落数和ph,直到60h。稀释后的大肠杆菌、罗伊氏乳杆菌、脆弱拟杆菌涂布于麦康凯培养基(桃红色菌落)、mc培养基(粉红色菌落,有溶钙环)、莫匹星罗锂盐半胱氨酸盐酸盐培养基(圆形凸起,边缘整齐,无色不透明)中计算菌落数。分别得到如图5a和图5b所示的三菌实验的三种肠道微生物在不同碳源下共培养生长曲线示意图。由图5可知,三菌结果与双菌结果相似,由图5a可知,在以葡萄糖为碳源的生长环境下,三菌共培养中的罗伊氏乳杆菌可以产酸抑制大肠杆菌的生长,而对脆弱拟杆菌没有影响。由图5b可知,在木糖醇为碳源的情况下,大肠杆菌可以生长,但生长曲线一直位于乳杆菌和拟杆菌之下。说明在三菌情况下,乳杆菌和拟杆菌是优势菌,而木糖醇对此结构没有影响。(19)对多种主要菌群中的任意三种以上分别采用与步骤(16)相同的评价方法进行多菌菌落数评价实验。与前实施方法相似,不再赘述。本发明的糖醇体外肠道微生物评价方法不仅可以用于糖醇评价,还可以用于多糖或者其他益生元的体外肠道微生物评价。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1