改善肠道菌群结构的方法及应用与流程
技术领域
本发明涉及一种改善肠道菌群结构的方法,及其在制备药物、营养品、保健品、食品、饮料等过程中的应用。
背景技术:
人体内共生着大量的微生物,尤其是肠道微生物是人体最重要的“内生环境因素”,拥有大于1000种的细菌种类,其细胞数目是人体自身细胞的10倍左右,基因数目是人体自身基因组的150倍左右。这些微生物的基因组总和被称作“微生物组”或者“人体元基因组”,也被誉为人体的第二个基因组。最新的人体观认为人体是由宿主细胞和共生微生物细胞,尤其是共生肠道菌群,共同构成的“超级生物体”,人的健康状况发生变化,体内的共生微生物的组成就会发生变化;体内共生微生物的组成的变化也会导致人体的健康状况的改变。因此,人的基因组与人体内的微生物基因组共同决定人体的免疫、营养和代谢,乃至疾病和健康等过程。然而,到目前为止肠道菌群参与疾病发生发展的机理还不是很清楚,具体地说就是什么样的细菌对宿主的健康状况呈正相关,什么样的细菌对宿主的健康状况呈负相关还不是很清楚。
技术实现要素:
本发明的目的是,提供一种改善肠道菌群结构的新方法。采用基于高通量测序技术以及多变量统计学方法找出了与宿主代谢密切相关的肠道细菌类群。建立了改善肠道菌群结构的新方法,包括可以选择性地富集一部分细菌,如短链脂肪酸产生菌等,同时可以抑制一部分细菌,如可以产生内毒素的细菌等,从而实现对包括肥胖、胰岛素抵抗等在内的代谢综合征的预防或者治疗。本发明还提供一种筛选具有类似作用的药物、化合物的新方法,以及一种改善肠道菌群结构的组合物。
为了达到上述目的,本发明采用了以下技术方案:
一种改善肠道菌群结构的方法是,通过口服或者肠道给药给予一种制剂后,选择性地增加肠道中一些细菌的含量,同时抑制肠道中另外一些细菌的含量;被增加的肠道细菌包括短链脂肪酸产生菌,被抑制的肠道细菌包括可以产生内毒素的细菌。
所述制剂为天然药物或者其提取物;或者来源于小檗属(Berberis)、黄连属(Coptis)、黄芩属(Scutellarias)、黄檗属(Phellodendron)、苦瓜属(Momordica)、冬青属(Ilex)、苦参属(Sophora)、龙胆属(Gentiana)、知母属(Anemarrhena)、栀子属(Gardenia)、大黄属(Rheum)或蒲公英属(Taraxacum)的植物或者其提取物;或者来源于小檗科(Berberidaceae)、毛莨科(Ranunculaceae)、唇形科(Lamiaceae)、芸香科(Rutaceae)、葫芦科(Cucurbitaceae)、冬青科(Aquifoliaceae)、豆科(Leguminosae)、龙胆科(Gentianaceae)、百合科(Agavaceae)、茜草科Rubiaceae、蓼科(Polygonaceae)、菊科(Asteraceae)、防己科(Menispermaceae)或葫芦科(Cucurbitaceae)的植物或者其提取物。比如,来源于小檗(Berberis vulgaris)、黄连(Coptis chinensis)、黄芩(Scutellaria baicalensis)、黄柏(Phellodendri Chinensis)、苦瓜(Momordica charantia)、苦丁茶(Ilex kudingcha)、苦参(Sophora flavescens)、龙胆草(Gentiana scabra)、知母(Anemarrhena asphodeloides)、栀子(Gardenia jasminoides)、大黄(Rheum palmatum)或蒲公英(Herba Taraxaci)的天然药物或者其提取物,包括小檗碱、小檗碱衍生物或者其它异喹啉生物碱。
肠道中产短链脂肪酸的细菌大多为有益菌,其可以直接或者通过增加肠道中短链脂肪酸的含量间接地起到抗炎、保护肠屏障功能、调节人体代谢与免疫等的作用,尤其是在预防或治疗肥胖、胰岛素抵抗、糖尿病等代谢性疾病的过程中具有重要的作用。
根据所述的改善肠道菌群结构的方法,被增加的肠道细菌包括Alistipes、Allobaculum、拟杆菌属(Bacteroides)、Barnesiella、Blautia、Butyricicoccus、Butyricimonas、Dorea、螺杆菌属(Helicobacter)、Hespellia、霍尔德曼氏菌属(Holdemania)、劳森氏菌属(Lawsonia)、颤杆菌克属(Oscillibacter)、Parabacteroides、Phascolarctobacterium、普氏菌属(Prevotella)或Sedimentibacter;或者拟杆菌科(Bacteroidaceae)、Coriobacteriaceae、脱硫弧菌科(Desulfovibrionaceae)、丹毒丝菌科(Erysipelotrichaceae)、黄杆菌科(Flavobacteriaceae)、螺杆菌科(Helicobacteraceae)、Incertae Sedis XI、Incertae Sedis XIV、毛螺旋菌科(Lachnospiraceae)、紫单胞菌科(Porphyromonadaceae)、普雷沃氏菌科(Prevotellaceae)、理研菌科(Rikenellaceae)、瘤胃球菌科(Ruminococcaceae)或韦荣氏球菌科(Veillonellaceae);或者弯曲菌目(Campylobacterales)、脱硫弧菌目(Desulfovibrionales)、拟杆菌目(Bacteroidales)、Coriobacteriales、黄杆菌目(Flavobacteriales)、梭菌目(Clostridiales)或丹毒丝菌目(Erysipelotrichales);或者ε-变形菌纲(Epsilonproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、拟杆菌纲(Bacteroidia)、Coriobacteridae、黄杆菌纲(Flavobacteria)、梭菌纲(Clostridia)或丹毒丝菌纲(Erysipelotrichi);或者变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)或厚壁菌门(Firmicutes)的细菌。
根据所述的改善肠道菌群结构的方法,短链脂肪酸产生菌包括Blautia、Allobaculum、普氏菌属(Prevotella)、拟杆菌属(Bacterioides)或Butyricimonas。
根据所述的改善肠道菌群结构的方法,所述被增加的肠道细菌的16SrRNA基因V3区序列与序列表中序列1-93中任意一个的相似性至少为95%或者80%。
肠道中产内毒素的细菌大多为有害菌,其可以直接或者通过增加肠道中内毒素的含量引起炎症、损害肠屏障功能、引起人体代谢与免疫失调等的作用,从而诱导肥胖、胰岛素抵抗、糖尿病等代谢性疾病。
根据所述的改善肠道菌群结构的方法,被抑制的肠道细菌包括Alistipes、厌氧原体属(Anaeroplasma)、Barnesiella、双歧杆菌属(Bifidobacterium)、Butyricimonas、丁酸弧菌属(Butyrivibrio)、粪球菌属(Coprococcus)、Fastidiosipila、螺杆菌属(Helicobacter)、Hespellia、Marvinbryantia、Oribacterium、颤杆菌克属(Oscillibacter)、普氏菌属(Prevotella)、罗斯氏菌属(Roseburia)、瘤胃球菌属(Ruminococcus)或TM7_genera_incertae_sedis;或者螺杆菌科(Helicobacteraceae)、毛螺旋菌科(Lachnospiraceae)、紫单胞菌科(Porphyromonadaceae)、普雷沃氏菌科(Prevotellaceae)、理研菌科(Rikenellaceae)、瘤胃球菌科(Ruminococcaceae)、厌氧原体科(Anaeroplasmataceae)或双歧杆菌科(Bifidobacteriaceae);或者弯曲菌目(Campylobacterales)、拟杆菌目(Bacteroidales)、梭菌目(Clostridiales)、厌氧原体目(Anaeroplasmatales)或双歧杆菌目(Bifidobacteriales);或者ε-变形菌纲(Epsilonproteobacteria)、α-变形菌纲(Alphaaproteobacteria)、拟杆菌纲(Bacteroidia)、梭菌纲(Clostridia)、放线菌纲(Actinobacteridae)或柔膜菌纲(Mollicutes);或者变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)或柔膜菌门(Tenericutes)的细菌。
根据所述的改善肠道菌群结构的方法,可以产生内毒素的细菌包括变形菌门(Proteobacteria)的细菌。
根据所述的改善肠道菌群结构的方法,被抑制的肠道细菌的16SrRNA基因V3区序列与序列表中序列94-268中任意一个的相似性至少为95%或者80%。
实行所述的改善肠道菌群结构的方法,所述制剂能够口服或者通过肠道给药。所述制剂是栓剂、片剂、丸剂、颗粒剂、膜剂、微囊剂、滴丸剂、气雾剂、酒剂、糖浆剂或口服液等。所述制剂可以降低血清脂多糖结合蛋白(LBP)、单核细胞趋化蛋白-1(MCP-1)或瘦素(Leptin)的含量;并增加脂联素(adiponectin)的分泌。所述制剂可以增加肠道中短链脂肪酸的含量。所述制剂量相当于50mg/kg体重至400mg/kg体重的制剂。
以小檗碱为例,采用新一代测序技术——454焦磷酸测序技术对菌群结构进行分析,采用气相色谱的方法对肠道中短链脂肪酸进行测定。结果表明口服小檗碱可以显著地改变肠道菌群的结构,包括使得一些可以产生短链脂肪酸的细菌得到富集,同时也可以抑制或清除另外一些细菌,包括可以产生内毒素的细菌等。同时口服小檗碱还可以明显增加肠道中短链脂肪酸的含量,尤其是对代谢综合征个体肠道短链脂肪酸含量的作用更加显著。进一步的观察表明,小檗碱对肠道菌群结构和功能的这种调节可以明显改善胰岛素敏感性,降低炎症反应,并且对体重具有有效的控制作用。尤其是可以明显地预防饮食诱导的肥胖、慢性炎症和胰岛素抵抗的发生。
一种用于上述改善肠道菌群结构的方法的药物、化合物或食品的筛选方法是,采用可以选择性地增加肠道中一些细菌的含量,同时可以抑制肠道中另外一些细菌的含量的制剂作为对照,比较受试药物、化合物或食品对肠道菌群结构的调节作用,如果受试药物、化合物或食品对菌群结构的调节作用与对照制剂具有相似的作用,即表明受试药物、化合物或食品具有改善肠道菌群结构的作用;被增加的肠道细菌包括短链脂肪酸产生菌,被抑制的肠道细菌包括可以产生内毒素的细菌。受试药物、化合物或食品可以是单化合物或组合物,也可以为一种食物、一种食物添加成分、保健品或饮料。
根据所述的筛选方法,受试药物、化合物或食品对菌群的调节作用与对照制剂的相似性大于95%、90%、85%、80%、75%或70%时即可以表明受试药物、化合物或食品可能具有改善肠道菌群结构的作用。
根据所述的筛选方法,对照制剂为天然药物或者其提取物;或者来源于小檗属(Berberis)、黄连属(Coptis)、黄芩属(Scutellarias)、黄檗属(Phellodendron)、苦瓜属(Momordica)、冬青属(Ilex)、苦参属(Sophora)、龙胆属(Gentiana)、知母属(Anemarrhena)、栀子属(Gardenia)、大黄属(Rheum)或蒲公英属(Taraxacum)的植物或者其提取物;或者来源于小檗科(Berberidaceae)、毛莨科(Ranunculaceae)、唇形科(Lamiaceae)、芸香科(Rutaceae)、葫芦科(Cucurbitaceae)、冬青科(Aquifoliaceae)、豆科(Leguminosae)、龙胆科(Gentianaceae)、百合科(Agavaceae)、茜草科Rubiaceae、蓼科(Polygonaceae)、菊科(Asteraceae)、防己科(Menispermaceae)或葫芦科(Cucurbitaceae)的植物或者其提取物。比如,来源于小檗(Berberis vulgaris)、黄连(Coptis chinensis)、黄芩(Scutellaria baicalensis)、黄柏(Phellodendri Chinensis)、苦瓜(Momordica charantia)、苦丁茶(Ilex kudingcha)、苦参(Sophora flavescens)、龙胆草(Gentiana scabra)、知母(Anemarrhena asphodeloides)、栀子(Gardenia jasminoides)、大黄(Rheum palmatum)或蒲公英(Herba Taraxaci)的天然药物或者其提取物,包括小檗碱、小檗碱衍生物或者其它异喹啉生物碱。
根据所述的筛选方法,被增加的肠道细菌包括Alistipes、Allobaculum、拟杆菌属(Bacteroides)、Barnesiella、Blautia、Butyricicoccus、Butyricimonas、Dorea、螺杆菌属(Helicobacter)、Hespellia、霍尔德曼氏菌属(Holdemania)、劳森氏菌属(Lawsonia)、颤杆菌克属(Oscillibacter)、Parabacteroides、Phascolarctobacterium、普氏菌属(Prevotella)或Sedimentibacter的细菌;短链脂肪酸产生菌包括Blautia、Allobaculum、普氏菌属(Prevotella)、拟杆菌属(Bacterioides)或Butyricimonas。
根据所述的筛选方法,所述被增加的肠道细菌的16S rRNA基因V3区序列与序列表中序列1-93中任意一个的相似性至少为95%或者80%。
根据所述的筛选方法,被抑制的肠道细菌包括Alistipes、厌氧原体属(Anaeroplasma)、Barnesiella、双歧杆菌属(Bifidobacterium)、Butyricimonas、丁酸弧菌属(Butyrivibrio)、粪球菌属(Coprococcus)、Fastidiosipila、螺杆菌属(Helicobacter)、Hespellia、Marvinbryantia、Oribacterium、颤杆菌克属(Oscillibacter)、普氏菌属(Prevotella)、罗斯氏菌属(Roseburia)、瘤胃球菌属(Ruminococcus)或TM7_genera_incertae_sedis的细菌;可以产生内毒素的细菌包括变形菌门(Proteobacteria)的细菌。
根据所述的筛选方法,被抑制的肠道细菌的16S rRNA基因V3区序列与序列表中序列94-268中任意一个的相似性至少为95%或者80%。
根据所述的筛选方法,对照制剂可以降低血清脂多糖结合蛋白(LBP)、单核细胞趋化蛋白-1(MCP-1)或瘦素(Leptin)的含量;可以增加脂联素(adiponectin)的分泌;可以增加肠道中短链脂肪酸的含量。
一种用于改善肠道菌群结构的组合物,每日摄入相当于50mg/kg体重至400mg/kg体重剂量的该组合物至少两周后可以选择性地增加肠道中一些细菌的含量,同时可以抑制肠道中另外一些细菌的含量;被增加的细菌包括短链脂肪酸产生菌,被抑制的细菌包括可以产生内毒素的细菌。
所述组合物包含一种天然药物或者其提取物;或者包含来源于小檗属(Berberis)、黄连属(Coptis)、黄芩属(Scutellarias)、黄檗属(Phellodendron)、苦瓜属(Momordica)、冬青属(Ilex)、苦参属(Sophora)、龙胆属(Gentiana)、知母属(Anemarrhena)、栀子属(Gardenia)、大黄属(Rheum)或蒲公英属(Taraxacum)的植物或者其提取物;或者包含来源于小檗科(Berberidaceae)、毛莨科(Ranunculaceae)、唇形科(Lamiaceae)、芸香科(Rutaceae)、葫芦科(Cucurbitaceae)、冬青科(Aquifoliaceae)、豆科(Leguminosae)、龙胆科(Gentianaceae)、百合科(Agavaceae)、茜草科Rubiaceae、蓼科(Polygonaceae)、菊科(Asteraceae)、防己科(Menispermaceae)或葫芦科(Cucurbitaceae)的植物或者其提取物。比如,来源于小檗(Berberis vulgaris)、黄连(Coptis chinensis)、黄芩(Scutellaria baicalensis)、黄柏(Phellodendri Chinensis)、苦瓜(Momordica charantia)、苦丁茶(Ilex kudingcha)、苦参(Sophora flavescens)、龙胆草(Gentiana scabra)、知母(Anemarrhena asphodeloides)、栀子(Gardenia jasminoides)、大黄(Rheum palmatum)或蒲公英(Herba Taraxaci)的天然药物或者其提取物,包括小檗碱、小檗碱衍生物或者其它异喹啉生物碱。
所述被增加的肠道细菌包括Alistipes、Allobaculum、拟杆菌属(Bacteroides)、Barnesiella、Blautia、Butyricicoccus、Butyricimonas、Dorea、螺杆菌属(Helicobacter)、Hespellia、霍尔德曼氏菌属(Holdemania)、劳森氏菌属(Lawsonia)、颤杆菌克属(Oscillibacter)、Parabacteroides、Phascolarctobacterium、普氏菌属(Prevotella)或Sedimentibacter的细菌;短链脂肪酸产生菌包括Blautia、Allobaculum、普氏菌属(Prevotella)、拟杆菌属(Bacterioides)或Butyricimonas。
所述被增加的肠道细菌的16S rRNA基因V3区序列与序列表中序列1-93中任意一个的相似性至少为95%或者80%。
所述被抑制的肠道细菌包括Alistipes、厌氧原体属(Anaeroplasma)、Barnesiella、双歧杆菌属(Bifidobacterium)、Butyricimonas、丁酸弧菌属(Butyrivibrio)、粪球菌属(Coprococcus)、Fastidiosipila、螺杆菌属(Helicobacter)、Hespellia、Marvinbryantia、Oribacterium、颤杆菌克属(Oscillibacter)、普氏菌属(Prevotella)、罗斯氏菌属(Roseburia)、瘤胃球菌属(Ruminococcus)或TM7_genera_incertae_sedis的细菌;可以产生内毒素的细菌包括变形菌门(Proteobacteria)的细菌。
所述被抑制的肠道细菌的16S rRNA基因V3区序列与序列表中序列94-268中任意一个的相似性至少为95%或者80%。
本发明改善肠道菌群结构的方法,可以用于制备改善肥胖、胰岛素抵抗等代谢性疾病的药物、营养品、保健品、饮料、食品等。
附图说明
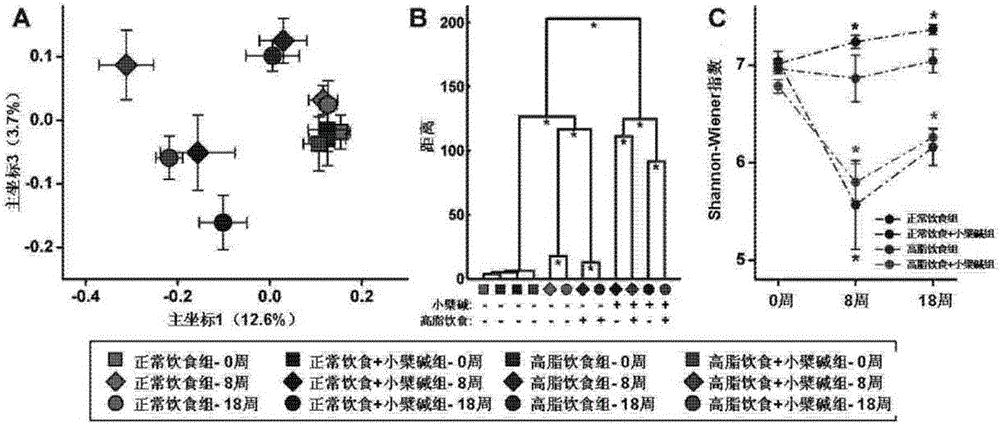
图1为小檗碱对大鼠肠道菌群结构的影响,其中:(A)基于unweighted UniFrac距离的主坐标分析得分图;(B)多变量方差分析(MANOVA);(C)Shannon-Wiener指数。
图2为基于OTU相对丰度的冗余分析三序图,溶剂:0.5%羧甲基纤维素钠溶剂。
图3为不同处理组大鼠粪便中短链脂肪酸的含量。
图4为小檗碱对高脂饮食大鼠肥胖表型及进食量的影响。
图5为小檗碱对高脂饮食大鼠胰岛素敏感性的影响。
图6为小檗碱对高脂饮食大鼠血清炎症水平的影响。
具体实施方式
本发明以Wistar大鼠(8周龄,雄性)为实施对象,采用小檗碱作为例子进行本发明的说明。40只Wistar大鼠适应性饲养2周后,随机分为4组,即正常饮食组(NCD)、正常饮食小檗碱处理组(NCD+BBR)、高脂饮食组(HFD)和高脂饮食小檗碱处理组(HFD+BBR),继续饲养或处理18周,期间处理组每天灌胃小檗碱。实验过程中不同时间点采集每一只动物的粪便样品,采用454焦磷酸测序技术对肠道菌结构进行分析,采用气相色谱的方法对粪便中短链脂肪酸进行测定。同时,实验过程中,对体重、进食量、胰岛素敏感性、系统炎性水平等进行监测。
实施例一小檗碱显著改变正常饮食和高脂饮食大鼠肠道菌群结构
采用454焦磷酸测序技术和多变量统计学的方法对各组大鼠的肠道菌群结构进行分析。采用基于unweighted UniFrac距离的主坐标分析(PCoA),结果表明,不管是正常饮食还是高脂饮食饲养的大鼠,每天灌胃100mg/kg的小檗碱,均可以显著地改变肠道菌群的整体结构。小檗碱的作用可以解释肠道菌群结构整体变异的12.6%(参见图1A)。饮食对肠道菌群结构的也存在明显的影响,从图1A可以看出两种不同饮食的动物菌群结构在主坐标3的方向上(3.7%)明显不同。采用多变量方差分析(MANOVA)对四组之间的菌群结构差异进行统计学分析,结果表明小檗碱或者饮食对肠道菌群结构具有显著的影响(P<0.01),而差异最显著的是,是否给予小檗碱的组(参见图1B)。Shannon-Wiener指数也表明小檗碱可以显著降低肠道菌群结构的多样性(P<0.05)。
实施例二小檗碱显著富集正常饮食和高脂饮食大鼠肠道中短链脂肪酸产生菌的含量,并减少内毒素产生菌的含量。
采用冗余分析(Redundancy analysis,RDA)的方法找出268个与小檗碱处理相关的OTU,结果如图2所示。其中93个OTU(序列表中序列1-93)在小檗碱的作用下可以得到富集,另外175个OTU(序列表中序列94-268)在小檗碱的作用下减少或者被清除。基于此,根据本发明所述的改善肠道菌群结构的方法,所述被增加的肠道细菌的16S rRNA基因V3区序列与序列表中序列1-93中任意一个的相似性至少为95%、90%、85%、80%、75%或70%。另外,所述被抑制的肠道细菌的16S rRNA基因V3区序列与序列表中序列94-268中任意一个的相似性至少为95%、90%、85%、80%、75%或70%。
采用RDP classifier对OTU的代表序列进行分类地位鉴定,发现被抑制的细菌包括属于Alistipes、厌氧原体属(Anaeroplasma)、Barnesiella、双歧杆菌属(Bifidobacterium)、Butyricimonas、丁酸弧菌属(Butyrivibrio)、粪球菌属(Coprococcus)、Fastidiosipila、螺杆菌属(Helicobacter)、Hespellia、Marvinbryantia、Oribacterium、颤杆菌克属(Oscillibacter)、普氏菌属(Prevotella)、罗斯氏菌属(Roseburia)、瘤胃球菌属(Ruminococcus)或TM7_genera_incertae_sedis等的细菌;其中螺杆菌属(Helicobacter)等属于变形杆菌门(Proteobacteria)的细菌被可以产生高活性的内毒素。被富集的细菌包括属于Alistipes、Allobaculum、拟杆菌属(Bacteroides)、Barnesiella、Blautia、Butyricicoccus、Butyricimonas、Dorea、螺杆菌属(Helicobacter)、Hespellia、霍尔德曼氏菌属(Holdemania)、劳森氏菌属(Lawsonia)、颤杆菌克属(Oscillibacter)、Parabacteroides、Phascolarctobacterium、普氏菌属(Prevotella)或Sedimentibacter的细菌。其中丰度较高的Blautia、Allobaculum、普氏菌属(Prevotella)、拟杆菌属(Bacterioides)或Butyricimonas等都已被证实是具有产生短链脂肪酸的能力的肠道细菌。
基于此,根据本发明所述的改善肠道菌群结构的方法,口服相当于50mg/kg体重至400mg/kg体重的小檗碱的该组合物,可以选择性地增加肠道中一些细菌的含量,同时可以抑制肠道中另外一些细菌的含量;被增加的肠道细菌包括短链脂肪酸产生菌;被抑制的肠道细菌包括可以产生内毒素的细菌。
实施例三小檗碱增加正常饮食和高脂饮食大鼠肠道中短链脂肪酸的含量
采用气相色谱的方法对大鼠粪便中短链脂肪酸(包括乙酸、丙酸、丁酸、戊酸、异丁酸、异戊酸等)的含量进行测定。结果表明,口服100mg/kg的小檗碱可以明显增加正常饮食或者高脂饮食大鼠肠道中短链脂肪酸的含量,尤其是对乙酸和丙酸的增加更加显著(参见图3)。基于此,根据本发明所述的改善肠道菌群结构的方法,所述制剂可以增加肠道中短链脂肪酸的水平。
实施例四小檗碱对大鼠肥胖表型的影响
对各组大鼠体重的监测与分析结果表明,经过18周的高脂饮食诱导,高脂饮食组大鼠的体重显著高于正常饮食组(P<0.01)。每天灌胃给予100mg/kg的小檗碱可以有效地控制大鼠体重的增长,尤其是高脂饮食大鼠,在整个实验过程中HFD+BBR组大鼠体重一直被控制在与正常饮食组相近的水平,两组之间没有显著差异(P>0.05);小檗碱对正常饮食大鼠体重也有一定程度的影响(参见图4A)。实验结束时,处死所有动物,对包括空腹体重、附睾脂肪和肾周脂肪的重量进行称量,计算脂肪指数([附睾脂肪垫重量+肾周脂肪垫]/空腹体重×100),结果如图4B所示。经过18周的高脂饮食,大鼠脂肪指数显著高于正常饮食对照组,小檗碱处理显著地降低脂肪指数。但是,高脂饮食以及小檗碱对肝脏和胰脏等在本实验中均没有显著的影响,提示长时间的食用小檗碱对大鼠的正常生理功能没有明显的毒副作用。对各组大鼠热量摄入进行监测发现,口服100mg/kg的小檗碱对大鼠进食量,尤其是高脂饮食大鼠的进食量具有明显的抑制作用(参见图4C)。
实施例五小檗碱对正常饮食或高脂饮食喂养大鼠的胰岛素敏感性的影响
高脂喂养18周大鼠空腹血糖(FBG)显著高于正常饮食对照组;给予小檗碱可以有效地降低正常饮食以及高脂饮食大鼠的空腹血糖(FBG),尤其是高脂饮食大鼠的空腹血糖(FBG)得到显著降低(P<0.05)(参见图5A)。然后,我们检测了各组大鼠空腹血清胰岛素(FINS)的浓度,结果如图5B所示,高脂饮食模型对照组空腹血清胰岛素(FINS)水平显著高于正常饮食组,经过18周的小檗碱预防,高脂饮食大鼠空腹血清胰岛素(FINS)含量显著降低,达到与正常饮食组相当的水平。通过计算HOMA胰岛素抵抗指数评价大鼠胰岛素抵抗状态,结果如图5C所示,表明经过18周的高脂饮食诱导,大鼠形成了明显的胰岛素抵抗,同时给予100mg/kg小檗碱进行预防可以显著地防止胰岛素抵抗的形成(P<0.05)。
为了进一步对大鼠胰岛素敏感性进行检测,我们进行了口服葡萄糖耐量试验(OGTT)以及腹腔注射胰岛素耐量试验(ITT),结果如图5D和图5E所示。与上述结果一致,经过18周的高脂饮食诱导,大鼠口服葡萄糖耐量和腹腔注射胰岛素耐量显著受损,若同时给予100mg/kg小檗碱进行预防可以显著地防止葡萄糖耐量和胰岛素耐量受损的发生,显示出小檗碱在改善糖代谢过程中的发挥着重要的作用。
实施例六小檗碱降低正常饮食和高脂饮食大鼠系统炎性水平
为了显示实验过程中不同组别大鼠系统炎性水平,本研究对血清中内毒素结合蛋白(LBP)、单核细胞趋化蛋白1(MCP-1)、瘦素以及脂联素的浓度进行检测,结果如图6所示。实验结果表明,高脂饮食可以显著增加血清中内毒素结合蛋白(LBP)的水平,给予100mg/kg的小檗碱可以显著控制血清中内毒素结合蛋白水平的增加(P<0.05,参见图6A)。单核细胞趋化蛋白1(MCP-1)是由炎性组织分泌的一种细胞因子,对单核/巨噬细胞有趋化和激活作用。大量的研究表明,多种炎性疾病的发生和发展都与单核细胞趋化蛋白1(MCP-1)密切相关,因而与多种疾病有着密切的关系,包括动脉粥样硬化、肥胖、II型糖尿病、关节炎、败血症以及慢性细菌感染等。本研究结果表明,大鼠经过高脂饮食诱导形成肥胖和胰岛素抵抗过程中MCP-1的水平逐渐升高,但是给予小檗碱进行预防后,单核细胞趋化蛋白1(MCP-1)的浓度显著降低,甚至低于正常饮食对照组(参见图6B)。瘦素是一种由脂肪组织分泌的激素,广泛参与机体脂肪、糖以及能量代谢的过程。本实验结果表明,高脂组大鼠血清瘦素浓度极显著高于正常饮食组(P<0.01),小檗碱可以显著降低大鼠血清瘦素水平,尤其是高脂饮食大鼠(P<0.05,参见图6C)。对各组动物脂联素的分析结果表明,经过体重校正后高脂组大鼠脂联素含量显著低于正常饮食组(P<0.001),给予小檗碱同样也可以显著增加高脂饮食大鼠血清脂联素的含量(P<0.01,参见图6D)。基于此,根据本发明所述的改善肠道菌群结构的方法,所述制剂可以降低血清内毒素结合蛋白(LBP)、单核细胞趋化蛋白1(MCP-1)或瘦素等的含量;并增加脂联素等的分泌。
以下部分对应于母案申请的项书:
1.一种改善肠道菌群结构的方法,其特征在于:给予一种制剂后可以选择性地增加肠道中一些细菌的含量,同时可以抑制肠道中另外一些细菌的含量;被增加的细菌包括短链脂肪酸产生菌,被抑制的细菌包括可以产生内毒素的细菌。
2.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述制剂为天然药物或者其提取物。
3.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述制剂包括小檗碱、小檗碱衍生物或者其它异喹啉生物碱。
4.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述制剂包括小檗(Berberis vulgaris)、黄连(Coptis chinensis)、黄芩(Scutellaria baicalensis)、黄柏(Phellodendri Chinensis)、苦瓜(Momordica charantia)、苦丁茶(Ilex kudingcha)、苦参(Sophora flavescens)、龙胆草(Gentiana scabra)、知母(Anemarrhena asphodeloides)、栀子(Gardenia jasminoides)、大黄(Rheum palmatum)或蒲公英(Herba Taraxaci),或它们的提取物。
5.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述制剂包括来源于小檗属(Berberis)、黄连属(Coptis)、黄芩属(Scutellarias)、黄檗属(Phellodendron)、苦瓜属(Momordica)、冬青属(Ilex)、苦参属(Sophora)、龙胆属(Gentiana)、知母属(Anemarrhena)、栀子属(Gardenia)、大黄属(Rheum)或蒲公英属(Taraxacum)的植物或其提取物。
6.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述制剂包括来源于小檗科(Berberidaceae)、毛莨科(Ranunculaceae)、唇形科(Lamiaceae)、芸香科(Rutaceae)、葫芦科(Cucurbitaceae)、冬青科(Aquifoliaceae)、豆科(Leguminosae)、龙胆科(Gentianaceae)、百合科(Agavaceae)、茜草科Rubiaceae、蓼科(Polygonaceae)、菊科(Asteraceae)、防己科(Menispermaceae)或葫芦科(Cucurbitaceae)的植物或其提取物。
7.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被增加的肠道细菌包括Alistipes、Allobaculum、拟杆菌属(Bacteroides)、Barnesiella、Blautia、Butyricicoccus、Butyricimonas、Dorea、螺杆菌属(Helicobacter)、Hespellia、霍尔德曼氏菌属(Holdemania)、劳森氏菌属(Lawsonia)、颤杆菌克属(Oscillibacter)、Parabacteroides、Phascolarctobacterium、普氏菌属(Prevotella)或Sedimentibacter。
8.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被增加的肠道细菌包括拟杆菌科(Bacteroidaceae)、Coriobacteriaceae、脱硫弧菌科(Desulfovibrionaceae)、丹毒丝菌科(Erysipelotrichaceae)、黄杆菌科(Flavobacteriaceae)、螺杆菌科(Helicobacteraceae)、Incertae Sedis XI、Incertae Sedis XIV、毛螺旋菌科(Lachnospiraceae)、紫单胞菌科(Porphyromonadaceae)、普雷沃氏菌科(Prevotellaceae)、理研菌科(Rikenellaceae)、瘤胃球菌科(Ruminococcaceae)或韦荣氏球菌科(Veillonellaceae)。
9.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被增加的肠道细菌包括弯曲菌目(Campylobacterales)、脱硫弧菌目(Desulfovibrionales)、拟杆菌目(Bacteroidales)、Coriobacteriales、黄杆菌目(Flavobacteriales)、梭菌目(Clostridiales)或丹毒丝菌目(Erysipelotrichales)。
10.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被增加的肠道细菌包括ε-变形菌纲(Epsilonproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、拟杆菌纲(Bacteroidia)、Coriobacteridae、黄杆菌纲(Flavobacteria)、梭菌纲(Clostridia)或丹毒丝菌纲(Erysipelotrichi)。
11.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被增加的肠道细菌包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)或厚壁菌门(Firmicutes)。
12.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述短链脂肪酸产生菌包括属于Blautia、Allobaculum、普氏菌属(Prevotella)、拟杆菌属(Bacterioides)或Butyricimonas的细菌。
13.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被增加的肠道细菌的16S rRNA基因V3区序列与序列表中序列1-93中任意一个的相似性至少为95%。
14.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被增加的肠道细菌的16S rRNA基因V3区序列与序列表中序列1-93中任意一个的相似性至少为80%。
15.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被抑制的肠道细菌包括Alistipes、厌氧原体属(Anaeroplasma)、Barnesiella、双歧杆菌属(Bifidobacterium)、Butyricimonas、丁酸弧菌属(Butyrivibrio)、粪球菌属(Coprococcus)、Fastidiosipila、螺杆菌属(Helicobacter)、Hespellia、Marvinbryantia、Oribacterium、颤杆菌克属(Oscillibacter)、普氏菌属(Prevotella)、罗斯氏菌属(Roseburia)、瘤胃球菌属(Ruminococcus)或TM7_genera_incertae_sedis。
16.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被抑制的肠道细菌包括螺杆菌科(Helicobacteraceae)、毛螺旋菌科(Lachnospiraceae)、紫单胞菌科(Porphyromonadaceae)、普雷沃氏菌科(Prevotellaceae)、理研菌科(Rikenellaceae)、瘤胃球菌科(Ruminococcaceae)、厌氧原体科(Anaeroplasmataceae)或双歧杆菌科(Bifidobacteriaceae)。
17.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被抑制的肠道细菌包括弯曲菌目(Campylobacterales)、拟杆菌目(Bacteroidales)、梭菌目(Clostridiales)、厌氧原体目(Anaeroplasmatales)或双歧杆菌目(Bifidobacteriales)。
18.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被抑制的肠道细菌包括ε-变形菌纲(Epsilonproteobacteria)、α-变形菌纲(Alphaaproteobacteria)、拟杆菌纲(Bacteroidia)、梭菌纲(Clostridia)、放线菌纲(Actinobacteridae)或柔膜菌纲(Mollicutes)。
19.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被抑制的肠道细菌包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)或柔膜菌门(Tenericutes)。
20.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述可以产生内毒素的细菌包括变形菌门(Proteobacteria)的细菌。
21.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被抑制的肠道细菌的16S rRNA基因V3区序列与序列表中序列94-268中任意一个的相似性至少为95%。
22.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述被抑制的肠道细菌的16S rRNA基因V3区序列与序列表中序列94-268中任意一个的相似性至少为80%。
23.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述制剂能够口服或者通过肠道给药。
24.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述制剂为栓剂、片剂、丸剂、颗粒剂、膜剂、微囊剂、滴丸剂、气雾剂、酒剂、糖浆剂或口服液。
25.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述制剂可以降低血清脂多糖结合蛋白(LBP)、单核细胞趋化蛋白-1(MCP-1)或瘦素(Leptin)的含量;并增加脂联素(adiponectin)的分泌。
26.根据项1所述的改善肠道菌群结构的方法,其特征在于:所述制剂可以增加肠道中短链脂肪酸的含量。
27.一种用于项1所述改善肠道菌群结构的方法的受试药物、化合物或食品的筛选方法,其特征在于:采用可以选择性的增加肠道中一些细菌包括短链脂肪酸产生菌的含量,同时可以抑制肠道中另外一些细菌包括可以产生内毒素的细菌的含量的制剂作为对照,比较受试药物或者化合物对肠道菌群结构的调节作用,如果受试药物、化合物或食品对菌群的调节作用与对照制剂具有相似的作用,即表明受试药物、化合物或食品可能具有改善肠道菌群结构的作用。
28.如项27所述的筛选方法,其特征在于:受试药物、化合物或食品对菌群的调节作用与对照制剂的相似性大于95%时即可以表明受试药物、化合物或食品可能具有改善肠道菌群结构的作用。
29.如项27所述的筛选方法,其特征在于:受试药物、化合物或食品对菌群的调节作用与对照制剂的相似性大于75%时即可以表明受试药物、化合物或食品可能具有改善肠道菌群结构的作用。
30.如项27所述的筛选方法,其特征在于:所述对照制剂为天然药物或者其提取物。
31.如项27所述的筛选方法,其特征在于:所述对照制剂为小檗碱、小檗碱衍生物或者其它异喹啉生物碱。
32.如项27所述的筛选方法,其特征在于:所述对照制剂为小檗(Berberis vulgaris)、黄连(Coptis chinensis)、黄芩(Scutellaria baicalensis)、黄柏(Phellodendri Chinensis)、苦瓜(Momordica charantia)、苦丁茶(Ilex kudingcha)、苦参(Sophora flavescens)、龙胆草(Gentiana scabra)、知母(Anemarrhena asphodeloides)、栀子(Gardenia jasminoides)、大黄(Rheum palmatum)或蒲公英(Herba Taraxaci),或它们的提取物。
33.如项27所述的筛选方法,其特征在于:所述对照制剂来源于小檗属(Berberis)、黄连属(Coptis)、黄芩属(Scutellarias)、黄檗属(Phellodendron)、苦瓜属(Momordica)、冬青属(Ilex)、苦参属(Sophora)、龙胆属(Gentiana)、知母属(Anemarrhena)、栀子属(Gardenia)、大黄属(Rheum)或蒲公英属(Taraxacum)植物或其提取物。
34.如项27所述的筛选方法,其特征在于:所述对照制剂来源于小檗科(Berberidaceae)、毛莨科(Ranunculaceae)、唇形科(Lamiaceae)、芸香科(Rutaceae)、葫芦科(Cucurbitaceae)、冬青科(Aquifoliaceae)、豆科(Leguminosae)、龙胆科(Gentianaceae)、百合科(Agavaceae)、茜草科Rubiaceae、蓼科(Polygonaceae)、菊科(Asteraceae)、防己科(Menispermaceae)或葫芦科(Cucurbitaceae)的植物或其提取物。
35.如项27所述的筛选方法,其特征在于:所述被增加的肠道细菌包括Alistipes、Allobaculum、拟杆菌属(Bacteroides)、Barnesiella、Blautia、Butyricicoccus、Butyricimonas、Dorea、螺杆菌属(Helicobacter)、Hespellia、霍尔德曼氏菌属(Holdemania)、劳森氏菌属(Lawsonia)、颤杆菌克属(Oscillibacter)、Parabacteroides、Phascolarctobacterium、普氏菌属(Prevotella)或Sedimentibacter。
36.如项27所述药物的筛选方法,其特征在于:所述短链脂肪酸产生菌包括Blautia、Allobaculum、普氏菌属(Prevotella)、拟杆菌属(Bacterioides)或Butyricimonas。
37.如项27所述的筛选方法,其特征在于:所述被增加的肠道细菌的16S rRNA基因V3区序列与序列表中序列1-93中任意一个的相似性至少为95%。
38.如项27所述的筛选方法,其特征在于:所述被增加的肠道细菌的16S rRNA基因V3区序列与序列表中序列1-93中任意一个的相似性至少为为80%。
39.如项27所述的筛选方法,其特征在于:所述被抑制的肠道细菌包括Alistipes、厌氧原体属(Anaeroplasma)、Barnesiella、双歧杆菌属(Bifidobacterium)、Butyricimonas、丁酸弧菌属(Butyrivibrio)、粪球菌属(Coprococcus)、Fastidiosipila、螺杆菌属(Helicobacter)、Hespellia、Marvinbryantia、Oribacterium、颤杆菌克属(Oscillibacter)、普氏菌属(Prevotella)、罗斯氏菌属(Roseburia)、瘤胃球菌属(Ruminococcus)或TM7_genera_incertae_sedis。
40.如项27所述的筛选方法,其特征在于:所述内毒素产生菌包括变形菌门(Proteobacteria)的细菌。
41.如项27所述的筛选方法,其特征在于:所述被抑制的肠道细菌的16S rRNA基因V3区序列与序列表中序列94-268中任意一个的相似性至少为95%。
42.如项27所述的筛选方法,其特征在于:所述被抑制的肠道细菌的16S rRNA基因V3区序列与序列表中序列94-268中任意一个的相似性至少为80%。
43.如项27所述的筛选方法,其特征在于:所述对照制剂可以降低血清脂多糖结合蛋白(LBP)、单核细胞趋化蛋白-1(MCP-1)或瘦素(Leptin)的含量;并增加脂联素(adiponectin)的分泌。
44.如项27所述的筛选方法,其特征在于:所述对照制剂可以增加肠道中短链脂肪酸的含量。
45.一种用于改善肠道菌群结构的组合物,其特征在于:所述组合物可以选择性地增加肠道中一些细菌的含量,同时可以抑制肠道中另外一些细菌的含量;被增加的细菌包括短链脂肪酸产生菌;被抑制的细菌包括可以产生内毒素的细菌。
46.如项45所述的组合物,其特征在于:所述组合物包含一种天然药物或者其提取物。
47.如项45所述的组合物,其特征在于:所述组合物包含小檗碱、小檗碱衍生物或其它异喹啉生物碱。
48.如项45所述的组合物,其特征在于:所述组合物包含小檗(Berberis vulgaris)、黄连(Coptis chinensis)、黄芩(Scutellaria baicalensis)、黄柏(Phellodendri Chinensis)、苦瓜(Momordica charantia)、苦丁茶(Ilex kudingcha)、苦参(Sophora flavescens)、龙胆草(Gentiana scabra)、知母(Anemarrhena asphodeloides)、栀子(Gardenia jasminoides)、大黄(Rheum palmatum)或蒲公英(Herba Taraxaci),或它们的提取物。
49.如项45所述的组合物,其特征在于:所述组合物包含来源于小檗属(Berberis)、黄连属(Coptis)、黄芩属(Scutellarias)、黄檗属(Phellodendron)、苦瓜属(Momordica)、冬青属(Ilex)、苦参属(Sophora)、龙胆属(Gentiana)、知母属(Anemarrhena)、栀子属(Gardenia)、大黄属(Rheum)或蒲公英属(Taraxacum)植物或其提取物。
50.如项45所述的组合物,其特征在于:所述组合物包含来源于小檗科(Berberidaceae)、毛莨科(Ranunculaceae)、唇形科(Lamiaceae)、芸香科(Rutaceae)、葫芦科(Cucurbitaceae)、冬青科(Aquifoliaceae)、豆科(Leguminosae)、龙胆科(Gentianaceae)、百合科(Agavaceae)、茜草科Rubiaceae、蓼科(Polygonaceae)、菊科(Asteraceae)、防己科(Menispermaceae)或葫芦科(Cucurbitaceae)的植物或其提取物。
51.如项45所述的组合物,其特征在于:所述该组合物为一种食物、一种食物添加成分或者药物。
52.如项45所述的组合物,其特征在于:每日摄入相当于50mg/kg体重至400mg/kg体重剂量的该组合物至少两周后,可以选择性地增加肠道中一些细菌的含量,同时可以抑制肠道中另外一些细菌的含量;被增加的细菌包括短链脂肪酸产生菌;被抑制的细菌包括可以产生内毒素的细菌。
53.如项45所述的组合物,其特征在于:所述被增加的肠道细菌包括Alistipes、Allobaculum、拟杆菌属(Bacteroides)、Barnesiella、Blautia、Butyricicoccus、Butyricimonas、Dorea、螺杆菌属(Helicobacter)、Hespellia、霍尔德曼氏菌属(Holdemania)、劳森氏菌属(Lawsonia)、颤杆菌克属(Oscillibacter)、Parabacteroides、Phascolarctobacterium、普氏菌属(Prevotella)或Sedimentibacter。
54.如项45所述的组合物,其特征在于:所述短链脂肪酸产生菌包括Blautia、Allobaculum、普氏菌属(Prevotella)、拟杆菌属(Bacterioides)或Butyricimonas。
55.如项45所述的组合物,其特征在于:所述被增加的肠道细菌的16SrRNA基因V3区序列与序列表中序列1-93中任意一个的相似性至少为95%。
56.如项45所述的组合物,其特征在于:所述被增加的肠道细菌的16SrRNA基因V3区序列与序列表中序列1-93中任意一个的相似性至少为80%。
57.如项45所述的组合物,其特征在于:所述被抑制的肠道细菌包括Alistipes、厌氧原体属(Anaeroplasma)、Barnesiella、双歧杆菌属(Bifidobacterium)、Butyricimonas、丁酸弧菌属(Butyrivibrio)、粪球菌属(Coprococcus)、Fastidiosipila、螺杆菌属(Helicobacter)、Hespellia、Marvinbryantia、Oribacterium、颤杆菌克属(Oscillibacter)、普氏菌属(Prevotella)、罗斯氏菌属(Roseburia)、瘤胃球菌属(Ruminococcus)或TM7_genera_incertae_sedis。
58.如项45所述的组合物,其特征在于:所述内毒素产生菌包括变形菌门(Proteobacteria)的细菌。
59.如项45所述的组合物,其特征在于:所述被抑制的肠道细菌的16SrRNA基因V3区序列与序列表中序列94-268中任意一个的相似性至少为95%。
60.如项45所述的组合物,其特征在于:所述被抑制的肠道细菌的16SrRNA基因V3区序列与序列表中序列94-268中任意一个的相似性至少为80%。
61.根据项1所述的改善肠道菌群结构的方法的应用,其特征在于:所述改善肠道菌群结构的方法,用于制备改善肥胖、胰岛素抵抗这样的代谢性疾病的药物、营养品、保健品、饮料或食品。
- 还没有人留言评论。精彩留言会获得点赞!