镰孢菌遗传分化的SDHC亚基作为药靶资源在药物研发中的用途的制作方法
本发明涉及药物靶标及药物研发领域,具体公开了镰孢菌遗传分化的sdhc亚基作为药靶资源在药物研发中的用途。
背景技术:
赤霉病是发生在小麦上的一种重要的病害之一,在我国的江淮流域、西南冬麦区和东北春麦区发生严重。造成小麦赤霉病的病原物主要是以禾谷镰孢菌(fusariumgraminearum)和亚洲镰孢菌(fusariumasiaticum)为优势种的复合种群,有性态为玉蜀黍赤霉(gibberelllazeae)。小麦赤霉病不仅造成小麦的产量和质量下降,而且病原菌侵染小麦粒后产生的真菌毒素会在麦粒中积累影响谷物的品质,严重时危害人畜的健康。防治小麦赤霉病的有效措施包括农业防治、生物防治、物理防治和化学防治,但应用杀菌剂化学防治病害仍然是最重要、最有效、最直接的一种手段。以多菌灵为代表的苯并咪唑类杀菌剂自问世近50年来,在应用于防治小麦小麦赤霉病方面贡献突出。但由于在田间长期使用该类杀菌剂,早在1992年,周明国在浙江省就监测到了世界上第一株多菌灵田间抗性菌株。之后,田间小麦赤霉病菌对多菌灵的抗药性问题越来越严重,面临着该类杀菌剂防治小麦赤霉病失效的问题,因此研究开发替代杀菌剂势在必行。
植物病原菌线粒体呼吸传递链上的复合物ⅱ(琥珀酸脱氢酶或琥珀酸泛醌还原酶)是三羧酸循环的功能部分,与线粒体电子传递相连催化琥珀酸氧化到延胡索酸和从泛醌(辅酶q)还原到泛醇的偶联反应。复合物ⅱ主要由黄素蛋白(fp,sdha)、铁硫蛋白(ip,sdhb)和两种嵌膜蛋白(sdhc和sdhd)等4个亚基组成。sdha和sdhb构成了复合物ⅱ的可溶性部分,具有琥珀酸脱氢酶活性;sdhc和sdhd具有泛醌还原酶活性,且将sdha、sdhb固定在内膜上。琥珀酸脱氢酶抑制剂类杀菌剂通过干扰呼吸电子传递链上的复合物ⅱ抑制线粒体的功能,阻止其产生能量,抑制病原菌生长,最终导致其死亡。
琥珀酸脱氢酶抑制剂作为一类新型作用机制的杀菌剂,全新结构、全新作用机理的优势,使其在杀菌剂市场中的地位不容小觑,氟唑菌酰胺、啶酰菌胺、苯并烯氟菌唑、联苯吡菌胺和氟唑菌苯胺位居前五,占琥珀酸脱氢酶抑制剂杀菌剂市场的80.2%。随着琥珀酸脱氢酶抑制剂的发展和应用,植物病原真菌的抗药性问题也越来越严重。shima等检测到aspergillusoryzae对萎锈灵抗性的突变体中存在在3个突变位点,且3个突变位点分别位于sdhb、sdhc和sdhd亚基上。通过对kegg呼吸通路研究发现,在其它真菌中sdhc亚基只有一个基因,而在亚洲镰孢菌中sdhc亚基由2个基因组成,分别是fgsg_09012
(sdhc1)和fgsg_01981(sdhc2)。
本发明人研究镰孢菌呼吸链sdhc亚基分化成sdhc1和sdhc2基因对镰孢菌对琥珀酸脱氢酶抑制剂药敏性的调控作用,并测定sdhc1和sdhc2基因敲除突变体和野生型的其它生物学特性是否存在差异,为揭示镰孢菌对琥珀酸脱氢酶抑制剂抗药性研究和琥珀酸脱氢酶抑制剂对镰孢菌的作用机理研究提供理论基础,为以sdhc1基因和/或sdhc2基因为药物靶标的药物研发提供重要的理论资料。
技术实现要素:
本发明公开了镰孢菌(fusariumgenus)遗传分化的sdhc亚基作为药靶资源在药物研发中的用途,所述sdhc亚基分化为sdhc1基因或sdhc2基因,进一步的,sdhc1基因调控琥珀酸脱氢酶抑制剂的抗药性,sdhc2基因调控琥珀酸脱氢酶抑制剂的敏感性,所述药物是以sdhc1或sdhc2作为药剂靶标的农用杀菌剂及医用抗生素。
有益效果:
本发明研究了镰孢菌呼吸链sdhc亚基分化成sdhc1和sdhc2基因对镰孢菌对琥珀酸脱氢酶抑制剂药敏性的调控作用,并测定sdhc1和sdhc2基因敲除突变体和野生型的其它生物学特性是否存在差异,为揭示镰孢菌对琥珀酸脱氢酶抑制剂抗药性研究和琥珀酸脱氢酶抑制剂对镰孢菌的作用机理研究提供理论基础,为以sdhc1基因和/或sdhc2基因为药物靶标的药物研发提供重要的理论资料。
附图说明
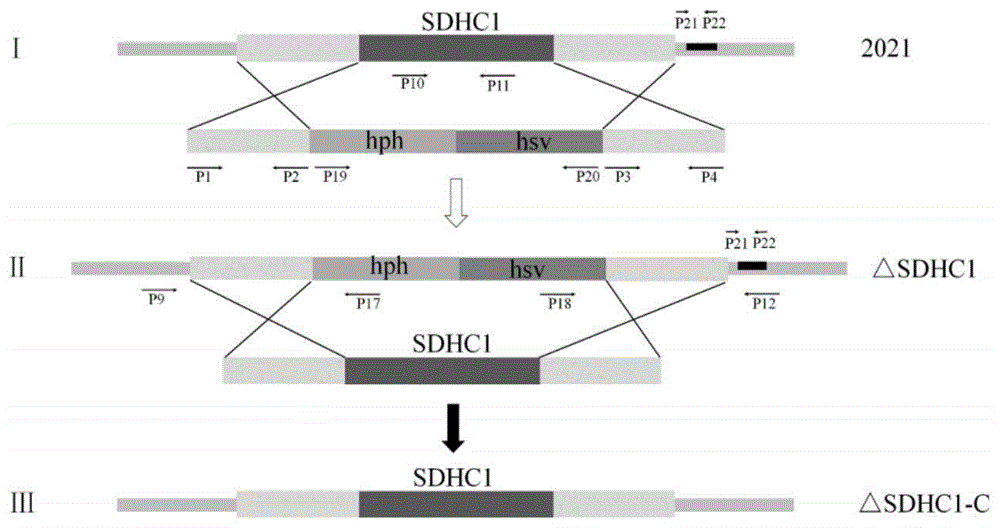
图1:sdhc1基因同源重组技术路线;
其中i.hph-hsv同源置换野生型菌株2021的sdhc1基因获得突变体菌株△sdhc1;ii.野生型菌株2021的sdhc1基因同源置换敲除体△sdhc1的hph-hsv片段获得菌株△sdhc1-c。
图2:sdhc2基因同源重组技术路线;
其中iv.hph-hsv同源置换野生型菌株2021的sdhc2基因获得突变体菌株△sdhc2;v.野生型菌株2021的sdhc1基因同源置换敲除体△sdhc2的hph-hsv片段获;vi.得菌株△sdhc2-c。
具体实施方式
1材料与方法
1.1供试菌株
采自江苏省小麦赤霉病发生地块的亚洲镰孢菌,命名为亚洲镰孢菌2021。
1.2试剂
1.2.1供试药剂
98%萎锈灵原药(carboxin,瑞士先正达公司),98%啶酰菌胺原药(pyridylamine,江西正邦生物化学股份有限公司),96%氟吡菌酰胺原药(fluoropylamide,拜耳公司),99.1%氟唑菌酰胺原药(fluoropylamide,瑞士先正达公司)原药均用甲醇配制成10000μg/ml的母液。
1.2.2供试试剂和试剂盒
限制性内切酶、dighighprimednalabelinganddetectionstarterkitⅰ(dig试剂盒)等试剂购自takara公司,gelextractionkit(200)试剂盒购自omega公司,phantamaxsuperfidelitydnapolymerase、2×taqplusmixⅱ购自诺唯赞公司,hygeromycin购自solarbio公司,5-fluoro-2’-deoxyuridine购自fluka公司,maker购自tran公司,植物基因组总dna和总rna提取试剂盒购自天根生化科技有限公司,eppendorfbiophotometerplus购自美国艾本德公司,atp试剂盒购自索莱宝公司、oxygraphsystem呼吸仪购自汉莎科技公司。
1.3试验培养基、仪器及耗材
1.3.1培养基
yba培养基、yepd培养基、绿豆汤、覆盖培养基、再生培养基、pda培养基、绿豆汤培养基。
1.3.2仪器及耗材
pcr仪、实时荧光定量pcr仪、离心机、摇床、球磨仪、凝胶电泳仪、微波炉、培养箱、冰箱、培养皿、量筒、三角瓶、研钵、离心管、钢珠、滤纸、滤菌布、擦镜纸、枪头、移液枪、打孔器、电子天平、血球计数板等。
2生物学操作方法
2.1ctab法提取dna
1)将需要提取dna的菌株活化到pda平板上,在25℃培养箱生长2~3天;
2)在超净工作台用牙签(121℃高压灭菌20min)刮取平板上生长的少许菌丝体,将其置入2ml离心管(121℃高压灭菌20min)中;
3)用在酒精灯外焰上烧过的镊子夹取钢珠,加到上述离心管中;
4)加700μl的ctab提取液;
5)球磨仪打碎菌丝;
6)12000rpm离心1min,将在离心管中产生的泡沫经过离心破裂掉;
7)加700μl三氯甲烷(氯仿),剧烈摇晃片刻,使离心管中的试剂混匀;
8)12000rpm离心10min;
9)离心后管内液体分三层,dna被三氯甲烷萃取到上层上清液中;
10)小心吸取300μl上清液到1.5ml离心管(121℃高压灭菌20min)中,加750μl无水乙醇,,轻轻颠倒混匀
11)-20℃沉降2h,沉降过程中,dna和无水乙醇结合形成絮状物;
12)12000rpm离心10min,dna沉积在离心管的底部,小心将上清液吸出,倒
扣在吸水纸上过夜晾干;
13)离心管中加30μl的无菌水,12000rpm短暂离心,使dna溶解在无菌水中。
操作注意事项:
1)提取dna过程中用到的牙签、钢珠、离心管、无菌水等要湿热灭菌(121℃,
20min)或干热灭菌(160℃,2h),防止污染;
2)用牙签刮取菌丝时,每个菌株对应一根牙签,防止交叉污染;
3)球磨仪打完菌丝后,注意要离心,防止因为手触及泡沫引起交叉污染;
4)加三氯甲烷离心后,吸取上清液时要注意不要洗到中间层的菌丝体;
5)提取的dna可以放在室温下短时间内待用,也可以放在4℃或-20℃长期保存。
2.2载体构建。
运用primerpremier5设计引物,并由上海金斯瑞生物工程技术服务有限公司合成。体外构建亚洲镰孢菌sdhc1和sdhc2的敲除载体,以亚洲镰孢菌野生型2021的dna作为模板,设计引物p1-p2扩增sdhc1的上游片段,引物p3-p4扩增sdhc1的下游片段;引物p5-p6扩增sdhc2的上游片段,引物p7-p8扩增sdhc2的下游片段。反应体系为:dnapolymerase1μl,dntpmix1μl,2×phantamaxbuffer25μl,dna模板2μl,引物各2μl,ddh2o17μl(50μl体系)。反应程序为:95℃预变性3min,95℃变性15s,56℃退火15s,72℃延伸1min,35个循环;72℃延伸10min;产物4℃保存。pcr产物经1%琼脂糖凝胶电泳后用gelextractionkit(200)试剂盒回收sdhc1和sdhc2的上下游片段。引物p19-p20扩增双筛片段(hph-hsv),反应程序为:95℃预变性3min,95℃变性15s,56℃退火15s,72℃延伸3.5min,35个循环(95℃变性15s,56℃退火15s,72℃延伸3.5min),72℃延伸10min;产物4℃保存。pcr产物经1%琼脂糖凝胶电泳后用gelextractionkit(200)试剂盒回收。以double-jointpcr方法将双筛片段(hph-hsv)分别与亚洲镰孢菌sdhc1和sdhc2的上下游片段融合。融合反应体系为:模板dna10ng(亚洲镰孢菌sdhc1基因上游片段:双筛片段:亚洲镰孢菌sdhc1基因下游片段=1:3:1),加ddh2o至25μl。融合程序为:94℃预变性5min,94℃变性30s,68℃退火30s,72℃延伸5min,17个循环;94℃变性30s,56℃退火30s,72℃延伸5min,21个循环(94℃变性30s,56℃退火30s,72℃延伸5min);72℃充分延伸10min;产物4℃保存。得到的sdhc1和sdhc2三段融合产物,加75μlddh2o稀释至100μl,用于扩增敲除载体的模板。扩增体系:dnapolymerase1μl,dntpmix1μl,2×phantamaxbuffer25μl,dna模板2μl,引物各2μl,ddh2o17μl(50μl体系)。反应程序为:95℃预变性3min,95℃变性15s,56℃退火15s,72℃延伸5min,35个循环(95℃变性15s,56℃退火15s,72℃延伸5min),72℃延伸10min,产物4℃保存。pcr产物经1%琼脂糖凝胶电泳后用gelextractionkit(200)试剂盒回收得到sdhc1和sdhc2的敲除载体。
sdhc1基因回复载体构建,以野生型菌株2021的基因组dna为模板,以p1-p4引物扩增sdhc1基因;sdhc2基因回复载体构建,以野生型菌株2021的基因组dna为模板,以p5-p8引物扩增sdhc2基因(如图1、图2所示)。
表1本申请中使用的引物
2.3pcr产物琼脂糖凝胶电泳、回收。
1)制备1%琼脂糖凝胶:称取琼脂糖(大胶块称1.0g,中胶块称0.6g,小胶块
称0.3g),tae电泳液溶解,加热后倒至胶板,加eb搅匀,冷却待用;
2)用移液枪将pcr产物小心转移至琼脂糖凝胶的胶孔,120v,200ma通电30min;
3)成像仪观察pcr产物条带,拍照;
4)将含有目的条带的位置用手术刀片小心切下来,放入2ml离心管中;
5)加500μlbindingsolution,65℃水浴充分融化;
6)每次转移700μl溶液至hibinddna柱中,12000rpm离心30s;
7)倒掉hibinddna柱下面的废液,重复第六步操作,至离心管中的溶液全部转移完;
8)hibinddna柱中加300μlbindingsolution,12000rpm离心30s,弃废液;
9)hibinddna柱中加600μlspwwashsolution,12000rpm离心1min,弃废液;
10)重复第九步操作;
11)将回收装置放入离心机,12000rpm空离心2min,弃废液;
12)将hibinddna柱取出来放到1.5ml离心管中,室温放置2min,移液枪加30μl的ddh2o溶解,室温放置3~5min;
13)12000rpm离心2min,弃掉吸附柱,在离心管上标注载体名称;
14)eppendorfbiophotometerplus仪器测定载体浓度。
2.4原生质体的制备和转化。
1)将保存在南京农业大学杀菌剂生物学实验室的亚洲镰孢菌野生菌株2021活化到pda平板上;
2)用在酒精灯外焰上烧过的手术刀片在2021菌落的边缘划取5~6个菌丝块,将其置于100mlyepd液体培养基中,25℃、175rpm摇床中培养14~16h;
3)配制裂解液:0.2g蜗牛酶、0.1g裂解酶、0.1g崩溃酶,20ml0.7mnacl溶解,3500rpm离心5min,将上清倒至50ml三角瓶中待用;
4)滤菌布收取yepd培养基中的菌碟,并用0.7mnacl冲洗;
5)将菌碟转移至裂解液中,37℃、85rpm摇床中裂解2h;
6)三层擦镜纸过滤裂解液至50ml离心管中,0.7mnacl冲洗;
7)2000rpm离心5min,原生质体沉积在管子的底部,倒掉上清液,并用10ml0.7mnacl重悬;
8)2000rpm离心5min,倒掉上清液,10mlstc溶液重悬;
9)2000rpm离心5min,倒掉上清液;
10)stc:sptc=4:1(stc160μl,sptc40μl)溶解原生质体,置于冰上30min;
11)在原生质体悬浮液中加10μl肝素钠和3000ng载体,并用移液枪混匀置于冰上30min,隔15min混匀一次;
12)加1mlsptc溶液,混匀,25℃培养箱中放置20min,隔10min混匀一次;13)将上述得到的混合液加入到200ml冷却至40~50℃再生培养基中,充分混匀,倒在直径90mm培养皿中,每皿大约10ml,25℃培养箱中放置大约12h;
14)200ml覆盖培养基冷却至40~50℃时加入200μl抗生素hygb,充分混匀,覆盖到再生培养基平板上(覆盖薄薄的一层),25℃培养大约3d;
15)将在平板上长的菌落分别挑取到含有hygb和f2du的平板上,25℃培养1d,将在hygb平板上生长,在f2du平板上不生长的转化子转移到pda平板上,作进一步的验证。sdhc1得到2个转化子命名为△sdhc1-8和△sdhc1-9,sdhc2得到2个转化子命名为△sdhc2-5和△sdhc2-7。
2.5转化子验证。
2.5.1特异性引物验证
ctab法提取转化子的dna,经过pcr程序验证转化子的目的基因、上游结合区和下游结合区的正确性。
验证上下游结合区,primerprimier5设计p9-p17特异性扩增sdhc1上游结合区片段(2157bp),p12-p18特异性扩增sdhc1下游结合区片段(1973bp);p13-p17特异性扩增sdhc2上游结合区片段(2084bp),p16-p18特异性扩增sdhc2下游结合区片段(2151bp)。反应体系:2×taqplusmixⅱ5.7μl,引物各0.6μl,模板0.6μl,加ddh2o至15μl。反应程序:94℃预变性5min,94℃变性30s,56℃退火30s,72℃延伸1min,35个循环(94℃变性30s,56℃退火30s,72℃延伸1min),72℃延伸10min,产物4℃保存。
验证目的基因,primerprimier5设计p10-p11特异性扩增sdhc1目的基因(490bp),p14-p15特异性扩增sdhc2目的基因(465bp)。反应体系:2×taqplusmixⅱ5.7μl,引物各0.6μl,模板0.6μl,加ddh2o至15μl。反应程序:94℃预变性5min,94℃变性30s,56℃退火30s,72℃延伸30s,35个循环(94℃变性30s,56℃退火30s,72℃延伸30s),72℃延伸10min,产物4℃保存。
2.5.2southren杂交验证
(1)杂交溶液的配制
bufferⅰ(maleicacidbuffer):0.1mmaleicacidbuffer,0.7mnacl,ph7.5(1l)bufferⅱ(washingbuffer):570mlbufferⅰ,30ml吐温20溶液,超纯水400ml,ph7.5(1l)20×ssc溶液:3.0mnacl,0.3m柠檬酸钠,ph7.0(1l)10%sds:20gsds,超纯水定容到200ml,孔径为0.22μm的细菌过滤器过滤bufferⅲ:100ml20×ssc溶液,10ml10%的sds溶液(1l)bufferⅳ:5ml20×ssc溶液,10ml10%的sds溶液(1l)变性液:1.5mnacl,0.5mnaoh(1l)中和液:1.5mnacl,0.5m柠檬酸钠,ph7.5(1l)blockingsolution:150mlbufferⅰ,15ml6号液(现用现配)antibodysolution:50mlblockingsolution,8μl4号液(现用现配)
detectionbuffer:0.1mtris,0.1mnacl,0.2mmgcl·6h2o,ph9.5(1l)colorsolution:30mldetectionbuffer,200μl5号液(现用现配)
(2)提取植物基因组dna
1)将转化子活化到pda平板上,25℃培养箱中生长3d;
2)在转化子菌落边缘用灭菌的打孔器打3~5个菌碟,将其置于100ml培养基
中,25℃、175rpm培养3d;
3)滤菌布收取菌丝,吸水纸吸干水分;
4)用植物基因组dna提取试剂盒提取转化子的基因组dna;
5)取适量菌丝置于灭菌的研钵,加入液氮充分研磨;
6)研磨好的菌丝粉末装到2ml离心管中,加入700μl预热缓冲液gp1,65℃水浴30min,水浴过程中需颠倒离心管数次确保裂解液充分裂解菌丝体;
7)加700μl三氯甲烷(氯仿),充分混匀,12000rpm离心10min;
8)离心后管中的液体分为3层,dna被三氯甲烷萃取到上层水相中,小心吸取500μl上清液,转移至新的2ml离心管中,并加700μlgp2,充分混匀;
9)将混匀的液体分次转移到吸附柱cb3中,每次转移700μl,12000rpm离心;
10)弃掉收集管中废液,重复第9步,至全部转移至吸附柱;
11)向吸附柱中加500μl缓冲液gd,12000rpm离心30s;
12)弃掉收集管中废液,向吸附柱中加600μl漂洗液pw,12000rpm离心1min;
13)弃掉收集管中废液,重复第12步;
14)12000rpm空离心2min;
15)弃掉收集管中废液,吸附柱室温自然晾干2~3min,将其转移至新的1.5ml离心管中;
16)在吸附柱上方悬空加ddh2o50μl,室温放置3~5min;
17)12000rpm离心2min,dna溶解在收集的液体中。
(3)探针标记
以亚洲镰孢菌野生菌株2021为模板,用primerpremier5分别设计sdhc1基因的引物p21-p22,扩增片断(470bp)作为探针;sdhc2基因的引物p23-p24,扩增片段(676bp)作为探针。反应体系:2×taqplusmixⅱ5.7μl,引物各0.6μl,模板0.6μl,加ddh2o至15μl。反应程序:94℃预变性5min,94℃变性30s,56℃退火30s,72℃延伸30s,35个循环(94℃变性30s,56℃退火30s,72℃延伸30s),72℃延伸10min,产物4℃保存;
1)琼脂糖凝胶电泳回收纯化pcr产物,测定产物浓度,作为探针的dna模板;
2)1.5ml离心管中加入1μgdna模板、4μlλ-ecot14digestmarker,加ddh2o至16μl;
3)沸水浴变性10min(注意离心管的盖子用封口膜封住,防止管中液体溅出),取出后立即冰浴5min;
4)12000rpm短暂离心,使液体集中到离心管的底部;
5)在管中加4μl1号液,充分混匀,37℃过夜孵育约20h;
6)60水浴孵育10min终止反应,-20℃条件下保存。
(4)dig试剂盒酶切植物基因组dna及电泳
1)sdhc1酶切体系:2μlecorⅰ,5μlbuffer,43μl植物基因组dna;sdhc2酶切体系:2μlecorⅴ,5μlbuffer,43μl植物基因组dna。置于37℃,酶切约10h;
2)制备1%琼脂糖凝胶:称取1.5g琼脂糖,150mltae电泳液溶解,微波炉加热并自然冷却至40~50℃,将其导入胶板,加eb搅匀后冷却待用;
3)将酶切后的样品,移液枪上样至胶孔中,25v,200ma过夜跑胶。
(5)凝胶预处理
1)将有目的片段的胶块切下,置于玻璃皿中,加变性液至浸没凝胶块,摇床轻摇45min;
2)将变性液倒出,超纯水冲洗2次;
3)加中和液至浸没凝胶块,摇床轻摇15min;
4)将中和液倒出,超纯水冲洗,摇床轻摇15min;
5)倒出中和液,加20×ssc摇床轻摇平衡至少10min。
(6)转膜
1)大培养皿中加300ml10×ssc溶液作为介质,双层滤纸用10×ssc浸湿,将其覆盖在玻璃板上形成“盐桥”,用玻璃棒在滤纸上滚动出去纸间的气泡;
2)剪取和凝胶块大小相同的硝酸纤维素膜,超纯水浸泡10min,再用20×ssc
浸泡5min;
3)剪取两张和凝胶大小相同的滤纸,用2×ssc浸湿;
4)小心将预处理的凝胶倒扣放在“盐桥”上,并用玻璃棒赶走存在胶块和“盐桥”之间的气泡;
5)将处理好的硝酸纤维素膜放在凝胶上;
6)2×ssc浸湿的滤纸放在硝酸纤维素膜上;
7)2×ssc滤纸上面放置高度5~8cm的吸水纸,用玻璃板压住,其上再加500g
重物,整个装置呈平衡状态;
8)转膜过程持续约8h,期间需要更换吸水纸,确保凝胶中的dna转移到硝酸纤维素膜上;
9)转膜结束后,揭下膜,在6×ssc溶液中浸泡5min;
10)取出膜,在滤纸上干燥约10min至晾干;
11)紫外交联3min。
(7)预杂交
将硝酸纤维素膜正面朝上小心放到杂交管中,沿杂交管内壁加10ml7号液,48℃,预杂交2h;
(8)杂交
将保存在-20℃的探针取出,在离心管中加入200μl3号液,煮沸10min,立即冰浴5min,12000rpm短暂离心(使管壁的液体集中在管底)。加4ml7号液,充分混匀作为杂交液。将杂交管中的预杂交液倒出,倒入杂交液,48℃过夜杂交(12~16h)。
(9)洗膜显色
1)回收杂交液;
2)加30mlbufferⅲ到杂交管,48℃,5min;
3)重复操作2;
4)加30mlbufferⅳ到杂交管,48℃,15min;
5)倒出液体,重复操作4;
6)倒出液体,小心用镊子将硝酸纤维素膜取出置于玻璃皿中,加bufferⅱ,摇床轻摇5min;
7)倒出液体,加blcokingbuffer摇床轻摇漂洗30min;
8)倒出液体,加antibodysolution漂洗30min;
9)倒出液体,加bufferⅱ摇床轻摇15min;
10)重复操作9;
11)倒出液体,加detectionbuffer漂洗5min;
12)倒出液体,加colorsolution暗处显色30min~2h;
3、突变体敏感性测定
采用菌落直径法测定亚洲镰孢菌出发菌株2021和突变体对琥珀酸脱氢酶抑制剂的有效抑制中浓度(ec50)。将菌株接到pda平板上作为试验材料,在菌落边缘用打孔器打直径5mm的菌碟,并将其转接到含有不同杀菌剂、不同浓度的含药平板上,25℃培养3d。3d后采用十字交叉法,测量各菌落的直径。求出不同浓度的校正抑制率(%)=[(对照的菌落增长直径-处理的菌落增长直径)/对照的菌落增长直径×100],根据药剂浓度的对数(x)与抑制率对应的机率值(y),求出毒力回归曲线方程y=a+bx及ec50。敏感性测定试验共选择了4种琥珀酸脱氢酶抑制剂类杀菌剂,包括萎锈灵、啶酰菌胺、氟吡菌酰羟胺和氟唑菌酰胺。萎锈灵、啶酰菌胺、氟吡菌酰羟胺杀菌剂分别处理菌株时,sdhc1突变体设置的浓度梯度均为0、0.625、2.5、10、40、160μg/ml,sdhc2突变体设置的浓度梯度均为0、0.039、0.156、0.625、2.5、10μg/ml。氟唑菌酰羟胺处理菌株时,sdhc1和sdhc2突变体设置的浓度梯度均为0、0.0039、0.0156、0.0625、0.25、1μg/ml。将菌株活化到pda平板上作为试验材料,在菌落边缘用打孔器打直径5mm的菌碟,小心转接到含有杀菌剂的pda平板上,25℃培养箱中生长约3d,用十字交叉法测量菌落的直径。dps数据处理软件计算出对应的回归方程和ec50。每个处理重复3次,试验重复3次。
4、转化子对琥珀酸脱氢酶抑制剂的敏感性。
采用菌落直径法测定亚洲镰孢菌2021和突变体对4种琥珀酸脱氢酶抑制剂的有效抑制中浓度(ec50)。结果见表2。
表2亚洲镰孢菌对琥珀酸脱氢酶抑制剂的敏感性
由上表可知:萎锈灵药剂处理时,2021的ec50为86.95μg/ml,sdhc1敲除体的ec50分别为148.74μg/ml和139.33μg/ml,sdhc2敲除体的ec50分别是6.33μg/ml和7.07μg/ml;啶酰菌胺药剂处理时,2021的ec50为43.62μg/ml,sdhc1敲除体的ec50均大约设置的最高处理浓度160μg/ml,sdhc2敲除体的ec50分别是0.46μg/ml和0.48μg/ml;氟吡吡菌酰胺药剂处理时,2021的ec50为86.95μg/ml,sdhc1敲除体的ec50分别为14.53μg/ml和24.66μg/ml,sdhc2敲除体的ec50分别是0.22μg/ml和0.20μg/ml;氟唑菌酰羟胺药剂处理时,2021的ec50为0.05μg/ml,sdhc1敲除体的ec50分别为0.07μg/ml和0.05μg/ml,sdhc2敲除体的ec50分别是0.01μg/ml和0.02μg/ml。
亚洲镰孢菌2021的sdhc1和sdhc2被双筛片段(hph-hsv)同源置换后,sdhc1基因敲除后表现出对这类杀菌剂的敏感性显著降低,而sdhc2基因敲除后表现出对这类杀菌剂超敏感,表明sdhc1和sdhc2基因对亚洲镰孢菌对琥珀酸脱氢酶抑制剂的敏感性水平有较大的影响,且sdhc亚基遗传分化导致sdhc1基因调控亚洲镰孢菌对琥珀酸脱氢酶抑制剂的抗药性,而sdhc2基因调控亚洲镰孢菌对琥珀酸脱氢酶抑制剂的敏感性。sdhc1和sdhc2基因敲除体的回复体对琥珀酸脱氢酶抑制剂的敏感性恢复到了野生型水平。
上述结果还表明sdhc1基因敲除后,突变体表现得更不敏感,而sdhc2基因敲除后突变体表现的更敏感。即sdhc亚基分化成的两个基因分别调控镰孢菌对该类杀菌剂的抗药性和敏感性,对敏感性的调控有不同的作用机制。因此,sdhc1和sdhc2可作为药物靶标资源。
本发明所述的镰孢菌为禾谷镰孢菌和亚洲镰孢菌,但不限于禾谷镰孢菌和亚洲镰孢菌。
- 还没有人留言评论。精彩留言会获得点赞!