日本血吸虫PHB1与PHB2基因的siRNA及其应用的制作方法
本发明涉及分子生物学和生物医药
技术领域:
,尤其涉及一种日本血吸虫抗增殖蛋白1(sjphb1)与日本血吸虫抗增殖蛋白2(sjphb2)基因的sirna及其应用。
背景技术:
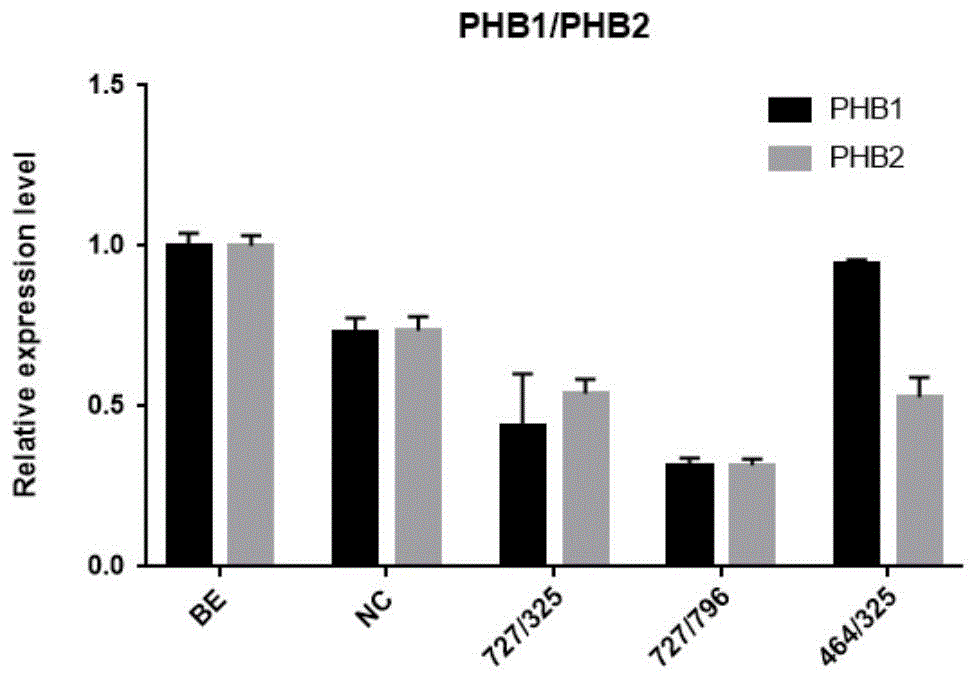
:日本血吸虫病是我国长江流域及以南地区广泛流行的人兽共患寄生虫病,严重危害流行区人畜健康并影响社会经济发展。我国血吸虫病防治取得了巨大成就,但是由于血吸虫中间宿主钉螺难以消灭及其孳生环境难以改变,该病在我国部分流行地区仍将是重要的公共卫生问题。目前吡喹酮是唯一一种在血吸虫病临床治疗和防治工作中得到广泛应用的药物。然而,近年国外学者报道了与日本血吸虫亲缘关系相近的曼氏血吸虫的吡喹酮抗性现象,国内学者也已关注到日本血吸虫对吡喹酮敏感性改变的现象。这说明有必要寻找新的治疗或预防血吸虫病的药物。抗增殖蛋白(prohibitin,phb)是一种高度保守的蛋白,广泛分布于细菌、原虫、酵母等多种生物细胞中,主要定位于细胞膜、线粒体内膜、细胞核中,参与细胞增殖、分化、衰老、凋亡等多种生物学进程。多个研究表明,phb在利什曼原虫、布氏锥虫、细粒棘球绦虫、伯氏疟原虫、科罗拉多马铃薯甲虫幼虫等寄生生物中具有重要的功能,是维持生物体组织形态和重要生理功能的基础蛋白。我们前期工作中克隆到日本血吸虫抗增殖蛋白编码基因,研究表明日本血吸虫phb基因编码两种同源亚型蛋白:sjphb1(33kda)和sjphb2(36kda)。rna干扰是双链rna(dsrna)介导的、序列特异的靶基因转录后基因沉默过程,是一种进化上保守的抵御转基因或外来病毒侵犯的防御机制。rna干扰(rnai)是指将与靶基因转录的mrna存在同源互补的双链rna导入细胞后,能特异性地降解该mrna,从而产生相应的功能表型缺失。目前该技术已经在基因功能研究,基因治疗和药物研究开发等领域得到广泛应用。小分子干扰rna(smallinterferingrna,sirna),是能够以同源互补序列mrna为靶目标并将其降解而介导rna干扰途径的短片段双链rna分子,通常由约20个核苷酸组成,能诱导特异性的转录后基因沉默。sirna已经广泛应用于基因表达调控机制研究和药物研发等领域。技术实现要素:本发明要解决的技术问题是提供一种日本血吸虫phb1与phb2基因的sirna,该sirna可明显抑制sjphb1与sjphb2基因的转录,可用于制备治疗血吸虫病的药物。此外还提供了一种日本血吸虫phb1与phb2基因的sirna在制备治疗血吸虫病的药物中的应用。为了解决上述技术问题,本发明通过如下技术方案实现:在本发明的一个方面,提供了一种特异性抑制日本血吸虫phb1与phb2基因表达的sirna,其含有与日本血吸虫phb1和/或phb2基因的靶序列杂交的核苷酸序列。所述sirna包含第一链和第二链,该第一链和第二链互补形成rna二聚体,所述sirna的第一链和第二链选自下述的一对或任意两对以上的组合:seqidno.1和seqidno.2所示的核苷酸序列;seqidno.3和seqidno.4所示的核苷酸序列;seqidno.5和seqidno.6所示的核苷酸序列;seqidno.7和seqidno.8所示的核苷酸序列。优选的,所述sirna为下述两对的组合:seqidno.3和seqidno.4所示的核苷酸序列;seqidno.5和seqidno.6所示的核苷酸序列。在本发明的另一方面,提供了一种特异性抑制日本血吸虫phb1或phb2基因表达的sirna,其含有与日本血吸虫phb1或phb2基因的靶序列杂交的核苷酸序列。所述sirna包含第一链和第二链,该第一链和第二链互补形成rna二聚体,所述sirna的第一链和第二链选自下述的一对或任意两对以上的组合:seqidno.1和seqidno.2所示的核苷酸序列;seqidno.3和seqidno.4所示的核苷酸序列;seqidno.5和seqidno.6所示的核苷酸序列;seqidno.7和seqidno.8所示的核苷酸序列。在本发明的另一方面,还提供了一种治疗血吸虫病的药物,所述药物的活性成分为:通过rna干扰抑制日本血吸虫phb1和/或phb2基因表达的sirna,该sirna含有与日本血吸虫phb1和/或phb2基因的靶序列杂交的核苷酸序列。所述sirna包含第一链和第二链,该第一链和第二链选自下述的一对或任意两对以上的组合:seqidno.1和seqidno.2所示的核苷酸序列;seqidno.3和seqidno.4所示的核苷酸序列;seqidno.5和seqidno.6所示的核苷酸序列;seqidno.7和seqidno.8所示的核苷酸序列。优选的,所述sirna为下述两对的组合:seqidno.3和seqidno.4所示的核苷酸序列;seqidno.5和seqidno.6所示的核苷酸序列。在本发明的另一方面,还提供了上述日本血吸虫phb1与phb2基因的sirna在制备治疗血吸虫病的药物中的应用。在本发明的另一方面,还提供了上述日本血吸虫phb1与phb2基因的sirna在制备预防血吸虫病的药物中的应用。本发明日本血吸虫phb1与phb2基因的sirna,可用于干扰日本血吸虫phb1与phb2基因转录、表达及血吸虫的生长发育,小鼠的体内rna干扰试验结果表明,该sirna能诱导小鼠获得40.43%(p<0.05)的减虫率,适于制备治疗血吸虫病的药物。附图说明下面结合附图和具体实施方式对本发明作进一步详细的说明。图1是本发明实施例1实时定量pcr分析体外干扰筛选效果图;图2是本发明实施例2实时定量pcr分析体内干扰效果图。具体实施方式下列实施例中,未注明具体条件的实验方法,通常按常规条件,如《分子克隆实验指南》(m.r.格林和j.萨姆布鲁克著,贺福初、陈薇和杨晓明等译,第3版,北京:科学出版社,2017)中所述的方法进行。实施例1体外rna干扰1.1sirna分子的设计与制备根据日本血吸虫phb1与phb2基因序列分别设计sjphb1与sjphb2特异的sirna分子(s1-s4,见下表1),sirna由上海吉玛制药技术有限公司合成,irrelevantsirna分子为无关对照由上海吉玛制药技术有限公司提供。表1日本血吸虫phb1与phb2基因的sirna序列与对应的靶基因序列1.2虫体收集培养与体外rna干扰20只6周龄的雄性balb/c小鼠经腹部贴片法感染日本血吸虫尾蚴,每鼠感染80条尾蚴。在感染后21d通过门静脉灌注法收集日本血吸虫虫体。用含青链霉素的dmem培养基清洗三次后转入培养皿中,用含10%胎牛血清和青链霉素的rpmi1640完全培养基清洗,置于37℃、5%co2的培养箱中培养。采用瞬时电激法向体外培养体系的虫体中转染sirna。首先用depc水溶解sirna干粉,浓度为20um;并置于冰盒避光保存。然后用dmem润洗电转杯,并于电转杯中加入70μldmem培养基和60μl稀释好的sirna溶液,将两者轻轻混匀并静置,避免产生气泡。每个电转杯中加入15对状态良好的合抱虫体,并将电转杯放入电转仪中进行电激(125v持续25μs)。电转完成后,加入适量dmem培养基并将血吸虫转移到含有预热的完全培养基中培养一段时间。电激时设置空白对照和无关rnai对照。1.3qrt-pcr检测sjphb1或sjphb2特异的sirna的干扰效果提取各干扰组和对照组的虫体rna,反转为cdna后进行qrt-pcr检测。以日本血吸虫pmsd为内参基因,以无关rna对照组中sjphb1与sjphb2基因的表达量为参照,采用2-δδct法分析不同干扰组的虫体中sjphb1与phb2基因的转录水平。sj-psmd的上游引物:5’-cctcaccaacaatttccacatct-3’(seqidno.11);下游引物:5’-gatcacttatagccttgcgaacat-3’(seqidno.12)。sj-phb1的上游引物:5’-cggtgaaggtcttattga-3’(seqidno.13);下游引物:5’-tgtacggcaggaaggtta-3’(seqidno.14)。sj-phb2的上游引物:5’-gggacagattatgatgaacg-3’(seqidno.15);下游引物:5’-tacgaatgagcagcgaca-3’(seqidno.16)。针对sjphb1与sjphb2基因的sirna干扰结果如图1所示,四种不同的dsrna分子,s2与s3sirna分子组合干扰了sjphb1与sjphb2基因的转录水平,降低了约70%,因此后续选择s2和s3sirna分子组合进行体内rna干扰试验。实施例2体内rna干扰1.方法步骤将6周龄balb/c雄性小鼠随机分为3组:s2和s3sirna共同干扰组、s2sirna干扰组、irrelevantsirna对照组。每只小鼠通过腹部皮肤贴片法攻击100±2条日本血吸虫尾蚴。于感染后10d开始,各组小鼠通过尾静脉分别注射s2与s3sirna(各1od/150μl/只)、s2sirna(1od/150μl/只)、irrelevantsirna(1od/150μl/只)。每3天注射一次,共注射4次。感染后21d时,剖杀小鼠,门静脉灌注法收集虫体并计数,以空白对照组为基准计算减虫率。同时根据前述方法分析不同干扰组虫体的sjphb1与sjphb2基因的转录水平,结果见图2。减虫率=(1-试验组平均虫荷数/对照组平均虫荷数)×100%;2.结果:体内干扰试验结果如表2所示,小鼠尾静脉注射s2和s3sirna后诱导了部分减虫率,与空白对照组相比,s2与s3sirna共同干扰可诱导小鼠获得40.43%(p<0.05)的减虫率(表2)。表2s2与s3sirna诱导小鼠减虫效果组别虫荷减虫率p值irrelevantsirna对照组70.5±11.715--s2sirna干扰组71±40.7%0.952s2和s3sirna共同干扰组42±540.43%*0.0303*表示与空白对照组的统计显著性(p<0.05).以上所述实施例仅表达了本发明的实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。序列表<110>中国农业科学院上海兽医研究所(中国动物卫生与流行病学中心上海分中心)<120>日本血吸虫phb1与phb2基因的sirna及其应用<160>16<170>patentinversion3.3<210>1<211>21<212>rna<213>人工序列(artificial)<400>1ccgaacgagccucgucauutt21<210>2<211>21<212>rna<213>人工序列(artificial)<400>2aaugacgaggcucguucggtt21<210>3<211>21<212>rna<213>人工序列(artificial)<400>3gcugccgaagauauugcuutt21<210>4<211>21<212>rna<213>人工序列(artificial)<400>4aagcaauaucuucggcagctt21<210>5<211>21<212>rna<213>人工序列(artificial)<400>5acuggcucuuugauucucatt21<210>6<211>21<212>rna<213>人工序列(artificial)<400>6ugagaaucaaagagccagutt21<210>7<211>21<212>rna<213>人工序列(artificial)<400>7ccacacauauaucguacautt21<210>8<211>21<212>rna<213>人工序列(artificial)<400>8auguacgauauauguguggtt21<210>9<211>21<212>rna<213>人工序列(artificial)<400>9uucuccgaacgugucacgutt21<210>10<211>21<212>rna<213>人工序列(artificial)<400>10acgugacacguucggagaatt21<210>11<211>23<212>dna<213>人工序列(artificial)<400>11cctcaccaacaatttccacatct23<210>12<211>24<212>dna<213>人工序列(artificial)<400>12gatcacttatagccttgcgaacat24<210>13<211>18<212>dna<213>人工序列(artificial)<400>13cggtgaaggtcttattga18<210>14<211>18<212>dna<213>人工序列(artificial)<400>14tgtacggcaggaaggtta18<210>15<211>20<212>dna<213>人工序列(artificial)<400>15gggacagattatgatgaacg20<210>16<211>18<212>dna<213>人工序列(artificial)<400>16tacgaatgagcagcgaca18当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1