一种新型冠状病毒肺炎dsRNA疫苗的制备方法与流程
本发明涉及一种用于传染病防治领域的新型冠状病毒肺炎dsrna疫苗的制备方法,属于疫苗制备方法技术领域。
背景技术:
人类冠状病毒(hcov229e和hcovoc43)可引起达30%的感冒。动物冠状病毒,如猪胃肠炎冠状病毒(tgev)、小鼠肝炎冠状病毒(mhv)、鸟传染性气管炎冠状病毒(ibv)等可感染相应宿主的呼吸道、胃肠道、神经系统和肝脏,导致相应症状。冠状病毒的包膜呈花瓣形突起,使冠状病毒看起来像王冠(拉丁语,corona),其核衣壳是可变的长螺旋形。冠状病毒的病毒粒子直径为60nm~140nm,球形,病毒基因组是27kb~32kb的单链正义rna,是所有rna病毒基因组中最大的。2003年冠状病毒的一个变种引起了严重急性呼吸综合征即非典(sars)的爆发,sars-cov基因组大小为27~3lkb,有14个开放读码框(openreadingframe,orf)和1个s2m模序(s2mmotif)。
石正丽等报道从5名病人体内获得了基本一致的ncov-2019全基因组,其中有79.5%的序列与sars-cov一致,通过对其保守的7个非结构蛋白进行对比,发现ncov-2019属于sarsr-cov的包膜rna病毒。ncov-2019含有5'非翻译区(utr)、复制酶复合体(orf1ab)、s基因、e基因、m基因、n基因、3'utr以及几个未知的非结构性开放式阅读框架。对于ncov-2019的基因诊断(pcr),目前中国疾病预防控制中心推荐了针对新型冠状病毒ncov-2019的开放读码框1ab(orf1ab)、核壳蛋白(nucleoprotein,n)基因区域的引物和探针序列,其中:target1(orf1ab):正向引物(f):ccctgtgggttttacacttaa;反向引物(r):为acgattgtgcatcagctga;探针(p):5'-fam-ccgtctgcggtatgtggaaaggttatgg-bhq1-3'。target2(n):正向引物(f):ggggaacttctcctgctagaat;反向引物(r):cagacattttgctctcaagctg;荧光探针(p):5'-fam-ttgctgctgcttgacagatt-bhq1-3'。ncov-2019全基因组序列和功能的分析(anovelcoronavirusfrompatientswithpneumoniainchina,2019.thenewenglandjournalofmedicine,2020,january24)也为ncov-2019的进一步研究奠定了良好的基础,但目前尚缺少有关ncov-2019的更确切信息。
国际流行病防范创新联盟(cepi)首席执行官理查德·哈切特(richardhatchett)于2020年1月23日表示,他所在的机构已首轮投资1500万美元进行新型冠状病毒疫苗的研制,若进展顺利,有望6个月后开始临床测试。2020年1月26日,中国疾病控制中心表示,该中心开始启动新型冠状病毒疫苗的研发,目前已经成功分离病毒,正在筛选种子毒株。2020年1月26日,浙江大学传染病诊治国家重点实验室李兰娟院士也表示分离到3株新型冠状病毒,为下一步的疫苗研究奠定了基础。疫苗可分为减毒活疫苗、灭活疫苗、亚单位疫苗、dna疫苗、重组载体疫苗、病毒颗粒样疫苗和多肽疫苗等。传统疫苗多为死疫苗、减毒活疫苗或重组亚单位疫苗,而新型疫苗则为编码抗原蛋白的病毒核酸或能激发特异性免疫应答的细胞疫苗。现有的传统疫苗主要靠病原体的抗原蛋白刺激机体产生保护性抗体,现有的新型疫苗除此之外还能激发特异性细胞免疫应答。鉴于2019-ncov的生物学特性还不太明了,传染性很强,应该注意到,活疫苗不具有安全性而且制备困难,灭活疫苗可能会与野毒株重组而回复,只宜作为应急储备。相比之下,基于现代生物技术的亚单位疫苗、dna疫苗和多肽疫苗的安全性、实用性和可操作性更强。为了减少疫苗运输、存放、接种的成本以及方便接种,常将数种不同病原体的疫苗混合在一起,称为多联疫苗,如百白破疫苗,一次接种可同时预防白喉、破伤风和百日咳。此外,为克服因毒株多型性而造成免疫效果差的缺点,常将针对同种病原体不同血清型的疫苗混合在一起,称为双价或多价疫苗,如多价hpv疫苗。但能否发明一种与抗原蛋白、抗体或细胞免疫无关的不同于现有疫苗的抗新型冠状病毒肺炎多价疫苗呢?
本发明人拟尽早公开一种基于rna干扰的新型冠状病毒双价疫苗的制备方法。rna干扰(rnainterference,rnai)是指某种小rna可以与目的基因配对结合,特异性地剔除或关闭被结合基因的表达。即rnai是指由双链rna(double-strandedrna,dsrna)诱发的同源mrna的高效特异性降解。文献报道,1995年来自复旦大学的guoshu博士在美国康奈尔大学将反义rna注入秀丽新小杆线虫(c·ele-gans)体内,试图阻断par-1基因的表达。同时她还将正义rna注入对照组线虫,以期观察到par-1基因表达增强的效果。然而对照组的par-1基因表达不仅未增强,反而与实验组一样被阻断。这种结果无法用传统的反义rna技术做出解释,但她们还是将研究结果如实地投寄给了cell杂志,并被发表。这一悬疑引起了华盛顿卡内基研究院firea博士的注意,他采用凝胶电泳将正义rna和反义rna纯化,同时故意将纯化后的正、反义rna混合在一起,制成dsrna杂合体,分别注入线虫。结果发现纯化后的反义rna基因阻抑作用显著减弱,而dsrna杂合体却高效、特异地阻断了同源mrna表达,其阻断作用超过反义rna至少100倍以上。这一结果意外地证实了dsrna在基因阻抑中发挥着重大作用。hrea将dsrna的这一作用称为rna干扰(rnainterference,rnai)。1998年,hrea将研究结果发表于nature杂志,以致迅速在全球掀起了rna干扰研究的热潮,并证实rna干扰是因dsrna注入真核细胞后,激发真核细胞内防御反应,生成dsrna诱导的沉默复合体,将与dsrna具有同源序列的mrna降解,导致基因在转录后水平沉默,丧失表达蛋白或多肽的能力。进一步的研究表明,病毒基因、人工转入基因、转座子等外源性基因随机整合到宿主细胞基因组内,并利用宿主细胞进行转录时,常产生一些dsrna。宿主细胞对这些dsrna迅即产生反应,其胞质中的核酸内切酶(dicer)将dsrna切割成多个具有特定长度和结构的小片段sirna(大约21~23bp),sirna在细胞内rna解旋酶的作用下解链成正义链和反义链,由反义sirna再与体内一些酶(包括内切酶、外切酶、解旋酶等)结合形成rna诱导的沉默复合物(rna-inducedsilencingcomplex,risc)。risc与外源性基因表达的mrna的同源区进行特异性结合,risc具有核酸酶的功能,在结合部位切割mrna,切割位点即是与sirna中反义链互补结合的两端。被切割后的断裂mrna随即降解,从而诱发宿主细胞针对这些mrna的降解反应。sirna不仅能引导risc切割同源单链mrna,而且可作为引物与靶rna结合并在rna聚合酶(rna-dependentrnapolymerase,rdrp)作用下合成更多新的dsrna,新合成的dsrna再由dicer切割产生大量的次级sirna,从而使rnai的作用进一步放大,最终靶mrna被完全降解。rnai作用类似于基因剔除,但远比基因剔除简单易行,安全性高,因不是真正剔除基因,可以避免基因误剔而带来的严重后果。这为研制基于rna干扰的新型冠状病毒dsrna疫苗提供了可行的机制。
文献报道,rnai抗病毒复制的体外试验较易成功,但sirna在体内血清中易被rna酶(rnase)降解,这就需要一种理想的载体将shrna递送到细胞内表达。腺病毒重组载体技术于2004年首次应用于rnai(xiaeta1.2004),经典的腺病毒包装系统包括hek293细胞、携带外源基因的穿梭质粒、包含腺病毒基因组的骨架质粒。穿梭载体一般具有真核启动子和位于其下游的多克隆位点,插入了外源基因的多克隆位点称为外源基因表达盒。穿梭载体与骨架质粒共转染hek293细胞后,因hek293细胞提供了病毒复制所必须的e1蛋白,使穿梭载体中的外源基因转移到骨架质粒,从而使重组腺病毒颗粒被包装出来。目前研究最明确的人腺病毒包括2型(ad2)和5型(ad5),由ad5研制的腺病毒载体,已有商品化产品应用于疾病治疗及科研领域,具有感染谱广、不整合、安全、易操作、体外增殖滴度高、基因组中非必需片段大等特点,是目前应用最广泛的病毒载体,而且当e3区缺失后免疫原性增强,可能还充当免疫佐剂的免疫效应。最重要的是呼吸道上皮细胞含有丰富的腺病毒受体(car),ad5腺病毒的天然宿主是人体呼吸道上皮细胞,故复制缺陷型重组腺病毒载体能高效地感染呼吸道上皮细胞,为通过口腔、上呼吸道进行免疫接种(喷雾剂或鼻腔滴剂)提供了可能。另外,腺病毒载体表达的免疫原经宿主细胞表达、加工、折叠、修饰、提呈后基本保持了免疫原的天然构象,便于模拟自然状态下的免疫反应,而且新型冠状病毒主要通过呼吸道感染,腺病毒载体疫苗可方便地制成口腔或上呼吸道喷雾剂,雾化吸入接种不仅方便,而且大大降低了使用成本,若能用腺病毒载体疫苗诱导有效的粘膜免疫反应,将具有广阔的应用前景。
雾化吸入接种是将药物或疫苗放入特定的气溶胶发生器中,将药物或疫苗雾化吸入呼吸道内,刺激呼吸道黏膜产生粘膜免疫并进一步进入肺泡发生作用。由于肺部具有巨大的肺泡表面积、丰富的毛细血管以及极小的转运距离,接种的药物或疫苗经肺吸收后可迅速的发挥药效。国外对雾化吸入治疗的研究可以追溯到上世纪五十年代,riker实验室早在1956年研发上市了首个压力定量吸入器medihaler-epitm含肾上腺素,medihaler-isotm含异丙肾上腺素。气雾免疫,直接将疫苗接种于呼吸道粘膜,不仅能提供一种生理和免疫学的优势,而且这一路线的疫苗接种也提供了潜在的后勤优势,因为它不需要训练有素的人员。因此,气雾免疫法是一种值得稳步推广的免疫方法。近代人们对雾化吸入治疗给予了巨大的关注,并且越来越多的气雾免疫药物被开发出来,在人的气雾免疫研究方面麻疹疫苗的气溶胶接种是研究最多并被证实有确切的疗效。随着科学技术的不断进步,雾化接种将会越来越完善并成为一种常规的免疫治疗途径。雾化吸入接种或给药的重点始终离不开雾化器,压缩空气雾化器需要空气压缩机来驱动雾化。压缩的高速气流通过文丘里氏管,产生文丘里效应,从而在喷嘴周围产生一个负压环境,使药液杯里的药物被高速气流带出来,通过特殊的喷嘴高速撞击挡板从而破碎成为直径为5μm的雾滴。现在压缩空气雾化器在临床上的应用比较广泛,可对麻疹、流行性感冒和卡介苗(bcg)疫苗等药物进行雾化吸入治疗和接种。
总上,虽然基于病原体抗原制备抗原性疫苗的方法以及基于抗原性疫苗接种产生免疫性抗体从而使病原体被清除的现有疫苗的制备方法已得到广泛应用,但未见基于病原体保守基因组制备dsrna疫苗的方法以及基于dsrna疫苗接种产生基因沉默复合物从而使病原体同源mrna被降解的dsrna疫苗制备方法的文献报道和应用。
技术实现要素:
本发明的目的在于解决现有技术未见基于病原体保守基因组制备dsrna疫苗的方法以及基于dsrna疫苗接种产生基因沉默复合物从而使病原体同源mrna被降解的dsrna疫苗制备方法的文献报道和应用的不足,提供一种不同于传统工艺的新型冠状病毒肺炎dsrna疫苗的制备方法
本发明的目的是这样实现的:扩增ncov2019的靶向干扰基因shrna序列,所扩增的shrna序列与空干扰载体psilencer4.1.cmv.neo经bamhi和hindiii酶切而构建干扰载体psilencer-shrna,该干扰载体经感受态大肠杆菌dh5a扩增并经鉴定shrna插入无误后与空穿梭载体pdc312经hindlii和ecori酶切而构建穿梭载体pdc312-shrna,该穿梭载体与腺病毒骨架质粒pbhgloxael共转染hek293细胞,在该细胞内进行同源重组而获得重组腺病毒ad-shrna,再经hek293细胞多次扩增后制备重组腺病毒载体的ad-ncovdsrna疫苗。
进一步的,所述靶向干扰基因shrna序列是指相对保守的ncov2019功能基因组,目前指orf1ab、3'utr、s、e、m、n基因序列。
进一步的,所述靶向干扰基因shrna是指利用shrna在线软件获得长度为19nt的sirna序列,与其互补的保守序列被选为干扰的靶位点。
进一步的,所述靶向干扰基因shrna为表达发夹结构的shrna模板,每个模板由两条大部分互补的单链dna构成,经退火互补后能形成带有bamhi和hindiii酶切位点粘性末端的dna双链。
进一步的,所述ad-ncovdsrna疫苗指携带shrna的重组腺病毒载体进入呼吸道或消化道上皮细胞后,其中的shrna能在细胞内合成dsrna,所合成的dsrna能特异性降解具有同源序列的mrna,使之丧失表达蛋白或多肽的能力;所述ad指复制缺陷型重组腺病毒载体;所述ncov2019指新型冠状病毒的保守基因或功能基因的靶向干扰序列。
本发明的有益效果在于:本发明具有见效快、效果好、使用安全、接种方便等优点。首先,本发明创新了疫苗制备的机制和观念。在传统观念上,疫苗就是抗原,或虽非直接抗原但也是能被转化为抗原的,如dna疫苗,通过编码mrna产生蛋白质抗原,所以现有的疫苗通常为抗原性疫苗,通常通过疫苗接种刺激机体产生抗体,经抗原抗体反应而起免疫作用。而本发明是基于病原体保守基因组或功能基因制备dsrna疫苗,通过rna干扰而起抗病毒作用,整个过程没有抗体参与。更重要的是,本发明能在接种后快速产生抗病毒作用,当本发明经喷雾接种后,重组腺病毒载体将疫苗导入呼吸道感染细胞,疫苗中的shrna立即产生dsrna,进而激活核酸酶,即时降解同源的病毒mrna,很快使病毒失去致病力。而现有的疫苗要等产生抗体后才起免疫作用,这个病毒性抗体的产生通常需要2~3周。所以本发明与现有技术相比,具有紧急预防的突出效果。此外,本发明的载体为复制缺陷型腺病毒,具有使用安全、稳定表达和易操作等优点,因能高效感染呼吸道上皮细胞而为通过口腔、上呼吸道进行免疫喷雾接种提供了依据,理论上更适合于新型冠状病毒肺炎的预防。
附图说明
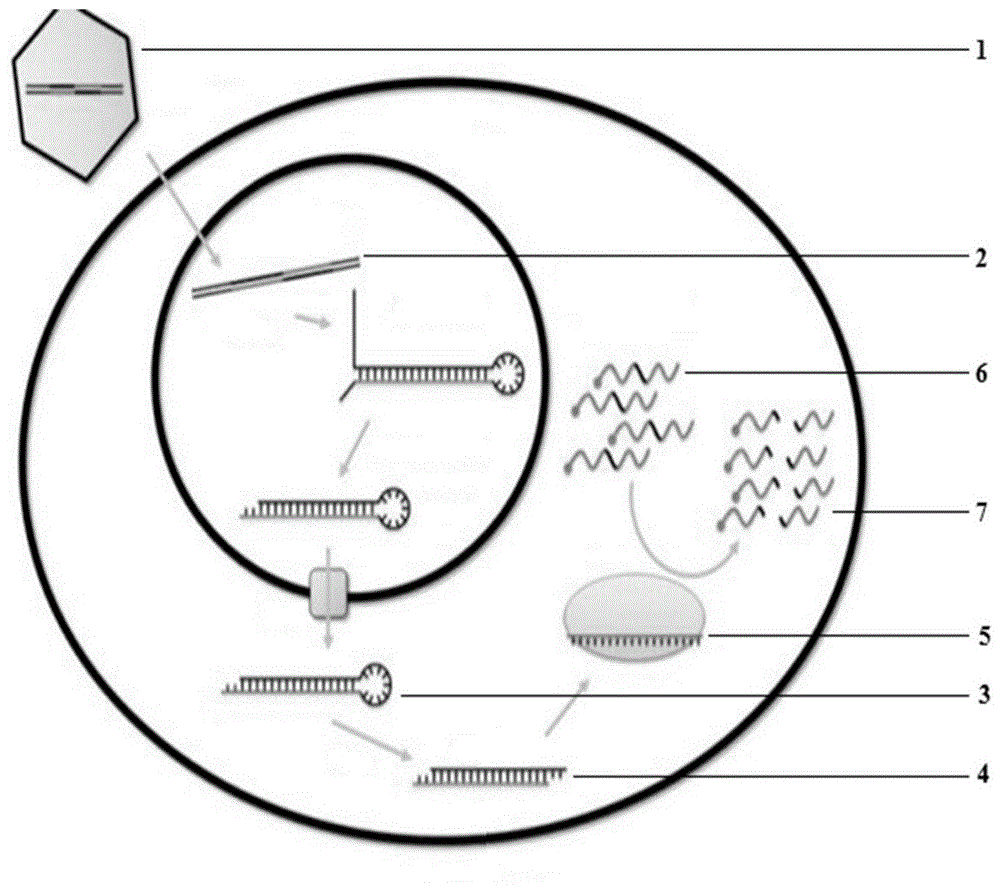
图1是本发明提出的一种新型冠状病毒肺炎dsrna疫苗的作用示意图。
图1中,重组腺病毒载体ad1、病毒dna2、shrna3、dsrna4、risc5、反义sirna与外源基因表达的mrna结合物6、被降解的外源基因7。
下面结合图1,对本发明的具体实施方法作详细的描述。
1、新型冠状病毒rnai靶位点的选择及其shrna干扰载体的构建
(1)rnai靶位点的选择及sirna表达模板的设计:根据已测序得知的新型冠状病毒orf1ab、3'utr、s、e、m、n基因序列,利用ambion公司的shrna在线设计软件(http://www.ambion.com/techlib/misc/sirnatools.html)获得长度为19nt的多个sirna备选序列,根据rna结合的tm值及特异性比对结果,优选sirna序列,与其互补的基因组区域被选为干扰的靶位点,结合psilencer4.1.cmv.neo干扰载体的多克隆酶切位点设计出可以表达发夹结构的shrna模板,每个模板由两条大部分互补的55bp的单链dna构成,退火互补后能形成带有bamhi和hindiii酶切位点粘性末端的dna双链,用于与线性化干扰载体psilencer4.1.cmv.neo的连接。
(2)shrna表达载体的构建:将上述寡核苷酸链进行退火互补与线性化的shrna表达载体psilencer4.1.cmv.neo进行连接,构建shrna表达质粒,并转化至感受态细胞dh5a。退火互补和载体连接的具体方法如下:
①寡聚dna退火:将合成的寡核苷酸用ddh20溶解成100μm,两两互补单链各取5μl进行混合,然后将6种oligodna混合液放置在98℃水浴锅中加热5min,关闭水浴锅开关使其自然冷却到室温,使双链dna形成,退火体系如下:100μm正链寡核苷酸:5μl;100μm负链寡核苷酸:5μl;10xpcrbuffer:2μl;ddh20:8μl;总体积20μl。
②载体连接:将合成的双链dna进一步稀释成10nm,16℃连接30min。酶连接体系如下:psilencer4.1.cmv.neo:4μl;5xligationbuffer:2μl;dsoligo(10nm):4μl;t4dna连接酶(1u/μl):1μl;ddh20:9μl;总体积:20μl。构建psilencer-orf1ab、psilencer-3'utr、psilencer-s、psilencer-e、psilencer-m、psilencer-n载体。
③载体的鉴定:将连接产物转化大肠杆菌感受态细胞dh5a,每个重组载体平板挑选6个克隆进行测序鉴定,确定插入片段正确后,保存备用。
2、shrna干扰载体的效果鉴定
通过构建荧光标签载体并与shrna干扰载体共转染293t细胞进行鉴定。
(1)orf1ab、3'utr、s、e、m、n基因荧光标签载体的构建
①orf1ab、3'utr、s、e、m、n基因引物设计:根据中国国家基因组科学数据中心(ngdc)发布的新型冠状病毒(ncov-2019)基因组序列(序列号为gwhabkf00000000、gwhabkg00000000、gwhabkh00000000、gwhabki00000000、gwhabkj00000000),选择保守区域设计所需的下、下游引物,或根据新发新型冠状病毒毒株的基因测序结果设计所需引物。本发明以ncov-2019的orf1ab、3'utr、s、e、m、n基因为实施例,参照网上在线的引物设计软件,根据不同载体、酶切位点、鉴定需要,委托生物公司按要求设计所需的引物,上游引物5'端添加起始密码,为将扩增产物克隆到pegfp-n1中,引物的5'端添加用于与载体发生同源重组的同源臂。
②orf1ab、3'utr、s、e、m、n基因的扩增:基因扩增反应体系及反应条件按上海生工提供的试剂盒进行,基因扩增产物经回收纯化备用。
③pegfp-n1载体的线性化:复苏含有pegfp-n1质粒的dh5a菌种,按试剂盒或文献提取质粒,测定浓度后进行酶切,酶切体系如下:10xmbuffer:5μl;质粒dna:20μl;hindiii:2μl;ddh20:23μl;总体积:50μl。将混合液混匀后置于37℃水浴锅中酶切2h,0.8%琼脂糖凝胶电泳鉴定并回收线性化的载体备用。
④pegfp-orf1ab、pegfp-3'utr、pegfp-s、pegfp-e、pegfp-m、pegfp-n载体的构建:使用金斯瑞公司的同源重组试剂盒进行连接,体系及条件如下:线性化载体(100-200ng/μl):6μl;纯化的pcr产物:8μl;10xcloneezbuffer:2μl;cloneezenzyme:2μl;ddh20:2μl;总体积:20μl。混合物配制好后轻轻混匀,25℃保持30min,之后在冰上保持5min。连接结束后可保存在-20℃备用或马上进行转化。
(2)共转染方法:分别将干扰载体psilencer-orf1ab、psilencer-3'utr、psilencer-s、psilencer-e、psilencer-m、psilencer-n与对应的荧光标签载体pegfp-orf1ab、pegfp-3'utr、pegfp-s、pegfp-e、pegfp-m、pegfp-n共转染293t细胞。干扰载体与标签载体的质量比为1:2,同时设立无关干扰孔和未干扰孔作为对照,转染后48h观察细胞内gfp蛋白的融合表达情况,根据荧光强度评价干扰效果。
(3)共转染后的流式细胞检测:为将不同干扰载体的干扰效果进行定量分析,用流式细胞术检测试验的细胞,分析表达荧光蛋白的细胞在总细胞数中的比例。流式细胞分析方法操作步骤如下:
①将试验的细胞用胰蛋白酶从细胞板上消化下来并吹打为单个细胞,转入1.5ml离心管。
②将细胞悬液细胞40c300xg离心10min,弃上清,加入预冷pbs进行洗涤。
③重复步骤(2)3次后充分悬浮细胞,并将细胞吹打为单个。
④取适当数量细胞上机检测,检测方法采用guavaexpressplus方法,每秒钟通过细胞数保持在800个以下。
⑤检测数据保存后用flowjo流式分析软件进行结果的分析与统计。
(4)orf1ab、3'utr、s、e、m、n蛋白的westernbolt分析
①细胞的收集与裂解:采用ripa组织裂解液裂解细胞,具体步骤如下:
a.将细胞用pbs洗涤1次备用;以10μl的pmsf与lmlripa混合的比例将裂解液配好,现用现配;
b.每孔按加入150-250μl的裂解液,用移液器吹打数次,使裂解液与细胞充分接触;
c.裂解后的样品12000xg离心3.5min,取上清备用。
②蛋白样品的sds-page电泳:
将样品加入等体积的2xsds上样缓冲液,沸水煮5min,冰浴2min,12000xg,10min,sds-page胶的制备如下:
a.按照垂直电泳装置的使用方法,将玻璃板洗净晾干后开始装配,保证良好的密封性。先配制分离胶。
b.按下列成分配制10ml15%分离胶:30%丙烯酰胺混合液:5.0ml;1.5mtris(ph8.8):2.5ml;10%过硫酸铵:o.1ml;10%sds:0.1ml;temed:0.004ml;ddh202.3ml。最后加入temed,分离胶配好后迅速混匀,用移液器将配好的凝胶溶液在玻璃板的一端注入到间隙中,当胶面距玻璃板边缘3cm左右时停止加液。并在胶的顶端加入ddh20,当凝胶完全凝集后将水倒掉,用滤纸小心吸干凝胶上的残余的液体。
c.浓缩胶的制备t按下列成分配制2ml5%的浓缩:30%丙烯酰胺混合液:o.33ml;1.0mtris(ph6.8)0.25ml;10%过硫酸铵:o.02ml;10%sds0.02ml;temed0.002ml;h201.4ml。浓缩胶配好后迅速混匀,temed最后加入,用移液器将配好的凝胶溶液在玻璃板的一端注入到间隙中,加完后轻轻插入梳子防止产生气泡,除去流出的多余凝胶。
d.浓缩胶凝固后拔下梳子。
e.将凝胶在制胶架上拆下,装在电泳装槽内,加入1xtris-甘氨酸电泳液,先外后内,最后点样,每孔20此。
f.浓缩胶电泳使用80v电压,待样品进入分离胶后,调整电压为120v直到电泳结束(溴酚蓝进入到电泳液中)。
g.小心的取下凝胶,用考马斯亮蓝r-250染色液在水平摇床上进行染色中,更换脱色液后再在水平摇床上过夜脱色,其间更换脱色液,直至观察到的凝胶上出现清晰条带为止。
③westernblot检测。
a.转膜:将未染色凝胶放入转膜缓冲液,将滤纸和pvdf膜剪至与凝胶大小相近,但略小一些。用无水甲醇将pvdf膜短暂浸泡后再放入转膜缓冲液,滤纸直接在转膜缓冲液中浸透。组合转膜的装置(从下至上的顺序):滤纸(3层)、pvdf膜(1层)、凝胶、滤纸(3层),组装好后放入电泳夹具中并放到转印槽内,150ma恒流转印120min。
b.封闭:将膜取出,放入10ml2.5%pbst稀释的脱脂奶中,摇床振摇lh。
c.一抗结合:将膜放入装有10ml用2.5脱脂奶中稀释的一抗中(抗gfp单克隆抗体、抗ib-actin单克隆抗体),摇床振摇1h。
d.洗涤:用pbst洗涤3遍。
e.二抗结合:将pvdf膜放入装稀释1:800稀释的二抗中,摇床振摇1h。
f.洗涤:用pbst洗涤3遍。
g.显色:将膜使用天根hrp-dab底物显色试剂盒进行显色。
h.用去离子水洗涤终止显色,观察结果。
(5)转染细胞orf1ab、3'utr、s、e、m、n的相对表达量检测。
a.检测转染细胞中orf1ab、3'utr、s、e、m、n基因的相对表达量,定量评价不同干扰载体的干扰效果,采用相对荧光定量rt-pcr检测方法。
b.对样品的目的基因转录进行相对定量检测时,分别根据标准曲线方程,由ct值换算出目的基因以及b-actin内参基因拷贝数。以b-actin内参基因校正病毒基因mrna相对表达量(目的基因拷贝数/b-actin拷贝数)。
3、干扰2019ncov复制的重组腺病毒穿梭载体(pdc312-2019ncov)构建
(1)shrna干扰载体中shrna表达盒的转移
常规提取shrna干扰载体(psilencer-orf1ab、psilencer-3'utr、psilencer-s、psilencer-e、psilencer-m、psilencer-n)和pdc312或pshuttle腺病毒穿梭载体,同时使用限制性内切酶hindlii和ecori进行酶切,将shrna干扰载体中的shrna表达盒切下,并将pdc312载体进行线性化。
酶切体系如下:10xmbuffer:5ul;质粒dna:20ul;hindiii:2ul;ecori:2ul;ddh20:2lul;总体积50ul。
回收线性化载体及shrna表达盒,按如下体系连接:pdc312/pshuttle:2ul;shrna表达盒:4ul;5xligationbuffer:4ul;t4dna连接酶(1u/ul):1ul;ddh20:9ul;总体积20ul。
将连接产物转化大肠杆菌感受态细胞dh5a,隔夜培养后挑取4个克隆进行测序鉴定,确定插入片段正确后,将该重组载体命名为pdc312-ncov2019(pdc312-orf1ab、pdc312-3'utr、pdc312-s、pdc312-e、pdc312-m、pdc312-n),并保存备用。
(2)重组腺病毒穿梭载体(pdc312-ncov2019)鉴定引物的设计
根据genbank发布的ad5序列以及中国国家基因组科学数据中心发布的ncov-2019基因组序列,由上海生工公司设计可以扩增orf1ab、3'utr、s、e、m、n区域880bp片段的引物(如orf1ab:f:ccctgtgggttttacacttaa;r:acgattgtgcatcagctga。n:f:ggggaacttctcctgctagaat;r:cagacattttgctctcaagctg),用于重组腺病毒(pdc312/pshuttle)的鉴定。
(3)重组腺病毒(ad-2019ncov)的包装与扩增
标题中ad代表重组腺病毒载体,2019ncov或ncov2019一样,代表ad中可用于靶向干扰的新型冠状病毒的保守或功能基因位点,如orf1ab、3'utr、s、e、m、n。本发明采用admax的双质粒转染系统进行重组腺病毒的包装,常规进行hek293细胞的转染。腺病毒骨架载体pbhgloxael与腺病毒重组穿梭载体(pdc312-2019ncov)的转染比例为质量比1:3。转染后每天观察细胞病变情况,大约8d左右待,80%细胞出现cpe时准备收毒。将待收毒的细胞瓶/培养板冻融3次,使细胞破裂崩解,细胞内的病毒得到充分释放。将冻融液离心并收集含病毒的上清液,3000xg4℃离心lomin后取上清保存备用。将收获的第一代重组腺病毒(ad-2019ncov)反复感染hek293细胞增殖病毒,提取第三代病毒应用dna提取试剂盒提取dna,进行pcr鉴定。
(4)ad-2019ncov滴度测定
重组腺病毒滴度的测定采用快速腺病毒感染性滴度(tcidso)检测试剂盒。通过一系列稀释的病毒样品感染293细胞,每个稀释度感染8个细胞孔,经过大约10d的培养后,在显微镜下对每个细胞孔内是否存在病毒引起的细胞病变进行判断,通过出现噬斑的孔数计算出腺病毒的滴度。
4、ad-2019ncov(dsrna)干扰2019ncov复制的验证
①体外验证:为研究重组腺病毒ad-2019ncov对2019ncov复制的干扰效果,将ad-ncov2019以lo、50、100、250、500个moi接种于12孔板培养的hek293细胞中,同时使用仅含有cmv启动子的未包括shrna模板序列的对照病毒ad-cmv作为对照病毒接种。感染24h后再接种2019ncov株(临床分离),将只接种2019ncov的细胞作为阳性对照细胞。2019ncov感染48h后收集细胞进行检测。对各组细胞进行2019ncov基因(orf1ab、3'utr、s、e、m、n)相对表达量的检测,评价干扰效果。
②动物试验:
a.实验动物:wistar大鼠在spf级的动物实验室中培养,雌雄各半,6~8周龄,体重110+10g,记录动物生产合格证号。
b.ad-ncov2019(dsrna)准备:结合真核发酵技术和腺病毒柱层析纯化技术,ad-ncov2019(dsrna)自行扩增、cscl两次离心纯化,滴度为5x1010pfu/ml。
c.拟定实验方法
a.ad-ncov2019(dsrna)滴鼻对照组(空载体对照组),先用3%戊巴比妥腹腔注射麻醉,5分钟后滴鼻,o.5ml/只,剂量1×107pfu/dose/rat。
b.ad-ncov2019(dsrna)滴鼻组,同上麻醉,5分钟后滴鼻,剂量1×107pfu/dose/rat。
c.ad-ncov2019(dsrna)尾静脉注射对照组(空载体对照组),剂量1×107pfu/dose/rat。
d.ad-ncov2019(dsrna)尾静脉注射组,尾静脉注射给药,剂量1×107pfu/dose/rat。
e.空白对照组,尾静脉注射pbs,o.5ml/只鼠。
f.饲养方法:上述各组大鼠同等暴露于已确诊的ncov2019患者的分泌物中或含ncov2019毒株的环境中。
以上各组,每组10只动物。
g.观察和取样:观察大鼠的发病情况,检测第0、1、2、3、4周样本的ncov2019。
h.ncov2019诊断:参照目前市售pcr试剂盒检测诊断。
i.根据上述实验结果判断ad-ncov2019(dsrna)干扰ncov2019复制的效果。
j.命名:如果上述结果证明ad-ncov2019(dsrna)能有效干扰ncov2019复制,则将ad-ncov2019(dsrna)命名为“新型冠状病毒dsrna疫苗”或“ncov2019-dsrna疫苗”
5、ncov2019-dsrna疫苗的批量制备
(1)取上述制备的重组腺病毒包装hek293细胞,37℃水浴-液氮冻融细胞3次。每次融解后涡旋振荡,利于细胞裂解(如用已制备的ncov2019-dsrna疫苗作进一步的批量制备,则从下述第7步开始操作)。
(2)离心,去除细胞碎片。
(3)在60mm培养板(24孔板)内接种293细胞,1×106细胞/250ul/孔,用无血清rpmi1640过夜培养至75%融合。
(4)加入细胞裂解上清,250ul/孔。
(5)37℃、5%c02条件下培养,每日观察cpe(cytopathiceffect),一周内应出现cpe。
(6)当50%以上的细胞脱落时,收获细胞。
(7)参照上述步骤,反复用病变293细胞的裂解上清液感染293细胞,用150cm2培养瓶扩增细胞、制备重组腺病毒(ncov2019-dsrna疫苗):
a.将全部病毒溶解到培养液中制成储存液,以保证每瓶感染的病毒总数相同。
b.常规方法培养293细胞,长至90%~100%汇合时按150cm2培养面积接种病毒颗粒l×1010个计算,用腺病毒感染293细胞。
c.37℃培养36小时左右,在此期间观察腺病毒的扩增情况,随细胞病变的发展,细胞变圆,折光度改变,开始从培养瓶的表面脱落。
(8)重组腺病毒(ncov2019-dsrna疫苗)纯化、浓度检测及贮存
a.吹打293细胞,将细胞转移至离心管。
b.4℃,1500g离心20分钟。
c.收集上清(supematant#1),储存于4℃离心管。
d.用25ml无菌100mmtris-hci(ph7.4)重悬细胞沉淀。
e.在37℃水浴-液氮中反复冻融细胞3次。每次融解后旋涡振荡,促进细胞裂解。
f.4℃,1500g离心20分钟,收集上清(supematant#2)。
g.混合supematant#1和supematant#2。
h.将bottle-topfilterunit,放入超净台内,开盖,把pre-filterdisc放在0.45micronfilter上面。
i.将bottle-topfilterunit与真空泵连接。
j.真空泵置vacuumoff档,往pre-filter加loml的100mmtris-hci(ph7.4),使pre-filter与0.45micronfilter紧贴。
k.小心将细胞裂解上清倒入bottle-topfilterunit。
h.真空泵置vacuulnon档,当collectionvessel接满后,断开真空泵,将滤过液转至消毒瓶内。若bottle-topfilterunit堵塞,换另一个bottle-topfirerunit。
l.在滤过液内加入终浓度为10unitsbenzonase/ml的benzonasenuclease(novagen),37℃孵育30min。
m.用无菌milli-qh20稀释5×dilutionbuffers和5×washbuffers至1×浓度。
n.将等体积的滤过液和1×dilutionbuffer混合。
o.纯化腺病毒。
p准备好以下物品:tubingassembly和bdadeno-xpurificationfilter:1×washbuffer、1×elutionbutter;无菌pbs:1×formulationbuffer;5-ml、20-ml、60-mlbdluer-loktmtip注射器;无菌15-m1、50-ml离心管。
q.连接bdadeno-xpurificationfilter和tubingassembly。
r.将纯化系统与真空泵连接,把tubingassemblya一端放入无菌pbs中,缓慢打开真空泵,抽取10~20ml无菌pbs使之通过bdadeno-xpurificationfilter和tubingassembly,关闭止水夹,关闭真空泵,以去除bdadeno-xpurificationfilter和tubingassembly中的气泡。
s.把tubingassembly管放入病毒液中。
t.缓慢开启真空泵,用止水夹将流速控制在20ml/min左右。过滤后,夹紧tubingassembly管,卸下真空泵管。
u.从接收瓶卸下tubingassembly,放入1×washbuffer。
v.将washbuffer用bdadeno-xpurificationfilter滤过,流速20ml/min。
w.卸下tubingassemblyb,tubingassemblya留作下步洗脱用。
x.洗脱腺病毒:将20ml注射器接到bdadeno-xpurificationfilter入口端。同时将tubingassembly接到出口端,然后放入装有20m11×elutionbuffer的离心管中。抽取l×elutionbuffer,注射器内即为纯化的腺病毒,将之转入50ml离心管。
y.用bdadeno-xtmrapidtiterkit测定腺病毒滴度。
z.重组腺病毒(ncov2019-ad-dsrna疫苗)保藏:置-70℃保存备用。所制重组腺病毒(ad)中携带了新型冠状病毒(ncov2019)靶向干扰基因(orf1ab、3'utr、s、e、m、n)shrna序列,称为ad-ncovdsrna疫苗,其中的shrna能产生dsrna,进而产生rna干扰。将ad-ncovdsrna与水配成喷雾剂。
如图1所示,当本发明的疫苗随腺病毒载体(1)进入细胞内时,疫苗的dna(2)合成shrna(3),shrna(3)被核酸酶脱掉发夹结构而生成dsrna(4),并进一步被切割成小片段rna(sirna)后生成沉默复合物risc(5),risc(5)使致病基因表达的mrna6切割成断裂的mrna(7)而被降解。
- 还没有人留言评论。精彩留言会获得点赞!