类器官病毒感染模型的构建方法和应用与流程
本发明属于生物医药和细胞工程
技术领域:
,具体涉及类器官病毒感染模型的构建方法和应用。
背景技术:
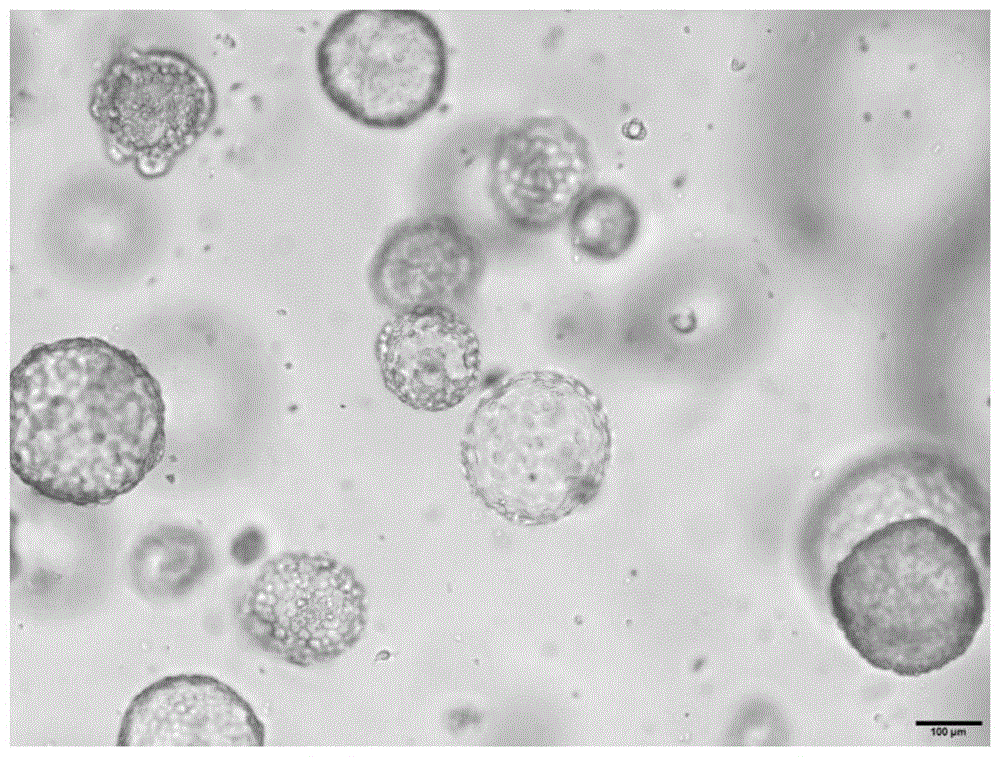
:冠状病毒是一个广泛的病毒家族,目前已知六种(229e、nl63、oc43、hku1、mers-cov和sars-cov)可感染人并引起呼吸道疾病的冠状病毒,sars-cov-2则是第七种致病的冠状病毒,可引起致命的呼吸系统疾病,具有很强的传染性和致病性。传统的病毒研究过程中,会采用细胞株如非洲绿猴肾细胞(vero、agmk、bgm)和人胚肺成纤维细胞等接种病毒,扩增培养后分离病毒,再接种到动物模型如小鼠、大鼠、豚鼠和仓鼠进行病毒学研究,动物模型广泛用于病毒性疾病致病机理和对自然发生或实验引起病毒感染的防御机理的研究。但动物模型之间存在个体差异,实验结果误差较大,因此需要批量动物进行实验,严重损害动物福利;还会引起动物间病原微生物的污染,不利于管理;模型构建成功率低,周期长;而且模型数量规模小,不具有高通量筛选的可能;最关键的是新型冠状病毒的受体ace2基因在物种间存在表达差异,限制了模式动物实验结果的适用性。类器官是一种接近于体内生理条件,具有自我更新能力和自我组织能力,且具有相应组织器官功能的一类细胞团。类器官来源原代组织、胚胎干细胞和诱导多能干细胞中的其中之一,并依赖人工胞外基质(ecm)自我组织恢复成原始组织细胞结构。与传统的体外培养不同,类器官具有和原代组织类似的细胞组成和结构,并且包含小部分具有稳定基因组,自我更新和分化潜能的干细胞。另外一个重要的特点是类器官可以在体外无限扩增并可以和普通细胞一样进行冻存。另外,类器官基于ecm培养方式也提供了一种可以体外探究细胞微环境对类器官生长的影响。这些独特的优势使得类器官在学术研究和工业技术中得到了广泛的应用。通过获取少量的器官组织,便可在体外迅速扩增得到大量的类器官,用于干细胞行为研究、药物筛选、疾病模型建立和遗传筛选。从健康人体和病人中获取的类器官还可以建立类器官样本库,供世界范围内的研究者进行相关研究。基于类器官模型的特征,本发明首次提出利用人类器官构建新型冠状病毒侵感染模型,该模型的建立可以规避细胞模型和动物模型中的一些问题,较好的模拟和表征新型冠状病毒在人肺器官中感染过程,并可应用于抗新型冠状病毒药物的高通量筛选以及药物研发,以及用于病毒性疾病致病机理和对自然发生或实验引起病毒感染的防御机理的研究,具有重要的社会、经济和科学意义。技术实现要素:为了解决现有技术的不足,本发明的目的在于提供一种类器官病毒感染模型的构建方法,该模型的建立可应用于抗病毒药物的高通量筛选、毒性测定和药物研发,以及用于病毒性疾病致病机理和对自然发生或实验引起病毒感染的防御机理的研究,为病毒感染患者的临床治疗提供了新的策略。因此,在一方面,本发明提供了类器官病毒感染模型的构建方法。在一实施例中,以人肺器官为例,病毒在人肺类器官中的复制在感染后24小时达到顶峰,并且磷酸氯喹能有效抑制新型冠状病毒对人肺类器官的感染和杀伤作用。在一方面,本发明提供了前述类器官病毒感染模型的构建方法获得的3d类器官。在一方面,本发明提供了前述类器官病毒感染模型的构建方法或3d类器官在病毒研究的用途。在一方面,本发明提供了前述类器官病毒感染模型的构建方法或3d类器官在抗病毒药物的筛选、毒性测定、病毒性疾病致病机理、对自然发生或实验引起病毒感染的防御机理的研究中的用。在一方面,本发明提供了类器官培养用的培养基。在一方面,本发明提供了前述类器官培养用的培养基在培养3d类器官中的用途。附图说明图1为分离培养的人肺类器官明场照片。图2为新型冠状病毒感染类器官的流程示意图。图3为人肺类器官在感染新型冠状病毒后不同时间点使用核酸检测病毒拷贝数的结果;24h人肺类器官中的病毒拷贝数达到最高。图4为磷酸氯喹在人肺类器官构建的新型冠状病毒感染扩增模型中的作用效果。具体实施方式以下通过具体实施方式进一步描述本发明,但本发明不仅仅限于以下实施例。另外,在下面的实施例中所采用的试剂和材料也均是市售可得的,如果未明确说明,则所采用的方法和条件,也均按照公知的方法和条件进行相关处理。i.定义在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的蛋白质和核酸化学、分子生物学、细胞和组织培养、微生物学、免疫学相关术语和实验室操作步骤均为相应领域内广泛使用的术语和常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。本文使用的术语“3d类器官”,简称类器官,是指一种接近于体内生理条件,具有自我更新能力和自我组织能力,且具有相应组织器官功能的一类培养在基质胶中具有3d立体结构细胞团。术语“平面化”是指相对于3d立体培养,平面化可以理解为二维化(2d)。术语“平面化共孵育”是指类器官与病毒混合后,在没有基质胶的包裹情况下,2d培养的状态。术语“脱离平面化状态”是指2d培养的类器官经收集,重新包裹于基质胶中,进行3d培养。术语“包含/包括”涉及组合物、方法及其各自的组成部分,所述组成部分对所述方法或组合物是必要的,并且无论是否必要都仍然对未指定的要素保持开放。术语“干细胞”表示未分化的、并具有分化成所期望细胞类型(例如内皮细胞或肠上皮细胞)能力的细胞。术语“胚胎干细胞”是指具有全能性并且来源于受精之后妊娠结束前所形成的组织的细胞,所述组织包括取自妊娠期间任意时间(通常但没必要非在约10-12周妊娠前)的胎儿组织、胚胎前期组织(例如,囊胚)或胚胎组织。胚胎干细胞可直接从适合的组织(包括但不限于人组织)或从已建立的胚胎干细胞系中获得。术语“诱导多能干细胞”或“ipsc”可互换使用,是指来源于已分化的细胞的多能细胞。术语“自我更新”应当理解为表示细胞自我繁殖同时保持本发明细胞的原始增殖和分化特性的能力。这样的细胞通过分裂增殖形成克隆,所述克隆进一步分裂成克隆并由此无需外部干预而扩增成细胞群的大小,而不会进化成分化潜能更受限的细胞。术语“组织”代表从患者或动物中取得的活检材料或外植体或体外产生的组织。术语“分化”意指培养的细胞的组织特异性功能的发展。术语“培养基”意指具有用于培养细胞的营养物和物质的生长支持液体。合适的培养基的实例包括dmem、汉姆氏(ham’s)f12以及rpmi。术语“分离的”是指在不同程度上不具有在其天然状态下所见通常与其相伴的成分。“分离”指代与原始来源或环境的分离程度。ii.具体实施方式在一方面,本发明提供了类器官病毒感染模型的构建方法,其中,所述构建方法包括以下步骤:(1)将3d培养的类器官与病毒感染液混合,然后平面化共孵育,完成感染过程;(2)感染完成后,使类器官脱离平面化状态,重新回到3d培养的状态,获得分离培养的3d类器官。优选地,所述病毒感染模型是扩增的病毒感染模型。优选地,所述混合是均匀混合。优选地,步骤(1)中所述的3d类器官是新鲜获得的3d培养的类器官。优选地,所述类器官选自人类器官、鼠类器官、狗类器官、猿猴类器官、猩猩类器官,包括肺类器官、肝脏类器官、消化道类器官、肠道类器官、心脏类器官、肾脏类器官、神经系统类器官、脑类器官、鼻咽癌类器官或子宫颈类器官;优选地,所述类器官是人类器官;更优选地,所述人类器官选自人肺类器官、人肝脏类器官、人消化道类器官、人肠道类器官、人心脏类器官、人肾脏类器官、人神经系统类器官、人脑类器官、人鼻咽癌类器官和人子宫颈类器官。优选地,所述病毒选自新型冠状病毒sars-cov-2、流感病毒、艾滋病毒、sars-cov冠状病毒、mers-cov冠状病毒、黄病毒、西尼罗病毒、基孔肯雅热病毒、结核分支杆菌、埃博拉病毒、肝炎病毒和人hpv病毒;更优选地,所述病毒为新型冠状病毒sars-cov-2;更优选地,所述流感病毒为高致病性流感病毒。根据前一方面的构建方法,其中,步骤(1)中所述病毒感染液是将所述病毒用类器官培养用的培养基稀释后所获得的溶液;优选地,所述稀释的比例为1:20~1:5;更优选地,稀释的比例为1:10。优选地,使新型冠状病毒的接种量moi为10e3-10e7;更优选地,moi为10e5。优选地,步骤(1)中,所述的平面化共孵育是指类器官与病毒混合后,在没有基质胶的包裹情况下,2d培养的状态。优选地,步骤(1)中,所述类器官在matrigel基质胶(购于corning,货号:356231或bme基质胶(trevigen,3432-001-01)上与病毒平面化共孵育;更优选地,所述类器官在铺有matrigel基质胶或bme基质胶的平板孔板上与病毒平面化共孵育。优选地,步骤(2)中,所述使类器官脱离平面化状态,重新回到3d立体培养的状态是在类器官培养用的培养基中进行的。优选地,步骤(2)中,所述脱离平面化状态是指2d培养的类器官经收集,重新包裹于基质胶中,进行3d培养;优选为将类器官连同病毒液一起收集在离心管中,去除含有病毒的上清液,获取类器官沉淀,并使用pbs冲洗,优选冲洗两遍,去除pbs后,再用matrigel基质胶重新包裹类器官,进行3d培养。根据前一方面的构建方法,其中,所述类器官培养用的培养基包括基础培养基advanceddmem/f12培养基和其他维持类器官正常生长的生长因子或小分子。优选地,人肺类器官培养用的培养基包含以下组分:advanceddmem/f12;b-27;优选地,所述b-27含量为1%-4%(体积百分比,b-27母液为50x储存液,购于gibco,货号:17504044);更优选地,所述为b-27含量为2%;fbs;优选地,所述fbs的含量为2%-8%(体积百分比);更优选地,所述fbs的含量5%;egf;优选地,所述egf是megf(购于lifetechnologies,货号:pmg8043);优选地,所述egf浓度为15-40ng/ml;更优选地,所述egf浓度为25ng/ml;fgf7;优选地,所述fgf7是hfgf7(购于lifetechnologies,货号:phg0094);优选地,所述fgf7浓度为80-120ng/ml;更优选地,所述fgf7浓度为100ng/ml;noggin;优选地,所述noggin是mnoggin(购于r&d,货号:6057-ng-100);优选地,所述noggin浓度为80-120ng/ml;更优选地,所述noggin浓度为100ng/ml;jagged-1肽;优选地,所述jagged-1肽(购于anaspec,货号:as-61298)浓度为0.8-1.2μm;更优选地,所述jagged-1肽浓度为1μm;sb431542;优选地,所述sb431542(sigma,货号:s4317-5mg)浓度为8-12μm;更优选地,所述sb431542浓度为10μm;chir99021;优选地,所述chir99021(购于mce,货号:hy-10182)浓度为1-5μm;更优选地,所述chir99021浓度为3μm;blebbistatin;优选地,所述blebbistatin(购于selleck,货号:s7099)浓度为1-5μm;更优选地,所述blebbistatin浓度为5μm;青霉素/链霉素溶液;优选地,青霉素浓度为50-200u/ml,链霉素浓度为50-200μg/ml;更优选地,青霉素/链霉素浓度分别为100u/ml和100μg/ml。优选地,人肝脏类器官培养用的培养基包括以下组分:advanceddmem/f12;b-27;优选地,所述b-27含量为1%-4%(体积百分比,b-27母液为50x储存液,购于gibco,17504044);更优选地,所述为b-27含量为2%;n-乙酰半胱氨酸(购于sigma,货号:a0737-5mg);优选地,所述n-乙酰半胱氨酸浓度为0.8-1.2mm;更优选地,所述n-乙酰半胱氨酸浓度为1mm;烟酰胺(购于sigma,货号:n0636-100g);优选地,所述烟酰胺浓度为8-12mm;更优选地,所述烟酰胺浓度为10mm;r-spondin1(购于r&d,货号:4645-rs-025);优选地,所述r-spondin1浓度为400-600ng/ml;更优选地,所述r-spondin1浓度为500ng/ml;egf(lifetechnologies,货号:pmg8043);优选地,所述egf浓度为160-240ng/ml;更优选地,所述egf浓度为200ng/ml;fgf10(购于peprotech,货号:100-26);优选地,所述fgf10浓度为80-120ng/ml;更优选地,所述fgf10浓度为100ng/ml;hgf(购于peprotech,货号:100-39);优选地,所述hgf浓度为15-25ng/ml;更优选地,所述hgf浓度为25ng/ml;胃泌素(gastrin);优选地,所述胃泌素浓度为8-12nm;更优选地,所述胃泌素浓度为10nm;forskolin;优选地,所述forskolin浓度为8-12μm;更优选地,所述forskolin浓度为10μm;a83-01;优选地,所述a83-01浓度为3-8μm;更优选地,所述a83-01浓度为5μm;青霉素/链霉素溶液;优选地,青霉素浓度为50-200u/ml,链霉素浓度为50-200μg/ml;更优选地,青霉素/链霉素浓度分别为100u/ml和100μg/ml。优选地,人肠道类器官培养用的培养基包括以下组分:advanceddmem/f12;b-27;优选地,所述b-27的含量为1%-4%(体积百分比);更优选地,所述为b-27含量为2%;r-spondin1;优选地,所述r-spondin1浓度为400-600ng/ml;更优选地,所述r-spondin1浓度为500ng/ml;egf;优选地,所述egf浓度为160-240ng/ml;更优选地,所述egf浓度为200ng/ml;noggin;优选地,所述noggin是mnoggin;优选地,所述noggin浓度为80-120ng/ml;更优选地,所述noggin浓度为100ng/ml;青霉素/链霉素溶液:优选地,青霉素浓度为50-200u/ml,链霉素浓度为50-200μg/ml;更优选地,青霉素/链霉素浓度分别为100u/ml和100μg/ml。更优选地,所述人肺类器官培养用的培养基、人肝脏类器官培养用的培养基或人肠道类器官培养用的培养基包括以下组分:根据前一方面的构建方法,其中,所述构建方法还包括:(3)经过3d培养后,将步骤(2)病毒感染后的获得的分离培养的3d类器官经过破碎细胞,收集病毒,检测病毒;优选地,所述破碎为机械破碎、裂解液破碎、冻融破碎、表面活性剂破碎和/或超声破碎;更优选地,机械破碎为研磨破碎;更优选地,所述破碎为研磨和反复冻融破碎;优选地,在所述破碎细胞后,还包括沉淀浓缩病毒;更优选地,所述沉淀浓缩病毒采用包含peg/nacl沉淀,硫酸铵沉淀、蔗糖梯度差速离心等沉淀浓缩病毒;优选地;所述peg为peg-8000;优选地;所述peg的浓度为8-12%(重量百分比);更优选地,所述peg的浓度10%;优选地;所述nacl的浓度为1.7-2.6%(重量百分比)更优选地,所述nacl的浓度2.2%;更优选地,步骤(3)中,分离培养的3d类器官经过3d培养0~72小时后,优选地,分别在3d培养1h、24h和48h后,将病毒感染后的类器官经过研磨和反复冻融破碎细胞后,离心获得上清液;使所述上清液在含有10%peg-8000和2.2%nacl的溶液中沉淀病毒颗粒,并离心获得病毒粗沉淀;优选地,在4℃下10000×g离心30min获取病毒粗沉淀。优选地,步骤(3)中,所述检测病毒包括检测病毒感染效率,其包括将病毒通过核酸检测方法(taqman法),检测新型冠状病毒在细胞内的拷贝数,结合不同时间点的取样,绘制病毒在类器官中的感染复制进程;优选地,通过特异性探针检测核酸;所述特异性探针选自表3。根据前一方面的构建方法,其中,所述构建方法还包括:(4)将步骤(2)获得的分离培养的3d类器官进行抗病毒药物的药敏实验;优选地,通过cck-8法检测类器官细胞活性,同时检测病毒拷贝数;更优选地,分别在0h、24h、48h和72h通过cck-8法检测类器官细胞活性,同时检测病毒拷贝数;优选地,实验分组设置为:(i)正常人肺类器官对照组:正常人3d肺类器官培养;(ii)正常人肺类器官给药组:正常人3d肺类器官与抗病毒药物共同孵育;(iii)新型冠状病毒感染人肺类器官对照组:新型冠状病毒感染的人肺类器官培养;(iv)新型冠状病毒感染人肺类器官给药组:新型冠状病毒感染的人肺类器官与抗病毒药物共同孵育。优选地,抗病毒药物使用量为10μmol;优选地,新型冠状病毒的接种量moi=10e5。优选地,抗病毒药物为磷酸氯喹。在一方面,本发明提供了通过前一方面所述3d类器官感染模型的构建方法获得的3d类器官。在一方面,本发明提供了前一方面的3d类器官感染模型的构建方法或3d类器官在病毒研究中的用途;优选地,所述病毒选自新型冠状病毒sars-cov-2、流感病毒、艾滋病毒、sars-cov冠状病毒、mers-cov冠状病毒、黄病毒、西尼罗病毒、基孔肯雅热病毒、结核分支杆菌、埃博拉病毒、肝炎病毒和人hpv病毒;更优选地,所述病毒为新型冠状病毒sars-cov-2;更优选地,所述流感病毒为高致病性流感病毒。在一方面,本发明提供了前一方面的3d类器官感染模型的构建方法或权利要求6所述的3d类器官在抗病毒药物的筛选、毒性测定、病毒性疾病致病机理、对自然发生或实验引起病毒感染的防御机理的研究中的用途;优选地,所述筛选是高通量筛选。在一方面,本发明提供了类器官培养用的培养基,其成分如前所述。在一方面,本发明提供了前一方面的类器官培养用的培养基在培养类器官中的用途。在一些实施方案中,步骤(3)中,采用包含peg和nacl的溶液沉淀浓缩病毒过程中,peg-8000占10%,nacl占2.2%,是指含有病毒的上清液中加入干燥peg-8000和nacl后分别达到10%和2.2%,此时新型冠状病毒的沉淀浓缩效果最好。在一些实施方案中,步骤(4)中所述磷酸氯喹使用量为10μmol,新型冠状病毒的接种量moi=10e5,根据cck8试剂盒(购于mkbio,货号:mx3008-1ml)具体操作,通过酶标仪检测类器官细胞活性,病毒的拷贝数的检测同步骤(3)。在以人肺类器官为例的实施方案中,新型冠状病毒采用上述方法感染的人肺类器官,病毒拷贝数在感染后24h达到顶峰,随后降低;48h药敏实验结果显示磷酸氯喹能有效抑制新型冠状病毒对类器官的感染和杀伤作用。这是细胞和动物模型不能比拟和取代的,取得了意料不到的技术效果。本发明的优势在于:本发明首次通过感染人肺类器官,在体外实现了新型冠状病毒感染人肺组织细胞的目的,因人的类器官模型能够消除种属差异,更真实地模拟人器官组织的实际情况,是普通细胞系和小鼠模型所不能比拟的,该模型的建立可应用于抗新型冠状病毒药物的高通量筛选以及药物研发,以及用于病毒性疾病致病机理和对自然发生或实验引起病毒感染的防御机理的研究。并为其他类型病毒致病机制的研究以及抗病毒药物的体外高通量筛选提供了新的思路和方法,为病毒感染患者的临床治疗提供了新的策略。实施例1:人肺类器官的分离与培养1.取肺脏手术切除的肺组织,置于4℃预冷的基础培养基中,基础培养基成分为:advanceddmem/f12培养基、青链霉素、glutamax和hepes,用于保持组织细胞的活性。2.将步骤1获得的肺组织用手术剪将其剪成0.5mm3的小块,并转移到15ml离心管中,加入10ml清洗培养基(成分为:dmem培养基、1%胎牛血清、1%青链霉素)反复吹打,获得肺组织小块。3.将步骤2获得肺组织小块静置沉降,去除上清。再加入10ml清洗培养基,吹打混匀,获得肺组织小块。4.将步骤3获得肺组织小块尽可能地去除多余的清洗培养基,加入37℃预热的消化培养基,其成分为离析酶ii(购于sgima,d4693-1g),终浓度为0.125mg/ml,添加脱氧核糖核酸酶i,终浓度为0.1mg/ml。室温孵育45min,进行组织消化。5.消化结束后,使用移液器吹打均匀,细胞悬液依次通过100μm、70μm和40μm滤网,获得过滤后的细胞。6.将步骤5获得的过滤后的细胞用dmem补齐至50ml。以160×g,4℃,离心15min,去上清,获得离心后的细胞。7.将步骤6获得的离心后的细胞用2ml红细胞裂解液重悬细胞,加入13mldmem快速终止裂解反应。以160×g,4℃,离心15min,去上清,将细胞沉淀重悬于1mldmem中,获得细胞悬液。8.染色:将如下流式抗体:cd31-apc(biolegend,102509)、cd45-apc(biolegend,103111)、epcam-pe(abcam,ab157319)以及mhcii-pb(biolegend,107619)均以1:100比例加入步骤7获得的细胞悬液中,4℃避光孵育30min,获得具有荧光标记的细胞。9.将步骤8获得的荧光标记的细胞用pbs清洗多余抗体,以160×g,4℃,离心15min,去上清。将离心后的细胞重悬于1mlpbs中,获得细胞悬液。10.将步骤9获得的细胞悬液进行流式分选以获得肺泡ii型细胞,其分选策略为cd45-cd31-epcam+mhcii+。11.将步骤10分选出的肺泡ii型细胞按每5000个细胞与50μlmatrigel基质胶混合,种于24孔板中,待matrigel基质胶凝固后,加入人肺类器官培养用的培养基,获得分离培养的人肺类器官,其处于3d培养状态,在37℃的co2培养箱中,培养7天,其明场照片如图1所示。其中,人肺类器官培养用的培养基包含以下组分:advanceddmem/f12b-27(2%,体积百分比)fbs(5%,体积百分比)megf(25ng/ml)mfgf7(100ng/ml)mnoggin(100ng/ml)jagged-1肽(1μm)sb431542(10μm)chir99021(3μm)blebbistatin(5μm)青霉素/链霉素溶液(青霉素/链霉素浓度分别为100u/ml和100μg/ml)实施例2:人肝类器官的分离与培养1.取肝脏手术切除的肝组织,置于4℃预冷的基础培养基中,基础培养基成分为:advanceddmem/f12培养基、青链霉素、glutamax和hepes,用于保持组织细胞的活性。,获得肝组织小块2.将步骤1获得的肝组织用手术剪将其剪成0.5mm3的小块,并转移到15ml离心管中,加入10ml清洗培养基(成分为:dmem培养基、1%胎牛血清、1%青链霉素)反复吹打。3.将步骤2获得肺组织小块静置沉降,去除上清。再加入10ml清洗培养基,吹打混匀,获得肝组织小块。4.将步骤3获得肺组织小块尽可能地去除多余的清洗培养基,加入37℃预热的消化培养基,其成分为胶原酶d(购于roche,货号:1108866001),终浓度为2.5mg/ml,添加脱氧核糖核酸酶i,终浓度为0.1mg/ml。室温孵育30min,进行组织消化。5.消化后的组织经静置沉降3分钟后,取上清液至另一15ml离心管中,1200rpm离心5min,收集细胞沉淀。6.用清洗培养基重悬步骤5收集的细胞沉淀,1200rpm离心5min,去除上清液,收集细胞沉淀。7.步骤6收集的细胞沉淀经细胞计数后,按每5000个细胞与50μlmatrigel基质胶混合,种于24孔板中,待matrigel基质胶凝固后,加入人肝类器官培养用的培养基,获得分离培养的人肝类器官,其处于3d培养状态,在37℃的co2培养箱中培养7天后可用于后续实验。其中,人肝类器官培养用的培养基包含以下组分:advanceddmem/f12b27(2%,体积百分比)n-acetylcysteine(1mm)nicotinamide(10mm)r-spondin1(500ng/ml)egf(200ng/ml)fgf10(100ng/ml)hgf(25ng/ml)gastrin(10nm)forskolin(10μm)a83-01(5μm)青霉素/链霉素溶液(青霉素/链霉素浓度分别为100u/ml和100μg/ml)实施例3:人肠道类器官的分离与培养1.取肠道手术切除的肠道组织,置于4℃预冷的基础培养基中,基础培养基成分为:advanceddmem/f12培养基、青链霉素、glutamax和hepes,用于保持组织细胞的活性。2.将步骤1获得的肠组织用手术刀将肠道内壁的绒毛轻轻刮去,再用手术剪将其剪成0.5cm3的小块,并转移到15ml离心管中,加入10mlpbs,反复吹打,获得肠组织小块。3.将步骤2获得的肠组织小块静置沉降,去除上清。再加入10ml含有5mmedta的pbs溶液,4℃静置25分钟,进行消化。4.将步骤3中消化完成的肠组织转移至新的含有10mlpbs的培养皿中,反复吹打肠组织约10次,使肠陷窝脱离,获得基本上没有肠陷窝的肠组织。5.将步骤4获得的基本上没有肠陷窝的肠组织经细胞计数后,按每500个肠陷窝与50μlmatrigel基质胶混合,种于24孔板中,待matrigel基质胶凝固后,加入人肠道类器官培养用的培养基,获得分离培养的人肠道类器官,其处于3d培养状态,在37℃的co2培养箱中培养7天后可用于后续实验。其中,人肠道类器官培养用的培养基包含以下组分:advanceddmem/f12b27(2%,体积百分比)r-spondin1(500ng/ml)egf(200ng/ml)mnoggin(100ng/ml)青霉素/链霉素溶液(青霉素/链霉素浓度分别为100u/ml和100μg/ml)实施例4:新型冠状病毒感染类器官(p3实验室)新型冠状病毒sars-cov-2感染类器官的流程示意图如图2所示。1.将实施例1,或者实施例2,或者实施例3中制备的处于3d培养的类器官连同matrigel基质胶一起从孔板中分离出来,并收集于1.5ml离心管中,获得包含类器官与matrigel基质胶的混合物。2.将步骤1获得的包含类器官与matrigel基质胶的混合物以900rpm转速离心1min,去除含有病毒的上清液,获得离心后的包含类器官与matrigel基质胶的混合物。3.将步骤2获得的离心后的包含类器官与matrigel基质胶的混合物加入1mlpbs缓冲液,充分吹打混匀,以去除黏附在类器官周围的matrigel基质胶,获得类器官。4.将步骤3获得的类器官和pbs混合液以1000rpm转速离心1min,去除上清,获得类器官沉淀。5.在步骤4获得的类器官沉淀中加入1mlpbs缓冲液,充分吹打混匀,以1000rpm转速离心1min,去除上清,获得类器官沉淀。6.取40μl预冷的matrigel基质胶均匀的铺在24孔板中,室温放置10min使基质胶完全凝固,获得铺有凝固的matrigel基质胶的24孔板。7.将新冠肺炎病毒sars-cov-2用400μl相应类器官培养用的培养基稀释,稀释的比例为1:10,使moi=10e5,获得新型冠状病毒sars-cov-2感染液。8.用步骤7获得的新型冠状病毒sars-cov-2感染液重悬步骤5获得的类器官沉淀,获得新型冠状病毒sars-cov-2感染液与类器官沉淀的混合物,并将该混合物均匀地滴在步骤6获得的铺有凝固的matrigel基质胶的24孔板中。37℃,co2培养箱共孵育2小时,进行平面化共孵育(即进行2d培养),完成感染过程,获得包含matrigel基质胶且感染有新冠肺炎病毒sars-cov-2的2d类器官培养物。9.将步骤8获得的感染有新冠肺炎病毒sars-cov-2的类器官连同病毒液一起收集在1.5ml离心管中,用移液器轻缓吹打后以900rpm转速离心1min,去除含有病毒的上清液,获得感染有新冠肺炎病毒sars-cov-2的类器官沉淀。10.向步骤9获得的感染有新冠肺炎病毒sars-cov-2的类器官的离心管中加入1mlpbs溶液,用移液器轻缓吹打后以900rpm转速离心1min,去除上清液。11.重复步骤10。12.取50μl预冷的matrigel基质胶,并将其与步骤11获得的感染有新冠肺炎病毒sars-cov-2的类器官沉淀混匀,获得包含感染有新冠肺炎病毒sars-cov-2的类器官沉淀和预冷的matrigel基质胶的混合物;将该混合物均匀地铺在24孔板中,室温放置10min使基质胶完全凝固,获得铺有包含感染有新冠肺炎病毒sars-cov-2的类器官沉淀和凝固的matrigel基质胶混合物的24孔板。13.在步骤12获得的铺有包含感染有新冠肺炎病毒sars-cov-2的类器官沉淀和凝固的matrigel基质胶混合物的24孔板中加入类器官培养用的培养基,进行3d培养,获得含新冠肺炎病毒sars-cov-2的类器官:人肺类器官、人肝类器官或人肠道类器官。实施例5:病毒提纯与核酸检测病毒细胞内拷贝数1.培养实施例4获得的含新冠肺炎病毒sars-cov-2的人肺类器官,分别在感染完成后(即为培养0h)、培养1h、24h和48h后,将其收集至2ml离心管中,加入玻璃珠充分混匀研磨,制成10%的类器官细胞悬液,类器官细胞悬液经3次反复冻融破碎细胞后,以5000×g离心15min,获得第一次离心后的上清液。2.将步骤1获得的第一次离心后的上清液再以10000×g离心30min,获得第二次离心后的上清液。3.快速将步骤2获得的第二次离心后的上清液用剪去尖峰的枪头转移到提前准备好的含有干燥peg-8000和nacl的离心管中,使含病毒的上清液中含有10%(重量百分比)peg-8000和2.2%(重量百分比)nacl,获得包含peg、nacl和上清液的混合物。4.轻轻旋转步骤3获得的包含peg、nacl和上清液的混合物,直到peg晶体完全溶解,并使用旋转摇床在4℃下温和孵育30min,获得包含peg、nacl和上清液的混合液。5.随后将步骤4获得的包含peg、nacl和上清液的混合液在4℃下10000×g离心30min,去上清,留沉淀,即含有病毒的peg沉淀蛋白,获得病毒粗沉淀物。6.在步骤5获得的病毒粗沉淀物中加入200μl提前预冷的hepes盐溶液(0.9%nacl,1mmhepes,ph6.7),重悬沉淀物,直至溶解,获得病毒悬液。7.取5μl步骤6获得的病毒悬液作为模板,使用invitrogen公司提供的superscriptiiionesteprt-pcrsystemwithplatinumtaqpolymerase试剂盒以及idt公司提供的引物和探针,分别于0h和24h、48h检测病毒拷贝数。具体地,n1的引物和探针主要用于检测类似sars的冠状病毒,n2和n3的引物和探针用于特异性的检测sars-cov-2冠状病毒,rnp的引物和探针用于检测内参基因。病毒检测的反应体系见表1。表1反应体系成分体积(μl)2×反应缓冲液12.5反转录酶/taq酶混合物1硫酸镁(50mm)0.4病毒悬液(来自步骤6)5引物和探针(10μm)3(正反向引物和探针各为1)水补至25病毒检测使用bio-radcfx-96荧光定量pcr仪,其程序见表2。表2pcr程序核酸检测新型冠状病毒所用到的引物和探针序列见表3。表3引物和探针taqman引物和探针寡核苷酸序列(5'-3')ncov-n1正向gaccccaaaatcagcgaaat(seqidno:1)ncov-n1反向tctggttactgccagttgaatctg(seqidno:2)ncov-n1探针fam-accccgcattacgtttggtggacc-bhq1(seqidno:3)ncov-n2正向ttacaaacattggccgcaaa(seqidno:4)ncov-n2反向gcgcgacattccgaagaa(seqidno:5)ncov-n2探针fam-acaatttgcccccagcgcttcag-bhq1(seqidno:6)ncov-n3正向gggagccttgaatacaccaaaa(seqidno:7)ncov-n3反向tgtagcacgattgcagcattg(seqidno:8)ncov-n3探针fam-aycacattggcacccgcaatcctg-bhq1(seqidno:9)rnp正向agatttggacctgcgagcg(seqidno:10)rnp反向gagcggctgtctccacaagt(seqidno:11)rnp探针fam-ttctgacctgaaggctctgcgcg-bhq1(seqidno:12)8.通过软件分析,得出新型冠状病毒特异基因的相对表达量,以此反应病毒在类器官中的感染复制情况。人肺类器官在感染新型冠状病毒后不同时间点使用核酸检测病毒拷贝数的结果如图3所示。由图3可见,24h人肺类器官中的病毒拷贝数达到最高,随后降低。实施例6:磷酸氯喹对类器官构建的新型冠状病毒感染扩增模型的作用效果实验1.实验分组设置为:(1)正常人肺类器官对照组:正常人3d肺类器官培养;(2)正常人肺类器官给药组:正常人3d肺类器官与磷酸氯喹共同孵育;(3)新型冠状病毒感染人肺类器官对照组:新型冠状病毒感染的人肺类器官培养;(4)新型冠状病毒感染人肺类器官给药组:新型冠状病毒感染的人肺类器官与磷酸氯喹共同孵育。2.根据实施例4中的步骤建立新型冠状病毒感染人肺类器官模型。3.用0.9%nacl溶解药物,给药组加入磷酸氯喹至终浓度10μmol,新型冠状病毒的接种量moi=10e5,对照组给予同等量的0.9%nacl;分别于0h、24h、48h和72h检测类器官细胞活性以及病毒拷贝数。4.类器官活性使用cck-8法进行检测。向待测孔加入10μlcck-8溶液,置于培养箱中孵育4小时后,用酶标仪测定450nm处吸光度。5.类器官中病毒拷贝数按实施例5中的步骤进行检测。检测结果见表4。表4磷酸氯喹在人肺类器官构建的新型冠状病毒感染扩增模型中的作用效果如图4和表4所示。由图4和表4可见,磷酸氯喹能够在48h有效抑制新型冠状病毒对人肺类器官的感染和杀伤作用(*p<0.05)。序列表<110>张高华奥生命科学(上海)有限公司<120>类器官病毒感染模型的构建方法和应用<130>mti20035<160>12<170>siposequencelisting1.0<210>1<211>20<212>dna<213>人工序列(artificialsequence)<400>1gaccccaaaatcagcgaaat20<210>2<211>24<212>dna<213>人工序列(artificialsequence)<400>2tctggttactgccagttgaatctg24<210>3<211>24<212>dna<213>人工序列(artificialsequence)<400>3accccgcattacgtttggtggacc24<210>4<211>20<212>dna<213>人工序列(artificialsequence)<400>4ttacaaacattggccgcaaa20<210>5<211>18<212>dna<213>人工序列(artificialsequence)<400>5gcgcgacattccgaagaa18<210>6<211>23<212>dna<213>人工序列(artificialsequence)<400>6acaatttgcccccagcgcttcag23<210>7<211>22<212>dna<213>人工序列(artificialsequence)<400>7gggagccttgaatacaccaaaa22<210>8<211>21<212>dna<213>人工序列(artificialsequence)<400>8tgtagcacgattgcagcattg21<210>9<211>24<212>dna<213>人工序列(artificialsequence)<400>9aycacattggcacccgcaatcctg24<210>10<211>19<212>dna<213>人工序列(artificialsequence)<400>10agatttggacctgcgagcg19<210>11<211>20<212>dna<213>人工序列(artificialsequence)<400>11gagcggctgtctccacaagt20<210>12<211>23<212>dna<213>人工序列(artificialsequence)<400>12ttctgacctgaaggctctgcgcg23当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1