一种抗新型冠状病毒的可降解缓释凝胶的制备方法与流程
本发明涉及一种抗新型冠状病毒的可降解缓释凝胶的制备方法,医药技术领域。
背景技术:
水凝胶具有三维网状结构,可吸收大量的水分或体内组织液,因其特殊的性质,水凝胶已被广泛应用于生物医学领域,包括药物释放、细胞培养、医用工程器件等等。例如deng的课题组研发出通过“tetrazole-alkene”反应得到的原位凝胶;li的课题组应用席夫碱反应制备了系列淀粉基的原位凝胶;click反应也是一类常用的制备原位凝胶的化学交联方法,但其所涉及的化学改性通常比较复杂,对聚合物的高分子骨架影响比较大。
互穿网络(ipn)水凝胶是由两种或两种以上聚合物通过网络互穿而形成的具有独特性能的聚合物。在互穿网络水凝胶中,两个组分网络之间没有化学键合相,各个聚合物都保持各自的特性;同时,两种网络互穿相互影响,有协同增强力学性能的作用。因此制备互穿网络水凝胶是一种提高水凝胶强度的有效方法。国内外对ipn生物医用材料的研究已有多年探索,通常采用化学交联方法得到ipn水凝胶。由于化学交联剂或引发剂对细胞或环境有毒,制备的ipn水凝胶用于医疗领域有潜在的毒性,限制了互穿网络水凝胶在生物医用方面的应用。
互穿网络水凝胶还可以采用物理交联方式,如疏水作用、氢键作用、离子交联等,虽不引入新的化学物质但难以获得均匀一致的、理想的交联度,或者交联点可能在生理体液中易于解体。
酶,是一种高效催化某一特异性反应发生的生物催化剂。由于反应的温和性,酶交联得到的凝胶近年来受到广泛关注。辣根过氧化物酶(hrp)由于其良好的生物相容性及高度的稳定性,被广泛应用于酶交联水凝胶体系中,在双氧水存在的条件下,苯酚衍生化的聚合物可以在辣根过氧化物酶的催化下形成交联网络。而hrp介导的水凝胶通常应用于天然高分子材料中,例如透明质酸、葡聚糖、明胶、壳聚糖等。合成高分子材料,如聚(l-谷氨酸)、四臂ppo-peo也适用酶交联方法,得到相关水凝胶。但由于合成高分子材料复杂的合成步骤及添加剂的潜在毒性,使其临床应用受到很大的限制。
聚谷氨酸(pga)分子结构上是一类尼龙-4的衍生物,重复单元的4位碳上接枝有一个羧基。德国人(berlin/heidelberg)于1935年第一次在b.anthracis中发现天然pga。据报道,该物质是枯草杆菌与有机底物在需氧发酵过程中主要的细胞外产物。pga具有的众多性质,如:水溶性、可降解性、可食用性及对人类和环境的友好性等,使其成为生物医用领域理想的候选材料,现已被广泛应用于组织工程支架、药物传递及组织胶黏剂等。透明质酸(ha)是一种酸性粘多糖,是由d-葡萄糖醛酸及n-乙酰葡糖胺组成的双糖单位,1934年美国哥伦比亚大学眼科教授meyer等首先从牛眼玻璃体中分离出该物质。透明质酸具有独特的分子结构和优良的生物相容性,在机体内显示出多种重要的生理功能,如润滑关节,调节血管壁的通透性,调节蛋白质,水电解质扩散及运转,促进创伤愈合等。以上两种材料分属聚氨基酸和天然多糖大分子,均为组成基质的重要成分,二者复合预期可得到环境友好、可降解的基质材料。
传统的抗病毒凝胶剂大多采用人工合成高分子材料作为载体,材料本身合成步骤较多,环境经济性较差,用于医用领域有潜在生物毒性。天然高分子基生物水凝胶的出现为解决这一问题提供了较好方案,其生物相容性良好,并且可在自然界中降解吸收,与药物结合还可以用于不同临床病症,表现出广阔的应用前景[21]。
单个酶催化交联制备的水凝胶已有报道,但是用于载药领域,水凝胶强度通常比较低,缓释效果不甚理想。因此,有必要结合具有良好医用前景的新型高分子材料,开发适用性强、环境友好、生物相容性好的互穿网络水凝胶抗病毒凝胶制剂。
2019年全球爆发的新型冠状病毒具有易传染、潜伏期长等特点,有效的化学试剂有多种,二氧化氯是其中一种已经验证的有效抗病毒化学试剂。二氧化氯具有广谱抗微生物作用,而且对高等动物细胞无致痛、致畸、致突变作用,还具有消除甲醛的作用,具有高度的安全性,被世界卫生组织列为al级广谱、安全、高效消毒剂,被推崇为第四代消毒剂。
技术实现要素:
本发明的目的在于提供一种抗新型冠状病毒的可降解缓释凝胶的制备方法,以解决上述背景技术中提出的问题。
本发明针对2019年全球爆发的新型冠状病毒提供一种具有抗病毒效果的原位交联可降解缓释凝胶,相关研究已表明二氧化氯具有典型抗病毒特性,而且二氧化氯具有广谱抗微生物作用,而且对高等动物细胞无致痛、致畸、致突变作用,还具有消除甲醛的作用,具有高度的安全性,被世界卫生组织列为al级广谱、安全、高效消毒剂,被推崇为第四代消毒剂。但是二氧化氯性质不稳定,易分解,使用安全性较差,因此合适载体的缺乏使其应用受到了一定限制。
原位交联可降解缓释凝胶的设计用以解决上述技术问题;制备的缓释凝胶具有优异的生物相容性,并且具有理想的力学强度。由此制备方法得到的水凝胶既可克服化学交联剂带来的毒性,又可解决物理交联效果不佳的缺点,自身材料还可实现无毒无害降解。结合抗病毒药物可以使得药物实现缓释功能,解决合成聚合物载体惯有的释药时间短,药效弱及载药基质无法降解的缺点。
为实现上述目的本发明采用以下技术方案:
一种抗新型冠状病毒的可降解缓释凝胶的制备方法,包括以下步骤:
1)、首先采用水相法分别合成酪胺(ty)接枝聚谷氨酸(pga)的前体大分子pga-ty和半胱胺(ca)接枝透明质酸(ha)的前体大分子ha-ca;
2)、其次,以5%的二氧化氯溶液为基底液,将pga-ty和ha-ca分别配成不同浓度的前体大分子溶液;
3)、然后,量取两种前体大分子溶液,按不同体积比进行混合,再加入辣根过氧化物酶(hrp)、双氧水、柠檬酸/磷酸二氢钠达到一定终浓度,快速搅拌形成均一体系,于室温下静置,即得到原位交联可降解的抗新型冠状病毒缓释凝胶。
作为本发明进一步的方案,前体大分子pga-ty0.5-200mg/ml,前体大分子ha-ca0.5-200mg/ml,pga-ty和ha-ca混合体积比介于10:1到1:10之间。
作为本发明进一步的方案,柠檬酸/磷酸二氢钠比例在1:100-100:1之间,加入量占总体积0.1-50%,辣根过氧化物酶hrp0.1-100u/ml,双氧水0.1-100mm。
作为本发明进一步的方案,所述以前体大分子pga-ty60mg/ml,前体大分子ha-ca60mg/ml以体积比1:1混合制备。
作为本发明进一步的方案,交联剂辣根过氧化物酶hrp10u/ml,双氧水10mm。
作为本发明进一步的方案,稳定二氧化氯溶液占80%,柠檬酸/磷酸二氢钠比例为1:1,加入量占总体积8%。
作为本发明进一步的方案,步骤3)中制备抗新型冠状病毒凝胶的方法为涡旋法,加入辣根过氧化物酶(hrp),将混合液涡旋5min,在涡旋状态下,先将柠檬酸/磷酸二氢钠加入,最后将双氧水滴入混合液,形成后于室温下静置既得所述抗新型冠状病毒凝胶。
作为本发明进一步的方案,所述前体大分子溶液及交联剂溶液均采用0.22μm滤膜除菌消毒,制备过程中所述配置溶液用缓冲液或水均为灭菌水或灭菌缓冲液。
作为本发明进一步的方案,所述涡旋转速设置为200rpm/min。
与现有技术相比,本发明的有益效果是:本发明提供的抗新型冠状病毒的原位交联可降解缓释凝胶,在聚谷氨酸大分子链上引入酚羟基通过氧化酶催化酚羟基氧化交联和含有巯基的透明质酸通过氧化交联构成互穿网络水凝胶,两个网络协同作用提高了水凝胶的力学强度和药物缓释能力。
2.本发明所用的原材料均源自天然来源的天然多糖大分子或天然聚氨基酸,二者结合制备凝胶,得到环境友好、可降解吸收的材料,解决了以往载体材料易环境污染,不易回收利用的缺点。
3.本发明采用酶催化交联和自氧化交联制备抗感染凝胶制剂的方法既克服了化学交联剂带来的毒性,又解决了物理交联剂效果不佳的缺点。
4.本发明所提供的抗新型冠状病毒的原位交联可降解缓释凝胶含有药物二氧化氯,相比其他抗新型冠状病毒的药物,该缓释凝胶具有更长的、可调节的释药周期,并且释放出来的药物表现出良好的药物活性;相比现有用药方式,该抗感染凝胶制剂复合物可显著延长药效时间。
附图说明
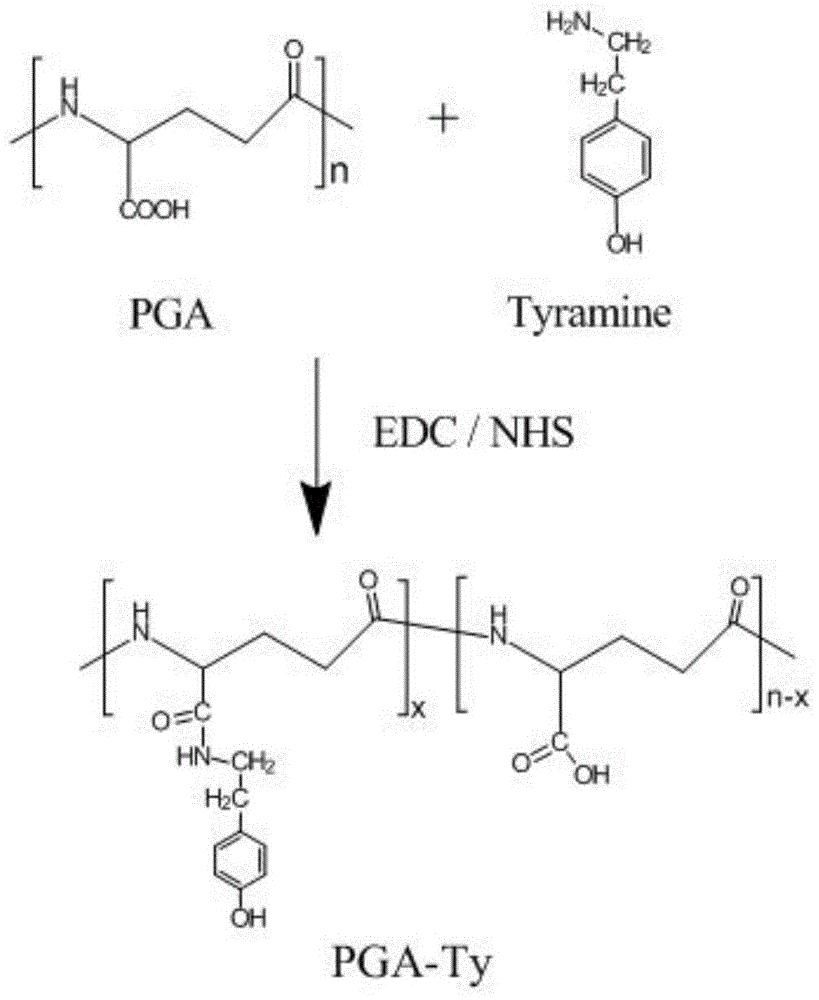
图1是聚谷氨酸大分子接枝酪胺基团的合成示意图。
图2是透明质酸大分子接枝半胱胺基团的合成示意图。
图3是接枝酪胺的聚谷氨酸前体大分子和接枝半胱胺的透明质酸前体大分子形成互穿网络水凝胶的示意图。
图4是两种互穿网络水凝胶体外酶降解曲线图。
图5是不同浓度含量的两种互穿网络水凝胶内部结构示意图(a为水凝胶内部孔径在10-100微米之间,b为水凝胶内部孔径处于10-150微米之间)。
图6是不同浓度含量的互穿网络水凝胶体外细胞毒性评价示意图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的阐述。
酪胺接枝聚谷氨酸前体pga-ty的合成;
图1为酪胺接枝聚谷氨酸前体pga-ty的合成示意图。将1g聚谷氨酸溶解于50毫升蒸馏水中,再加入1.076g酪胺盐酸盐。随后4.457gedc和2.674gnhs加入到混合溶液中引发反应。随着反应的进行,用1m的氢氧化钠和盐酸溶液调节体系的ph稳定于4.8。在室温下搅拌过夜,将体系ph值调回7后,反应溶液被转移到截流分子量为1000da的透析袋中。首先在100mm的氯化钠溶液中透析2天,再于水和乙醇的混合溶液(体积比3:1)中透析1天,最后在纯水中透析1天。透析纯化的产品溶液最终冻干形成白色絮状样品,4℃冷冻保存,经测试收率86%左右。
半胱胺接枝透明质酸前体ha-ca的合成;
图2为半胱胺接枝透明质酸前体ha-ca的合成示意图;称取透明质酸2g溶于100ml去离子水中,用磁力搅拌器恒温搅拌至完全溶解。称取半胱胺盐酸盐1.68g,edc2.73g和nhs1.72g溶于100ml的蒸馏水中,室温活化1h(ph=4.8),将活化液加入到透明质酸溶液中,室温搅拌过夜。反应液移入透析袋中蒸馏水透析3天,透析纯化的产品溶液最终冻干形成白色絮状样品,4℃冷冻保存,经测试收率92%左右。
互穿网络水凝胶的制备;
表1.pga-ty/ha-ca互穿网络水凝胶的组成
图3是互穿网络水凝胶的制备示意图。将pga-ty及ha-ca分别配置成浓度为4%(40mg/ml)和6%(60mg/ml)的溶液。ipn凝胶则按不同体积比,将两种前体大分子溶液按表1体积比混匀后倒入5mm高的圆柱型模具内。之后加入hrp、双氧水,使其终浓度分别达到10u·ml-1和10mm。于室温下静置过夜,确保交联反应彻底完成。脱模之后,将交联的水凝胶于75%的乙醇溶液中消毒2小时,随后用清水洗涤三次,以备测试使用。形成凝胶过程中,凝胶时间采用小瓶倾斜法进行测试,即样品瓶倒置一分钟之内没有观察到流体流动,则可判定样品达到凝胶状态。
抗感染互穿网络凝胶制剂复合物的制备;
准备50ml稳定型二氧化氯溶液,随后将pga-ty和ha-ca加入pbs中,充分溶解形成溶液,最后加入hrp和柠檬酸/磷酸二氢钠,最后加入h2o2快速搅拌形成载药凝胶。该凝胶与其他样品一致,室温放置即可充分反应交联。
互穿网络水凝胶体外酶降解测试;
按互穿网络水凝胶的制备步骤,以pga-ty(40mg/ml)与ha-ca(40mg/ml)体积比1:1制备互穿网络凝胶i3;按实施例3步骤,以pga-ty(60mg/ml)与ha-ca(60mg/ml)体积比1:1制备互穿网络凝胶i3’样品。将i3和i3’样品浸泡在37℃下含有0.05mg/ml木瓜蛋白酶的pbs溶液中(0.01m,ph7.4),震荡箱设置为100rpm,取样点设定为2、4、8、24小时。测试中在每一个提前设置好的时间点,将样品取出,用纯水洗涤并擦去表面游离水,进行冻干。体外降解的速率由冻干后的质量(wt)除以初始样品冻干质量(w0)确定:剩余质量分数=(wt/w0)×100%,降解曲线如图4所示。
互穿网络水凝胶内部型貌测试;
选取互穿网络水凝胶的制备中具有不同组分含量的水凝胶i3、i3’为样品,首先将样品放入-20℃冰箱冻成冰,之后放入冻干机冻干得到sem样品。冻干样品放在sem载物台表面,用导电胶带粘结固定并形成导电通路,随后将固定好的样品喷金1分钟,使样品表面形成致密的镀金薄膜。样品形貌在5kv加速电压下进行观测。需要注意的是,样品冻干制备过程容易破坏内部形貌,为了真实反映凝胶内部结构形貌,应在样品冻结成固态时进行脆断。样品内部型貌扫描电镜图片如图5所示。
互穿网络水凝胶体外细胞毒性评价;
选取互穿网络水凝胶的制备中具有不同组分含量的水凝胶为样品。消毒过后的水凝胶样品用dmem进行浸提,样品以1cm2/ml浸提比进行浸提处理24小时,温度设置37℃。100微升含有104细胞的悬液与100微升样品浸提液分别加入96孔板中,在37℃、5%二氧化碳环境中共培养。于第一天、第三天、第五天时分别加入mtt(5mg/ml),培养四小时确保显色晶体形成后,加入150微升dmso将晶体进行溶解。样品混合液在490nm波长下进行吸光度测试。
互穿网络水凝胶的制备通过酶交联和氧化交联制备互穿网络水凝胶的机理图,如图3所示。在制备过程中,两种前体溶液混合得到均一体系,加入hrp/h2o2后继续搅拌,防止出现不均匀的硬块(交联不均匀),确保得到内部结构较均一的水凝胶体系。接枝了酪胺的pga-ty可以在双氧水与hrp共存条件下,催化形成交联的水凝胶。为了尽量降低双氧水的添加所可能带来的潜在毒性,实验中采用了较低浓度的双氧水浓度(10mm)。交联的原理可归为在交联过程中出现的两种新共价键:一种是苯环上相邻两个碳原子之间形成的碳碳键;一种是邻位碳原子与酚氧原子之间的碳氧键。ha-ca因双氧水的存在,也会影响其自交联过程,最终形成稳定交联的二硫键。
所测试互穿网络水凝胶体外酶降解的数据如图4所示。i3水凝胶在2小时内质量减少21.4%。i3’水凝胶在2小时内质量减少15.8%,经过24小时降解后仍保留69.9%。两个样品均表现出较规律的降解曲线。在初始阶段,i3样品的快速降解可归于样品内部相对疏松的结构。在i3样品内部,自由水的流动性更强,酶溶液与高分子骨架相互接触的更加容易,因此样品的降解速度比较快。与此同时,在样品i3’组中,因前体大分子含量相对比较高,形成的凝胶内部结构更加紧密,这就阻止了酶溶液快速浸入ipn凝胶内部,因此降解速度会相对较慢。
互穿网络水凝胶内部型貌测试的结果如图5所示。可以看出两种浓度的ipn水凝胶内部均具有多孔结构,并且孔之间具有良好的贯穿性。i3’水凝胶内部孔径在10-100微米之间(a),i3水凝胶内部孔径处于10-150微米之间(b),而较小的组分含量有可能是造成i3孔径较大的主要原因。依据该数据及有关报道,可以推测该水凝胶内部结构与组分含量具有一定的相关性,并且在细胞包裹及其他生物医学领域具有潜在的用途。
互穿网络水凝胶体外细胞毒性评价数据如图6所示。数据显示,所有ipn水凝胶样品的体外毒性均无显著差异,这一点可归因于水凝胶基材良好的生物相容性和交联反应的温和性。计算得到的rgr值均大于80%,证明了ipn水凝胶良好生物相容性的本质,是该凝胶成为生物医用领域良好候选材料的重要保证。
以上所述为本发明较佳实施例,对于本领域的普通技术人员而言,根据本发明的教导,在不脱离本发明的原理与精神的情况下,对实施方式所进行的改变、修改、替换和变型仍落入本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!