一种固醇调控元件结合蛋白和酸性核质DNA结合蛋白-1抑制剂及其制备方法和应用与流程
本发明属于医药技术领域,涉及一类含硼小分子化合物的制备方法和应用,具体地涉及一种新的能够抑制固醇调控元件结合蛋白(srebp)和酸性核质dna结合蛋白-1(and-1,也叫做wdhd1)的小分子药物,所述化合物的制备方法,所述化合物作为固醇调控元件结合蛋白抑制剂或者酸性核质dna结合蛋白-1抑制剂药物在制备抗肿瘤药物以及肿瘤放化疗增敏剂药物中的应用。
背景技术:
下面关于与本发明相关的背景介绍用于帮助对本发明的理解,但不应被认为是本发明的已有技术。所有引用的出版物都被全文参考。
脂质稳态打破和很多疾病的发生发展有关,包括二型糖尿病,病毒感染,癌症以及其它被称为“代谢综合症”的一系列疾病。脂质代谢重编程是恶性肿瘤的特征之一。对于快速增殖的肿瘤细胞来说,脂质可以为其提供能源供应,合成细胞膜的主要结构成分。在很多肿瘤当中,脂质合成被强烈上调。
srebp转录因子是细胞脂质稳态的主要调控因子(cell,2006;124,35-46)。基因srebp-1编码产生srebp-1a和srebp-1c,其主要激活脂肪酸和甘油三酯合成所需基因的转录,包括乙酰辅酶a羧化酶(acc)、脂肪酸合酶(fas)、硬酯酰辅酶a去饱和酶1(scd-1)、脂蛋白脂肪酶(lpl)等。而基因srebp-2编码产生srebp-2,其主要激活胆固醇合成和摄取所需基因的转录,包括hmg-coa还原酶、hmg-coa合酶等(trendsinbiochemicalsciences,2018;43,358-368)。
已发展的srebp抑制剂主要有如下几种类型。第一类是fatostatin,以insig非依赖性的方式和srebp裂解激活蛋白(scap)相互作用,干扰srebp从内质网向高尔基体转运。第二类是betulin,通过稳定insigs与scap的结合,促进srebp在内质网逗留,从而间接抑制srebp活化。第三类是化合物bf-175。bf-175是一类新型的含硼有机小分子,其可能通过与med15-kix(mediatorofrnapolymeraseiitranscriptionsubunit15-kinaseinducibledomaininteracting)结构域结合从而干扰srebp转录活性(cellmetab,2011;13,44-56)。尽管bf-175与其它抑制剂相比具有独特的优势,包括其硼原子可能参与共价结合,该化合物具有较低的毒性,以及是已发现的唯一的直接干扰srebp转录激活作用的小分子,但是其依然存在一定的问题。一方面,硼酸酯的稳定性较差,对该分子的生物活性和体内药代动力学研究造成困难。另一方面,上述化合物主要被用于抗代谢性疾病,尚没有开发用于抗肿瘤化合物的报道。因此,开发新型高活性且理化性质稳定的srebp抑制剂对于治疗糖尿病等代谢性疾病和恶性肿瘤具有重要意义。
在研究此类化合物的作用机制时,本研究团队发现其通过另一种关键途径产生抗肿瘤作用:此类化合物直接作用于酸性核质dna结合蛋白-1(and-1,也叫做wdhd1),抑制dna损伤修复。临床研究表明,and-1免疫染色阳性与非小细胞肺癌和食管癌患者预后差有关(clincancerres.2010;16:226-39.)。多变量分析表明它是食管癌的独立预后因素。用小干扰rna抑制and-1表达可有效抑制肺癌和食管癌细胞的生长(clincancerres.2010;16:226-39.)。依赖于microrna-494的and-1抑制减少了胆管癌细胞的上皮-间充质转化,肿瘤生长和转移(digestiveandliverdisease.2019;51:397-411.)。因此,and-1可以做为潜在的抗肿瘤药物靶标。开发小分子的and-1抑制剂具有重要意义。
技术实现要素:
本发明旨在针对现有技术的缺陷,提供一种新的能够抑制固醇调控元件结合蛋白和酸性核质dna结合蛋白-1的小分子药物的制备方法和应用,以解决现有技术中缺乏一种类似化合物的技术问题;
本发明要解决的另一技术问题是发明背景中所述化合物的活性低、稳定性较差;
本发明要解决的再一技术问题是尚没有酸性核质dna结合蛋白-1抑制剂的报道;
本发明要解决的又一技术问题是提供所述化合物作为固醇调控元件结合蛋白抑制剂和酸性核质dna结合蛋白抑制剂在抗肿瘤药物或者肿瘤放化疗增敏剂中的应用。
为实现以上技术目的,本发明采用以下技术方案:
一种由式i表示的化合物:
其中:
a.r1为单取代或多取代,独立地选自:氢、三氟甲基、三氟甲氧基、硝基、氰基、卤素、c1-c10烷基、-or2;
b.r2独立地选自:氢、c1-c10烷基。
作为优选,所述的化合物或其在药学上可用的盐,选自:
本发明提供了一种药物组合物,包含上述化合物或其药学上可用的盐,以及药学上可接受的载体,包括稀释剂。
同时,本发明提供了上述化合物或其药学上可用的盐、上述药物组合物在制备固醇调控元件结合蛋白抑制剂、酸性核质dna结合蛋白-1抑制剂药物的应用。
作为优选,上述化合物或其药学上可用的盐、上述药物组合物是针对抗肿瘤或者肿瘤放化疗增敏的药物。
同时,本发明提供了上述化合物的制备方法,包括以下步骤:
1)化合物a与浓盐酸以及多聚甲醛反应得到化合物b;
2)由化合物b在非质子性溶剂中与三苯基磷反应得到化合物c;
3)由化合物c与化合物d在强碱的条件下得到化合物e;
4)由化合物e与三氟甲磺酸酐在二氯甲烷中反应得到化合物f;
5)由化合物f与联硼酸频哪醇酯(或者联硼酸)在钯盐催化剂下反应得到化合物g;
6)由化合物g和硼氢化钠(或四氢铝锂等还原剂)反应后加酸得到化合物h。
其中,化合物结构如下:
作为优选,步骤3)、5)所述反应是在加热条件下进行的。
作为优选,步骤4)、6)所述反应是在低温下进行的。更优的,反应温度为0摄氏度。
作为优选,步骤3)所述反应是在强碱条件下进行的,包括甲醇钠、乙醇钠、叔丁醇钠、异丙醇钠、丁基锂、氢氧化钠、氢氧化锂;更优的,为乙醇钠的乙醇溶液。
作为优选,步骤5)所述反应的钯催化剂包括但不限于以下:醋酸钯,氯化钯,四(三苯基磷)钯,双(乙腈)二氯化钯,二(三苯基磷)氯化钯,1,1’-[双(二苯基磷)二茂铁]二氯化钯,二(苯腈)二氯化钯,1,1’-[双(二叔丁基磷)二茂铁]二氯化钯,双(三环己基磷)二氯化钯,双(邻甲苯磷)二氯化钯。更优的,催化剂为1,1’-[双(二苯基磷)二茂铁]二氯化钯。
作为优选,步骤5)所述反应在碱性条件下进行,碱包括但不限于醋酸钠、醋酸钾、甲醇钠、乙醇钠、甲醇钾、乙醇钾、氟化钠、氟化钾。更优的,为醋酸钾。
作为优选,步骤5)所述反应在极性溶剂中进行的,包括但不限于n,n-二甲基甲酰胺、二甲基亚砜、乙腈、丙酮、甲基乙基酮、1,4-二氧六环、水。更优的,为1,4-二氧六环。
以上技术方案的相关技术术语,除非特殊解释,否则将遵循下面的定义。
术语“烷基”指具有指定碳原子数的直链或支链烃基,因此例如,在此使用的术语“c1-c4烷基”和“c1-c10烷基”是指分别具有至少1个且至多4个或10个碳原子的烷基。本发明中所使用的此类支链或直链烷基的实例包括,但不限于,甲基、乙基、正丙基、异丙基、异丁基、正丁基、叔丁基、正戊基、异戊基、正己基、正庚基、正辛基、正壬基,和正癸基。和后面五个正烷烃的的支链类似物。
当使用术语“c3-c8杂环烷基”时,其是指含有指定数目环原子的非芳香杂环,其为饱和的或具有一个或多个不饱和度,且含有一个或多个选自o、s或n的杂原子。此类环可任选稠合至一个或多个其它“杂环”或环烷基上。“杂环”基团的实例包括,但不限于,氮杂环丙烷、硫杂环丙烷、氧杂环丙烷、氮杂环丁烷、硫杂环丁烷、氧杂环丁烷、四氢呋喃、吡喃、1,4-二恶烷,1,4-二噻烷、1,3-二恶烷、1,3-二氧戊环、哌啶、哌嗪、2,4-哌嗪二酮、吡咯烷、2-咪唑啉、咪唑烷、吡唑烷、吡唑啉、吗啉、硫代吗啉、四氢呋喃、四氢噻吩等。
术语“芳基”指含有5-14个环原子,至少一个环拥有共轭π电子体系的芳香基团,包括有全碳原子的芳环、芳杂环和并芳环或联芳环,并可带有取代基。芳基可以带有1-6个取代基。
杂芳环或芳杂环是指含有5-14个环上原子的基团,其中1-4个杂原子为芳香环上原子,其余环上原子为碳原子。合适的杂原子有氧、硫、氮、和硒原子。合适的芳杂环有呋喃、噻吩、吡啶、吡咯啶、氮上带有低碳数烷基取代基的吡咯烷、吡啶氮氧化物、嘧啶、吡嗪、咪唑及其他类似杂环,并均可带有取代基。
术语“随意取代”或“取代”指基团带有1-4个不同的取代基,可以分别是低碳数烷基、低碳数芳基、低碳数芳烷基、低碳数环状烷基、低碳数杂环烷基、羟基、低碳数烷氧基、低碳数芳氧基、多卤代烷氧基、芳烷氧基、低碳数杂芳基、低碳数杂芳环氧基、低碳数杂芳烷基、低碳数杂芳烷氧基、叠氮基、氨基、卤素、低碳数烷巯基、氧基、低碳数酰烷基、低碳数羧酸酯基、羧酸、酰胺基、硝基、低碳数酰氧基、低碳数胺烷基、低碳数烷胺芳基、低碳数烷芳基、低碳数烷胺烷基、低碳数烷氧芳基、低碳数芳胺基、低碳数芳烷胺基、磺酰基、低碳数酰胺烷芳基、低碳数酰胺芳基、低碳数羟烷基、低碳数卤代烷基、低碳数烷胺烷酸基、低碳数脲烷基、氰基、低碳数烷氧烷基、低碳数多卤代烷基、低碳数芳烷氧烷基。
“取代芳基”和“取代杂芳基”指芳环或者杂芳环基团上带有1-6个取代基。这些取代基可以是低碳数烷基、低碳数烷氧基、低碳数多卤代烷基、卤素、羟基和氨基。
附图说明
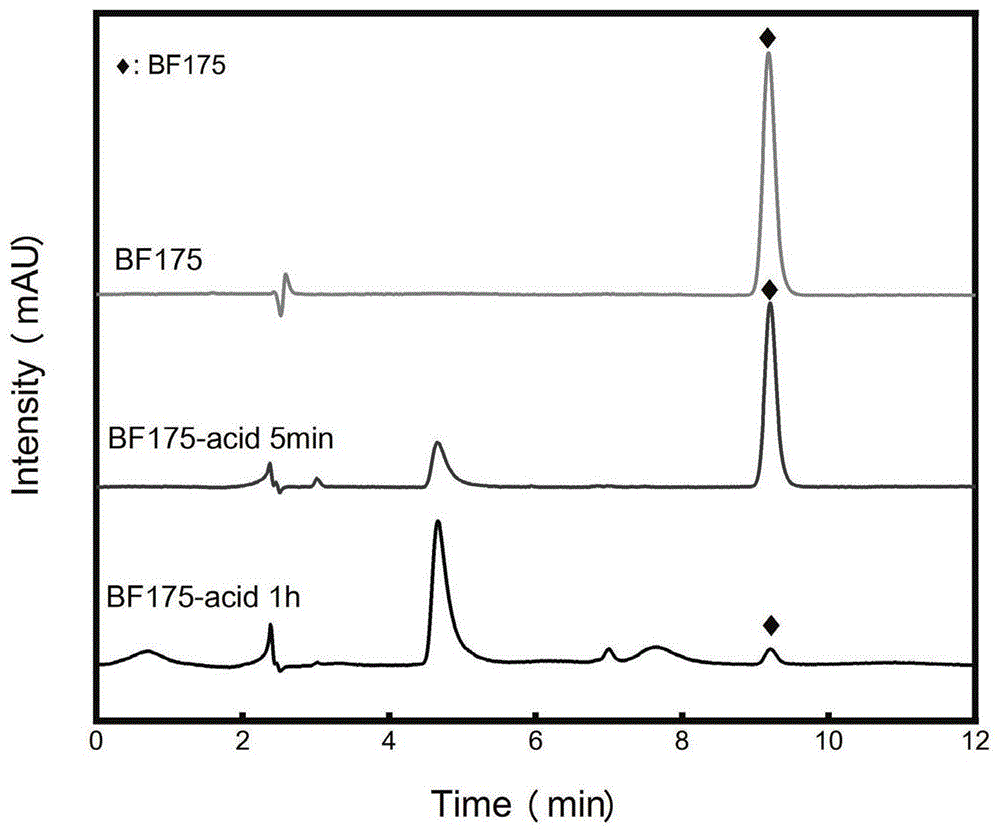
图1:bf-175及其衍生物的hplc结果;
图2:化合物benzoxaborole和travaborole的结构式;
图3:代表性化合物对an3ca细胞克隆形成率的影响;
图4:代表性化合物对an3ca细胞的增殖抑制作用;
图5:化合物iii的westernblot结果(a549细胞系)
具体实施方式
本发明中的化合物及制备可以通过下面的实例更好地说明。这些实例不应被解读为本发明的局限,现在已知的或将来开发的这些化合物的变化体也应被认为属于本发明的范畴并申请保护。
以下将对本发明的具体实施方式进行详细描述。为了避免过多不必要的细节,在一下实施例中对属于公知的结构或功能将不进行详细描述。
以下实施例中所使用的近似性语言可用于定量表述,表明在不改变基本功能的情况下可允许数量有一定的变动。因此,用“大约”、“左右”等语言所修正的数值不限于该准确数值本身。在一些些实施例中,“大约”表示允许其修正的数值在正负百分之十(±10%)的范围内变化,比如,“大约100”表示的是可以是90到110之间的任何数值。此外,在“大约第一数值到第二数值”的表述中,大约同时修正第一和第二数值两个数值。在某些情况下,近似性语言可能与测量仪器的精度有关。
除有定义外,以下实施例中所使用的技术和科学术语具有与本发明所属领域技术人员普遍理解的相同含义。
实施例15-(氯甲基)-2-羟基苯甲醛(b)
将多聚甲醛(24.40g,0.20mol)的浓盐酸(80ml)溶液于室温下搅拌10分钟,在30分钟内分批滴加水杨醛(17.95g,0.60mol)。反应液于室温下搅拌24小时,得白色沉淀。过滤,冷水洗涤滤饼,干燥得粗产物。粗产物用正己烷(310ml)重结晶得白色针状结晶(16.80g,49.4%)。1hnmr(400mhz,dmso-d6)δ10.91(s,1h),10.27(s,1h),7.72(d,j=2.4hz,1h),7.59(dd,j=8.5,2.4hz,1h),7.03(d,j=8.5hz,1h),4.76(s,2h).
实施例2(3-formyl-4-hydroxybenzyl)triphenylphosphoniumchloride(c)
将5-(氯甲基)-2-羟基苯甲醛(15.50g,91.2mmol)和三苯基磷(30.98g,118.1mmol)溶于220ml干燥乙腈。在氮气的保护下,将反应液于80℃搅拌3小时。在减压条件下蒸干乙腈,用石油醚(100ml×3)洗去剩余的三苯基磷,过滤后得到白色粉末(38.52g,97.8%)。
实施例3(e)-5-(3,5-dichlorostyryl)-2-hydroxybenzaldehyde(e1)
在氮气保护下,将钠(0.19g,8.26mmol)溶于无水乙醇(30ml)。将上步膦盐(1.20g,2.78mmol)加入此乙醇钠溶液中,至反应液变为深黄色,加入3,5-二氯苯甲醛(0.57g,3.26mmol)。反应液于75℃搅拌3小时。停止反应,冷至室温,加水先澄清再浑浊,用稀盐酸调ph至酸性,析出黄色固体。过滤,干燥,并用四氢呋喃重结晶两次,得到黄色晶体(0.387g,44.4%)。1hnmr(400mhz,dmso-d6)δ10.97(s,1h),10.31(s,1h),7.87(d,j=2.2hz,1h),7.79(dd,j=8.7,2.3hz,1h),7.67(d,j=1.8hz,2h),7.46(d,j=16.5hz,1h),7.45(t,j=1.8hz,1h),7.13(d,j=16.5hz,1h),7.06(d,j=8.6hz,1h)。
参照实施例3的步骤,可以制备如下中间体:
(e)-5-(3-fluorostyryl)-2-hydroxybenzaldehyde
1hnmr(400mhz,dmso-d6)δ10.91(s,1h),10.31(s,1h),7.87(d,j=1.9hz,1h),7.80(dd,j=8.6,1.9hz,1h),7.49-7.36(m,3h),7.32(d,j=16.4hz,1h),7.14(d,j=16.4hz,1h),7.07(dd,j=14.4,6.6hz,2h).
13cnmr(101mhz,dmso-d6)δ191.56,164.30,161.89,161.09,140.39,140.31,134.54,130.99,130.91,129.28,128.79,127.59,126.19,126.16,123.15,123.13,122.87,118.29,114.52,114.30,112.88,112.67。
(e)-5-(3-chlorostyryl)-2-hydroxybenzaldehyde
1hnmr(400mhz,dmso-d6)δ10.94(s,1h),10.31(s,1h),7.87(d,j=2.0hz,1h),7.81(dd,j=8.6,2.1hz,1h),7.68(s,1h),7.54(d,j=7.8hz,1h),7.35(dt,j=17.0,7.9hz,3h),7.14(d,j=16.5hz,1h),7.05(d,j=8.6hz,1h)。
(e)-2-hydroxy-5-(3-methylstyryl)benzaldehyde
1hnmr(400mhz,dmso-d6)δ10.86(s,1h),10.30(s,1h),7.84(d,j=2.2hz,1h),7.80(dd,j=8.6,2.3hz,1h),7.44-7.34(m,2h),7.29-7.17(m,2h),7.14-7.01(m,3h),2.32(s,3h)。
(e)-2-hydroxy-5-(3-methoxystyryl)benzaldehyde
1hnmr(400mhz,dmso-d6)δ10.89(s,1h),10.31(s,1h),7.93-7.75(m,2h),7.39-7.22(m,2h),7.14(dd,j=16.7,12.2hz,3h),7.04(d,j=8.6hz,1h),6.88-6.79(m,1h),3.79(s,3h)。
(e)-2-hydroxy-5-styrylbenzaldehyde
1hnmr(400mhz,dmso-d6)δ10.88(s,1h),10.31(s,1h),7.86(s,1h),7.84-7.78(m,1h),7.59(d,j=7.7hz,2h),7.37(t,j=7.6hz,2h),7.30-7.20(m,2h),7.14(d,j=16.5hz,1h),7.04(d,j=8.6hz,1h)。
(e)-2-hydroxy-5-(3-(trifluoromethyl)styryl)benzaldehyde
1hnmr(400mhz,dmso-d6)δ10.93(s,1h),10.31(s,1h),7.95(s,1h),7.90(t,j=4.3hz,2h),7.83(dd,j=8.7,2.3hz,1h),7.65-7.55(m,2h),7.44(d,j=16.5hz,1h),7.26(d,j=16.5hz,1h),7.06(d,j=8.6hz,1h)。
(e)-5-(3,4-dichlorostyryl)-2-hydroxybenzaldehyde
1hnmr(400mhz,dmso-d6)δ10.92(s,1h),10.31(s,1h),7.87(d,j=1.9hz,2h),7.80(dd,j=8.6,2.3hz,1h),7.65-7.52(m,2h),7.37(d,j=16.5hz,1h),7.13(d,j=16.5hz,1h),7.05(d,j=8.6hz,1h).
13cnmr(101mhz,dmso-d6)δ191.43,161.22,138.63,134.57,131.94,131.13,130.08,129.72,128.62,128.24,127.64,126.74,124.79,122.88,118.30。
(e)-5-(3,5-bis(trifluoromethyl)styryl)-2-hydroxybenzaldehyde
1hnmr(400mhz,dmso-d6)δ11.02(s,1h),10.32(s,1h),8.29(s,2h),7.93(d,j=2.0hz,1h),7.91(s,1h),7.83(dd,j=8.6,2.1hz,1h),7.67(d,j=16.6hz,1h),7.37(d,j=16.5hz,1h),7.07(d,j=8.6hz,1h)。
(e)-5-(3-fluoro-5-(trifluoromethyl)styryl)-2-hydroxybenzaldehyde
1hnmr(400mhz,dmso-d6)δ11.00(s,1h),10.31(s,1h),7.89(d,j=2.2hz,1h),7.84-7.74(m,3h),7.59-7.48(m,2h),7.26(d,j=16.5hz,1h),7.06(d,j=8.6hz,1h)。
(e)-2-hydroxy-5-(2-(trifluoromethyl)styryl)benzaldehyde
1hnmr(400mhz,dmso-d6)δ11.01(s,1h),10.31(s,1h),7.98(d,j=7.9hz,1h),7.85(d,j=2.2hz,1h),7.80(dd,j=8.6,2.3hz,1h),7.74(d,j=7.8hz,1h),7.69(t,j=7.6hz,1h),7.48(t,j=7.6hz,1h),7.35(d,j=16.1hz,1h),7.24(dd,j=16.2,2.1hz,1h),7.08(d,j=8.6hz,1h)。
(e)-2-hydroxy-5-(4-(trifluoromethyl)styryl)benzaldehyde
1hnmr(400mhz,dmso-d6)δ10.98(s,1h),10.31(s,1h),7.90(d,j=2.2hz,1h),7.85(dd,j=8.6,2.2hz,1h),7.79(d,j=8.2hz,2h),7.71(d,j=8.3hz,2h),7.43(d,j=16.5hz,1h),7.24(d,j=16.5hz,1h),7.05(d,j=8.6hz,1h)。
(e)-2-hydroxy-5-(3-(trifluoromethoxy)styryl)benzaldehyde
1hnmr(400mhz,dmso-d6)δ10.90(s,1h),10.31(s,1h),7.89(d,j=2.2hz,1h),7.82(dd,j=8.6,2.3hz,1h),7.66-7.56(m,2h),7.49(t,j=8.0hz,1h),7.38(d,j=16.5hz,1h),7.21(t,j=12.3hz,2h),7.05(d,j=8.6hz,1h)。
实施例4
将(e)-5-(3,5-dichlorostyryl)-2-hydroxybenzaldehyde和吡啶(0.751g,9.49mmol)溶于无水二氯甲烷(25ml)中,并将反应液于0℃搅拌。滴加三氟甲磺酸酐(0.81g,2.87mmol)的二氯甲烷溶液。将反应液在冰浴下搅拌40分钟以后,tlc监控,直至原料消耗完。反应液投入冰水中,用稀盐酸调ph至2,饱和食盐水洗三次,二氯甲烷层用无水硫酸钠干燥,在减压条件下蒸干,残余物通过柱色谱分离(洗脱剂石油醚∶乙酸乙酯4∶1),得白色固体(0.775g,96.3%)。1hnmr(400mhz,dmso-d6)δ10.11(s,1h),8.28(s,1h),8.03(d,j=8.6hz,1h),7.71(s,2h),7.65(d,j=8.6hz,1h),7.60(d,j=16.5hz,1h),7.50(s,1h),7.41(d,j=16.5hz,1h).13cnmr(101mhz,dmso-d6)δ189.15,147.29,140.62,138.38,134.99,134.27,131.74,129.48,129.21,128.85,127.78,125.79,123.84,123.43,120.24,117.06,113.87。
参照实施例4的步骤,可以制备如下中间体:
(e)-4-(3-fluorostyryl)-2-formylphenyltrifluoromethanesulfonate
1hnmr(400mhz,dmso-d6)δ10.17(s,1h),8.39(d,j=2.3hz,1h),8.11(dd,j=8.6,2.3hz,1h),7.70(d,j=8.5hz,1h),7.63-7.46(m,5h),7.26-7.15(m,1h)。
(e)-4-(3-chlorostyryl)-2-formylphenyltrifluoromethanesulfonate
1hnmr(400mhz,dmso-d6)δ10.11(s,1h),8.33(d,j=2.3hz,1h),8.06(dd,j=8.6,2.3hz,1h),7.76(s,1h),7.63(dd,j=18.5,8.1hz,2h),7.53(d,j=16.5hz,1h),7.50-7.35(m,3h)。
(e)-2-formyl-4-(3-methylstyryl)phenyltrifluoromethanesulfonate
1hnmr(400mhz,dmso-d6)δ10.11(s,1h),8.34(d,j=2.3hz,1h),8.06(dd,j=8.6,2.3hz,1h),7.62(d,j=8.6hz,1h),7.52-7.39(m,4h),7.31(t,j=7.6hz,1h),7.16(d,j=7.5hz,1h),2.35(s,3h)。
(e)-2-formyl-4-(3-methoxystyryl)phenyltrifluoromethanesulfonate
1hnmr(400mhz,dmso-d6)δ10.11(s,1h),8.34(d,j=1.9hz,1h),8.06(dd,j=8.6,2.0hz,1h),7.64(d,j=8.5hz,1h),7.45(s,2h),7.34(t,j=7.9hz,1h),7.23(d,j=7.3hz,2h),6.99-6.86(m,1h),3.82(s,3h)。
(e)-2-formyl-4-styrylphenyltrifluoromethanesulfonate
1hnmr(400mhz,dmso-d6)δ10.12(s,1h),8.35(d,j=2.3hz,1h),8.07(dd,j=8.6,2.3hz,1h),7.65(dd,j=14.2,8.0hz,3h),7.53-7.39(m,4h),7.34(t,j=7.3hz,1h).
(e)-2-formyl-4-(3-(trifluoromethyl)styryl)phenyltrifluoromethanesulfonate
1hnmr(400mhz,dmso-d6)δ10.12(s,1h),8.36(d,j=2.3hz,1h),8.09(dd,j=8.6,2.3hz,1h),8.03(s,1h),7.96(d,j=6.7hz,1h),7.72-7.54(m,5h).
(e)-4-(3,4-dichlorostyryl)-2-formylphenyltrifluoromethanesulfonate
1hnmr(400mhz,dmso-d6)δ10.11(s,1h),8.28(d,j=2.1hz,1h),8.02(dd,j=8.6,2.2hz,1h),7.90(d,j=1.4hz,1h),7.68-7.56(m,3h),7.51(d,j=16.5hz,1h),7.41(d,j=16.5hz,1h).
13cnmr(101mhz,dmso-d6)δ189.20,147.11,138.55,137.70,134.14,132.10,131.71,131.33,130.92,129.79,128.83,128.79,128.23,127.42,123.77,120.24,117.05.
(e)-4-(3,5-bis(trifluofomethyl)styryl)-2-formylphenyltrifluoromethanesulfonate
1hnmr(400mhz,dmso-d6)δ10.12(s,1h),8.47-8.28(m,3h),8.09(dd,j=8.6,2.1hz,1h),8.03(s,1h),7.84(d,j=16.6hz,1h),7.69(dd,j=12.3,10.5hz,2h).
(e)-2-formyl-4-(4-(trifluoromethyl)styryl)phenyltrifluoromethanesulfonate
1hnmr(400mhz,dmso-d6)δ10.12(s,1h),8.38(s,1h),8.11(dd,j=8.6,1.9hz,1h),7.87(d,j=8.0hz,2h),7.78(d,j=7.5hz,2h),7.66(dd,j=8.5,2.0hz,1h),7.64-7.52(m,2h).
(e)-2-formyl-4-(3-(trifluoromethoxy)styryl)phenyltrifluoromethanesulfonate
1hnmr(400mhz,dmso-d6)δ10.12(s,1h),8.35(d,j=2.3hz,1h),8.08(dd,j=8.7,2.4hz,1h),7.73-7.62(m,3h),7.60-7.48(m,3h),7.35-7.29(m,1h).
实施例5
在氮气氛围下,将联硼酸频哪醇酯(0.870g,3.43mmol)和醋酸钾(0.51g,5.19mmol)加入无水1,4-二氧六环中(18ml),并脱气10分钟。加入(e)-4-(3,5-dichlorostyryl)-2-formylphenyltrifluoromethanesulfonate(0.725g,1.71mmol)和pd(dppf)cl2(0.140g,0.17mmol),再次脱气两次。将混合物于80摄氏度搅拌两小时。减压旋除二氧六环后,残余物通过快速柱色谱纯化,得到粗产物,此粗产物直接用于下一步反应。将粗产物溶于4毫升甲醇和3毫升四氢呋喃的混合溶液中,在0摄氏度分批加入硼氢化钠(0.28g,7.41mmol)。混合物搅拌一小时以后,减压除去部分溶剂,加入15毫升水,并用稀盐酸将ph调至3。乙酸乙酯萃取,有机相通过无水硫酸钠干燥,减压蒸干,残余物首先通过柱色谱纯化,然后再用甲苯重结晶,得到0.250克白色固体。两步收率48.2%。1hnmr(400mhz,dmso-d6)δ9.23(s,1h),7.76(d,j=7.6hz,1h),7.72(d,j=1.7hz,2h),7.65-7.57(m,2h),7.54(d,j=16.5hz,1h),7.50(s,1h),7.33(d,j=16.4hz,1h),5.04(s,2h).
13cnmr(101mhz,dmso-d6)δ155.02,141.25,139.06,134.92,132.22,131.27,127.20,127.15,126.26,125.47,119.81,70.29.
参照实施例5的步骤,可以制备如下目标产物:
(e)-5-(3-fluorostyryl)benzo[c][1,2]oxaborol-1(3h)-ol(ix)
1hnmr(400mhz,dmso-d6)δ9.21(s,1h),7.75(d,j=7.3hz,1h),7.66-7.56(m,2h),7.50(d,j=10.6hz,1h),7.46-7.32(m,4h),7.12(s,1h),5.03(s,2h).
(e)-5-(3-chlorostyryl)benzo[c][1,2]oxaborol-1(3h)-ol(x)
1hnmr(400mhz,dmso-d6)δ9.22(s,1h),7.75(d,j=7.6hz,1h),7.71(s,1h),7.59(dd,j=13.9,6.6hz,3h),7.46-7.37(m,2h),7.37-7.30(m,2h),5.02(s,2h).
13cnmr(101mhz,dmso-d6)δ155.04,139.70,139.40,134.09,131.26,130.97,130.62,128.48,127.92,126.51,126.14,125.77,119.65,70.29.
(e)-5-(3-methylstyryl)benzo[c][1,2]oxaborol-1(3h)-ol(xi)
1hnmr(400mhz,dmso-d6)δ9.20(s,1h),7.74(d,j=7.6hz,1h),7.64-7.54(m,2h),7.47-7.38(m,2h),7.33-7.22(m,3h),7.10(d,j=7.5hz,1h),5.02(s,2h),2.33(s,3h).
13cnmr(101mhz,dmso-d6)δ155.07,139.84,138.27,137.25,131.23,130.09,129.08,128.71,127.56,125.95,124.39,119.39,70.30,21.48.
(e)-5-(3-methoxystyryl)benzo[c][1,2]oxaborol-1(3h)-ol(xii)
1hnmr(400mhz,dmso-d6)δ9.21(s,1h),7.74(d,j=7.6hz,1h),7.66-7.55(m,2h),7.37-7.26(m,3h),7.20(d,j=6.3hz,2h),6.87(dd,j=8.0,1.8hz,1h),5.02(s,2h),3.80(s,3h).
13cnmr(101mhz,dmso-d6)δ160.08,155.06,139.75,138.80,131.24,130.19,129.97,129.21,126.00,119.67,119.46,114.11,112.19,70.29,55.53.
(e)-5-styrylbenzo[c][1,2]oxaborol-1(3h)-ol(xiii)
1hnmr(400mhz,dmso-d6)δ9.21(s,1h),7.75(d,j=7.6hz,1h),7.60(dd,j=12.1,7.7hz,4h),7.38(t,j=7.6hz,2h),7.35-7.24(m,3h),5.01(s,2h).
13cnmr(101mhz,dmso-d6)δ155.07,139.78,137.33,131.25,130.02,129.21,128.91,128.34,127.09,125.98,119.45,70.31.
(e)-5-(3-(trifluoromethyl)styryl)benzo[c][1,2]oxaborol-1(3h)-ol(ii)
1hnmr(400mhz,dmso-d6)δ9.22(s,1h),7.94(dd,j=12.7,8.8hz,2h),7.76(d,j=7.6hz,1h),7.62(dd,j=14.5,8.9hz,4h),7.51(d,j=16.5hz,1h),7.45(d,j=16.5hz,1h),5.03(s,2h).
13cnmr(101mhz,dmso-d6)δ155.05,139.36,138.56,131.27,130.99,130.72,130.21,130.11(q,2jc-f=31.4hz),128.42,126.18,124.69(q,1jc-f=273.4hz),124.53(d,3jc-f=3.5hz),123.48(d,3jc-f=3.7hz),119.71,70.28.
(e)-5-(3,4-dichlorostyryl)benzo[c][1,2]oxaborol-1(3h)-ol(iii)
1hnmr(400mhz,dmso-d6)δ9.23(s,1h),7.89(s,1h),7.74(d,j=7.6hz,1h),7.65-7.54(m,4h),7.43(d,j=16.5hz,1h),7.32(d,j=16.5hz,1h),5.02(s,2h).13cnmr(75mhz,dmso-d6)δ155.05,139.25,138.35,132.02,131.28,130.27,128.58,127.46,127.13,126.18,119.70,70.28.
(e)-5-(3,5-bis(trifluoromethyl)styryl)benzo[c][1,2]oxaborol-1(3h)-ol(iv)
1hnmr(400mhz,dmso-d6)δ9.24(s,1h),8.31(s,2h),7.93(s,1h),7.77(d,j=7.6hz,1h),7.71(d,j=16.5hz,1h),7.67-7.59(m,2h),7.54(d,j=16.5hz,1h),5.03(s,2h).
13cnmr(101mhz,dmso-d6)δ155.04,140.32,138.97,133.09,131.34,131.17(q,2jc-f=35.8hz),127.31,126.94,126.34,123.84(q,1jc-f=273.9hz),120.91,119.90,70.26.
(e)-5-(2-(trifluoromethyl)styryl)benzo[c][1,2]oxaborol-1(3h)-ol(vi)
1hnmr(400mhz,dmso-d6)δ9.24(s,1h),8.00(d,j=7.8hz,1h),7.74(dt,j=20.2,7.7hz,3h),7.62(s,1h),7.57(d,j=7.5hz,1h),7.54-7.47(m,1h),7.41(t,j=14.1hz,2h),5.03(s,2h).
13cnmr(101mhz,dmso-d6)δ155.18,139.00,135.91,133.76,133.25,131.44,128.48,127.86,126.39(q,2jc-f=29.7hz),126.36,125.40(q,1jc-f=182.7hz),119.74,70.33.
(e)-5-(4-(trifluoromethyl)styryl)benzo[c][1,2]oxaborol-1(3h)-ol(vii)
1hnmr(400mhz,dmso-d6)δ9.24(s,1h),7.95-7.31(m,9h),5.02(s,2h).
13cnmr(101mhz,dmso-d6)δ155.05,141.43,139.18,131.76,131.28,128.42,128.17(q,2jc-f=31.1hz),127.55,126.28,126.01,119.83,70.28.
(e)-5-(3-(trifluoromethoxy)styryl)benzo[c][1,2]oxaborol-1(3h)-ol(viii)
1hnmr(400mhz,dmso-d6)δ9.18(s,1h),7.75(d,j=7.6hz,1h),7.71-7.58(m,4h),7.53(t,j=8.0hz,1h),7.50-7.36(m,2h),7.31-7.24(m,1h),5.03(s,2h).
13cnmr(101mhz,dmso-d6)δ155.06,149.41,140.01,139.35,131.25,131.05,130.96,128.45,126.19,126.08,120.61(q,1jc-f=257.3hz),120.36,119.69,119.21,70.28。
实施例6稳定性检测实验
对照品bf-175的液相色谱条件:
色谱仪为essentialc-16高效液相色谱仪、dionexultimate3000液相色谱仪;色谱柱为xaquaph5μm100a4.6×250mm;柱温35℃;流动相为乙腈/水70∶30;流速1.000ml/min;进样量10μl;检测波长315nm。分别移取1mg/ml乙腈储备液20μl于4个10ml容量瓶中,各加入4ml0.1m盐酸(或者4ml0.1m氢氧化钠),37℃水浴保温,分别于5min,1h取出,用乙腈定容至刻度,混匀,过滤,进样。考察样品在0.1m盐酸和氢氧化钠中稳定性。
化合物的液相色谱条件:
色谱仪为essentialc-16高效液相色谱仪、dionexultimate3000液相色谱仪;色谱柱为xaquaph5μm100a4.6×250mm;柱温35℃;流动相为乙腈/水60∶40;流速1.000ml/min;进样量10μl;检测波长313nm。分别移取0.1mg/ml乙腈储备液200μl于8个10ml容量瓶中,各加入4ml0.1m盐酸(或者4ml0.1m氢氧化钠),37℃水浴保温,分别于5min、2h、5h、19h取出,用乙腈定容至刻度,混匀,过滤,进样。考察样品在0.1m盐酸和0.1m氢氧化钠中稳定性。
结果详见说明书附图1:bf-175及其衍生物的hplc结果。(a):bf-175的hplc分析结果;(b):bf-175在0.1m盐酸中放置5分钟后的hplc分析结果;(c):bf-175在0.1m盐酸中放置5分钟后的hplc分析结果;
上述结果证明bf-175在酸性条件下极其不稳定,而其衍生物在相同条件下稳定。
实施例7rt-pcr检测实验
1.实验试剂
2.实验步骤:
2.1an3ca细胞复苏及培养(mem培养基10%血清1%双抗);
2.2传代(1∶2比例传代);
2.3待细胞状态好时铺6孔板,5×105/孔,培养过夜;
2.4加药:用培养基稀释药物终浓度为10μm,2ml/孔;
2.5加药处理48h后提rna;
2.5.1去除培养基后加0.5ml/孔trizol裂解细胞,待5min后用移液枪反复吹打完全裂解移到无rna酶的1.5mlep管内,静止5min;
2.5.2加200μl氯仿迅速震荡混匀,静止10min12000rpm/15min;
2.5.3小心取出上清液移至ep管内加同体积的异丙醇,颠倒混匀静止10min离心12000rpm/10min;
2.5.4去除上清,加1ml75%乙醇洗涤一次离心8000rpm/5min,小心去除干净上清,室温放置10min让乙醇挥发干净,等沉淀变成透明状时加40μldepc处理水溶解;
2.5.5测rna浓度,depc处理水浓度稀释成100ng/μl
2.6逆转录
试剂盒takara(primescripttmrtreagentkit(perfectrealtime)
表一:化合物诱导scd-1基因表达含量变化
rt-pcr结果表明,除了化合物vi和vii以外,所有化合物均能不同程度的降低srebp靶基因scd-1的相对mrna表达水平,其中化合物ii和iv活性优于bf-175。
尽管benzoxaborole和travaborole也具有苯并硼杂氧杂环戊烷的结构(结构式见附图2),但是其不具有降低scd-1基因表达的活性(见表一)。与化合物ii、iv、xiv、ix、x、xi、xii、iii等化合物相比,benzoxaborole和travaborole不含有取代二苯乙烯的结构片段。因此,初步构效关系提示,母核为二苯乙烯的苯并硼杂氧杂环戊烷的结构为此类化合物的活性结构。
实施例8细胞克隆形成检测实验
1.实验步骤:
1.1an3ca细胞复苏及培养(mem培养基,10%血清,1%双抗);
1.2传代(1:2比例传代);
1.3待细胞状态好时铺6孔板,500/孔,培养过夜;
1.4加药:用培养基稀释药物终浓度为10μm,2ml/孔;
1.5每隔两天换液形式加药;
1.6经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用pbs小心浸洗2次,空气干燥。加4%多聚甲醛固定细胞5ml固定30分钟或用甲醇固定10分钟。空气干燥后去固定液,加适量gimsa应用染色液染10~30分钟,然后用流水缓慢洗去染色液,空气干燥。
1.7将平皿倒置并叠加一张带网格的透明胶片,用肉眼直接计数克隆,或在显微镜(低倍镜)计数大于10个细胞的克隆数。最后计算克隆形成率。
1.8克隆形成率=(克隆数/接种细胞数)×100%
克隆形成实验结果见说明书附图3,可以看出,代表性化合物对an3ca细胞克隆形成率均有不同程度的抑制作用。5μm化合物xiv与10μmbf175对an3ca细胞克隆形成率抑制效果相当。化合物ii对an3ca细胞克隆形成率抑制效果最为明显,10μm化合物ii可以完全抑制an3ca细胞克隆形成。
实施例9细胞增殖检测实验
1.实验步骤:
1.1an3ca细胞复苏及培养(mem培养基,10%血清,1%双抗);
1.2传代(1∶2比例传代);
1.3待细胞状态好时铺96孔板,1×104/孔,培养过夜;
*培养基用10%脱脂血清
1.4加药:用培养基稀释药物终浓度为10μm,100μl/孔处理48h;
*培养基用10%脱脂血清
1.5加20μlmts/孔,小心加防止产生气泡,1-4h后490nm测数据
结果见说明书附图4。可以看出,代表性化合物ii、iv、xiv对an3ca细胞均有不同程度的抑制作用,其中化合物ii优于bf175。化合物ii在10μm时可以将an3ca细胞抑制80%。
实施例10化合物抑制and-1的ic50值(μm)
表2:代表性化合物对igrov1cr和ov90cr两种细胞and-1抑制的ics0值(μm)
结果表明,化合物对igrov1cr和ov90cr两种卵巢癌细胞有不同程度的抑制作用,代表性化合物iii对igrov1cr细胞and-1抑制的ic50值为7.8μm。
实施例11免疫印迹检测and-1蛋白表达实验
1.实验步骤:
选取生长状态良好的a549细胞,分别以50万的密度接种于60mm培养皿中,37℃,5%co2恒温培养箱内培养24h后,加入相同浓度(5μm)的不同化合物,继续培养24h后收集细胞,做蛋白免疫印迹实验,与未加药的细胞作对照,检测各个化合物对and-1蛋白表达的抑制效果。
结果见说明书附图5。代表性化合物iii可以显著抑制a549细胞系中and-1蛋白的表达。
因此,式i所示的化合物均能不同程度的抑制多种细胞系中srebp和and-1的活性。其中,代表性化合物iii、x、ii在10μm时对人子宫内膜癌an3ca细胞srebp有较高的抑制作用,同时对人卵巢癌细胞igrov1、ov90以及肺癌细胞a549的and-1蛋白有较好的抑制活性。式i所示的化合物有望成为抗肿瘤药物或放化疗增敏药物。
- 还没有人留言评论。精彩留言会获得点赞!