一种利用微藻快速脱硝的方法及其应用与流程
本发明属于工业生物
技术领域:
,特别涉及一种利用微藻快速脱硝的方法及其应用。
背景技术:
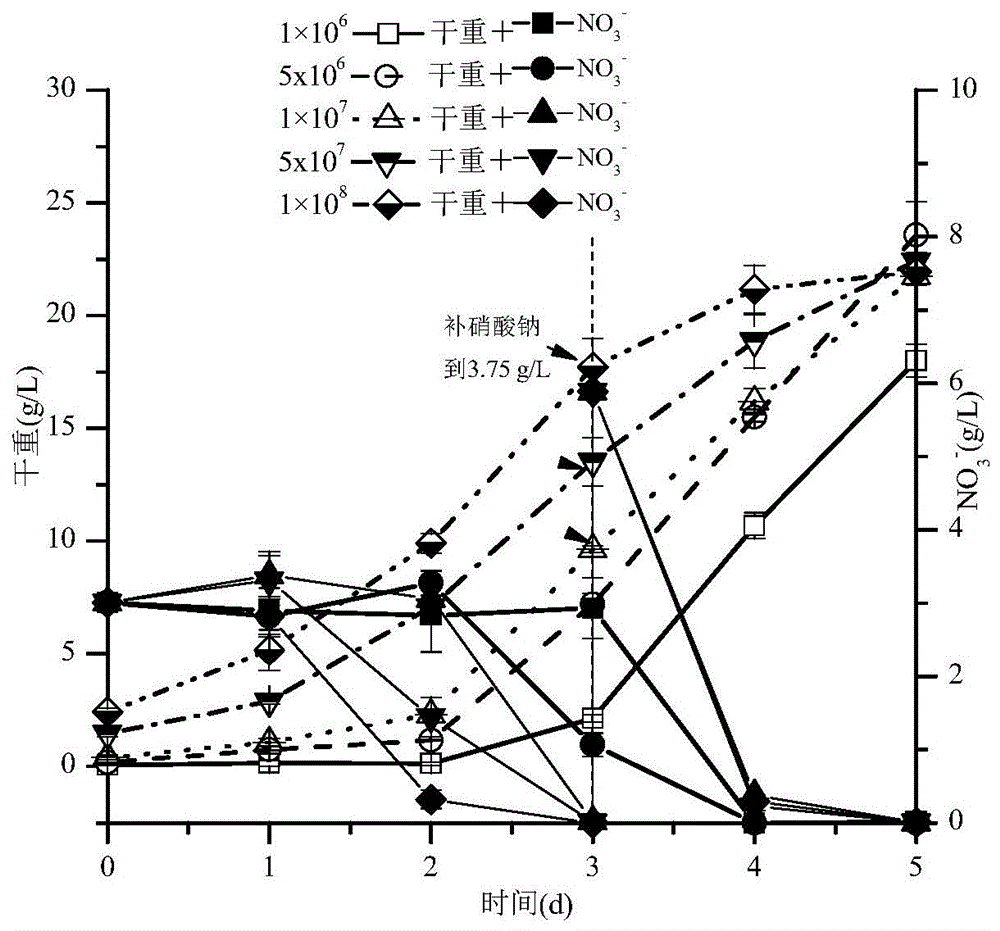
:人类工业化进程的加速发展,在提升人们生活质量的同时,也带来了严重的水污染,其中食品、皮革、造纸和化肥等工业产生的废水会导致含氮化合物的大量排放,特别是硝酸盐的大量排放。工业生产过程中排放的烟道气中也存在大量的氮氧化物(nox),后续会转化为硝酸、硝酸盐等高浓度含氮废液;烟道气脱硝塔也产生大量的废硝酸,这些废硝酸、高硝酸盐废水,统称为高硝氮工业废水。高硝氮工业废水通常含有超过200毫克/升的no3--n,而生产炸药、化肥、果胶、玻璃纸和金属加工的工业废水含有超过1000毫克/升的no3--n。按照国家发布的《铜、镍钴工业污染物排放标准》,工业废水中no3-的直接排放标准不超过15mg/l,间接排放不超过40mg/l。若高硝氮工业废水不经处理直接排放到水体中,不仅会造成水环境的富营养化,而且会伴随饮用水或其他途径进入人体,诱发如高铁血红蛋白症、致癌和致基因突变等疾病,威胁人类的身体健康。因此,如何高效处理高硝氮工业废水是当前工业界面临的一个迫在眉睫的难题。国内外常见的处理高硝氮工业废水的方式主要分为物化处理和生化处理两种方式。物化处理又分为化学脱氮、催化脱氮、反渗透脱氮和离子交换脱氮等,而生化处理主要为生物脱氮法。这些方法优缺点不一,但就废水的处理效率、处理能力及氮素的循环利用等方面均存在明显的局限性。在生物处理法中,尤其是基于微藻培养的生物处理法,不仅能够将废水中硝酸盐快速吸收并转化为生物质中的蛋白质,而且具有成本较低且能变废为宝的优势和特点,在处理高硝氮工业废水及其资源化利用方面具有广阔的应用前景。微藻具有的最突出特点是生长速度快、环境适应性强、培养方式多样以及可以利用水体中的多种氮素转化为高价值的微藻含氮化合物(如蛋白质、叶绿素等)。因此,利用微藻高效脱氮从而降低废水中氮含量是可行的。蛋白核小球藻(chlorellapyrenoidosa)作为水体中的初级生产者,可以将水体中的氮磷等富营养物质转化为高品质的微藻生物质,其胞内的蛋白质含量可达干重的30~68%。目前,蛋白核小球藻已经广泛应用于渔场养殖过程中的调水剂和鱼虾等水生动物的饵料。2012年我国已经批准蛋白核小球藻为新资源食品,可作为大豆等植物蛋白源的功能替代品。近年来,已有大量的研究将蛋白核小球藻与废水处理结合起来,实现了废水减排,并获得了富含高值化产品的微藻生物质资源。中国专利申请201811416938.6利用小球藻/斜生栅藻处理缫丝废水的同时获得含蛋白质的微藻生物质(采用光照摇床的方式,培养周期为16~24d),但缫丝废水中总氮含量尤其是硝态氮含量低,同时该专利申请中小球藻的蛋白质产量只有7.70~14.41mg/l。可见,该专利申请虽然实现了废水处理及联产微藻生物质,但脱硝能力及蛋白质产量低,不能满足实际应用的需要。中国专利申请201810266297.4公开了一种利用蛋白核小球藻处理红曲霉发酵废水及联产微藻蛋白饲料的方法(培养周期为7~10d),尽管该专利申请中小球藻处理废水后获得的生物质中粗蛋白含量可达63.77%,但该专利申请中原始废水经预处理后总氮含量只有910mg/l(其中氨氮占55%,硝氮含量并未给出),同时,上述两个专利的培养系统均在摇瓶系统中,未进行规模化试验,与发酵罐系统的培养存在显著差异,无法用于工业废水处理中。中国专利申请201811502958.5公开了一种硝酸废液生产微藻中清洗废水的处理方法,采用自养方式,培养周期为1~36d;中国专利申请201811502952.8公开了一种利用微藻处理高硝废水的方法,通过发酵(培养周期为1~36d)、反应、浓缩和干燥,使微藻能够对高硝态氮废水中的硝酸根离子进行吸收,并获得微藻生物质。这两个专利申请微藻培养周期长,并未微藻的脱硝能力以及对获得的微藻生物质进行蛋白含量等品质进行评估,无法判断其营养价值。因此,现有技术尚未将利用微藻快速高效处理高硝氮废水和联产高蛋白生物质有机地结合起来,不利于实现这类废水的资源化高效利用。技术实现要素:本发明的首要目的在于克服现有技术的缺点与不足,提供一种利用微藻快速脱硝的方法。本发明的另一目的在于提供所述利用微藻快速脱硝的方法的应用。本发明的目的通过下述技术方案实现:一种利用微藻快速脱硝的方法,包括如下步骤:s1、将微藻细胞培养至对数生长期,得到微藻种子液;s2、将微藻种子液接种至装有含高硝氮的发酵培养基的发酵罐中进行间歇补料兼养发酵,当发酵培养基中的葡萄糖浓度低于5g/l(优选为低于10g/l)时,补加葡萄糖使发酵体系中的葡萄糖浓度高于10g/l,并控制ph值为6.0~7.5;其中,含高硝氮的发酵培养基中的no3-的浓度高于3000mg/l。步骤s1中所述的微藻为小球藻、栅藻、胶球藻和色绿藻中的至少一种;优选为蛋白核小球藻(chlorellapyrenoidosa)。步骤s1中所述的微藻微藻种子液优选为通过如下方法获得:(1)将微藻细胞接种至基础培养基的斜面上进行培养,获得微藻藻苔;(2)将步骤(1)中获得的微藻藻苔转接到液体基础培养基上进行培养,得到微藻种子液。步骤(1)中所述的培养的条件优选为:培养温度30~35℃(优选为30℃),光照10μmol/m2/s。步骤(2)中所述的液体基础培养基的组成成分如下:葡萄糖10g/l;edta500mg/l;fecl3·7h2o49.8mg/l;co(no3)2·6h2o15.7mg/l;h3bo3114.2mg/l;nano31250mg/l;mgso4·7h2o1000mg/l;cacl2·2h2o111mg/l;znso4·7h2o88.2mg/l;kh2po41250mg/l;cuso4·5h2o15.7mg/l;mncl2·h2o14.2mg/l;na2moo4·2h2o11.92mg/l;ph6.1。步骤(2)中所述的培养的条件优选为:培养温度30~35℃(优选为30℃),光照10μmol/m2/s,转速150rpm,培养时间3~5天。步骤s2中所述的微藻种子液的接种量为按其在所述发酵体系的终浓度为1×106~1×1010cfu/ml添加计算(即接种量为5%~10%(v/v));优选为按其在所述发酵体系的终浓度为5×106~1×108cfu/ml添加计算;更优选为按其在所述发酵体系的终浓度为1×108cfu/ml(即接种量为8%(v/v))添加计算。步骤s2中所述的含高硝氮的发酵培养基中的no3-的浓度为高于3600mg/l;优选为3600~25600mg/l;更优选为3600~11000mg/l;最优选为3647~10941mg/l。步骤s2中所述的含高硝氮的发酵培养基的组成成分优选为:葡萄糖0~50g/l;nano35~35g/l;kh2po41.25g/l;edta500mg/l;mgso4·7h2o1000mg/l;cuso4·5h2o15.7mg/l;fecl3·7h2o49.8mg/l;cacl2·2h2o111mg/l;mncl2·h2o14.2mg/l;co(no3)2·6h2o15.7mg/l;znso4·7h2o88.2mg/l;na2moo4·2h2o11.92mg/l;h3bo3114.2mg/l。步骤s2中所述的含高硝氮的发酵培养基的组成成分更优选为:葡萄糖5~20g/l;nano35~15g/l;kh2po41.25g/l;edta500mg/l;mgso4·7h2o1000mg/l;cuso4·5h2o15.7mg/l;fecl3·7h2o49.8mg/l;cacl2·2h2o111mg/l;mncl2·h2o14.2mg/l;co(no3)2·6h2o15.7mg/l;znso4·7h2o88.2mg/l;na2moo4·2h2o11.92mg/l;h3bo3114.2mg/l。步骤s2中所述的含高硝氮的发酵培养基的组成成分最优选为:葡萄糖5g/l;nano310g/l;kh2po41.25g/l;edta500mg/l;mgso4·7h2o1000mg/l;cuso4·5h2o15.7mg/l;fecl3·7h2o49.8mg/l;cacl2·2h2o111mg/l;mncl2·h2o14.2mg/l;co(no3)2·6h2o15.7mg/l;znso4·7h2o88.2mg/l;na2moo4·2h2o11.92mg/l;h3bo3114.2mg/l。步骤s2中所述的含高硝氮的发酵培养基为经过高温高压灭菌处理的发酵培养基。所述的高温高压灭菌处理优选为通过如下方式实现:110~121℃的水蒸气连续喷射灭菌或高温高压实罐灭菌;优选为121℃高压灭菌15min。步骤s2中所述的发酵罐为光发酵罐(装填系数70%~80%);优选为1~50000l的光发酵罐;更优选为5~50l的光发酵罐。步骤s2中所述的发酵培养的光照强度为20~2000μmol/m2/s(发酵罐中心的光照强度);优选为120~560μmol/m2/s;更优选为120~210μmol/m2/s。步骤s2中所述的发酵培养所采用的光源为led正白光、暖白光或自然白;优选的为正白光。步骤s2中所述的发酵培养的条件为:温度30~35℃(优选为30℃),搅拌转速100~250rpm,发酵周期60~84h,通气量0.5~2.0vvm(优选为1.5vvm),培养至发酵体系中氮或磷的含量为0时终止培养。步骤s2中所述的补加葡萄糖优选为通过流加葡萄糖溶液的方式进行;所述的葡萄糖溶液的浓度为450~700g/l(优选为500g/l)。步骤s2中所述的补加葡萄糖优选为补加葡萄糖使发酵体系中的葡萄糖浓度为10~50g/l;优选为10~20g/l;更优选为10~15g/l。步骤s2中所述的ph值优选为6.5。步骤s2中所述的ph值的调节剂优选为硝酸溶液;优选为0.5~1mol/l的硝酸溶液。步骤s2中所述的发酵培养中还可以加入消泡剂进行消泡(根据泡沫情况适当流加)。所述的消泡剂优选为ppe聚醚消泡剂。所述的ppe聚醚消泡剂的浓度为质量体积比3‰。所述的利用微藻快速脱硝的方法,在步骤s2之后还包括如下步骤:s3、待发酵结束后,将微藻分离洗涤、冷冻干燥,得到含高蛋白的微藻生物质。步骤s3中所述的冷冻干燥优选为-40℃真空冷冻干燥。所述的利用微藻快速脱硝的方法在废水处理或生产富含蛋白质的微藻生物质中的应用。所述的废水为高硝氮工业废水;优选为no3-浓度高于3000mg/l的工业废水;进一步优选为no3-浓度高于3600mg/l的工业废水;再进一步优选为no3-浓度为3600~25600mg/l的工业废水;更优选为no3-浓度为3600~11000mg/l的工业废水;最优选no3-浓度为3647~10941mg/l的工业废水。本发明相对于现有技术具有如下的优点及效果:(1)本发明为高硝氮工业废水的处理及其资源化利用提供了一种新方法。通过改良基础培养基获得含高硝氮的兼养发酵培养基,灭菌后接种蛋白核小球藻进行高密度光发酵,间歇补加碳氮源(葡萄糖和硝酸),发酵结束时生物量浓度可高达23.40~30.10g/l,收获的微藻生物质中蛋白质含量可达干重的50.06~52.88%;光发酵过程中硝酸根最高的平均消耗速率可高达5.15g/l/d,同步实现了快速脱硝、微藻高密度培养和高蛋白生物质的产出,为实现高硝氮工业废水的资源化利用和藻基高蛋白饲料原料生产相结合提供了一条新的、高效、经济的方法,既减少了高硝氮废水的排放,又实现了硝态氮的资源化循环利用。(2)本发明通过微藻高密度培养去除培养基中高浓度的硝酸根并实现氮资源转化利用。该方法利用蛋白核小球藻在改良的含高硝氮的基础培养基进行培养,通过兼养高密度培养,优化小球藻培养条件,以实现小球藻去除培养基中硝酸根的高速率为目标,并最终同时获得了高蛋白含量的小球藻生物质。这种方法一方面能够实现微藻快速处理高硝氮工业废水,减少污水排放和节约水资源;另一方面还能得到富含蛋白质的微藻生物质,实现高价值微藻生物质的经济生产,是一种绿色循环经济的新技术途径,具有良好的环境效益和社会效益。(3)本发明在发酵罐体系中进行微藻培养,因培养体系的改变使得光照强度、通气量的调控区别于摇瓶体系,同时发酵罐系统的分批补料的策略无法快速无菌地在摇瓶体系中实现,因此,摇瓶体系的成功并已不一定能复制在发酵罐体系中,而在本发明的发酵罐体系中,无论是生物量产量还是脱硝能力均优于摇瓶体系,且该发酵体系可以顺利地扩大至工业规模,附图说明图1是在摇瓶中不同接种密度下蛋白核小球藻兼养细胞生长及硝酸根消耗情况图。图2是在摇瓶中不同硝酸钠浓度下蛋白核小球藻兼养细胞生长及硝酸根消耗情况图。图3是在摇瓶中不同光照强度下蛋白核小球藻兼养细胞生长及硝酸根消耗情况图。图4是在5l光发酵罐中不同初始葡萄糖浓度下兼养蛋白核小球藻生物量增长曲线图。图5是在5l光发酵罐中不同初始葡萄糖浓度下兼养蛋白核小球藻细胞中蛋白质含量变化图。图6是在5l光发酵罐中不同初始葡萄糖浓度下兼养蛋白核小球藻生物质产率、硝酸根同化速率和蛋白质产率图。图7是在5l光发酵罐中不同初始硝酸钠浓度下兼养蛋白核小球藻生物量增长曲线图及磷酸根的消耗情况图。图8是在5l光发酵罐中不同初始硝酸钠浓度下兼养蛋白核小球藻中蛋白质含量变化图。图9是在5l光发酵罐中不同初始硝酸钠浓度下兼养蛋白核小球藻生物质产率、硝酸根同化速率和蛋白质产率图。图10是在5l光发酵罐中不同ph下兼养蛋白核小球藻生物量增长曲线图。图11是在5l光发酵罐中不同ph下兼养蛋白核小球藻中蛋白质含量变化图。图12是在5l光发酵罐中不同ph下兼养蛋白核小球藻生物质产率、硝酸根同化速率和蛋白质产率。具体实施方式下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本
技术领域:
常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。本发明实施例中采用的检测方法可参照如下说明进行:(一)蛋白核小球藻中生物量浓度的测定蛋白核小球藻(chlorellapyrenoidosa)培养过程中的生物量浓度测定方法采用干重法进行测定。吸取2ml藻液置于已准确称重的2ml离心管中,离心后将所得藻泥用超纯水反复清洗离心两次,然后将含有藻泥的离心管放入60℃恒温烘箱中烘干至恒重。用分析天平称量并计算得到烘干藻粉的重量。生物量以及生物量产率(单位:g/l/d)的计算根据公式:生物量(gl-1)=(m2-m1)/0.002;式中:m1,空离心管质量(g);m2,含有干燥藻泥的离心管质量(g)。生物量产率=(dw2-dw1)/2-t1);式中dw1,dw2分别代表t1和t2时间点的生物量。(二)蛋白核小球藻中no3-、po43-和葡萄糖浓度的测定1)no3-和po43-浓度的测定使用意大利hannahi83200多参数水质分析仪进行测定。选择合适的量程范围(0~30mg/l),将待测样品稀释到测定范围(0~30mg/l)内,按照仪器说明,在比色皿中加入相应的hi93728硝酸根和hi93717磷酸根试剂进行测定并读数。读数结束后,读数乘以稀释倍数即为培养基内no3-和po43-的含量。no3-平均同化速率(单位:g/l/d)的计算根据公式:平均同化速率=(nt2-nt1)/(t2-t1);式中nt1、nt2分别代表t1和t2时间点的硝酸根浓度。2)葡萄糖浓度的测定葡萄糖浓度采用sba-40d生物传感分析仪进行测定,矫正范围为0.5~1.0g/l。测定前,取待测样品的上清液,经0.45μm滤膜过滤后稀释到葡萄糖浓度矫正范围内。用1.0g/l的葡萄糖标准液进行定标,待定标通过后,用微量注射器吸取25μl处理好的上清液进行测定,每个样品重复测定三次后取平均值,测定读数乘以稀释倍数,即为待测样品的葡萄糖浓度。(三)蛋白核小球藻中蛋白质含量的测定采用foss公司的半自动凯氏定氮仪测定蛋白质含量。蛋白质产率采用如下公式计算:蛋白质产率(g/l/d)=(dw2×pc2-dw1×pc1)/(t2-t1);式中,dw1、dw2分别代表t1和t2时间点的生物量浓度,pc1、pc2分别代表t1和t2时间点的蛋白质含量。实施例1在摇瓶中不同起始细胞密度对蛋白核小球藻的生长及硝酸根同化速率的影响1.1菌种活化及种子液制备将蛋白核小球藻藻种转接到含有基础培养基的斜面上进行培养,培养温度为30℃,光照为10μmol/m2/s,培养3~5天并观察蛋白核小球藻的生长情况。用接种环将蛋白核小球藻藻苔接种到装有基础液体培养基的三角瓶中(装液量为100ml)进行培养,在30℃、10μmol/m2/s的恒温振荡摇床中(转速为150rpm)进行培养,培养3~5天用作种子液。其中,所述的基础培养基(ph6.1)成分如下表1所示(单位为mg/l):表1液体培养基配方组分含量(mg/l)组分含量(mg/l)组分含量(mg/l)葡萄糖10000nano31250kh2po41250edta500mgso4·7h2o1000cuso4·5h2o15.7fecl3·7h2o49.8cacl2·2h2o111mncl2·h2o14.2co(no3)2·6h2o15.7znso4·7h2o88.2na2moo4·2h2o11.92h3bo3114.2///注:edta为乙二胺四乙酸1.2不同起始细胞密度下蛋白核小球藻的培养将培养好的蛋白核小球藻种子液转接至改良的基础培养基,控制起始细胞密度分别为1×106、5×106、1×107、5×107和1×108cfu/ml,并将摇瓶置于恒温振荡摇床中,观察蛋白核小球藻的生长及硝酸根同化的影响情况。其中所用的改良的基础培养基的配方与表1中的配方相比,不同之处在于:初始葡萄糖和nano3浓度分别为50g/l和3.75g/l;同时,采用分批补料方式,当培养基中的葡萄糖浓度<10g/l,补料流加葡萄糖(母液浓度为500g/l)使得培养基中的葡萄糖浓度为50g/l。培养温度30℃,转速150rpm,光照强度120μmol/m2/s,培养5天。培养过程中,每天收集藻液,离心取藻泥洗涤多次后,恒温烘干至恒重,测量生物量;离心后取上清液,测定葡萄糖浓度,确定流加的葡萄糖母液体积;测定no3-的浓度,计算no3-同化速率。1.3实验结果在不同起始细胞密度下,蛋白核小球藻的生物量和硝酸根浓度的变化见图1。结果表明,当起始细胞密度高于5×106cfu/ml时,蛋白核小球藻的生物量浓度之间无显著差异,基本保持在21.75g/l以上。随着初始细胞密度的提高,硝酸根同化速率也逐步提高。培养到第2天,当细胞密度为1×108cfu/ml时,其硝酸根平均同化速率达到最大值,为2.51g/l/d,显著高于其他组别(p<0.01)。实施例2在摇瓶中不同硝酸钠浓度对蛋白核小球藻细胞生长和硝酸根同化速率的影响2.1藻种活化及种子液制备将蛋白核小球藻按1.1所述的培养方法,培养3~5天用作种子液。2.2不同硝酸钠浓度下蛋白核小球藻的培养将培养好的蛋白核小球藻种子液按1.2所述的方法,控制初始细胞密度为1×108cfu/ml,分装到不同硝酸钠浓度(终浓度为5、15、25和35g/l)的培养基中进行培养。光照为210μmol/m2/s,其余条件与1.2相同,培养4天。培养过程中样品的收集处理及相关指标的测定参照1.2中所述的方法。2.3实验结果在不同硝酸钠浓度下,蛋白核小球藻的生物量和硝酸根浓度变化情况如图2所示。结果表明,当硝酸钠浓度超过25g/l时,蛋白核小球藻的生物量增长缓慢;当硝酸钠浓度为5~15g/l时,小球藻的生物量浓度在14.88~21.08g/l之间,同时获得较高的硝酸根平均同化速率(1.81~2.15g/l/d)。实施例3在摇瓶中不同光照强度对蛋白核小球藻的生长及硝酸根同化速率的影响3.1藻种活化及种子液制备将蛋白核小球藻按1.1所述的培养方法,培养3~5天用作种子液。3.2不同光照强度下蛋白核小球藻的培养将培养好的蛋白核小球藻种子液按1.2所述的方法,控制起始细胞密度为1×108cfu/ml,光照强度分别为120、150、180、210μmol/m2/s。同时,培养体系中初始葡萄糖和nano3浓度分别为20g/l和15g/l,当培养基中的葡萄糖浓度<10g/l,补料流加葡萄糖(母液浓度为500g/l)使得培养基中的葡萄糖浓度为20g/l。其余条件与1.2相同,培养6天。培养过程中样品的收集处理及相关指标的测定参照1.2中所述的方法。3.3实验结果在不同光照强度下,蛋白核小球藻的生物量和硝酸根浓度变化情况如图3所示。结果表明,当光照强度在150~210μmol/m2/s时,生物量之间无显著性差异,在33.75~35.22g/l之间。同时,硝酸根同化速率在120~210μmol/m2/s之间也无显著性差异,在1.14~1.38g/l/d之间,由此可知,在摇瓶兼养条件下培养蛋白核小球藻,光照强度为210μmol/m2/s时更有利于细胞增殖,进而促进微藻高效同化硝酸根。实施例4在5l光发酵罐中不同初始葡萄糖浓度对蛋白核小球藻生长、硝酸根同化速率及蛋白质产量的影响4.1菌种活化及种子液制备将蛋白核小球藻按1.1所述的培养方法,培养3~5天用作种子液。4.2在5l光发酵罐中不同初始葡萄糖浓度下蛋白核小球藻兼养高密度的培养将培养好的蛋白核小球藻种子液按照8%的接种体积(发酵体积3.5l)接种到灭菌后的改良基础培养基中,控制起始细胞密度为1.0×108cfu/ml,设置初始葡萄糖浓度分别为5和20g/l。培养基及补料瓶121℃高压灭菌15min。发酵过程中流加葡萄糖母液(450~700g/l)维持发酵过程中葡萄糖浓度为10~20g/l,具体的葡萄糖补料策略如下:当初始葡萄糖浓度为5g/l时,在12h时补加葡萄糖使其浓度维持在10g/l,36h后每12h补加葡萄糖使其浓度维持在15~20g/l;当初始葡萄糖浓度为20g/l时,当葡萄糖浓度<5g/l时,补加葡萄糖使其浓度维持在25~30g/l。光发酵罐中通气量维持在1.5vvm左右。配制3‰(m/v,消泡剂/培养基)的消泡剂(ppe聚醚消泡剂,济南兴隆飞化工有限公司),在发酵过程中当泡沫高于泡位时,添加适量消泡剂减少泡沫的干扰。发酵过程中采用0.5mol/l硝酸溶液进行调节,控制ph为6.5。其中,本实施例中所用的改良基础培养基,其配方与表1中的配方相比,不同之处在于:初始nano3浓度为15g/l。本实施例中的培养温度30℃,光源采用led正白光硬灯条串联并排放置,当初始葡萄糖浓度为5g/l,光照强度为120μmol/m2/s;当初始葡萄糖浓度为20g/l时,光照强度随培养时间根据细胞生长情况从120μmol/m2/s逐步增加到560μmol/m2/s。培养时间为72h。培养过程中,在5g/l和20g/l葡萄糖条件下,分别每12h和8h收集藻液,离心取藻泥,洗涤多次后,一部分藻泥恒温烘干至恒重,测量生物量;另一部分藻泥-40℃真空冷冻干燥获得冻干藻粉,测量藻粉蛋白质含量;离心后取上清液,测定葡萄糖浓度,确定流加的葡萄糖母液体积;测定no3-的浓度,计算no3-平均同化速率。4.3实验结果在不同初始葡萄糖浓度下,蛋白核小球藻的生物量、蛋白质含量、生物质产率、硝酸根同化速率及蛋白质产率如图4~6所示。如图4所示,蛋白核小球藻在两组中均出现了24h的延滞期,而在初始葡萄糖浓度为20g/l时,结束培养时获得了最大的生物量浓度(37.2g/l)。如图5所示,在葡萄糖浓度为5g/l时,蛋白核小球藻在培养过程中的蛋白质含量始终高于20g/l条件下,在48h时其蛋白质含量高出20g/l葡萄糖条件下33%。在结束培养时,5g/l葡萄糖条件下蛋白核小球藻的蛋白质含量为干重的48.47%。如图6所示,在葡萄糖浓度为5g/l时,蛋白核小球藻获得了最大的硝酸根平均同化速率,为4.47g/l/d,高出20g/l条件下27%。虽然在葡萄糖浓度为5g/l条件下,生物量浓度未获得较大增长,但是蛋白质含量及硝酸根平均同化速率均高于20g/l葡萄糖浓度下。因此,选择5g/l初始葡萄糖浓度能在高硝氮培养基中实现快速脱硝及联产高蛋白生物质,同时可以缩减工业化中的生产成本。实施例5在5l光发酵罐中不同初始nano3浓度对蛋白核小球藻生长、硝酸根同化速率及蛋白质产量的影响5.1菌种活化及种子液制备将蛋白核小球藻按1.1所述的培养方法,培养3~5天用作种子液。5.2在5l光发酵罐中不同初始nano3浓度下蛋白核小球藻兼养高密度培养发酵前期相关溶液的制备及灭菌以及发酵开始时的细胞接种参照4.2中所述的方法。设定发酵体系中初始nano3浓度分别为5、10和15g/l,初始葡萄糖浓度为5g/l。当葡萄糖浓度<10g/l,在前24h内补加葡萄糖母液(450~700g/l)使其维持糖浓度在10~15g/l,24h后到培养结束维持糖浓度在15~20g/l。其中在第36h时,初始nano3浓度为15g/l的补糖浓度为10~15g/l;对于不同初始浓度的硝酸钠,在培养开始时的光照强度为100~120μmol/m2/s,在结束培养的前12h,提高光照强度到140~160μmol/m2/s。发酵过程中所用的ph调节剂为1mol/l的硝酸溶液,控制ph为6.5;其余条件与4.2相同,培养60~84h(当初始po43-浓度为0时即终止培养)。培养过程中样品的收集及测定参照4.2中所述的方法。5.3实验结果在不同初始nano3浓度下,蛋白核小球藻的生物量、蛋白质含量、生物质产率、硝酸根同化速率及蛋白质产率如图7~9所示。其中,当初始nano3浓度分别为5、10和15g/l时,终止培养的时间点分别为60、60和84小时。由图7可知,在10g/l的初始nano3实验条件下,尽管po43-浓度在60h降为0,蛋白核小球藻的生物量仍可继续增长,并在84h获得最高的生物量浓度(33.07g/l);如图8所示,当nano3浓度为5~10g/l时,终止培养时蛋白质含量可达51.48%~52.36%。同时,在起始nano3为10g/l的条件下,终止培养时其生物量产率、硝酸根平均同化速率及蛋白质产率分别为7.88g/l、5.15g/l/d及4.51g/l/d,显著高于其他组别。这表明在初始葡萄糖浓度为5g/l,初始nano3浓度10g/l的条件下,蛋白核小球藻可以在获得较高的硝酸根平均同化速率的同时获得较高的蛋白质产率(图9)。实施例6在5l光发酵罐中不同ph对蛋白核小球藻生长、硝酸根同化速率及蛋白质产量的影响6.1菌种活化及种子液制备将蛋白核小球藻按1.1所述的培养方法,培养3~5天用作种子液。6.2在5l光发酵罐中不同ph下蛋白核小球藻在发酵罐中的兼养高密度培养发酵前期相关溶液的制备及灭菌以及发酵开始时的细胞接种参照5.2中所述的方法。设定发酵体系中初始葡萄糖浓度和初始nano3浓度分别为5g/l和10g/l,设定ph分别为6.0、6.5和7.5,其余条件与5.2相同。培养条件和测定方法具体可参照5.2中所述的方法。6.3实验结果在不同ph下蛋白核小球藻的细胞生物量、蛋白质含量、生物质产率、硝酸根同化速率及蛋白质产率如图10~12所示。其中,当初始ph分别为6.0、6.5和7.5时,终止培养的时间点分别为72、60和72小时。图10表明,蛋白核小球藻在不同ph下的生物量之间无显著差异。由图11可知,在ph6.5的条件下,60h时蛋白核小球藻细胞内的蛋白质含量占细胞干重的51.48%,高于其他组别;但在72h时,蛋白核小球藻在ph7.5条件下获得了更高的蛋白质含量(52.88%)。图12表明,在ph6.5的条件下,硝酸根平均同化速率可达到5.15g/l/d,是ph6.0和ph7.5条件下的1.34和6.44倍。综合实施例1~6表明,在发酵罐兼养条件下,当初始葡萄糖和nano3浓度分别为5g/l和10g/l,发酵罐维持的ph值为6.5时,蛋白核小球藻能获得较高的硝酸根平均同化速率为5.15g/l/d,同时获得的最高蛋白质含量占干重的51.48%。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1