一种利奈唑胺结晶形式及其制备方法和药物组合物与流程
本文涉及医药技术,尤指一种利奈唑胺结晶形式及其制备方法和药物组合物。
背景技术:
利奈唑胺的结构如式(i)所示:
利奈唑胺(linezolid),化学名为(s)-n-{3-[3-氟-4-(4-吗啉基)苯基]-2-氧代-5-恶唑烷基}甲基乙酰胺,是第一类合成的新型的恶唑烷酮类的抗菌药物,于1996年首次合成。利奈唑胺2000年进入市场,商品名为斯沃(zyvox)。2000年获得美国fda批准,用于治疗革兰阳性(g+)球菌引起的感染,包括由mrsa引起的疑似或确诊院内获得性肺炎(hap)、社区获得性肺炎(cap)、复杂性皮肤或皮肤软组织感染(ssti)以及耐万古霉素肠球菌(vre)感染。
技术实现要素:
以下是对本文详细描述的主题的概述。本概述并非是为了限制保护范围。
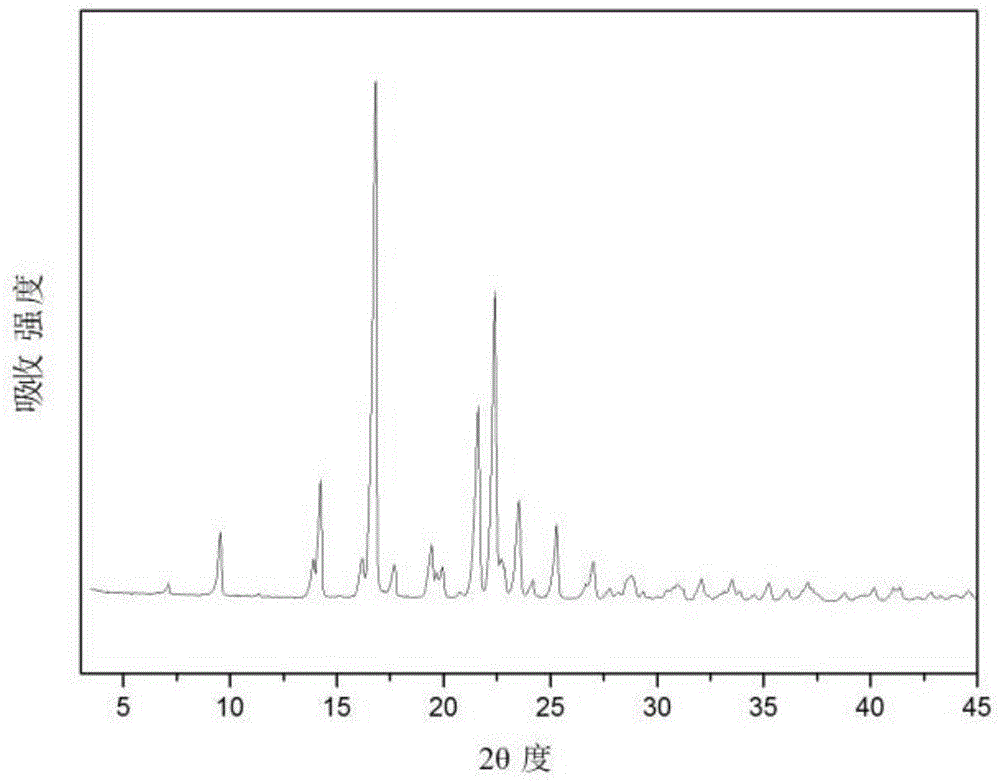
本申请提供了一种利奈唑胺结晶形式,所述利奈唑胺结晶形式在该结晶形式的使用cukα辐射、以2θ角度表示的粉末x线衍射的衍射图中,在衍射角度2θ±0.1°为9.4°、13.9°、14.2°、16.7°、19.8°、21.5°、22.3°、23.5°和25.2°中至少一处有衍射峰;而且,所述利奈唑胺结晶形式的粒度dv90在35μm至41μm的范围内。
另一方面,本申请提供了利奈唑胺结晶形式的制备方法,所述制备方法包括如下步骤:
将利奈唑胺原料加入乙酸乙酯中,搅拌,加热升温60℃至80℃并持续一段时间;然后,降温至40℃至55℃,并持续一段时间;最后降温至室温,经抽滤、干燥,得到所述利奈唑胺结晶形式。
第三方面,本申请提供了包含上述利奈唑胺结晶形式的药物组合物。
在本申请的一些实施方案中,本申请提供了一种利奈唑胺结晶形式,所述利奈唑胺结晶形式在该结晶形式的使用cukα辐射、以2θ角度表示的粉末x线衍射的衍射图中,在衍射角度2θ±0.1°为9.4°、13.9°、14.2°、16.7°、19.8°、21.5°、22.3°、23.5°和25.2°中至少两处有衍射峰;而且,所述利奈唑胺结晶形式的粒度dv90在35μm至41μm的范围内。
在本申请的一些实施方案中,本申请提供了一种利奈唑胺结晶形式,所述利奈唑胺结晶形式在该结晶形式的使用cukα辐射、以2θ角度表示的粉末x线衍射的衍射图中,在衍射角度2θ±0.1°为9.4°、13.9°、14.2°、16.7°、19.8°、21.5°、22.3°、23.5°和25.2°处有衍射峰。
在本申请的一些实施方案中,本申请提供了一种利奈唑胺结晶形式,所述利奈唑胺结晶形式的使用cukα辐射、以2θ角度表示的粉末x线衍射的衍射图基本上如图1所示。
在本申请的一些实施方案中,本申请提供了一种利奈唑胺结晶形式,所述利奈唑胺结晶形式的粒度dv90在37μm至41μm的范围内、在38μm至41μm的范围内、在39μm至41μm的范围内、或在40μm至41μm的范围内。
在本申请的一些实施方案中,所述利奈唑胺结晶形式的粒度dv90为37.1μm、37.2μm、37.3μm、37.4μm、37.5μm、37.6μm、37.7μm、37.8μm、37.9μm、38.0μm、38.1μm、38.2μm、38.3μm、38.4μm、38.5μm、38.6μm、38.7μm、38.8μm、38.9μm、39.0μm、39.1μm、39.2μm、39.3μm、39.4μm、39.5μm、39.6μm、39.7μm、39.8μm、39.9μm、40.1μm、40.2μm、40.3μm、40.4μm、40.5μm、40.6μm、40.7μm、或40.8μm。
在本申请的一些实施方案中,所述利奈唑胺结晶形式还包括其粒度dv50在3μm至15μm范围内,可以是3μm至10μm、3μm至9μm、3μm至8μm、4μm至10μm、4μm至9μm、或4μm至8μm等范围内。
在本申请的一些实施方案中,所述利奈唑胺结晶形式还包括其粒度dv10在1μm至5μm范围内,可以是1μm至4μm、1μm至3μm、或1μm至2μm、等范围内。
在本申请的一些实施方案中,所述利奈唑胺结晶形式的平均粒度为2μm×12μm×40μm,可选地,所述利奈唑胺结晶形式的显微图如图4所示。
在本申请的实施方案中,所述利奈唑胺结晶形式是原生的,即不要粉碎工序而直接结晶得到的。
另一方面,本申请提供了上述利奈唑胺结晶形式的制备方法,所述制备方法包括如下步骤:
将利奈唑胺原料加入乙酸乙酯中,搅拌,加热升温至60℃至80℃并持续一段时间;然后,降温至40℃至55℃,并持续一段时间;最后降温至室温,经抽滤、干燥,得到所述利奈唑胺结晶形式;这里,所述的一段时间为0.2h至5h。
在本申请的一些实施方案中,本申请提供的上述利奈唑胺结晶形式的制备方法,其中,利奈唑胺原料与乙酸乙酯的重量体积比为1:15至1:25,单位为g/ml,可选地,为1:16至1:25、1:17至1:25、1:18至1:25、1:19至1:25、1:20至1:25、1:15至1:21、1:17至1:21、1:18至1:21、1:19至1:21、或1:20。
在本申请的一些实施方案中,本申请提供的上述利奈唑胺结晶形式的制备方法,其中,所述加热升温的温度可以是70℃至80℃、71℃至80℃、72℃至80℃、73℃至80℃、74℃至80℃、75℃至80℃、76℃至80℃、70℃至77℃、71℃至77℃、72℃至77℃、73℃至77℃、74℃至77℃、75℃至77℃、或使乙酸乙酯回流的温度。
在本申请的一些实施方案中,本申请提供的上述利奈唑胺结晶形式的制备方法,其中,所述降温的温度为41℃至55℃、42℃至55℃、43℃至55℃、44℃至55℃、45℃至55℃、46℃至55℃、47℃至55℃、48℃至55℃、49℃至55℃、或50℃至55℃。
在本申请的一些实施方案中,本申请提供的上述利奈唑胺结晶形式的制备方法,其中,所述加热升温后持续的时间为0.2h至2h、0.3h至2h、0.4h至2h、0.2h至1h、0.3h至1h、0.4h至1h、0.2h至0.6h、0.3h至0.6h、0.4h至0.6h、0.5h至0.6h、或0.5h。
在本申请的一些实施方案中,本申请提供的上述利奈唑胺结晶形式的制备方法,其中,所述降温后持续的时间为0.5h至5h、0.6h至5h、0.7h至5h、0.8h至5h、0.9h至5h、1h至5h、1.1h至5h、1.2h至5h、1.3h至5h、1.4h至5h、1.5h至5h、1.6h至5h、1.7h至5h、1.8h至5h、1h至4h、1.1h至3h、1.2h至3h、1.3h至3h、1.4h至2.5h、1.5h至2.5h、1.6h至2.5h、1.7h至2.5h、1.8h至2.5h、或2h。
第三方面,本申请提供了包含上述利奈唑胺结晶形式以及药学上可接受的辅料的药物组合物。这里,所述的药物组合物是片剂、胶囊、固体颗粒剂或干混悬剂,可选地,为片剂或干混悬剂。当所述的药物组合物为片剂时,所述的药学上可接受的辅料包括玉米淀粉、微晶纤维素、羟丙基纤维素、羧甲基淀粉钠、硬脂酸镁、和巴西棕榈蜡;可选地,所述药物组合物包括本申请的结晶形式的利奈唑胺400.0mg、玉米淀粉36.0-44.0mg、微晶纤维素70.5-86.2mg、羟丙基纤维素7.2-8.8mg、羧甲基淀粉钠25.2-30.8mg、硬脂酸镁5.04-6.16mg、巴西棕榈蜡0-0.0224mg,还可包括包衣剂如欧巴代11.2-22.4mg;或者,所述药物组合物包括本申请的结晶形式的利奈唑胺600.0mg、玉米淀粉54-66mg、微晶纤维素105.84-129.36mg、羟丙基纤维素10.8-13.2mg、羧甲基淀粉钠37.8-46.2mg、硬脂酸镁7.56-9.24mg、巴西棕榈蜡0-0.0336mg,还可包括包衣剂如欧巴代16.8-33.6mg;当所述的药物组合物为干混悬剂时,所述的药学上可接受的辅料为蔗糖、枸橼酸钠、枸橼酸、微晶纤维素、羧甲基纤维素钠、阿斯巴甜、黄原胶、甘露醇、苯甲酸钠、胶态二氧化硅、氯化钠和调味剂。
本发明的有益效果在于:
1、本发明的利奈唑胺结晶形式,其粒度均匀且较小,所得的产品纯度更高,对原料药易裹挟的杂质f有特殊的去除效果。
2、利奈唑胺原料药属于bcs四类药,为低溶低渗型,本发明利奈唑胺结晶形式粒度较小,有助于提高其溶解性,减少溶解时间。
3、本发明利奈唑胺结晶形式解决了原料药固体丝状蓬松易聚团,流动性差,在分散介质中不易分散、搅拌易起泡的问题。
本申请的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本申请而了解。本申请的其他优点可通过在说明书以及附图中所描述的方案来实现和获得。
附图说明
附图用来提供对本申请技术方案的理解,并且构成说明书的一部分,与本申请的实施例一起用于解释本申请的技术方案,并不构成对本申请技术方案的限制。
图1表示的是本发明实施例1得到的利奈唑胺结晶形式的粉末衍射图谱;
图2表示的是批号lnze0010816利奈唑胺产品的原料药的粉末衍射图谱;
图3表示的是本发明对比例1得到的利奈唑胺产品的粉末衍射图谱;
图4表示的是本发明实施例1得到的利奈唑胺结晶形式的显微图;
图5表示的是批号lnze0010816的利奈唑胺原料的显微图;
图6表示的是本发明对比例1得到的利奈唑胺结晶形式的显微图。
具体实施方式
为使本申请的目的、技术方案和优点更加清楚明白,下文中将对本发明的实施例进行详细说明。需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的特征可以相互任意组合。
在本申请实施例中,所用的试剂都是可以商业上购买。
在本申请实施例中,所用的利奈唑胺粗品原料均为本申请人根据文献kondaiahseku等,“anovelmethodforpreparationoflinezolid,(s)-n-((3-(3-fluoro-4-morpholinophenyl)-2-oxo-5-oxazolidinyl)methyl)acetamide”,lettersinorganicchemistry,14(1),pp56-60;2017制备,批号为ln18101001-cplb。
其中本批次的利奈唑胺粗品原料的hplc检测结果如下:
在本申请实施例中,粒度的测定采用的粒度仪的仪器型号:马尔文ms3000
仪器参数设置:
分散气压:2.0bar
进样速率:60%
狭缝宽度:1.0mm
折光率:0.5-10%
进样量:0.4g
在本申请实施例中,hplc的测定采用的仪器型号:安捷伦1260
hplc的检测条件为:
色谱柱:welchvltimatexb-c18(3μm,4.6mm×250mm);
检测器:uv,
检测波长:254nm;
柱温:40℃;
流速:0.8ml/min;
进样量:10μl。
流动相:0.1mol/l三氟乙酸水溶液:0.1mol/l三氟乙酸乙腈溶液
在本申请的实施例中,所用粉末x射线衍射的仪器为:
荷兰piiniilyticiil公司(原philips分析仪器公司)x’pertprompdx射线衍射仪;
条件为:cukα辐射;0.15418nm管压:40kv;管流:40ma;ni滤波片。
实施例1
向50l反应釜中加入2.12kg利奈唑胺粗品(批号:ln18101001-cplb)和42.5l乙酸乙酯。开启搅拌,升温,控制打浆体系温度75℃±2℃,保温搅拌2h后,停止加热,在50±2℃下保温2h,自然降至室温。抽滤,收集滤饼,干燥。得到类白色粉末1.61kg,摩尔收率:75.94%。质谱m+1/z=337.35,hplc纯度为99.88%。批号记为ln18101001。上述类白色粉末的显微图如图4。
上述类白色粉末的x-粉末衍射图谱如图1所示,具体的数据如下:
实施例2
向500ml三口瓶中加入10g利奈唑胺粗品(批号:ln18101001-cplb)和200ml乙酸乙酯。开启搅拌,升温,控制打浆体系温度75℃±2℃,保温搅拌2h后,停止加热,在50±2℃下保温2h,自然降至室温。抽滤,收集滤饼,干燥。得到类白色粉末7.73g,摩尔收率:77.3%。质谱m+1/z=337.35,hplc纯度为99.81%,批号记为ln19061703-jp。本实施例的上述类白色粉末的x-粉末衍射图谱基本如图1所示。
实施例3
向1l三口瓶中加入20.5g利奈唑胺粗品(批号:ln18101001-cplb)和410ml乙酸乙酯。开启搅拌,升温,控制打浆体系温度75℃±2℃,保温搅拌2h后,停止加热,在50±2℃下保温2h,自然降至室温。抽滤,收集滤饼,干燥。得到类白色粉末17.8g,摩尔收率:86.83%。质谱m+1/z=337.35,hplc纯度为99.70%。批号记为ln19061704-jp。本实施例的上述类白色粉末的x-粉末衍射图谱基本如图1所示。
对比例1
向500ml三口瓶中加入10.1g利奈唑胺粗品(批号:ln18101001-cplb,下同)和80ml乙醇。开启搅拌,升温至80℃±2℃,体系全部溶清后,停止加热,自然降至室温。抽滤,收集滤饼,干燥。得到类白色粉末8.5g,摩尔收率:84.16%。质谱m+1/z=337.35,hplc纯度为99.38%,批号记为ln19061701-jp。上述类白色粉末的x-粉末衍射图谱如图3。
对比例2
向500ml三口瓶中加入10.08g利奈唑胺粗品(批号:ln18101001-cplb,下同)和110ml乙醇。开启搅拌,升温至80℃±2℃,体系全部溶清后,停止加热,自然降至室温。抽滤,收集滤饼,干燥。得到类白色粉末8.3g,摩尔收率:82.34%。质谱m+1/z=337.35,hplc纯度为99.49%,批号记为ln19061702-jp。上述类白色粉末的x-粉末衍射图基本谱如图3所示。
对比试验
(1)原料粒度控制与纯度的影响
在本发明中使用了四批利奈唑胺原料药,其中对比了对比例1和2的两批原料药(批号:ln19061701-jp,ln19061702-jp),以及使用实施例2和实施例3的两批原料药(批号:ln19061703-jp,ln19061704-jp)的杂质去除情况。其中,利奈唑胺杂质f的结构如式(ⅱ)所示:
上述对比结果表明,本发明的利奈唑胺结晶形式,无论是杂质个数还是含量,都显著地优于对比例。
(2)原料粒度控制与否的对比考察
在应用利奈唑胺原料制备利奈唑胺片剂(配方及其制备为cn01806469a实施例2)的研究中,对比了采用商业上购得的印度产原料(印度symedlabslimited,批号:lnze0010816,其x粉末衍射图谱如图2,显微图如图5)及本申请实施例的利奈唑胺结晶形式和对比例的原料(批号:ln18101001和ln19061701-jp)组成处方时的溶解情况。本申请的利奈唑胺结晶形式、对比例和印度产原料的粒度测定结果见下表。
对比上表可知,在使用上述三种原料做粒度测定时,批号ln18101001的粒度数据dv90均值在38.9μm左右,其粒度较小且分布均匀如显微图——图4所示;印度原料药批号lnze0010816粗大如图5所示,在溶解时间上不具备优势;批号ln19061701-jp的粒度数据dv90均值在179.0μm左右,其外观如棉絮状的丝状物细且长如图6所示,不利于制剂的压片等一系列工序。三种原料制备样品时均使用热水(温度70至80℃)配液,试验过程及结果见下表。
对比上表可知,在原料粒度差异较大的情况下,使用热水配液时,原料完全溶解的时间相差较大,由此说明,在利奈唑胺原料的制备制剂过程中,使用热水配液时,应用本申请的利奈唑胺结晶形式可保证其在较短时间内完全溶解,同时,降低粒度未控制而带来的风险。
此外,尽管在生产中,为了保证不同批次原料在配液时均能完全溶解,本着将风险降至最低的原则,可对原料进行粉碎处理,控制粒度分布dv90不大于40.7μm,即可保证原料快速完全溶解,使得每批样品的含量均符合质量标准的要求,但是,本申请的结晶形式是原生的,不仅能够保持晶形,而且粒度均匀,同时减少了粉粹处理工序。
(3)不同原料粒度的xrd的粉末衍射图谱的对比考察
在使用上述三种原料做xrd的粉末衍射测定时,实施例1批号ln18101001的结晶形式的衍射图如图1所示,印度原料批号lnze0010816的结晶形式衍射图如图2所示,对比例1批号ln19061701-jp的结晶形式衍射图如图3所示。
把以上lnze0010816和ln19061701-jp原料粉碎到dv90约为80μm的粒度前后的xrd粉末衍射图谱做了对比,结果显示在同一批号下,粉碎前后不影响其xrd衍射结果。本申请实施例1批号ln18101001的结晶形式(图1)在衍射角度2θ±0.1°的21.5°和22.3°处的吸收峰与印度(symedlabslimited公司)原料批号lnze0010816(图2)和对比例1批号ln19061701-jp(图3)的相同位置的吸收峰的吸收强度存在明显差异,印度原料药批号lnze0010816和对比例1批号ln19061701-jp则无明显区别。
本申请描述了多个实施例,但是该描述是示例性的,而不是限制性的,并且对于本领域的普通技术人员来说显而易见的是,在本申请所描述的实施例包含的范围内可以有更多的实施例和实现方案。
- 还没有人留言评论。精彩留言会获得点赞!