一种基于体外肿瘤细胞培养模型的灵芝质量评价方法与流程
(一)技术领域
本发明涉及一种基于体外肿瘤细胞培养模型的灵芝质量评价方法。
(二)
背景技术:
中药质量控制对于确保中药产品的安全性、有效性和一致性有着重要意义,是中药现代化和国际化的关键。随着分析化学、药物分析学等相关学科的不断发展,中药质量评价技术取得了巨大进步,逐步形成了以化学检测为核心的质检技术体系,通过检测主要化学成分、指标性成分或活性成分等来评价中药产品的质量。但是,中药化学组成复杂且药效成分往往未知,测定一个或少数几个指标性成分难以真实反映大部分中药产品的质量,这也导致化学检测方法往往脱节于中药的药效和临床疗效。相较而言,生物活性检测与中药疗效具有更直接的联系。因此,通过检测中药的生物活性建立与药效相关的质量评价方法对于提高中药产品质量有重大现实意义,已成为中药质控领域的研究前沿。
灵芝为多孔菌科真菌赤芝ganodermalucidum或紫芝ganodermasinense的干燥子实体,为我国传统珍稀名贵药材。《本草纲目》记载:灵芝性平,味苦,无毒,主胸中结,益心气,补中,增智慧,不忘,久服轻身不老,延年神仙。现代研究表明,灵芝具有抗肿瘤、免疫调节、强心、调节血脂、降血糖、保肝护肝等多种药理作用,临床上主要用于冠心病、高血脂症、高血压、糖尿病和肿瘤等疾病的治疗。灵芝具有多种化学成分,包括多糖、三萜、生物碱和脂肪酸等,其中多糖和三萜是其主要的活性成分。
目前,灵芝的质量评价主要采用化学成分含量测定。例如2015版《中国药典》对灵芝的主要活性成分多糖、三萜及甾醇的含量进行了规定,其中多糖不得少于0.9%,三萜及甾醇不得少于0.5%。按照药典标准,这两种成分的总和加起来不到灵芝干重的1.5%,很难客观地评价灵芝的整体质量。
期刊论文“基于uplc-ms/ms多指标成分测定的灵芝质量评价(中国药师,2019,22(05):844-848)”中,采用超高效液相色谱-串联质谱联用技术测定灵芝样品中灵芝酸c2、灵芝酸a、灵芝酸g、灵芝酸b、赤芝酸a和灵芝烯酸d的含量,并以6种成分的含量作为灵芝质量的评价指标。其检测方法为:以灵芝酸c2、灵芝酸a、灵芝酸g、灵芝酸b、赤芝酸a和灵芝烯酸d的混合溶液作为对照品,采用uplc-ms/ms技术检测不同批次灵芝样品中灵芝酸c2、灵芝酸a、灵芝酸g、灵芝酸b、赤芝酸a和灵芝烯酸d的含量。该方法的缺点是:利用uplc-ms/ms技术虽可快速测定灵芝样品中灵芝酸c2、灵芝酸a、灵芝酸g、灵芝酸b、赤芝酸a和灵芝烯酸d的含量,但这并不能直接反映各成分的生物活性,也无法全面反映灵芝药材的质量。
专利申请号为cn201610821304.3的“一种赤灵芝药材的质量评价方法”中,采用液相色谱法测定灵芝药材样本中总灵芝三萜的含量,以总灵芝三萜含量作为评价赤灵芝药材质量优劣的质量标准。其评价方法是:以赤灵芝提取物对照品为对照,用液相色谱法在210nm~280nm的任意波长下测定待测赤灵芝药材样本,在得到的液相色谱图中对保留时间为15~65分钟区间的所有紫外吸收峰面积求和,并与赤灵芝提取物对照品中的灵芝酸a所对应的紫外吸收峰面积相比较,计算待测赤灵芝药材样本中总灵芝三萜含量。该方法的缺点是:用高效液相色谱法虽可快速测定灵芝药材中灵芝酸a、灵芝酸b、灵芝酸c2和灵芝酸g的含量,并计算灵芝总三萜的含量,但含量并不能直接反映灵芝总三萜的生物活性,也无法全面反映灵芝药材的质量。
专利申请号为cn201210382193.2的“一种评价灵芝提取物质量的新方法”中,以灵芝提取物的体外抗氧化活性作为评价灵芝质量的理化指标。其评价方法为:测定灵芝提取物样品清除dpph阳离子自由基、abts+阳离子自由基、超氧阴离子自由基、羟基阴离子自由基的能力、总抗氧化的能力、还原铁离子的能力和螯合亚铁离子的能力,以抗氧化的半数有效浓度作为灵芝提取物质量定性的初步评价指标。该方法的缺点是:检测灵芝提取物的抗氧化活性,在一定程度上可以反映灵芝药材的质量,但是抗氧化活性与灵芝的临床应用和疗效的相关性不强。
期刊论文“灵芝胶囊质量标准研究及质量评价(2005(09):88-89)”中,以腺苷的含量作为灵芝胶囊的质量评判指标。其检测方法为:以腺苷溶液作为对照品,采用高效液相色谱发测定灵芝胶囊中腺苷的含量。该方法的缺点是:高效液相色谱法虽可准确检测灵芝胶囊中腺苷的含量,但腺苷的含量并不能全面地反映灵芝胶囊的活性以及质量。
由于化学检测方法的缺陷,因此有必要建立基于药效作用或生物活性的方法更全面地评价灵芝及其产品质量。
现代研究表明,灵芝具有良好的抗肿瘤活性,在临床上也可用于肿瘤的防治。因此,抗肿瘤活性可作为较理想的灵芝质量评价指标。在体外实验中,通常采用肿瘤细胞模型来评价药物对肿瘤的抑制作用。肿瘤细胞单层贴壁生长的二维(2-dimensional,2d)培养模式是目前评价抗肿瘤药物活性的主要方法,该培养模式便捷、经济、易于操作,但缺乏体内细胞生长及分化的微环境,不能很好地模拟体内肿瘤细胞与肿瘤微环境间的相互作用,与动物实验和临床实验的结果可能存在一定的差异。肿瘤细胞体外三维(3-dimensional,3d)培养模式是近年来发展起来的细胞培养新技术,与2d细胞培养和动物模型的体内研究相比,3d细胞培养模式可模拟细胞在人体内的生长环境,形成的多细胞球(multicellularspheroids,mcs)具有与体内实体瘤相似的增殖曲线、梯度生理环境和耐药特征,研究周期短且无动物伦理学的争议,可更好地用于抗肿瘤活性评价。因此,2d和3d肿瘤细胞培养模型均可开发成为灵芝质量较为理想的评价方法。
(三)
技术实现要素:
针对以上不足,为更好的评价灵芝及其产品的质量,本发明构建肿瘤细胞的2d和3d体外培养模型,提供了一种基于体外肿瘤细胞培养模型的灵芝质量评价方法。
本发明采用的技术方案是:
一种基于体外肿瘤细胞培养模型的灵芝质量评价方法,所述方法包括:
(1)取待测灵芝样品,用溶剂配制成样品溶液;
(2)取阳性对照品,用溶剂配制成阳性对照品溶液;
(3)构建肿瘤细胞的2d或3d培养模型,用培养液将样品溶液和阳性对照品溶液稀释成不同浓度,与肿瘤细胞共孵育;
(4)分别吸除步骤(3)孵育后的溶液,加入新鲜的培养液,再加入细胞活力指示剂反应1~5h,采用酶联免疫检测仪检测反应液的吸光度或荧光强度,计算灵芝样品溶液、阳性对照品溶液对肿瘤细胞增殖的抑制率,并计算相应的ic50,以细胞增殖抑制率评价灵芝质量;所述细胞增殖抑制率的计算方法为:
细胞增殖抑制率(%)=[1-(od样品组或阳性对照组-od空白组/od空白对照组-od空白组)]×100%。
或者,所述方法如下:
(1)取待测灵芝样品,用溶剂配制成样品溶液;
(2)取阳性对照品,用溶剂配制成阳性对照溶液;阳性对照溶液的终浓度为1~800ug/ml;
(3)构建肿瘤细胞的2d或3d培养模型,用培养液(常规培养液,如dmem等)将样品溶液和对照品溶液稀释成不同浓度,分别与肿瘤细胞共孵育;样品溶液的终浓度为0.001~60mg/ml;
(4)构建肿瘤细胞的3d培养模型,用培养液(常规培养液,如dmem等)将样品溶液和对照品溶液稀释成不同浓度,将样品溶液与对照品溶液混合,所得混合液与肿瘤细胞共孵育;样品溶液的终浓度为0.001~10mg/ml;
(5)分别吸除步骤(3)、(4)孵育后的灵芝样品溶液和阳性对照品溶液,加入新鲜的培养液(常规培养液,如dmem等),再加入细胞活力指示剂反应1~5h,采用酶联免疫检测仪检测反应液的吸光度或荧光强度,计算灵芝样品溶液和阳性对照溶液对肿瘤细胞增殖的抑制率,并计算相应的ic50或增长抑制率,以细胞增殖抑制率或增长抑制率评价灵芝质量;所述细胞增殖抑制率的计算方法为:
细胞增殖抑制率(%)=[1-(od样品组或阳性对照组-od空白组/od空白对照组-od空白组)]×100%;
增长抑制率(%)=抑制率混合溶液-抑制率阳性对照品溶液;
od值为在细胞活力指示剂对应检测波长下测得的吸光度或荧光强度。
所述肿瘤细胞可为下列之一:肝癌细胞(如hepg2和hccc9810),乳腺癌细胞(如mda-mb-231和mcf-7),结肠癌细胞(如hct116、ht-29和lovo),肺癌细胞(如a549和h460),胃癌细胞(如sgc-7901和mgc-803),或胰腺癌细胞(如bxpc-3和panc-1)。
所述阳性对照品为固体粉末,可为下列之一:氟尿嘧啶,顺铂,伊立替康,或多西紫杉醇。
所述步骤(4)混合溶液中灵芝样品的浓度为0.001~10mg/ml。
所述细胞活力指示剂为下列之一:吖啶橙/溴化乙锭,dapi,hoechst,mtt,xtt,srb,mts,cck-8,ctg,或calcein/pi。
所述细胞活力指示剂为cck-8时,反应时间为3.5h,细胞增殖抑制率(%)=[1-(od样品组或阳性对照组-od培养基/od空白对照组-od培养基)]×100%。
所述细胞活力指示剂为mtt时,反应时间为4h,细胞增殖抑制率(%)=[1-(od样品组或阳性对照组-od二甲基亚砜/od空白对照组-od二甲基亚砜)]×100%。
cck-8和mtt进入细胞后均可被活细胞线粒体中的琥珀酸脱氢酶还原为蓝紫色甲瓒结晶,甲瓒结晶溶于二甲基亚砜或培养基后,用酶联免疫检测仪在490或450nm波长处测定光吸收值,可间接反映活细胞的数量和样品溶液对肿瘤细胞的增殖抑制率。
所述2d培养的肿瘤细胞由如下方法获得:肿瘤细胞用胰酶消化后,用培养基稀释、重悬肿瘤细胞,混匀获得细胞悬液,将细胞悬液等体积均匀分散在微孔板中,获得肿瘤细胞2d培养模型。
所述3d培养的肿瘤细胞由如下方法获得:肿瘤细胞用胰酶消化后,用培养基稀释、重悬肿瘤细胞,混匀获得细胞悬液,取基质材料溶解,等体积均匀分散在微孔板中,待基质材料成胶后,将细胞悬液等体积均匀分散在微孔板中,获得肿瘤细胞3d培养模型。
所述基质材料为i型鼠尾胶原、琼脂糖凝胶、matrigel水凝胶、geltrex基质胶和col-tgle基质胶之一,基质材料稀释比例为1:1、1:2或1:3。
作为优选,步骤(4)所述肿瘤细胞为结肠癌细胞hct116和乳腺癌细胞mda-mb-231;所述基质材料为matrigel水凝胶。进一步优选,所述基质材料为matrigel水凝胶时,稀释比例为1:2。
所述灵芝样品包括灵芝药材、灵芝饮片、灵芝提取物、含有灵芝的中药复方产品、破壁灵芝孢子粉、破壁灵芝孢子粉提取物、含有破壁灵芝孢子粉的中药复方产品、去壁灵芝孢子粉、去壁灵芝孢子粉提取物、含有去壁灵芝孢子粉的中药复方产品等;所述灵芝包括赤芝(ganodermalucidum)和紫芝(ganodermasinense)。
步骤(1)所述待测灵芝样品由如下方法获得:灵芝加入至溶剂中,采用回流提取、超声提取、索氏提取、浸提或加压逆流提取方式,提取得到样品溶液后,采用氮吹、蒸干、减压浓缩、离心浓缩、或冷冻干燥方法进行干燥,得到待测样品;所述溶剂为下列之一:水、乙醇、5%~95%乙醇溶液、甲醇、5%~95%甲醇溶液、乙酸乙酯、三氯甲烷。优选的,所述溶剂为水或乙醇;所述提取方法为回流提取或超声提取法;所述干燥方法为冷冻干燥或减压干燥。提取溶剂为水时,待测样品粉末以培养基作为溶剂;提取溶剂为乙醇时,待测样品粉末以无水乙醇作为溶剂,所述水提取样品的终浓度为0.001~40mg/ml,乙醇提取样品的终浓度为1~600ug/ml,特殊的,待测样品为灵芝片时,所述灵芝片样品溶液的终浓度为1~60mg/ml。优选的,样品制备溶剂为水时,样品的终浓度为0.625~30mg/ml;样品制备溶剂为乙醇时,样品的终浓度为12.5~400μg/ml,样品为灵芝片时,样品的终浓度为3.125~60mg/ml。
步骤(1)或(2)中所述溶剂各自独立为下列之一:纯化水、培养液(常规培养液,如dmem等)、磷酸盐缓冲液、甲醇、无水乙醇或二甲基亚砜。其中,氟尿嘧啶和顺铂以纯化水为溶剂;伊立替康以二甲基亚砜为溶剂;多西紫杉醇以无水乙醇为溶剂。
本发明的有益效果主要体现在:
(1)本发明基于体外培养的肿瘤细胞,通过测定灵芝对肿瘤细胞的抑制作用来评价其质量,检测指标与灵芝的抗肿瘤活性直接相关,可反映其临床疗效,因此可以更全面地评价灵芝的质量。
(2)本发明采用2d和3d培养的肿瘤细胞进行灵芝的抗肿瘤作用研究,可全面地评价灵芝的质量,且肿瘤细胞3d培养与体内原位瘤更接近,评价结果更为准确,不涉及动物伦理学,分析流程短,分析成本低。
(四)附图说明
图1不同批次灵芝药材水提取样品抑制2d培养的hct116细胞增殖的ic50(mean±sd,n=3);
图2不同批次灵芝药材水提取样品抑制3d培养的hct116细胞增殖的ic50(mean±sd,n=3);
图3不同批次灵芝药材联合氟尿嘧啶对3d培养的hct116细胞增殖的抑制率(mean±sd,n=3);
图4不同批次破壁灵芝孢子粉乙醇提取样品抑制2d培养的mda-mb-231细胞增殖的ic50(mean±sd,n=3);
图5不同批次灵芝孢子粉醇提取样品抑制3d培养的mda-mb-231细胞增殖的ic50(mean±sd,n=3);
图6不同批次灵芝片水提取样品抑制2d培养的hct116细胞增殖的ic50(mean±sd,n=3);
图7不同批次灵芝片水提取样品抑制3d培养的hct116细胞增殖的ic50(mean±sd,n=3)。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例中,采用的matrigel基质胶购自bd公司,i型鼠尾胶原购自美仑生物技术有限公司,dmem培养基、琼脂糖凝胶和geltrex基质胶购自赛默飞世尔科技有限公司,col-tgle基质胶购自华雅再生医学生物工程技术有限公司,mtt溶液购自sigma公司,cck-8、dapi、hoechst、calcein/pi溶液购自碧云天生物技术有限公司,srb、mts溶液购自abcam公司,吖啶橙/溴化乙锭购自索莱宝生物科技有限公司,ctg溶液购自盛世华康生物医药科技有限公司,氟尿嘧啶、顺铂、伊立替康、多西紫杉醇购自aladdin公司。
实施例1:基于化学检测的灵芝药材质量评价
赤芝(ganodermalucidum)药材5个批次,紫芝(ganodermasinense)药材5个批次,由武义寿仙谷中药饮片有限公司提供。按《中国药典》2015版一部灵芝项下【含量测定】规定的方法,对这10个批次灵芝样品的多糖、三萜及甾醇的含量进行测定:多糖的测定采用蒽酮-硫酸法,以无水葡萄糖作为对照品;三萜及甾醇的测定采用香草醛-冰醋酸法,以齐墩果酸作为对照品。检测结果如表1所示。
由表1可知,5个批次赤芝的多糖含量1.19%~1.91%,三萜及甾醇含量0.85%~1.58%;5个批次紫芝多糖含量1.20%~1.77%,三萜及甾醇含量0.84%~1.17%。这10个批次赤芝和紫芝的多糖、三萜及甾醇的含量无明显差异。根据药典中多糖不得少于0.90%、三萜及甾醇不得少于0.50%的规定,这些样品均为合格药材。
表1:不同批次灵芝药材多糖、三萜及甾醇含量(%)
实施例2:基于2d肿瘤细胞培养模型的灵芝药材质量评价
取与实施例1相同的赤芝、紫芝药材,按以下步骤对其质量进行评价:
(1)取不同批次灵芝药材粉末(过40目筛)各2g,加水50ml,水浴加热回流1h,滤过,滤液置水浴上蒸干,得灵芝待测样品;
(2)取灵芝待测样品各40mg,用dmem培养基配制成样品溶液(浓度40mg/ml);
(3)取氟尿嘧啶10mg,用纯化水配制成阳性对照溶液(浓度10mg/ml);
(4)结肠癌细胞hct116用0.25%胰酶消化后,用dmem培养基稀释、重悬肿瘤细胞(细胞浓度约1×105个/ml),混匀获得细胞悬液,将细胞悬液等体积均匀分散在微孔板中,获得肿瘤细胞hct116的2d培养模型;取2d培养的结肠癌细胞hct116均匀分散在96孔板中,用dmem培养基将步骤(2)和(3)中获得的灵芝样品溶液和氟尿嘧啶溶液稀释成不同浓度(灵芝样品溶液:40、35、30、25、20、15、12.5、10、7.5、5、2.5、1.25、0.625、0.3125mg/ml;氟尿嘧啶溶液:200、175、150、125、100、75、50、25、12.5、6.25、3.125、1.5625、0.78125μg/ml),分别与hct116细胞共孵育48h,每个浓度3个复孔。
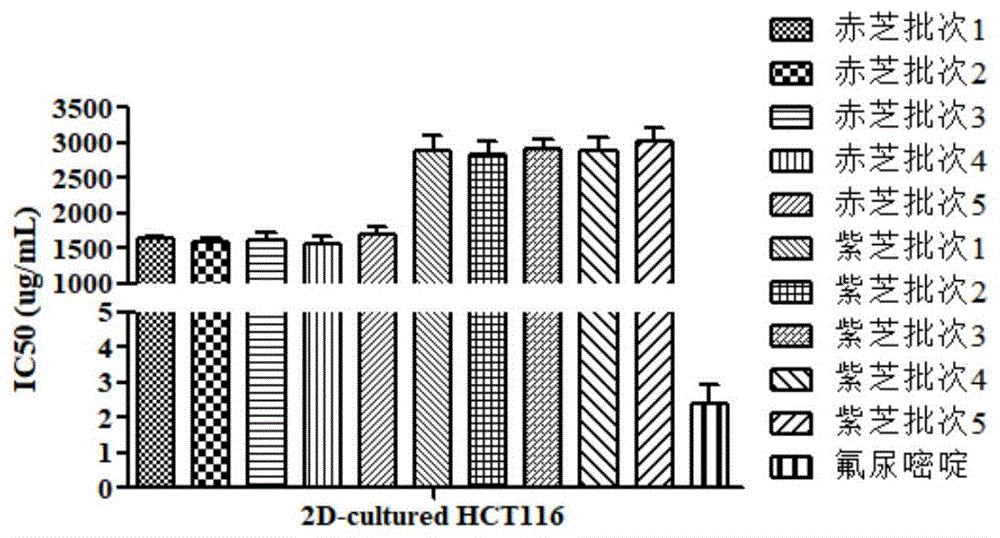
(5)吸除灵芝样品溶液和氟尿嘧啶溶液,加入新鲜的dmem培养基90μl,再加入cck-8溶液10μl反应3.5h,采用酶联免疫检测仪在450nm波长下检测反应液的吸光度,计算灵芝样品溶液和阳性对照溶液对肿瘤细胞增殖的抑制率,并计算相应的ic50,采用ic50评价灵芝质量。检测结果如图1所示。
由图1可知,氟尿嘧啶抑制hct116细胞增殖的ic50为2.40±0.53ug/ml;5个批次赤芝水提取样品抑制2d培养的hct116细胞增殖的ic50无明显差异,ic50值在1.58±0.05mg/ml和1.69±0.12mg/ml之间;5个批次紫芝水提取样品抑制2d培养的hct116细胞增殖的ic50无明显差异,ic50值在2.84±0.17mg/ml和3.02±0.18mg/ml之间。该检测结果表明,测试批次赤芝的抗肿瘤活性高于紫芝,也表明该2d肿瘤细胞培养模型可以较好的区分并评价不同灵芝药材的质量。
为了确保该方法适用于质量评价,对方法的精密度、重复性和稳定性进行了考察。取批次1的赤芝药材作为质控样品。精密度为制备好样品后,连续用酶标仪测定6次;重复性为取批次1的赤芝药材,平行制备6份样品进行检测;稳定性为制备好灵芝待测样品后,放置0、2、4、6、8、12、24h,再按后续步骤进行检测。结果表明,精密度rsd<5%,重复性rsd<15%,稳定性rsd<8%,表明该方法具有良好的性能,适用于灵芝质量评价。
实施例3:基于3d肿瘤细胞培养模型的灵芝样品质量评价
取与实施例1相同批次的赤芝、紫芝药材,按以下步骤对其质量进行评价:
步骤(1)至(3)与实施例2相同。
(4)取2d培养的结肠癌细胞hct116(2d培养模型构建方法同实施例1)以1:2稀释的matrigel水凝胶为基质材料构建3d培养模型,用dmem培养基将步骤(2)和(3)中获得的灵芝样品溶液和氟尿嘧啶溶液稀释成不同浓度(终浓度与实施例2步骤(4)相同),分别与hct116细胞共孵育48h,每个浓度3个复孔。
(5)吸除灵芝样品溶液和氟尿嘧啶溶液,加入新鲜的dmem培养基90μl,再加入cck-8溶液10μl反应3.5h,吸取等体积反应液于新的96孔板中,采用酶联免疫检测仪在450nm波长下检测反应液的吸光度,计算灵芝样品溶液和氟尿嘧啶溶液对肿瘤细胞增殖的抑制率,并计算相应的ic50,采用ic50评价灵芝质量。检测结果如图2所示。
由图2可知,氟尿嘧啶抑制3d培养的hct116细胞增殖的ic50为113.78±7.52ug/ml;5个批次赤芝水提取样品抑制3d培养的hct116细胞增殖的ic50无明显差异,ic50值在9.64±0.42mg/ml和10.20±0.98mg/ml之间;5个批次紫芝水提取样品抑制3d培养的hct116细胞增殖的ic50无明显差异,ic50值在21.29±1.68mg/ml和23.37±1.12mg/ml之间。该检测结果表明,测试批次赤芝的抗肿瘤活性高于紫芝,也表明该3d肿瘤培养模型可以较好地区分并评价不同灵芝药材的质量。
为了确保该方法适用于质量评价,对方法的精密度、重复性和稳定性进行了考察。取批次1的赤芝药材作为质控样品。精密度为制备好样品后,连续用酶标仪测定6次;重复性为取批次1的赤芝药材,平行制备6份样品进行检测;稳定性为制备好灵芝待测样品后,放置0、2、4、6、8、12、24h,再按后续步骤进行检测。结果表明,精密度rsd<8%,重复性rsd<13%,稳定性rsd<10%,表明该方法具有良好的性能,适用于灵芝质量评价。
以上结果表明,肿瘤细胞的2d和3d体外培养模型均可用于灵芝的质量评价,其中肿瘤3d体外培养模型由于药物抵抗、肿瘤细胞与微环境相互作用等原因,测得的ic50值比2d模型大,这也更符合临床实际情况。因此,采用肿瘤细胞3d体外培养模型可以更客观地评价灵芝的质量。
实施例4:基于3d肿瘤细胞培养模型-增长抑制率的灵芝样品质量评价
取与实施例1相同批次的灵芝(赤芝)药材,按以下步骤对其质量进行评价:
步骤(1)至(3)与实施例2相同。
(4)将步骤(2)中获得的样品溶液与步骤(3)中获得的氟尿嘧啶溶液按体积比1:1的比例混合。
(5)取2d培养的结肠癌细胞hct116(2d培养模型构建方法同实施例1)以1:2稀释的matrigel水凝胶为基质材料构建3d培养模型,用dmem培养基将步骤(2)-(4)中获得的溶液分别与hct116细胞共孵育48h,每个浓度3个复孔。
(6)吸除96孔板中的溶液,加入新鲜的dmem培养基90μl,再加入cck-8溶液10μl反应3.5h,吸取等体积反应液于新的96孔板中,采用酶联免疫检测仪在450nm波长下检测反应液的吸光度,计算混合溶液对3d培养的肿瘤细胞增殖的抑制率及相对阳性药的增长抑制率。检测结果如图3所示。
由图3可知,5个批次赤芝水提取样品对3d培养的hct116细胞的增殖无显著影响,氟尿嘧啶对3d培养的hct116细胞增殖的抑制率为35.82±4.50%;与氟尿嘧啶单独处理相比,5个批次赤芝水提取样品与氟尿嘧啶的混合溶液对3d培养的hct116细胞增殖的抑制率分别为65.53±1.66%、59.51±2.84%、55.93±2.88%、63.85±4.29%、58.13±3.98%,增长抑制率分别约为29.71%、23.69%、20.11%、28.03%、22.31%。该检测结果表明,灵芝可加强氟尿嘧啶的抗肿瘤作用。因此,除了ic50外,也可以用增长抑制率作为指标评价灵芝药材质量。而且以氟尿嘧啶作为阳性对照,检测结果更为可靠。
实施例5:基于化学检测的破壁灵芝孢子粉样品质量评价
破壁灵芝(赤芝)孢子粉5个批次,由武义寿仙谷中药饮片有限公司提供。按《浙江省中药炮制规范》2015版灵芝孢子粉项下【含量测定】规定的方法,对这5个批次破壁灵芝孢子粉的多糖、甘油三油酸酯进行测定:多糖的测定采用蒽酮-硫酸法,以无水葡萄糖作为对照品;甘油三油酸酯的测定采用高效液相色谱法,采用甘油三油酸酯作为对照品。检测结果如表2所示。
由表2可知,5个批次破壁灵芝孢子粉多糖含量1.88%~2.75%,甘油三油酸酯含量6.02%~6.87%,批次间相对标准偏差(rsd)分别为12.1%和4.7%,说明这5个批次的批次间一致性较好。根据炮制规范中多糖不得少于0.80%、甘油三油酸酯不得少于3.0%的规定,这些样品均为合格中药饮片。
表2:不同批次破壁灵芝孢子粉多糖、甘油三油酸酯含量(%)
实施例6:基于2d肿瘤细胞培养模型的破壁灵芝孢子粉样品质量评价
取与实施例5相同批次的破壁灵芝孢子粉,按以下步骤对其质量进行评价:
(1)取不同批次破壁灵芝孢子粉各2g,加乙醇50ml,超声提取1h,滤过,滤液用离心浓缩仪在50℃挥干,得待测样品;
(2)取破壁灵芝孢子粉待测样品各60mg,用无水乙醇配制成样品溶液(浓度60mg/ml);
(3)取多西紫杉醇10mg,用无水乙醇配制成阳性对照溶液(浓度10mg/ml);
(4)取2d培养的乳腺癌细胞mda-mb-231(2d培养模型构建方法同实施例1)均匀分散在96孔板中,用dmem培养基将步骤(2)和(3)中获得的灵芝孢子粉样品溶液和多西紫杉醇溶液稀释成不同浓度(灵芝孢子粉样品:600、550、500、450、400、350、300、250、200、150、100、75、50、25、12.5、6.25μg/ml;多西紫杉醇:100、75、50、25、12.5、6.25、3.125、1.5625、0.78125μg/ml),分别与mda-mb-231细胞共孵育48h,每个浓度3个复孔。
(5)各孔加入20μl(5mg/ml)mtt溶液反应4h,吸除上清液,再加入200μl二甲基亚砜反应10min,吸取150μl反应液于新的96孔板中,采用酶联免疫检测仪在490nm波长下检测反应液的吸光度,计算灵芝孢子粉样品溶液和多西紫杉醇溶液对肿瘤细胞增殖的抑制率,并计算相应的ic50。检测结果如图4所示。
由图4可知,多西紫杉醇抑制2d培养的mda-mb-231细胞增殖的ic50为1.72±0.19μg/ml;5个批次灵芝孢子粉乙醇提取样品抑制2d培养的mda-mb-231细胞增殖的ic50无明显差异,ic50值在45.61±3.12μg/ml和54.28±2.35μg/ml之间,该检测结果表明,2d肿瘤细胞培养模型可以较好的评价破壁灵芝孢子粉的质量。
为了确保该方法适用于质量评价,对方法的精密度、重复性和稳定性进行了考察。取批次1的灵芝孢子粉作为质控样品。精密度为制备好样品后,连续用酶标仪测定6次;重复性为取批次1的灵芝孢子粉,平行制备6份样品进行检测;稳定性为制备好灵芝孢子粉待测样品后,放置0、2、4、6、8、12、24h,再按后续步骤进行检测。结果表明,精密度rsd<4%,重复性rsd<17%,稳定性rsd<7%,表明该方法具有良好的性能,适用于灵芝孢子粉质量评价。
实施例7:基于3d肿瘤细胞培养模型的破壁灵芝孢子粉样品质量评价
取与实施例6相同的破壁灵芝孢子粉,按以下步骤对其质量进行评价:
步骤(1)至(3)与实施例5相同。
(4)取2d培养的结肠癌细胞mda-mb-231(2d培养模型构建方法同实施例1)以1:2稀释的matrigel水凝胶为基质材料构建3d培养模型,用dmem培养基将步骤(2)和(3)中获得的灵芝孢子粉样品溶液和多西紫杉醇溶液稀释成不同浓度(终浓度与实施例2步骤4相同),分别与mda-mb-231细胞共孵育48h,每个浓度3个复孔。
(5)各孔加入20μl(5mg/ml)mtt溶液反应4h,吸除上清液,再加入200μl二甲基亚砜反应10min,吸取150μl反应液于新的96孔板中,采用酶联免疫检测仪在490nm波长处检测反应液的吸光度,计算灵芝孢子粉样品溶液和多西紫杉醇溶液对肿瘤细胞增殖的抑制率,并计算相应的ic50。检测结果如图5所示。
由图5可知,多西紫杉醇抑制3d培养的mda-mb-231细胞增殖的ic50为63.29±1.53μg/ml;5个批次灵芝孢子粉乙醇提取样品抑制3d培养的hct116细胞增殖的ic50无明显差异,ic50值在159.61±15.28μg/ml和178.36±18.16mg/ml之间,表明3d培养的mda-mb-231细胞对多西紫杉醇和灵芝孢子粉乙醇提取样品的耐受性均提高;与2d培养相比,3d培养的mda-mb-231细胞对多西紫杉醇的耐受指数约为36.79,对5个批次灵芝孢子粉乙醇提取样品的耐受指数分别为3.72、3.55、3.66、3.10、3.11,该检测结果表明,与多西紫杉醇相比,灵芝孢子粉乙醇提取样品不易引起肿瘤细胞的耐受。
为了确保该方法适用于质量评价,对方法的精密度、重复性和稳定性进行了考察。取批次1的灵芝孢子粉作为质控样品。精密度为制备好样品后,连续用酶标仪测定6次;重复性为取批次1的灵芝孢子粉,平行制备6份样品进行检测;稳定性为制备好灵芝孢子粉待测样品后,放置0、2、4、6、8、12、24h,再按后续步骤进行检测。结果表明,精密度rsd<6%,重复性rsd<12%,稳定性rsd<13%,表明该方法具有良好的性能,适用于灵芝孢子粉质量评价。
以上结果表明,肿瘤细胞的2d和3d体外培养模型均可用于破壁灵芝孢子粉的质量评价。
实施例8:基于化学检测的灵芝片样品质量评价
中成药灵芝片5个批次,由金华市康寿制药有限公司提供。按《中国药典》2015版一部灵芝项下【含量测定】规定的方法,对这10个批次灵芝片样品的多糖含量进行测定:多糖的测定采用蒽酮-硫酸法,以无水葡萄糖作为对照品。检测结果表明,5个批次灵芝片的多糖含量分别为75%、86%、82%、71%、80%。灵芝片多糖含量很高,是因为里面含有较高含量的辅料,包括淀粉、糊精、蔗糖等。而这些辅料同样也会与硫酸、蒽酮反应显色,因此如果采用蒽酮-硫酸法,存在非常大的误差,难以客观评价灵芝片的含量。
实施例9:基于2d肿瘤细胞培养模型的灵芝片质量评价
取与实施例8相同批次的灵芝片,按以下步骤对其质量进行评价:
(1)取不同批次灵芝片粉末(过40目筛)各2g,加水50ml,水浴加热回流1h,滤过,滤液置水浴上蒸干,得灵芝待测样品;
(2)取灵芝待测样品各60mg,用dmem培养基配制成样品溶液(浓度60mg/ml);
(3)取伊立替康40mg,用二甲基亚砜配制成阳性对照溶液(浓度80mg/ml);
(4)取2d培养的结肠癌细胞hct116(2d培养模型构建方法同实施例1)均匀分散在96孔板中,用dmem培养基将步骤(2)和(3)中获得的灵芝片样品溶液和伊立替康溶液稀释成不同浓度(灵芝片样品溶液:60、55、50、45、40、35、30、25、20、15、12.5、6.25、3.125、1.5625mg/ml;伊立替康溶液:800、600、400、300、200、100、75、50、25、12.5、6.25、3.125μg/ml),分别与hct116细胞共孵育48h,每个浓度3个复孔。
(5)吸除灵芝片样品溶液和伊立替康溶液,加入新鲜的dmem培养基90μl,再加入cck-8溶液10μl反应3.5h,采用酶联免疫检测仪在450nm波长下检测反应液的吸光度,计算灵芝片样品溶液和伊立替康溶液对肿瘤细胞增殖的抑制率,并计算相应的ic50。检测结果如图6所示。
由图6可知,伊立替康抑制hct116细胞增殖的ic50为9.83±0.87μg/ml;5个批次灵芝片水提取样品抑制2d培养的hct116细胞增殖的ic50无明显差异,ic50值在6.21±0.40mg/ml和6.64±0.58mg/ml之间。该检测结果表明2d肿瘤细胞培养模型可以较好地评价灵芝片的质量。
为了确保该方法适用于质量评价,对方法的精密度、重复性和稳定性进行了考察。取批次1的灵芝片作为质控样品。精密度为制备好样品后,连续用酶标仪测定6次;重复性为取批次1的灵芝片,平行制备6份样品进行检测;稳定性为制备好灵芝片待测样品后,放置0、2、4、6、8、12、24h,再按后续步骤进行检测。结果表明,精密度rsd<4%,重复性rsd<16%,稳定性rsd<9%,表明该方法具有良好的性能,适用于灵芝片质量评价。
实施例10:基于3d肿瘤细胞培养模型的灵芝片样品质量评价
取与实施例8相同批次的灵芝片,按以下步骤对其质量进行评价:
步骤(1)至(3)与实施例9相同。
(4)取2d培养的结肠癌细胞hct116(2d培养模型构建方法同实施例1)以1:2稀释的matrigel水凝胶为基质材料构建3d培养模型,用dmem培养基将步骤(2)和(3)中获得的灵芝片样品溶液和伊立替康溶液稀释成不同浓度(终浓度与实施例9步骤4相同),分别与hct116细胞共孵育48h,每个浓度3个复孔。
(5)吸除灵芝片样品溶液和伊立替康溶液,加入新鲜的dmem培养基90μl,再加入cck-8溶液10μl反应3.5h,吸取等体积反应液于新的96孔板中,采用酶联免疫检测仪在450nm波长下检测反应液的吸光度,计算灵芝片样品溶液和伊立替康溶液对肿瘤细胞增殖的抑制率,并计算相应的ic50。检测结果如图7所示。
由图7可知,伊立替康抑制3d培养的hct116细胞增殖的ic50为473.62±18.51ug/ml;5个批次灵芝片水提取样品抑制3d培养的hct116细胞增殖的ic50无明显差异,ic50值在43.22±1.80mg/ml和47.35±1.37mg/ml之间。该检测结果表明3d肿瘤细胞培养模型可以较好地评价灵芝片的质量。
为了确保该方法适用于质量评价,对方法的精密度、重复性和稳定性进行了考察。取批次1的灵芝片作为质控样品。精密度为制备好样品后,连续用酶标仪测定6次;重复性为取批次1的灵芝片,平行制备6份样品进行检测;稳定性为制备好灵芝片待测样品后,放置0、2、4、6、8、12、24h,再按后续步骤进行检测。结果表明,精密度rsd<8%,重复性rsd<17%,稳定性rsd<5%,表明该方法具有良好的性能,适用于灵芝片质量评价。
实施例11:
实施例1~10中涉及的参数的优化过程如下:
一、肿瘤细胞系和基质材料的优化
(1)2d培养的肿瘤细胞系优化:取2d培养的肝癌细胞hepg2和hccc810、乳腺癌细胞mda-mb-231和mcf-7、结肠癌细胞hct116、ht-29和lovo、肺癌细胞a549和h460、胃癌细胞sgc-7901和mgc-803(2d培养模型构建方法同实施例1),将不同浓度的灵芝样品溶液与肿瘤细胞共孵育48h,计算灵芝样品溶液抑制肿瘤细胞增殖的ic50。
结果显示,灵芝水提取样品和乙醇提取样品抑制乳腺癌细胞mda-mb-231和mcf-7、结肠癌细胞hct116和胃癌细胞mgc-803增殖的ic50值较低。因此,优选细胞系为乳腺癌细胞mda-mb-231和mcf-7、结肠癌细胞hct116和胃癌细胞mgc-803。
(2)3d培养的肿瘤细胞系及基质材料的优化:取(1)中优化的细胞系分别以i型鼠尾胶原、琼脂糖凝胶、matrigel水凝胶、geltrex基质胶、col-tgle基质胶为基质材料构建3d培养模型,观察肿瘤细胞在基质材料中的生长形态。
结果显示,乳腺癌细胞mda-mb-231和结肠癌细胞hct116在matrigel水凝胶中形成轮廓清晰、致密的多细胞球体。因此,优选细胞系为乳腺癌细胞mda-mb-231和结肠癌细胞hct116;基质材料为matrigel水凝胶。
(3)基质材料稀释比例的优化:将(2)中优化的基质材料用dmem培养基以1:1、1:2和1:3的比例稀释,取(1)中优化的细胞系分别以原液和稀释液为基质材料构建3d模型,观察肿瘤细胞在基质材料中的生长形态。
结果显示,乳腺癌细胞mda-mb-231和结肠癌细胞hct116在matrigel水凝胶原液和1:2稀释的稀释液中形成轮廓清晰、致密的多细胞球,而在1:2稀释的稀释液中形成的多细胞球的体积较大。因此,优选1:2稀释的matrigel水凝胶为基质材料。
二、灵芝样品溶液和阳性对照样品溶液终浓度的优化
(1)灵芝水提取样品终浓度优化:取灵芝水提取样品粉末,用dmem培养基配制成0.001~40mg/ml的样品溶液,与肿瘤细胞共孵育48h后,加入细胞活力指示剂进行反应,测定反应液的吸光度或荧光强度。
结果显示,当灵芝水提取样品溶液的终浓度低于0.625mg/ml时,反应液的吸光度或荧光强度趋于平缓;而浓度大于30mg/ml时,反应液的吸光度或荧光强度太低不利于检测。因此,优选灵芝水提取样品溶液的终浓度为0.625~30mg/ml。
(2)灵芝乙醇提取样品终浓度优化:取灵芝乙醇提取样品粉末,用无水乙醇配制成1~600μg/ml的样品溶液,与肿瘤细胞共孵育48h后,加入细胞活力指示剂进行反应,测定反应液的吸光度或荧光强度。
结果显示,当灵芝乙醇提取样品溶液的终浓度低于12.5ug/ml时,反应液的吸光度或荧光强度趋于平缓;而浓度大于500ug/ml时,反应液的吸光度或荧光强度太低不利于检测。因此,优选灵芝乙醇提取样品溶液的终浓度为12.5~500ug/ml。
(3)阳性对照样品终浓度优化:取阳性对照样品粉末,用纯化水配制成0.3125~800ug/ml的样品溶液,与肿瘤细胞共孵育48h后,加入细胞活力指示剂进行反应,测定反应液的吸光度或荧光强度。
结果显示,当阳性对照样品溶液的终浓度低于0.625ug/ml时,反应液的吸光度或荧光强度趋于平缓;而浓度大于600ug/ml时,反应液的吸光度或荧光强度太低不利于检测。因此,优选阳性对照样品溶液的终浓度为0.625~600ug/ml。
(4)混合溶液中灵芝提取样品终浓度优化:取灵芝水提取样品,用dmem培养基配制成0.625~5mg/ml的灵芝水提取样品溶液;取灵芝乙醇提取样品,用无水乙醇配制成12.5~75ug/ml的灵芝乙醇提取样品溶液;灵芝水提取样品溶液和灵芝乙醇提取样品溶液分别与3d培养的肿瘤细胞共孵育48h后,加入细胞活力指示剂进行反应,测定反应液的吸光度或荧光强度,计算灵芝水提取样品溶液和灵芝乙醇提取样品溶液对肿瘤细胞增殖的抑制率。
结果显示,1.25mg/ml的灵芝水提取样品溶液和50ug/ml的灵芝乙醇提取样品溶液对肿瘤细胞增殖的影响最小。因此,优选灵芝水提取样品的终浓度为1.25mg/ml;灵芝乙醇提取样品的终浓度为50ug/ml。
(5)灵芝片样品终浓度优化:取灵芝片样品粉末,用dmem培养基配制成1~60mg/ml的样品溶液,与肿瘤细胞共孵育48h后,加入细胞活力指示剂进行反应,测定反应液的吸光度或荧光强度。
结果显示,当灵芝片样品溶液的终浓度低于3.125mg/ml时,反应液的吸光度或荧光强度趋于平缓。因此,优选灵芝水提取样品溶液的终浓度为3.125~60mg/ml。
三、细胞活力指示剂优化
(1)指示剂溶液优化:取灵芝水提取样品溶液、乙醇提取样品溶液和阳性对照样品溶液,各溶液与肿瘤细胞共孵育48h后,分别加入吖啶橙/溴化乙锭、dapi、hoechst、mtt、srb、mts、cck-8、ctg、calcein/pi进行反应,测定反应液的吸光度或荧光强度,计算各溶液对肿瘤细胞增殖的抑制率或ic50。
结果显示,以srb、cck-8、ctg、mtt为细胞活力指示剂时,各溶液对肿瘤细胞增殖的抑制率无显著差异。因此,出于经济和便捷考虑,优选cck-8和mtt为细胞活力指示剂。
(2)指示剂反应时间优化:取灵芝水提取样品溶液、乙醇提取样品溶液和阳性对照样品溶液,各溶液与肿瘤细胞共孵育48h后,加入cck-8或mtt进行反应,反应时间分别为2、2.5、3、3.5、4、4.5、5h,测定反应液的吸光度。
结果显示,cck-8反应3.5h时后,反应液的吸光度达到最大且不发生显著变化;mtt反应4h时后,反应液的吸光度达到最大且不发生显著变化。因此,优选cck-8反应时间为3.5h;mtt的反应时间为4h。
- 还没有人留言评论。精彩留言会获得点赞!